Болезнь Крона — это пожизненное и хроническое рецидивирующее воспалительное заболевание кишечника, потенциально влияющее на любую часть желудочно-кишечного тракта от рта до ануса. Подобно неспецифическому язвенному колиту, другому основному воспалительному заболеванию кишечника, болезнь Крона чаще всего проявляется во втором и третьем десятилетии, но начало заболевания может происходить в любом возрасте. У 25% всех пациентов болезнь Крона начинается до 18 лет.
Болезнь Крона и неспецифический язвенный колит являются наиболее часто диагностируемыми воспалительными заболеваниями кишечника. Хотя точный этиопатогенез болезни Крона до конца не определён, было выявлено несколько иммунологических, генетических и экологических факторов, способствующих заболеванию. Основная причина, по всей видимости, относится к дисбалансу между толерантностью к комменсальной кишечной микробиоте, пищевым антигенам и иммунным ответам на патогены. Таким образом, воспаление слизистой оболочки, наблюдаемое при болезни Крона, запускается у генетически предрасположенных людей с помощью нерегулярных врожденных и адаптивных иммунных реакций.
В последнее время в метаанализе исследований ассоциации генома количество локусов риска для воспалительных заболеваний кишечника было увеличено до 163; из которых 110 связаны как с болезнью Крона, так и с язвенным колитом. Среди наиболее важных генов восприимчивости для болезни Крона — рецептор NOD2, гены аутофагии ATG16L1 и IRGM и транскрипционный фактор XBP1. Кроме того, было показано, что мутации в IL-10 и в рецепторе IL-10 вызывают моногенетическое воспаление кишечника с тяжелым трудноразрешимым энтероколитом у младенцев.
Из-за роста заболеваемости в промышленно развитых странах считается, что факторы окружающей среды, такие как западная диета, способствуют развитию болезней. Исследования взаимодействия микробиоты кишечника выявили корреляцию между ответами на микобактериальные инфекции и восприимчивость человека к воспалению кишечника. Также предполагается, что аутоиммунитет является еще одним важным фактором патогенеза.
Болезнь Крона — это, в основном, клинический диагноз, основанный на истории болезни пациента и его исследовании и подтвержденный лабораторными, серологическими, рентгенологическими, эндоскопическими и гистологическими данными. Никаких патогномоничных (характерных) маркеров для болезни Крона не существует, поскольку любые данные (например, гранулемы в биопсии) также могут быть обнаружены при других заболеваниях.
Наиболее важные диагностические критерии болезни Крона.
Симптомы — должны присутствовать в течение 4-6 недель
Диарея с кровью и/или слизью
Ночная диарея
Явное или скрытое ректальное кровотечение
Боль в животе
Потеря веса
Задержка полового созревания, задержка роста (у детей и подростков)
Семейная история воспалительных заболеваний кишечника (родственники первой степени у пациентов с болезнью Крона имеют 10-15-кратный риск возникновения заболевания)
Симптомы, вызывающие подозрение на внеуниверсальные проявления болезни Крона (суставы, глаза, кожа)
Абдоминальные массы — пальпируемые образования в брюшной полости ( возможная илеоцекальная инфильтрация или абсцесс)
Перианальные заболевания (трещины, фистулы, абсцессы)
Афтозный стоматит
Орофациальный гранулематоз
Внеуниверсальные признаки (боль в суставах, отек, покраснение или жесткость, узловатая эритема, покраснение глаз). Экстрагинальные проявления, такие как: периферический артрит, анкилозирующий спондилит, увеит и узловатая эритема, выявляются почти у половины пациентов.
Повышенный С-реактивный белок
Повышенная скорость оседания эритроцитов
малокровие
Дефицит железа (низкий ферритин)
Дефицит витамина В12
Тромбоцитоз
Гипоальбуминемия
Повышенный фекальный кальпротектин
Антитела к пекарским дрожжам Saccharomyces cerevisiae (ASCA) (антитела к сахаромицетам)
Ультразвуковое исследование трансабдоминальной области часто является первым методом визуализации, используемым для определения утолщения стенки кишечника и брыжеечного лимфаденита. У всех пациентов должна выполняться колоноскопия с интубацией конечной подвздошной кишки и гастродуоденоскопия. В отличие от неспецифического язвенного колита, связанные с болезнью Крона поражения тканей не ограничиваются толстой кишкой, а могут быть обнаружены во всем пищеварительном тракте, часто с участием конечной подвздошной кишки и слепой кишки. Полное и адекватное исследование тонкой кишки должно проводиться с помощью не излучающих методов, таких как магниторезонансная энтерография, которая также может обнаруживать внемагистральное распространение воспаления и осложнения (препятствия, фистулы, абсцессы).
Основные лабораторные данные болезни Крона не являются маркерами специфичными для болезни. Среди маркеров наиболее изученными являются C-реактивный белок, а также фекальный кальпротектин и лактоферрин. Они могут указывать на активное заболевание и могут прогнозировать рецидив, но тем не менее являются неспецифическими маркерами воспаления. Наиболее часто изучаемыми серологическими маркерами при воспалении кишечника являются антитела к Saccharomyces cerevisiae (ASCA) и антинейтрофильные цитоплазматические антитела — АНЦА. Распространенность ASCA при болезни Крона колеблется между 45 и 60%, однако также может достигать 15% и при язвенном колите.
Положительность ASCA и отрицательный тест на АНЦА или антитела к b-клеткам поджелудочной железы показывают, что болезнь Крона более вероятна, чем неспецифический язвенный колит. Для комбинаций АНЦА отрицательный, а ASCA положительный и и АНЦА положительный, а ASCA отрицательный достигается специфичность 92-97% при болезни Крона и 81-98% для язвенного колита соответственно.
Болезнь Крона может быть классифицирована в соответствии с Монреальской классификацией относительно возраста начала заболевания, локализации заболевания и симптомов. Монреальская классификация используется главным образом в исследованиях, но имеет некоторые двусмысленности: не существует консенсуса относительно того, является ли микроскопическое воспаление в макроскопически нормальной слизистой оболочке проявлением болезни Крона, а также является ли им заболевание подвздошной кишки с ограниченным вовлечением слепой кишки в L1 или L3. Педиатрическая модификация Монреальской классификации, Парижская классификация, пытаются преодолеть эти проблемы.
Также у 5-10% пациентов с воспалительным заболеванием кишечника и при поражении только толстой кишки не может быть поставлен конкретный диагноз болезнь Крона или язвенный колит. Для этих конкретных случаев используется термин неклассифицированное воспалительное заболевание кишечника.
Активность заболевания может быть определена как легкая, умеренная и тяжелая, даже если нет точной классификации самого заболевания. Чаще всего при оценке используется индекс активности болезни Крона (CDAI), но большинство врачей считают CDAI слишком сложным для клинической практики. Этот индекс представляет собой балльную оценку и включает в себя восемь пунктов, а именно: частота стула, боль в животе, общее состояние здоровья, наличие осложнений и абдоминальной массы, гематокрит, потеря веса.
В отличие от CDAI, индекс Харви-Брэдшоу состоит только из клинических параметров: общего состояния здоровья, боли в животе, количества жидкого стула, абдоминальной массы и осложнений с одной балльной точкой для каждого положительного параметра. Для педиатрии был разработан детский индекс активности болезни Крона (PCDAI).
На данный момент в лечении болезни Крона существует не только почти идеологическое противоречие в отношении цели терапии, клинической ремиссии или исцеления слизистой оболочки, но также и в способе достижения ремиссии. Кортикостероиды, аминосалицилаты, иммуномодуляторы, анти-TNF-антитела, антибиотики и другие новые биологические препараты используются в зависимости от тяжести заболевания, локализации, поведения и предшествующей или планируемой операции. При остром течении болезни Крона у детей исключительно энтеральное питание должно быть предпочтительным не только из-за отсутствия побочных эффектов, но и из-за положительного влияния на рост и увеличение веса ребёнка.
Общая информация по воспалительным заболеваниям кишечника
источник
Определение лабораторных маркеров воспалительных заболеваний кишечника (антитела к Sacchаromyces cerevisiae и антитела к цитоплазме нейтрофилов), используемое для дифференциальной диагностики болезни Крона и неспецифического язвенного колита.
- Антитела к цитоплазме нейтрофилов, IgG (с определением типа свечения)
- Антитела к Sacchаromyces cerevisiae (ASCA) классов IgA
- Антитела к цитоплазме нейтрофилов класса IgA (АНЦА)
Серологические тесты при болезни Крона и неспецифическом язвенном колите, антитела к Sacchаromyces cerevisiae и антитела к цитоплазме нейтрофилов (АНЦА).
Синонимы английские
Inflammatory Bowel Disease, Serology panel, Anti-Saccharomyces cerevisiae antibodies (ASCA, ASCAs) and Anti-neutrophil cytoplasmic antibodies (ANCA, ANCAs).
Непрямая реакция иммунофлюоресценции.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Воспалительные заболевания кишечника (ВЗК) — группа состояний, при которых наблюдается нарушение иммунного ответа организма на антигены собственного кишечника и/или антигены нормальной микрофлоры собственного кишечника. В результате этого в кишечнике развивается и поддерживается воспалительный процесс. Выделяют две основные нозологические формы ВЗК: болезнь Крона (БК) и неспецифический язвенный колит (НЯК). Несмотря на некоторую общность патогенеза и принадлежность к одной группе болезней, НЯК и БК характеризуются разным прогнозом и разной тактикой лечения. Поэтому правильная дифференциальная диагностика двух болезней имеет принципиальное значение. Дифференциальная диагностика НЯК и БК носит комплексный характер, и, как правило, включает развернутое серологическое обследование. В настоящее время наиболее широко используются следующие маркеры:
- Антитела к цитоплазме нейтрофилов
Антитела к цитоплазме нейтрофилов (АНЦА) – это группа антител, направленных против различных компонентов нейтрофилов. Их определяют с помощью непрямой реакции иммунофлюоресценции (РНИФ). Кроме факта наличия АНЦА большое значение имеет тип свечения. Говоря о ВЗК, однако, важно различать «типичные» и «атипичные» АНЦА.
Различают два основных типа свечения АНЦА: цитоплазматический (в этом случае говорят о наличии ц-АНЦА, или c-ANCA) и перинуклеарный (п-АНЦА, или p-ANCA). Цитоплазматический тип характеризуется зернистым, диффузным окрашиванием цитоплазмы. Показано, что основным антигеном для ц-АНЦА является протеиназа-3. «Типичный» перинуклеарный тип характеризуется гомогенным, кольцевидным окрашиванием перинуклеарной цитоплазмы. Показано, что основным антигеном для п-АНЦА является миелопероксидаза. Таким образом, ц-АНЦА и типичные п-АНЦА взаимодействуют преимущественно с цитоплазматическими антигенами. Указанные типы АНЦА – это хорошо известные маркеры первичных васкулитов.
Существует также третий тип свечения АНЦА, называемый «атипичным» перинуклеарным типом. Этот тип характеризуется неоднородным, широким, кольцевидным свечением периферической части ядра с множественными внутриклеточными включениями. Таким образом, в отличие от ц-АНЦА и типичных п-АНЦА, атипичные п-АНЦА взаимодействуют преимущественно с ядерными, а не с цитоплазматическими антигенами. Какой-либо специфический антиген для атипичных п-АНЦА, однако, до сих пор не найден.
Следует помнить, что клиническое значение атипичных п-АНЦА отличается от типичных п-АНЦА. Говоря о п-АНЦА при ВЗК (особенно при НЯК), имеют в виду именно атипичные п-АНЦА (но не типичные п-АНЦА). Часто эти антитела путают.
Так как антиген для атипичных п-АНЦА не выявлен, РНИФ остается единственным способом их выявления. Для сравнения: после того как было установлено, что в большинстве случаев антигеном для типичных п-АНЦА является миелопероксидаза, были разработаны более точные тест-системы на основе иммуноферментного анализа (ИФА). Сегодня ИФА является обязательным подтверждающим тестом при выявлении типичных п-АНЦА. В случае же с атипичными п-АНЦА такого подтверждающего теста нет.
Атипичные п-АНЦА обнаруживаются в крови 40-80% пациентов с НЯК и 5-25% пациентов с БК. Эти антитела также могут быть выявлены при других видах колита (например, эозинофильном и коллагенозном колите), других аутоиммунных заболеваниях (например, при первичном склерозирующем холангите — до 88%, и аутоиммунном гепатите I типа — до 81%). У здоровых людей атипичные п-АНЦА встречаются редко (1-3%).
- Антитела к Sacchаromyces cerevisiae
Антитела к Sacchаromyces cerevisiae (ASCA) – антитела, направленные преимущественно против фосфопептидоманнана (компонента клеточной стенки, включающего маннозу) пекарских дрожжевых грибов Sacchаromyces cerevisiae. Манноза входит в состав не только пекарских дрожжевых грибов, но также и некоторых микобактерий и других микроорганизмов (например, дрожжеподобных Candida albicans). До сих пор патофизиологическая роль ASCA не до конца ясна.
Чаще ASCA обнаруживаются у пациентов с БК (50-80% случаев), чем у пациентов с НЯК (2-14%). Распространенность ASCA гораздо выше среди пациентов со спорадическими случаями БК и в семьях только с БК (63%), чем в семьях с БК и НЯК (около 33%).
По структуре ASCA относятся к иммуноглобулинам IgG и IgA классов. Приблизительно у 2/3 пациентов с БК и положительным результатом ASCA IgG также определяются ASCA IgA. До 20% пациентов с БК имеют только ASCA IgA, что объясняет необходимость исследовать оба класса антител.
ASCA также могут быть выявлены при других аутоиммунных заболеваниях (например, при аутоиммунном гепатите – до 20%, болезни Бехчета, первичном билиарном циррозе) и других заболеваниях кишечника (например, при целиакии). У здоровых людей ASCA встречаются редко (1-7%).
Из-за недостаточно высокой чувствительности и специфичности диагностическая роль отдельных тестов п-АНЦА и ASCA несколько ограничена. Большее значение имеет комбинация этих тестов. Результат ASCA + /атипичные п-АНЦА — более характерен для БК, в то время как результат ASCA — /атипичные п-АНЦА + — для НЯК.
В нескольких исследованиях показано, что комбинация двух тестов позволяет различить НЯК и БК с чувствительностью 30-64% и специфичностью более 90%. Следует отметить, что отрицательный результат каждого теста в отдельности или в комбинации не позволяет полностью исключить ВЗК. Также наличие указанных антител в отдельности или в комбинации не позволяет со 100% уверенностью подтвердить диагноз ВЗК. Результат этого комплексного анализа оценивают с учетом всех значимых клинических, лабораторных и инструментальных исследований.
Для чего используется исследование?
- Для дифференциальной диагностики болезни Крона и неспецифического язвенного колита.
Когда назначается исследование?
- При наличии симптомов воспалительного заболевания кишечника (ВЗК): диареи с примесью крови или слизи/констипации, боли в области живота, тенезмов, тошноты и рвоты, потери веса, лихорадки, анемии;
- при обследовании пациента с отягощенным наследственным анамнезом по болезни Крона или неспецифическому язвенному колиту.
Антитела к цитоплазме нейтрофилов, IgG (с определением типа свечения)
Антитела к Sacchаromyces cerevisiae (ASCA) классов IgA
Антитела к цитоплазме нейтрофилов класса IgA (АНЦА)
Что может влиять на результат?
- ASCA чаще выявляются в спорадических случаях болезни Крона или в семьях только с БК и реже в семьях с БК и НЯК.
- ASCA могут быть выявлены у 1-7% здоровых людей, атипичные п-АНЦА – у 1-3%;
- результат исследования следует оценивать с учетом анамнестических, лабораторных и инструментальных данных.
Кто назначает исследование?
Гастроэнтеролог, врач общей практики, педиатр.
- Papp M, Norman GL, Altorjay I, Lakatos PL. Utility of serological markers in inflammatory bowel diseases: gadget or magic? World J Gastroenterol. 2007 Apr 14;13(14):2028-36.
- Iskandar HN, Ciorba MA. Biomarkers in inflammatory bowel disease: current practices and recent advances. Transl Res. 2012 Apr;159(4):313-25.
- Lewis JD. The utility of biomarkers in the diagnosis and therapy of inflammatory bowel disease. Gastroenterology. 2011 May;140(6):1817-1826.e2.
источник
Современная медицина рассматривает болезнь Крона как сложное заболевание, причины возникновения которого до конца не изучены. Эта хроническая аутоиммунная болезнь может появиться как в детском, так и во взрослом возрасте. При данном заболевании поражается желудочно-кишечный тракт (ЖКТ). Воспалительный процесс затрагивает не только слизистую оболочку кишечника, но также подслизистый и мышечный его слои.
Вылечить полностью болезнь Крона у детей и взрослых, как правило, невозможно. Терапия может быть направлена только на устранение симптомов. При первых признаках болезни необходимо обратиться за помощью к гастроэнтерологу или терапевту.
Определить стадию болезни Крона и диагностировать состояние пациента порой затруднительно. Бывает так, что симптомы заболевания выражены неярко и отдаленно напоминают другие болезни, например, неспецифический язвенный колит. В таком случае диагноз, как правило, звучит как «неуточненный колит».
При болезни Крона диагностика проводится комплексно. Важно не только установить нозологический диагноз, но и определить активность воспалительного процесса, выполнить топическую диагностику.
Врач обязан учесть внекишечные признаки, которые сопровождают болезнь Крона, диагностика в таком случае будет более полной. Устранить симптомы только в ЖКТ (желудочно-кишечном тракте) недостаточно. Проявления заболевания на кожных покровах, в печени, почках или, например, в мочевом пузыре могут также влиять на качество и продолжительность жизни пациента.
Диагностика при заболевании ЖКТ — это динамический процесс. Ошибки при обследовании больного возможны, и главную роль тут могут сыграть объективные трудности диагностики.
Чтобы исключить ошибки, важно обращаться за помощью только к компетентному врачу. Нельзя самостоятельно проводить диагностику и тем более следовать сомнительным советам, которые дают родственники или друзья относительно терапии.
Ошибки при диагностике болезни Крона у детей и взрослых могут возникнуть из-за врачебного недопонимания какого-либо сущностного явления заболевания. Такая ситуация может произойти в том случае, когда диагност имеет небольшую практику, то есть мало сталкивался с болезнью Крона и его проявлениями.
Даже если врач на первом осмотре диагностирует болезнь Крона, анализы назначаются в обязательном порядке. Выявить острую форму болезни Крона у детей и взрослых, а также определить стадию поражения кишечника помогут следующие анализы:
- мочи;
- кала;
- крови.
Если у пациента болезнь Крона, диагностика может определить:
- низкий гемоглобин;
- высокую СОЭ (скорость оседания эритроцитов);
- повышенный уровень лейкоцитов.
Биохимические анализы при болезни Крона, как правило, выявляет повышение концентрации фибриногена. Падает содержание в крови альбумина, а С-реактивный белок, наоборот, растет. Уровень фолиевой кислоты и витамина В12 понижается. А вот иммунологический тест при болезни Крона показывает рост содержания циркулирующих иммунных комплексов и иммуноглобулинов.
При болезни Крона анализ мочи выявляет протеинурию (белок в моче), а также гематурию (наличие крови). В кале могут определяться лейкоциты, примесь крови и клетки эпителия, глисты и даже инфекция бактериального типа. Проводимые при болезни Крона анализы мазков, полученные из слизистой части кишки – еще одна разновидность лабораторной диагностики.
Если у пациента диагностируется болезнь Крона, анализы необходимо сдавать периодически, как правило, с интервалом, который будет зависеть от течения заболевания и проводимой терапии.
Болезнь Крона у детей и взрослых требует срочного врачебного реагирования. Определить наличие воспаления в кишечнике можно при помощи современной и точной колоноскопии. Такая процедура позволяет подробно изучить состояние толстой кишки почти по всей ее длине. Противопоказаниями для проведения колоноскопии являются лишь:
- перитонит, представляющий собой воспаление брюшины;
- нарушения свертываемости крови;
- сердечная недостаточность.
Рентген области живота позволяет определить прободение кишечника и всевозможные расширения этого полого органа. При болезни Крона незаменима и серошкальная, а также цветная допплеросонография. Ультразвуковая диагностика поможет обнаружить свищи, опухолевидные конгломераты и непроходимость.
Компьютерная томография является еще одним способом диагностики состояния пациента при болезни Крона. Такое исследование позволяет мгновенно получить четкое изображение брюшины и таза. При помощи КТ можно выявить абсцесс и участки с перфорацией. Именно благодаря компьютерной томографии врачи чаще всего успешно проводят дренирование абсцессов, что облегчает состояние пациента и помогает избежать сложных операций.
Какая именно диагностика может быть проведена в конкретном случае, решает только лечащий врач. Важно знать, что, например, рентген противопоказан при беременности, а колоноскопия, если болезнь Крона находится в острой стадии, может проводиться только в редких случаях.
Гастроэнтеролог подберет оптимальный список диагностических манипуляций, которые будут самыми информативными в конкретном случае. Врач учтет возраст пациента, симптомы, стадию и области поражения. Также специалист примет во внимание наличие сопутствующих хронических заболеваний у пациента, что может существенно отразиться не только на диагностике, но и на лечении аутоиммунной хронической болезни.
источник
Подцарство: Высшие грибы Отдел: Аскомицеты
Подотдел: Saccharomycotina O.E. Erikss. & Winka 1997
Класс: Сахаромицеты (Saccharomycetes G.Winter, 1880)
Порядок: Сахаромицетовые Семейство: Сахаромицетовые
Род: Сахаромицес Вид: Saccharomyces cerevisiae
Международное научное название
Saccharomyces cerevisiae Meyen ex E.C.Hansen 1883
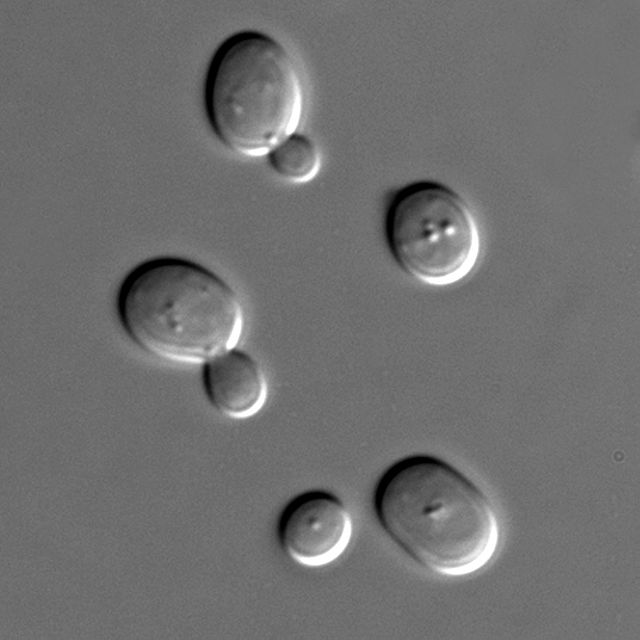
Пекарские дрожжи [1]:96,102 (лат. Saccharomyces cerevisiae) — вид одноклеточных микроскопических (5—10 мкм в диаметре) грибков (дрожжей) из класса сахаромицетов, широко используемый в производстве алкогольной и хлебопекарной продукции, а также в научных исследованиях. В 1996 году пекарские дрожжи стали первыми эукариотами, чей геном был полностью секвенирован[2].
Клетки Saccharomyces cerevisiae размножаются вегетативным образом при помощи почкования. Сначала появляется вырост на материнской клетке, затем происходит митотическое деление ядра, образование клеточной стенки и отделение клеток друг от друга. На материнской клетке остается шрам от почкования, что позволяет определить её возраст. Обычно материнская клетка может образовывать 20—30 почек.
Клетки дрожжей могут пребывать в одном из двух стабильных состояниях (фазах): гаплоидном (сфероиды) и диплоидном (эллипсоиды), которые считаются различными поколениями. В течение каждой фазы пекарские дрожжи размножаются вегетативно почкованием. По продолжительности у пекарских дрожжей преобладает диплоидная фаза. Она переходит в гаплоидную фазу путём образования гаплоидных аскоспор в результате мейоза. Гаплоидная фаза переходит в диплоидную путём слияния образовавшихся из аскоспор гаплоидных клеток [1]:96-97.
Для выращивания оптимальными условиями является раствор дрожжевого экстракта с температурой 30 °C, содержащий пептон и глюкозу.
Saccharomyces cerevisiae — один из наиболее изученных модельных организмов, на примере которого происходит исследование клеток эукариотов, они легко выращиваются и не являются патогенными для человеческого организма. По сравнению с кишечной палочкой (Escherichia coli), клетка дрожжей содержит в несколько раз больше ДНК и имеет более сложную организацию, чем бактерии. Клетки сохраняют жизнеспособность даже с множественными генетическими маркерами в своем генотипе, что существенно с точки зрения генной инженерии[3]
1) дрожжи – это грибок, а пекарские дрожжи – грибок, не встречающийся в природе, более стойкий, чем природные грибки, не разрушается в организме человека, в процессе производства обрабатывается хлорной известью, подкисляется серной кислотой и т.п.
2) дрожжи распространяются по всему организму с током крови, куда попадают из пищеварительного тракта, увеличивают проницаемость наших клеток, чем пользуются патогенные микроорганизмы и вирусы
3) пекарские дрожжи размножаются в геометрической прогрессии и позволяют активно размножаться и процветать патогенной микрофлоре, которая, в свою очередь, подавляет нормальную – бактерии, способные вырабатывать для нас витамины и аминокислоты для построения собственных белков
4) дрожжи закисляют желудочную среду, в перспективе и совместно с крахмалами способствуют образованию язв и гастритов, хроническим запорам, способствуют образованию камней в печени и желчном пузыре, в закисленной среде удобнее селиться и процветать паразитам, из-за этого и из-за общего закисления нарушается усвоение кальция
5) дрожжевое брожение вызывает вздутие, и вслед за ним анатомические нарушения, диафрагма уже не может должным образом, мощными колебаниями на глубоком дыхании, стимулировать приток крови в легкие, иногда в связи с изменениями в кишечнике и желудке смещается и меняет форму желчный пузырь, не происходит «массаж» сердца, легких, печени, поджелудочной, все это способствует нарастанию застойных явлений в нижних конечностях, малом тазе, голове, варикозу, тромбообразованию, дальнейшему снижению иммунитета
6) грибы (дрожжи в т.ч.) способны производить, помимо прочих токсичных веществ, и антибиотики
7) продукты вторичного метаболизма дрожжей, выделяемые в малых количествах в ткани организма: сивушные масла, ацетоин, диацетил, масляный альдегид, изоамиловый спирт, диметилсульфид и др.
8) грибки могут селиться в мицелии кишечника – специальном поверхностном слое, который нужен для размещения здоровой микрофлоры. Мицелиевый слой кишечника слущивается только на третью неделю лечебного голодания, но также помогают бороться с дрожжами и продуктами их жизнедеятельности антагонисты дрожжей – лактобактерии и культура кишечной палочки (которые лучше и легче всего получаются из клетчатки сырых овощей – моркови, свеклы, капусты). Есть и «стерилизующие» травы.
Анализ крови АНЦА — что это? Аббревиатура расшифровывается как антинейтрофильные цитоплазматические антитела. Известен анализ далеко не всем, многие не знают, что это соотношение, которое формируют антитела к цитоплазме нейтрофилов, или же просто тест на выявление системного васкулита. Исследованию подлежит сыворотка крови на наличие или отсутствие антител с гранулами моноцитов или нейтрофилов.
Антитела к цитоплазме нейтрофилов с учетом образования того или иного фермента по отношению к ним бывают 3 видов, это:
С-ANCA, антитела к нейтрофилам, образующиеся по большей части к миелобластину (протеиназе-3 лизосом).
р-ANCА, как антитела к ферментам — миелопероксидазе, катепсину G, лактоферрину, лизоцину, эластазе.
х-ANCА, появление которых в крови указывает на ряд заболеваний — язвенный колит, ревматоидный васкулит, гепатит C, холангит, болезнь Крона, иные проблемы с пищеварительным трактом.
Анализ дает возможность выявить присутствие и количество антител типа igа по отношению к нейтрофилам, подтвердить (опровергнуть) развитие аутоиммунного заболевания сосудов. Все антитела класса igg — IgA и igm — взаимосвязаны между собой и с нейтрофилами, приводят к выбросам биологически активных веществ (радикалов кислорода) из клеток интервентов, оказывающих губительное воздействие на стенки сосудов.
Только вовремя взятый анализ крови на АНЦА позволяет подтвердить либо опровергнуть развитие аутоиммунного заболевания, поскольку доказана связь АНЦА с гранулематозом Вегенера. При подозрении на системный васкулит чувствительность теста у больного составляет более 85%, при подозрении на красную волчанку либо синдром Гудпасчера — до 80%.
Дополнительные клинические признаки у больного помогают подтвердить диагноз в случае получения положительного результата теста. Заключение врача может быть опровергнуто, если признаки слабо выражены, хотя рецидивы при васкулите вполне возможны, а положительный анализ АНЦА может быть получен позже.
Норма показателей и проведение анализа
Анализ показан к проведению больным с целью дифференциации васкулита или при подозрении на воспалительный процесс в сосудах, развитие патологии в пищеварительном тракте, язвенного колита, неспецифической болезни Крона.
В норме, когда анализ будет отрицательным, то данные будут составлять меньше 1/40 ммоль/л. Анализ будет положительным, если референсные значения окажутся свыше данной нормы.
При положительных результатах исследования у больных зачастую наблюдаются лабораторные признаки дисфункции почек, что также подтверждает и клиническая картина его состояния.
Это явно указывает в первую очередь на развитие геморрагического васкулита, когда зачастую появляются сразу все симптомы:
петехиальная сыпь на коже (пятна разного диаметра, которые могут иметь цвет от бледно-красного до фиолетового);
болезненность в животе;
ломота в суставах.
В каких случаях показатели превышают норму?
У здоровых людей анализ крови на АНЦА, конечно, будет отрицательным.
Положительная реакция свидетельствует о развитии:
геморрагического васкулита;
системной волчанки;
ревматоидного воспаления суставов (артрита);
гепатита типа C в хронической форме;
неспецифического язвенного колита;
Все это случаи, когда референсные значения или антитела к нейтрофилам (количественное значение) превышают норму АНЦА в крови — 1/40. Бывает, что количество нейтрофилов в крови повышается, если проведенная терапия не привела к должным результатам.
Кроме того, анализ назначается к проведению ревматологом или неврологом при разработке лечебной программы при вышеперечисленных заболеваниях. Результаты исследования необходимы для врача.
Среди серологических тестов – обнаружение р-антинейтрофильных цитоплазматических антител (р-АNСАs) и анти-Saccharomyces cerevisae антител (АSCАs). По данным проспективного наблюдения Joossens S. et al.(2002) 50% пациентов с первоначальным диагнозом НЯК и положительными серологическими тестами в последующем был поставлен диагноз БК либо НЯК: 80% пациентов c АSСА+/рАNСА- страдали БК, 63,6% с рANCA+/ASCA- — ЯК, а 48% с диагнозом НЯК показали отрицательные результаты обоих серологических тестов.
Следовательно, серологические маркеры недостаточно специфичны для постановки диагноза.
ИСТОЧНИК
Общая информация об исследовании
Антитела к Sacchаromycescerevisiae (ASCA) – это иммуноглобулины, взаимодействующие с гликопротеином клеточной стенки пекарских дрожжей Sacchаromyces cerevisiae. Их удается обнаружить в крови пациентов с воспалительными заболеваниями кишечника, такими как болезнь Крона (терминальный илеит) и неспецифический язвенный колит (НЯК), хотя на сегодняшний день роль ASCA в патогенезе этих заболеваний остается до конца не ясной.
ASCA представлены иммуноглобулинами двух классов: IgG и IgA. Около трети больных терминальным илеитом, в крови которых определяются ASCA, IgG, также имеют иммуноглобулины IgA. Каждый пятый пациент с болезнью Крона имеет только ASCA, IgA. В настоящее время рекомендуется раздельное определение классов иммуноглобулинов ASCA.
Исследование ASCA, IgA, входит в комплекс лабораторных тестов, назначаемых при обследовании пациента с жалобами на нарушения стула (диарея), боль в области живота, тошноту и рвоту, потерю веса и др. Данные симптомы не являются специфическими для воспалительных заболеваний кишечника и могут наблюдаться при заболеваниях другой этиологии (инфекционных, онкологических). Для дифференциальной диагностики заболеваний кишечника, наряду с другими лабораторными и инструментальными исследованиями , назначается определение концентрации ASCA, IgA. Эти антитела указывают на болезнь Крона и НЯК и не характерны для синдрома раздраженного кишечника, злокачественных новообразований, лактазной недостаточности и других состояний, сопровождающихся диареей. Необходимо отметить, что ASCA, IgA, могут быть определены в некоторых случаях целиакии (глютеновой энтеропатии) и аутоиммунного гепатита и, таким образом, не являются специфическими маркерами воспалительных заболеваний кишечника. Кроме того, эти антитела иногда обнаруживаются у здоровых людей.
ASCA, IgA, чаще выявляются у пациентов с болезнью Крона, но также могут присутствовать и у некоторых больных НЯК, поэтому тест на ASCA, IgA, не может быть использован в качестве единственного исследования, позволяющего различить два состояния. Для этой цели рекомендуется определение как ASCA, IgA, так и ASCA, IgG. Наличие у больного ASCA, IgG и IgA, позволяет с высокой вероятностью предполагать болезнь Крона, что, однако, не отменяет необходимости биопсии кишки и комплексного обследования пациента.
Наибольшую трудность представляет группа пациентов с поражением толстой кишки, характеризующимся признаками как болезни Крона, так и НЯК («неопределенный, неклассифицируемый колит»). В такой ситуации анализ на ASCA, IgA, с тестом на антитела к нейтрофилам (p-ANCA) позволяет определить прогноз заболевания и тактику лечения. Сочетание ASCA /ANCA— в 80 % случаев неопределенного колита предсказывает развитие болезни Крона, а сочетание ASCA—/ANCA в 64 % случаев – развитие НЯК.
Анализ на ASCA, IgA, может быть использован для оценки прогноза болезни Крона. Её течение при наличии ASCA, IgA, характеризуется более частым поражением тонкой кишки, а также развитием стриктур и перфораций. Пациенты с ASCA/ANCA — с болезнью Крона, хуже отвечают на лечение биологическими препаратами ( ингибиторами ФНО-? ).
Концентрация ASCA, IgA, остается стабильной вне зависимости от эффективности лечения и не отражает длительности и тяжести заболевания. По этой причине повторные определения ASCA, IgA, не проводят.
На сегодняшний день остается не до конца ясным, почему ASCA, IgA, иногда выявляются при обследовании близких родственников пациента с болезнью Крона или НЯК, не имеющих жалоб и признаков воспалительных заболеваний кишечника. ASCAпоявляются у 30 % пациентов задолго (за 1,5-4,5 года) до клинически выраженной картины болезни Крона. По этой причине пациентам с наличием ASCA, IgA, имеющим хотя бы одного кровного родственника с болезнью Крона или НЯК, рекомендуется наблюдение у гастроэнтеролога.
Для получения максимально полной информации о пациенте анализ на ASCA, IgA, дополняют другими общеклиническими и лабораторными тестами. Результат исследования следует оценивать с учетом анамнестических, лабораторных и инструментальных данных.
Для чего используется исследование?
* Для дифференциальной диагностики воспалительных заболеваний кишечника (болезни Крона и неспецифического язвенного колита);
* для диагностики и оценки прогноза болезни Крона.
Когда назначается исследование?
* При симптомах воспалительных заболеваний кишечника (диарея с примесью крови или слизи, боли в области живота, ложные позывы к дефекации, тошнота и рвота, потеря веса, лихорадка, анемия);
* при обследовании пациента с отягощенным наследственным анамнезом по болезни Крона или неспецифическому язвенному колиту.
Что означают результаты?
Референсные значения: 0 — 20 RU/ml.
Причины положительного результата:
* болезнь Крона (терминальный илеит);
* неспецифический язвенный колит;
* целиакия (глютеновая энтеропатия);
* болезнь Бехчета;
* аутоиммунный гепатит.
Причины отрицательного результата:
* норма;
* неправильное взятие крови на исследование.
Что может влиять на результат?
* ASCA, IgA, чаще выявляются в единичных случаях терминального илеита или в семьях с несколькими больными только болезнью Крона и гораздо реже в семьях с несколькими больными болезнью Крона и неспецифическим язвенным колитом.
Важные замечания
* ASCA, IgG могут быть выявлены у здоровых людей.
* Исследование не предназначено для оценки тяжести заболевания и эффективности лечения.
* Результат исследования следует оценивать с учетом анамнестических, лабораторных и инструментальных данных.
Также рекомендуется
* Общий анализ крови (без лейкоцитарной формулы и СОЭ)
* Скорость оседания эритроцитов (СОЭ)
* Анализ кала на скрытую кровь
* Копрограмма
* С-реактивный белок, количественно (метод с нормальной чувствительностью)
* Антитела к Sacchаromyces cerevisiae (ASCA) классов IgG
* Антитела к цитоплазме нейтрофилов, IgG (с определением типа свечения)
* Диагностика воспалительных заболеваний кишечника (антитела к бокаловидным клеткам кишечника и протокам поджелудочной железы)
* Дифференциальная диагностика болезни Крона и язвенного колита
Фунгемия, вызванная Saccharomyces cerevisiae
Опубликовано: Понедельник, 26 сентября 2005 г. — 08:55
Saccharomyces cerevisiae применяется в пекарной и пивной промышленности, а также в качестве пробиотика в терапии антибиотик-ассоциированной диареи. Однако, в ряде случаев данный микроорганизм может стать причиной развития инфекций у человека.
За период с 15 по 30 апреля 2003 г. у 3 пациентов, находившихся в отделении реанимации и интенсивной терапии Университетского госпиталя Мадрида (Испания), развилась фунгемия, вызванная S.cerevisiae. Предпринятое эпидемиологическое исследование показало, что единственным фактором риска возникновения инфекции являлся приём препарата, содержащего пробиотик Saccharomyces boulardii, являющийся одним из штаммов S.cerevisiae. Все 3 пациента получали данный пробиотик посредством введения через назофаренгиальный зонд в течение, в среднем, 8,5 дней до развития фунгемии. Молекулярно-генетическое исследование клинических изолятов показало их полную идентичность штаммам, содержащимся в капсулах препарата. Прекращение использования препарата в отделении позволило купировать вспышку инфекции.
При поиске литературы были выявлены описания еще 57 случаев фунгемии, вызванной S.cerevisiae, причём, в 31 из них пациенты получали пробиотики или находились в контакте с лицами, получавшими их. 60% пациентов находились в отделении реанимации и интенсивной терапии, 71% получали энтеральное или парентеральное питание. Смертность от фунгемии достигала 28%.
Таким образом, S.cerevisiae может являться возбудителем нозокомиальной грибковой инфекции. Следует с осторожностью подходить к использованию пробиотиков, содержащих данный микроорганизм, особенно у пациентов с иммунодефицитными состояниями, а также находящихся в критическом состоянии.
ИСТОЧНИК
В настоящее время публикуются обширные обзоры дрожжей в желудочно-кишечном тракте человека, но исследовательская группа выбрала два типа дрожжей, которые являются обычными в кишечной микробиоте здоровых и пациентов с ВЗК.
Saccharomyces cerevisiae, также называемый пекаркие дрожжи, является выдающимся организмом в нашей среде и нашей пище.
Rhodotorula aurantiaca обычно встречается в нашей среде, а также в молочном и фруктовом соках.
В этом исследовании ученые дали мышам, дрожжи этих разных типов, которые были обработаны химическими веществами, чтобы вызвать симптомы, подобные ВЗК. Симптомы увеличились у мышей, которых кормили Saccharomyces cerevisiae , но не у тех, которых кормили Rhodotorula aurantiaca.
«У мышей, которых кормили S. cerevisiae, наблюдалась значительная потеря веса, диарея, кровавый стул, как и у человека с ВЗК», — сказал Тайсон Чиаро, аспирант лаборатории Round.
В отличие от других сортов дрожжей, S. cerevisiae не может разрушать пурины, которые накапливаются в кишечном тракте и переходят в другое соединение, называемое мочевой кислотой. Мочевая кислота усугубляет воспаление, которое может ухудшить симптомы ВЗК.
В дополнение, ученые исследовали образцы сыворотки у здоровых взрослых людей. «Мы обнаружили, что каждый образец человеческой сыворотки, с высокими антителами S. cerevisiae, также имел высокий уровень мочевой кислоты».
Хотя только подгруппа пациентов с ВЗК была колонизирована S. cerevisiae, результаты этого исследования подтверждают идею о том, что дрожжи усугубляют болезнь у этих людей.
Чтобы проверить идею, ученые дали мышам лекарство аллопуринол,
которое используют для предотвращения образования мочевой кислоты у пациентов с подагрой. Препарат значительно уменьшил воспаление кишечника у этих мышей.
Раунд хочет расширить эту работу, исследуя — как бактерии и дрожжи взаимодействуют друг с другом в кишечнике? «Дрожжи и бактерии могут влиять на биологию друг друга в нашей кишке. Однако мы не знаем, как это взаимодействие влияет на человеческую болезнь». Сказала Раунд. «Наши исследования будут продолжаться для изучения роли кишечных микроорганизмов, в нашем микробиоме, с надеждой на то, чтобы идентифицировать терапию на основе микробиоты, для лечения различных заболеваний».
ИСТОЧНИК ещё ИСТОЧНИК
Дрожжи saccharomyces cerevisiae, используемые в качестве пробиотика, и композиция на их основе
Классификация по МПК: A23L Патент на изобретение №: 2490324
Дата публикации: Пятница, Февраль 10, 2012
Начало действия патента: Пятница, Декабрь 12, 2008
Изобретение относится к штаммам дрожжей Saccharomyces cerevisiae CNCM I-3856 и Saccharomyces cerevisiae var. boulardii CNCM I-3799, используемых в качестве пробиотика, пригодного при производстве пищевых или фармацевтических композиций. Предложена также композиция, содержащая штамм дрожжей Saccharomyces cerevisiae CNCM I-3856 и/или Saccharomyces cerevisiae var. boulardii CNCM 1-3799 и/или по меньшей мере один из париентальных маннопротеинов EL 05 и EL 06 штамма дрожжей Saccharomyces cerevisiae CNCM I-3856. Изобретение способствует уменьшению боли в кишечнике, индуцированию противовоспалительного действия при отсутствии провоспалительного действия, затруднению и уменьшению адгезии и заселения желудочно-кишечного тракта бактериями, являющимися патогенными и/или имеющими инвазивный характер.
Объектом настоящего изобретения являются также дрожжи Saccharomyces cerevisiae, полученные исходя из штамма, депонированного в Национальной коллекции культур микроорганизмов под № CNCM I-3856, и дрожжи Saccharomyces var. boulardii, полученные исходя из штамма, депонированного в Национальной коллекции культур микроорганизмов под № CNCM I-3799.
Другим объектом настоящего изобретения является композиция, содержащая дрожжи Saccharomyces cerevisiae, полученные исходя из штамма, депонированного в Национальной коллекции культур микроорганизмов под № CNCM I-3856, и/или дрожжи Saccharomyces var. boulardii, полученные исходя из штамма, депонированного в Национальной коллекции культур микроорганизмов под № CNCM I-3799, и/или по меньшей мере один производный продукт дрожжей Saccharomyces cerevisiae, выбранный из экстрактов дрожжей, производных продуктов клеточных стенок, париетальных глюканов, париетальных маннопротеинов, липидных фракций дрожжей, фракций нуклеиновых кислот дрожжей (РНК, ДНК).
Композиция по настоящему изобретению имеет следующие преимущества:
— способность, в частности, в сухих формах сопротивляться и выживать при переходе желудочного барьера, что позволяет оптимизировать ее действие на желудочно-кишечный тракт;
— противовоспалительное действие;
— отсутствие провоспалительного действия или очень слабое такое действие;
— способность уменьшать боли в кишечнике;
— способность затруднять и уменьшать адгезию и заселение бактериями, являющимися патогенными и/или имеющими инвазивный характер, желудочно-кишечного тракта, в частности тонкого кишечника и толстой кишки.
Такая новая композиция, обладающая такой комбинацией характеристик, до настоящего времени еще не была описана или идентифицирована.
Таким образом, данная композиция представляет собой исключительный интерес.
Анализ ASCA — не является диагностическим анализом для ВЗК. Результаты этого анализа, могут быть косвенно использованы для дифференцировки БК и НЯК, но условно, относительно к статистике БК (более часто встречаются).
Если по результатам анализов видно, что у человека имеются антитела к сахаромицетам, а именно к Saccharomyces cerevisiae и его подтипам, то такие пробиотики строго запрещены! Более того, нужно исключить из своего меню всё, что создаёт благоприятные условия для питания этих грибов, глютеносодержащие продукты, а также продукты, которые готовились с применением Saccharomyces cerevisiae — пекарских (термофильных) дрожжей.
Этот анализ важен для выбора диеты или для корректировки питания, с учётом грибов, в случае положительного результата анализа.
источник
Не менее 3 часов после последнего приема пищи. Можно пить воду без газа.
Метод исследования: иммуноферментный анализ (ИФА)
Определение антител к Saccharomyces IgA/IgG являются основным диагностическим маркером выявления болезни Крона, кроме того они могут использоваться для дифференциальной диагностики болезни Крона и неспецифического язвенного колита.
При язвенном колите антитела к Saccharomyces IgG и IgA выявляются в 5% и 7%, а при болезни Крона в 75% и 60% случаев соответственно. Общая специфичность ASCA (IgG и IgA) для диагностики болезни Крона составляет 93%. И, наоборот, частота выявления ANCA варьирует от 50% до 90% при язвенном колите, и от 10% до 20% при болезни Крона. Комбинация двух серологических тестов ANCA и ASCA делает возможным быструю и неинвазивную дифференциальную диагностику между болезнью Крона и язвенным колитом.
- Диагностика болезни Крона и неспецифического язвенного колита;
- Дифференциальная диагностика БК и НЯК.
Референсные значения (вариант нормы):
| Параметр | Референсные значения |
|---|---|
| Антитела к Saccharomyces Cerevisae (ASCA) IgA, качественное определение | Не обнаружено |
- Обнаружено – свидетельствует о наличии специфических аутоантител
- Не обнаружено – свидетельствует об отсутствии специфических аутоантител
- Серая зона (пограничный результат) – рекомендуется повторить исследование не ранее, чем через 2 недели при отсутствии острых воспалительных заболеваний
- определение аутоантител проводится с целью подтверждения диагноза у пациентов с недостаточным количеством клинических критериев;
- обнаружение аутоантител при отсутствии клинических признаков не является достаточным для постановки диагноза аутоиммунного заболевания;
- отмечено нарастание частоты выявления аутоантител у лиц пожилого и старческого возраста, на фоне приема лекарственных препаратов, при вирусных и бактериальных инфекциях, злокачественных новообразованиях, у здоровых родственников больных аутоиммунными заболеваниями;
- при оценке клинического значения аутоантител необходимо учитывать стойкость и выраженность их гиперпродукции. Например, при инфекциях наблюдается умеренное транзиторное образование аутоантител, а при аутоиммунных заболеваниях – стойкая выраженная гиперпродукция.
Обращаем Ваше внимание на то, что интерпретация результатов исследований, установление диагноза, а также назначение лечения, в соответствии с Федеральным законом № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» от 21 ноября 2011 года, должны производиться врачом соответствующей специализации.
» [«serv_cost»]=> string(4) «1145» [«cito_price»]=> NULL [«parent»]=> string(2) «24» [10]=> string(1) «1» [«limit»]=> NULL [«bmats»]=> array(1) array(3) string(1) «N» [«own_bmat»]=> string(2) «12» [«name»]=> string(31) «Кровь (сыворотка)» > > >
| Тип | В офисе |
|---|---|
| Кровь (сыворотка) |
Не менее 3 часов после последнего приема пищи. Можно пить воду без газа.
Метод исследования: иммуноферментный анализ (ИФА)
Определение антител к Saccharomyces IgA/IgG являются основным диагностическим маркером выявления болезни Крона, кроме того они могут использоваться для дифференциальной диагностики болезни Крона и неспецифического язвенного колита.
При язвенном колите антитела к Saccharomyces IgG и IgA выявляются в 5% и 7%, а при болезни Крона в 75% и 60% случаев соответственно. Общая специфичность ASCA (IgG и IgA) для диагностики болезни Крона составляет 93%. И, наоборот, частота выявления ANCA варьирует от 50% до 90% при язвенном колите, и от 10% до 20% при болезни Крона. Комбинация двух серологических тестов ANCA и ASCA делает возможным быструю и неинвазивную дифференциальную диагностику между болезнью Крона и язвенным колитом.
- Диагностика болезни Крона и неспецифического язвенного колита;
- Дифференциальная диагностика БК и НЯК.
Референсные значения (вариант нормы):
| Параметр | Референсные значения |
|---|---|
| Антитела к Saccharomyces Cerevisae (ASCA) IgA, качественное определение | Не обнаружено |
- Обнаружено – свидетельствует о наличии специфических аутоантител
- Не обнаружено – свидетельствует об отсутствии специфических аутоантител
- Серая зона (пограничный результат) – рекомендуется повторить исследование не ранее, чем через 2 недели при отсутствии острых воспалительных заболеваний
- определение аутоантител проводится с целью подтверждения диагноза у пациентов с недостаточным количеством клинических критериев;
- обнаружение аутоантител при отсутствии клинических признаков не является достаточным для постановки диагноза аутоиммунного заболевания;
- отмечено нарастание частоты выявления аутоантител у лиц пожилого и старческого возраста, на фоне приема лекарственных препаратов, при вирусных и бактериальных инфекциях, злокачественных новообразованиях, у здоровых родственников больных аутоиммунными заболеваниями;
- при оценке клинического значения аутоантител необходимо учитывать стойкость и выраженность их гиперпродукции. Например, при инфекциях наблюдается умеренное транзиторное образование аутоантител, а при аутоиммунных заболеваниях – стойкая выраженная гиперпродукция.
Обращаем Ваше внимание на то, что интерпретация результатов исследований, установление диагноза, а также назначение лечения, в соответствии с Федеральным законом № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» от 21 ноября 2011 года, должны производиться врачом соответствующей специализации.
источник
Иммунитет – сложная система. Планируя лечение, мы должны четко представлять себе, какие именно нарушения в иммунной системе произошли и почему. Тогда и лечение можно с уверенностью направить именно туда, где оно требуется. Не существует лекарства «Для всей иммунной системы». Современные лекарства позволяют избирательно, «точечно» помочь тому или иному иммунному процессу, а иммунограмма помогает определить эффективные и безопасные точки приложения лечения. Такое лечение и надежнее, и требует меньше медикаментов и отвечает критериям безопасности.
Основные показания для обследования иммунитета
Наличие хронического воспаления где-либо, когда иммунитет не в силах справиться с инфекцией (тонзиллит, фарингит, бронхит, цистит, пиелонефрит, гастрит, дисбактериоз, простатит, уреаплазма, молочница, герпес и др.);
Наличие аутоиммунного, ревматического заболевания, когда иммунитет может проявлять агрессию к здоровым тканям организма, принимая их за чужеродные;
Частые и длительные заболевания «простудами»;
Нейроинфекции, в т.ч., арахноидит;
Риск онкологических заболеваний (снижение противоопухолевого иммунитета, неблагоприятная наследственность, радиоактивное облучение и др.), состояние после операций, химиотерапии, лучевой терапии.
Иммунитет — поддерживайте его в оптимальном
Иммунитет — наш билет в бесконечность – так назвал его американский ученый Роберт Голдман. Сказано сильно, и абсолютно верно.
Все мы находимся в состоянии постоянной войны с миллиардами бактерий и вирусов, угрожающим нам инфекцией, способной нанести существенный ущерб здоровью, и сократить срок жизни. Новейшие исследования показывают, что инфекции являются частью механизма развития сердечных недугов. Они ускоряют прогрессирование хронических заболеваний и даже провоцируют ускоренную потерю памяти.
Доказано: слабо выраженные и нераспознанные инфекции отнимают до 20 лет активной жизни. А кто защищает нас от вирусов и бактерий? Иммунитет. Есть и второй важнейший нюанс: при ослаблении иммунных функции накапливаются мутации ДНК и существенно повышается риск онкологии. Таким образом, иммунитет это сложнейшая защитная система организма, которая противостоит всему чужеродному в организме, обеспечивает постоянство организма. Создавая специальные клетки, которые уничтожают микробы которые спасают нас от инфекций и опухолей.
В иммунную систему входят органы – костный мозг, вилчковая железа, селезенка, лимфатическая железа с лимфатическими уздами, которых более 400, лимфатические узелки в кишечнике, аппендикс, небные миндалины. И важно чтобы суммарная реакция иммунитета, или иммунный ответ был сильным.
На снижение иммунитета, конечно, играют окружающая среда: плохой воздух от автомобилей, от предприятий, вода, загрязненная промышленными стоками, продукты с химическими добавками, нитратами, консервантами, бытовая химия. Не малую роль снижению иммунитету наносят изделия фармацевтических фабрик.
Особенно сильно влияет на снижение иммунитета антибиотики.
Нарушая баланс между полезными и вредными бактериями в организме, антибиотики наносят сильный удар по ослаблению иммунной системе. И, скорее всего, болезни сердца, сосудистой системы, воспалительные процессы разных органов это, прежде всего ослабление иммунной системы, самой слабой из всех систем организма.
Сильный иммунитет залог активного долголетия. Укрепляйте его! Всеми возможными средствами. Начните с общего – обратите внимание на то, что вы едите, и хорошо ли ваш организм усваивает пищу. Ведь 40% иммунных клеток находится в кишечнике. Следовательно, прежде всего, необходимо – восстановить нормальную кишечную микрофлору. Всеми средствами устраните дисбактериоз путем употребления кисломолочных продуктов. Помогает восстановить защитный слой слизистой желудочно-кишечного тракта овсянка: в любом виде — это и каша, и кисели, и настои цельного зерна. После восстановления слизистой – употребляйте клетчатку — свежие овощи и фрукты. Нужно употреблять проращенную пшеницу.
Необходимо пополнить организм запасами магния, цинка, селена, марганца. Они способствуют выработке антител. Источником магния является капуста, цветная, брокколи, белокочанная, свекла, редис, картофель, гречиха, овес, орехи, бобовые. Цинка много в моркови, свекле, овсе, горохе, фасоли, в черной смородине. Селена много в травах: мать-и-мачехи, чистотеле, боярышнике, ромашке, душице, алоэ.
Марганец имеется в проращенной пшенице, в репчатом луке, чесноке, в мяте, в тысячелистнике, шалфее. Устраните стресс в вашей жизни, т.к. он пробивает очень сильно брешь в иммунной системе. Иммунная система очень тесно связана с нервной и эндокринной системами организма. Неполадок в одной из них ведет автоматически снижение защитных сил организма.
Затяжной стресс, длительная депрессия очень опасные состояния
. Например ОРЗ может начаться без видимых причин, просто от неприятностей на работе. Но могут быть и более серьезные заболевания. Поэтому при нервных срывах, стрессах, депрессиях – только физические движения, не дать гормонам стресса произвести разрушительные действия в организме.
Для длительной долгосрочной задачи оздоровления наметить постоянный комплекс физической нагрузки, чтобы это были и утренняя гигиеническая физическая зарядка, а может быть какая то гимнастика в течение дня, для ухода за позвоночником, для нагрузок на сердечно-сосудистую систему. Ходьба, бег также для сердечно-сосудистой системы, для пополнения организма кислородом, не менее 30-60 минут, лыжи и т.д. в зависимости от времени года.
Некоторые доктора не рекомендуют насильственное стимулирование иммунной системы иммуностимуляторами, иммуномодуляторами, т.к. по их мнению это может сорвать иммунную систему.
Например, не рекомендуется без разрешения лечащего врача применять алоэ, золотой ус. Надо приводить иммунитет в нормальное состояние естественными способами, правильное питание (стресс это недостаток магния), движение, разумный режим дня, высыпайтесь каждый день, ежедневная психологическая настройкф, ежедневные правильные водные процедуры, то есть закаливание. В сезонные переходные периоды времени побольше отдыхайте, знайте, биологические понижения тонуса вашего организма по месяцам года, и берегите себя в эти месяца.
Иммунограмма — это анализ крови, в котором исследуются компоненты иммунной системы. В нем учитывается количество клеток (лейкоцитов, макрофагов или фагоцитов), их процентное соотношение и функциональная активность, а также «вещества», которые эти клетки вырабатывают — иммуноглобулины (Ig) классов A, M, G, E, компоненты системы комплемента. Иногда в иммунограмме определяют «патологические антитела» — антинуклеарный фактор, ревматоидный фактор, антитела к фосфолипидам и другие.
Или так. Иммунограмма -это исследование основных показателей иммунной системы человека.
Обычно определяется основные параметры иммунной защиты человека: количество и функциональную способность(например фагоцитарные индексы) лейкоцитов, их процентное соотношение; клеточный иммунитет — общее количество Т-лимфоцитов и их популяции;
гуморальный иммунитет — уровень иммуноглобулинов (антител) классов А, М,G, Е и количество В лимофоцитов; определение показателей системы комплимента и интерферона.
Как проводится иммунограмма
Для исследования используется венозная кровь.Не рекомендована сдача анализа во время менструации, на фоне острых инфекционных заболеваний с высокой лихорадкой, после обильного приема пищи.
При подсчете лейкоцитов (нейтрофилов, эозинофилов, базофилов, моноцитов) используется обычная методика подсчета лейкоцитарной формулы.Для определения фагоцитарных индексов (способности лейкоцитов к фагоцитозу микроорганизмов) используют тест с нитросиним тетразолием (НСТ — тест)
Отдельно проводится исследование на количество и процентное содержание клеточного звена иммунитета — Т и В -лимфоцитов.Для их определения чаще всего применяется метод розеткообразования. В основе метода лежит свойство гомологичности между антигенами мембраны эритроцитов барана и рецепторами СD2 Т-лимфоцитов. При смешивании сыворотки крови с эритроцитами барана образуются специфические фигуры в виде розеток, которые подсчитываются при микроскопии.Для определения B лимфоцитов используется метод ЕАС — розеток в присутствии комплимента (особых белков крови).Помимо количественного определения Т и В лимфоцитов в большинстве случаев определяют и так называемыеколичество и процентное соотношение субпопуляции Т-лифоцитов (Т-хелперы, супрессоры, нулевых и.т.д.).Для их определения используют моноклональные антитела или теофиллиновый тест.Функционального состояние T-лимфоцитов определяют с помощью теста с фитогемагглютинином (ФГА-тест).
Определение иммуноглобулинов классов A,M,G наиболее часто проводят при помощи иммуноферментного анализа
Когда назначается иммунограмма
Перечень заболеваний и состояний, когда действительно должно назначатся иммунологическое исследование невелик.Прежде всего это так называемые иммунодефициты, при которых поражается одно или несколько звеньев иммунной системы.Различают:
Носят наследственный (врожденный) характер.Чаще всего встречаются нарушения, связанные с отсутствием или сниженной выроботкой антител — наследственная гипогаммаглобулинемия.
Возникают при тяжелых заболеваниях органов иммунной системы (заболевание селезенки, костного мозга, крови, вилочковой железы).Чаще всего это злокачественные заболевания — лимфомы, лейкозы и.т.д.Приобретенные иммунодефициты возникают вследствии применения некоторых лекарственных средств(например иммуносупрессоров), при радиационных поражениях (лучевая болезнь) и при вирусном поражении иммунной системы (ВИЧ -инфекция)
-тяжелые, часто рецидивирующие, гнойные заболевания внутренних органов, слизистых и кожи
-наличие упорного грибкового поражения полости рта (кандидоза) или других слизистых и кожи
-заболевания так называемыми оппортунистическими инфекциями, которые не вызывают болезни у здоровых людей (например пневмоцистная пневмония)
-некоторые заболевания кожи (например часторецидивирующий опоясывающий лишай, распространенный и осложненный контагиозных моллюск, сарком Капоши и.т.д.)
-Также иммунограмма назначается при наличии или подозрении на так называемые аутоиммунные заболевания — когда организм начинает вырабатывать антитела к собственным клеткам.Это заболевания крови (например гемолитические анемии, тромбоцитопеническая пурпура ), эндокринологические заболевания (некоторые формы сахарного диабета, аутоиммунный тиреодит), заболевания кожи (пузырчатка, красная волчанка)
Несомненным показанием для исследования иммунитета является и трансплантация (пересадка органов), особенно при пересадке костного мозга (реакция трансплантант против хозяина)
Назначается ли иммунограмма при половых инфекциях
В последнее время в России получило распространение назначение исследования системы иммунитета (так называемого иммуного статуса) больным половыми инфекциями.
Обоснованием их являются многочисленные диссертационные работы в России и публикации на основании их в российских медицинских изданиях.Несомненно система иммунитета играет определенную важную роль в инфицировании и протекании инфекции, однако многочисленные наблюдения и исследования показателей иммунограмм у больных половыми инфекциями, проводимые в крупных зарубежных медицинских центрах, либо не выявляли отклонений от нормы, либо отклонения были ничтожны.
В мировой медицине исследование иммунитета не назначается больным половыми инфекциями и не входит в перечень обязательных и дополнительных исследований.
Инфицироваться и заболеть половой инфекцией может любой, абсолютно здоровый человек, независимо от состояния его иммунитета, хотя у лиц с нарушением иммунитета (например у ВИЧ-инфицированных) риск инфицирования несомненно выше.
Показаниями к назначению иммунограммы являются признаки иммунодефицитов, перечисленные выше, а также выявленная у больных ВИЧ-инфекция.
Одним из видов иммунограммы может считаться определение специфических атител к антигенам возбудителей половых инфекций.Наиболее часто это исследование назначается для диагностики сифилиса, реже для диагностики герпесвирусных инфекций человека и хламидийной инфекции.
Какие показатели нормальной иммунограммы
Вариант нормальных показателей иммунограммы, применяемых в России.В зависимости от уровня лаборатории, применяемых методик и тест систем величины показателей могут быть другие.
Лейкоциты. Их назначение — распознавать чужеродные вещества и микроорганизмы и бороться с ними, а также запоминать информацию о них — на будущее.
Различают следующие виды лейкоцитов…
лимфоциты (Т-лимфоциты: Т-хелперы, Т-супрессоры; В-лимфоциты; нулевые лимфоциты)
нейтрофильные лейкоциты (палочкоядерные и сегментоядерные)
Макрофаги (фагоциты) «поедают» живых и мертвых микробов, комплексы антиген-антитело (образуются в процессе борьбы с вирусами, бактериями и их токсинами), погибшие клетки самого организма. Без макрофагов невозможна деятельность лимфоцитов: они «помогают» последним распознавать антигены, выделяют медиаторы (вещества, стимулирующие или угнетающие деятельность других клеток иммунной системы). Предшественники макрофагов, моноциты, самые крупные клетки, циркулирующие в крови.
В-лимфоциты — разновидность лимфоцитов, вырабатывающая антитела (иммуноглобулины). Свое название они получили от латинского слова «bursa» — сумка, по названию сумки Фабрициуса — органа, в котором дифференцируются (созревают) В-лимфоциты у птиц. У человека этот процесс происходит в костном мозге.
Т-лимфоциты — разновидность лимфоцитов, контролирующих работу В-лимфоцитов (то есть продукцию антител). Название они получили от слова «тимус» — органа, в котором созревают.
Т-хелперы — разновидность Т-лимфоцитов, способствующих (помогающих) синтезу антител (to help — англ. — «помогать»).
Т-супрессоры — разновидность Т-лимфоцитов, препятствующих (подавляющих) синтез антител (to supress — англ. — «подавлять, пресекать, сдерживать, запрещать»).
Натуральные киллеры — лимфоцитоподобные клетки, лишенные признаков Т- и В-лимфоцитов; способны уничтожать опухолевые клетки и клетки, инфицированные вирусами
«Часто в иммунограмме вижу клетки CD, их число. Что это за клетки?»
Кластеры дифференцировки (CD) — это антигены, находящиеся на поверхности клеток, своеобразные маркеры (метки), по которым одни клетки отличаются от других. То, какие метки находятся на поверхности клетки, зависит от ее вида (Т-лимфоцит, В-лимфоцит и т.д.) и ее зрелости (способности выполнять свои функции).
Метки нумеруются по очереди в соответствии с тем, когда они были открыты: чем раньше был открыт кластер, тем меньше у него номер.
Кластеры дифференцировки в лабораториях выявляются с помощью моноклональных антител.
Клон — это совокупность клеток, появившихся от одной общей клетки. Клетки клона идентичны на 100%, то есть они похожи друг на друга как однояйцевые близнецы. Одинаковые клетки синтезируют одинаковые антитела. Эти антитела называются моноклональными. Чаще всего их используют в диагностике и в иммунологических исследованиях.
Наиболее часто встречающиеся кластеры
CD2 — кластер Т-лимфоцитов, NK-клеток
CD4 — кластер Т-хелперов и моноцитов (это клетки, которые, созревая, превращаются в макрофаги)
CD16 — NK-клетки (натуральные киллеры)
Нейтрофилы, эозинофилы и базофилы — это разновидности лейкоцитов. Название свое они получили за способность по-разному воспринимать красящие вещества. Эозинофилы воспринимают в основном кислые красители (эозин, конго красный) и в мазках крови имеют розово-оранжевый цвет; базофилы — щелочные (гематоксилин, метиленовый синий), поэтому в мазках выглядят сине-фиолетовыми; нейтрофилы — и те и другие, поэтому окрашиваются серо-фиолетовым, нейтральным цветом.
Ядра зрелых нейтрофилов сегментированы — имеют перетяжки (поэтому их называют сегментоядерными), ядра незрелых клеток имеют вид изогнутых палочек, поэтому их называют палочкоядерными.
Одно из названий нейтрофилов — «микрофагоциты» указывает на их способность фагоцитировать микроорганизмы, но в меньших количествах, чем это делают макрофаги.
Эозинофилы принимают участие в уничтожении паразитов (выделяют специальные ферменты, оказывающие на них повреждающее действие), в аллергических реакциях (выделяют вещества, уничтожающие гистамин, предотвращающие выход ферментов из гранул тучных клеток).
При аллергических реакциях в крови находится много иммуноглобулина Е, он «связывается» с мембраной базофилов, способствуя их дегрануляции (то есть выходу из клеток гистамина). К чему это приводит, знают все аллергики!
IgM — этот вид антител появляется раньше всего при контакте с антигеном (микробом), повышение их титра (содержания) в крови свидетельствует об остром воспалительном процессе.
IgG — антитела этого класса появляются спустя какое-то время после контакта с антигеном. Они участвуют в борьбе с микробами — соединяются с антигенами на поверхности бактериальной клетки. Затем к ним присоединяются другие белки плазмы (так называемый комплемент), и бактериальная клетка лизируется (ее оболочка разрывается). Кроме того, IgG участвует в возникновении некоторых аллергических реакций.
IgA — препятствуют проникновению вирусов в организм через слизистые оболочки; хотя от бактерий антитела этого класса нас защитить не могут, с их токсинами они справляются.
IgE — антитела этого класса взаимодействуют с рецепторами, расположенными на тучных клетках и базофилах. В результате высвобождается гистамин и другие медиаторы аллергии. Развивается собственно аллергическая реакция.
источник