Расщепление в желудке (кислая среда).
Всасывание в тонком кишечнике.
 |  |
На нужды организма: CO2, Н2О, NH3 -выведение.
(аминокислоты выстраиваются в

(алиментарная дистрофия – необратимая)
Весь синтез белков состоит из двух процессов: транскрипции и трансляции.
1. Транскрипция – процесс считывания, синтез РНК, осуществляемый РНК полимеразой. Процесс идёт с одной цепи ДНК. Транскрипция производится одним или несколькими генами, отвечающих за синтез определённого белка. У прокариотов этот участок называется опероном.
2. В начале каждого оперона находится площадка для РНК полимеразы – промотр – специальная последовательность нуклеотидов РНК, которую фермент определяет благодаря химическому средству. Присоединяется к просмотру и начинается синтез иРНК. Дойдя до конца оперона фермент встречает сигнал (определённую последовательность нуклеотидов), который означает конец считывания.
1. Связывание РНК полимеразы с промотором.
2. Инициация – начало синтеза.
3. Элонгация – рост цепочки РНК. V=50 нуклеотидов/секунда.
4. Терминация – завершение синтеза.
Трансляция – происходит в ядре на рибосомах.
1. Аминокислоты доставляют тРНК к рибосомам. Кодоны шифруют аминокислоты. На вершине тРНК имеется последовательность трёх нуклеотидов, компланарных нуклеотидам кодона в иРНК, — антикодон. Фермент определяет антикодон и присоединяет тРНК аминокислоту.
2. На рибосоме тРНК переводит с «языка» нуклеотидов на «язык» аминокислот. Далее аминокислоты отрываются от тРНК.
3. Фермент синтеза присоединяет аминокислоту к полипептидной цепи.
Синтез завершён и готовая цепь отходит от рибосом.
Белки – это высокомолекулярные соединения, молекулы которых представлены двадцатью альфа – аминокислотами, соединёнными пептидными связями – СО — NН —
Мономерами белков являются аминокислоты.
Кислотные свойства аминокислот определятся карбоксильной группой (-СООН), щелочные – аминогруппой (-NH2). Каждая из 20 аминокислот имеет одинаковую часть, включающую обе эти группы (-CHNH2 – COOH), и отличается от любой другой особой химической группировкой R – группой, или радикалом.
· Простые белки – состоящие из одних аминокислот. Например, растительные белки – проламины, белки кровяной плазмы – альбулины и глобулины.
· Сложные белки – помимо аминокислот имеют в своём составе другие органические соединения (нуклеиновые кислоты, липиды, углеводы), соединения фосфора, металлы. Имеют сложные названия нуклеопротеиды, шикопротеиды и т. д.
Простейшая аминокислота – глицерин NH2 – CH2 – COOH.
Но разные аминокислоты могут содержать различные радикалы CH3 – CHNH2 – COOH

Образование линейных молекул белков происходит в результате соединения аминокислот друг с другом. Карбоксильная группа одной аминокислоты сближается с аминогруппой другой, и при отщеплении молекулы воды между аминокислотными остатками возникает прочная ковалентная связь, называемая пептидной.
· Первичная – определяется последовательностью аминокислот. Из трёх аминокислот – 27 комбинаций, тогда из 20 аминокислот – 10 1300 длиной каждая не менее 100 остатков, следовательно, продолжается эволюционный процесс.
· Вторичная – спираль, полая внутри, которая удерживается водородными связями, при этом радикалы направлены наружу.
· 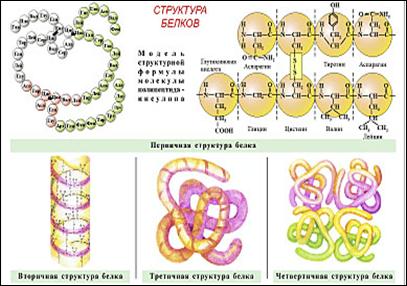
· Четвертичная структура – некоторые белки, например гемоглобин и инсулин, состоят из нескольких цепей, различающихся по первичной структуре.
В человеческом организме около 100000 белков, молекулярная масса которых от нескольких тысяч до нескольких миллионов.


В 1902 г. Э. Фишер предложил пептидную теорию строения белка.
В 1951 г. Л. Полинг разработал модель вторичной структуры белка.

У белков очень сложное строение и на данном этапе развития науки очень сложно выявить структуру молекул белков.
Первый белок, у которого была расшифрована первичная структура, был инсулин. Это случилось в 1954 году. Для этого понадобилось около 10 лет. Синтез белков — очень сложная задача, и если ее решить, то возрастет количество ресурсов для дальнейшего использования их в технике, медицине и т.д., а также уже возможен биохимический и синтетический способы получения пищи.
А.Н. Несмеянов провел широкие исследования в области создания микробиологической промышленности по производству искусственных продуктов питания. Практическое осуществление путей получения такой пищи ведется в двух основных направлениях. Одно из них основано на использовании белков растений, например сои, а второе — на использовании белков продуктов, полученных микробиологическим путем из нефти.
В природе широко представлена автоматическая самосборка надмолекулярных структур и инициатором ее являются белковые молекулы. Это дает надежду выяснить закономерности формообразования у растений и животных и понять молекулярные механизмы, обеспечивающие сходство родителей и детей.
Чем глубже химики познают природу и строение белковых молекул, тем более они убеждаются в исключительном значении получаемых данных для раскрытия тайны жизни. Раскрытие связи между структурой и функцией в белковых веществах — вот краеугольный камень, на котором покоится проникновение в самую глубокую сущность жизненных процессов, вот та основа, которая послужит в будущем исходным рубежом для нового качественного скачка в развитии биологии и медицины.
Белки входят в состав живых организмов и являются основными материальными агентами, управляющими всеми химическими реакциями, протекающими в организме.
Одной из важнейших функций белков является их способность выступать в качестве специфических катализаторов (ферментов), обладающих исключительно высокой каталитической активностью. Без участия ферментов не проходит почти ни одна химическая реакция в живом организме.
Вторая важнейшая функция белков состоит в том, что они определяют механо — химические процессы в живых организмах, в результате которых поступающая с пищей химическая энергия непосредственно превращается в необходимую для движения организма механическую энергию.
Третьей важной функцией белков является их использование в качестве материала для построения важных составных частей организма, обладающих достаточной механической прочностью, начиная с полупроницаемых перегородок внутри клеток, оболочек клеток и их ядер и заканчивая тканями мышц и различных органов, кожи, ногтей, волос и т.д.
Белки являются необходимой составной частью продуктов питания. Отсутствие или недостаточное количество их в пище вызывает серьезные заболевания.
Важную роль в жизнедеятельности играют комплексы белков с нуклеиновыми кислотами — нуклеопротеиды. Из нуклеопротеидов состоят, в частности, хромосомы, важнейшие составные части ядра клетки, ответственные за хранение наследственной информации, а также рибосомы — мельчайшие частицы протоплазмы, в которых происходит синтез белковых молекул.
источник
Белок – неотъемлемая составляющая нашего организма, нарушение которой может вызвать его разрушение. Исторический анализ открытия и исследований белков. Свойства белка, выделение. Биосинтез и химический синтез белка — практическое применение и значение.
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
2. Свойства белка, выделение
4. Значение белков в питании
Список использованной литературы
Белки — высокомолекулярные природные полимеры, построенные из остатков аминокислот, соединенных амидной (пептидной) связью — СО-NH-. Каждый белок характеризуется специфической аминокислотной последовательностью и индивидуальной пространственной структурой (конформацией). На долю белка приходится не менее 50% сухой массы органических соединений животной клетки. Функционирование белка лежит в основе важнейших процессов жизнедеятельности организма. Обмен веществ (пищеварение, дыхание и др.), мышечное сокращение, нервная проводимость и жизнь клетки в целом неразрывно связаны с активностью ферментов — высокоспецифических катализаторов биохимических реакций, являющихся белками. Основу костной и соединительной тканей, шерсти, роговых образований составляют структурные белки. Они же формируют остов клеточных органелл (митохондрий, мембран и др.). Расхождение хромосом при делении клетки, движение жгутиков, работа мышц животных и человека осуществляются по единому механизму при посредстве белков сократительной системы. Важную группу составляют регуляторные белки, контролирующие биосинтез белка, и нуклеиновых кислот. К регуляторным белкам относятся также пептидно-белковые гормоны, которые секретируются эндокринными железами. Информация о состоянии внешней среды, различные регуляторные сигналы (в т.ч. гормональные) воспринимаются клеткой с помощью специальных рецепторных белков, располагающихся на наружной поверхности плазматической мембраны. Эти белки играют важную роль в передаче нервного возбуждения и в ориентированном движении клетки (хемотаксисе). В активном транспорте ионов, липидов, сахаров и аминокислот через биологические мембраны участвуют транспортные белки, или белки-переносчики. К последним относятся также гемоглобин и миоглобин, осуществляющие перенос кислорода. Преобразование и утилизация энергии, поступающей в организм с питанием, а также энергии солнечного излучения происходят при участии белков биоэнергетической системы (например, родоксин, цитохромы). Большое значение имеют пищевые и запасные белки, играющие важную роль в развитии и функционировании организмов. Защитные системы высших организмов формируются защитными белками, к которым относятся иммуноглобулины (ответственны за иммунитет), белки комплемента (ответственны за лизис чужеродных клеток и активацию иммунологической функции), белки системы свертывания крови и противовирусный белок интерферон.
По составу белки делятся на простые, состоящие только из аминокислотных остатков, и сложные. Сложные могут включать ионы металла (металлопротеиды) или пигмент (хромопротеиды), образовывать прочные комплексы с липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеиды), а также ковалентно связывать остаток фосфорной кислоты (фосфопротеиды), углевода (гликопротеины) или нуклеиновой кислоты (геномы некоторых вирусов). В соответствии с формой молекул белки подразделяют на глобулярные и фибриллярные. Молекулы первых свернуты в компактные глобулы сферической или эллипсоидной формы, молекулы вторых образуют длинные волокна (фибриллы) и высокоасимметричны. Большинство глобулярных белков, в отличие от фибриллярных, растворимы в воде. Особую группу составляют мембранные (амфипатические) белки, характеризующиеся неравномерным распределением гидрофильных и гидрофобных (липофильных) участков в молекуле: погруженная в биологическую мембрану часть глобулы состоит преимущественно из липофильных аминокислотных остатков, а выступающая из мембраны — из гидрофильных.
Первые работы по выделению и изучению белковых препаратов были выполнены еще в 18 в., однако в тот период исследования белков носили описательный характер. В начале 19 в. были сделаны первые анализы элементного состава белков (Ж.Л. Гей-Люссак, Л. Ж. Тенар, 1810) положившие начало систематическим аналитическим исследованиям, в результате которых было установлено, что все белковые вещества близки не только по внешним признакам и свойствам, но и по элементарному составу. Важное следствие этих работ — создание первой теории строения белковых веществ, согласно которой все белки содержат общий гипотетический радикал — «протеин», имеющий эмпирическую формулу C40H62N10O12 и связанный в различных пропорциях с атомами серы и фосфора. Получив сначала всеобщее признание, эта теория привлекла интерес к аналитическим исследованиям белков, совершенствованию препаративных методов белковой химии. В этот период были разработаны простейшие приемы выделения белков путем экстракции растворами нейтральных солей и осаждения, получены первые кристаллические белки (гемоглобин, некоторые растительные белки), для анализа белков стали использовать кислотный и щелочной гидролиз.
Создание теории протеина совпало по времени с формированием представлений о функции белков в организме. В 1835 г. И.Я. Берцелиус высказал идею о важнейшей функции белка — биокаталитической. Вскоре были открыты первые протеолитические ферменты — пепсин (Т. Шванн, 1836) и трипсин (Л. Корвизар, 1856). Открытие протеаз стимулировало интерес биохимиков к физиологии пищеварения, а следовательно, и к продуктам переваривания белков. К середине 19 в. было показано, что под действием протеолитических ферментов белки распадаются на близкие по свойствам фрагменты, получившие название пептоинов (К. Леман, 1850).
Важное событие в изучении белков — выделение из белкового гидролиза аминокислоты глицина (А. Браконно, 1820). К концу 19 в. было изучено большинство аминокислот, входящих в состав белка, синтезирован аланин (А. Штреккер, 1850). В 1894 г. А. Коссель высказал идею о том, что основными структурными элементами белков являются аминокислоты.
В начале 20 в. значительный вклад в изучение белка внес Э. Фишером, впервые применившим для этого методы органической химии. Путем встречного синтеза Э. Фишер доказал, что белки построены из остатков — аминокислот, связанных амидной (пептидной) связью. Он также выполнил первые аминокислотные анализы белка, дал правильное объяснение протеолизу.
В 20-40-е гг. получили развитие физико-химические методы анализа белков. Седиментационными и диффузионными методами были определены молекулярные массы многих белков, получены данные о сферической форме молекул глобулярных белков, выполнены первые рентгеноструктурные анализы аминокислот и пептидов, разработаны хроматографические методы анализа. Существенно расширились представления о функциональной роли белка.
В начале 50-х гг. была выдвинута идея о трех уровнях организации белковых молекул (К.У. Линдерстрём-Ланг, 1952) — первичной, вторичной и третичной структурах. Определены первичные структуры инсулина (Ф. Сенгер, 1953) и рибонуклеазы (К. Анфинсен, С. Мур, К. Херс, У. Стайн, 1960). По данным рентгеноструктурного анализа были построены трехмерные модели миоглобина (Дж. Кендрю, 1958) и гемоглобина (М. Перуц, 1958) и, таким образом, доказано существование в белках сторичной и третичной структур, в т.ч. -спирали, предсказанной Л. Полингом и Р. Кори в 1949-51.
В 60-е гг. в химии белков развивалось синтетическое направление: были синтезированы инсулин и рибонуклеаза. Дальнейшее развитие получили аналитические методы: стал широко использоваться автоматический аминокислотный анализатор, созданный С. Муром и У. Стайном в 1958, существенно модифицированы хроматографические методы, до высокой степени совершенства доведен рентгеноструктурный анализ, сконструирован автоматический прибор для определения последовательности аминокислотных остатков в белке — секвенатор. Благодаря созданию прочной методологической базы стало возможным проводить широкие исследования аминокислотной последовательности белка. В эти годы была определена структура несколько сотен сравнительно небольших белков (до 300 аминокислотных остатков в одной цепи), полученных из самых различных источников как животного, так и растительного, бактериального, вирусного и другого происхождения. Среди них — протеолитические ферменты (трипсин, химотрипсин, субтилизин, карбоксипептидазы), миоглобины, геомоглобины, цитохромы, лизоцимы, иммуноглобулины, гистоны, нейротоксины, белкоавых оболочек вирусов, белково-пептидные гормоны и др. В результате были созданы предпосылки для решения актуальных проблем энзимологии, иммунологии, эндокринологии и др. областей физико-химической биологии.
В 70-80-е гг. наибольший прогресс был достигнут при изучении белков-регуляторов матричного синтеза биополимеров (в т.ч. белков рибосом), сократительных, транспортных и защитных белков, ряда мембранных белков (в т.ч. белков биоэнергетических систем), рецепторных белков. Большое внимание уделялось дальнейшему совершенствованию методов анализа белка. Значительно повышена чувствительность автоматического анализа аминокислотной последовательности б. Широкое применение нашли новые методы разделения белков и пептидов (жидкостная хроматография высокого давления, биоспецифическая хроматография). В связи с разработкой эффективных методов анализа нуклеотидной последовательности ДНК (А. Максам и У. Гилберт, Ф. Сингер) стало возможным использовать полученную при таком анализе информацию и при определении первичной структуры белков. В результате установлена структура ряда белков, доступных в ничтожно малых количествах (интерферон, ацетилхолиновый рецептор), а также белков, большой молекулярной массы. Успехи структурного анализа позволили вплотную приступить к определению пространственной организации и молекулярных механизмов функционирования надмолекулярных комплексов, в т.ч. рибосом, хроматина (нуклеосом), митохондрий, фагов и вирусов. Существенные результаты получены в эти годы советскими учеными: определена первичная структура аспартатаминотрансферазы (1972), бактериородопсина (1978), животного родопсина (1982), некоторых рибосомальных белков, фактора элонгации G (1982), важнейшего фермента — РНК-полимеразы (1976-82), нейротоксинов и др.
2. Свойства белка, выделение
Свойства. Физическо-химические свойства белков определяются их высокомолекулярной природой, компактность укладки полипептидных цепей и взаимным расположением остатков аминокислот. Молекулярная масса варьируется от 5 до 1 млн., а константы седиментации — от 1 до 20 (и выше). Средний удельный объем белковых молекул -0,70-0,75 см 3 /г, а константы диффузии — 10 6 -10 8 см 2 /с. Максимум поглощения белков, в УФ-области спектра, обусловленный наличием ароматических аминокислот, находится вблизи 280 нм. Возбуждение электронов атома азота пептидной группы вызывает резкое увеличение поглощения при 185-240 нм. В ИК-области спектра белки поглощают за счет СО- и NH-групп при 1600 и 3100-3300 см -1 .
В растворах белки амфотерны. Изоэлектрические точки белка могут иметь значения от -3 мкг/мл примесного антигена).
Биосинтез белка происходит в результате трансляции в субклеточных частицах — рибосомах, представляющих собой сложный рибонуклеиновый комплекс. Информация о первичной структуре белка «хранится» в соответствующих генах — участках ДНК — в виде последовательности нуклеотидов. В процесс транскрипции эта информация с помощью фермента — ДНК — зависимой РНК — полимеразы — передается на матричную рибонуклеиновую кислоту, которая, соединяясь с рибосомой, служит матрицей для синтеза белка. Выходящие из рибосомы синтезированные полипептидные цепи, самопроизвольно сворачиваясь, принимают присущую данному белку конформацию, а также подвергаются модификации благодаря реакциям различных функциональных групп аминокислотных остатков и расщеплению пептидных связей.
Химический синтез широко применяют для получения пептидов, в т.ч. биологически активных гормонов и их разнообразных аналогов, используемых для изучения взаимосвязи структуры и биологической функции, а также пептидов, несущих антигенные детерминанты различных белков и применяемых для приготовления соответствующих вакцин. Первые химические синтезы белка в 60-е гг. (инсулина овцы и рибонуклеазы S), осуществленные в растворе с помощью тех же методов, которые используют при синтезе пептидов, были связаны с чрезвычайно большими сложностями. В каждом случае требовалось провести сотни химических реакций и окончательный выход белка был очень низок (менее 0,1%), в результате чего полученные препараты не удалось очистить. Позже были синтезированы некоторые химически чистые белки, в частности инсулин человека (П. Зибер и др.) и нейротоксин II из ядра среднеазиатской кобры (В.Т. Иванов). Однако до сих пор химический синтез белка представляет весьма сложную проблему и имеет скорее теоретическое, чем практическое значение. Более перспективны методы генетической инженерии, которые позволяют наладить промышленное получение практически важных белков и пептидов.
4. Значение белков в питании
Белок — необходимая составная часть продуктов питания. Проблема пищевого белка стоит очень остро. По данным Международной организации по продовольствию и сельскому хозяйству при ООН больше половины человечества не получает с пищей необходимого количества белка. Недостаток белка в пище вызывает тяжелое заболевание — квашиоркор.
В процессе пищеварения белки подвергаются гидролизу до аминокислот, которые и всасываются в кровь. Пищевая ценность белка зависит от их аминокислотного состава, содержания в них так называемых незаменимых аминокислот, не синтезирующихся в организмах (для человека незаменимы триптофан, лейцин, изолейцин, валин, треонин, лизин, метионин и фенилаланин). В питательном отношении растительные белки менее ценны, чем животные; они беднее лизином, метионином и триптофаном, труднее перевариваются. Один из путей решения проблемы — добавление в растительную пищу синтетических аминокислот. Наряду с этим выводят новые сорта растений, содержащие гены, ответственные за синтез недостающих аминокислот. Перспективно использование для этого методов генетической инженерии. Чрезвычайно важное значение имеет широкое внедрение промышленного микробиологического синтеза, например, выращивание дрожжей на гидролизном этиловом спирте, природном газе или нефти. Получаемые при этом белково-витаминные концентраты (БВК) используют в качестве добавок к корму сельскохозяйственных животных. Исследования советских микробиологов и технологов (Г.К. Скрябин и др.) послужили основой для производства БВК в СССР в крупных масштабах.
Белок — неотъемлемая составляющая нашего организма, нарушение которой может вызвать его разрушение. Необходимость постоянного получения белковой пищи человеком вызвано наличием у белка определенных функций, которые необходимы живому организму для его развития, размножения и осуществления жизнедеятельности.
На долю белка приходится не менее 50% сухой массы органических соединений животной клетки. Функционирование белка лежит в основе важнейших процессов жизнедеятельности организма. Обмен веществ (пищеварение, дыхание и др.), мышечное сокращение, нервная проводимость и жизнь клетки в целом неразрывно связаны с активностью ферментов — высокоспецифических катализаторов биохимических реакций, являющихся белками. Основу костной и соединительной тканей, шерсти, роговых образований составляют структурные белки. Они же формируют остов клеточных органелл (митохондрий, мембран и др.). Расхождение хромосом при делении клетки, движение жгутиков, работа мышц животных и человека осуществляются по единому механизму при посредстве белков сократительной системы. Важную группу составляют регуляторные белки, контролирующие биосинтез белка, и нуклеиновых кислот.
Большинство глобулярных белков, в отличие от фибриллярных, растворимы в воде. Особую группу составляют мембранные (амфипатические) белки, характеризующиеся неравномерным распределением гидрофильных и гидрофобных (липофильных) участков в молекуле: погруженная в биологическую мембрану часть глобулы состоит преимущественно из липофильных аминокислотных остатков, а выступающая из мембраны — из гидрофильных.
Биохимический синтез белка в промышленных целях необходимо важен для человечества, это позволяет создавать искусственные препараты, продукты питания и средства индивидуальной защиты.
источник
Министерство здравоохранения Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
«Пермский государственный медицинский университет имени академика Е.А. Вагнера»
«Физико-химические свойства белков и их определение»
· Химические свойства белков
· Химический синтез и анализ белков
· Определение первичной структуры белков
· Определение вторичной структуры белков
· Определение третичной и четвертичной структур белков
· Выделение и очистка белков
· Белки в промышленности и медицине
· Список использованной литературы
Белки представляют собой высокомолекулярные органические соединения, построенные из остатков α-аминокислот, соединенных между собой пептидными связями.
Белки играют наиважнейшую роль в процессах жизнедеятельности. Ни один из известных живых организмов не обходится без них. Белки служат питательными веществами, они регулируют обмен веществ, исполняя роль ферментов — катализаторов обмена веществ, способствуют переносу кислорода по всему организму и его поглощению, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения, участвуют в передаче генетической информации и т.д. Известно, что аминокислоты, соединяясь друг с другом посредством пептидных связей, образуют полипептиды. Белками являются полипептиды, способные образовывать и самостоятельно стабилизировать свою пространственную структуру. Как правило, белками называют полипептиды, которые содержат более 50 аминокислотных остатков.
Различают химические, физические и биологические свойства белков.
Химические свойства отличаются исключительным разнообразием. Некоторые из радикалов аминокислот содержат свободные минные (лизин, аргинин) и карбоксильные (аспарагиновая и глутаминовая кислоты) группы. Взаимодействуя с окружающими молекулами растворителя (воды), ионогенные группы ионизируются, образуя катионные и анионные центры молекулы белка.
Целью данной семестровой работы является изучение химических и физических свойств белков. Поставленная цель решается посредством следующих задач:
рассмотрение основных физических свойств белков;
изучение характеристики их химических свойств.
Физические свойства
Особо следует отметить подвижность белковых молекул в электрическом поле, их оптическую активность, способность рассеивать свет (ввиду значительных размеров белковых частиц) и поглощать ультрафиолетовое излучение. Перечисленныеоптические свойства белков используют при их фракционировании, количественном определении, измерении молекулярной массы и т.п.
Одним из характерных физических свойств белков является их способность адсорбировать на своей поверхности (а иногда и захватывать внутрь молекулы) низкомолекулярные органические соединения и ионы. С этим свойством белков связана их транспортная функция в организме: некоторые белки являются хорошими переносчиками продуктов обмена и токсических веществ [1].
Биологические свойства
В первую очередь следует отметить биокаталитическую (ферментативную) активность белков. Благодаря особому строению молекулы или наличию активных групп многие белки обладают способностью каталитически ускорять ход химических реакций. Это свойство белков играет важную роль в осуществлении процессов жизнедеятельности.
Другое важное биологическое свойство белков — их гормональная активность, т.е. способность воздействовать на целые группы химических реакций в организме. Некоторым белкам присущи также токсические свойства, патогенная активность, защитные функции в организме и т.п.
Важной является пластическая роль белков: в сочетании с другими макромолекулами они дают начало смешанным сополимерам — нуклеопротеинам, липопротеинам и гликопротеинам, которые в свою очередь обеспечивают возникновение субклеточных структур и надклеточных образований в организме.
Особым свойством белков является их способность к денатурации. Белки, обладающие всеми характерными природными свойствами, называют нативными. Часто под влиянием мягкой обработки (например, легкого встряхивания) или при резких физических или химических воздействиях (тепловой шок, стресс, отравление тяжелыми металлами) белки теряют нативность и переходят в денатурированное состояние.
Изменение уникальной структуры нативного белка, сопровождающееся обратимой или необратимой потерей характерных для него свойств (растворимости, биологической активности, электрофоретической подвижности и т.п.) называют денатурацией. При обратимой денатурации, как правило, нарушаются четвертичная, третичная и частично вторичная структура белковой молекулы, но не происходит каких — либо изменений первичной структуры. В случае обратимой денатурации (в отличие от необратимой) при определенных условиях денатурированный белок можно частично или полностью вернуть к нативному состоянию, такой белок называют ренатурированным, а процесс — ренатурацией.
При необратимой денатурации белка (при кипячении, под действием ионов тяжелых металлов и других агентов) происходит глубокое нарушение структуры белка, в результате чего ренатурация его невозможна [2].
Химические свойства белков
Они отличаются исключительным разнообразием. Обладая аминокислотными радикалами различной химической природы, белковые тела способны вступать в разнообразные реакции. Некоторые из радикалов аминокислот содержат свободные аминные (лизин, аргинин) и карбоксильные (аспарагиновая и глутаминовая кислоты) группы. Взаимодействуя с окружающимимолекулами растворителя (воды), ионогенные группы ионизируются, образуя катионные и анионные центры молекулы белка.
В зависимости от соотношения противоположно заряженных ионов белковая молекула получает суммарный положительный или отрицательный заряд. Для характеристики кислотно-основных свойств молекул белков и аминокислот используется такой показатель, как изоэлектрическая точка.
Изоэлектрическая точка белка (рI) — это значение рН среды, при котором молекула белка электронейтральна и не перемещается в электрическом поле.
Белки, как и аминокислоты, являясь амфотерными электролитами, могут диссоциировать как кислоты и как основания. Условно молекулу белка в растворе с равным числом ионизированных аминных и карбоксильных групп (вблизи изоэлектрической точки) можно представить следующим образом:
В кислой среде (рН 7) подавляется диссоциация белка по аминогруппам, и молекула заряжается отрицательно:
Изоэлектрическая точка кислых белков (с повышенным содержанием дикарбоновых кислот) лежит в слабокислой области, изоэлектрическая точка основных белков (с повышенным содержанием диаминокислот) — в слабощелочной области.
В водном растворе белков их молекулы заряжены и гидратированы, что обусловливает устойчивость белковых растворов. Однако при высокой концентрации солей, ионы которых тоже гидратированы, происходит разрушение водных оболочек белковых молекул и нейтрализация их заряда адсорбирующимися противоионами соли. Белковые частицы слипаются и выпадают в осадок. Таков механизм высаливания белков, который используют для выделения отдельных белков из смеси [3].
Химический синтез и анализ белков
Синтез.Осуществление белкового синтеза химическим путем привлекало внимание многих исследователей. Метод твердофазного синтеза, разработанный Б. Меррифилдом, дал возможность получать достаточно большие полипептиды. Таким же способом был получен гормон инсулин, а его уже можно отнести к классу белков. В случае инсулина более трудной задачей было соединение двух полипептидных цепей в активную макромолекулу. К. Диксон и А. Уардлоу справились с этой задачей и положили основу химического синтеза белков. Однако несмотря на разработку автоматических синтезаторов, метод химического синтеза белков не получил широкого распространения из-за наличия большого числа технических ограничений. В природе небольшие полипептиды синтезируются с помощью соответствующих ферментов, основная же масса белков образуется посредством матричного синтеза.
Анализ. Методы анализа белковых макромолекул селективны и осуществляются в зависимости от того, какая структура является объектом исследования, и начинаются с определения аминокислотного состава. Для этого необходимо провести полный гидролиз пептидных связей и получить смесь, состоящую из отдельных аминокислот. Гидролиз проводят при помощи 6М соляной кислоты при кипячении в течение 24 ч. Так как для гидролиза пептидных связей изолейцина и валина этого может быть недостаточно, проводят контрольный 48 — и 72 — часовой гидролиз. Некоторые аминокислоты, например триптофан, при кислотном гидролизе разрушаются, поэтому для их идентификации используют гидролиз при помощи метансульфоновой кислоты в присутствии триптамина.
Для определения цистеина белок окисляют надмуравьиной кислотой, при этом цистеин превращается в цистеиновую кислоту, которую затем анализируют. Выделение и идентификацию аминокислот проводят при помощи аминокислотных анализаторов, принцип действия которых основан на хроматографическом разделении белкового гидролизата на сульфополистирольных катионитах.
В основе количественного определения той или иной аминокислоты лежит цветная реакция с нингидрином, однако более перспективным следует считать метод, при котором аминокислоты модифицируют в производные, поглощающие свет в видимом диапазоне. Разделение смеси аминокислот проводят при помощи высокоэффективной жидкостной хроматографии, а само определение — спектрофотометрически.
Следующим этапом является определение концевых аминных и карбоксильных группировок в белковой макромолекуле. Это необходимо для того, чтобы знать, какой белок подвергается анализу — протомер или олигомер. Олигомерные белки предварительно обрабатывают надмуравьиной кислотой для разделения на отдельные полипептидные цепи. N-Концевую аминокислоту определяют при помощи динитрофторбензола, который реагирует с α-аминогруппой белка, образуя окрашенное в желтый цвет производное. Что касается С-концевых аминокислот, то их определение связано с применением ферментативного метода. В качестве фермента чаще всего используют карбоксипептидазу А, которая последовательно отщепляет от карбоксильного конца отдельные аминокислоты. Суть метода заключается в количественном определении накопления свободных аминокислот во времени[4].
Дата добавления: 2018-04-15 ; просмотров: 88 ; ЗАКАЗАТЬ РАБОТУ
источник
Белки – это молекулы жизни. Каждый живой организм содержит большое количество различных белковых молекул, при этом каждому виду присущи особые, свойственные только ему белки. Даже белки, выполняющие у различных видов одну и ту же функцию, отличаются друг от друга. Например, у всех позвоночных животных – рыб, птиц, млекопитающих – красные клетки крови содержат белок гемоглобин, переносящий кислород. Но гемоглобин у каждого вида животных свой, особенный. Молекула гемоглобина лошади отличается от соответствующего белка человека в 26 местах, свиньи – в 10 местах, а гориллы – всего лишь одной аминокислотой.
Функции белков в организме очень разнообразны. Есть белки – переносчики веществ (молекул, ионов) и электронов; есть биокатализаторы, ускоряющие реакции в миллиарды раз и отличающиеся удивительной специфичностью, есть регуляторы различных биологических процессов в организме – гормоны, например, инсулин, вазопрессин, окситоцин. Белки защищают организм от инфекции, они способны узнавать и уничтожать чужеродные объекты: вирусы, бактерии, клетки. Контакты клетки с внешней средой также выполняют разнообразные белки, умеющие различать форму молекул, регистрировать изменение температуры, ничтожные примеси веществ, отличать один цвет от другого.
Свойства белков весьма разнообразны и определяются их строением.
1. По растворимости в воде белки делятся на два класса:
глобулярные белки – растворяются в воде или образуют коллоидные растворы; фибриллярные белки – в воде нерастворимы.
2. Денатурация. При нагревании, изменении кислотности среды происходит разрушение вторичной и третичной структуры белка с сохранением первичной. Это явление называют денатурацией.
Пример денатурации – свертывание яичных белков при варке яиц. Денатурация бывает обратимой (при употреблении алкоголя, солёной пищи) и необратимой. Необратимая денатурация может быть вызвана высокими температурами, радиацией, при отравлении организма солями тяжелых металлов, спиртами, кислотами.
3. Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот. Анализируя продукты гидролиза, можно установить количественный состав белков.
4. Для белков известно несколько качественных реакций.
1. Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе. Эта реакция называется биуретовой.
2. Белки, содержащие остатки ароматических аминокислот (фенилаланин, тирозин) дают желтое окрашивание при действии концентрированной азотной кислоты – ксантопротеиновая реакция.
5. Амфотерные свойства белков
Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма.
Превращение белков в организме
Животные организмы строят свои белки из аминокислот тех белков, которые они получают с пищей. Поэтому наряду с жирами и углеводами белки – обязательный компонент нашей пищи.
Животные и растительные белки в пищеварительном тракте человека расщепляются на аминокислоты. В процессе переваривания пищи происходит гидролиз белков под влиянием ферментов. В желудке они расщепляются на более или менее крупные «осколки» – пептиды, которые далее в кишечнике гидролизуются до аминокислот. Последние всасываются ворсинками кишечника в кровь и поступают во все ткани и клетки организма. Здесь из аминокислот под действием ферментов синтезируются белки, свойственные тканям человеческого тела. Для синтезирования белков необходимо наличие определенных аминокислот. Но в одних белках, поступающих с пищей, имеются все необходимые человеку аминокислоты, а в других не все. Организм человека может сам синтезировать некоторые аминокислоты или заменять их другими. Но 10 аминокислот он образовать не в состоянии. Их должен непременно получать с пищей. Эти кислоты называются незаменимыми (см. Приложения).
Белки, содержащие все необходимые аминокислоты, называют полноценными. Остальные белки — неполноценные. Полноценными являются белки молока, сыра, мяса, рыбы, яиц, бобовых. Синтезом белков в клетках управляет ДНК. Он осуществляется на поверхности рибосом с помощью РНК. В организме человека белки почти не откладываются в запас. Излишки аминокислот в клетках печени превращаются в углеводы — глюкозу и гликоген или в резервный жир. Поэтому артистам балета слишком больших количеств белков в пище нужно избегать. Но и намеренное голодание, когда вследствие больших энерготрат организм, израсходовав запасы углеводов и жира, начинает тратить резервы белка, очень вредно. Это тратятся белки цитоплазмы клеток.
Судьба аминокислот в организме различна
1. Основная их масса расходуется на синтез белков, которые идут на увеличение белковой массы организма при его росте и на обновление белков, распадающихся в процессе жизнедеятельности.
2. Синтез белков идет с поглощением энергии.
3. Аминокислоты используются в организме и для синтеза небелковых азотсодержащих соединений, например нуклеиновых кислот.
4. Часть аминокислот подвергается постепенному распаду и окислению.
Успехи в изучении и синтезе белков
Основные сведения о составе и строении белков были получены при изучении их гидролиза (гидролиз белков – необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот). Установлено, что в результате гидролиза любого белка получается смесь α-аминокислот, причем наиболее часто встречаются в составе белков 20 α-аминокислот.
Как же аминокислоты образуют белковую молекулу? Еще в 80-х годах прошлого века русский ученый-биохимик А.Я. Данилевский на основании своих опытов впервые высказал гипотезу о пептидной связи между остатками аминокислот в белковой молекуле. В 1899 году исследованиями белков занялись немецкие химики-органики Эмиль Фишер и Франц Гофмейстер. Они высказали предположение, что в белках аминокислоты связаны за счет аминогруппы одной кислоты и карбоксила другой. При образовании такой связи выделяется молекула воды. Эта гипотеза была блестяще подтверждена экспериментально в 1907 году и получила название “полипептидной теории”.
Фишеру удалось синтетически получить полипептиды, в молекулы которых входили различные аминокислотные остатки, соединенные пептидными связями.
Химический синтез широко применяют для получения пептидов, в т.ч. биологически активных гормонов и их разнообразных аналогов, используемых для изучения взаимосвязи структуры и биологической функции, а также пептидов, несущих антигенные детерминанты различных белков и применяемых для приготовления соответствующих вакцин. Первые химические синтезы белка в 60-е гг. (инсулина овцы и рибонуклеазы S), осуществленные в растворе с помощью тех же методов, которые используют при синтезе пептидов, были связаны с чрезвычайно большими сложностями. В каждом случае требовалось провести сотни химических реакций и окончательный выход белка был очень низок (менее 0,1%), в результате чего полученные препараты не удалось очистить. Позже были синтезированы некоторые химически чистые белки, в частности инсулин человека (П. Зибер и др.) и нейротоксин II из ядра среднеазиатской кобры (В.Т. Иванов). Однако до сих пор химический синтез белка представляет весьма сложную проблему и имеет скорее теоретическое, чем практическое значение. Более перспективны методы генетической инженерии, которые позволяют наладить промышленное получение практически важных белков и пептидов.
Упрощенный синтез полипептидов можно представить так:
Вспомните: связь между остатками аминокислот, а именно: между группами С = О одной кислоты и N-H другой кислоты – называется пептидной (амидной), группа атомов –СО─NH ─ называется пептидной (амидной) группой.
Пептидная или белковая цепь представляет собой продукт поликонденсации аминокислот. Один из концов цепи, где находится остаток аминокислоты со свободной аминогруппой, называется N-концом, сама аминокислота – N-концевой; другой конец цепи с остатком аминокислоты, имеющим карбоксильную группу, называется С-концом, кислота – С-концевой.
Пептидную цепь всегда записывают, начиная с N-конца. В названии пептида за основу принимают С-концевую кислоту, остальные аминокислоты указывают как заместители с суффиксом –ил-, перечисляя их последовательно, начиная с N-конца. Название полученного дипептида: ГЛИЦИЛАЛАНИН
источник
Белки — высокомолекулярные органические соединения, состоящие из остатков аминокислот, соединённых в длинную цепочку пептидной связью.
В состав белков живых организмов входит всего 20 типов аминокислот, все из которых относятся к альфа-аминокислотами, а аминокислотный состав белков и их порядок соединения друг с другом определяются индивидуальным генетическим кодом живого организма.
Одной из особенностей белков является их способность самопроизвольно формировать пространственные структуры характерные только для данного конкретного белка.
| первичная | последовательность соединения остатков аминокислот | |
| вторичная | локальное упорядочивание фрагмента полипептидной цепи в спирали | |
| третичная | пространственная ориентация полипептидной спирали или способ ее укладки определенном объеме в глобулы (клубки) или фибриллы (нити) |
Из-за специфики своего строения белки могут обладать разнообразными свойствами. Например, белки, имеющие глобулярную четвертичную структуру, в частности белок куриного яйца, растворяются в воде с образованием коллоидных растворов. Белки, обладающие фибриллярной четвертичной структурой в воде не растворяются. Фибриллярными белками, в частности, образованы ногти, волосы, хрящи.
Все белки способны вступать в реакцию гидролиза. В случае полного гидролиза белков образуется смесь из α -аминокислот:
Белок + nH2O => смесь из α-аминокислот
Разрушение вторичной, третичной и четвертичной структур белка без разрушения его первичной структуры называют денатурацией. Денатурация белка может протекать под действием растворов солей натрия, калия или аммония – такая денатурация является обратимой:
Денатурация же протекающая под действием излучения (например, нагрева) или обработке белка солями тяжелых металлов является необратимой:
Так, например, необратимая денатурация белка наблюдается при термической обработке яиц в процессе их приготовления. В результате денатурации яичного белка его способность растворяться в воде с образованием коллоидного раствора исчезает.
Если к раствору, содержащему белок добавить 10%-й раствор гидроксида натрия, а затем небольшое количество 1 %-го раствора сульфата меди, то появится фиолетовое окрашивание.
раствор белка + NаОН(10%-ный р-р) + СuSO4 = фиолетовое окрашивание
растворы белка при кипячении с концентрированной азотной кислотой окрашиваются в желтый цвет:
раствор белка + HNO3(конц.) => желтое окрашивание
| каталитическая | ускоряют различные химические реакции в живых организмах | ферменты |
| структурная | строительный материал клеток | коллаген, белки клеточных мембран |
| защитная | защищают организм от инфекций | иммуноглобулины, интерферон |
| регуляторная | регулируют обменные процессы | гормоны |
| транспортная | перенос жизненно-необходимых веществ от одних частей организма к другим | гемоглобин переносит кислород |
| энергетическая | снабжают организм энергией | 1 грамм белка может обеспечить организм энергией в количестве 17,6 Дж |
| моторная (двигательная) | любые двигательные функции организма | миозин (мышечный белок) |
Открыта запись на индивидуальные, а также вебинарные занятия в следующем учебном году
© Сергей Широкопояс, 2015–2018. Все права защищены.
Уважаемые посетители!
Если вы используете информацию с сайта ОЗНАКОМЛЕНИЕ ОБЯЗАТЕЛЬНО !
В этом документе вы можете узнать, на каких условиях вы сможете использовать материалы сайта Наука для тебя(scienceforyou.ru) на своих ресурсах, в своих рассылках и.т.д.
СТРОГО ЗАПРЕЩЕНО: копировать с сайта изображения с дипломами об образовании.
1. ФИО и другие реквизиты автора должны быть обязательно включены в перепечатываемую публикацию.
2. Любое искажение информации об авторе при перепечатке материалов запрещено!
3. Содержание урока или статьи при перепечатке не должно подвергаться переделке. Все уроки и статьи, размещенные на сайте, должны перепечатываться как есть. Вы не имеете права урезать, исправлять или иным образом переделывать материалы взятые с сайта.
4. В конце каждого перепечатываемого материала вы обязаны вставить ссылку на сайт scienceforyou.ru Ссылка на сайт обязательно должна быть работоспособной (при нажатии человек должен попадать на сайт автора материала).
5. Все документы и материалы представленные на сайте не могут быть использованы в коммерческих целях. Ограничение доступа к урокам и статьям также запрещено!
источник
Химический синтез белков и нуклеиновых кислот с использованием автоматических синтезаторов (Халимская Л.М. , 2000), ХИМИЯ
Описан современный твердофазный метод химического синтеза фрагментов белков и нуклеиновых кислот. Приведены принципиальные схемы получения этих биополимеров, используемые в автоматических синтезаторах.
ХИМИЧЕСКИЙ СИНТЕЗ БЕЛКОВ И НУКЛЕИНОВЫХ КИСЛОТ С ИСПОЛЬЗОВАНИЕМ АВТОМАТИЧЕСКИХ СИНТЕЗАТОРОВ
Новосибирский государственный университет
Белки и нуклеиновые кислоты — два важнейших класса биологически активных веществ, входящих в состав живых клеток. Биологические функции белков чрезвычайно разнообразны. Все биохимические реакции катализируются белками-ферментами. Многие гормоны, токсины, некоторые антибиотики являются белками или их более короткими фрагментами — пептидами. Существуют белки, осуществляющие транспорт различных молекул и ионов через клеточные мембраны или с током крови. Важную роль играют защитные белки, которые помогают организму бороться с болезнями, структурные белки, составляющие основу многих тканей, двигательные белки, белки-рецепторы, регуляторные белки и пептиды, а также пищевые белки. Биологическая функция нуклеиновых кислот заключается в хранении и передаче генетической информации в живых клетках.
За последние 40 лет в области химического синтеза этих биополимеров достигнуты значительные успехи. Синтезировано множество пептидов, которые используют в медицине и сельском хозяйстве. Химическим путем удается получать улучшенные аналоги природных пептидов с более избирательным, усиленным или длительным действием. Осуществлен также синтез некоторых небольших белков, например гормона инсулина и некоторых ферментов.
В настоящее время достаточно быстро можно синтезировать искусственные фрагменты нуклеиновых кислот разной длины и любого состава (такие фрагменты называются олигонуклеотидами), а затем соединить их в более длинные цепи с помощью специальных ферментов. Полученные таким образом гены и их фрагменты широко используются в генетической инженерии, биотехнологии, а также для диагностики инфекционных и генетических заболеваний. Большие надежды связаны с их применением для направленного воздействия на генетический аппарат клетки (генотерапия). С помощью синтетических фрагментов ДНК можно модифицировать природные гены, вводя в них определенные изменения. Таким способом можно вводить направленные модификации в структуру белка, кодируемого данным геном (белковая инженерия). Это открыло путь к созданию белков, обладающих измененной биологической активностью, например к получению ферментов с улучшенными свойствами. Указанные пути улучшения старых и создания новых белков открывают широкие перспективы для медицины и биотехнологии.
Белки и нуклеиновые кислоты являются биополимерами, состоящими из мономерных остатков — аминокислот (белки) или нуклеотидов (нуклеиновые кислоты). В состав белков и пептидов входят 20 канонических аминокислот, которые отличаются между собой структурой радикала R:
Существует также одна иминокислота — пролин:
Аминокислоты в белках соединены между собой пептидными связями:
В состав нуклеиновых кислот и олигонуклеотидов входят пять нуклеотидов, отличающихся между собой строением азотистого гетероцикла В. Три из них — производные аденина (А), гуанина (G) и цитозина (С) входят в состав и ДНК и РНК, производное тимина (Т) — только в ДНК, урацила (U) — только в РНК. Нуклеотиды в отличие от нуклеозидов содержат остаток фосфорной кислоты:
Если Х = ОН — это рибонуклеозид и рибонуклеотид, входящие в состав РНК. При Х = Н — это дезоксирибонуклеозид и дезоксирибонуклеотид, они входят в состав ДНК. Структура азотистых гетероциклов нуклеиновых кислот:
В нуклеиновых кислотах нуклеотиды соединены между собой фосфодиэфирными связями:
Строение нуклеиновых кислот, а также основные достижения их химии и биохимии описаны в статьях Д.Г. Кнорре [1, 2].
Задачей химического синтеза белков и нуклеиновых кислот является соединение входящих в их состав мономеров в строго определенной последовательности. Схематически образование пептидной связи можно представить как конденсацию двух аминокислот с отщеплением молекулы воды:
Для образования межнуклеотидной связи также должно произойти соединение двух нуклеотидов с отщеплением молекулы воды:
Образующийся димер реагирует далее со следующим мономером (аминокислотой или нуклеотидом) с образованием тримера и т.д. Для проведения этих реакций необходимо выполнение следующих условий.
1. Нужно добиться селективности соединения мономерных звеньев. Например, карбоксильная группа первой аминокислоты должна прореагировать с аминогруппой второй аминокислоты, тогда как другие амино- и карбоксильная группы не должны участвовать в реакции. То же и в случае конденсации нуклеотидов — гидроксильная группа первого нуклеотида должна взаимодействовать с фосфатным остатком второго, но не наоборот. Для этого фрагменты, которые не участвуют в реакции, нужно блокировать с помощью специальных защитных групп.
2. Сами по себе карбоксильная и аминогруппы в аминокислотах (так же, как и фосфатная и гидроксильная группы в нуклеотидах) не реагируют друг с другом. Для проведения конденсации мономеров нужно активировать карбоксильную (фосфатную) группу.
3. Поскольку синтез проводится в несколько стадий, каждая реакция должна проходить с очень высоким выходом. В противном случае общий выход будет катастрофически падать с ростом длины целевого продукта. Например, для получения фрагмента длиной десять звеньев нужно провести девять реакций конденсации. При 90%-ном выходе на каждой стадии общий выход продукта составит 0,99 » 100 = 39%. Для синтеза фрагмента длиной 20 звеньев понадобится провести 19 реакций конденсации, и общий выход продукта составит всего 0,919 » 100 = 13,5%. Чтобы добиться получения значительного количества вещества при синтезе протяженных фрагментов белков и нуклеиновых кислот, выход на каждой стадии должен составлять 96-98%.
4. Все процессы — введение и удаление защитных групп, активация и конденсация — должны проводиться в мягких условиях, то есть без использования высоких температур, а также концентрированных растворов кислот или щелочей, что могло бы привести к образованию побочных продуктов и разрушению имеющихся и вновь образованных химических связей.
В настоящее время разработано большое число методов синтеза пептидов и олигонуклеотидов, удовлетворяющих этим условиям, подобраны удобные защитные группы и предложены способы активации карбоксильной и фосфатной групп.
ПРИНЦИПИАЛЬНАЯ СХЕМА ТВЕРДОФАЗНОГО МЕТОДА СИНТЕЗА
Синтез протяженных фрагментов белков и нуклеиновых кислот состоит из большого числа стадий. После проведения каждой химической реакции нужно выделить полученный продукт, очистив его от не вступивших в реакцию исходных веществ и других примесей. Это делает процесс длительным и трудоемким, а также приводит к значительным потерям на каждой стадии выделения.
Американский ученый Роберт Меррифилд в 1962 году предложил оригинальную идею твердофазного метода синтеза, которая позволила резко упростить и ускорить проведение процесса. Идея заключается в том, что первый мономер (аминокислоту или нуклеозид) присоединяют к нерастворимому полимерному носителю (твердой фазе), который помещают в колонку-реактор. Раствор, содержащий второй мономер и другие необходимые реагенты, пропускают через колонку. При этом образовавшийся продукт реакции также оказывается присоединенным к твердой фазе. Затем колонку промывают растворителем для удаления непрореагировавших веществ и побочных продуктов, после чего через реактор пропускают следующий мономер, повторяя процедуру многократно до завершения синтеза желаемого продукта.
Таким образом, растущая полимерная цепь в процессе синтеза закреплена на твердой фазе, и все реакции с другими компонентами, находящимися в растворе, протекают на поверхности носителя. Этот прием позволяет заменить сложные и трудоемкие процедуры разделения и очистки промежуточных продуктов элементарными операциями промывки полимера.
Синтез включает в себя несколько принципиальных стадий.
Стадия 1. Получение защищенных мономеров, которые являются исходными блоками для построения цепочки белка или олигонуклеотида. Для этого те фрагменты молекул, которые не должны подвергаться химическим превращениям, блокируют специальными защитными группами.
Стадия 2. Присоединение концевого мономера (защищенной таким образом аминокислоты или нуклеозида) к полимерному носителю. Гранулы носителя с присоединенным концевым мономером вносят в колонку-реактор.
Стадия 3. Удаление защитной группы с концевого мономера. Для этого через колонку пропускают раствор реагента, вызывающего отщепление защитной группы.
Стадия 4. Проведение конденсации, для чего через колонку пропускают раствор второго мономера в смеси с активирующим реагентом.
Стадии 3 и 4 повторяют многократно до получения биополимера необходимой длины. Затем проводят стадии 5 и 6.
Стадия 5. Обработка носителя реагентами, приводящими к отщеплению синтезированного продукта от твердой фазы и удалению всех защитных групп.
Стадия 6. Выделение и очистка синтезированного фрагмента белка или нуклеиновой кислоты с помощью различных хроматографических и электрофоретических методов. (Из-за неполноты протекания реакций к концу синтеза на носителе накапливаются более короткие фрагменты цепи, поэтому необходима тщательная очистка конечного продукта.)
СИНТЕЗ ПЕПТИДОВ И БЕЛКОВ ТВЕРДОФАЗНЫМ МЕТОДОМ
Р. Меррифилд осуществил синтез нескольких пептидов и фермента рибонуклеазы твердофазным методом, за что в 1984 году ему была присуждена Нобелевская премия.
Рассмотрим применение принципиальной схемы твердофазного метода к синтезу пептидов.
Стадия 1. Получение защищенных аминокислот. Для блокирования аминогрупп часто используют трет-бутилоксикарбонильную группу (сокращенное английское обозначение — Вoc):
Таким образом защищают аминогруппы всех аминокислот, входящих в данный пептид или белок. Некоторые боковые радикалы R аминокислот содержат функциональные группы (например, амино- или карбоксильные), способные участвовать в реакциях с образованием побочных продуктов, поэтому их также необходимо блокировать.
Стадия 2. Присоединение концевой аминокислоты к полимерному носителю, например к полистиролу с введенными в него хлорметильными группами.
Стадия 3. Удаление Вoc-защитной группы с присоединенной к полимерному носителю аминокислоты мягкой кислотной обработкой полимера.
Стадия 4. Проведение реакции образования пептидной связи. Через колонку пропускают раствор, содержащий аминокислоту с защищенной аминогруппой в смеси с реагентом, который обеспечивает активацию карбоксильной группы. В качестве такого реагента Меррифилд использовал дициклогексилкарбодиимид C6H11N=C=NC6H11 .
Затем вновь удаляют защитную группу (стадия 3), добавляют следующий защищенный мономер и активирующий реагент (стадия 4) и т.д. Стадии 3 и 4 повторяют до тех пор, пока не закончится синтез требуемого пептида. Каждый цикл длится несколько часов.
В настоящее время в пептидном синтезе применяют более эффективные конденсирующие реагенты на основе солей фосфония и урония, что позволяет сократить время синтеза одной пептидной связи (стадия 4) до 10-15 мин.
После окончания синтеза удаляют защитные группы, введенные в боковые радикалы R, затем в более жестких кислых условиях отщепляют с полимерного носителя полученный пептид (стадия 5) и проводят его очистку (стадия 6).
СИНТЕЗ ФРАГМЕНТОВ ДНК ТВЕРДОФАЗНЫМ
Основной вклад в развитие олигонуклеотидного синтеза внес Г. Корана, осуществивший в начале 60-х годов химический синтез фрагментов нуклеиновых кислот заданной последовательности и получивший за эту работу в 1968 году Нобелевскую премию. В 1970 году он впервые синтезировал полный ген аланиновой транспортной РНК.
В 1975 году Р. Летсингер предложил новый метод образования межнуклеотидной связи, на основании которого в начале 80-х годов М. Карузерс разработал так называемый твердофазный амидофосфитный метод синтеза олигонуклеотидов (см. ниже). С этого времени начались бурное развитие этого метода и его автоматизация. Рассмотрим основные стадии процесса.
Стадия 1. Получение защищенных исходных мономеров для олигонуклеотидного синтеза. В трех из четырех входящих в состав ДНК нуклеозидов (A, G и С) гетероциклы содержат аминогруппы, которые могут трансформироваться при наращивании олигомерной цепи, поэтому их нужно предварительно блокировать. Затем одну из гидроксильных групп нуклеозида защищают диметокситритильной группой (DMTr):
В связи с тем что реагент содержит объемные заместители, реакция протекает только по одной стерически более доступной ОН-группе нуклеозида.
В качестве мономеров, используемых для синтеза фрагментов ДНК, применяют амидофосфиты нуклеозидов, поэтому метод синтеза называют амидофосфитным. Эти соединения, содержащие трехвалентный фосфор, являются более активными по сравнению с производными пятивалентного фосфора. Амидофосфитные мономеры получают из защищенных нуклеозидов:
Стадия 2. Присоединение концевого нуклеозида к полимерному носителю осуществляют через так называемую якорную группу, которая связывает нуклеозид с твердой фазой (обычно остаток янтарной кислоты). В качестве полимерного носителя используют стеклянные гранулы.
Стадия 3. Удаление защитной группы с присоединенного к полимеру нуклеозида с помощью мягкой кислотной обработки:
Стадия 4. Образование межнуклеотидной связи. Конденсация гидроксильной группы связанного с полимером нуклеозида с амидофосфитным производным второго нуклеозида осуществляется в присутствии активирующего реагента — тетразола. Затем атом трехвалентного фосфора должен быть окислен до пятивалентного состояния иодом в присутствии воды:
После этого снова удаляют диметокситритильную группу с полученного продукта (стадия 3) и проводят конденсацию со следующим мономером и окисление (стадия 4). Эти процедуры повторяют до окончания синтеза целевого фрагмента ДНК. Каждый цикл длится несколько минут.
После окончания синтеза продукт реакции отщепляют от полимерного носителя обработкой концентрированным аммиаком, при этом удаляются все щелочелабильные защитные группы (стадия 5). Затем, как и в случае пептидов, проводят тщательную очистку полученного фрагмента ДНК (стадия 6).
Аналогичный метод применяют для синтеза РНК, однако при этом приходится использовать дополнительные стадии введения и удаления защитной группы, связанные с присутствием в рибонуклеозидах еще одной гидроксильной группы.
АВТОМАТИЗАЦИЯ СИНТЕЗА ФРАГМЕНТОВ БЕЛКОВ И НУКЛЕИНОВЫХ КИСЛОТ
Важным преимуществом твердофазного метода синтеза является простота операций. Процесс синтеза состоит из повторяющихся стадий пропускания защищенных мономеров, реагентов и растворителей через колонку с полимерным носителем, к которому присоединена растущая цепь. Это делает возможной автоматизацию процесса.
Автоматические синтезаторы включают в себя реактор, содержащий носитель с присоединенным к нему первым мономером, и сосуды с необходимыми мономерами, реагентами и растворителями. С помощью насоса растворы из этих сосудов поочередно подаются в реактор в соответствии с имеющейся программой и заданной последовательностью синтезируемого фрагмента белка или нуклеиновой кислоты. В настоящее время автоматические синтезаторы пептидов и олигонуклеотидов выпускают различные, в том числе и отечественные, фирмы.
Для современной биоорганической химии синтез пептидов и олигонуклеотидов, содержащих 30-40 мономерных звеньев, не является сложной задачей. Как правило, твердофазным методом синтезируют олигонуклеотиды длиной около 40 звеньев. Использование специальных ферментов позволяет соединять их в гены, включающие до 2 тыс. пар нуклеотидов. Путем экспрессии генов с помощью методов генетической инженерии сейчас получают значительные количества труднодоступных белков и пептидов, а также их аналогов.
1. Кнорре Д.Г. Биохимия нуклеиновых кислот // Соросовский Образовательный Журнал. 1998. ╧ 8. С. 30-35.
2. Кнорре Д.Г. Химические инструменты в современной биологии: (На примере антисмысловых воздействий на генетические структуры) // Там же. ╧ 12. С. 25-31.
3. Овчинников Ю.А. Биоорганическая химия. М.: Просвещение, 1987.
4. Кнорре Д.Г., Мызина С.Д. Биологическая химия. М.: Высш. шк., 1998.
5. Пептиды: Основные методы образования пептидных связей / Под ред. Э. Гросса, И. Майенхофера. М.: Мир, 1983.
6. Шабарова З.А., Богданов А.А., Золотухин А.С. Химические основы генетической инженерии. М.: Изд-во МГУ, 1994.
Рецензенты статьи А.А. Богданов, Н.Л. Клячко
Людмила Михайловна Халимская, кандидат химических наук, доцент Новосибирского государственного университета. Область научных интересов — использование различных производных олигонуклеотидов для направленного воздействия на генетический аппарат клеток. Автор 25 научных публикаций, в том числе двух методических и одного учебного пособия.
источник






