Всоставе вируса гепатита С имеются различные белки, среди которых выделяют структурные, т. е. входящие в структуру виру-
са (core, El, E2), и неструктурные, т. е. не входящие в структуру вируса, но выполняющие определенные функции (NS2, NS3, NS4, NS5). В крови больного обнаруживаются антитела к этим белкам, которые позволяют в неясных случаях подтвердить факт инфицирования больного вирусом гепатита С. В последние годы появилась информация о том, что имеется связь между выявлением определенных белков и клиническим течением болезни.
Единственным маркером, используемым для выявления инфицирования вирусом гепатита TTV, является дезоксирибонуклеино-вая кислота вируса (ДНК TTV). Инфицирование этим вирусом, как уже указывалось, не всегда сопровождается развитием острого или хронического гепатита.
Маркером, подтверждающим инфицирование вирусом гепатита G, является рибонуклеиновая кислота вируса (РНК BГG). Чаще вирус гепатита G обнаруживается у пациентов с гепатитом С, а вопрос о самостоятельном существовании гепатита G и его клиническом значении остается спорным.
Биохимический анализ кровивключает в себя многие показатели, которые отражают функцию печени на момент исследования. Эти показатели очень изменчивы, поэтому для достоверной оценки течения процесса необходимы многократные повторные их определения. К основным биохимическим тестам при вирусных гепатитах относятся печеночные ферменты (аминотрансферазы), билирубин, щелочная фосфатаза, общий белок и белковый спектр крови.
Аминотрансферазы — аланиновая (АЛТ) и аспарагиновая (ACT) — это ферменты, которые находятся внутри печеночных клеток. В норме небольшие концентрации этих веществ определяются в крови. При повреждении печени (в частности, в результате вирусного воздействия) печеночные клетки разрушаются и печеночные ферменты обнаруживаются в крови в повышенных количествах.
Пределы колебаний этих показателей очень широки и в определенной степени отражают остроту и активность воспаления печеночной ткани при гепатите. Основным ориентиром при этом служит уровень АЛТ. Для точного определения характера поражения печени этого исследования недостаточно, для этого существуют спе-
циальные диагностические методы — в частности, пункционная биопсия печени. Кроме того, значения аминотрансфераз могут меняться очень существенно и быстро, даже без всякого медикаментозного воздействия, т. е. самопроизвольно. В связи с этим при вирусном гепатите для мониторинга за течением болезни необходимо регулярное исследование крови на активность печеночных ферментов. Во время противовирусной терапии нормализация уровней АЛТ и ACT свидетельствует об эффективности лечения.
Билирубин — это желчный пигмент, который образуется в крови человека в результате распада красных кровяных клеток (эритроцитов). Затем билирубин захватывается клетками печени и с желчью через кишечник выводится из организма. Попавший в печеночные клетки билирубин называется связанным, а находящийся в крови (т. е. до попадания в печень) — свободным. В норме небольшие количества билирубина (преимущественно за счет свободного) обнаруживаются в крови. При вирусных поражениях печени (как правило, при острых гепатитах и циррозе) содержание общего билирубина (сумма свободного и связанного) может повышаться, что выражается желтушным окрашиванием кожи и склер. Причин развития желтухи существует очень много. Далеко не всегда ее появление связано с вирусным гепатитом или вообще с каким-либо поражением печени. В большинстве случаев этот симптом указывает на необходимость стационарного обследования пациента.
Щелочная фосфатаза (ЩФ) — фермент, активность которого отражает процессы перемещения желчи по желчевыводящим путям (из печеночной клетки в желчный пузырь и далее в кишечник).
Задержка оттока желчи бывает не только при вирусных гепатитах и циррозах, но и при медикаментозных поражениях печени, закупорке желчных протоков камнем, спайками, опухолью и т. д. При задержке оттока желчи (холестазе) уровень ЩФ в крови возрастает и превышает норму. Желтуха при этом не обязательна, но довольно часто больные отмечают, что их беспокоит кожный зуд.
Общий белок и белковый спектр крови — это группа показателей, которые отражают способность печени и клеток иммунной системы к выработке определенных белков. Общий белок крови состоит из так называемых альбумина и глобулинов. Печень синтезирует альбумин. Эта способность уменьшается при повреждениях печеночных клеток, и тогда в анализе белкового спектра отмечается снижение уровня альбумина. Степень снижения соответствует глубине поражения печени: наибольшие отклонения этого показателя характерны для цирроза. При циррозах и аутоиммунных ге-
патитах увеличиваются концентрации гамма-глобулинов, которые вырабатываются иммунными клетками.
Следует подчеркнуть, что существует множество причин для изменений белкового спектра крови, не связанных с патологией печени, но анализ этих показателей при вирусных гепатитах может существенно помочь определить стадию поражения печени в тех случаях, когда по каким-либо причинам проведение пункционной биопсии затруднено.
Общий анализ крови включает в себя много различных показателей, которые, преимущественно, отражают содержание тех или иных клеток крови (тромбоцитов, лейкоцитов, эритроцитов и т. д.). Уровни этих клеток могут меняться при произвольном течении вирусных гепатитов. Например, у пациентов с циррозом печени, как правило, снижается содержание тромбоцитов. Современное противовирусное лечение также может существенно влиять на количество клеток крови (в первую очередь — лейкоцитов).
Необходимость контроля этих показателей связана с тем, чтовсе виды кровяных клеток выполняют важнейшие функции (защита от инфекций, поддержание нормальной свертываемости крови, обеспечение тканей кислородом), и падение их содержания ниже критических уровней недопустимо. Поэтому регулярное проведение общего анализа крови позволяет более точно оценивать тяжесть состояния больного и своевременно проводить коррекцию противовирусной терапии для обеспечения ее безопасности.
источник
Структура и молекулярная масса РНК-геномов вирусов животных
| Семейство | Структура | Информационные функции | Молекулярная масса |
| Пикорнавирусы | Линейная однонитчатая | «Плюс»-нитевая | 2,7·10 6 |
| Тогавирусы | Линейная однонитчатая | «Плюс»-нитевая | 4·10 6 |
| Парамиксовирусы | Линейная однонитчатая | «Минус»-нитевая | 5·10 6 -7,5·10 6 |
| Рабдовирусы | Линейная однонитчатая | «Минус»-нитевая | 3,8·10 6 -4,5·10 6 |
| Ортомиксовирусы | Фрагментированная (8 уникальных фрагментов) | «Минус»-нитевая | От 0,2·10 6 до 1·10 6 , всего 5·10 6 |
| Буньявирусы | Фрагментированная однонитчатая кольцевая (3 уникальных фрагмента L, M, S) | «Минус»-нитевая | L 3· 10 6 -5·10 6 M 1·10 6 -2·10 6 S 0,4·10 6 -0,8·10 6 |
| Аренавирусы | Фрагментированная однонитчатая кольцевая и линейная формы; 2 вирус-специфических фрагмента L и S | «Амбисенс»» | L 2,1·10 6 -3,2·10 6 S 1,1·10 6 -1,6·10 6 |
| Реовирусы | Фрагментированная двунитчатая (10—12 уникальных фрагментов) | ДиплоРНК-вирусы | 0,2·10 6 -3·10 6 |
| Ретровирусы | Однонитчатая, 2 идентичные молекулы | «Плюс»-нитевая, в составе внутриклеточной формы | По 3·10 6 , всего 6·10 6 -7·10 6 |
В зараженной клетке вирусный геном кодирует синтез двух групп белков: 1) структурных, которые входят в состав вирусных частиц потомства, и 2) неструктурных, которые обслуживают процесс внутриклеточной репродукции вируса на разных его этапах, но в состав вирусных частиц не входят.
Количество структурных белков в составе вирусной частицы варьирует в широких пределах в зависимости от сложности организации вириона. Наиболее просто организованный вирус табачной мозаики содержит всего один небольшой белок с молекулярной массой 17-18·10 3 , некоторые фаги содержат 2-3 белка, просто организованные вирусы животных — 3-4 белка. Сложно устроенные вирусы, такие как вирусы оспы, содержат более 30 структурных белков.
Структурные белки делятся на 2 группы:
1) капсидные белки, образующие капсид, т. е. футляр для нуклеиновой кислоты вируса (от лат. capsa — вместилище), и входящие в состав капсида геномные белки и ферменты;
2) суперкапсидные белки, входящие в состав суперкапсида, т. е. наружной вирусной оболочки.
Поскольку суперкапсид называют также «пеплос» (от греч. peplos — покров, мантия), эти белки называют пепломерами.
Просто организованные вирусы, представляющие собой нуклеокапсид, содержат только капсидные белки. Сложно организованные вирусы содержат капсидные и суперкапсидные белки.
Капсидные белки. Первоначальное представление о том, что капсидные белки являются всего лишь инертной оболочкой для вирусной нуклеиновой кислоты, сложилось на основании изучения наиболее просто организованного вируса табачной мозаики, частица которого состоит из одной молекулы РНК и одного типа белка, образующего чехол для РНК.
Однако такое представление неправильно. Хотя основной функцией капсидных белков является функция защиты вирусного генома от неблагоприятных воздействий внешней среды, у многих вирусов в составе капсида есть белки и с другими функциями. Поэтому термин «капсид» далеко выходит за пределы представления о нем как о футляре или чехле для вирусной нуклеиновой кислоты.
В составе капсида некоторых вирусов (пикорнавирусы, паповавирусы, аденовирусы) содержатся белки, ковалентно связанные с вирусным геномом (геномные белки). Эти белки являются терминальными, т. е. соединенными с концом вирусной нуклеиновой кислоты. Функции их неразрывно связаны с функциями генома и их регуляцией»
У ряда сложно организованных вирусов в составе капсида имеются ферменты, осуществляющие транскрипцию и репликацию вирусного генома — РНК и ДНК (РНК и ДНК-полимеразы), а также ферменты, модифицирующие концы иРНК. Если ферменты и геномные белки представлены единичными молекулами, то капсидные белки представлены множественными молекулами. Эти белки и формируют капсидную оболочку, в которую у сложно организованных вирусов вставлены молекулы белков с другими функциями.
Основным принципом строения капсидной оболочки вирусов является принцип субъединичности, т. е. построение капсидной оболочки из субъединиц — капсомеров, образованных идентичными полипептидными цепями. Правильно построенные белковые субъединицы — капсомеры возникают благодаря способности вирусных капсидных белков к самосборке. Самосборка объясняется тем, что упорядоченная структура — капсид имеет наименьшую свободную энергию по сравнению с неупорядоченными белковыми молекулами. Сборка капсидной оболочки из субъединиц запрограммирована в первичной структуре белка и происходит самопроизвольно или при взаимодействии с нуклеиновой кислотой.
Принцип субъединичности в строении вирусного капсида является универсальным свойством капсидных белков и имеет огромное значение для вирусов. Благодаря этому свойству достигается огромная экономия генетического материала. Если бы капсидная оболочка была построена из разных белков, то на кодирование ее потребовалась бы основная часть генетической информации, заложенной в вирусном геноме. В действительности на кодирование, например, одной полипептидной цепи вируса табачной мозаики, расходуется менее 10 % генома. Далее, в механизме самосборки заложена возможность контроля за полноценностью вирусных полипептидов: дефектные и чужеродные полипептидные цепи при таком способе сборки вирионов будут автоматически отбрасываться.
Описанная способность к самосборке в пробирке и в зараженной клетке характерна только для простых вирусов. Сборка сложно организованных вирусов является гораздо более сложным многоступенчатым процессом, хотя отдельные ее этапы, например формирование капсидов и нуклеокапсидов, также основаны на самосборке.
Суперкапсидные белки. Гликопротеиды. Суперкапсидные белки, или пепломеры, располагаются в липопротеидной оболочке (суперкапсиде или пеплосе) сложно устроенных вирусов. Они либо пронизывают насквозь липидный бислой как, например, гликопротеиды альфа-вирусов (вируса леса Семлики), либо не доходят до внутренней поверхности. Эти белки являются типичными внутримембранными белками и имеют много общего с клеточными мембранными белками. Как и последние, суперкапсидные белки обычно гликозилированы. Углеводные цепочки прикреплены к молекуле полипептида в определенных участках. Гликозилирование осуществляют клеточные ферменты, поэтому один и тот же вирус, продуцируемый разными видами клеток, может иметь разные углеводные остатки: может варьировать как состав углеводов, так и длина углеводной цепочки и место прикрепления ее к полипептидному ocтoвy.
У большинства вирусов гликопротеиды формируют «шипы» на поверхности вирусной частицы, длина которых достигает 7-10 нм. Шипы представляют собой морфологические субъединицы, построенные из нескольких молекул одного и того же белка. Вирусы гриппа имеют два типа шипов, построенных соответственно из гемаглютинина и нейраминидазы. Парамиксовирусы также имеют два типа шипов, построенных соответственно из двух гликопротеидов (HN и F), рабдовирусы имеют только один гликопротеид и, соответственно, один тип шипов, а альфа-вирусы имеют два или три гликопротеида, формирующих один тип шипов.
Гликопротеиды являются амфипатическими молекулами: они состоят из наружной, гидрофильной части, которая содержит на конце аминогруппу (N-конец), и погруженной в липидный бислой, гидрофобной части, которая содержит на погруженном конце гидроксильную группу
Основной функцией гликопротеидов является взаимодействие со специфическими рецепторами клеточной поверхности. Благодаря этим белкам осуществляется распознавание специфических клеточных рецепторов и прикрепление к ним вирусной частицы, т.е. адсорбция вируса на клетке. Поэтому гликопротеиды, выполняющие эту функцию, называют вирусными прикрепительными белками.
Другой функцией гликопротеидов является участие в слиянии вирусной и клеточной мембран, т.е. в событии, ведущем к проникновению вирусных частиц в клетку. Вирусные белки слияния ответственны за такие процессы, как гемолиз и слияние плазматических мембран соседних клеток, приводящие к образованию гигантских клеток, синцитиев и симпластов.
«Адресная функция» вирусных белков. Вирусы вызывают инфекционный процесс у относительно небольшого круга хозяев. Вирус должен «узнать» чувствительную клетку, которая сможет обеспечить продукцию полноценного вирусного потомства. Если бы вирус проникал в любую клетку, которая встретилась на его пути, это привело бы к исчезновению вирусов в результате деструкции «родительской» вирусной частицы и отсутствия вирусного потомства. В процессе эволюции у вирусов вырабатывалась так называемая адресная функция, т.е. поиск чувствительного хозяина среди бесконечного числа нечувствительных клеток. Эта функция реализуется путем наличия специальных белков на поверхности вирусной частицы, которые узнают специфический рецептор на поверхности чувствительной клетки.
Вирусные прикрепительные белки. Прикрепительные белки могут находиться в составе уникальных органелл, таких как структуры отростка у Т-бактериофагов или фибры у аденовирусов, которые хорошо видны в электронном микроскопе; могут формировать морфологически менее выраженные, но не менее уникальные аранжировки белковых субъединиц на поверхности вирусных мембран, как, например, шипы у оболочечных вирусов, «корону» у коронавирусов.
Просто организованные вирусы животных содержат прикрепительные белки в составе капсида. У сложно организованных вирусов эти белки входят в состав суперкапсида и представлены множественными молекулами.
Неструктурные белки изучены гораздо хуже, чем структурные, поскольку их выделяют не из очищенных препаратов вирусов, а из зараженных клеток, и возникают трудности в их идентификации и очистке от клеточных белков.
К неструктурным белкам относятся:
1) предшественники вирусных белков, которые отличаются от других неструктурных белков нестабильностью в зараженной клетке в результате быстрого нарезания на структурные белки;
2) ферменты синтеза РНК и ДНК (РНК и ДНК-полимеразы), обеспечивающие транскрипцию и репликацию вирусного генома;
4) ферменты, модифицирующие вирусные белки, например протеиназы и протеинкиназы.
Однако многие неструктурные белки при ряде вирусных инфекций еще не идентифицированы и функции их не определены.
Типы структурных и неструктурных белков просто и сложно устроенных вирусов и их функции показаны на схеме 1.
источник
В ответ на попадание в организм человека инородных частиц, таких, как вирусы, иммунная система вырабатывает иммуноглобулины — защитные антитела. Эти антитела выявляют специальным анализом методом ИФА, скрининговым исследованием, используемым для установления факта инфицирования человека вирусом гепатита С. Для гепатита С все антитела содержат аббревиатуру anti-HCV. что означает «против вируса гепатита С».
Антитела гепатита С бывают двух классов — G и M, что в анализах пишется, как IgG и IgM (Ig – immunoglobulin (иммуноглобулин) — это латинское название антител). Anti-HCV total (anti-НСV, анти-hcv ) — суммарные антитела (классов IgG и IgM) к антигенам вируса гепатита C. Тест на определение этих маркеров проводится всем пациентам, когда хотят проверить, есть ли у них гепатит С. Anti-HCV присутствуют как при остром (они могут обнаруживаться уже с 4 — 6 недели после инфицирования), так и при хроническом гепатите. Anti-HCV tota l также встречаются у тех, кто переболел гепатитом С и выздоровел самостоятельно. У таких людей данный маркер может обнаруживаться в течение 4 — 8 и более лет после выздоровления. Поэтому положительный анализ на anti-HCV не является достаточным для того, чтобы установить диагноз. На фоне хронической инфекции суммарные антитела выявляются постоянно, а после успешного лечения сохраняются длительное время (прежде всего за счет anti-HCV core IgG. о них написано ниже), при этом их титры постепенно снижаются.«
Важно знать, что антитела к гепатиту С не защищают от развития HCV-инфекции и не обеспечивают надежного иммунитета против повторного инфицирования.
Спектр anti-НСV (core, NS3, NS4, NS5) — это специфические антитела к отдельным структурным и неструктурным белкам вируса гепатита С. Их определяют для суждения о вирусной нагрузке, активности инфекции, риске хронизации, разграничении острого и хронического гепатита, степени поражения печени. Обнаружение антител к каждому из антигенов имеет самостоятельное диагностическое значение. Anti-HCV состоят их структурных (core) и неструктурных (NS3. NS4. NS5 ) белков (протеинов).
Anti-HCV core IgG —антитела класса G к ядерным (core) белкам HCV. Anti-HCV IgG появляются с 11-12 недели после инфицирования, поэтому для диагностики возможных «свежих» случаев инфицирования используют Anti-HCV total, которые появляются раньше. Anti-HCV IgG достигают пика концентрации к 5 — 6 месяцу с момента инфицирования и при хроническом течении болезни выявляются в крови пожизненно. При перенесенном гепатите С титр антител класса IgG постепенно снижается и может достигнуть неопределяемых величин через несколько лет после выздоровления.
Anti-HCV IgM —антитела класса IgM к антигенам вируса гепатита C. Anti-HCV IgM могут определяться в крови уже через 4-6 недель после инфицирования, их концентрация быстро достигает максимума. После завершения острого процесса уровень IgM падает и может повышается вновь во время реактивации инфекции, поэтому принято считать, что эти антитела являются признаком острой инфекции или хронической с признаками реактивации. При остром гепатите С длительное обнаружение антител класса М, является фактором, прогнозирующим переход заболевания в хроническую форму. Считается, что обнаружение anti-HCV IgM может отражать уровень виремии и активность гепатита С, однако не всегда при реактивации ХВГС anti-HCV IgM выявляются. Также есть случаи, когда при хроническом гепатите С в отсутствии реактивации обнаруживаются anti-HCV IgM .
В большинстве случаев, наличие anti-HCV IgM указывает на текущую инфекцию. При хроническом гепатите С антитела класса М могут свидетельствовать об обострении процесса. При проведении терапии интерфероном наблюдение за anti-HCV IgM в динамике позволяет оценивать эффективность лечения.
Неструктурные (NS3, NS4, NS5) белки.
NS3, NS4, NS5 относятся к неструктурным (NS — nonstructural ) белкам. На самом деле, этих белков больше — NS2, NS3, NS4a, NS4b, NS5a, NS5b, однако в большинстве клинико-диагностических лабораторий определяют антитела к белкам NS3, NS4 и NS5.
Anti-NS3 выявляются на самых ранних этапах сероконверсии. Высокие титры anti-NS3 характерны при остром гепатите С и могут являться самостоятельным диагностическим маркером острого процесса. При остром процессе высокая концентрация anti-NS3 обычно свидетельствует о значительной вирусной нагрузке, а длительное сохранение их в острой фазе связано с высоким риском хронизации инфекционного процесса.
Anti -NS4 и anti-NS5, как правило, появляются в более поздние сроки. При ХВГС определение anti-NS4 в высоких титрах может свидетельствовать о длительности инфекционного процесса и, по некоторым данным, имеет связь со степенью поражения печени. Выявление anti-NS5 в высоких титрах часто свидетельствует о присутствии вирусной РНК, а в острой стадии является предиктором хронизации инфекционного процесса. Снижение титров NS4 и NS5 в динамике может являться благоприятным признаком, указывающим на формирование клинико-биохимической ремиссии. Титры anti-NS5 могут отражать эффективность ПВТ, причем их повышенные значения характерны для лиц, не отвечающих на терапию. После выздоровления титры anti-NS4 и anti-NS5 снижаются с течением времени. Результаты одного из исследований показали, что почти у половины пациентов через 10 лет после успешного лечения интерферонами, anti-NS4 и anti-NS5 не определялись. В следующей таблице приведены наиболее вероятные варианты трактовки сочетания маркеров гепатита С.
В ответ на попадание в организм человека инородных частиц, таких, как вирусы, иммунная система вырабатывает иммуноглобулины защитные антитела. Эти антитела выявляют специальным анализом методом ИФА, скрининговым исследованием, используемым для установления факта инфицирования человека вирусом гепатита С. Для гепатита С все антитела содержат аббревиатуру anti-HCV, что означает против вируса гепатита С.
Антитела гепатита С бывают двух классов G и M, что в анализах пишется, как IgG и IgM (Ig immunoglobulin (иммуноглобулин) это латинское название антител). Anti-HCV total (anti-НСV, анти-hcv) суммарные антитела (классов IgG и IgM) к антигенам вируса гепатита C. Тест на определение этих маркеров проводится всем пациентам, когда хотят проверить, есть ли у них гепатит С. Anti-HCV присутствуют как при остром (они могут обнаруживаться уже с 4 — 6 недели после инфицирования), так и при хроническом гепатите. Anti-HCV total также встречаются у тех, кто переболел гепатитом С и выздоровел самостоятельно. У таких людей данный маркер может обнаруживаться в течение 4 — 8 и более лет после выздоровления.
Поэтому положительный анализ на anti-HCV не является достаточным для того, чтобы установить диагноз. На фоне хронической инфекции суммарные антитела выявляются постоянно, а после успешного лечения сохраняются длительное время (прежде всего за счет anti-HCV core IgG, о них написано ниже), при этом их титры постепенно снижаются.
Спектр anti-НСV (core, NS3, NS4, NS5) это специфические антитела к отдельным структурным и неструктурным белкам вируса гепатита С. Их определяют для суждения о вирусной нагрузке, активности инфекции, риске хронизации, разграничении острого и хронического гепатита, степени поражения печени. Обнаружение антител к каждому из антигенов имеет самостоятельное диагностическое значение. Anti-HCV состоят их структурных (core) и неструктурных (NS3, NS4, NS5) белков (протеинов).
Anti-HCV core IgG антитела класса G к ядерным (core) белкам HCV. Anti-HCV IgG появляются с 11-12 недели после инфицирования, поэтому для диагностики возможных свежих случаев инфицирования используют Anti-HCV total, которые появляются раньше. Anti-HCV IgG достигают пика концентрации к 5 — 6 месяцу с момента инфицирования и при хроническом течении болезни выявляются в крови пожизненно. При перенесенном гепатите С титр антител класса IgG постепенно снижается и может достигнуть неопределяемых величин через несколько лет после выздоровления.
Неструктурные (NS3, NS4, NS5) белки.
NS3, NS4, NS5 относятся к неструктурным (NS nonstructural) белкам. На самом деле, этих белков больше NS2, NS3, NS4a, NS4b, NS5a, NS5b, однако в большинстве клинико-диагностических лабораторий определяют антитела к белкам NS3, NS4 и NS5.
Anti-NS3 выявляются на самых ранних этапах сероконверсии. Высокие титры anti-NS3 характерны при остром гепатите С и могут являться самостоятельным диагностическим маркером острого процесса. При остром процессе высокая концентрация anti-NS3 обычно свидетельствует о значительной вирусной нагрузке, а длительное сохранение их в острой фазе связано с высоким риском хронизации инфекционного процесса.
Anti -NS4 и anti-NS5, как правило, появляются в более поздние сроки. При ХВГС определение anti-NS4 в высоких титрах может свидетельствовать о длительности инфекционного процесса и, по некоторым данным, имеет связь со степенью поражения печени. Выявление anti-NS5 в высоких титрах часто свидетельствует о присутствии вирусной РНК, а в острой стадии является предиктором хронизации инфекционного процесса. Снижение титров NS4 и NS5 в динамике может являться благоприятным признаком, указывающим на формирование клинико-биохимической ремиссии. Титры anti-NS5 могут отражать эффективность ПВТ, причем их повышенные значения характерны для лиц, не отвечающих на терапию. После выздоровления титры anti-NS4 и anti-NS5 снижаются с течением времени. Результаты одного из исследований показали, что почти у половины пациентов через 10 лет после успешного лечения интерферонами, anti-NS4 и anti-NS5 не определялись. В следующей таблице приведены наиболее вероятные варианты трактовки сочетания маркеров гепатита С.
Подготовка пациента: Сдача крови натощак.
Стабильность пробы: не более 3 суток при температуре 2-8 C при условии отсутствия микробной контаминации и не более 3 месяцев при температуре -20 C. Замораживать не более одного раза.
Анализатор: Sinnowa ER-500.
Тест система: VitroTest.
Референсные значения (норма):
Когда происходит заражение, продуцируются антитела к вирусу гепатита С. Подобное явление говорит о том, что организм старается справиться с возбудителем. Когда анализы показали наличие антител, то есть иммуноглобулинов, то у любого человека сразу возникнет беспокойство по поводу дальнейшего развития ситуации. Врачи советуют преждевременно не паниковать, потому что с помощью одного анализа окончательный диагноз не ставится. Тем более есть факторы, которые могут результаты искажать.
От инфекционного недуга не застрахован ни один человек. В большинстве случаев болезнь развивается при отсутствии симптоматики. Но как только чужеродные элементы попадают в организм, включаются защитные силы. Другими словами, вырабатываются антитела к гепатиту С. Они не дают вредоносному вирусу в крови дальше распространяться.
Поскольку существует несколько генотипов возбудителя, то бороться с ними будут антитела разных видов гепатита С.
Речь идет об иммуноглобулинах:
Суммарные иммуноглобулины образовываются в крови в разное время.
- На протяжении первых полутора месяцев в крови быстро увеличивается количество IgM. Это значит, что болезненный процесс обостряется, из-за чего появляются антитела к вирусу гепатита С. Несколько месяцев заболевание протекает скрытно. После того как наступил пик концентрации иммуноглобулинов, их количество в крови начинает уменьшаться. Далее, наблюдается развитие следующего этапа.
- Антитела против инфекции при гепатите С, которые имеют название IgG, появятся спустя 3 месяца с момента инфицирования. Однако суммарные показатели иммуноглобулинов группы G бывают обнаружены и месяца через два. Существует норма концентрации IgG в крови. Если анализ демонстрирует, что она присутствует, это свидетельствует об окончании острой фазы. Но при этом следует быть готовым к появлению хронической формы либо к тому, что больной станет вирусоносителем.
Следует сказать, что возбудителем воспроизводятся структурные и неструктурные белки.
Наличие в крови определенного вида белка, в частности структурного core-антигена, вызывает ответную реакцию – появляются антитела конкретного вида при гепатите С.
Если иммуноглобулины обнаружены в чрезмерном количестве, значит, имеется много неструктурных белков.
Болезнь протекает волнообразно.
Фаз при этом существует три:
- Латентная. Никакие выраженные клинические проявления того, что инфекция в крови присутствует, не наблюдаются. Но, с другой стороны, анализ покажет наличие иммуноглобулинов группы G к белку core и к другим белкам – неструктурным. Титр антител к вирусу высокий. Отличие фазы в том, что не обнаруживаются маркеры IgM и РНК возбудителя. Правда, их концентрация все же может быть, хотя и незначительной. Такое происходит, если болезнь обостряется.
- Острая. В сыворотке крови становится больше печеночных ферментов. Антитела IgM и IgG при гепатите С присутствуют, при этом отмечается нарастание их титров. Кроме того, имеются антитела к РНК возбудителя гепатита С.
- Фаза реактивации (восстановления). Отличается специфическими проявлениями. Активность печеночных ферментов повышается. Наблюдаются высокие титры IgG и РНК вируса. Позже будет обнаружено постепенное увеличение количества IgM.
Данный вид заболевания опасен тем, что он непредсказуем. Поэтому возникает необходимость в определенных исследованиях, которые помогут изучить происходящий процесс.
В лабораторных условиях проводится иммуноферментный анализ (ИФА), а также применяется ПЦР – полимеразная цепная реакция.
Если болезнь находится в стадии обострения, антитела опасного гепатита С обнаруживаются с трудом. Врачи в своей практике пользуются методом непрямого и прямого исследования.
- Непрямой способ. С его помощью устанавливается инфицирование и насколько сильной является защитная реакция иммунной системы. Определяется, на какой стадии недуг находится, и когда именно вирус проник в клетки. Если у больного иммунная деятельность понижена, то есть диагностировано наличие ВИЧ или почечной дисфункции, расшифровка покажет ответ ложноотрицательный. Наличие ревматоидных проявлений и пассивная передача антител дает значение ложноположительное.
Если результаты анализа положительные, они все равно должны быть перепроверены. Если исследуются серологические маркеры, и расшифровка демонстрирует ответ негативный, а инфекция присутствует, тогда исследование должно быть продолжено с помощью молекулярного определения РНК вируса. Анализ может выявить его спустя пять дней после инфицирования.
- Метод прямой. Для обнаружения РНК возбудителя в сыворотке крови используется ПЦР. Такой анализ позволяет идентифицировать генотип, а также стадию адсорбции. Расшифровка производится в ранние сроки.
Как уже было сказано, у возбудителя имеется положительно заряженная РНК. Она занимается кодированием 3 структурных белков (среди них core-антиген) и 5 неструктурных. К каждому белку формируются соответствующие иммуноглобулины.
Анализ крови дает возможность обнаружить их и узнать, есть ли инфекция в организме. Расшифровка анализа даст ответ, насколько болезнь успела распространиться. Это покажет количество иммуноглобулинов.
Методика иммуноферментного анализа помогает выявить маркеры, то есть антитела к недугу. Если человек стал вирусоносителем хронической формы, то наблюдаются высокие титры иммуноглобулинов. Если их концентрация снижается, значит, лечение проходит успешно.
Окончательно диагностировать заболевание с помощью ИФА нельзя. Одного этого анализа будет недостаточно. Должны быть и другие лабораторные исследования.
Немного стоит сказать об обнаружении белка core. Его присутствие в крови говорит о случившемся заражении. С момента инфицирования может пройти несколько дней, и уже тогда core-антиген выявляется.
При этом маркеры (антитела) отсутствуют. Другими словами, даже на ранней стадии есть возможность с помощью анализа получить подтверждение заражения. Для определения core-антигена используются комбинированные наборы реагентов. Результат анализа может быть как отрицательным, так и положительным.
Правильный диагноз устанавливается только благодаря тщательному обследованию. Поэтому стоит сохранять максимум спокойствия до получения результатов.
источник
Определение в крови иммуноглобулинов IgG к белкам вируса гепатита С, которое используется для диагностики этого заболевания.
Антитела к белкам гепатита С;
Antibodies to structural and non-structural proteins of HCV;
Иммуноферментный анализ (ИФА).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Исключить из рациона жирную пищу в течение 24 часов до исследования;
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Гепатит С – вирусное заболевание печени, отличительной чертой которого является бессимптомное течение и высокая частота прогрессии в хронический гепатит, цирроз печени и гепатоцеллюлярную карциному. Основной путь передачи гепатита С – через кровь и ее компоненты. Группы риска по заражению ВГС:
- Медицинские работники;
- Люди, использующие инъекционные наркотики;
- Пациенты с ВИЧ;
- Люди, которым были сделаны татуировки с помощью нестерильных инструментов;
- Пациенты, получившие переливание крови или ее компонентов до 1992 г.;
- Пациенты, получившие трансфузию факторов свертывания крови до 1987 г.;
- Пациенты, получающие лечение гемодиализом в течение длительного времени;
- Дети, рождённые от матерей с ВГС.
Следует отметить, что по крайней мере в 20 % случаев источник заражения установить не удается. В России наблюдается рост заболеваемости гепатитом С: в период с 1999 по 2011 гг. заболеваемость хроническим ВГС выросла в 3 раза. Как правило, пациенты с ВГС не догадываются о своем заболевании.
Вирус гепатита С (ВГС) – РНК-вирус, принадлежащий семейству Flaviviridae. При транскрипции его генома образуется единый белок длиной около 3000 аминокислот, который затем разрезается с помощью пептидаз клетки-хозяина и вирусных пептидаз с образованием структурных и неструктурных белков:
- Структурные белки (коровый белок, Е1 и Е2, от англ. envelope glycoproteins – гликопротеины оболочки) необходимы для формирования вирусного капсида;
- Неструктурные белки (p7, NS2, NS3, NS4A, NS4B, NS5A и NS5B, от англ. non-structural – неструктурные) выполняют различные регуляторные функции.
В ответ на заражение вирусом гепатита С в организме человека начинают вырабатываться антитела – иммуноглобулины M и G, которые можно исследовать для диагностики гепатита. Следует отметить, что при гепатите С синтез иммуноглобулинов М может наблюдаться на разных стадиях заболевания, как при остром, так и при хроническом гепатите, и поэтому не имеет никакого диагностического значения. Это важное отличие диагностики гепатита С от гепатита В (выявление иммуноглобулинов М при гепатите В наблюдается только в острую стадию). Таким образом, все серологические тесты для диагностики гепатита С основаны на выявлении иммуноглобулинов G к белкам этого вируса.
Структурные и неструктурные белки иммуногенны в разной степени. Показано, что наиболее выраженными иммуногенными свойствами обладают следующие белки (в скобках указан процент пациентов с хроническим гепатитом С, у которых в крови обнаруживаются антитела к указанному белку):
Менее иммуногенны белки E2 (31 %), NS4A(28 %) и E1 (22 %). NS2 и NS5B имеют очень слабые иммуногенные свойства, и антитела к ним у пациентов с ВГС выявляются редко.
Антитела к ВПС могут быть определены в крови приблизительно через 8 недель после первичного заражения. Ложноотрицательные результаты могут наблюдаться у людей с иммунодефицитом (например, ВИЧ-инфицированных), почечной недостаточностью и эссенциальной смешанной криоглобулинемией. Ложноположительные результаты также встречаются.
Вирусы гепатита С неоднородны по генетическому составу. На этом основании выделяют 6 генотипов ВПГ, геномы которых различаются на 30-35 %, и множество подтипов, различающихся на 20-25 %. В восточной Европе и США чаще встречаются генотипы 1a и 1b, тогда как для других стран характерны другие генотипы (например, Египет – генотип 4, Южная Африка – генотип 5). Показано, что иммунный ответ пациентов, инфицированных разными генотипами ВГС, различается. Это особенно справедливо в отношении антител к белкам E1, E2, NS3, NS4A и NS5A.
Качественный и количественный состав антител к ВГС у пациента остается достаточно постоянным в течение заболевания, в том числе и после проведенного лечения.
Антитела к гепатиту С – чувствительный, но недостаточно специфичный метод диагностики этого заболевания. Поэтому серологические тесты – это скрининговые тесты диагностики гепатита. При получении положительного результата исследования антител на гепатит С обязательно проводят подтверждающее исследование – анализ на РНК вируса с помощью полимеразной цепной реакции в реальном времени (РТ-ПЦР). Кроме того, при подтверждении диагноза «гепатит С» может понадобиться генотипирование ВГС и гистологическое исследование печени или неинвазивные методы определения состояния печени (такие как ФиброМакс).
Для чего используется исследование?
- Для диагностики гепатита С.
Когда назначается исследование?
- При профилактическом обследовании, особенно если пациент принадлежит к группе риска по гепатиту С;
- в некоторых случаях при устройстве на работу.
- гепатит С;
- ложноположительный результат (чаще у пациентов, не относящихся к группам риска, например доноров крови).
- норма;
- ложноотрицательный результат (сопутствующая ВИЧ-инфекция, почечная недостаточность, эссенциальная смешанная криоглобулинемия).
Что может влиять на результат?
- Время, прошедшее с момента заражения;
- Состояние иммунной системы;
- Сопутствующие заболевания почек;
- Генотип вируса гепатита С.
- Это скрининговый тест. При получении положительного результата необходим дополнительный, подтверждающий тест (определение РНК вируса с помощью ПЦР);
- результаты анализа следует интерпретировать с учетом дополнительных клинических, лабораторных и инструментальных данных.
Кто назначает исследование?
Инфекционист, терапевт, врач общей практики.
источник

Гепатиту С свойственно вялотекущее течение, длительный период без проявления основных симптомов заболевания и высокий риск осложнений. Болезнь долгое время себя никак не выдает и может быть раскрыта только тестом на антитела к гепатиту С и другими маркерами.
Поражаются вирусом гепатоциты (клетки печени), он вызывает их дисфункцию и деструкцию. Постепенно, пройдя этап хронизации, заболевание приводит к летальному исходу человека. Своевременная диагностика больного на антитела гепатита С способна приостановить развитие болезни, улучшить качество и продолжительность жизни пациента.
Вирус гепатита С впервые был выделен в конце 20 века. Медицина сегодня различает шесть вариаций вируса и более чем сто его подтипов. Определение разновидности микроба и его подтипа у человека очень важно, так как они определяют течение болезни и, следовательно, подходы к ее лечению.
С момента первичного попадания вируса в кровь человека до появления первых симптомов проходит от 2 до 20 недель. Более чем у четырех пятых всех заболевших острая инфекция развивается без каких-либо симптомов. И лишь в одном из пяти случаев возможно развитие острого процесса с характерной яркой клинической картиной по всем правилам перенесения желтухи. Хроническое течение инфекция приобретает более чем у половины заболевших, далее переходя в цирроз печени.
Выявленные вовремя антитела к вирусу гепатита С способны диагностировать заражение на самой первичной его стадии и подарить пациенту шанс на полное излечение.

Вирус данного заболевания в своей структуре содержит ряд белковых компонентов. При попадании в организм человека эти белки вызывают реакцию иммунной системы и к ним образуются антитела на гепатит С. Выделяют разные типы антител, в зависимости от типа исходного белка. Они определяются лабораторно в разные периоды времени и диагностируют различные стадии заболевания.
Чтобы обнаружить антитела к гепатиту С, человеку в лаборатории производят забор венозной крови. Данное исследование удобно тем, что не требует какой-либо предварительной подготовки, кроме воздержания от приема пищи за 8 часов до процедуры. В стерильной пробирке сохраняется кровь обследуемого, после методом иммуноферментного анализа (ИФА), основанного на связи антиген-антитело, выявляются соответствующие иммуноглобулины.
Анализ на антитела к гепатиту С является вариантом первичного скрининга наличия данной инфекции у человека.
Показания к проведению диагностики:
- нарушения в работе печени, жалобы пациента;
- повышение индикаторов работы печени в биохимическом анализе — трансаминаз и фракций билирубина;
- предоперационное обследование;
- планирование беременности;
- сомнительные данные УЗИ—диагностики органов брюшной полости, в частности печени.

Есть ряд случаев, когда вероятны как ложноотрицательные, так и ложноположительные итоги диагностики. Поэтому после консультации со специалистом рекомендуется повторить сомнительный анализ.
Если обнаружены антитела к гепатиту С, настраиваться на худшее не стоит. Следует обратиться за консультацией к профильному специалисту и провести дополнительные обследования.
В зависимости от антигена, к которому они сформированы, антитела при гепатите С делятся на группы.
Это основной тип антител, определяемых для диагностики заражения при первоначальном скрининге у пациентов. «Данные маркеры гепатита С, что это такое?» — спросит у врача любой пациент.
Если эти антитела к гепатиту С положительные, то это говорит о том, что иммунная система сталкивалась с данным вирусом прежде, может присутствовать вялотекущая форма заболевания без яркой клинической картины. В момент взятия проб не происходит активная репликация вируса.
Обнаружение данных иммуноглобулинов в крови человека является поводом дополнительного обследования (выявление РНК возбудителя гепатита С).
Этот тип маркеров начинает выделяться сразу после попадания патогенного микроорганизма в организм человека. Лабораторно его можно отследить через месяц после случая заражения. Если обнаружены антитела к гепатиту С класса М, то диагностируют острую фазу. Количество этих антител увеличивается в момент ослабления иммунитета и активации вируса при хроническом процессе заболевания.
При снижении активности возбудителя и переходе заболевания в хроническую форму данный вид антител может перестать диагностироваться в крови при проведении исследований.
В практических ситуациях чаще обращаются именно к данному типу исследования. Антитела к вирусу гепатита С суммарные представляют собой обнаружение обоих классов маркеров, как М, так и G. Данный анализ становится информативен после накопления первого класса антител, то есть через 3-6 недель после факта заражения. Через два месяца в среднем после этой даты начинают активно вырабатываться иммуноглобулины G класса. Они определяются в крови болеющего человека всю жизнь или до момента ликвидации вируса.
Суммарные антитела к гепатиту С являются универсальным способом первичного скрининга заболевания через месяц после заражения человека.

Антитела к элементам NS3 обнаруживаются на самом первой стадии. Характеризуют первичное взаимодействие с патогеном и служат самостоятельным индикатором наличия инфекции. Длительное сохранение этих титров в большом объеме может быть индикатором повышенного риска перехода инфекции в хроническую форму.
Антитела к элементам NS4 и NS5 обнаруживаются в поздние периоды развития заболевания. Первый из которых свидетельствует об уровне поражения печени, второй — о запуске хронических механизмов инфекции. Уменьшение титров обоих показателей будет положительным знаком наступления ремиссии.
На практике наличие в крови неструктурных антител гепатита С проверяют редко, так как это значительно повышает стоимость исследования. Чаще для изучения состояния печени используются антитела core к гепатиту С.
В медицинской практике есть еще несколько показателей, по которым судят о наличии у пациента вируса гепатита С.
Возбудитель гепатита С — РНК—содержащий, поэтому можно ПЦР-способом с обратной транскрипцией провести обнаружение самого гена возбудителя в крови или биоматериале, взятом при биопсии печени.
Данные тест—системы очень чувствительны и могут определить даже одну единственную частицу вируса в материале.
Этим способом возможно не только диагностировать болезнь, но и определить ее тип, что помогает выработать план будущего лечения.
Если пациент получил результаты анализа на обнаружение гепатита С иммуноферментным методом (ИФА), он может задаться вопросом — антитела гепатита С, что это? И что они показывают?
При исследовании биоматериала на гепатит С, антитела суммарные в норме не обнаруживаются.
Для количественной оценки в медицинской практике используется коэффициент позитивности R. Он отражает оптическую плотность образца в биоматериале. При его значении больше 1 результат признается положительным. Если он менее 0,8 — то считается отрицательным. Значение R от 0,8 до 1 является сомнительным и требует дополнительной диагностики.
Рассмотрим примеры ИФА анализов на гепатит С и их интерпретации:
| Результаты анализов | Интерпретация |
|---|---|
| HСV IgG cor 16.45 (положительно) Аnti-HСV IgG NS3 14,48 (положительно) Аnti-НCV IgG NS4 16,23 (положительно) Аnti-НCV IgG NS5 0,31 (отрицательно) | В крови имеются высоки титры антител к вирусу гепатита С. Вероятно наличие заболевания. Необходима ПЦP-диагностика для подтверждения диагноза и определения типа возбудителя. |
| Аnti-НCV IgG cоr 0.17 (отрицательно) Аnti-НCV IgG NS3 0.09 (отрицательно) Аnti-НCV IgG NS4 8.25 (положительно) Аnti-НCV IgG NS5 0.19 (отрицательно) НBsАg (австралийский антиген) 0.43 (отрицательно) Антитела IgM к НАV 0.283 (отрицательно) | Присутствуют антитела в крови к гепатиту С. Сомнительный результат. Для уточнения диагноза необходимо провести ПЦP-диагностику |
Как видно из таблицы, если все-таки обнаружены антитела к гепатиту С, то расшифровка анализа должна проводится только специалистом. В зависимости от типа маркеров, выявленных в биологическом материале обследуемого, можно говорить о наличии заболевания и стадии его развития.
Иммуноферментный метод является достаточно точным и в большинстве случаев отражает истинную клиническую картину состояния больного. Однако и ему иногда свойственны ложноотрицательные и ложноположительные результаты.

Ложноотрицательные результаты анализа практически не встречаются, и могут проявиться у пациентов с иммунодефицитом и у принимающих иммуноподавляющие препараты.
Сомнительным признается результат при наличии клинических признаков заболевания у обследуемого, но отсутствия маркеров в крови. Такая ситуация возможно при ранней диагностике методом ИФА, когда антитела еще не успели выработаться в крови у человека. Рекомендуется провести повторную диагностику через месяц после первой и контрольный анализ через шесть месяцев.
Если обнаружены антитела к гепатиту С положительные, то они могут свидетельствовать и о ранее перенесенном гепатите С пациентом. В 20% случаев данное заболевание переносится латентно и не переходит в хроническую форму.
Но вот как быть, если какие-то иммуноглобулины были все-таки выявлены? Не паниковать и не расстраиваться! Нужна очная консультация профильного специалиста. Только он способен компетентно расшифровать обозначенные маркеры.
Квалифицированный врач всегда проверит у пациента все возможные варианты ложноотрицательных и ложноположительных результатов в соответствии с его анамнезом.

Также проводится дополнительная диагностика состояния пациента спустя шесть месяцев после первой сдачи крови.
И только по расширенному списку анализов, очной консультации специалиста и подтвержденных результатов через промежуток времени можно диагностировать заражение обследуемого вирусом.
При этом вместе с определением маркеров в крови целесообразно назначить контроль состояния пациента методом ПЦР. Анализ на антитела к гепатиту С не является абсолютным критерием наличия заболевания. Необходимо анализировать и общую клиническую картину состояния человека.
В следующем видео — дополнительная информация об анализе на антитела к гепатиту С:
Антитела к вирусу гепатита С в крови человека дают развернутую информацию о контакте его с этим возбудителем заболевания. В зависимости от типов маркеров специалист всегда определит стадию заболевания, тип возбудителя и предложит наилучший план лечения.
При эффективно подобранной терапии и ранней диагностике инфекции методом ИФА возможно предотвратить переход болезни в хроническую стадию. Поэтому проходить скрининговые исследования на обнаружение антител в крови к гепатиту С периодически показано всем.
источник
Белки — это высокомолекулярные органические соединения, биополимеры, построенные из 20 видов L-?-аминокислотных остатков, соединенных в определенной последовательности в длинные цепи. Молекулярная масса белков варьируется от 5 тысяч до 1 миллиона. Название «белки» впервые было дано веществу птичьих яиц, свертывающемуся при нагревании в белую нерастворимую массу. Позднее этот термин был распространен на другие вещества с подобными свойствами, выделенные из животных и растений.
Рис. 1. Наиболее сложными биополимерами являются белки. Их макромолекулы состоят из мономеров, которыми являются аминокислоты. Каждая аминокислота имеет две функциональные группы: карбоксильную и аминогруппу. Все разнообразие белков создается в результате различных сочетаний 20 аминокислот.
Белки преобладают над всеми другими присутствующими в живых организмах соединениями, составляя, как правило, более половины их сухого веса. Предполагается, что в природе существует несколько миллиардов индивидуальных белков (например, только в бактерии кишечной палочки присутствует более 3 тысяч различных белков).
Белки играют ключевую роль в процессах жизнедеятельности любого организма. К числу белков относятся ферменты, при участии которых протекают все химические превращения в клетке (обмен веществ); они управляют действием генов; при их участии реализуется действие гормонов, осуществляется трансмембранный транспорт, в том числе генерация нервных импульсов. Они являются неотъемлемой частью иммунной системы (иммуноглобулины) и системы свертывания крови, составляют основу костной и соединительной ткани, участвуют в преобразовании и утилизации энергии.
Первые попытки выделить белки были предприняты еще в 18 веке. К началу 19 века появляются первые работы по химическому изучению белков. Французские ученые Жозеф Луи Гей-Люссак и Луи Жак Тенар попытались установить элементный состав белков из разных источников, что положило начало систематическим аналитическим исследованиям, благодаря которым был сделан вывод о том, что все белки сходны по набору элементов, входящих в их состав. В 1836 голландский химик Г. Я. Мульдер предложил первую теорию строения белковых веществ, согласно которой все белки имеют некий гипотетический радикал (С40H62N10O12), связанный в различных пропорциях с атомами серы и фосфора. Он назвал этот радикал «протеином» (от греческого protein — первый, главный). Теория Мульдера способствовала увеличению интереса к изучению белков и совершенствованию методов белковой химии. Были разработаны приемы выделения белков путем экстракции растворами нейтральных солей, впервые были получены белки в кристаллической форме (гемоглобин, некоторые белки растений). Для анализа белков стали использовать их предварительное расщепление с помощью кислот и щелочей.
Одновременно все большее внимание стало уделяться изучению функции белков. Йенс Якоб Берцелиус в 1835 первым высказал предположение о том, что они играют роль биокатализаторов. Вскоре были открыты протеолитические ферменты — пепсин (Т. Шванн, 1836) и трипсин (Л. Корвизар, 1856), что привлекло внимание к физиологии пищеварения и анализу продуктов, образующихся в ходе расщепления пищевых веществ. Дальнейшие исследования структуры белка, работы по химическому синтезу пептидов завершились появлением пептидной гипотезы, согласно которой все белки построены из аминокислот. К концу 19 века было изучено большинство аминокислот, входящих в состав белков.
В начале 20 века немецкий химик Эмиль Герман Фишер впервые применил методы органической химии для изучения белков и доказал, что белки состоят из ?-аминокислот, связанных между собой амидной (пептидной) связью. Позже, благодаря использованию физико-химических методов анализа, была определена молекулярная масса многих белков, установлена сферическая форма глобулярных белков, проведен рентгеноструктурный анализ аминокислот и пептидов, разработаны методы хроматографического анализа (см. хроматография).
Был выделен первый белковый гормон — инсулин (Фредерик Грант Бантинг, Джон Джеймс Рикард Маклеод, 1922), доказано присутствие гамма -глобулинов в антителах, описана ферментативная функция мышечного белка миозина (Владимир Александрович Энгельгардт, М. Н. Любимова, 1939). Впервые в кристаллическом виде были получены ферменты — уреаза (Дж. Б. Салинер, 1926), пепсин (Дж. Х. Нортрон, 1929), лизоцим (Э. П. Абрахам, Роберт Робинсон, 1937).
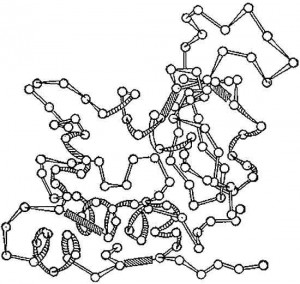
Рис. 2. Схема трёхмерной структуры фермента лизоцима. Кружки — аминокислоты; тяжи — пептидные связи; заштрихованные прямоугольники — дисульфидные связи. Видны спирализованные и вытянутые участки полипептидной цепи.
В 1950-х годах была доказана трехуровневая организация белковых молекул — наличие у них первичной, вторичной и третичной структуры; создали автоматический анализатор аминокислот (Станфорд Мур, Уильям Хауард Стайн, 1950). В 60-х годы были предприняты попытки химического синтеза белков (инсулин, рибонуклеаза). Существенно усовершенствовались методы рентгеноструктурного анализа; был создан прибор — секвенатор (П. Эдман, Г. Бэгг, 1967), позволявший определять последовательность аминокислот в полипептидной цепи. Следствием этого явилось установление структуры нескольких сотен белков из самых разных источников. Среди них протеолитические ферменты (пепсин, трипсин, химотрипсин, субтилизин, карбоксипептидазы), миоглобины, гемоглобины, цитохромы, лизоцимы, иммуноглобулины, гистоны, нейротоксины, белки вирусных оболочек, белково-пептидные гормоны. В результате появились предпосылки для решения актуальных проблем энзимологии, иммунологии, эндокринологии и других областей биологической химии.
В конце 20 века значительные успехи были достигнуты в изучении роли белков в ходе матричного синтеза биополимеров, понимания механизмов их действия в различных процессах жизнедеятельности организмов, установления связи между их структурой и функцией. Огромное значение при этом имело совершенствование методов исследования, появление новых способов для разделения белков и пептидов.
Разработка эффективного метода анализа последовательности расположения нуклеотидов в нуклеиновых кислотах позволила значительно облегчить и ускорить определение аминокислотной последовательности в белках. Это оказалось возможным потому, что порядок расположения аминокислот в белке определяется последовательностью нуклеотидов в кодирующем этот белок гене (фрагменте ДНК). Следовательно, зная расстановку нуклеотидов в этом гене и генетический код, можно безошибочно предсказать, в каком порядке располагаются аминокислоты в полипептидной цепи белка. Наряду с успехами в структурном анализе белков значительные результаты были достигнуты в изучении их пространственной организации, механизмов образования и действия надмолекулярных комплексов, в том числе рибосом и других клеточных органелл, хроматина, вирусов и т. д.
Практически все белки построены из 20 ?-аминокислот, принадлежащих к L-ряду, и одинаковых практически у всех организмов. Аминокислоты в белках соединены между собой пептидной связью —СО—NH—, которая образуется карбоксильной и ?-аминогруппой соседних аминокислотных остатков: две аминокислоты образуют дипептид, в котором остаются свободными концевые карбоксильная (—СООН) и аминогруппа (H2N—), к которым могут присоединяться новые аминокислоты, образуя полипептидную цепь.
Участок цепи, на котором находится концевая Н2N-группа, называют N-концевым, а противоположный ему — С-концевым. Огромное разнообразие белков определяется последовательностью расположения и количеством входящих в них аминокислотных остатков. Хотя четкого разграничения не существует, короткие цепи принято называть пептидами или олигопептидами (от олиго…), а под полипептидами (белками) понимают обычно цепи, состоящие из 50 и более аминокислот. Наиболее часто встречаются белки, включающие 100-400 аминокислотных остатков, но известны и такие, молекула которых образована 1000 и более остатками. Белки могут состоять из нескольких полипептидных цепей. В таких белках каждая полипептидная цепь носит название субъединицы.
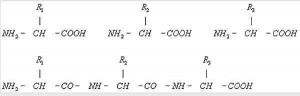
Рис. 3. Белок всех организмов состоит из 20 видов аминокислот. Каждый белок характеризуется определённым ассортиментом и количественным соотношением аминокислот. В молекулах белков аминокислоты соединены между собой пептидными связями (— СО — NH —) в линейной последовательности, составляющей так называемую первичную структуру белка. Верхняя строка — свободные аминокислоты с боковыми группами R1, R2, R3; нижняя строка — аминокислоты соединены пептидными связями.
Полипептидная цепь способна самопроизвольно формировать и удерживать особую пространственную структуру. Исходя из формы белковых молекул белки делят на фибриллярные и глобулярные. В глобулярных белках одна или несколько полипептидных цепей свернуты в компактную структуру сферической формы, или глобулу. Обычно эти белки хорошо растворимы в воде. К их числу относятся почти все ферменты, транспортные белки крови и многие запасные белки. Фибриллярные белки представляют собой нитевидные молекулы, скрепленные друг с другом поперечными связями и образующие длинные волокна или слоистые структуры. Они обладают высокой механической прочностью, нерастворимы в воде и выполняют главным образом структурные и защитные функции. Типичными представителями таких белков являются кератины волос и шерсти, фиброин шелка, коллаген сухожилий.
Порядок расположения ковалентно связанных аминокислот в полипептидной цепи называют аминокислотной последовательностью, или первичной структурой белков. Первичная структура каждого белка, кодируемая соответствующим геном, постоянна и несет в себе всю информацию, необходимую для формирования структур более высокого уровня. Потенциально возможное число белков, которые могут образоваться из 20 аминокислот, практически не ограничено.
В результате взаимодействия боковых групп аминокислотных остатков отдельные относительно небольшие участки полипептидной цепи принимают ту или иную конформацию (тип укладки), известную как вторичная структура белков. Наиболее характерными элементами ее являются периодически повторяющиеся ?-спираль и ?-структура. Вторичная структура весьма стабильна. Так как она в значительной мере определяется аминокислотной последовательностью соответствующего участка белка, становится возможным ее предсказание с определенной степенью вероятности. Термин «?-спираль» был введен американским биохимиком, физиком и химиком Лайнусом Карлом Полингом, описавшим укладку полипептидной цепи в белке ?-кератине в виде правосторонней спирали (?-спираль можно сравнить со шнуром от телефонной трубки). На каждый виток такой спирали в белке приходится 3,6 аминокислотных остатков. Это означает, что группа —С= О одной пептидной связи образует водородную связь с группой —NH другой пептидной связи, отстоящей от первой на четыре аминокислотных остатка. В среднем каждый ?-спиральный участок включает до 15 аминокислот, что соответствует 3-4 оборотам спирали. Но в каждом отдельном белке длина спирали может сильно отличаться от этой величины. В поперечном сечении ?-спираль имеет вид диска, от которого наружу направлены боковые цепи аминокислот.
?-структура, или ? -складчатый слой, может быть образована несколькими участками полипептидной цепи. Эти участки растянуты и уложены параллельно друг другу, связываясь между собой водородными связями, которые возникают между пептидными связями. Они могут быть ориентированы в одном и том же или в противоположных направлениях (направление движения вдоль полипептидной цепи принято считать от N-конца к С-концу). В первом случае складчатый слой называют параллельным, во втором — антипараллельным. Последний образуется, когда пептидная цепь делает резкий поворот вспять, образуя изгиб (? -изгиб). Боковые цепи аминокислот ориентированы перпендикулярно плоскости ? -слоя.
Относительное содержание ? -спиральных участков и ? -структур может широко варьироваться в разных белках. Существуют белки с преобладанием ?-спиралей (около 75% аминокислот в миоглобине и гемоглобине), а основным типом укладки цепи во многих фибриллярных белках (в том числе фиброин шелка, ?-кератин) является ? -структура. Участки полипептидной цепи, которые нельзя отнести ни к одной из вышеописанных конформаций, называют соединительными петлями. Их структура определяется главным образом взаимодействиями между боковыми цепями аминокислот, и в молекуле любого белка она укладывается строго определенным образом.
Третичной структурой называют пространственное строение глобулярных белков. Но часто это понятие относят к характерному для каждого конкретного белка способу сворачивания полипептидной цепи в пространстве. Третичная структура формируется полипептидной цепью белка самопроизвольно, по-видимому, по определенному пути (путям) свертывания с предварительным образованием элементов вторичной структуры. Если стабильность вторичной структуры обусловлена водородными связями, то третичная структура фиксируется разнообразной системой нековалентных взаимодействий: водородными, ионными, межмолекулярными взаимодействиями, а также гидрофобными контактами между боковыми цепями неполярных аминокислотных остатков.
В некоторых белках третичная структура дополнительно стабилизируется за счет образования дисульфидных связей (—S—S—-связей) между остатками цистеина. Как правило, внутри белковой глобулы расположены боковые цепи гидрофобных аминокислот, собранные в ядро (их перенос внутрь глобулы белка выгоден термодинамически), а на периферии находятся гидрофильные остатки и часть гидрофобных. Белковую глобулу окружает несколько сотен молекул гидратной воды, необходимой для стабильности молекулы белка и нередко участвующей в его функционировании. Третичная структура подвижна, отдельные ее участки могут смещаться, что приводит к конформационным переходам, которые играют значительную роль во взаимодействии белка с другими молекулами.
Третичная структура является основой функциональных свойств белка. Она определяет образование в белке ансамблей функциональных групп — активных центров и зон связывания, придает им необходимую геометрию, позволяет создать внутреннюю среду, являющуюся предпосылкой протекания многих реакций, обеспечивает взаимодействие с другими белками.
Третичная структура белков однозначно соответствует его первичной структуре; вероятно, существует еще нерасшифрованный стереохимический код, определяющий характер свертывания белка. Однако один и тот же способ укладки в пространстве обычно соответствует не единственной первичной структуре, а целому семейству структур, в которых совпадать может лишь небольшая доля (до 20-30%) аминокислотных остатков, но при этом в определенных местах цепи сходство аминокислотных остатков сохраняется. Результатом является образование обширных семейств белков, характеризующихся близкой третичной и более или менее сходной первичной структурой и, как правило, общностью функции. Таковы, например, белки организмов разных видов, несущие одинаковую функцию и эволюционно родственные: миоглобины и гемоглобины, трипсин, химотрипсин, эластаза и другие протеиназы животных.
Рис. 4. В результате соединения нескольких белковых макромолекул, обладающих третичной структурой, в сложный комплекс формируется четвертичная структура белка. Примером таких сложных белков является гемоглобин, состоящий из четырех макромолекул.
Нередко, особенно в крупных белках, сворачивание полипептидной цепи проходит через формирование отдельными участками цепи более или менее автономных элементов пространственной структуры — доменов, которые могут обладать функциональной автономией, будучи ответственными за ту или иную биологическую активность белка. Так, N-концевые домены белков системы свертывания крови обеспечивают их присоединение к клеточной мембране.
Существует много белков, молекулы которых представляют собой ансамбль из глобул (субъединиц), удерживаемых вместе за счет гидрофобных взаимодействий, водородных или ионных связей. Такие комплексы называют олигомерными, мультимерными или субъединичными белками. Укладку субъединиц в функционально активном белковом комплексе называют четвертичной структурой белка. Некоторые белки способны образовывать структуры более высоких порядков, например, полиферментные комплексы, протяженные структуры (белки оболочек бактериофагов), надмолекулярные комплексы, функционирующие как единое целое (например, рибосомы или компоненты дыхательной цепи митохондрий).
Четвертичная структура позволяет создать молекулы необычной геометрии. Так, у ферритина, образованного 24 субъединицами, имеется внутренняя полость, благодаря которой белку удается связать до 3000 ионов железа. Кроме того, четвертичная структура позволяет в одной молекуле выполнять несколько различных функций. В триптофансинтетазе совмещены ферменты, ответственные за несколько последовательных стадий синтеза аминокислоты триптофана.
Первичная структура белков определяет все остальные уровни организации белковой молекулы. Поэтому при изучении биологической функции различных белков важно знание этой структуры. Первым белком, для которого была установлена аминокислотная последовательность, был гормон поджелудочной железы — инсулин. Эта работа, потребовавшая 11 лет, была выполнена английским биохимиком Фредериком Сенгером (1954). Он определил расположение 51 аминокислоты в молекуле гормона и показал, что она состоит из 2-х цепей, соединенных дисульфидными связями. Позже большая часть работ по установлению первичной структуры белков была автоматизирована.
С развитием методов генетической инженерии появилась возможность еще более ускорить этот процесс, определяя первичную структуру белков в соответствии с результатами анализа нуклеотидной последовательности в генах, кодирующих эти белки. Вторичную и третичную структуру белков исследуют с помощью достаточно сложных физических методов, например, кругового дихроизма или рентгеноструктурного анализа белковых кристаллов. Третичная структура была впервые установлена английским биохимиком Джоном Коудери Кендрю (1957) для белка мышц — миоглобина.
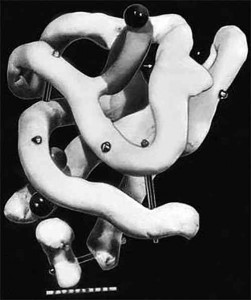
Рис. 5. Модель молекулы миоглобина (пространственная конфигурация молекулы)
Сравнительно слабые связи, ответственные за стабилизацию вторичной, третичной и четвертичной структур белка, легко разрушаются, что сопровождается потерей его биологической активности. Разрушение исходной (нативной) структуры белка, называемое денатурацией, происходит в присутствии кислот и оснований, при нагревании, изменении ионной силы и других воздействиях. Как правило, денатурированные белки плохо или совсем не растворяются в воде. При непродолжительном действии и быстром устранении денатурирующих факторов возможна ренатурация белка с полным или частичным восстановлением исходной структуры и биологических свойств.
Сложность строения белковых молекул, чрезвычайное разнообразие выполняемых ими функций затрудняют создание единой и четкой их классификации, хотя попытки сделать это предпринимались неоднократно, начиная с конца 19 века. Исходя из химического состава белки делят на простые и сложные (иногда их называют протеидами). Молекулы первых состоят только из аминокислот. В составе же сложных белков помимо собственно полипептидной цепи имеются небелковые компоненты, представленные углеводами (гликопротеиды), липидами (липопротеиды), нуклеиновыми кислоты (нуклеопротеиды), ионами металла (металлопротеиды), фосфатной группой (фосфопротеиды), пигментами (хромопротеиды) и т. д.
В зависимости от выполняемых функций различают несколько классов белков. Самый многообразный и наиболее специализированный класс составляют белки с каталитической функцией — ферменты, обладающие способностью ускорять химические реакции, протекающие в живых организмах. В этом качестве белки участвуют во всех процессах синтеза и распада различных соединении в ходе обмена веществ, в биосинтезе белков и нуклеиновых кислот, регуляции развития и дифференцировки клеток. Транспортные белки обладают способностью избирательно связывать жирные кислоты, гормоны и другие органические и неорганические соединения и ионы, а затем переносить их с током крови и лимфы в нужное место (например, гемоглобин участвует в переносе кислорода от легких ко всем клеткам организма). Транспортные белки осуществляют также активный транспорт через биологические мембраны ионов, липидов, сахаров и аминокислот.
Структурные белки выполняют опорную или защитную функцию; они участвуют в формировании клеточного скелета. Наиболее распространены среди них коллаген соединительной ткани, кератин волос, ногтей и перьев, эластин клеток сосудов и многие другие. В комплексе с липидами они являются структурной основой клеточных и внутриклеточных мембран.
Ряд белков выполняет защитную функцию. Например, иммуноглобулины (антитела) позвоночных, обладая способностью связывать чужеродные патогенные микроорганизмы и вещества, нейтрализуют их болезнетворное воздействие на организм, препятствует размножению раковых клеток. Фибриноген и тромбин участвуют в процессе свертывания крови. Многие вещества белковой природы, выделяемые бактериями, а также компоненты ядов змей и некоторых беспозвоночных относятся к числу токсинов.
Некоторые белки (регуляторные) участвуют в регуляции физиологической активности организма в целом, отдельных органов, клеток или процессов. Они контролируют транскрипцию генов и синтез белка; к их числу относятся пептидно-белковые гормоны, секретируемые эндокринными железами. Запасные белки семян обеспечивают питательными веществами начальные этапы развития зародыша. К ним относят также казеин молока, альбумин яичного белка (овальбумин) и многие другие. Благодаря белкам мышечные клетки приобретают способность сокращаться и в конечном итоге обеспечивать движения организма. Примером таких сократительных белков могут служить актин и миозин скелетных мышц, а также тубулин, являющиеся компонентом ресничек и жгутиков одноклеточных организмов; они же обеспечивают расхождение хромосом при делении клеток.
Белки-рецепторы являются мишенью действия гормонов и других биологически активных соединений. С их помощью клеткой воспринимается информация о состоянии внешней среды. Они играют важную роль в передаче нервного возбуждения и в ориентированном движении клетки (хемотаксисе). Преобразование и утилизация энергии, поступающей в организм с пищей, а также энергии солнечного излучения тоже происходит при участии белков биоэнергетической системы (например, зрительного пигмента родопсина, цитохромов дыхательной цепи). Существует также множество белков с другими, порой довольно необычными функциями (например, в плазме крови некоторых антарктических рыб содержатся белки, обладающие свойствами антифриза).
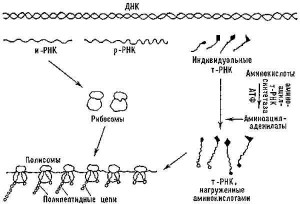
Вся информация о структуре того или иного белка «хранится» в соответствующих генах в виде последовательности нуклеотидов и реализуется в процессе матричного синтеза. Сначала информация с помощью фермента ДНК-зависимой РНК-полимеразы передается (считывается) с молекулы ДНК на матричную РНК (мРНК), а затем в рибосоме на мРНК, как на матрице в соответствии с генетическим кодом при участии транспортных РНК, доставляющих аминокислоты, происходит формирование полипептидной цепи.
Выходящие из рибоcoмы синтезированные полипептидные цепи, самопроизвольно сворачиваясь, принимают свойственную данному белку конформацию и могут подвергаться посттрансляционной модификации. Модификациям могут подвергаться боковые цепи отдельных аминокислот (гидроксилированию, фосфорилированию и т. д.). Именно поэтому в коллагене, например, встречается гидроксипролин и гидроксилизин (см. Аминокислоты). Модификация может сопровождаться и разрывом полипептидных связей. Таким путем, например, происходит образование активной молекулы инсулина, состоящего из двух цепей, соединенных дисульфидными связями.
Рис. 6. Общая схема биосинтеза белков.
Белки являются важнейшими компонентами пищи животных и человека. Пищевая ценность белков определяется содержанием в них незаменимых аминокислот, которые в самом организме не образуются. В этом отношении растительные белки менее ценны, чем животные: они беднее лизином, метионином и триптофаном, труднее перевариваются в желудочно-кишечном тракте. Отсутствие незаменимых аминокислот в пище приводит к тяжелым нарушениям азотистого обмена.
В процессе пищеварения белки расщепляются до свободных аминокислот, которые после всасывания в кишечнике поступают в кровь и разносятся ко всем клеткам. Часть из них распадается до простых соединений с выделением энергии, используемой на разные нужды клеткой, а часть идет на синтез новых белков, свойственных данному организму. (Р. А. Матвеева, Энциклопедия Кирилл и Мефодий)
- амилоидный — amyloid;
- анионный — anionic [cathodic];
- антивирусный — antiviral;
- аутоиммунный — autoimmune;
- аутологичный — autologic;
- бактериальный — bacterial;
- белок Бенс-Джонса — Bence Jones protein;
- вирусиндуцируемый — virus induced;
- вирусный — virus;
- вирусный неструктурный — virus nonstructural;
- вирусный структурный — virus structural;
- вирусоспецифический — virus specific;
- высокомолекулярный — high molecular weight;
- гемсодержащий — heme;
- гетерологичный — foreign [heterologous];
- гибридный — hybrid;
- гликозилированный — glycated;
- глобулярный — globular;
- денатурированный — denaturated;
- железосодержащий — iron;
- желточный — yolk;
- животный белок — animal protein;
- защитный — defensive [protective];
- иммунный — immune;
- иммуногенный — immunologically relevant;
- кальцийсвязывающий — calcium binding;
- кислый — acidic;
- корпускулярный — corpuscular;
- мембранный — membrane;
- миеломный — myeloma;
- микросомный — microsomal;
- белок молока — milk protein;
- моноклональный — monoclonal immunoglobulin;
- мышечный белок — muscle protein;
- нативный — native;
- негистоновый — nonhistone;
- неполноценный — partial [incomplete];
- нерастворимый — insoluble;
- неусвояемый — insoluble;
- неферментный — nonenzyme;
- низкомолекулярный — low molecular weight;
- новый белок — new protein;
- общий — whole [crude];
- онкогенный — oncoprotein;
- белок основной фазы — anionic [cathodic];
- белок острой фазы (воспаления) — protein of acute phase;
- пищевой — food;
- белок плазмы крови — plasma protein;
- плацентарный — placenta;
- разобщающий — uncoupling;
- белок регенерирующего нерва — protein of regenerating nerve;
- регуляторный — regulatory;
- рекомбинационный — recombinant;
- рецепторный — receptor;
- рибосомный — ribosomal;
- связывающий — binding;
- секреторный белок — secretory protein;
- С-реактивный — C-reactive;
- белок сыворотки молока — whey protein, lactoprotein;
- тканевый — tissue;
- токсический — toxic;
- химерный — chimeric;
- цельный — whole;
- цитозольный — cytosolic;
- щелочной белок — anionic [cathodic] protein;
- экзогенный — exogenous [external];
- эндогенный — endogenous [internal] protein.
Более подробно о белках читайте в литературе:
- Волькенштейн М. В., Молекулы и жизнь[en] , М., 1965, гл. 3 — 5;
- Гауровиц Ф., Химия и функции белков, пер. с англ., [2 изд.], Москва, 1965;
- Сисакян Н. М. и Гладилин К. Л., Биохимические аспекты синтеза белка, в кн.: Успехи биологической химии, т. 7, М., 1965, с. 3;
- Степанов В. М. Молекулярная биология. Структура и функция белков. М., 1996;
- Шамин А. Н., Развитие химии белка, М., 1966;
- Белки и пептиды. М., 1995-2000. Т. 1-3;
- Биосинтез белка и нуклеиновых кислот, под ред. А. С. Спирина, М., 1965;
- Введение в молекулярную биологию, пер. с англ., М., 1967
- Молекулы и клетки. [Сб. ст.], пер. с англ., М., 1966, с. 7 — 27, 94 — 106;
- Основы биохимии: Перевод с английского М., 1981. Т. 1;
- Проблема белка. М., 1995. Т. 1-5;
- The Proteins. New York, 1975-79. 3 ed. V. 1-4.
источник