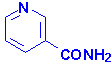
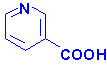
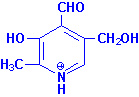
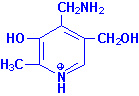
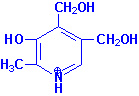
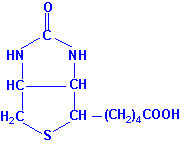
Биомолекулы. Пептиды и белки
Методы выделения и анализа белков
Препараты высокоочищенных белков находят разнообразное применение в научных исследованиях, медицине и биотехнологии. Так как многие белки, и в особенности глобулярные, высоколабильны (см. с. 80), выделение проводят с помощью предельно мягких методов и при пониженной температуре (0-5°С). К таким методам относится ионообменная хроматография , которая обсуждалась на с. 68. Другие методы выделения белков представлены в этом разделе.
Растворимость белков сильно зависит от концентрации солей (от ионной силы ). В дистиллированной воде белки чаще всего растворяются плохо, однако их растворимость возрастает по мере увеличения ионной силы. При этом все большее количество гидратированных неорганических ионов (светло-синие кружочки) связывается с поверхностью белка и тем самым уменьшается степень его агрегации ( засаливание ). При высокой ионной силе молекулы белков лишаются гидратирующих оболочек, что приводит к агрегации и выпадению белка в осадок ( высаливание ). Используя различие в растворимости, можно с помощью обычных солей, например (NН 4 ) 2 SО 4 , разделить (фракционировать) смесь белков.
Для отделения низкомолекулярных примесей или замены состава среды используют диализ. Метод основан на том, что молекулы белка из-за своих размеров не могут проходить через полупроницаемые мембраны , в то время как низкомолекулярные вещества равномерно распределяются между объемом, ограниченным мембраной, и окружающим раствором. После многократной замены внешнего раствора состав среды в диализном мешочке (концентрация солей, величина pH и др.) будет тот же, что и в окружающем растворе.
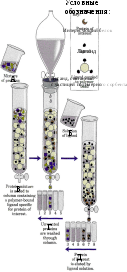
Гель-проникающая хроматография (гель-фильтрация) позволяет разделять белки по величине и форме молекул . Разделение проводят в хроматографических колонках , заполненных сферическими частицами набухшего геля (размером 10-500 мкм) из полимерных материалов ( 1а ). Частицы геля проницаемы благодаря внутренним каналам, которые характеризуются определенным средним диаметром. Смесь белков ( 1б ) вносят в колонку с гелем и элюируют буферным раствором. Белковые молекулы, не способные проникать в гранулы геля (помечены красным цветом), будут перемещаться с высокой скоростью. Средние (зеленого цвета) и небольшие белки (синего цвета) будут в той или иной степени удерживаться гранулами геля ( 1в ). На выходе колонки элюат собирают в виде отдельных фракций ( 2 ). Объем выхода того или иного белка зависит в основном от его молекулярной массы ( 3 ).
Г. Электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия
В настоящее время электрофорез в полиакриламидном геле (ПААГ) в присутствии додецилсульфата натрия (ДСН) [ДСН-ПААГ-электрофорез (SDS-PAGE)] является общепринятым методом определения гомогенности белковых препаратов. Метод основан на свойстве заряженных частиц (молекул) перемещаться под действием электрического поля (см. с. 270). Обычно скорость миграции зависит от трех параметров анализируемых белков: величины молекул, формы молекул и суммарного заряда. Поэтому предварительно белки денатурируют с тем, чтобы скорость миграции зависела только от молекулярной массы. Для этого анализируемую смесь обрабатывают додецилсульфа-том натрия [ДСН (SDS)] (C 12 H 25 OSO 3 Na), который представляет собой детергент с сильно выраженными амфифильными свойствами (см. с. 34). Под действием ДСН олигомерные белки диссоциируют на субъединицы и денатурируют. Развернутые полипептидные цепи связывают ДСН (примерно 0,4 г/г белка) и приобретают отрицательный заряд. Для полной денатурации в среду добавляют тиолы, которые расщепляют дисульфидные мостики ( 1 ).
Электрофорез проводят в тонком слое полиакриламида ( 2 ). После завершения электрофореза, зоны белков выявляют c помощью красителя, В качестве примера на схеме 3 приведена электрофореграмма трех препаратов: клеточного экстракта, содержащего сотни белков ( а ); выделенного из экстракта гомогенного белка ( б ); контрольной смеси белков с известными молекулярными массами ( в ).
источник
Среди методов, используемых в биохимии, ключевое значение имеют выделение веществ из биологических источников и, как правило, их очистка с целью получения индивидуальных соединений.
Следует отметить три главные проблемы выделения в индивидуальном виде компонентов из живых организмов:
1) Исходный материал биомасса состоит из многих сотен и даже тысяч различных соединений. Разделение таких смесей чрезвычайно сложно, кроме того многие компоненты этих смесей построены довольно однотипно (например, иммуноглобулины). В связи с этим они мало различаются между собой по физико-химическим характеристикам — растворимости или способности к сорбции на определенном типе сорбента.
2) Работа с биохимическими объектами зачастую сопровождается необходимостью манипулировать с очень небольшими количествами исходного вещества. При ничтожно малом количестве используемого материала методы их детекции должны быть высокочувствительными. Такими методами являются спектрофотометрические методы, основанные на измерении поглощения видимого или ультрафиолетового света, радиохимические методы, основанные на изменении радиоактивности, и люминесцентные, основанные на изменении флуоресценции, био- и хемилюминесценции.
3) Многие компоненты обладают очень низкой устойчивостью. Часто задача состоит в том, чтобы выделить белок в нативном, т.е. сохраняющим биологическую активность состоянии. Между тем многие белки при умеренных температурах и незначительных изменениях рН среды подвержены денатурации, которая обычно сопровождается потерей биологической активности -инактивацией. Кроме того, в клетках часто имеются ферменты (в неповрежденных клетках в лизосомах) способные разрушить те или иные вещества, в первую очередь белки.
Традиционные методы выделения и очистки белков
Все методы разделения смесей основаны на том, что разделяемые компоненты в результате каких-либо манипуляций оказываются в разных участках системы и могут быть механически отделены друг от друга.
Выделение индивидуальных белков является ступенчатым процессом, т.к. на первых этапах очистки фракции содержат множество примесей. На каждой ступени разделения должна получаться фракция, более богатая необходимым веществом, чем предыдущая. Такой процесс часто называют фракционированием.
На каждой стадии разделения белок находится либо в виде раствора, либо в виде осадка.
1) Осаждение . Для осаждения необходимо понизить каким-либо способом растворимость белка. Растворимость белка зависит от их способности к гидратации. У глобулярных водорастворимых белков высокий уровень гидратации обеспечивается расположением гидрофильных групп на поверхности. Добавление органических растворителей понижает степень гидратации и приводит к осаждению белка. В качестве таких растворителей используют ацетон. Осаждают белки также с помощью солей, например, сульфата аммония. Принцип этого метода основан на том, что при повышении концентрации соли в растворе происходит сжатие ионных атмосфер, образуемых противоионами белка, что способствует сближению их до критического расстояния, на котором межмолекулярные силы ван-дер-ваальсова притяжения перевешивают кулоновские силы отталкивания противоионов. Это приводит к слипанию белковых частиц и их выпадению в осадок.
2) Изоэлектрическое осаждение . Заряд белков обусловлен в первую очередь остатками аспаратата и глутамата (отрицательный заряд) и остатками лизина и аргинина (положительный заряд). По мере повышения рН различными способами заряд белков проходит от положительных к отрицательным значениям и в изоэлектрической точке оказывается равен нулю. В результате белок лишается своей ионной атмосферы и его частицы слипаются, выпадая в осадок.
3) Центрифугирование . Выпавший осадок белка можно выделить фильтрованием. Для этого часто пользуются центрифугами. Частицы осажденного вещества под действием центробежной силы оседают на дне центрифужных стаканов и сжимаются в плотный осадок, с которого оставшийся раствор (надосадочная жидкость, или супернатант) легко сливается или отсасывается. Скоростные центрифуги (ультрацентрифуги) создают центробежное ускорение порядка 100000g (т.е. 100000 ускорений свободного падения), что позволяет осаждать даже некоторые крупные надмолекулярные агрегаты — рибосомы и вирусы.
4) Сорбция . Основана на различном сродстве компонентов смесей к определенным веществам сорбентам. Наиболее часто используемый сорбент гель фосфата кальция (гидроксиапатит) или активированный уголь. Эффективную сорбцию можно получить на ионитах сорбентах, имеющих на поверхности заряженные группы. В исходном состоянии эти заряды скомпенсированы какими-либо подвижными противоионами. Практически при сорбции на ионитах происходит обмен этих противоионов. Если на поверхности сорбента находятся отрицательно заряженные группы, то он связывает катионы и его называют катионитом, соответственно сорбент с положительно заряженными группами называют анионитом. В качестве ионитов чаще всего используют материалы (после соответствующей химической обработки) на гидрофильной основе — целлюлозе, декстране, силикагеле или пористых стеклах.
5) Ситовой эффект . Молекулярные сита представляют собой материалы с очень маленькими порами определенного размера. Следует отметить отличие этих «сит»: крупные частицы не остаются на поверхности материала сита, а обтекают его частички (гранулы), тогда как мелкие вещества примесей диффундируют в частицы сита и таким образом задерживаются. Материалом для молекулярных сит может служить сефадекс (полисахарид декстран, у которого после соответствующей обработки цепи оказываются сшитыми трехуглеродными мостиками) или полиакриламид, линейные цепи которого сшиты метиленовыми мостиками.
В перечисленных методах в конечной смеси остаются вспомогательные низкомолекулярные вещества органические растворители, соли и кислоты. Для очищения от них используется метод диализа. Диализ основан на применении мембран проницаемых для воды и низкомолекулярных веществ и непроницаемых для белков. Чаще всего с этой целью используют пленки из целлофана (нитрат целлюлозы). В лаборатории подлежащий диализу раствор белка помещают в мешок из целлофана и погружаю последний в сосуд с водой. Непрерывный ток воды через сосуд приводит к полному переходу в него всех проходящих через целлофан веществ, а белки остаются внутри.
Методы зонального разделения
Эти методы основаны на том, что создается некоторая система, в которой компоненты смеси перемещаются с различными скоростями. Если в такую систему ввести разделяемую смесь в виде некоторой зоны, то по мере ее перемещения компоненты смеси, движущиеся с разными скоростями, будут формировать отдельные зоны, которые затем можно разнести в разные приемники.
1) Хроматография . При разделении белков и их анализе используется жидкостная хроматография. В жидкостной хроматографии зона разделяемых веществ с помощью тока элюирующей (вымывающей) жидкости перемещается относительно неподвижной фазы, которая обладает разным сродством к разделяемым компонентам. При перемещении зоны с помощью тока элюента каждый из разделяемых компонентов проводит некоторую часть времени на неподвижной фазе. Чем больше это время, тем медленнее перемещается зона с разделяемой смесью.
В зависимости от природы физико-химического явления, лежащего в основе разделения веществ, различают адсорбционную, ионообменную, распределительную и гель-хроматографию (эксклюзивную хроматографию). В адсорбционной чаще всего используют оксид алюминия в качестве неподвижной фазы. В ионообменной используются те же типы ионитов, что в ионообменной сорбции. Распределительная хроматогрфия основана на разделении веществ между двумя несмешивающимися жидкими фазами. Неподвижная жидкая фаза образуется в результате ее закрепления на пористом нерастворимом носителе.
2) Электрофорез . В этом случае зоны создаются в результате того, что разные компоненты смеси с различной скоростью перемещаются в электрическом поле. После специальной обработки разделяемые смеси наносят на гель (декстроновый, полиакриламидный, или другой) а затем подключают но определенное время постоянный электрический ток. Белки в зависимости от своей молекулярной массы и заряда начинают двигаться с различной скоростью. После отключения тока гель помещают в специальный раствор, где интересующие исследователя белки окрашиваются. Существует электрофорез в растворе, но он имеет ограниченное применение, т.к. исследуемые белки часто подвергаются значительному диффузионному размыванию. Однако сейчас стало возможным применять этот метод в условиях невесомости в космосе, что устраняет конвекционные токи, обуславливающие диффузионную размывку.
Все описанные выше методы зонального разделения являются одномерными, разделение в них происходит в одной координате. Наряду с этим применяются двумерные системы разделения на пластинах. При этом разделяемую смесь в виде пятна наносят на один из углов и разделяют в одном направлении. Затем какие-либо параметры, определяющие разделяющую способность системы изменяют и проводят разделение в перпендикулярном направлении. При удачном подборе системы и условий разделения удается разделить те компоненты, которые не разделились при первой процедуре. Комбинации методов могут быть довольно разнообразны: двумерная хроматография с использованием в разных направлениях разных элюентов, хроматография в одном и электрофорез в другом направлениях.
Определение первичной структуры белков
Определение первичной структуры белков сводится к выяснению порядка расположения аминокислот в полипептидной цепочке. Эту задачу решают с помощью метода секвенирования (от англ. sequence последовательность).
Собственно секвенирование на его сегодняшнем уровне позволяет определить аминокислотную последовательность а полипептидах, размер которых не превышает несколько десятков аминокислотных остатков. В то же время исследуемые полипептидные фрагменты значительно короче тех природных белков, с которыми приходится иметь дело. Поэтому необходимо предварительное разрезание исходного полипептида на короткие фрагменты. После секвенирования полученных фрагментов их необходимо снова сшить в первоначальной последовательности.
Таким образом определение первичной последовательности белка сводится к следующим основным этапам:
1) Расщепление белка на несколько фрагментов длиной, доступной для секвенирования.
2) Секвенирование каждого из полученных фрагментов.
3) Сборка полной структуры белка из установленных структур его фрагментов.
Для специфического расщепления белков по определенным точкам применяются как ферментативные, так и химические методы. Из ферментов, катализирующих гидролиз белков по определенным точкам, наиболее широко используют трипсин и химотрипсин. Трипсин катализирует гидролиз пептидных связей, расположенных после остатков лизина и аргинина. Химотрипсин преимущественно расщепляет белки после остатков ароматических аминокислот — фенилаланина, тирозина и триптофана. При необходимости специфичность трипсина может быть повышена или изменена. Например, обработка цитраконовым ангидридом исследуемого белка приводит к ацилированию остатков лизина. В таком модифицированном белке расщепление будет проходить только по остаткам аргинина.
источник
Для выделения нативных белков (без изменения пространственной структуры) из биологического раствора используют методы:
высаливание: осаждение солями щелочных, щелочноземельных металлов (хлорид натрия, сульфат магния), сульфатом аммония; при этом не нарушается первичная структура белка;
осаждение: использование водоотнимающих веществ: спирт или ацетон при низких температурах (около –20 С).
При использовании этих методов белки лишаются гидратной оболочки и выпадают в осадок в растворе.
Денатурация — нарушение пространственной структуры белков (первичная структура молекулы сохраняется). Может быть обратимая (структура белка восстанавливается после устранения денатурирующего агента) или необратимая (пространственная структура молекулы не восстанавливается, например, при осаждении белков минеральными концентрированными кислотами, солями тяжелых металлов).
Используют специальную полимерную мембрану, которая имеет поры определенной величины. Малые молекулы (низкомолекулярные примеси) проходят через поры в мембране, а крупные (белки) задерживаются. Таким образом, белки отмывают от примесей.
Хроматографическую колонку заполняют гранулами геля (сефадекс), который имеет поры определенной величины. В колонку вносят смесь белков. Белки, размер которых меньше, чем размер пор сефадекса, задерживаются в колонке, так как «застревают» в порах, а остальные свободно выходят из колонки (рис. 2.1). Размер белка зависит от его молекулярной массы.
Рис. 2.1. Разделение белков методом гель-фильтрации
Этот метод основан на различной скорости седиментации (осаждения) белковых молекул в растворах с различным градиентом плотности (сахарозный буфер или хлорид цезия) (рис. 2.2).
Рис. 2.2. Разделение белков методом ультрацентрифугирования
Данный метод основан на различной скорости миграции белков и пептидов в электрическом поле в зависимости от заряда.
Носителями для электрофореза могут служить гели, ацетатцеллюлоза, агар. Разделяемые молекулы движутся в геле в зависимости от размера: те из них, которые имеют бóльшие размеры, будут задерживаться при прохождении через поры геля. Меньшие молекулы будут встречать меньшее сопротивление и, соответственно, двигаться быстрее. В результате, после проведения электрофореза, бóльшие молекулы будут находиться ближе к старту, чем меньшие (рис. 2.3).
Рис. 2.3. Разделение белков методом электрофореза в геле
Методом электрофореза можно разделить белки и по молекулярной массе. Для этого используют электрофорез в ПААГ в присутствии додецилсульфата натрия (ДДS-Na).
ДДС-Na является дифильным веществом и содержит заряженную группу и гидрофобную. Белки связываются с ДДС-Na своими гидрофобными радикалами и при этом денатурируют. Таким образом, белки выравниваются по форме и заряду. После этого подвижность белка при электрофорезе зависит только от его молекулярной массы.
Выделение индивидуальных белков
Аффинная хроматография
Метод основан на способности белков прочно связываться с различными молекулами нековалентными связями. Используется для выделения и очистки ферментов, иммуноглобулинов, рецепторных белков.
Молекулы веществ (лиганды), с которыми специфически связываются определенные белки, ковалентно соединяют с частицами инертного вещества. Смесь белков вносят в колонку, и искомый белок прочно присоединяется к лиганду. Остальные белки свободно выходят из колонки. Задержанный белок затем можно вымыть из колонки с помощью буферного раствора, содержащего в свободном состоянии лиганд. Этот высокочувствительный метод позволяет выделить в чистом виде очень малые количества белка из клеточного экстракта, содержащего сотни других белков.
Метод основан на различной величине ИЭТ белков. Белки разделяют методом электрофореза на пластине с амфолином (это вещество, у которого заранее сформирован градиент pH в диапазоне от 3 до 10). При электрофорезе белки разделяются в соответствии со значением их ИЭТ (в ИЭТ заряд белка будет равен нулю, и он не будет передвигаться в электрическом поле).
Представляет собой сочетание изоэлектрофокусирования и электрофореза с ДДС-Na. Проводят сначала электрофорез в горизонтальном направлении на пластине с амфолином. Белки разделяются в зависимости от заряда (ИЭТ). Затем обрабатывают пластину раствором ДДС-Na и проводят электрофорез в вертикальном направлении. Белки разделяются в зависимости от молекулярной массы.
Аналитический метод, используемый для определения специфичных белков в образце (рис 2.4).
Выделение белков из биологического материала.
Разделение белков по молекулярной массе методом электрофореза в ПААГ с ДДС-Na.
Перенос белков с геля на полимерную пластину с целью облегчения дальнейших работ.
Обработка пластины раствором неспецифического белка для заполнения оставшихся пор.
Таким образом, после этого этапа получена пластинка, в порах которой содержатся разделенные белки, а пространство между ними заполнено неспецифическим белком. Теперь надо выявить, есть ли среди белков искомый, ответственный за какое-то заболевание. Для выявления используют обработку антителами. Под первичными антителами понимают антитела к искомому белку. Под вторичными антителами понимают антитела к первичным антителам. В состав вторичных антител вводят дополнительно специальную метку (т.н. молекулярный зонд), чтобы потом можно было визуализировать результаты. В качестве метки используются радиоактивный фосфат или фермент, прочно связанные с вторичным антителом. Связывание сначала с первичными, а затем с вторичными антителами преследует две цели: стандартизация метода и улучшение результатов.
Обработка раствором первичных антител связывание происходит в том месте пластины, где есть антиген (искомый белок).
Удаление несвязавшихся антител (промывка).
Обработка раствором меченых вторичных антител для последующей проявки.
Удаление несвязавшихся вторичных антител (промывка).
Проявка — авторадиография в случае использования радиоактивного фосфата или обработка пластины раствором субстрата — в случае ферментной метки.
Рис. 2.4. Иммуноэлектрофорез (Вестерн-блот)
В случае присутствия искомого белка в биологическом материале – на пластинке появляется полоса, свидетельствующая о связывании этого белка с соответствующими антителами.
источник
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ
Физико-химические свойства белков обусловлены их структурной организацией и зависят от факторов внешней среды.
1. Высокая молекулярная масса — от 6000 до нескольких миллионов Дальтон.
2. Амфотерность – способность белка проявлять кислотные и основные свойства.В молекуле белка есть катионообразующие группы (аминогруппы) и анионообразующие (карбоксильные группы). Если преобладают карбоксильные группы, то заряд молекулы отрицательный (слабокислые свойства), если аминогруппы – то положительный (основные свойства). Заряд белка также зависит от рН среды. В кислой среде молекула приобретает положительный заряд, в щелочной – отрицательный.
3. Гидратация и растворимость. Зависит от сродства аминокислотных остатков на поверхности белковой молекулы к воде.
4. Способность к ионизации. Благодаря наличию аминогрупп и карбоксильных групп белки – амфотерные полиэлетролиты. В растворах находятся в виде биполярных ионов.
5. Способность радикалов аминокислот к химическим превращениям и взаимодействиям.
6. Способность к денатурации и ренатурации.
7. Способность к гидролизу. Благодаря пептидной связи белки подвергаются кислотному, щелочному и ферментативному гидролизу. При этом образуются свободные аминокислоты.
Факторы стабилизации белка в растворе.
1. Гидратная оболочка – слой молекул воды на поверхности белковой молекулы. Вода связана с белковой молекулой слабыми связями («связанная вода»). Гидратная оболочка не дает белковым молекулам сближаться и выпадать в осадок.
2. Заряд белковой молекулы. На поверхности белковой молекулы есть положительно и отрицательно заряженные радикалы аминокислот. Количество этих групп и, следовательно, заряд белков зависят от рН среды. Значение рН, при котором белок имеет нулевой заряд, называется изоэлектрической точкой (ИЭТ). В ИЭТ белки наименее устойчивы. При потере заряда в ИЭТ белки агрегируют и выпадают в осадок.
Денатурация– нарушение нативной конформации белка. При денатурация изменяются физико-химические свойства и теряется биологическая активность белка. При денатурации не изменяется первичная структура, но изменяется вторичная, третичная и, если есть, четвертичная структура.
1. Физические (высокая температура, вибрация, радиация, УФО, ультразвук и др.).
2. Химические (мочевина, кислоты и щелочи, соли тяжелых металлов, растительные алкалоиды, органические растворители и др.).
При денатурации уменьшается растворимость, изменяется электрофоретическая подвижность, изменяется число реакционных групп.
Способность белков к денатурации используется в медицине.
- Пастеризация продуктов.
- Стерилизация шовного материала.
Ренатурация– восстановление нативной конформации денатурированного белка. При ренатурации восстанавливаются физико-химические свойства белков и их активность. В организме происходит быстрая ренатурация при помощи специфических белков — шаперонов. Шапероны присоединяются к денатурированному белку слабыми связями и создают условия для ренатурации.
Классификации белков.
1.По растворимости — водорастворимые (альбумины), солерастворимые (глобулины), спирторастворимые (протамины), нерастворимые (склеропротеины).
2.По форме белковой молекулы – фибриллярные, глобулярные, мембраносвязанные.
3.По химическому строению – простые белки (состоят только из аминокислот) и сложные (состоят из аминокислот и небелковой части – липидов, углеводов, металлов, нуклеиновых кислот).
4.По функциям – структурная, каталитическая, регуляторная, двигательная, транспортная, рецепторная, защитная, резервная, опорная.
Методы исследования белков.
Дата добавления: 2016-11-23; просмотров: 573 | Нарушение авторских прав
Растворимость белков сильно зависит от концентрации солей (от ионной силы). В дистиллированной воде белки чаще всего растворяются плохо, однако их растворимость возрастает по мере увеличения ионной силы.
При этом все большее количество гидратированных неорганических ионов связывается с поверхностью белка и тем самым уменьшается степень его агрегации (засаливание). При высокой ионной силе молекулы белков лишаются гидратирующих оболочек, что приводит к агрегации и выпадению белка в осадок (высаливание).
Используя различие в растворимости, можно с помощью обычных солей, например (NН4)2SО4, разделить (фракционировать) смесь белков.
Для отделения низкомолекулярных примесей или замены состава среды используют диализ.
Метод основан на том, что молекулы белка из-за своих размеров не могут проходить через полупроницаемые мембраны, в то время как низкомолекулярные вещества равномерно распределяются между объемом, ограниченным мембраной, и окружающим раствором. После многократной замены внешнего раствора состав среды в диализном мешочке (концентрация солей, величина pH и др.) будет тот же, что и в окружающем растворе.
Гель-проникающая хроматография (гель-фильтрация) позволяет разделять белки по величине и форме молекул. Разделение проводят в хроматографических колонках, заполненных сферическими частицами набухшего геля (размером 10-500 мкм) из полимерных материалов (1а). Частицы геля проницаемы благодаря внутренним каналам, которые характеризуются определенным средним диаметром. Смесь белков вносят в колонку с гелем и элюируют буферным раствором.
Белковые молекулы, не способные проникать в гранулы геля, будут перемещаться с высокой скоростью. Средние и небольшие белки будут в той или иной степени удерживаться гранулами геля. На выходе колонки элюат собирают в виде отдельных фракций. Объем выхода того или иного белка зависит в основном от его молекулярной массы.
Электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия
В настоящее время электрофорез в полиакриламидном геле (ПААГ) в присутствии додецилсульфата натрия (ДСН) является общепринятым методом определения гомогенности белковых препаратов.
Метод основан на свойстве заряженных частиц (молекул) перемещаться под действием электрического поля. Обычно скорость миграции зависит от трех параметров анализируемых белков: величины молекул, формы молекул и суммарного заряда. Поэтому предварительно белки денатурируют с тем, чтобы скорость миграции зависела только от молекулярной массы.
Для этого анализируемую смесь обрабатывают додецилсульфа-том натрия (C12H25OSO3Na), который представляет собой детергент с сильно выраженными амфифильными свойствами. Под действием ДСН олигомерные белки диссоциируют на субъединицы и денатурируют.
Развернутые полипептидные цепи связывают ДСН (примерно 0,4 г/г белка) и приобретают отрицательный заряд. Для полной денатурации в среду добавляют тиолы, которые расщепляют дисульфидные мостики.
Электрофорез проводят в тонком слое полиакриламида.
После завершения электрофореза, зоны белков выявляют c помощью красителя, В качестве примера на схеме 3 приведена электрофореграмма трех препаратов: клеточного экстракта, содержащего сотни белков; выделенного из экстракта гомогенного белка; контрольной смеси белков с известными молекулярными массами.
Изменение белкового состава организма. В процессе развития организма белковый состав значительно меняется. В специализированных тканях появляются специфические белки. Например, гемоглобин в эритроцитах, родопсин в клетках сетчатки глаза. Специализированные клетки отличаются и по количеству белков, присутствующих во всех или во многих тканях организма. Белковый состав организма здорового взрослого человека относительно постоянен.
Вариации количества отдельных белков могут определяться составом пищи, режимом питания, физиологической активностью.
При различных заболеваниях происходит изменение белкового состава тканей. Эти изменения называют протеинопатиями. Различают наследственные и приобретенные протеинопатии. Пример наследственной протеинопатии – гемоглобинопатии. В зависимости от роли дефектного белка в жизнедеятельности организма наследственные протеинопатии могут вызывать болезни или летальный исход.
При наследственных протеинопатиях нарушается первичная структура белка.
Приобретенные протеинопатии развиваются в результате болезни. В этом случае первичная структура белка не нарушается, а происходит
количественное изменение белков в пораженном органе или ткани.
2. изменение биологической активности белков из-за нарушения нативной конформации:
– при сдвигах рН среды в щелочную или кислую сторону;
– при присоединении низкомолекулярных веществ к белкам, например, при сахарном диабете к белкам крови присоединяется глюкоза;
Изменение белкового состава крови и мочи используется для диагностики ряда заболеваний.
Ультрацентрифугирование,метод разделения и исследования высокомолекулярных соединений, вирусов и субклеточных частиц с помощью ультрацентрифуги.
Идея ультрацентрифугирования была предложена А. В. Думанским в 1913, однако разработка современной теории седиментационного анализа стала возможной только после того, как Т. Сведберг в 1926 сконструировал высокоскоростную ультрацентрифугу, обеспечивавшую ускорение 105 g.
Принято различать 2 типа ультрацентрифугирования: препаративное и аналитическое. Препаративное ультрацентрифугирование применяют для фракционирования и выделения биополимеров в количествах, достаточных для практических целей.
Широко используют ультрацентрифугирование в градиенте плотности растворовсахарозы, глицерина, декстринов; оно позволяет разделять смеси веществ на отдельные компоненты, различающиеся эффективной массой и коэффициентом трения частиц или молекул.
Применение зональных и проточных роторов дало возможность значительно повысить объёмы растворов фракционируемых частиц и использовать их для очистки вируса гриппа при изготовлении вакцин.
Аналитическое ультрацентрифугирование используют для исследования гомогенности (чистоты) препаратов биополимеров (белков, нуклеиновых кислот, полисахаридов), а также для определения константседиментации, молекулярной массы, констант ассоциации и размеров макромолекул. Ультрацентрифугирование применяется в медицине при клинической диагностике, для приготовления кровезаменителей и т.п.
В., Методы исследования биополимеров с помощью аналитической ультрацентрифуги, в кн.: Современные методы в биохимии, М., 1964; Боуэн Т., Введение в ультрацентрифугирование, пер.
с англ., М., 1973; Schachman Н.
К., Ultra centrifugation in biochemistry, N. Y. — L., 1959.
84-85
Биомолекулы. Пептиды и белки

с. 80), выделение проводят с помощью предельно мягких методов и при пониженной температуре (0-5°С). К таким методам относится ионообменная хроматография, которая обсуждалась на с. 68. Другие методы выделения белков представлены в этом разделе.
Растворимость белков сильно зависит от концентрации солей (от ионной силы). В дистиллированной воде белки чаще всего растворяются плохо, однако их растворимость возрастает по мере увеличения ионной силы. При этом все большее количество гидратированных неорганических ионов (светло-синие кружочки) связывается с поверхностью белка и тем самым уменьшается степень его агрегации (засаливание).
При высокой ионной силе молекулы белков лишаются гидратирующих оболочек, что приводит к агрегации и выпадению белка в осадок (высаливание). Используя различие в растворимости, можно с помощью обычных солей, например (NН4)2SО4, разделить (фракционировать) смесь белков.
Для отделения низкомолекулярных примесей или замены состава среды используют диализ.
Метод основан на том, что молекулы белка из-за своих размеров не могут проходить через полупроницаемые мембраны, в то время как низкомолекулярные вещества равномерно распределяются между объемом, ограниченным мембраной, и окружающим раствором. После многократной замены внешнего раствора состав среды в диализном мешочке (концентрация солей, величина pH и др.) будет тот же, что и в окружающем растворе.
Гель-проникающая хроматография (гель-фильтрация) позволяет разделять белки по величине и форме молекул.
Разделение проводят в хроматографических колонках, заполненных сферическими частицами набухшего геля (размером 10-500 мкм) из полимерных материалов (1а).
Частицы геля проницаемы благодаря внутренним каналам, которые характеризуются определенным средним диаметром. Смесь белков (1б) вносят в колонку с гелем и элюируют буферным раствором. Белковые молекулы, не способные проникать в гранулы геля (помечены красным цветом), будут перемещаться с высокой скоростью.
Средние (зеленого цвета) и небольшие белки (синего цвета) будут в той или иной степени удерживаться гранулами геля (1в).
На выходе колонки элюат собирают в виде отдельных фракций (2). Объем выхода того или иного белка зависит в основном от его молекулярной массы (3).
В настоящее время электрофорез в полиакриламидном геле (ПААГ) в присутствии додецилсульфата натрия (ДСН) [ДСН-ПААГ-электрофорез (SDS-PAGE)] является общепринятым методом определения гомогенности белковых препаратов.
Метод основан на свойстве заряженных частиц (молекул) перемещаться под действием электрического поля (см. с. 270). Обычно скорость миграции зависит от трех параметров анализируемых белков: величины молекул, формы молекул и суммарного заряда.
Поэтому предварительно белки денатурируют с тем, чтобы скорость миграции зависела только от молекулярной массы. Для этого анализируемую смесь обрабатывают додецилсульфа-том натрия [ДСН (SDS)] (C12H25OSO3Na), который представляет собой детергент с сильно выраженными амфифильными свойствами (см. с. 34). Под действием ДСН олигомерные белки диссоциируют на субъединицы и денатурируют.
Развернутые полипептидные цепи связывают ДСН (примерно 0,4 г/г белка) и приобретают отрицательный заряд. Для полной денатурации в среду добавляют тиолы, которые расщепляют дисульфидные мостики (1).
Электрофорез проводят в тонком слое полиакриламида (2). После завершения электрофореза, зоны белков выявляют c помощью красителя, В качестве примера на схеме 3 приведена электрофореграмма трех препаратов: клеточного экстракта, содержащего сотни белков (а); выделенного из экстракта гомогенного белка (б); контрольной смеси белков с известными молекулярными массами (в).
источник
Растворимость белков сильно зависит от концентрации солей (от ионной силы). В дистиллированной воде белки чаще всего растворяются плохо, однако их растворимость возрастает по мере увеличения ионной силы. При этом все большее количество гидратированных неорганических ионов связывается с поверхностью белка и тем самым уменьшается степень его агрегации (засаливание). При высокой ионной силе молекулы белков лишаются гидратирующих оболочек, что приводит к агрегации и выпадению белка в осадок (высаливание). Используя различие в растворимости, можно с помощью обычных солей, например (NН4)2SО4, разделить (фракционировать) смесь белков.
Для отделения низкомолекулярных примесей или замены состава среды используют диализ. Метод основан на том, что молекулы белка из-за своих размеров не могут проходить через полупроницаемые мембраны, в то время как низкомолекулярные вещества равномерно распределяются между объемом, ограниченным мембраной, и окружающим раствором. После многократной замены внешнего раствора состав среды в диализном мешочке (концентрация солей, величина pH и др.) будет тот же, что и в окружающем растворе.
Гель-проникающая хроматография (гель-фильтрация) позволяет разделять белки по величине и форме молекул. Разделение проводят в хроматографических колонках, заполненных сферическими частицами набухшего геля (размером 10-500 мкм) из полимерных материалов (1а). Частицы геля проницаемы благодаря внутренним каналам, которые характеризуются определенным средним диаметром. Смесь белков вносят в колонку с гелем и элюируют буферным раствором. Белковые молекулы, не способные проникать в гранулы геля, будут перемещаться с высокой скоростью. Средние и небольшие белки будут в той или иной степени удерживаться гранулами геля. На выходе колонки элюат собирают в виде отдельных фракций. Объем выхода того или иного белка зависит в основном от его молекулярной массы.
Электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия
В настоящее время электрофорез в полиакриламидном геле (ПААГ) в присутствии додецилсульфата натрия (ДСН) является общепринятым методом определения гомогенности белковых препаратов. Метод основан на свойстве заряженных частиц (молекул) перемещаться под действием электрического поля. Обычно скорость миграции зависит от трех параметров анализируемых белков: величины молекул, формы молекул и суммарного заряда. Поэтому предварительно белки денатурируют с тем, чтобы скорость миграции зависела только от молекулярной массы. Для этого анализируемую смесь обрабатывают додецилсульфа-том натрия (C12H25OSO3Na), который представляет собой детергент с сильно выраженными амфифильными свойствами. Под действием ДСН олигомерные белки диссоциируют на субъединицы и денатурируют. Развернутые полипептидные цепи связывают ДСН (примерно 0,4 г/г белка) и приобретают отрицательный заряд. Для полной денатурации в среду добавляют тиолы, которые расщепляют дисульфидные мостики.
Электрофорез проводят в тонком слое полиакриламида. После завершения электрофореза, зоны белков выявляют c помощью красителя, В качестве примера на схеме 3 приведена электрофореграмма трех препаратов: клеточного экстракта, содержащего сотни белков; выделенного из экстракта гомогенного белка; контрольной смеси белков с известными молекулярными массами.
Изменение белкового состава организма. В процессе развития организма белковый состав значительно меняется. В специализированных тканях появляются специфические белки. Например, гемоглобин в эритроцитах, родопсин в клетках сетчатки глаза. Специализированные клетки отличаются и по количеству белков, присутствующих во всех или во многих тканях организма. Белковый состав организма здорового взрослого человека относительно постоянен. Вариации количества отдельных белков могут определяться составом пищи, режимом питания, физиологической активностью.
При различных заболеваниях происходит изменение белкового состава тканей. Эти изменения называют протеинопатиями. Различают наследственные и приобретенные протеинопатии. Пример наследственной протеинопатии – гемоглобинопатии. В зависимости от роли дефектного белка в жизнедеятельности организма наследственные протеинопатии могут вызывать болезни или летальный исход. При наследственных протеинопатиях нарушается первичная структура белка.
Приобретенные протеинопатии развиваются в результате болезни. В этом случае первичная структура белка не нарушается, а происходит
1. количественное изменение белков в пораженном органе или ткани.
2. изменение биологической активности белков из-за нарушения нативной конформации:
– при сдвигах рН среды в щелочную или кислую сторону;
– при присоединении низкомолекулярных веществ к белкам, например, при сахарном диабете к белкам крови присоединяется глюкоза;
Изменение белкового состава крови и мочи используется для диагностики ряда заболеваний.
источник
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ
Физико-химические свойства белков обусловлены их структурной организацией и зависят от факторов внешней среды.
1. Высокая молекулярная масса — от 6000 до нескольких миллионов Дальтон.
2. Амфотерность – способность белка проявлять кислотные и основные свойства.В молекуле белка есть катионообразующие группы (аминогруппы) и анионообразующие (карбоксильные группы). Если преобладают карбоксильные группы, то заряд молекулы отрицательный (слабокислые свойства), если аминогруппы – то положительный (основные свойства). Заряд белка также зависит от рН среды. В кислой среде молекула приобретает положительный заряд, в щелочной – отрицательный.
3. Гидратация и растворимость. Зависит от сродства аминокислотных остатков на поверхности белковой молекулы к воде.
4. Способность к ионизации. Благодаря наличию аминогрупп и карбоксильных групп белки – амфотерные полиэлетролиты. В растворах находятся в виде биполярных ионов.
5. Способность радикалов аминокислот к химическим превращениям и взаимодействиям.
6. Способность к денатурации и ренатурации.
7. Способность к гидролизу. Благодаря пептидной связи белки подвергаются кислотному, щелочному и ферментативному гидролизу. При этом образуются свободные аминокислоты.
Факторы стабилизации белка в растворе.
1. Гидратная оболочка – слой молекул воды на поверхности белковой молекулы. Вода связана с белковой молекулой слабыми связями («связанная вода»). Гидратная оболочка не дает белковым молекулам сближаться и выпадать в осадок.
2. Заряд белковой молекулы. На поверхности белковой молекулы есть положительно и отрицательно заряженные радикалы аминокислот. Количество этих групп и, следовательно, заряд белков зависят от рН среды. Значение рН, при котором белок имеет нулевой заряд, называется изоэлектрической точкой (ИЭТ). В ИЭТ белки наименее устойчивы. При потере заряда в ИЭТ белки агрегируют и выпадают в осадок.
Денатурация– нарушение нативной конформации белка. При денатурация изменяются физико-химические свойства и теряется биологическая активность белка. При денатурации не изменяется первичная структура, но изменяется вторичная, третичная и, если есть, четвертичная структура.
1. Физические (высокая температура, вибрация, радиация, УФО, ультразвук и др.).
2. Химические (мочевина, кислоты и щелочи, соли тяжелых металлов, растительные алкалоиды, органические растворители и др.).
При денатурации уменьшается растворимость, изменяется электрофоретическая подвижность, изменяется число реакционных групп.
Способность белков к денатурации используется в медицине.
- Пастеризация продуктов.
- Стерилизация шовного материала.
Ренатурация– восстановление нативной конформации денатурированного белка. При ренатурации восстанавливаются физико-химические свойства белков и их активность. В организме происходит быстрая ренатурация при помощи специфических белков — шаперонов. Шапероны присоединяются к денатурированному белку слабыми связями и создают условия для ренатурации.
Классификации белков.
1.По растворимости — водорастворимые (альбумины), солерастворимые (глобулины), спирторастворимые (протамины), нерастворимые (склеропротеины).
2.По форме белковой молекулы – фибриллярные, глобулярные, мембраносвязанные.
3.По химическому строению – простые белки (состоят только из аминокислот) и сложные (состоят из аминокислот и небелковой части – липидов, углеводов, металлов, нуклеиновых кислот).
4.По функциям – структурная, каталитическая, регуляторная, двигательная, транспортная, рецепторная, защитная, резервная, опорная.
Методы исследования белков.
Дата добавления: 2016-11-23 ; просмотров: 1203 | Нарушение авторских прав
источник
Этапы исследования структуры белка:
1).Выделение белка из смеси в чистом виде.
2).Определение N-концевой аминокислоты.
3).Определение С-концевой аминокислоты.
4).Определение аминокислотной последовательности.
Методы разделения смеси белков
1).Диализ (метод мембранных сил).
Для этого используют полуроницаемые мембраны (целлофан, целлюлоза), диаметр пор которых варьирует в широких пределах.
2).Гель-хроматография.
Используеься гель с порами. Белки с маленьким размером заходят в поры, и скорость их прохождения больше.
3).Аффинная хроматография.
Основана на высоком сродстве белков к специфическим группам и молекулам. Колонка для аффинной хроматографии заполняется твёрдым носителем, поверхность которого содержит вещества, способные специфически связываться с анализируемыми белками (например белок лектин связывается с глюкозой).
4).Ионно-обменная хроматография.
Каждый белок имеет определённый заряд — положительный или отрицательный в определённом рН. Это свойство и лежит в основе ионной хроматографии. Для этого используют целлюлозу, которая заряжена либо отрицательно (катионный обменник) либо положительно (анионный обменник). Белки, которые имеют противоположный заряд по отношению к целлюлозе, сохраняются при прохождении раствора белков через колонку. Потом их отсоединяют с помощью элюентов.
5).Адсорбционная хроматография.
Разделение компонентов смеси (образца) основана на их различной сорбируемости на твёрдых адсорбентов. В качестве адсорбентов используют:
-активированный древесный уголь;
-гель фосфата кальция;
-оксид аллюминия;
-оксид кремния;
6).Распределительная хроматография.
Твёрдый носитель играет роль опоры для передвигающего с разной скоростью белка. Носители — силикагель, крахмал, плёнки.
7).Ультрацентрифугирование.
8).Электрофорез ( смотри методичку А.Д.Тагановича «Нуклеопротеины»).
9).Изоэлектрофокусирование.
Основано на проведение электрофореза в средах с градиентом рН. При этом точное месторасположение на колонке каждого белка из смеси определяется значением его изоэлектрической точки.
Определение N-концевой аминокислоты
Перед тем, как определять последовательность аминокислот в белке, необходимо удалить дисульфидные связи внутри пептидов и между другими пептидами. Для этого используют 2-меркаптоэтанол или дитиотреитол. Чтобы предотвратить обратное образование дисульфидных связей, белок надо обработать йодацетатной кислотой (алкилирует свободные сульфогидрильные радикалы). Методы:
1).Метод Сенжера. Для этого используют 1-фтор-2,4-динитробензол (ФДНБ), который взаимодействует с N-концевой аминокислотой в щелочных условиях. Такая аминокислота может быть отщеплена от белка и идентифицирована, т.к. имеет жёлтый цвет. Затем проводят электрофорез и сравнивают искомую аминокислоту со стандартами.
2).Даксил-хлорид. Как и ФДНБ, даксил-хлорид взаимодействует с N-концевой аминокислотой в щелочных условиях. Анализ как по методу Сенжера, только даксилированные аминокислоты определяют посредством флюоресценции.
3).Метод деградации Эдмана. При использовании этого метода аминокислотная последовательность в белке остаётся невредимой. Это имеет преимущество перед предыдующими методами, т.к. можно определить всю последовательность аминокислот в белке. При этом методе используют фенилизотиоционат (ФИТЦ).
Определение С-концевой аминокислоты
1).Метод Акабори. Используется гидразин. Он расщепляет пептидные связи , не нарушая последовательность а-т в пептиде. Эту а-ту определяют с помощью ФДНБ.
2).Ферментативные методы, Используются карбоксипептидазы, которые осуществляют разрыв пептидной связи с того конца пептида, где содержится свободная СООН-группа. Это приводит к освобождению С-концевой аминокислоты, природа которой может быть идентифицирована методом хроматографии.
Определение аминокислотной последовательности
Для этого сначала проводят избирательный (частичный) (химический или ферментативный) гидролиз пептида на олигопептиды, последовательность а-т в которых может быть точно определена.
Химические методы избирательного гидролиза основаны на применении таких химических реактивов, которые вызывают селективный распад пептидных связей, образованных определёнными а-тами, оставляя незатронутыми другие связи:
-бромциан (по остаткам метионина)
-гидроксиамин (меду аспаргиновой кислотой и глицином)
-N-бромсукцинамид (по остаткам триптофана).
Ферментативные методы — основаны на избирательном действии протеолитических ферментов, расщепляющих пептидные связи, образованные определёнными а-тами:
-пепсин (фен-тир-глу)
-химотрипсин (три-тир-фен)
-папаин, субтилизин и др.
Метод пептидных карт (метод отпечатков пальцев, метод Ингрена).
Используется при определении сходства и различий гомологических белков по первичной структуре.
Гомологические белки — это белки, которые выполняют одну и туже функцию, но различаются по структуре (норма и патология, локализованные в разных органах).
Этапы:
-оба белка (например от здорового и больного человека) расщепляют на пептиды с помощью пепсина, трипсина.
-затем смесь пептидов наносят в виде пятна на угол листа фильтровальной бумаги.
-проводят электрофорез в горизонтальном направлении и хроматографию в вертикальном.
-полученные карты (их две) сравнивают.
Этим методом определяется серповидно-клеточная анемия (глу — вал).
Синтез жирных кислот
Синтез жирных кислот — путь, обратный окислению ЖК. Однако имеются существенные отличия. Синтез ЖК протекает в цитоплазме, в то время, как окисление — в митохондрии. Другое отличие связано с использованием разных нуклеотидов как кофакторов: окисление сопровождается восстановлением ФАД+ и НАД+, а синтез — окислением НАДФН.
Первый шаг в синтезе ЖК — это превращение ацетилКоА в малонилКоА с помощью фермента ацетилКоАкарбоксилазы (АКК). АКК — главное место регуляции. Этот фермент существует в двух формах — мономерной и полимерной. Активной является полимерная форма. Активирует АКК цитрат, а ингибируют длинноцепочечные ЖК. АКК требует биотин как кофактор.
Для синтеза ЖК используется ацилсинтетазный комплекс, который состоит из:
-ацилпереносящий белок (АПБ)
-бетта-кетоацилсинтетаза (КС)
-малонилтрансфераза (МТ)
-бетта-кетоацилКоАредуктаза (КР)
-бетта-гидроксиацилДГ (ГД)
-еноилредуктаза (ЕР)
-ацилтрансацетилаза (АТ).
Сначала одна молекула ацетилКоА присоединяется к КС, а малонилКоА — к АПБ. Реакция конденсации приводит к образованию соединения с четырьмя углеродами, которое, будучи присоединёной к АПБ, подвергается востановлению (КР), дегидротации (ГД), и ещё раз восстановлению (ЕР). В завершение цикла полностью восстановленный продукт попадает опять на КС, а к АПБ присоединяется следующая молекула малонилКоА. Тем самым начинается следующий цикл реакций.
Суммарное уравнение:
ацетилКоА + 7малонил-КоА + 14НАДФН + 14Н+ = пальмитат + 7СО2 + 14НАДФ + 8КоА-SH + 6Н2О.
Сначала образуется пальмитат, из которого могут образовываться другие ЖК.
Источник цитоплазматического ацетилКоА
АцетилКоА образуется в митохондриях главным образом в ходе двух рекций: пируватдегидрогеназной (ПВК — АцетилКоА) и окисление ЖК. Для того, чтобы ацетилКоА был использован для синтеза ЖК, он должен перейти в цитоплазму.
АцетилКоА идёт в цитоплазму в форме цитрата. В цитоплазме под действием цитратлиазы цитрат превращается в ЩУК и ацетилКоА. Затем ЩУК превращается в малат посредством малатДГ. А малат под действием малик-фермента превращается в пируват (кофактор — НАДФ+/НАДФН). Пируват затем идёт в митохондрию, где под действием пируваткарбоксилазы превращается в ЩУК.
В ходе синтеза ЖК образуется пальмитат, который содержит 16 углеродных атомов и все связи насыщены. Чтобы получить другие ЖК пальмитат надо удлинить (элонгация) и/или добавить двойные связи (десатурация, ненасыщение, в общем desaturation). Элонгация и десатурация ЖК проходит как в митохондриях, так и эндоплазматическом ретикулуме.
Элонгация осуществляется благодаря конденсации ацилКоА с малонилКоА. В результате получается ЖК , на два атома углерода длиннее предыдущей, которая проходит восстановление, дегидратацию и снова восстановление.
Десатурация проходит под действием десатураз, которые содержат негемовое железо. Известно 4 вида десатураз, которые образуют двойные связи по С4, С5, С6 и С9-углеродным атомам. Электроны, которые переносятся во время десатурации, в свою очередь транспортируются на цитохром b5, а потом на НАДН-цитохром-b5-редуктазу.
Таких десатураз, которые образовывали двойную связь дальше, чем С9, в организме человека нет, поэтому такие ЖК, как линолевая и леноленовая, в организме синтезироваться не могут и обязательно должны поступать с пищей. Они называются незаменимые ЖК или витамин F. Арахидоновая кислота является частично незаменимой, поскольку она может синтезироваться из линолевой. А арахидоновая кислота является предшественником эйкозаноидов (простагландинов и тромбоксанов).
Синтез триацилглицеролов (ТАГ)
ТАГ являются эфирами трёхатомного спирта глицерола и трёх ЖК. ЖК, которые входят в состав ТАГ, в основном насыщены. Главным строительным кирпичиком для синтеза ТАГ во всех тканях, кроме жировой, является глицерол. В адипоцитах отсутствует фермент глицеролкиназа, поэтому здесь предшественником ТАГ является ФДА, промежуточный продукт гликолиза. Это означает, что для того, чтобы сохранить ЖК в форме ТАГ, необходимо окислить глюкозу.
Если в синтез вступает глицерол, то он активируется фосфорилированием с помощью глицеролкиназы, а если предшественником является ФДА, то он активируется с помощью фермента глицерол-3-фосфатДГ (реакция требует НАДН). ЖК, прежде чем включиться в ТАГ, должны активироваться с помощью ацилКоАсинтетазы. Сначала две молекулы ацилКоА присоединяются к глицерол-3-фосфату, и образуется 1,2-диацилглицеролфосфат (также называется фосфатидная кислота). Потом с помощью фосфатазы от фосфатидной кислоты уходит фосфат, образуется 1,2-ДАГ, который является субстратом для присоелинения третьего моля ЖК.
КИШЕЧНОЕ ВСАСЫВАНИЕ ЛИПИДОВ
Для того, чтобы липиды пищевого происхождения смогли использоваться организмом, они сперва должны всосаться в малом кишечнике. Жиры не растворимы в жидкой среде кишечника и для того, чтобы они всосались, необходимо их эмульгирование. Эмульгирование липидов идёт с помощью желчных кислот, которые синтезируются из холестерина в печени.
Как только произошло эмульгирование, липиды становятся доступными для панкреатических липаз (особенно липаза и фосфолипаза А2).
Продукты панкреатических липаз затем диффундируют в кишечные эпителиальные клетки, где из них снова ресинтезируются триацилглицеролы (ТАГ).
Затем эти триацилглицеролы и холестерол пищевого происхождения соединяются с протеинами и образуются аполипопротеины. Именно в таком виде они доставляются к клеткам организма. В этих апопротеинах разное соотношение липидов и белков. И как следствие этого они имеют разную плотность. Больше всего белков содержится в липопротеинах высокой плотности и поэтому они самые маленькие. Меньше всего — в хиломикронах, и из-за этого они самые крупные.
ХИЛОМИКРОНЫ
Хиломикроны собираются в слизистой оболочке кишечника, а точнее в энтероцитах.
Из липидов в хиломикронах больше всего ТАГ. Из апобелков они содержат АпоВ-48, АпоА-1, АпоА-2 и 4. АпоВ-48 входит только в состав хиломикронов.
Хиломикроны из-за своего большого размера не могут проникнуть в кровеносный сосуд, поэтому они поступают в лимфатическую систему, а только потом через подключичную вену в кровь. Для того, чтобы хиломикроны смогли путешествовать по крови, им требуется АпоС-2 и АпоЕ. Эти апопротеины они берут из ЛПВП.
В капиллярах жировой ткани и мышцах от ТАГ (которые входят в состав хиломикронов) уходят жирные кислоты (ЖК) посредством активности липопротеинлипазы(ЛПЛ), которая расположена на поверхности эндотелиальных клетках капилляров. Для того, чтобы активировалась ЛПЛ, необходимо присутствие АпоС-2.
Затем ЖК входят в клетки жировой или мышечной ткани, а глицерол идёт в печень, где превращается в 2-фосфодиоксиацетон.
Во время удаления ЖК часть фосфолипидов и апобелков переносится на ЛПВП. Как только от хиломикронов ушёл АпоС-2, происходит инактивация ЛПЛ. При этом хиломикроны превращаются в остатки хиломикронов.
Остатки хиломикронов, состоящие главным образом из холестерина, АпоЕ и АпоВ-48, доставляются и потребляются печенью посредством взаимодействия со специальным рецептором. Для того, чтобы произшло узнавание, требуется присутствие АпоЕ и АпоВ-48.
Функции хиломикронов:
-доставка ТАГ пищевого происхождения в жировую ткань;
-доставка холестерола пищевого происхождения в печень.
ЛИПОПРОТЕИНЫ ОЧЕНЬ НИЗКОЙ ПЛОТНОСТИ (ЛПОНП)
Если мы потребили жиров и углеводов больше, чем это нужно организму, то они превратятся в печени в ТАГ.
Затем эти ТАГ упаковываются в ЛПОНП и идут в кровь для доставки к различным тканям (в основном жировой и мышечной) для продукции энергии, полученную путём окисления.
Следовательно, ЛПОНП — это молекулы, которые образовались для транспорта ТАГ эндогенного происхождения к внепечёночным тканям. Как и хиломикроны, ЛПОНП для путеществия по крови требуют АпоЕ и АпоС, которые они берут от ЛПВП. Кроме ТАГ в состав ЛПОНП входят холестерол, эфиры холестерола и апопротеины (АпоВ-100, АпоС-2 и 3, АпоЕ).
ЖК ЛПОНП освобождаются в жировой или мышечной ткани по тому же пути, что и хиломикроны (через активацию ЛПЛ).
После действия ЛПЛ ЛПОНП превращаются в липопротеины промежуточной плотности (ЛППП), которые также называются остатками ЛПОНП.
При дальнейшей потере ТАГ ЛППП превращаются в липопротеины низкой плотности (ЛПНП).
ЛИПОПРОТЕИНЫ ПРОМЕЖУТОЧНОЙ ПЛОТНОСТИ (ЛППП)
ЛППП образуются из ЛПОНП путём удаления от последних ТАГ. Дальше ЛППП либо превращаются в ЛПНП, либо непосредственно потребляются печенью.
ЛППП взаимодействуют с специальным рецептором, после этого формируется комплекс, который эндоцитозом входит в цитоплазму гепатоцитов. Для того, чтобы этот рецептор узнал ЛППП, требуется присутствие АпоВ-100 и АпоЕ, поэтому этот рецептор ещё называется АпоВ-100/ АпоЕ-рецептор.
ЛИПОПРОТЕИНЫ НИЗКОЙ ПЛОТНОСТИ (ЛПНП)
Каждая клетка для своей жизнедеятельности требует холестерол как мембранный компонент. Это удолетворяется двумя путями: либо холестерол в клетке синтезируется de novo, либо приходит в клетку из внеклеточных источников (хиломикроны и ЛПНП).
Как было сказано выше, холестерол пищевого происхождения доставляется в печень в составе хиломикронов. Кроме того, в печени синтезируется свой собственный холестерол. Он может транспортироваться к внепечёночным тканям, если упакован в ЛПОНП. В крови ЛПОНП под действием ЛПЛ превращается в ЛПНП, поэтому ЛПОНП — первичные переносчики холестерола ко всем тканям.
Исключительный апопротеин ЛПНП — это АпоВ-100. ЛПНП потребляются клетками после взаимодействия их с рецептором. Потребление ЛПНП в основном происходит в печени, надпочечниках и жировой ткани.
В цитоплазме клетки холестерол встраивается в мембрану в тех местах, где это необходимо. Если внутриклеточного холестерола итак много, то он превращается в эфиры холестерола посредством фермента ацилКоА-холестерол ацилтрансферазы (АХАТ). Эфиры холестерола могут запасаться в клетке. Активность АХАТ увеличивается в клетках в присутствии холестерола.
ЛИПОПРОТЕИНЫ ВЫСОКОЙ ПЛОТНОСТИ (ЛПВП)
ЛПВП образуются de novo в печени и малом кишечнике как протеин-богатые частицы. ЛПВП не имеют холестерола и эфиров холестерола. Основные апопротеины — АпоС-1, АпоА-1, АпоС-2, АпоЕ и другие. Главная их функция — это накопление апопротеинов.
Свободный холестерол, который присутствует в остатках хиломикронов и ЛППП, может быть этерифицирован через активность лецитин-холестерол-ацилтрансферазы, которая ассоциирована с ЛПВП.
Окисление жирных кислот
Использование липидов пищевого происхождения требует того, чтобы они всосались в кишечнике. Но липиды не растворимы в водной среде кишечника, поэтому необходимо их эмульгирование. Эмульгирование осуществляется с помощью солей желчных кислот, которые синтезируются печенью.
Эмульгированные жиры могут расщепляться под действием панкреатических липаз (в основномлиназа и фосфолипаза А2). Эти ферменты, секретируемые поджелудочной железой, дают свободные ЖК и смесь моно- и диацилглицеролов из ТАГ. Панкреатическая липаза расщепляет ТАГ по первой и второй позиции последовательно, образуя 1,2-ДАГ и 2-ацилглицерол. Фосфолипиды расщепляются с помощью панкреатической фосфолипазы А2. При этом образуются свободные ЖК и лизофосфолипиды.
Потом продукты панкреатических действий липаз вступают в клетки кишечника, где заново осуществляется ресинтез ТАГ. Затем ТАГ соединяются с протеинами, формируя липопротеиновые комплексы, которые называются хиломикроны. Хиломикроны состоят из липидных капель, окружённых более полярными липидами и протеинами. ТАГ, синтезируемые в печени, упаковываются в ЛПОНП и идут прямо в кровь, в то время как хиломикроны из-за своего большого размера не могут попасть сразу в кровь и поэтому сначала идут в лимфу, а только потом в кровь.
Хиломикроны и ЛПОНП затем идут к различным тканям и органам для доставки энергии через окисление ЖК. С помощью фермента липопротеинлипаза идёт гидролиз ТАГ, которые содержаться в хиломикронах и ЛПОНП, на глицерол и свободные ЖК. Глицерол затем идёт в печень, где превращается в промежуточный продукт гликолиза — ФДА.
Мобилизация жировых депо
Основные источники ЖК для окисления — это ЖК пищевого происхождения и мобилизованные из клеточных депо. ЖК накапливаются главным образом в составе ТАГ в адипоцитах жировой ткани. Если организм нуждается в энергии, то эти ЖК, которые находятся в составе ТАГ, могут мобилизоваться для использования их периферическими тканями. Освобождение ЖК от ТАГ — это результат активности фермента гормон-чувствительной липазы.
Стимулом может быть глюкагон, эпинефрин (адреналин), бетта-кортикотропин. Эти гормоны связываются с рецепторами, которые расположены на поверхности клеток. Это ведёт к активации аденилатциклазы, возрастанию уровня цАМФ, что в свою очередь ведёт к активации протеинкиназы А, которая фосфорилирует и таким образом активирует гормон-чувствительную липазу. Этот фермент освобождает ЖК от первого и третьего углеродного атома ТАГ. Потом ДАГ расщепляются с помощью диацилглицероллипазы, а МАГ — с помощью моноацилглицероллипазы. При этом образуется один моль глицерола и три моля ЖК.
Свободные ЖК диффундируют через адипоциты, в крови связываются с альбумином и транспортируются в другие ткани, где вступают в клетки с помощью пассивной диффузии.
Но мобилизация может тормозиться многими стимулами, например, инсулином. Когда человек хорошо поел, то из клеток поджелудочной железы секретируется инсулин, который предупреждает мобилизацию ЖК из жировых депо, тормозя активность гормон-чувсвительной липазы.
Реакции окисления
Прежде чем ЖК будут окислены в митохондрии, сначала они должны активироваться в цитоплазме. Активация проходит с помощью фермента ацилКоАлигаза (ацилКоАсинтетаза или тиокиназа).
ЖК + АТФ + КоА = АцилКоА + ФФн + АМФ
Окисление ЖК проходит в митохондриях. Транспорт ацилКоА в митохондрию идёт с помощью ацилкарнитинового посредника, который образуется в результате активности карнитин-ацилтрансферазы 1, фермента, который расположен на наружной мембране митохондрий. Ацилкарнитиновая молекула затем транспортируется в митохондрию, где с помощью карнитин-ацилтрансферазы 2 идёт регенерация ацилКоА.
Каждый цикл бетта-окисления генерирует 1 моль НАДН, 1 моль ФАДН2 и 1 моль ацетилКоА, который идёт в цикл Кребса, где даёт 12 моль АТФ. Окисление олеиновой кислоты (18С) даёт 146 АТФ, в то время, как эквивалентное количество углеродных атомов глюкозы только 114 АТФ.
Альтернативные пути окисления
Большинство природных липидов содержат ЖК с чётным количеством углеродных атомов. При окислении ЖК с нечётным количеством углеродных атомов на последнем витке образуется 1 моль ацетилКоА и 1 моль пропионилКоА. ПропионилКоА потом превращается в сукцинилКоА, который идёт в цикл Кребса.
Окисление ненасыщенных ЖК точно такое же, как и насыщенных, исключая реакцию образования двойной связи. В этих случаях связь изомеризуется с помощью еноилКоАизомеразы и окисление продолжается дальше.
Регуляция метаболизма ЖК
Главным органом, который чувствует поел человек или нет, является поджелудочная железа. При низкой концентрации глюкозы в крови клетки поджелудочной железы секретируют глюкагон, а при повышенной — инсулин.
Метаболизм жиров регулируется двумя различными механизмами:
-кратковременная регуляция осуществляется через модификацию фермента.
-долговременная регуляция осуществляетяс с помощью изменения скорости синтеза фермента.
Синтез кетоновых тел
Во время высокого уровня окисления жирных кислот образуется большое количество ацетилКоА. Если в цикле Кребса его достаточно, то он идёт на синтез кетоновых тел, кетогенез.
Кетоновые тела:
-ацетоацетат
-бетта-гидроксибутират (восстановленная форма ацетоацетата)
-ацетон.
Формирование ацетоацетилКоА осуществляется путём конденсации двух молекул ацетилКоА в реакции, обратной тиолазной. АцетоацетилКоА и ещё один моль ецтилКоА превращаются в бетта-гидрокси-бетта-метилглутарилКоА (ГОМГ-КоА) с помощью фермента ГОМГ-КоАсинтетазы. Этот фермент находится в большом количестве в печени. Небольшое количество ГОМГ-КоА покидает митохондрию и затем с помощью ГОМГ-КоА редуктазы превращается в мевалонат, который является предшественником в синтезе холестерола). В митохондрии под действием ГОМГ-КоА лиазы ГОМГ-КоА превращается в ацетоацетат. Ацетоацетат может спонтанно декарбоксилироваться до ацетона или превращаться в бетта-гидроксибутират под действием бетта-гидроксибутиратДГ. Когда уровень гликогена в печени высок, то продукция бетта-гидроксибутирата возрастает.
Когда использование углеводов низкое или недостаточное, то падает уровень ЩУК. Это в свою очередь ведёт к возрастанию освобождения кетоновых тел из печени для исползования их как топливо другими тканями. В ранних стадиях голдания, когда последние остатки жиров окислились, сердце и мышцы главным образом будут потреблять кетоновые тела для того, чтобы сохранить драгоценную глюкозу, которая необходима мозгу.
Кетоновые тела используются внепечёночными тканями посредством превращения бетта-гидроксибутирата в ацетоацетат, а ацетоацетат в ацетоацетилКоА. Первый шаг — это реакция, обратная бетта-гидроксибутиратДГ-азной реакции. Второй — посредством активности ацетоацетат-сукцинилКоА трансферазы, которая также называется кетоацилКоА трансфераза.
ацетоацетат + сукцинилКоА = ацетоацетилКоА + сукцинат
Этот фермент присутствует во всех тканях, кроме печени, что позволяет печени продуцировать кетоновые тела, не используя их.
Регуляция кетогенеза
1).Освобождение свободных ЖК из жировой ткани напрямую тормозит уровень кетогенеза в печени.
2).Как только ЖК попадает в печень, то у неё есть два пути. Она может активироваться до ацил-КоА и потом окисляться, а может этерифицировать глицерол для синтеза ТАГ. Если в печени достаточно глицерол-3-фосфата, то большое количество ЖК пойдёт на синтез ТАГ.
3).Окисление ЖК регулируется гормонами посредством фосфорилированием АКК (активирует глюкагоном и ингибируется инсулином).
4).АцетилКоА может идти в цикл Кребса. Так что если клетка нуждается в АТФ, то ни о каком синтезе кетоновых тел не может быть и речи.
Биосинтез холестерола
Холестерол выполняет в организме очень важные функции:
-входит в состав мембран;
-является предшественником желчных кислот и стероидных гормонов.
Холестерол пищевого происхождения и холестерол, который синтезируется de novo, доставляются клетками через циркуляцию липопротеинов. Также транспортируются и эфиры холестерола (в этой форме холестеррол запасается в клетках).
Синтез и использование холестерола должно тщательно регулироваться, для того, чтобы предотвратить его ненормальное отложение в организме (особенно опасно его отложение в коронарных артериях).
Около половины всего холестерола организма синтезируется de novo.
АцетилКоА, который используется в синтезе холестерола, получается в окислительных реакциях (ЖК, пирувата) в митохондриях и затем транспортируется в цитоплазму тем же самым путём, который описан в синтезе ЖК.
АцетилКоА также может быть получен и в цитоплазме в результате окисления этанола- ацетилКоА-синтетазой.
Все восстановительные реакции синтеза холестерола используют НАДФН как кофактор.
Сначала конденсируются два моля ацетил-КоА с образованием ацетоацетил-КоА (реакция, обратная тиолазной). Затем ацетоацетил-КоА и третий моль ацетил-КоА под действием ГОМГ-КоА-синтетазы (ГОМГ — 3-гидрокси-3-метил-глатарил) превращаются в ГОМГ-КоА. Потом ГОМГ-КоА под действием ГОМГ-КоА-редуктазы превращается в мевалонат (требуется два моля НАДФН). Мевалонат затем проходит три фосфорилирования (надо три моля АТФ), образуя 5-пирофосфо-3-фосфомевалонат. Потом — декарбоксилирование с образованием изопентенилпирофосфата (ИПФ).
ИПФ находится в равновесии с его изомером — диметилаллилпирофосфатом (ДМПП). Затем одна молекула ИПФ конденсируется с одной молекулой ДМПП и образуется геранилпирофосфат (ГПФ). ГПФ затем конденсируется с ИПФ и получается фарнезилпирофосфат(ФПФ). Затем под действием НАДФН-зависимого фермента соединяется две молекулы ФПФ и образуется сквален. Потом сквален превращается в ланостерол, а ланостерол — в холестерол.
Регуляция
ГОМГ-редуктаза:
-синтез фермента затормаживается холестеролом
-вариабельность активности в течении дня
-активность усиливает инсулин, уменьшает глюкагон.
-активность регулируется за счёт фосфорилирования/дефосфорилирования.
-ингибиторы — мевастатин, мевакор, ловастатин.
Холесерол в клетках для его запасания может превращаться в эфиры холестерола. Это происходит благодаря двум ферментам:
-ацетилКоА-холестеролтрансфераза (АХАТ)
-лецитин-холестеролацилтрансфераза (ЛХАТ).
Репликация
Механизм репликации ДНК хорошо исследован у бактерий E.coli. Он состоит из трёх различных ферментов — полимеразы 1, 2 и 3. Репликацию генома обеспечивает пол.3.
В эукариотических клетках найдено пять различных полимераз — альфа, бетта, гамма, сигма и эпселон. Пол. альфа эукариот соответствует пол.3 прокариот, пол. бетта — пол.1, а полимераза гамма ответствена за синтез митохондриальной ДНК.
Для того, чтобы ДНК-полимеразы могли реплицировать ДНК, требуется множество дополнительных белков:
1).Праймаза — это ни что иное, как РНК-полимераза, которая катализирует синтез короткого олигорибонуклеотида (4-10 нуклеотидов), т.е. праймера, с которого потом начинается синтез ДНК.
2).Хеликаза — выполняет функцию раскручивания двойной спирали ДНК.
3).ДНК-связывающие белки — препятствуют обратному скручеванию цепочек ДНК.
4).ДНК-лигаза — сшивает фрагменты Оказаки.
5).Топоизомеразы — снимают суперскручивание, разрезая цепочку ДНК.
Процесс репликации ДНК начинается в определённом месте хромосомы, требует праймер, идёт в направлении 5` — 3` на обоих цепочках одновременно и даёт точные копии цепочек.
Сначала идёт раскручивание двойной спирали ДНК с помощью хеликазы. Образовавшиеся на некоторое время одноцепочечные участки ДНК служат в качестве матрицы при репликации и стабилизируются при помощи особых белков, которые связываются с одной цпочкой ДНК и препятствуют обратному комплементарному взаимодействию цепей ДНК.
Потом праймаза катализирует синтез праймера. С праймера начинается синтез ДНК. Синтез ДНК идёт в направлении 5` — 3` посредством прикрепления 5`-фосфатной группы dНТФ к существующей свободной 3`-ОН группе праймера с последующим освобождением пирофосфата.
Синтез одной цепи осуществляется непрерывно, а другой — прерывисто.Цепочка, синтез которой осуществляется непрерывно, называется ведущая, а та, которой прерывисто, — отстающая. На отстающей цепи синтезируются короткие (100-200 нуклеотидов) фрагменты (Оказаки), которые затем сшиваются ДНК-лигазами.
Как получается так, что ДНК-полимераза копирует обе цепочки одновременно? ДНК-полимераза — это димер, ассоциированный с другими белками в репликационной вилке, которая называется реплисомой. Отстающая цепочка временно делает петлю через реплисому и ДНК-полимераза идёт вдоль двух цепочек одновременно.
Терминация наступает тогда, когда исчерпана ДНК-матрица.
Репарация
Репарация — это внутриклеточный процесс, обеспечивающий восстановление повреждённой структуры молекулы ДНК.
1).Эндонуклеаза — «узнаёт» повреждённый участок и рядом с ним разрывает нить ДНК.
2).Экзонуклеаза «вырезает» повреждённый участок.
3).ДНК-полимераза по принципу комплементарности синтезирует фрагмент ДНК на месте разрушенного.
4).Лигаза «сшивает» концы ресинтезированного участка с основной нитью ДНК.
Принципиально доказана возможность репарации молекулы ДНК при повреждении обоих цепей. При этом информация может быть считана с иРНК (фермент ревертаза).
Обратная транскрипция
Обратная транскрипция — это синтез ДНК на матрице РНК. В 1970г. в составе онковирусов был открыт фермент обратная транскриптаза (ревертаза, РНК-зависимая ДНК-полимераза), который катализирует биосинтез молекулы ДНК на матрице РНК.Фермент также открыт во многих клетках про- и эукариот, в частности — в лейкозных клетках, пролиферирующих тканях, включая эмбриональные ткани.
Синтез ДНК на матрице РНК включает три стадии:
1).Ревертаза синтезирует на матрице вирусной РНК комплементарную цепь ДНК, что приводит к формированию гибридной молекулы.
2).Разрушение исходной вирусной РНК из комплекса гибридной молекулы под действием РНКазы.
3).На матрице цепи ДНК комплементарно синтезируются новые цепи ДНК.
Обратная транскрипция имеетогромное значение для процессов малигнизации.
Синтез иРНК
Главный фермент синтеза иРНК — это РНК-полимераза (транскриптаза, ДНК-зависимая РНК-полимераза).
Этот фермент отличается от ДНК-полимеразы:
-РНК-полимеразы в клетке значительно больше, чем ДНК-полимеразы;
-РНК-полимераза работает с меньшей скоростью (50-100 нуклеотидов/сек, а ДНК-полимераза — 1000 нуклеотидов/сек)
-ДНК-полимераза обеспечивает большую верность, чем РНК-полимераза.
Наиболее изучена РНК-полимераза E.coli. Она состоит из пяти субъединиц — две альфа, две бетта и одна гамма. Считается, что функция гамма-субъединицы — это узнавание определённого участка на матрице ДНК, который называется промотор, куда присоединяется РНК-полимераза. Другим субъединицам фермента (core — ядро) приписывается функция инициации биосинтеза РНК (альфа), связывание субстратов и элонгация синтеза (бетта).
Сначала РНК-полимераза связывается с одной цепью нативной ДНК в определённой точке, вызывая расплетение биспиральной структуры на ограниченном участке, где и происходит ситез РНК. Потом синтез идёт в направлении 5` — 3`. К свободной 3`-ОН группе присоединяется 5`-фосфатная группа другого нуклеотидтрифосфата (НТФ) с последующим освобождением пирофосфата. Терминация идёт за счёт ро-фактора. Этот фактор обладает способностью обратимо связываться с терминирующим участком ДНК, выключая действие РНК-полимеразы. Таким образом происходит синтез пре-иРНК.
После синтез пре-иРНК у эукариот происходит процессинг, который включает:
-сплайсинг (нуклеотические и лигазные реакции)
-кепирование (образование шапочки)
-терминальные реакции полиаденилирования и метилирования.
Последовательность нуклеотидов в иРНК начинается с пары ГУ (5`-конец) и заканчивается парой АГ (3`-конец). Эти последовательности служат местами узнавания для ферментов сплайсинга.
Химический смысл кепирование сводится к присоединению 7-метилгуанозина посредством трифосфорной связи к 5`-концу молекулы иРНК.
Полиаденилирование заключается в последовательном ферментативном присоединении от 100 до 200 остатков АМФ и фрагментов ААУАА к 3`-концу иРНК. Также происходит метилирование 2`-ОН групп рибозы и N6-атомов АМФ.
Синтез белка
Синтез белка (трансляция) условно может быть разделён на 2 этапа: активирование аминокислот и собственно процесс трансляции, который состоит из инициации, элонгации и терминации.
Активирование а-т — идёт с помощью специфических аминоацил-тРНК синтетазы.
Инициация
Инициация требует специфической тРНК. Для E.coli — это тРНКфmet, для эукариот — тРНКmet. Инициация требует узнавания кодона АУГ. Сначала с помощь eIF1 и eIF3 рибосомадиссоциирует на 40S и 60S субъединицы. Потом с помощью ГТФ и eIF2 активированная тРНК, мет-тРНКmet, связывается с 40S субъединицей, формируя преинициаторный комплекс. Затем с помощью eIF4 преинициаторный комплекс (43S) связывается с инициаторным кодоном АУГ. После этого с помощью eIF5 присоединяется 60S субъединица хромосомы. То место, где произошло связывание РНК с мет-тРНКmet, называется П-центр (пептидильный), другой — называется А-центр (аминоацильный).
Элонгация
Процесс элонгации, как и инициации, требует специфических белков — EF у прокариот и еEF у эукариот. Сначала пептид, который связан с тРНК и находится в П-центре, переносится на NH2-группу аминоацил-тРНК, которая расположена в А-центре. Реакция эта катализируется ферментом пептидилтрансферазой. Для того, чтобы присоединилась следующая аминоацил-тРНК, А-центр должен быть свободным. Для этого пептидил-тРНК из А-центра перемещается в П-центр. Этот процесс называется транслокацией и катализируется ферментом пептидилтранслоказой.
Терминация
Терминация также требует специфических белков — RF у прокариот и еRF у эукариот. Стимулом для терминации являются терминирующие кодоны (УАГ,УАА,УГА). После того, как терминирующий кодон иРНК займёт своё место в А-центре, к нему не присоединится тРНК, а присоединится один из белковых факторов терминации и блокируется дальнейшая элонгация цепи. Затем иРНК покидает рибосому, которая диссоциирует на 40S и 60S субъединицы снова.
Генетический код
Генетический код — это система записи генетической информации в ДНК (иРНК) в виде определённой последовательности нуклеотидов.
Свойства генетического кода:
1).Триплетность — одной а-те соответствует три расположенных рядом нуклеотида молекулы ДНК (иРНК).
2).Вырожденность (избыточность). Количество возможных триплетов — 64, а а-т только 20, поэтому одну а-ту могут кодировать несколько триплетов.
3).Неперекрываемость — один нуклеотид входит в состав только одного триплета.
4).Универсальность — у всех живых организмах одинаковые а-ты кодируются одинаковыми кодонами.
Тиамин также называется ещё витамин В1. Тиамин происходит от замещённого пиримидина и тиазола, которые связаны метиленовым мостиком. Тиамин очень быстро превращается в активную форму, тиамин пирофосфат (ТПФ), в мозге и печени с помощью фермента тиамин дифосфотрансферазы.
ТПФ является необходимым кофактором для пируватДГ, альфа-кетоглутаратДГ и транскетолазы, катализируемой реакции пентозофосфатного пути. Недостаточность потребления тиамина ведёт к тому, что клетка неспособна генерировать энергию (ведь энергия главным образом получается из глюкозы, которая распадается до пирувата, а пируват с помощью пируватДГ превращается в ацетилКоА, который сгорает в цикле Кребса, поэтому при недостатке тиамина пируват не превращается в ацетилКоА, который является главным источником энергии).
Суточное потребление тиамина составляет 1-1,5 мг.
Клинические проявления недостаточности тиамина.
Самыми ранними симптомами недостаточности тиамина являются запор, потеря аппетита, тошнота, депрессия, периферическая невропатия и общая слабость. Хроническая недостаточность тиамина ведёт к более тяжёлым неврологическим симптомам таких как атаксия, помутнение сознания и потеря координации глаз.
Болезнь при тяжёлой недостаточности тиамина называется Бери-Бери. Она развивается либо при диете, богатой углеводами, либо при недостаточности потребления тиамина. Также может развиваться болезнь, известная как синдром Вернике-Корсакова. Этот синдром чаще развивается у алкоголиков благодаря их стилю жизни.
Рибофлавин
Известен ещё как витамин В2. Рибофлавин является предшественником коферментов флавин мононуклеотид (ФМН) и флавин аденин динуклеотид (ФАД). Ферменты, которые требуют ФМН или ФАД как кофактор, называются флавопротеины. Некоторые флавопротеины содержат металл, и тогда они называюстя металлофлавопротеины. Оба класса этих ферментов вовлечены в широкий круг редокс- реакций. В ходе этих реакций образуются восстановленные формы ФМН и ФАД, ФМНН2 и ФАДН2 соответственно. Нормальная суточная потребность в рибофлавине составляет 1,2-1,7 мг.
Клинические проявления недостаточности рибофлавина.
Недостаточность рибофлавина редко наблюдается у жителей большинства европейских стран, т.к. он содержится в нормальных количествах в хлебе, яйцах, молоке, мясе и т.д. Недостаточность рибофлавина очень часто наблюдается у хронических алкоголиков.
Симптомы, связанные с недостаточностью рибофлавина, включают глоссит, себорея, ангулярный стоматит, хеёлоз и фотофобию. Рибофлавин разрушается на свету, поэтому недостаточность рибофлавина может возникнуть у новорожденных, которые лечатся от гипербилирубинемии фототерапией.
Ниацин
Ниацин (никотиновая кислота, никотинамид) известен также под названием витамин В3. Как никотиновая кислота, так и никотинамид могут служить как пищевые источники витамина В3. Ниацин требуется для синтеза активных форм витамина В3, никотинамид аденин динуклеотид (НАД+) и никотинамид аденин динуклеотид фосфат (НАДФ+). НАД+ и НАДФ+ являются кофакторами для значительного числа дегидрогеназ, например лактатДГ, малатДГ.
Ниацин может синтезироваться из аминокислоты триптофана. Однако эта возможность использованиятриптофана для синтеза ниацина ограничена. Из 60 мг триптофана образуется только 1 мг ниацина, кроме того для этого синтеза требуется присутствие витаминов В1, В2 и В6, которых не всегда присутствует в организме в избытке.
Рекомендованая суточная потребность для ниацина составляет 13-19 мг.
Клинические проявления недостаточности ниацина.
Недостаточное потребление ниацина (как и триптофана) ведёт к глосситу, дерматиту, потере веса, диарее, депрессии и деменции. Такие симптомы как депрессия, дерматит и диарея объединены в одно состояние, которое называется пеллагра. Некоторые физиологические состояния организма (например болезнь Хартнупа), а также применение некоторых лекарств может привести к недостаточности ниацина. При болезни Хартнупа страдает всасывание триптофана. Из лекарств можно выделить изониазид, который является основным лекарством для лечения туберкулёза.
Никотиновая кислота (не никотинамид) при назначении фармакологических доз (2-4 г/день) понижает уровень холестерола в крови, поэтому это используется для лечения гиперхолестеролемии. Это связано с тем, что никотиновая кислота уменьшает мобилизацию ЖК из жировых депо. Также никотиновая кислота исчерпывает депо гликогена, что ведёт к возрастанию уровня глюкозы в крови, поэтому терапия никотиновой кислотой не рекомендуется диабетикам и больным подагрой.
Пантотеновая кислота.
Также известна как витамин В5. Пантотеновая кислота образуется из аланина и пантоевой кислоты. Пантотеновая кислота требуется для синтеза коэнзимА (КоА), а также как компонент ацилпереносящего белка, который используется для синтеза ЖК. Следовательно, пантотеновая кислота используется для метаболизма углеводов в цикле Кребса и метаболизма всех жиров и белков.
Недостаточность пантотеновой кислоты набдюдается очень редко, т.к. она широко распространена в пищевых продуктах.
Витамин В6
Пиридоксаль, пиридоксамин и пиридоксин в общем известны как витамин В6. Все три компонента превращаются в биологически активную форму витамина В6, пиридоксальфосфат. Это превращение катализируется пиридоксаль киназой.
Пиридоксальфосфат как кофактор используется в реакциях трансаминирования аминокислот, а также в гликогенолизе как кофактор гликогенфосфорилазы. Суточная потребность в витамине В6 составляет 1,4 — 2,0 мг. Во время беременности и лактации потребность в витамине В6 возрастает на 0,6 мг в день.
Недостаточность витамина В6 бывает редко и обычно ассоциируется с недостаточностью других витаминов из группы В. Недостаточность в этом витамине может возникнуть при применении изониазида (используется для лечения туберкулёза) и пенициллинамина (используется для лечения ревматоидного артрита).
Биотин сам является коферментов для ферментов, которые используются в реакциях карбоксилирования (ацетилКоА карбоксилаза и пируват карбоксилаза). Биотин содержиться во многих продуктах, а также синтезируется нормальной микрофлорой, поэтому его недостаточность наблюдается очень редко. Недостаточность возникает при применении лекарств, которые влияют на микрофлору, а также при чрезмерном потреблении сырых яиц. Последнее связано с тем, что в яйцах содержится белок авидин, который препятствует абсорбции биотина.
Кобаламин более известен как витамин В12. Витамин В12 состоит из тетрапиррольного кольца и иона кобальта в центре. Витамин В12 синтезируется исключительно микроорганизмами и найден в печени животных, связанного с белком в виде метилкобаламина или 5-деоксиаденозилкобаламин. Витамин может освобождаться от белка, и тогда он становится активным. Освобождение осуществляется в желудке с помощью желудочного сока или трипсина после потребления мяса. Витамин потом связывается с фактором Касла, который снтезируется париетальными клетками желудка, и в таком виде происходит его всасывание.
В организме человека имеется только две реакции, которые требуют витамин В12 как кофактор. В ходе катаболизма ЖК с нечётным числом углеродных атомов и в катаболизме валина, изолейцина и треонина конечным продуктом является пропионилКоА, который превращается в сукцинилКоА для окисления его в цикле Кребса. Одним из ферментов для этого превращения является метилмалонилКоА мутаза, который требует витамин В12 как кофактор в превращении метилмалонилКоА в сукцинилКоА.
Второй реакцией, которая требует витамин В12 как кофактор, является превращение гомоцистеина в метионин. Ферментом этой реакции является метионин синтаза.
Клинические проявления недостаточности витамина В12.
Печень может накапливать витамин В12, поэтому его недостаточность встречается очень редко. При недостаточности витамина В12 развивается мегалобластическая анемия, которая в этом случае называется пернициозная анемия. Это наблюдается при недостатке фактора Касла, который необходим для всасывания В12. Анемия является результатом того, что страдает синтез пуриновых и пиримидиновых оснований, а следовательно и синтез ДНК. В синтезе нуклеотидов используется N5-метилТГФК, а для этого необходимо действие метионин синтазы, коферментом которого является витамин В12.
Также неврологическим осложнением недостаточности витамина В12 является демиелизация нервных клеток. Считается, что демиелинизация связана с возрастанием метилмалонилКоА, потому что он является ингибитором малонилКоА, который используется в синтезе ЖК. Это в свою очередь ведёт к нарушения синтеза миелина и деструкции миелиновой оболочки.
Фолиевая кислота
Фолиевая кислота состоит из трёх частей: птеридиновое кольцо, пара-аминобензойная кислота и глутаминовая кислота. Фолевая кислота содержится в дрожжах, листьевых овощах, печени животных и др.
В клетках фолиевая кислота превращается в тетрагидрофолиевую кислоту с помощью фермента дигидрофолат редуктазы. ТГФК переносит различные формы одноуглеродных радикалов (метил, метилен, метенил, формил) в ходе различных реакций. Эти реакции требуются в синтезе серина, метионина, глицина, холина и пуриновых нуклеотидов и дТМФ.
Клинические проявления недостаточности фолиевой кислоты.
Недостаточность фолиевой кислоты связана в первую очередь с нарушением синтеза ДНК. Это ведёт к остановке клеточного цикла быстро пролиферирующих клеток, в частности гемопоэтических клеток. В результате возникает мегалобластическая анемия как и при витамине В12.
Недостаточность фолиевой кислоты из-за его широкого распространения в продуктах встречается редко. Очень часто наблюдается у алкоголиков. У неалкоголиков главными причинами недостаточности является нарушения абсорбции, метаболизма витамина или его повышенной потребности. Например, во время беременности потребность в витамине возрастает. Это происходит благодаря увеличению быстро пролиферирующих клеток. Такие лекарства как антиконвульсанты и оральные контрацептивы ведут к нарушению абсорбции фолиевой кислоты.
Дата добавления: 2016-02-24 ; просмотров: 1116 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
источник