Далеко не каждая будущая мама знает, какие именно анализы она сдает по направлению врача во время вынашивания ребенка. Да это и не всегда требуется. Однако анализ на АФП хорошо известен беременным женщинам. Что это за исследование, о чем оно говорит и каковы нормативные значения АФП при беременности, мы расскажем в этой статье.
Аббревиатурой АФП обозначается белок альфа-фетопротеин. Этот белок в материнском организма образуется при развитии эмбриона и плода. Изначально вещество было открыто в качестве маркера раковых опухолей, и только во второй половине двадцатого века врачи и ученые заметили закономерность — белок появляется в крови беременных женщин, у которых нет никаких злокачественных опухолей.
Альфа-фетопротеин очень похож на другой белок — сывороточный альбумин.
У взрослых людей он переносит в ткани разные вещества с низким молекулярным весом. У малыша, который развивается в материнской утробе, АФП заменяет альбумин и выполняет его функции — переносит по всем тканям с кровью необходимые для роста и развития вещества.
Все функции этого удивительного белка науке еще не известны. Поэтому в энциклопедиях и научных справочниках присутствует формулировка «вероятные функции», «возможные и предположительные функции».
К таким вероятным функциям АФП относят иммуноподавляющее действие — белок неизвестными пока механизмами воздействует на иммунитет женщины, подавляя его активность и возможное отторжение плода, который лишь наполовину является ему «родным». Также АФП «подозревают» в подавлении иммунитета плода. В противном случае малыш мог бы негативно реагировать на новые соединения и белки, которые он получает с материнской кровью.
В самом начале беременности белок АФП производится желтым телом. Однако уже через три недели после зачатия малыш-эмбрион начинает сам производить необходимое белковое соединение. Вещество попадает с мочой крохи в околоплодные воды, а оттуда — в кровоток матери, чтобы быть выведенным наружу.
Количество АФП постепенно нарастает, и с 11-12 недель хорошо определяется в крови женщины.
К 16-17 неделе концентрация вещества поднимается до больших показателей.
Самое высокое содержание АФП в крови женщины наблюдается на 33-34 неделе, после чего количество эмбрионального (плодного) белка начинает медленно убывать.
Белок нашел широкое применение в лечении множества заболеваний, включая онкологические недуги. Его добывают из плацентарной и абортной крови. Во время вынашивания малыша уровень АФП может указывать на возможные осложнения и генетические патологии плода.
Анализ на альфа-фетопротеин также носит название теста Татаринова-Абелева. Он входит в так называемый «тройной тест», который назначается всем беременным в рамках второго пренатального скрининга.
Наилучшим для проведения анализа считается 16-17-18 недели беременности, так как в этот период белок хорошо определяется в крови женщины и носит достоверное диагностическое значение.
Плод, у которого имеются хромосомные аномалии (синдром Дауна, Тернера, Патау и другие, трисомии немолярные, а также пороки развития нервной трубки — головного и спинного мозга) производит определенные количества этого белка.
По уровню АФП можно косвенно судить о возможном отклонении в развитии ребенка.
Чтобы картина была более полной, концентрацию плодного белка сопоставляют с уровнем ХГЧ (хорионического гонадотропного гормона), а также уровнем свободного эстриола.
В некоторых клиниках также определяется уровень ингибина — гормона плаценты, и тогда анализ называется «четверным тестом». Дополняет лабораторную картину УЗИ, которое в обязательном порядке проводится в рамках скринингового обследования.
Кровь на анализ берут из вены. В лабораторию или процедурный кабинет женщине следует явиться натощак, в утреннее время, предварительно отменив прием всех гормональных средств и антибиотиков, если таковые были ей предписаны врачом.
За несколько дней до сдачи крови на анализ беременной стоит отказаться от приема жирной и сладкой пищи, большого количества соли, газированных напитков, кофе. Если будущая мама курит, несмотря на очевидный вред этой привычки, перед сдачей крови от курения следует воздерживаться на протяжении 3-4 часов.
Повлиять на результаты анализа может и нервный фактор, поэтому женщине рекомендуется не нервничать.
Уровень плодного белка АФП растет вместе со сроком беременности, это нетрудно понять по таблице:
Акушерский срок
Концентрация АФП (в Ед/мл)
Первый триместр до 12 недель
Тенденция к постепенному спаду
Поскольку лаборатории опираются на свои таблицы, которые зависят от единиц измерения концентрации вещества, чувствительности и качества реактивов, методов исследования, существует общепринятая мировая практика — измерять уровень в значении, кратном медиане — МоМ (multiples of median).
Нормой при беременности считается уровень АФП от 0,5 до 2,0 МоМ. Таким образом, если в заключении будет указано, что уровень АФП равен 0,2, речь идет о сниженной концентрации белка. Если значение АФП превысит 2 единицы, то речь будет идти о повышенном уровне.
Если лаборатория не указывает результат в МоМ, и в заключении фигурирует количество вещества в единицах на миллилитр, то уточнить значение медианы следует в конкретной лаборатории, чтобы понять, насколько нормальным является указанный показатель.
Сам по себе уровень альфа-фетопротеина не может говорить о наличии патологий у ребенка, в сочетании с другими параметрами тройного или четверного теста он всего лишь позволяет предположить какие-либо отклонения:
- Хромосомные и нехромосомные патологии плода – резкое повышение уровня АФП одновременно с нормальным уровнем ХГЧ.
- Угроза прерывания беременности — небольшое превышение уровня АФП и вдвое и более сниженный уровень ХГЧ.
- Синдром Дауна у ребенка — очень высокий уровень ХГЧ и очень низкий уровень АФП.
- Гибель ребенка внутриутробно — очень низкий ХГЧ и умеренно пониженный АФП.
На самом деле вариантов и комбинаций существует значительно больше, поскольку врач-сомнолог может определить некоторые маркеры патологий на УЗИ, картину дополнит уровень гормона эстриола в несвязанном состоянии.
Анализирует полученные данные компьютер, который, учитывая индивидуальные риски (возраст женщины, вредные привычки, неблагополучную наследственность), определяет вероятность рождения ребенка с той или иной патологией в виде дроби 1: 400, 1: 1400, 1: 3000 и так далее.
По существующей медицинской статистике отклонения в концентрации белка АФП наблюдается примерно у 7% беременных женщин. Это не означает, что у всех этих будущих мам в утробе растут больные дети.
Уровень альфа-фетопротеина может отличаться от нормальных значений и по другим причинам. Давайте рассмотрим самые распространенные.
Повышенным плодный белок может быть при беременности двойней или тройней, ведь несколько плодов продуцируют большее количество АФП, соответственно, уровень белка в крови матери также будет в 2 или 3 раза выше среднего значения. К моменту проведения второго скрининга женщина обычно уже точно знает о своей многоплодной беременности, поэтому повышенный уровень белка в лабораторном заключении не станет неожиданностью.
Незначительно повышенным АФП может быть у беременной, если у нее есть тенденция к крупному плоду. Остальные причины повышения АФП, к сожалению, не имеют под собой столь приятных и безобидных причин.
Высокий уровень альфа-фетопротеина может говорить о некрозе печени малыша. Важный для жизни орган малютки мог пострадать в процессе вирусного заболевания, от которого не смогла уберечься его мама в первом триместре беременности.
Если это произошло, уменьшенную в размерах и неровную печень сможет увидеть специалист УЗ-диагностики.
Повышенный АФП иногда является убедительным маркером непоправимых патологий в развитии ребенка — анэнцефалии (отсутствии головного мозга), микроцефалии (уменьшении мозга), наличии расщелин в позвоночнике. Большинство таких патологий делают жизнь ребенка невозможной, они летальны.
Подтвердить или опровергнуть такое подозрение может хороший специалист УЗИ, а окончательное решение вынесет экспертная комиссия, в которую войдут генетики и гинекологи. Может понадобиться амниоцентез или кордоцентез.
Врожденная пупочная грыжа, при которой внутренние органы малыша находятся за пределами брюшной полости в грыжевом мешке, также может сопровождаться повышенным уровнем АФП.
Иногда большое количество плодного белка наблюдается при разных пороках развития почек и мочевыводящих путей ребенка, атрезии пищевода. Все эти пороки можно увидеть на УЗИ.
Среди генетических хромосомных патологий повышенная концентрация АФП свойственна синдрому Тернера. Подтвердить или опровергнуть это может инвазивная диагностика (кордоцентез, амниоцентез), а также неинвазивный тест ДНК, для которого используется материнская венозная кровь.
Пониженный уровень белка АФП, выявленный во время второго скрининга, может говорить о присутствии у ребенка хромосомной патологии — синдрома Дауна. Также низкая концентрация альфа-фетопротеина свойственна трисомии 18 (синдрому Эдвардса).
Эти подозрения проверяют врачи-генетики, которые предлагают будущей маме пройти процедуру инвазивной диагностики. Она подразумевает прокол в области живота и забор длинной иглой околоплодных вод (амниоцентез) или кордовой пуповинной крови (кордоцентез) на генетический анализ. Эти процедуры связаны с определенным риском для мамы и плода. Женщина может отказаться от такого обследования.
Есть менее травматичный способ узнать правду — сделать неинвазивный тест ДНК. У женщины берут обычную венозную кровь. В ней находят эритроциты плода, из них выделяют его уникальную ДНК и узнают, есть ли у него хромосомные патологии. Стоит такое обследование очень дорого — несколько десятков тысяч рублей.
Минус заключается в том, что заключение о прохождении такого теста не является основанием для прерывания беременности по медпоказаниям.
Если печальные подозрения подтвердятся, и женщина захочет прервать беременность, ей все равно придется отправиться на кордоцентез или амниоцентез.
Пониженным уровень АФП может быть при задержке развития плода. Причин самой задержки может быть сколько угодно, и специалист УЗИ без труда сможет определить отставание малыша от нормальных размеров. Также сниженный АФП указывает на вероятность выкидыша или внутриутробной гибели малыша.
В любом случае женщине важно настроиться на дополнительное обследование, которое будет включать в себя ультразвуковое сканирование, другие анализы крови, а порой и посещение медико-генетического центра.
В случае выявления тотальных пороков и хромосомных нарушений женщине предлагается прерывание беременности. В случае подтверждения угрозы выкидыша или задержки развития крохи назначается поддерживающее лечение, оно может проходить дома или в больнице.
Все о ранней диагностике генетических заболеваний плода, включая анализ АФП, смотрите в следующем видео.
медицинский обозреватель, специалист по психосоматике, мама 4х детей
источник
оксидативный стресс сперматозоидов
Лаборатория сперматологии Sperma-test выполняет:
| Название анализа | Цена |
|---|---|
| Исследование АФК в нативном эякуляте ROS | 1 500 рублей |
| Исследование продукции АФК в отмытых сперматозоидах (ROS отмытый) | 2 000 рублей |
| Антиокислительная активность семенной плазмы | 3 000 рублей |
Окислительный (оксидативный) стресс — это состояние, при котором одновременно действует слишком много свободных радикалов (АФК — активных форм кислорода).
Анализ ROS определяет количество активных форм кислорода (АФК) в сперме.
Свободные радикалы (активные формы кислорода) — это молекулы кислорода, продукт метаболизма всех клеток. Их наличие нормально. В норме существует баланс между активными формами кислорода и антиоксидантами, которые их нейтрализуют. Если этот баланс нарушается и по каким-то причинам активных форм кислорода становится больше, возникает оксидативный стресс.
Если АФК много, оболочка сперматозоида повреждается, подвижность и способность оплодотворить яйцеклетку снижаются. Может даже произойти повреждение ДНК и гибель клетки. Шансы забеременеть и/или выносить здорового ребенка падают. Большое количество АФК трактуют как высокий уровень оксидативного стресса сперматозоидов.
Именно количество АФК и определяет анализ. ROS-тест не дает информации о том почему АФК много, он только фиксирует текущее состояние.
Как влияют активные формы кислорода на сперму:
- снижение количества сперматозоидов
- снижение подвижности сперматозоидов
- ухудшение морфологии сперматозоидов
- повышение индекса фрагментации ДНК сперматозоидов
- снижение шансов на успех при ЭКО
Таким образом, если по результатам спермограммы зафиксирована олигозооспермия, астенозооспермия и (или) тератозооспермия — это может быть результатом окислительного стресса.
Высокие уровни АФК могут быть и при лейкоспермии, но тут они скорее являются следствием воспалительных процессов. Поэтому при лечении воспаления, снижение АФК произойдет само по себе.
Влияние окислительного стресса на фертильность мужчины может быть разной. В одних случаях это может только увеличить количество циклов, до наступления беременности (т.е. потребовать больше времени). В других — быть причиной выкидышей и замерших беременностей или ненаступления беременности вовсе. Это зависит от того на какие показатели спермы в спермограмме оказано наибольшее влияние (насколько снижена подвижность, как много сперматозоидов с плохой морфологией и т.д.).
Распространенными причинами оксидативного стресса сперматозоидов считают:
- инфекционные заболевания мужских половых органов (часто — бактериальный простатит)
- иммунное бесплодие
- варикоцеле
- недавние операции на половых органах
- воздействие вредных веществ окружающей среды
- возраст
- диабет и другие системные заболевания
- тяжелые физические нагрузки
- несбалансированное питание
- курение табака и легких наркотических смесей
- Алкоголь
- Перегрев области мошонки
Курение системно воздействует на организм и повышает выработку АФК во многих тканях организма, включая яички. Чтобы показатели спермы восстановились после того, как мужчина бросил курить, необходимо не менее 3-х месяцев.
Если причиной повышенного производства АФК стали инфекции или заболевания (системные, Варикоцеле, Простатит), то в первую очередь лечить нужно именно их.
Если причиной стала недавняя операция на половых органах, то необходимо подождать полного восстановления и завершения процесса реабилитации.
В этих и любых других случаях, андролог также назначит диету, богатую антиоксидантами и витамином C.
Антиоксиданты по пути поступления в организм можно разделить на 2 болшие группы: естественные и синтетические.
Естественные (природные) антиоксиданты поступают в организм из пищи (фрукты, овощи, орехи, молочные продукты и мясо).
Синтетические антиоксиданты — в форме таблеток. Они тоже разные, например есть антиоксиданты, предотвращающие образование свободных радикалов, а есть те, что убирают уже существующие.
Антиоксиданты будут назначены и как биологически активная добавка. На сегодняшний день эффективность антиоксидантов подтверждена клиническими исследованиями. Доказано, что их употребление снижает продукцию АФК, улучшает показатели спермы и повышает шансы наступления естественной беременности.
Принимать антиоксиданты придется не менее 3-х месяцев.
Следующими по важности шагами, после диеты, будут отказ от курения и алкоголя, нормализация баланса “работа-отдых”, прогулки на свежем воздухе (не менее 40 минут в день).
Чтобы записаться на анализ, позвоните: +7 (495) 787-79-30
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
В процессе I триместра, наиболее важного периода для аутоиммунной патологии, контроль гемостаза проводим каждые 2 недели. Со 2-го дня после овуляции в цикле зачатия пациентка получает 1 т (5 мг) преднизолона или метипре-альфа. Витамины для беременных или метаболические комплексы, фолиевую кислоту и при необходимости подключаем антиагреганты и/или антикоагулянты. Из антиагрегантов в I триместре предпочтительнее использовать курантил N в дозе 25 мг 3 раза в день. При появлении признаков гиперкоагуляции или РКМФ к лечению добавляем гепарин по 5 000 ЕД 3 раза подкожно или НМГ (фраксипарин) 0,3 мл подкожно 1 раз в сутки или фрагмин 0,2 мл (2,500 ME) 2 раза подкожно до нормализации параметров гемостаза.
Альтернативным вариантом антикоагулянтной и антиагрегантной терапии является использование реополиглюкина 400,0 и 10 000 ЕД гепарина внутривенно капельно через день — 2-3 капельницы. Этот вариант терапии можно использовать практически в течение всей беременности, чтобы избежать длительного приема сочетания глюкокортикоидов и гепарина.
На основании собственного большого опыта и хороших клинических результатов в лечении этой категории больных следует остановиться на некоторых дискутабельных вопросах терапии антифосфолипидного синдрома при беременности.
Монотерапия нефракционированным гепарином или даже в сочетании с аспирином не дает такого терапевтического успеха, как бы хотелось. Монотерапия НМГ (фраксипарин, фрагмин) предпочтительнее, чем гепарин. По данным Shehota H. и соавт. (2001), где основной вид терапии антифосфолипидного синдрома аспирин и НМГ частота преэклампсии 18%, задержка внутриутробного развития 31% и преждевременные роды 43%, перинатальная смертность 7%.
По данным исследований, частота осложнений для плода при разных режимах антикоагулянтной терапии различна. Так, при использовании варфарина с гепарином или без него потеря беременности составила 33,6%, пороки плода 6,4%; гепарин в процессе всей беременности с 6 недель — пороков развития не выявлено, частота потери беременности составила 26,5%.
Еще один дискутабельный вопрос о применении иммуноглобулина в лечении беременных с антифосфолипидным синдромом. Все пациентки с антифосфолипидным синдромом имеют хроническую вирусную инфекцию. В связи с особенностями течения беременности, применением глюкокортикоидов даже в минимальных дозах возможна реактивация вирусной инфекции. Поэтому во время беременности рекомендуется проведение 3-х курсов профилактической терапии, которая состоит из внутривенного введения иммуноглобулина в дозе 25 мл (1,25г) через день всего 3 дозы, одновременно назначая свечи с вифероном. Малые дозы иммуноглобулина не подавляют собственную продукцию имуноглобулинов, а стимулируют защитные силы организма.
Повторно введение иммуноглобулина проводят в 24 недели беременности и перед родами. Это одна сторона вопроса — введение иммуноглобулина для профилактики активации вирусной инфекции.
Есть еще вторая сторона, использование больших доз иммуноглобулина для подавления продукции аутоантител.
Имеются данные о том, что большие дозы иммуноглобулина подавляют продукцию аутоантител и можно использовать этот метод вместо глюкокортикоидной терапии. Существует целая серия работ об эффективности использования иммуноглобулина. Так, по данным исследований, сочетание применения малых доз аспирина, гепарина и внутривенное введение иммуноглобулина в дозе 1 г/1 кг веса в течение 2-х дней каждого месяца беременности до 36 недель, дало очень хорошие результаты — все пациентки благополучно завершили беременность. Введение иммуноглобулина начинали до 12 недель беременности, причем в эти группы были включены пациентки, у которых была та же терапия без иммуноглобулина в предшествующие беременности, которые завершились неблагоприятно для плода. Тем не менее, есть много противников терапии иммуноглобулином и основные положения их состоят в том, что:
- иммуноглобулин очень дорогой препарат, необходимо использовать большие дозы, а стоимость лечения составляет от 7000 до 14000 долларов США;
- есть возможность передачи каких-либо вирусов, если не качественно приготовлен иммуноглобулин;
- есть осложнения от введения иммуноглобулина в виде головной боли, тошноты, гипотензии;
- применение иммуноглобулина не намного улучшает результат лечения гепарином и аспирином.
Несмотря на возражения, интерес к терапии иммуноглобулином чрезвычайно высок. Только чрезмерная дороговизна этого препарата для наших пациентов и невозможность использования иммуноглобулина отечественного призводства в больших дозах из-за возможных анафилактических осложнений ограничивает использование этого чрезвычайно эффективного метода терапии. При введении иммуноглобулина могут быть осложнения в виде аллергических реакций, головной боли, нередко незначительные явления острого респираторного заболевания. Для профилактики этих осложнений необходимо сделать анализ общих уровней иммуноглобулинов в крови класса IgG, IgM и IgA. При низком уровне IgA вводить иммуноглобулин опасно из-за возможных анафилактических реакций. Можно рекомендовать введение антигистаминных средств до и после введения иммуноглобулинов, назначить обильное питье, чай, кофе, соки, при явлениях ОРЗ — жаропонижающие средства. Как правило, все осложнения проходят через день-два. Неотъемлемой частью ведения беременности у пациенток с антифосфолипидным синдромом является профилактика плацентарной недостаточности.
Состояние фетоплацентарной системы при антифосфолипидном синдроме
Патогенетическое действие антифосфолипидных антител связано с тромбозами в сосудах плаценты с образованием инфарктов в плаценте и нарушением микроциркуляции крови. Следствием этих нарушений является развитие плацентарной недостаточности. По данным ультразвукового исследования, плацентарная недостаточность диагностируется тогда, когда появляются признаки гипотрофии плода. Однако внимательное исследование плаценты позволяет выявить наличие инфарктов, кист, истончение, уменьшение плаценты, явления плацентита и другие изменения, которые свидетель ствуют о нарушении нормального функционирования плаценты. Данные кардиотокографии также информативны в оценке состояния плода у пациенток с антифосфолипидным синдромом. У 70% беременных, несмотря на проводимую терапию, выявляется та или иная степень хронической гипоксии плода. Однако данные КТГ информативны лишь после 34 нед беременности. Большую прогностическую значимость в оценке состояния плода имеет ультразвуковая допплерометрия плодово-плацентарного кровотока. УЗ допплерометрия в различных бассейнах фетоплацентарной системы является ценным диагностическим методом оценки состояния плода, может служить критерием эффективности проводимой терапии и являться одним из показателей, определяющих сроки и способы родоразрешения. Исследование проводится с 16-20 нед с промежутками 3-4 недели до родоразрешения. При ухудшении показателей гемостазиограммы допплерометрию производят еженедельно для оценки эффективности проводимой терапии.
Проведенные исследования допплерометрии кровотока в артерии пуповины в динамике при невынашивании беременности показали, что «нулевой» и «отрицательный» кровоток в любом гестационном сроке являются крайне неблагоприятными признаками в оценке состояния плода, проводимая терапия эффекта не дает, что соответствует литературным данным. В таких случаях, если позволяет срок беременности, необходимо срочное родоразрешение. Несоответствие показателей кровотока гестационному сроку (как «опережение», так и «отставание») является также неблагоприятными признаками, требующими более интенсивной терапии по нормализации кровотока, улучшению функции плаценты и борьбе с хронической гипоксией плода. «Опережение» считается существенным при разнице в 8 и более недель.
Таким образом, допплерометрия плодово-плацентарного кровотока, проводимая в динамике беременности, позволяет оценить эффективность проводимой терапии и более точно определить сроки родоразрешения.
Профилактика и лечение плацентарной недостаточности у пациенток с антифосфолипидным синдромом должны проводиться с I триместра беременности. В комплекс профилактических мероприятий, помимо антиагрегантной и, при необходимости, антикоагулянтной терапии, входят курсы метаболической терапии, проводимой регулярно в процессе всей беременности с двухнедельными перерывами.
Для лечения плацентарной недостаточности у пациенток с антифосфолипидным синдромом целесообразно использование таких средств как внутривенное введение актовегина в дозе 5 мл в 250,0 мл физиологического раствора хлорида натрия (курс — 5 капельниц через день), чередуя с инстеноном в дозе 2,0 мл в 200,0 мл физиологического раствора хлорида натрия, также 5 капельниц. Целесообразно применение эссенсиале-форте внутривенно капельно или струйно медленно, или в капсулах, троксевазин внутривенно или в капсулах.
Лечение плацентарной недостаточности целесообразно осуществлять под контролем допплерометрии плодово-плацентарного кровотока, гемостазиограммы с целью оценки эффективности проводимой терапии, выбора оптимальных сроков родоразрешения и во избежании ятрогенных осложнений.
При плацентарной недостаточности и отсутствии эффекта от медикаментозной терапии целесообразно проведение плазмафереза.
Такая тактика ведения и терапия до и во время беременности позволяет нам без серьезных осложнений завершить беременность у 95-96,7% женщин с привычной потерей беременности, обусловленной антифосфолипидным синдромом.
Таким образом, сочетание нескольких разно направленных препаратов в минимальной, но эффективной дозе позволяет получить лучший эффект с меньшими ятрогенными осложнениями.
В последние годы появились сообщения об использовании для лечения пациенток с антифосфолипидным синдромом рыбьего жира в капсулах в дозировке, эквивалентной 5,1 г эйкозапентоевой кислоты (ЭПК) и декозагекзоеновой кислоты (ДГК) при соотношении 1:1,5. ЭПК и ДГК являются ненасыщенными жирными кислотами, получаемыми из морского планктона. Они способны конкурентно подавлять насыщение и удлинение альфа-цепи предшественника арахидоновой кислоты — минолеата. Благодаря своей способности ингибировать образование тромбоксана А, и агрегацию тромбоцитов, эти кислоты обладают противотромботической активностью.
Небольшой опыт использования не позволяет нам оценить профилактическую значимость этого метода терапии.
Чрезвычайно важно при ведении пациенток с антифосфолипидным синдромом получить не только живого, но и здорового ребенка, так как без проведения терапии погибает практически 90% и более беременностей и только 10% рождается живыми. Поэтому важным аспектом является оценка течения периода новорожденности детей у матерей с антифосфолипидным синдромом. У матерей с антифосфолипидным синдромом при использовании современных лечебных и диагностических технологий 90,8% детей рождаются доношенными и не имеют грубых нарушений в функционировании жизненноважных органов и систем. Выявленные отклонения в течение раннего неонатального периода расцениваются, как напряжение адаптационных механизмов, обусловленное особенностями внутриутробного периода развития, что позволяет отнести этих детей к категории повышенного риска по срыву адаптации. Особенности эндокринного статуса в виде гипокортизолемии при рождении (46%) и тиреоидной недостаточности (24%) носят транзиторный характер, как правило, не требуют проведения заместительной гормональной терапии и исчезают в течение первого месяца жизни. Изменения в иммунном статусе, такие как повышение в крови содержания Т-лимфоцитов (CD3+), Т-хел перов (CD4+), В-лимфоцитов (CD19+), доли клеток, экспрессирующих молекулы адгезии У новорожденных, родившихся у матерей с антифосфолипидным синдромом, целесообразно проведение контрольных исследований по оценке системы гипофиз-щитовидная железа-надпочечники при осложненном течении периода ранней неонатальной адаптации для своевременной корригирующей терапии. Выявленные в период новорожденности изменения в иммунном статусе позволяют рекомендовать диспансерное наблюдение за этими детьми для своевременной профилактики инфекционно-воспалительных заболеваний. Профилактика тромбоэмболических осложнений после родов Послеродовый период является наиболее опасным для состояния здоровья родильницы с антифосфолипидным синдромом, так как более часто, чем при беременности, наблюдаются тромбоэмболические осложнения. В нашей практике мы имели все случаи тромбофилических осложнений в послеродовом периоде. С целью профилактики тромбоэмболических осложнений необходимо продолжать прием преднизолона в течение двух недель в дозе 5-10 мг. Оценка системы гемостаза производится на 3-5 сутки после родов. При выраженной гиперкоагуляции целесообразно провести короткий курс гепаринотерапии в дозе 10 тыс или 20 тыс ЕД в сутки подкожно в течение 10-12 дней (фраксипарин, фрагмин предпочтительнее) и назначить аспирин по 100 мг в течение месяца. Необходимо рекомендовать родильнице диету с ограничением продуктов, повышающих свертывающий потенциал крови, и исследование гемостаза один раз в полгода. При появлении болей в суставах, лихорадки, протеинурии и других симптомов аутоиммунных заболеваний следует рекомендовать обследование у специалистов-ревматологов, так как нередко субклинические аутоиммунные нарушения предшествуют манифестным формам аутоиммунных заболеваний. «Катастрофический» антифосфолипидный синдром В настоящее время наряду с привычным и вторичным антифосфолипидным синдромом выделяют клинические и серологические варианты антифосфолипидного синдрома (Asherman R.A., 1997). «Катастрофический» антифосфолипидный синдром — термин, предложенный Asherman R.A. в 1992 г., ранее известный как «опустошающая невоспалительная васкулопатия» (Ingram S. и соавт., 1987), характеризуется развитием полиорганной недостаточности вследствие рецидивирующих тромбозов в различных органах в течение короткого периода времени. Сочетание этого синдрома с развитием ДВС ухудшает прогноз. Генез «катастрофического» антифосфолипидного синдрома более сложен по сравнению с тем, что имеет место при антифосфолипидном синдроме. Полагают, что в его развитии принимают участие различные клеточные медиаторы (цитокины) ответственные за «взрыв» клинически проявившегося воспалительного ответа с развитием полиорганной недостаточности. источник Анализ на АПФ при беременности играет важную роль. Норма АПФ в крови показывает, что у будущего ребенка все хорошо, у него нет пороков развития и других отклонений. Этот анализ сдают на 14 или 15 неделе беременности. Отклонение от нормы свидетельствует о наличии проблем. У малыша могут быть хромосомные аномалии и другие заболевания, обнаружить их поможет анализ на АПФ. Если их вовремя заметить, то возможно придется прерывать беременность. Совершенно не обосновано рожать заведомо больного ребенка. Не будет радости ни самому ребенку, ни родителям. С каждым днем его концентрация увеличивается, как в крови матери, так и в крови ребенка. Изменения уровня афп у женщины при беременности начинается с 9 или 10 недели, а максимальные цифры достигаются на 32 или 34 неделе беременности, после этого концентрация АПФ начинает снижаться. У ребенка наибольшая концентрация АПФ бывает на 12 – 16 неделе, а затем количество белка уменьшается, когда ребенок празднует свой первый день рождения, она становится минимальной. Анализ на АПФ сдают при беременности, чтобы убедиться, что будущий ребенок здоров: у него нет хромосомных аномалий, патологии внутренних органов, нервный канал развивается правильно. Назначить этот анализ при беременности может лечащий врач, если у него появились сомнения, что плод развивается правильно. Обычно для таких сомнений есть основания, т.е. чаще всего этот анализ крови назначают в следующих случаях: Когда нужно сдавать этот анализ? Врачи просят сдать этот анализ крови между 12 и 20 неделей беременности, но все же предпочтительнее проходить это обследование на 14 или 15 неделе беременности. Производится забор крови из вены, женщине необходимо сдать около 10 мл крови. Что сделать, чтобы результат анализа был правильным? Какова норма концентрации в крови АПФ? Об этом вы можете узнать из таблицы: Но, даже если вы знаете точные цифры АПФ в результатах своего анализа, и видите, что они не совпадают с данными в таблице, расстраиваться раньше времени не стоит. Не исключено, что у вас неправильно установили срок беременности, поэтому нужно сделать еще одно УЗИ. Оно покажет и пороки развития, если они есть. Кроме анализа на АПФ, надо сдать и другие анализы: на хгч, на свободный эстирол. Только после этого можно говорить о том, что есть патологии. Что означает повышение уровня АПФ при беременности? Не всегда это плохо. Может быть, срок беременности был установлен не верно, или же будущая мама ждет не одного ребенка, а двойню или тройню. В худшем случае это свидетельствует о гидроцефалии, расщепление позвоночника, пупочной грыже, болезнях женщины (гипертония, сахарный диабет) и гестозе и т.д. Что означает пониженный уровень ХГЧ при беременности? Это тоже не очень хорошо, т.к. беременность или замерла, или плод отстает в развитии, или у него серьезные хромосомные заболевания, такие, как синдром Дауна. Иногда это свидетельствует об ожирении беременной 2 или 3 степени. Оценивать ситуацию ставить диагнозы должен врач. Иногда бывает и так, что анализ не очень хороший, но женщины рожают здоровых детей, поэтому сначала необходимо комплексное исследование, консультация генетика, а уже потом можно поднимать вопрос о прерывании беременности. источник Антифосфолипидный синдром – это аутоиммунное тромбофилическое (со склонностью к тромбообразованию) состояние, которое обусловлено наличием в крови антител – APA. Эти антитела распознают и атакуют протеины, связанные с мембранами клеток, повреждают собственно мембраны клеток. Проявляется АФС развитием тромбозов или осложнениями беременности. Беременность с антифосфолипидным синдромом без лечения на этапе планирования и течения беременности часто имеет катастрофические последствия. Присутствие в крови антифосфолипидных антител без клинических симптомов – не является антифосфолипидным синдромом. АФС синдром классифицируют на: Как и у многих аутоиммунных заболеваний, этиология антифосфолипидного синдрома до конца неизвестна, но существует несколько теорий его происхождения: Мутация в гене, кодирующем эту молекулу бета-2-гликопротеина, приводит к тому, что молекула становится более антигенной, возникает аутосенсибилизация и появляются антитела к этому белку. Все патологические процессы воздействия АФС на беременность сводятся к 4 основным процессам: На стадии имплантации антифосфолипидные антитела нарушают свойства клеток эмбриона и строение клеток трофобласта, что продолжается весь период имплантации, приводя к снижению глубины проникновения трофобласта в эндометрий и усилению тромботических процессов. Антифосфолипидные антитела могут быть причиной прогестероновой недостаточности, которая сама по себе может вызвать невынашивание беременности и далее синдром потери плода. Эти процессы происходят генерализовано (во всех органах человека) и локально (местно) – в эндометрии матки. А для успешной имплантации и наступления беременности, как известно эндометрий должен быть здоровым. Поэтому частыми осложнениями беременности с антифосфолипидным синдромом бывают: Все симптомы и проявления АФС можно разбить на 2 группы: До наступления беременности АФС проявляется бесплодием неясного генеза, имплантационными нарушениями в естественных и искусственных циклах оплодотворения. Это и есть ответ на вопрос: мешает ли антифосфолипидный синдром забеременеть. Зачатие крайне затруднено. Также до беременности повышен риск тромботических осложнений. Во время беременности грозными осложнениями АФС синдрома являются: После родов антифосфолипидный синдром опасен венозными тромбоэмболическими нарушениями и катастрофическим антифосфолипидным синдромом. АФС во время беременности для ребенка имеет следующие осложнения:

Срок беременности женщины (в неделях) Количество АПФ в МЕ/мл Ранний срок до 12 От 0,5 до 15 От 12 до 15 От 15 до 60 От 15 до 19 От 15 до 95 От 19 до 24 От 17 до 125 От 24 до 28 От 52 до 140 От 28до 30 От 67 до 150 От 30 до 32 От 100 до 250
После родов у новорожденного встречаются следующие осложнения:
- Тромбозы.
- Повышается риск нейроциркуляторных тромбозов – 3%. Большинство этих нарушений сопровождается аутизмом.
- Бессимптомная циркуляция антител к фосфолипидам в 20% случаев.
Золотым стандартом в ведении беременности у женщин с АФС – назначение низкомолекулярных гепаринов и низких доз ацетилсалициловой кислоты.
Доказано, что низкомолекулярные гепарины могут:
- непосредственно связывать АФЛ антитела, тем самым снижается их концентрация в крови;
- ингибировать (угнетать) связывание антител с трофобластом;
- предотвращать гибель клеток трофобласта путем повышения синтеза антиапоптических белков;
- оказывают антикоугулянтное (противосвертывающее) действие – предотвращают повышение свертываемости крови и образование тромбов;
- блокируют выработку веществ, которые запускают механизмы воспалительной реакции.
Стандартные рекомендуемые схемы лечения АФС при беременности:
- При АФС синдроме без тромботических осложнений с потерями беременности до 10 недель в прошлом используют комбинацию НМГ (низкомолекулярного гепарина) и ацетилсалициловой кислоты. Подкожно вводится Клексан по 40 мг 1 раз в 24 часа.
- При АФС у беременных без тромботических осложнений с потерей беременности после срока 10 недель в анамнезе рекомендуют только НМГ – Клексан по 40 мг в сутки.
- При антифосфолипидном синдроме с тромботическими осложнениями и утратой беременности на любом сроке в анамнезе используют Клексан в дозе из расчета 1 мг на 1 кг веса каждые 12 часов.
При ухудшении показателей коагулограммы и маточного кровотока назначаются терапевтические дозы.
Принимать препараты – низко фракционированный гепарин (чаще всего используется Клексан, Эноксипарин) и ацетилсалициловую кислоту в низких дозах необходимо еще на этапе планирования беременности. При улучшении показателей крови и ее свертывающей системы (сдаются анализы – коагулограммы, гемостазиограмма), улучшении маточного кровотока (оценивается на доплерометрии) доктор «разрешает» беременность.
Введение антикоагулянтов не прекращается и продолжается до родов. На этапе планирования беременности также назначают:
- витамины – фолиевую кислоту в дозе 400 микрограмм в сутки;
- омега-3-полиненасыщенные жирные кислоты;
- Утрожестан.
Стандартный подход при терапии АФС с привычным невынашиванием беременности позволяет сохранить беременность в 70% случаев. У 30% беременных с АФС не удается добиться положительных результатов. В этих случаях используют плазмаферез, каскадную плазменную фильтрацию. Задача этих процедур – удалить из кровотока АФС антитела и ряд веществ, принимающих участие в каскаде воспалительных тромбообразующих процессов.
Перед плановым кесаревым сечением терапию приостанавливают, для профилактики кровотечений и возможности эпидуральной анестезии. Отмена препаратов производится за сутки. При самопроизвольных родах и экстренном кесаревом ситуация осложняется, но если НМГ вводились за 8-12 часов то эпидуральная анестезия возможна.
Учитывая такие сложности с терапией, с 37 недели беременности женщине отменяют низкомолекулярные гепарины и назначают нефракционированный гепарин, его действие более кратковременное. Прием стандартного гепарина – не является противопоказанием к эпидуральному обезболиванию родов.
При экстренном кесаревом сечении используют общую анестезию.
После родов противосвертывающая терапия антифосфолипидного синдрома возобновляется через 12 часов. При высоком риске возникновения тромботических осложнений – через 6 часов. Лечение продолжается в течение 1,5 месяца после родов.
источник
Антифосфолипидный синдром (АФС) – фото, виды, причины, симптомы и признаки. АФС у мужчин, у женщин, у детей. Антифосфолипидный синдром и беременность
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
Антифосфолипидный синдром (АФС), или синдром антифосфолипидных антител (САФА), представляет собой клинико-лабораторный синдром, основными проявлениями которого являются образование тромбов (тромбозы) в венах и артериях различных органов и тканей, а также патология беременности. Конкретные клинические проявления антифосфолипидного синдрома зависят от того, сосуды какого именно органа оказались закупорены тромбами. В пораженном тромбозами органе могут развиваться инфаркты, инсульты, некрозы тканей, гангрена и т.д. К сожалению, на сегодняшний день отсутствуют единые стандарты профилактики и лечения антифосфолипидного синдрома вследствие того, что нет четкого понимания причин заболевания, а также нет каких-либо лабораторных и клинических признаков, позволяющих с высокой степенью достоверности судить о риске рецидива. Именно поэтому в настоящее время лечение антифосфолипидного синдрома направлено на уменьшение активности свертывающей системы крови, чтобы снизить риск повторных тромбозов органов и тканей. Такое лечение базируется на применении препаратов групп антикоагулянтов (Гепарины, Варфарин) и антиагрегантов (Аспирин и др.), которые позволяют профилактировать повторные тромбозы различных органов и тканей на фоне заболевания. Прием антикоагулянтов и антиагрегантов обычно производится пожизненно, поскольку такая терапия только предотвращает тромбозы, но не излечивает заболевание, позволяя, таким образом, продлить жизнь и поддерживать ее качество на приемлемом уровне.
Антифосфолипидный синдром представляет собой аутоиммунное заболевание невоспалительного характера со своеобразным комплексом клинических и лабораторных признаков, в основе которого лежит образование антител к некоторым видам фосфолипидов, являющихся структурными компонентами мембран тромбоцитов, клеток кровеносных сосудов и нервных клеток. Такие антитела называются антифосфолипидными, и вырабатываются собственной иммунной системой, которая ошибочно принимает собственные структуры организма за чужеродные, и стремится уничтожить их. Именно из-за того, что в основе патогенеза антифосфолипидного синдрома лежит выработка антител иммунной системой против структур собственных клеток организма, заболевание относится к группе аутоиммунных.
Иммунная система может вырабатывать антитела на различные фосфолипиды, такие, как фосфатидилэтаноламин (ФЭ), фосфатидилхолин (ФХ), фосфатидилсерин (ФС), фосфатидилинозитол (ФИ), кардиолипин (дифосфатидилглицерол), фосфатидилглицерин, бета-2-гликопротеин 1, которые входят в состав мембран тромбоцитов, клеток нервной системы и кровеносных сосудов. Антифосфолипидные антитела «распознают» фосфолипиды, против которых они были выработаны, прикрепляются к ним, образуя на мембранах клеток крупные комплексы, активирующие работу свертывающей системы крови. Прикрепившиеся к мембранам клеток антитела выступают в качестве своего рода раздражителей для системы свертывания, поскольку имитируют неблагополучие в сосудистой стенке или на поверхности тромбоцитов, что вызывает активацию процесса свертывания крови или тромбоцитов, так как организм стремится устранить дефект в сосуде, «заделать» его. Такая активизация свертывающей системы или тромбоцитов приводит к образованию многочисленных тромбов в сосудах различных органов и систем. Дальнейшие клинические проявления антифосфолипидного синдрома зависят от того, сосуды какого именно органа оказались закупорены тромбами.
Антифосфолипидные антитела при антифосфолипидном синдроме являются лабораторным признаком заболевания и определяются, соответственно, лабораторными методами в сыворотке крови. Некоторые антитела определяют качественно (то есть устанавливают только тот факт, имеются они в крови, или нет), другие – количественно (определяют их концентрацию в крови).
- Волчаночный антикоагулянт. Данный лабораторный показатель является количественным, то есть определяется концентрация волчаночного антикоагулянта в крови. В норме у здоровых людей волчаночный антикоагулянт может присутствовать в крови в концентрации 0,8 – 1,2 у.е. Повышение показателя выше 2,0 у.е. является признаком антифосфолипидного синдрома. Сам волчаночный антикоагулянт является не отдельным веществом, а представляет собой совокупность антифосфолипидных антител классов IgG и IgM к различным фосфолипидам клеток сосудов.
- Антитела к кардиолипину (IgA, IgM, IgG). Данный показатель является количественным. При антифосфолипидном синдроме уровень антител к кардиолипину в сыворотке крови более 12 Ед/мл, а в норме у здорового человека данные антитела могут присутствовать в концентрации менее 12 Ед/мл.
- Антитела к бета-2-гликопротеину (IgA, IgM, IgG). Данный показатель является количественным. При антифосфолипидном синдроме уровень антител к бета-2-гликопротеину повышается более 10 Ед/мл, а в норме у здорового человека данные антитела могут присутствовать в концентрации менее 10 Ед/мл.
- Антитела к различным фосфолипидам (кардиолипину, холестерину, фосфатидилхолину). Данный показатель является качественным, и определяется с помощью реакции Вассермана. Если реакция Вассермана дает положительный результат при отсутствии заболевания сифилисом, то это является диагностическим признаком антифосфолипидного синдрома.
Перечисленные антифосфолипидные антитела вызывают повреждения мембран клеток сосудистой стенки, вследствие чего свертывающая система активируется, образуется большое количество тромбов, при помощи которых организм пытается «залатать» дефекты сосудов. Далее из-за большого количества тромбов возникают тромбозы, то есть происходит закупоривание просвета сосудов, в результате чего кровь по ним не может свободно циркулировать. Вследствие тромбозов возникает голодание клеток, которые не получают кислород и питательные вещества, исходом чего становится гибель клеточных структур какого-либо органа или ткани. Именно гибель клеток органов или тканей и дает характерные клинические проявления антифосфолипидного синдрома, которые могут быть различными в зависимости от того, какой именно орган подвергся разрушению из-за тромбоза его сосудов.
Тем не менее, несмотря на широкий спектр клинических признаков антифосфолипидного синдрома, врачи выделяют ведущие симптомы заболевания, которые присутствуют всегда у любого человека, страдающего данной патологией. К ведущим симптомам антифосфолипидного синдрома относят венозные или артериальные тромбозы, патологию беременности (невынашивание беременности, привычные выкидыши, отслойка плаценты, внутриутробная гибель плода и др.) и тромбоцитопению (низкий уровень тромбоцитов в крови). Все остальные проявления антифосфолипидного синдрома комбинируются в топические синдромы (неврологический, гематологический, кожный, сердечно-сосудистый и др.) в зависимости от пораженного органа.
Помимо этого, тромбозы могут развиваться в любых венах и артериях, вследствие чего у людей, страдающих антифосфолипидным синдромом, часто поражена кожа (трофические язвы, высыпания, похожие на сыпь, а также сине-фиолетовая неровная окраска кожи) и нарушено мозговое кровообращение (ухудшается память, появляются головные боли, развивается слабоумие). Если у женщины, страдающей антифосфолипидным синдромом, наступила беременность, то в 90% случаев она прерывается из-за тромбозов сосудов плаценты. При антифосфолипидном синдроме наблюдаются следующие осложнения беременности: самопроизвольные аборты, внутриутробная гибель плода, преждевременная отслойка плаценты, преждевременные роды, HELLP-синдром, преэклампсия и эклампсия.
Истинная частота встречаемости антифосфолипидного синдрома в популяции в настоящее время неизвестна. При этом антифосфолипидные антитела выявляют примерно у 2 – 4% (по данным других авторов у 1 – 12%) совершенно здоровых людей. Причем чем старше возрастная группа здоровых обследованных – тем чаще у них выявляются антифосфолипидные антитела. Кроме того, антифосфолипидные антитела выявляются у женщин в 5 раз чаще, чем у мужчин. Резкое увеличение уровня антифосфолипидных антител наблюдается у людей, страдающих злокачественными опухолями, аутоиммунной тромбоцитопенической пурпурой, различными аутоиммунными заболеваниями, такими, как системная красная волчанка, ревматоидный артрит, системная склеродермия, синдром Шегрена. Кроме того, уровень антифосфолипидных тел в крови повышается при острых и хронических вирусных, бактериальных и паразитарных инфекциях, при патологии беременности, при приеме некоторых лекарственных препаратов (оральные контрацептивы, психотропные средства и т.д.). Однако только наличие антител в крови не является несомненным признаком заболевания, поскольку они встречаются и у совершенно здоровых людей. Но, тем не менее, зачастую усиленная выработка антифосфолипидных антител приводит к развитию антифосфолипидного синдрома.
Выделяют две основные разновидности антифосфолипидного синдрома – первичный и вторичный. Вторичный антифосфолипидный синдром всегда развивается на фоне какого-либо другого аутоиммунного (например, системная красная волчанка, склеродермия), ревматического (ревматоидный артрит и др.), онкологического (злокачественные опухоли любой локализации) или инфекционного заболевания (СПИД, сифилис, гепатит С и т.д.), или после приема лекарственных препаратов (оральные контрацептивы, психотропные средства, Изониазид и др.). Первичный антифосфолипидный синдром развивается на фоне отсутствия иных заболеваний, и его точные причины в настоящее время не установлены. Однако предполагается, что в развитии первичного антифосфолипидного синдрома играет роль наследственная предрасположенность, тяжелые хронические длительно текущие инфекции (СПИД, гепатиты и др.) и прием некоторых лекарств (Фенитоин, Гидралазин и др.).
Соответственно, причиной вторичного антифосфолипидного синдрома является имеющееся у человека заболевание, которое и спровоцировало увеличение концентрации антифосфолипидных антител в крови с последующим развитием патологии. А причины первичного антифосфолипидного синдрома неизвестны.
Диагностика антифосфолипидного синдрома основана на выявлении клинических и лабораторных критериев, выработанных и принятых на международном уровне в Саппоро в 2006 г. К клиническим критериям АФС относят следующие проявления:
- Тромбоз сосудов. Наличие одного или более эпизода тромбоза. Причем тромбы в сосудах должны быть выявлены гистологическим, допплеровским или визиографическим методом.
- Патология беременности. Один или более случай смерти нормального плода в сроке до 10 недель гестации. Преждевременные роды в сроке до 34 недель гестации вследствие эклампсии/преэклампсии/фетоплацентарной недостаточности. Более двух выкидышей подряд.
К лабораторным критериям АФС относят следующие:
- Антикардиолипиновые антитела (IgG и/или IgM), которые были выявлены в крови минимум дважды в течение 12 недель.
- Волчаночный антикоагулянт, выявленный в крови минимум два раза в течение 12 недель.
- Антитела к бета-2 гликопротеину 1 (IgG и/или IgM), которые были выявлены в крови минимум дважды в течение 12 недель.
Диагноз антифосфолипидного синдрома выставляется в том случае, если у человека имеется как минимум один клинический и один лабораторный критерий, присутствующие непрерывно в течение 12 недель. Это означает, что поставить диагноз антифосфолипидного синдрома после однократного обследования невозможно, так как для диагностики следует на протяжении 12 недель минимум два раза провести лабораторные анализы и выяснить наличие клинических критериев. Если оба раза будут выявлены лабораторные и клинические критерии, то в конечном итоге выставляется диагноз антифосфолипидного синдрома.
На данных фотографиях изображен внешний вид кожи человека, страдающего антифосфолипидным синдромом.

Несмотря на отсутствие знаний о точных причинах антифосфолипидного синдрома, врачи и ученые выявили ряд факторов, которые можно отнести к предрасполагающим для развития АФС. То есть условно данные предрасполагающие факторы можно считать причинами антифосфолипидного синдрома.
В настоящее время к предрасполагающим факторам антифосфолипидного синдрома относят следующие:
- Генетическая предрасположенность;
- Бактериальные или вирусные инфекции (стафилококковые и стрептококковые инфекции, туберкулез, СПИД, цитомегаловирусная инфекция, вирусы Эпштейна-Барр, гепатиты В и С, инфекционный мононуклеоз и т.д.);
- Аутоиммунные заболевания (системная красная волчанка, системная склеродермия, узелковый периартериит, аутоиммунная тромбоцитопеническая пурпура и др.);
- Ревматические заболевания (ревматоидный артрит и др.);
- Онкологические заболевания (злокачественные опухоли любой локализации);
- Некоторые заболевания ЦНС;
- Длительный прием некоторых лекарственных препаратов (оральные контрацептивы, психотропные средства, интерфероны, Гидралазин, Изониазид).
Рассмотрим признаки катастрофического АФС и других форм заболевания по-отдельности. Такой подход представляется рациональным, поскольку по клиническим проявлениям различные виды антифосфолипидного синдрома одинаковы, а отличия имеются только у катастрофического АФС.
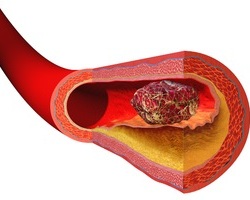
Если тромбозы поражают мелкие сосуды, то это приводит к легким нарушениям функционирования органа, в котором находятся закупоренные вены и артерии. Например, при закупорке мелких сосудов миокарда отдельные небольшие участки сердечной мышцы теряют способность сокращаться, что вызывает их дистрофию, но не провоцирует инфаркт или иные тяжелые повреждения. Но если тромбоз захватывает просвет основных стволов коронарных сосудов, то произойдет инфаркт.
При тромбозах мелких сосудов симптоматика проявляется медленно, но степень расстройства функций пораженного органа неуклонно прогрессирует. При этом симптоматика обычно напоминает какое-либо хроническое заболевание, например, цирроз печени, болезнь Альцгеймера и т.д. Таково течение обычных типов антифосфолипидного синдрома. Но при тромбозе крупных сосудов происходит резкое нарушение работы органа, что вызывает катастрофическое течение антифосфолипидного синдрома с полиорганной недостаточностью, ДВС-синдромом и другими тяжелыми состояниями, опасными для жизни.
Поскольку тромбоз может затрагивать сосуды любого органа и ткани, в настоящее время описаны проявления антифосфолипидного синдрома со стороны центральной нервной системы, сердечно-сосудистой системы, печени, почек, желудочно-кишечного тракта, кожи и др. Тромбоз сосудов плаценты при беременности провоцирует акушерскую патологию (выкидыши, преждевременные роды, отслойку плаценты и др.). Рассмотрим симптоматику антифосфолипидного синдрома со стороны различных органов.
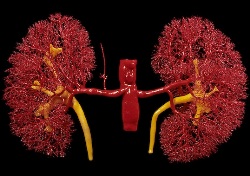
Наиболее часто при АФС развиваются венозные тромбозы различных органов. При этом чаще всего тромбы локализуются в глубоких венах нижних конечностей, и несколько реже – в венах почек и печени. Тромбозы глубоких вен ног проявляются болями, отечностью, покраснением, гангреной или язвами на пораженной конечности. Тромбы из вен нижних конечностей могут отрываться от стенок сосудов и с током крови доходить до легочной артерии, провоцируя опасные для жизни осложнения – тромбоэмболию легочной артерии, легочную гипертензию, кровоизлияния в легкие. При тромбозе нижней или верхней полой вены развивается синдром соответствующей вены. Тромбоз вены надпочечников приводит к кровоизлияниям и некрозу тканей надпочечников и развитием их последующей недостаточности.
Тромбоз вен почек и печени приводит к развитию нефротического синдрома и синдрома Бадда-Киари. Нефротический синдром проявляется наличием белка в моче, отеками и нарушением обмена липидов и белков. Синдром Бадда-Киари проявляется облитерирующим флебитом и тромбофлебитом вен печени, а также выраженным увеличением размеров печени и селезенки, асцитом, усиливающейся с течением времени гепатоцеллюлярной недостаточностью и иногда гипокалиемией (низкий уровень калия в крови) и гипохолестеринемией (низкий уровень холестерина в крови).
При АФС тромбоз поражает не только вены, но и артерии. Причем артериальные тромбозы развиваются примерно в два раза чаще венозных. Такие артериальные тромбозы тяжелее по течению по сравнению с венозными, поскольку проявляются инфарктами или гипоксией мозга или сердца, а также расстройствами периферического кровотока (кровообращение в коже, конечностях). Наиболее часто встречается тромбоз внутримозговых артерий, вследствие которого развиваются инсульты, инфаркты, гипоксия и другие повреждения ЦНС. Тромбоз артерий конечностей приводит к гангрене, асептическому некрозу головки бедренной кости. Относительно редко развивается тромбоз больших артерий – брюшной аорты, восходящего отдела аорты и др.
Поражение нервной системы является одним из наиболее тяжелых проявлений антифосфолипидного синдрома. Вызывается тромбозом мозговых артерий. Проявляется транзиторными ишемическими атаками, ишемическими инсультами, ишемической энцефалопатией, судорогами, мигренью, хореей, поперечным миелитом, нейросенсорной тугоухостью и рядом других неврологических или психиатрических симптомов. Иногда неврологическая симптоматика при тромбозах сосудов мозга при АФС напоминает клиническую картину рассеянного склероза. В некоторых случаях тромбозы сосудов мозга вызывают временную слепоту или нейропатию зрительного нерва.
Транзиторные ишемические атаки проявляются потерей зрения, парестезией (ощущение бегания «мурашек», онемение), двигательной слабостью, головокружениями и общей амнезией. Нередко транзиторные ишемические атаки предшествуют инсульту, появляясь за несколько недель или месяцев до него. Частые ишемические атаки приводят к развитию слабоумия, потере памяти, ухудшению внимания и другим умственным нарушениям, которые похожи на болезнь Альцгеймера или токсическое поражение мозга.
Рецидивирующие микроинсульты при АФС часто протекают без четкой и заметной симптоматики, и могут проявляться через некоторое время судорогами и развитием слабоумия.
Головные боли также являются одним из наиболее частых проявлений антифосфолипидного синдрома при локализации тромбоза во внутримозговых артериях. При этом головные боли могут иметь различный характер – от мигренозных до постоянных.
Кроме того, вариантом поражения ЦНС при АФС является синдром Снеддона, который проявляется сочетанием артериальной гипертензии, сетчатого ливедо (сине-фиолетовая сетка на коже) и тромбоза сосудов мозга.
Поражение сердца при антифосфолипидном синдроме проявляется широким спектром различных нозологий, включая инфаркт, поражение клапанов, хроническую ишемическую кардиомиопатию, внутрисердечный тромбоз, повышенное артериальное давление и легочную гипертензию. В редких случаях тромбозы при АФС вызывают проявления, похожие на миксому (опухоль сердца). Инфаркт миокарда развивается примерно у 5% больных антифосфолипидным синдромом, причем, как правило, у мужчин младше 50-летнего возраста. Наиболее часто при АФС происходит поражение клапанов сердца, степень выраженности которого варьирует от минимальных нарушений (утолщение створок клапанов, заброс части крови обратно) до пороков (стеноз, недостаточность клапанов сердца).
Несмотря на то, что поражение сердечно-сосудистой системы при АФС развивается часто, оно редко приводит к сердечной недостаточности и тяжелым последствиям, требующим хирургической операции.
Тромбоз сосудов печени при АФС приводит к развитию синдрома Бадда-Киари, инфаркту печени, асциту (выпот жидкости в брюшную полость), повышению активности АсАТ и АлАТ в крови, а также к увеличению размеров печени за счет ее гиперплазии и портальной гипертензии (повышенное давление в системе воротной вены печени).
При АФС примерно в 20% случаев отмечается специфическое поражение кожи из-за тромбозов мелких сосудов и нарушения периферического кровообращения. На коже появляется сетчатое ливедо (сосудистая сетка сине-фиолетового цвета, локализующаяся на голенях, ступнях, кистях, бедрах, и хорошо видимая при охлаждении), язвы, развивается гангрена пальцев рук и ног, а также множественные кровоизлияния в ногтевое ложе, которые по внешнему виду напоминают «занозу». Также иногда на коже появляется сыпь в виде точечных кровоизлияний, по внешнему виду напоминающая васкулит.
Также частым проявлением антифосфолипидного синдрома является акушерская патология, которая встречается у 80% беременных женщин, страдающих АФС. Как правило, АФС вызывает потерю беременности (выкидыш, замершая беременность, преждевременные роды), задержку внутриутробного развития плода, а также гестоз, преэклампсию и эклампсию.
Относительно редкими проявлениями АФС являются осложнения со стороны легких, такие, как тромботическая легочная гипертензия (повышенное кровяное давление в легких), кровоизлияния в легкие и капиллярит. Тромбозы легочных вен и артерий могут приводить к «шоковому» легкому – критическому для жизни состоянию, которое требует немедленного медицинского вмешательства.
Также редко при АФС развиваются желудочно-кишечные кровотечения, инфаркты селезенки, тромбозы мезентериальных сосудов кишки и асептические некрозы головки бедренной кости.
При АФС практически всегда имеется тромбоцитопения (количество тромбоцитов в крови ниже нормы), при которой количество тромбоцитов колеблется от 70 до 100 Г/л. Такая тромбоцитопения не требует лечения. Примерно в 10% случаев при АФС развивается Кумбс-положительная гемолитическая анемия или синдром Эванса (сочетание гемолитической анемии и тромбоцитопении).
Антифосфолипидный синдром может развиваться и у детей, и у взрослых. При этом детей данное заболевание встречается реже, чем у взрослых, но протекает тяжелее. У женщин антифосфолипидный синдром встречается в 5 раз чаще, чем у мужчин. Клинические проявления и принципы терапии заболевания одинаковы у мужчин, женщин и детей.

В настоящее время доказано, что антифосфолипидный синдром может вызывать следующие акушерские осложнения:
- Бесплодие неясного происхождения;
- Неудачи ЭКО;
- Выкидыши на ранних и поздних сроках беременности;
- Замершая беременность;
- Маловодие;
- Внутриутробная гибель плода;
- Преждевременные роды;
- Мертворождение;
- Пороки развития плода;
- Задержка развития плода;
- Гестозы;
- Эклампсия и преэклампсия;
- Преждевременная отслойка плаценты;
- Тромбозы и тромбоэмболии.
Осложнения беременности, протекающей на фоне имеющегося у женщины антифосфолипидного синдрома, фиксируются примерно в 80% случаев, если не проводится лечение АФС. Чаще всего АФС приводит к потере беременности по причине замершей беременности, выкидышей или преждевременных родов. При этом риск потери беременности коррелирует с уровнем антикардиолипиновых антител в крови женщины. То есть чем выше концентрация антикардиолипиновых антител – тем выше риск потери беременности.
У новорожденного ребенка, родившегося от матери, страдающей АФС, с первых дней жизни могут развиться тромбозы различных органов, поскольку данное заболевание передается потомству вместе с дефектными генами. Кроме того, у детей, рожденных матерями, страдающими АФС, повышен риск нейродисциркуляторных расстройств и аутизма. В целом у новорожденных матерями, страдающими АФС, примерно в 20% случаев отмечается бессимптомное циркулирование антифосфолипидных антител в крови. То есть у младенца имеются антитела к фосфолипидам в крови, но тромбозы отсутствуют.
Несмотря на тяжелые осложнения беременности, которые провоцирует антифосфолипидный синдром, необходимо избегать гипердиагностики. Так, нельзя женщине, вынашивающей ребенка, выставлять диагноз антифосфолипидного синдрома только на основании наличия антифосфолипидных антител в крови. Ведь у совершенно здоровых женщин в 2 – 4% случаев могут выявляться антифосфолипидные антитела в крови при беременности. Данный диагноз выставляется только на основании международных диагностических критериев, а не на основании данных лабораторных анализов.
Женщин, страдающих антифосфолипидным синдром, необходимо на первом этапе подготовить к беременности, обеспечив оптимальные условия и минимизировав риск потери плода на ранних сроках гестации. Затем необходимо вести беременность с обязательным применением препаратов, уменьшающих образование тромбов и, тем самым, обеспечивающих нормальное вынашивание плода и рождение живого здорового ребенка. Если беременность наступила без подготовки, то ее необходимо просто вести с применением препаратов, уменьшающих риск тромбозов, чтобы обеспечить нормальное вынашивание плода. Ниже мы приведем рекомендации по подготовке и ведению беременности, утвержденные российским Минздравом в 2014 году.
Итак, в первую очередь при подготовке женщины к беременности определяют показатели свертываемости крови (ПТИ, АЧТФ, ТВ, фибриноген, антитромбин III, МНО, РФМК, Д-димеры и др.), уровень волчаночного антикоагулянта и антифосфолипидных антител в крови. Также проводят лечение очагов хронической инфекции, если таковые имеются.
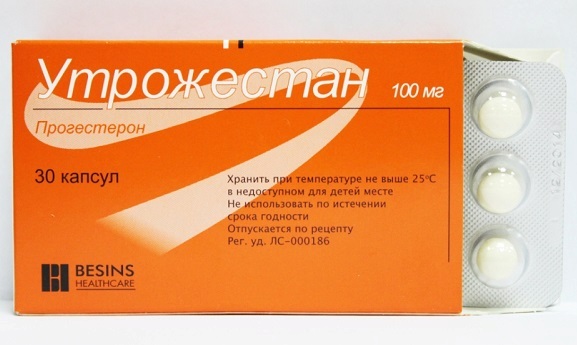
- Препараты низкомолекулярного гепарина (Клексан, Фраксипарин, Фрагмин);
- Препараты группы антиагрегантов (Клопидогрель, Аспирин в низких дозировках по 75 – 80 мг в сутки);
- Микронизированный прогестерон (Утрожестан по 200 – 600 мг в сутки) вагинально;
- Фолиевая кислота по 4 – 6 мг в сутки;
- Магний с витамином В6 (Магне В6);
- Препараты омега-3-6-9 жирных кислот (Линитол, Омега-3 Доппельгерц и др.).
Препараты низкомолекулярного гепарина и антиагреганты назначают под контролем показателей свертывания крови, корректируя их дозировку до тех пор, пока данные анализов не придут в норму.
Указанные препараты применяют в течение нескольких месяцев, после чего повторно определяют концентрацию волчаночного антикоагулянта и антифосфолипидных антител в крови. Если их концентрация не снизилась под влиянием лечения, то проводят 1 – 3 процедуры плазмафереза.
После того, как показатели коагулограммы, кровоток в маточных артериях и уровни антифосфолипидных антител придут в норму, женщина может беременеть. В период попыток забеременеть женщина должна продолжать принимать Клексан, антиагреганты, микронизированный прогестерон, фолиевую кислоту, магний с витамином В6 и препараты омега-3-6-9 жирных кислоты в тех же дозировках, что и на этапе подготовки к беременности, чтобы обеспечить формирование нормальной плаценты и снизить риск фетоплацентарной недостаточности.
После наступления беременности врач выбирает одну из рекомендованных тактик, основанных на концентрации антифосфолипидных антител в крови и наличия тромбозов или осложнений беременности в прошлом. В целом золотым стандартом ведения беременности у женщин с АФС считается применение низкомолекулярных гепаринов (Клексан, Фраксипарин, Фрагмин), а также Аспирина в низких дозировках. Глюкокортикоидные гормоны (Дексаметазон, Метипред) в настоящее время не рекомендуется применять для ведения беременности при АФС, поскольку они оказывают незначительный лечебный эффект, но зато существенно повышают риск осложнений как для женщины, так и для плода. Единственные ситуации, когда применение глюкокортикоидных гормонов оправдано – это наличие иного аутоиммунного заболевания (например, системной красной волчанки), активность течения которого необходимо постоянно подавлять.
Итак, в настоящее время Минздравом рекомендованы следующие тактики ведения беременности у женщин с АФС:
- Антифосфолипидный синдром, при котором у женщины в крови повышены уровни антифосфолипидных антител и волчаночного антикоагулянта, но в прошлом не было тромбозов и эпизодов потери беременности на ранних сроках (например, выкидыши, замершие беременности до 10 – 12 недель). В этом случае в течение всей беременности (до родов) рекомендуется принимать только Аспирин по 75 мг в сутки.
- Антифосфолипидный синдром, при котором у женщины в крови повышены уровни антифосфолипидных антител и волчаночного антикоагулянта, в прошлом не было тромбозов, но были эпизоды потери беременности на ранних сроках (выкидыши до 10 – 12 недель). В этом случае в течение всей беременности вплоть до родов рекомендуется принимать Аспирин по 75 мг в сутки, или комбинацию Аспирина 75 мг в сутки + препараты низкомолекулярного гепарина (Клексан, Фраксипарин, Фрагмин). Клексан вводят под кожу по 5000 – 7000 МЕ через каждые 12 часов, а Фраксипарин и Фрагмин – по 0,4 мг по одному разу в сутки.
- Антифосфолипидный синдром, при котором у женщины в крови повышены уровни антифосфолипидных антител и волчаночного антикоагулянта, в прошлом не было тромбозов, но были эпизоды замершей беременности на ранних сроках (выкидыши до 10 – 12 недель) или внутриутробной гибели плода, либо преждевременных родов вследствие гестоза или плацентарной недостаточности. В этом случае в течение всей беременности, вплоть до родов, следует применять низкие дозы Аспирина (по 75 мг в сутки) + препараты низкомолекулярного гепарина (Клексан, Фраксипарин, Фрагмин). Клексан вводят под кожу по 5000 – 7000 МЕ через каждые 12 часов, а Фраксипарин и Фрагмин – по 7500 – 10000 МЕ каждые 12 часов в первом триместре (до 12-ой недели включительно), и далее по 10000 МЕ каждые 8 – 12 часов во втором и третьем триместрах.
- Антифосфолипидный синдром, при котором у женщины в крови повышены уровни антифосфолипидных антител и волчаночного антикоагулянта, в прошлом были и тромбозы, и эпизоды потери беременности на любых сроках. В этом случае в течение всей беременности вплоть до родов следует применять низкие дозы Аспирина (по 75 мг в сутки) + препараты низкомолекулярного гепарина (Клексан, Фраксипарин, Фрагмин). Клексан вводят под кожу по 5000 – 7000 МЕ через каждые 12 часов, а Фраксипарин и Фрагмин – по 7500 – 10000 МЕ каждые 8 – 12 часов.

Так, всем женщинам с АФС, получающим во время беременности гепарины и Аспирин, рекомендуется вводить профилактически иммуноглобулин внутривенно по 0,4 г на 1 кг веса тела в течение пяти суток в начале каждого месяца, вплоть до родов. Иммуноглобулин профилактирует активизацию хронических и присоединения новых инфекций. Также рекомендуется женщинам, получающим гепарин, в течение всей беременности принимать препараты кальция и витамина D, чтобы предотвратить развитие остеопороза.
Применение Аспирина прекращают на 37-ой неделе беременности, а гепарины вводят вплоть до начала регулярной родовой деятельности, если роды ведут через естественные пути. Если назначено плановое кесарево сечение, то Аспирин отменяют за 10 дней, а гепарины за сутки до даты операции. Если гепарины применялись до начала родов, то таким женщинам нельзя давать эпидуральную анестезию.
После родоразрешения лечение, проводившееся во время беременности, продолжают еще 1 – 1,5 месяца. Причем возобновляют применением Аспирина и гепаринов через 6 – 12 часов после родов. Дополнительно после родов проводят мероприятия по профилактике тромбозов, для чего рекомендуется как можно раньше вставать с постели и активно двигаться, а также бинтовать ноги эластичными бинтами или надевать на них компрессионные чулки.
После 6-недельного применения гепаринов и Аспирина после родов дальнейшее лечение антифосфолипидного синдрома проводит врач-ревматолог, в компетенции которого и находится выявление и терапия данного заболевания. Через 6 недель после родов ревматолог отменяет гепарины и Аспирин, и назначает уже необходимое для дальнейшей жизни лечение.
В России в некоторых регионах распространена практика назначения беременным женщинам с АФС Вобэнзима и Вессел-Дуэ-Эф. Однако эффективность и безопасность применения данных препаратов при беременности с АФС не подтверждена серьезными научными исследованиями.
Депрессия при беременности: причины, симптомы и лечение. Страх послеродовой депрессии (рекомендации врача) – видео
Автор: Наседкина А.К. Специалист по проведению исследований медико-биологических проблем.
источник