Фенилкетонурия – наследственное нарушение аминокислотного обмена, обусловленное недостаточностью печеночных ферментов, участвующих в метаболизме фенилаланина до тирозина. Ранними признаками фенилкетонурии служат рвота, вялость или гиперактивность, запах плесени от мочи и кожи, задержка психомоторного развития; типичные поздние признаки включают олигофрению, отставание в физическом развитии, судороги, экзематозные изменения кожи и др. Скрининг новорожденных на фенилкетонурию проводится еще в родильном доме; последующая диагностика включает молекулярно-генетическое тестирование, определение концентрации фенилаланина в крови, биохимический анализ мочи, ЭЭГ, МРТ головного мозга. Лечение фенилкетонурии заключается в соблюдении специальной диеты.
Фенилкетонурия (болезнь Феллинга, фенилпировиноградная олигофрения) – врожденная, генетически обусловленная патология, характеризующаяся нарушением гидроксилирования фенилаланина, накоплением аминокислоты и ее метаболитов в физиологических жидкостях и тканях с последующим тяжелым поражением ЦНС. Фенилкетонурия впервые описана А. Феллингом в 1934 г.; встречается с частотой 1 случай на 10 000 новорожденных. В неонатальном периоде фенилкетонурия не имеет клинических проявлений, однако поступление фенилаланина с пищей вызывает манифестацию заболевания уже в первом полугодии жизни, а в дальнейшем приводит к тяжелым нарушениям развития ребенка. Именно поэтому пресимптоматическое выявление фенилкетонурии у новорожденных является важнейшей задачей неонатологии, педиатрии и генетики.
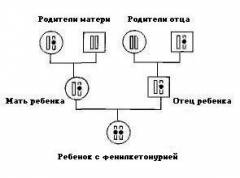
Фенилкетонурия является заболеванием с аутосомно-рецессивным характером наследования. Это означает, что для развития клинических признаков фенилкетонурии ребенок должен унаследовать по одной дефектной копии гена от обоих родителей, являющихся гетерозиготными носителями мутантного гена.
Чаще всего к развитию фенилкетонурии приводит мутация гена, кодирующего фермент фенилаланин-4-гидроксилазу и расположенного на длинном плече 12 хромосомы (локус12q22-q24.1). Это, так называемая, классическая фенилкетонурия I типа, составляющая 98% всех случаев заболевания. Гиперфенилаланинемия может достигать 30 мг% и выше. При отсутствии лечения данный вариант фенилкетонурии сопровождается глубокой умственной отсталостью.
Кроме классической формы, различают атипичные варианты фенилкетонурии, протекающие с той же клинической симптоматикой, но не поддающиеся коррекции диетотерапией. К ним относятся фенилкетонурия II типа (недостаточность дегидроптеринредуктазы), фенилкетонурия III типа (дефицит тетрагидробиоптерина) и другие, более редкие варианты.
Вероятность рождения ребенка, больного фенилкетонурией, повышается при заключении близкородственных браков.
В основе классической формы фенилкетонурии лежит недостаточность фермента фенилаланин-4-гидроксилазы, участвующего в конверсии фенилаланина в тирозин в митохондриях гепатоцитов. В свою очередь, производный тирозина – тирамин является исходным продуктом для синтеза катехоламинов (адреналина и норадреналина), а дийодтирозин – для образования тироксина. Кроме этого, результатом метаболизма фенилаланина служит образование пигмента меланина.
Наследственная недостаточность фермента фенилалаиин-4-гидроксилазы при фенилкетонурии приводит к нарушению окисления фенилаланина, поступающего с пищей, в результате чего его концентрация в крови (фенилаланинемия) и спинномозговой жидкости значительно возрастает, а уровень тирозина соответственно падает. Избыточное содержание фенилаланина устраняется путем повышенной экскреции с мочой его метаболитов — фенилпировиноградной, фенилмолочной и фенилуксусной кислот.
Нарушение обмена аминокислот сопровождается нарушением миелинизации нервных волокон, снижением образования нейромедиаторов (дофамина, серотонина и др.), запускающими патогенетические механизмы задержки умственного развития и прогредиентное слабоумие.
Новорожденные с фенилкетонурией не имеют клинических признаков заболевания. Обычно манифестация фенилкетонурии у детей происходит в возрасте 2-6 месяцев. С началом кормления в организм ребенка начинает поступать белок грудного молока либо его заменителей, что приводит к развитию первых, неспецифических симптомов – вялости, иногда – беспокойства и гипервозбудимости, срыгивания, мышечной дистонии, судорожного синдрома. Одним из ранних патогномоничных признаков фенилкетонурии служит упорная рвота, которая нередко ошибочно расценивается как проявление пилоростеноза.
Ко второму полугодию становится заметным отставание ребенка в психомоторном развитии. Ребенок становится менее активным, безучастным, перестает узнавать близких, не пытается садиться и вставать на ножки. Аномальный состав мочи и пота обусловливают характерный «мышиный» запах (запах плесени), исходящий от тела. Часто наблюдается шелушение кожи, дерматиты, экзема, склеродермия.
У детей с фенилкетонурией, не получающих лечения, выявляется микроцефалия, прогнатия, позднее (после 1,5 лет) прорезывание зубов, гипоплазия эмали. Отмечается задержка речевого развития, а к 3-4 годам выявляется глубокая олигофрения (идиотия) и практически полное отсутствие речи.
Дети с фенилкетонурией имеют диспластическое телосложение, нередко — врожденные пороки сердца, вегетативные дисфункции (потливость, акроцианоз, артериальную гипотонию), страдают запорами. К фенотипическим особенностям детей, страдающих фенилкетонурией, следует отнести светлую кожу, глаза и волосы. Для ребенка с фенилкетонурией характерны специфическая поза «портного» (согнутые в суставах верхние и нижние конечности), тремор рук, шаткая, семенящая походка, гиперкинезы.
Клинические проявления фенилкетонурии II типа характеризуются тяжелой степенью умственной отсталости, повышенной возбудимостью, судорогами, спастическим тетрапарезом, сухожильной гиперрефлексией. Прогрессирование заболевание может приводить к гибели ребенка в возрасте 2-З лет.
При фенилкетонури III типа развивается триада признаков: микроцефалия, олигофрения, спастический тетрапарез.
В настоящее время диагностика фенилкетонурии (а также галактоземии, врожденного гипотиреоза, адрено-генитального синдрома и муковисцидоза) входит в программу неонатального скрининга, осуществляемого всем новорожденным.
Скрининг-тест проводится на 3-5 день жизни доношенного и 7 день жизни недоношенного ребенка путем забора образца капиллярной крови на специальный бумажный бланк. При обнаружении гиперфенилаланемии более 2,2 мг% ребенка направляют к детскому генетику для повторного обследования.
Для подтверждения диагноза фенилкетонурии проверяется концентрация фенилаланина и тирозина в крови, определяют активность печеночных ферментов (фенилаланингидроксилазы), выполняется биохимическое исследование мочи (определение кетоновых кислот), метаболитов катехоламинов в моче и др. Дополнительно проводится ЭЭГ и МРТ головного мозга, осмотр ребенка детским неврологом.
Генетический дефект при фенилкетонурии может быть обнаружен еще на этапе беременности в ходе инвазивной пренатальной диагностики плода (хорионбиопсии, амниоцентеза, кордоцентеза).
Дифференциальный диагноз фенилкетонурии проводят с внутричерепной родовой травмой новорожденных, внутриутробными инфекциями, другими нарушениями обмена аминокислот.
Основополагающим фактором в лечении фенилкетонурии является соблюдение диеты, ограничивающей поступление белка в организм. Лечение рекомендуется начинать при концентрации фенилаланина >6 мг%. Для грудных детей разработаны специальные смеси — Афенилак, Лофенилак; для детей старше 1 года – Тетрафен, Фенил-фри; старше 8 лет — Максамум-ХР и др. Основу диеты составляют низкобелковые продукты — фрукты, овощи, соки, белковые гидролизаты и аминокислотные смеси. Расширение диеты возможно после 18 лет в связи с возрастанием толерантности к фенилаланину. В соответствии с российским законодательством обеспечение лиц, страдающих фенилкетонурией, лечебным питанием, должна осуществляться бесплатно.
Больным назначается прием минеральных соединений, витаминов группы В и др.; по показаниям — ноотропные средства, антиконвульсанты. В комплексной терапии фенилкетонурии широко используется общий массаж, ЛФК, иглорефлексотерапия.
Дети, страдающие фенилкетонурией, находятся под наблюдением участкового педиатра и психоневролога; нередко нуждаются в помощи логопеда и дефектолога. Необходим тщательный мониторинг нервно-психического статуса детей, контроль уровня фенилаланина в крови и показателей электроэнцефалограммы.
Атипичные формы фенилкетонурии, не поддающиеся лечению диетой, требуют назначения гепатопротекторов, противосудорожных средств, заместительной терапии леводопой, 5-гидрокситриптофаном.
Проведения массового скрининга на фенилкетонурию в неонатальном периоде позволяет организовать раннюю диетотерапию и предотвратить тяжелые церебральные повреждения, нарушения функции печени. При раннем назначении элиминационной диеты при классической фенилкетонурии прогноз развития детей хороший. При поздно начатом лечении прогноз в отношении умственного развития неблагоприятный.
Профилактика осложнений фенилкетонурии заключается в проведении массового скрининга новорожденных, раннего назначения и длительного соблюдения диетического питания.
С целью оценки риска рождения ребенка с фенилкетонурией предварительное генетическое консультирование должны пройти супружеские пары, уже имеющие больного ребенка, состоящие в кровнородственном браке, имеющие родственников с данным заболеванием. Женщины с фенилкетонурией, планирующие беременность, должны соблюдать строгую диету до зачатия и во время беременности для исключения повышения уровня фенилаланина и его метаболитов и нарушения развития генетически здорового плода. Риск рождения ребенка с фенилкетонурией у родителей-носителей дефектного гена, составляет 1:4.
источник
Фенилкетонурия (ФКУ). Причины, симптомы, диагностика и лечение фенилкетонурии. Лечение фенилкетонурии: диета и питание.
Фенилкетонурия (ФКУ) – довольно редкое наследственное заболевание, связанное с нарушением обмена аминокислот. Организм больного фенилкетонурией человека не способен расщеплять аминокислоту фенилаланин, которая поступает с белковой пищей. В результате этого, в тканях накапливаются соединения, отравляющие нервную систему и головной мозг в частности. Развивается умственная отсталость (малоумие), вплоть до идиотии. В связи с этим болезнь получила и другое название – фенилпировиноградная олигофрения.
Однако из всех наследственных заболеваний фенилкетонурия, единственное, которое удается полностью нейтрализовать. Сегодня ребенка, рожденного с признаками ФКУ, можно вырастить абсолютно здоровым. Обезопасить мозг малыша удается с помощью специальной диеты, о которой мы расскажем ниже.
В разных странах частота этого заболевания отличается в разы. В России рождается один больной ребенок на 10 000. В некоторых регионах Великобритании этот показатель в два раза выше – 1:5000. Дети на Африканском континенте практически не болеют фенилкетонурией. Среди больных количество девочек почти в два раза превышает количество мальчиков.
Причина возникновения этого заболевания связана с тем, что в печени человека не вырабатывается особый фермент – фенилаланин-4-гидроксилаза. Он отвечает за превращение фенилаланина в тирозин. Последний входит в состав пигмента меланина, ферментов, гормонов и необходим для нормальной работы организма.
При ФКУ фенилаланин, в результате побочных путей обмена, превращается в вещества, которых не должно быть в организме: фенилпировиноградную и фенилмолочную кислоты, фенилэтиламин и ортофенилацетат. Эти соединения накапливаются в крови и оказывают комплексное действие:
- нарушают процессы жирового обмена в мозге
- вызывают дефицит нейромедиаторов, которые передают нервный импульс между клетками нервной системы
- оказывают токсическое действие, отравляя мозг
Это вызывает значительное и необратимое снижение интеллекта. У ребенка быстро развивается умственная отсталость – олигофрения.

Если же момент упущен, и ребенок употребляет в пищу белковые продукты, богатые фенилаланином, то начинают проявляться симптомы поражения центральной нервной системы. Поначалу изменения у больных фенилкетонурией незначительны. Их трудно заметить даже опытному педиатру. Это слабость и беспокойство. Малыш не улыбается и мало двигается.
К шести месяцам задержка развития становится более заметной. Ребенок слабо реагирует на происходящее, не узнает мать, не пытается сесть и перевернуться. Фенилаланин и его производные выводятся из организма с мочой и потом. Они вызывают специфический «мышиный» или затхлый запах.
Годовалый ребенок не умеет выражать голосом свои эмоции и переживания, имеет невыразительную мимику, не понимает речь родителей.
В возрасте трех лет и старше симптомы фенилкетонурии нарастают. У детей наблюдается повышенная возбудимость, утомляемость, нарушения поведения, психотические расстройства, умственная отсталость. Если не заниматься лечением фенилкетонурии, то состояние больного будет ухудшаться.

На сегодняшний день все новорожденные дети массово обследуются на наличие фенилкетонурии. На территории России этот вопрос регламентирует приказ Минздрава РФ №316 от 30.12.1993 г. Процедура получила название неонатальный скрининг и является эффективным способом выявления наиболее распространенных наследственных заболеваний, среди них и ФКУ.
Массовое обследование новорождённых это простой и достоверный метод диагностики. В роддоме у каждого ребенка берут несколько капель периферической крови из пяточки. Это делается натощак, через три часа после кормления. У доношенных детей анализ берут на четвертый день жизни, а у недоношенных на седьмой. У тех новорожденных, которые появились на свет не в родильных домах, важно взять анализ на протяжении первых трех недель.
Кровь наносят на специальный тест-бланк, который потом отправляют в лабораторию для проведения генетического исследования. Там на протяжении суток проводится анализ крови на содержание в ней аминокислоты — фенилаланина. Результаты теста заносятся в обменную карту ребенка в виде штампа: «На ФКУ и ВГ обследован».
В том случае, если в анализе обнаруживают измененный ген, то родителей с ребенком приглашают в медико-генетический центр для обследования. Для того, чтобы подтвердить или опровергнуть диагноз назначаются дополнительные исследования:
- в сухом пятне крови
- в сыворотке крови
- потовый тест
- копрограмма
- ДНК-диагностика
В любом случае родители должны понимать, что при своевременно начатом лечении и соблюдении диеты удается полностью предотвратить развитие болезни.
На сегодняшний день в нашей стране единственным эффективным методом лечения является диетотерапия. Разрабатываются препараты, которые позволят контролировать уровень фенилаланина в крови без соблюдения диеты. В этом направлении есть значительные успехи, но в продаже такие лекарственные средства появятся не раньше чем через 5-7 лет.
Постоянно идет работа над поиском новых средств и методов борьбы с болезнью.
- Перспективным направлением считается использование растительного фермента фенилаланинлиазы, который будет расщеплять излишки фенилаланина в организме.
- Ученые возлагают большие надежды на генотерапию с использованием вирусного фактора, которая позволит вылечить больной ген и полностью избавиться от проблемы.
- Практикуется введение гена фенилаланингидроксилазы прямо в пораженные клетки печени.
Но в нашей стране эти разработки пока не используются. Лечение с помощью диеты – основная помощь больным фенилкетонурией. Ограничить употребление белка необходимо с самого рождения и до половой зрелости. За ростом и развитием ребенка постоянно наблюдают врачи: педиатр и невролог. Специалисты корректируют количество белков, чтобы они соответствовали возрасту и нагрузкам ребенка.
Некоторые формы фенилкетонурии поддаются лечению тетрагидробиоптерином, который является составляющей частью недостающего фермента фенилаланин-4-гидроксилазы. Атипичные формы ФКУ не лечатся с помощью диеты и требуют регулярного приема тетерагидробиоптерина или его заменителей.

Соблюдать диету требуется до 16-18 лет. Это обязательное условие. Желательно контролировать количество животных белков и в дальнейшем.
Если женщина, у которой в детстве были обнаружены признаки ФКУ, планирует забеременеть, то ей обязательно нужно вернуться к диете без фенилаланина. Таких ограничений необходимо придерживаться до зачатия, во время беременности и кормления грудью.
Все необходимые для роста и развития аминокислоты поступают в организм из специализированных лечебных продуктов. Обычно они представляют собой порошок – сухую смесь аминокислот. Их родителям больного малыша выдают бесплатно в медико-генетической консультации.
Грудные дети получают специальные смеси полностью очищенные от лактозы на основе гидролизата молочного белка.
Питательные средства, которые должны заменить детям натуральные белковые продукты, содержат:
- пептиды (расщепленные ферментами молочные белки);
- свободные аминокислоты (тирозин, триптофан, цистин, гистидин и таурин).
В России применяются такие смеси: Афенилак, Аналог-СП, Мдмил-ФКУ-0. Они представляют собой порошки, которые необходимо разводить кипяченой водой или сцеженным грудным молоком, согласно инструкции. В результате получается жидкая смесь или «сметанка». Такой прикорм вводят постепенно, в течение 2-5 дней под наблюдением врача.
Специальными диетическими продуктами для пополнения запасов белка у детей разного возраста также являются: “Берлафен“, “Циморган“, “Минафен“, “Апонти“.
Детей, больных ФКУ, можно кормить грудью. Но при этом кормящей матери нужно придерживаться специальной диеты.
В диете детей дошкольного и школьного возраста полностью исключают из меню белковые продукты. В списке разрешенных продуктов – овощи, фрукты, изделия из крахмала, растительные масла. При составлении дневного меню необходимо строго придерживаться возрастных норм фенилаланина.
| Возраст ребенка | Суточное количество фенилаланина (мк/кг массы тела) |
| Младше 2 мес. | 60 |
| 2-3 мес. | 60-55 |
| 3-6 мес. | 55-45 |
| 6-12 мес. | 45-35 |
| 1-1,5 года | 35-30 |
| 1,5-3 года | 30-25 |
| 3-6 лет | 25-15 |
| Старше 6 лет | 15-10 |
Необходимо помнить, что для растущего организма полноценное питание жизненно необходимо. Так в сутки ребенку требуется 120 мг тирозина на каждый килограмм массы. Поэтому дети и подростки с таким диагнозом должны получать аминокислоты для построения клеток и роста из дополнительных источников. Также обязательно назначают витаминно-минеральный комплекс. Особенно важно, чтобы ребенок получал норму витаминов С, В6 и B1, фолиевой кислоты, железа, кальция и магния. Количество калорий должно быть увеличено на 30% по сравнению с дневной нормой сверстников.
Разделяют три группы натуральных продуктов. В основе классификации лежит количество в них фенилаланина:
- Красный список – продукты, которые необходимо полностью исключить из рациона.
- Оранжевый список – разрешены в небольших количествах под строгим контролем.
- Зеленый список – могут употребляться без ограничений.
| Красный список | Оранжевый список | Зеленый список |
| Все виды мяса | Молочные продукты | Фрукты |
| Колбасные изделия | Рис и кукуруза | Ягоды |
| Все виды рыбы | Овощи (картофель, капуста) | Зелень |
| Морепродукты | Овощные консервы | Овощи |
| Яйца | Рисовая, кукурузная мука | |
| Сыры | Крахмал и саго | |
| Творог | Сахар и варенье | |
| Орехи | Мед | |
| Хлеб и хлебобулочные изделия | Сливочное и растительное масло, топленый жир | |
| Кондитерские изделия | ||
| Крупы и хлопья | ||
| Продукты из сои | ||
| Поп-корн | ||
| Аспартам |
Промышленность выпускает еще две группы продуктов:
- искусственные низкобелковые продукты, специально для диетического питания (хлеб, печенье, макароны)
- готовые пюре для детского питания на основе фруктов.
На основе этих продуктов можно составить полноценное меню, готовить ребенку вкусные, полезные и разнообразные блюда.
Родителям ребенка, больного ФКУ, важно уметь составлять диету и правильно рассчитывать количество фенилаланина. Для этого необходимо иметь под рукой весы, которые дают возможность взвешивать до десятой доли грамма.

Для определения необходимо сделать анализ крови в лаборатории. До трехмесячного возраста это делают еженедельно.
Постепенно врач снижает количество анализов. С тех месяцев до года – один раз в месяц, с года до трех лет – один раз в два месяца. После трех лет частота проверок снижается до одного раза в три месяца. Существует специальная схема, но специалист может изменить ее, исходя из состояния больного.
Делать анализ желательно утром натощак. От качества и регулярности такого контроля и своевременных исправлений в диете зависит сохранение интеллекта.
Новорожденные с диагнозом ФКУ ничем не отличаются от здоровых детей. И если болезнь вовремя выявить и остановить ее развитие, то и в дальнейшем такой ребенок останется абсолютно здоровым.
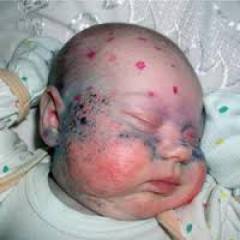
Как выглядят больные фенилкетонурией?
При рождении младенцы, больные фенилкетонурией, ничем не отличаются от остальных детей. Но на втором месяце жизни начинают проявляться изменения:
- посветление волос и радужки глаза из-за недостатка пигмента меланина
- чрезмерная прибавка в весе
- быстро зарастает большой родничок
- суховатая кожа
- шелушение, сыпь и экзема
- частая рвота
- моча и пот с характерным «мышиным» запахом
На втором полугодье дети, не получающие лечение, перестают узнавать мать, не могут фиксировать взгляд на одном предмете, не реагируют на яркие игрушки, не садятся и не переворачиваются, становятся раздражительными. В возрасте 2-3 года отмечаются такие особенности:
- появляются судороги и спазмы
- скованность движений и зажатая «поза портного», что связанно с повышенным напряжением в мышцах
- неадекватное поведение, выкрики, смех
- уменьшение размеров черепа
- деформация ушных раковин
- дрожание пальцев рук
- недержание мочи
- выступающая вперед нижняя челюсть
Внешние признаки болезни выражены незначительно, но при отсутствии диеты развиваются сильные психические отклонения, приводящие к инвалидности.
Для того чтобы обеспечить детей всеми необходимыми веществами в достаточном количестве разработаны специальные смеси на основе незаменимых и заменимых аминокислот. В их состав также входят витамины и все необходимые микроэлементы.
Для детей до одного года рекомендуют:
- Афенилак 13, Афенилак 15 от компании «Нутритек», Россия;
- MIDмил ФКУ 0 (Hero, Испания);
- ХР Аналог («Нутриция», Голландия);
- Фенил Фри 1 («Мид Джонсон» США).
Для детей старше одного года и для взрослых:
- П-АМ 1, П-АМ 2, П-АМ 3;
- Изифен (готовый продукт), а также ХР Максамейд и ХР Максамум с нейтральным и фруктовым вкусами («Нутриция», Голландия).
Эти продукты имеют прекрасные вкусовые качества и хорошо переносятся. Они необходимы детям и взрослым с диагнозом ФКУ в периоды умственных и физических нагрузок. Смеси удобны в применении, питательны и полностью покрывают потребности организма в аминокислотах.

Такой метод диетотерапии является самым дешевым и действенным. На протяжении многих лет он помогает детям с этой болезнью вырасти здоровыми. В своем развитии они ничем не уступают сверстникам. Те, кому в детстве ставили диагноз «фенилкетонурия», учатся в школе, получают высшее образование, заводят семью и рожают здоровых детей.
Подводя итоги, отметим, что фенилкетонурия это тяжелое генетическое заболевание, которое может привести к психической инвалидности. Изменения происходят в нервной системе очень быстро и имеют необратимый характер. Однако можно не допустить развития болезни. Для этого необходима ранняя диагностика и специальная диета.
- ФенилкетонурияI. Классическая и наиболее распространенная форма заболевания, описанная выше в статье. Связана с мутацией гена в 12-й хромосоме, при этом нарушается образование фермента фенилаланин-4-гидроксилазы, который превращает фенилаланин в тирозин.
- ФенилкетонурияII. При этой форме заболевания нарушение происходит в 4-й хромосоме. Нарушается выработка фермента дигидроптеридинредуктазы, который также способствует превращению фенилаланина в тирозин. Заболевание наследуется так же, как и I форма: для того, чтобы родился больной ребенок, необходимо, чтобы носителями гена были оба родителя. Распространенность фенилкетонурии II – 1 случай на 100 000 новорожденных.
- ФенилкетонурияIII. В результате генетических нарушений возникает недостаток фермента 6-пирувоилтетрагидроптеринсинтазы. Наследуется, как и две предыдущие формы заболевания. Распространенность – 1 случай на 300 000 новорожденных.
Критерии установления инвалидности при фенилкетонурии:
- При фенилкетонурии I инвалидность устанавливают только при необратимых нарушениях со стороны центральной нервной системы, которые приводят к неврологическим расстройствам и умственной отсталости.
- При фенилкетонурии II и III типа группу инвалидности устанавливают во всех случаях.

- Генетическое консультирование. Необходимо людям, планирующим завести ребенка, которые больны или являются носителями неправильного гена, у которых болен хотя бы один близкий родственник или уже родился больной ребенок. Консультирование проводит врач-генетик. Он помогает разобраться, как ген, ответственный за фенилкетонурию, передавался в предыдущих поколениях, каковы риски будущего ребенка. Также генетик помогает с планированием семьи.
- Скрининг новорожденных. Анализ не помогает предотвратить заболевание, но позволяет выявить его максимально рано, пока оно еще не привело к необратимым изменениям в головном мозге.
- Консультации и диета для женщин, страдающих фенилкетонурией. Если вы женщина и страдаете ФКУ, вам следует проконсультироваться с врачом и спросить, когда лучше планировать беременность в вашем случае. Во время беременности нужно соблюдать правильную диету – это помогает предотвратить дефекты развития у ребенка.
Прогноз зависит от формы заболевания и начала лечения, соблюдения диетических рекомендаций, медико-педагогической коррекции.
При фенилкетонурии I, при своевременном начале необходимых мероприятий, прогноз, как правило, благоприятный. Ребенок растет и развивается нормально. Если опоздать с лечением и диетой, то результат будет не таким хорошим.
При фенилкетонурии II и III прогноз серьезнее. Соблюдение диеты не приносит эффекта.
источник
Фенилкетонурия — это наследственное нарушение аминокислотного обмена, которое обусловлено недостаточностью определенных ферментов в печени, которые участвуют в обмене фенилаланина до тирозина.
Проверка младенцев на заболевание проводится в роддоме. Основа лечения — коррекция рациона в виде специальной диеты.
В этой статье мы расскажем о фенилкетонурии у новорожденных и детей постарше, а также дадим клинические рекомендации по образу жизни и питанию.
Фенилкетонурия, либо болезнь Феллинга, — это врожденная патология, которая имеет генетическую природу.
Заболевание предполагает нарушение гидроксилирования фенилаланина, а также накопление аминокислоты с продуктами ее обмена в тканях и жидкостях организма с дальнейшим серьезным поражением центральной нервной системы.
Заболевание впервые было описано А. Феллингом в 1934 г. Оно достаточно редкое, встречается в одном случае на 10 000 младенцев.
Болезнь может привести к серьезным нарушениям у ребенка. Желательно выявить его до того, как проявятся симптомы.
На данный момент это очень важная задача для педиатров, неонатологов и генетиков.
Код болезни по МКБ-10 — E70. Нарушения обмена ароматических аминокислот.
О том, что такое фенилкетонурия, расскажет видео:
Фенилкетонурия — болезнь с аутосомно-рецессивным способом наследования. Чтобы проявились ее характерные признаки, ребенку нужно унаследовать по одной дефектной копии гена от двух родителей, что являются гетерозиготными носителями гена с мутацией.
В данной ситуации речь идет о классической фенилкетонурии 1 типа, на которую приходится 98% случаев болезни.
Гиперфенилаланинемия может быть от 30 мг%. Если терапия не проводится, эта форма патологии будет сопровождаться серьезной интеллектуальной отсталости.
Помимо классической формы, существуют атипичные. Они имеют аналогичную симптоматику, но не поддаются коррекции посредством диетотерапии.
Это заболевания 2 и 3 типа. Есть другие варианты, но более редкие.
Причины заболевания следующие:
- Близкородственные браки, которые кроме ряда других патологий увеличивают риск появления ребенка с данной болезнью.
Мутация гена в районе 12 хромосомы.
Процесс наследования мутационного гена может иметь случайный характер.
В течение первых недель существования малыша выявить наличие фенилкетонурии у ребенка невозможно. Первые симптомы появляются через 2-6 месяцев после рождения.
Малыш становится вялым, не заинтересован в том, что его окружает, возникает беспокойство, нарушения мышечного тонуса. Возникают судороги, рвота, тяжелые экземы на коже.
Под экземами также поднимаются острые или хронические формы воспалений, не являющихся заразными и провоцирующими сыпь.
Шестой месяц жизни дает возможность выявить у ребенка отставание в развитии. У больного теряется способность фокусировать взгляд на конкретных предметах, ребенок может перестать узнавать родителей, реагировать на предметы ярких цветов.
Важно как можно раньше начать лечение, иначе отсталость будет проявляться все сильнее.
На физическом уровне отсталость проявляется меньше, чем на психическом. Габариты головы могут быть меньше нормы. Зубы начинают резаться позже нормы.
Когда такие малыши стоят, они широко расставляют ноги, сгибают их в коленях и тазобедренных суставах, опускают плечи и голову.
При ходьбе больные дети покачиваются, делают маленькие шажки. При сидении они поджимают под себя ножки, что связано с серьезным мышечным тонусом, которому он подвергается.
У больных фенилкетонурией детей имеются определенные особенности внешности. Они имеют белую кожу, лишенную пигментации, светлые волосы и глаза.
Кожа часто покрывается сыпью, поскольку она имеет высокую чувствительность к лучам ультрафиолета.
Из основных проявления заболевания — так называемый «мышиный» запах. Могут проявляться эпилептические припадки, которые пропадают по мере роста.
Другие признаки — дерматит, сниженное артериальное давление, частые запоры, дрожание конечностей, нарушение равновесия и координации движений.
Диагностика фенилкетонурии является составляющей программы неонатального скрининга и проводится у всех новорожденных еще в роддоме.
Делается это на 3-5 жизни ребенка (на 7 день, если он родится недоношенным) с помощью забора образца капиллярной крови на предназначенный для этого бланк.
Если обнаруживается гиперфенилаланемия больше 2,2 мг%, проводится полное обследование у детского генетика.
Чтобы подтвердить диагноз, выполняется проверка концентрации в крови фенилаланина и тирозина, определяется активность ферментов печени, делается биохимические исследование мочи.
Дополнительно делается МРТ головного мозга и ЭЭГ, показан осмотр ребенка у детского невролога.
В некоторых случаях генетический дефект обнаруживается еще при беременности на этапе пренатальной инвазивной диагностики будущего ребенка.
Дифференциальный диагноз — при внутричерепных родовых травмах, внутриутробных инфекциях, иных нарушениях метаболизма аминокислот.
Главный и практически единственный метод терапии патологии — соблюдение диеты с ограниченным поступлением в организм белка.
Начинать лечение рекомендовано при концентрации фенилаланина больше 6 мг%.
Диета базируется на низкобелковых продуктах, белковых гидролизатах и смесях аминокислот. Она может быть расширена по достижении совершеннолетия ввиду повышения толерантности к фенилаланину.
По закону обеспечение людей с фенилкетонурией лечебным питанием бесплатное.
Пациентам могут быть показаны минеральные соединения, витамины группы В, по показаниям — антиконвульсанты и ноотропные препараты.
В комплексном лечении может использоваться ЛФК, массаж, некоторые методы физиотерапии.
Страдающих фенилкетонурией детей должен наблюдать участковый педиатр и психоневролог. Иногда нужен логопед и дефектолог.
Важны мониторинг нервно-психического состояния, контроль фенилаланина в крови и показателей электроэнцефалограммы.
Атипичные формы заболевания, которые не поддаются лечению диетой, предполагают назначение гепатопротекторов, противосудорожных препаратов, заместительную терапию леводопой и 5-гидрокситриптофаном.
Основной метод терапии — это диета, которая нужна с первых дней жизни. Она предполагает резкое ограничение фенилаланина, содержащегося в некоторых продуктах.
По мере снижения в крови фенилаланина до нормальных показателей рацион дополняется продуктами животного происхождения. В питание включают фрукты, овощи, углеводы, животные и растительные жиры.
О продуктах для больного фенилкетонурией:
В небольших количествах можно употреблять мед, сливочное масло, хлеб, рис.
Исключается мясо, рыба, молоко, молочная продукция, яйца, бобовые, макароны, орехи, шоколад.
Строгая диета продолжается не менее пяти лет. Если все делается правильно, то обычно к 12-14 годам ребенок может переходить на обычное питание. Но важен постоянный контроль фенилаланина.
Осложнения заболевания в основном касаются центральной нервной системы. Ввиду расстройств жирового и белкового обмена снижается интеллект, в сложных ситуациях возможна идиотия.
Прогрессирующая форма при отсутствии лечения может стать причиной летального исхода.
Чтобы предупредить негативные последствия, нужно работать с медицинскими специалистами.
Поскольку новорожденным проводится массовый скрининг на фенилкетонурию, выявить заболевание удается на ранней стадии, своевременно организовать диетотерапию и предупредить серьезные церебральные нарушения, нарушения работы печени.
При классической фенилкетонурии и своевременном назначении диеты прогноз развития для ребенка благоприятный.
Неблагоприятен он, если лечение началось несвоевременно. Тогда возможно серьезное нарушение умственного развития.
Поскольку заболевание генетическое, профилактика его невозможна. Для профилактики же осложнений болезни используется массовый скрининг, назначается лечение с длительным соблюдением диеты.
С целью оценки вероятности появления на свет ребенка с фенилкетонурией семьи, у которых уже есть больной ребенок, и они находятся в кровнородственном браке или имеют родственников с данной болезнью, должны предварительно пройти консультацию генетика.
Женщины с фенилкетонурией, желающие стать матерями, до и после зачатия должны соблюдать специальную диету, которая исключит повышение уровня фенилаланина с его метаболитами, предотвратит нарушения развития у плода, являющегося генетически здоровым.
Фенилкетонурия — редкое, но достаточно опасное заболевание. Если ребенок болен им, важно своевременно начать терапию, организовать для него диету. Тогда прогноз может быть благоприятным.
источник
Ожидание рождения ребенка – период и радостный, и волнительный одновременно. Будущие родители испытывают тревогу по поводу здоровья еще не родившегося малыша. Когда чудо свершилось и маленький появился внешне здоровым, тогда все испытывают неимоверное облегчение. Но, дабы окончательно убедиться в отличном состоянии ребенка, у него берут первый в жизни анализ – скрининг.
Скрининг или «пяточный тест» — это анализ крови из пятки новорожденного. Его делают в обязательном порядке во многих странах. И в его проведении имеется серьезный смысл. Он определяет наличие наследственных заболеваний.
Процедура проведения скрининга утверждена на государственном уровне, так как является наиболее эффективным методом диагностирования отклонений у детей, в том числе новорожденных. Он помогает выявлять недуги, которые были скрыты во время беременности по различным причинам. Чем раньше будет обнаружена болезнь, тем успешнее будет лечение. Ну, а если скрининг ничего не показал, то мама может даже и не знать о том, что ее малыш сдавал анализ.
Благодаря проведению такого анализа, как пяточный тест, можно выявить следующие заболевания и отклонения у новорожденных.
- фенилкетонурия;
- муковисцидоз;
- галактоземия;
- адреногенитальный синдром;
- врожденных гипотиреоз.
Никакое другое обследование не способно выявить эти нарушения у ребенка на ранней стадии, поэтому проведение скрининга новорожденных проводится во всех родильных домах на 3-5 сутки после появления крохи на свет.
Анализ крови из пятки новорожденного покажет наличие или отсутствие наследственных заболеваний. Как правило, диагностируют пять наиболее распространенных патологий развития. Эти болезни связаны с нарушениями обмена веществ и при своевременной диагностике могут быть излечимы.
Фенилкетонурия (ФКУ) – это генетическое заболевание, которое возникает при нарушении расщепления финилаланина. Это одна из 20 незаменимых аминокислот, которые входят в состав белков. Она не вырабатывается самостоятельно и поступает извне с пищей. На конечном этапе финилаланин превращается в тирозин, который является медиатором. Он отвечает за скорость передачи электрических импульсов между нервными клетками.
При фенилкетонурии, поступающий финилаланин не расщепляется, накапливается в крови, происходит тяжелое токсическое отравление, страдает головной мозг и центральная нервная система. Это приводит к тяжелому умственному и физическому недоразвитию и является причиной ранней детской инвалидности. Ребенок рождается без симптомов и на первом этапе жизни болезнь трудно обнаружить.
Около 6 месяцев фенилкетонурия проявляет себе следующими симптомами:
- блуждающий взгляд;
- отсутствие реакции на голос или движение матери;
- слабая моторика;
- отсутствуют попытки перевернуться на животик или сесть.
Со временем симптомы могут становиться более выраженными, если пища, принимаемая малышом, имеет животный белок. Больной ребенок рождается в той семье, где родители носят ген фенилкетонурии.
Если обнаружить патологию на ранней стадии, исключить из питания младенца лактозу и соблюдать специальную диету, то можно прожить здоровую, долгую и счастливую жизнь.
Муковисцидоз (с латыни – вязкая слизь) – внутреннее наследственное заболевание, которое поражает легкие, потовые железы и желудочно-кишечный тракт, вызывает хронические респираторные и пищеварительные болезни. Возникает заболевание при мутации гена, который контролирует секреторные механизмы (секрет – биологически активная жидкость, выделяемая клеткой). В итоге сгущаются секреты экзокринных желез (сальные железы, потовые, молочные, слюнные, железы ЖКТ, печень), что приводит к одновременному заболеванию органов.
В первые несколько дней после рождения можно уже диагностировать муковисцидоз, наблюдая за первым в жизни актом дефекации младенца. Если ребенок самостоятельно не может избавиться от первородного кала, то нужно срочно делать анализ.
Симптомы болезни у маленьких детей:
- замедленное физическое развитие;
- сухость кожи;
- увеличенная печень;
- кожа становится землистого оттенка;
- стул – густой, с неприятным запахом;
- вздутый животик;
- затрудненное дыхание из-за слизи в легких.
Диагноз, как правило, подтверждается до двух лет. Больным необходимо постоянное наблюдение у врача и употребление медикаментов каждый день и до конца жизни. Современная медицина дает обнадеживающие прогнозы для людей с муковисцидозом.
Галактоземия – наследственное нарушение в активности фермента, который перерабатывает галактозу (простой сахар, входящий в состав молока). В печени этот моносахарид превращается в глюкозу с помощью фермента. Его отсутствие приводит к накоплению галактозы, отравлению организма и к тяжким последствиям со стороны ЦНС, глаз, ЖКТ и вызывает такие симптомы:
- сильная рвота и понос после кормления;
- отказ от пищи;
- уменьшение массы тела;
- желтуха, повышенный билирубин;
- судороги, нарушение движений.
Диагностировать заболевание можно еще в утробе мамы, но и скрининг новорожденного тоже достаточно эффективен, так как выявление патологии на ранней стадии может значительно облегчить протекание недуга и уменьшить его последствия. Патология возникает при условии, что оба родителя носят дефективный ген и вероятность передачи болезни потомству составляет лишь 25%. Молоко исключается из рациона человека навсегда. В это случае младенец не получает грудное молоко или молочные смеси, а специально разработанные адаптированные витаминные смеси.
Адреногенитальный синдром (АГС) – наследственная мутация генов, которые отвечают за выработку гормонов надпочечниками. Происходит чрезмерное продуцирование андрогенов (мужских гормонов). При этом процессе понижается количество кортизола (гормона, отвечающего за метаболизм, жировой обмен, рост, иммунитет) и альдостерона (поддерживает водно-минеральный баланс в организме, кровяное давление). Болезни подвержены мальчики и девочки в равной степени. АГС имеет три формы проявления:
- Верильная — увеличенные размеры гениталий при рождении, низкорослость, ранее половое созревание (2-4 года).
- Сольтеряющий вид приводит к обильной рвоте, диарее, гипотонии. Нарушается солевой баланс, страдает сердце.
- Гипертоническое проявление болезни встречается редко и угрожает почечной недостаточностью, кровоизлияниями в мозг, нарушением зрения.
Если оба родителя носят мутированный ген, то возможность его передачи ребенку составляет 0-25%. АГС лечится как оперативно, так и медикаментозно. Болезнь может не отражаться на жизни человека при правильном подходе.
Врожденный гипотиреоз – это ряд заболеваний, при которых щитовидная железа частично или полностью теряет свои функции, имеет нарушения в строении, не вырабатывает нужное количество гормонов для нормального развития малыша. Недуг может быть, как наследственным, так и возникать во время внутриутробного формирования. Много зависит от здоровья матери, ее образа жизни при беременности. Симптомы гипотиреоза видны сразу после рождения:
- вес ребенка свыше 4 кг;
- общая недоразвитость при сроке 40 недель и выше;
- желтоватый оттенок кожных покровов;
- мышечная слабость;
- холодные конечности;
- отечность тела;
- пупочная грыжа.
Гипотиреоз развивается постепенно. Уже к 6 месяцам он имеет ярко выраженную клиническую картину: кожа – серо-желтая, сухая, постоянные запоры, апатия, заторможенность моторики, уменьшено потоотделение, голос малыша – хриплый и низкий. В дальнейшем, у деток наблюдается интеллектуальное отставание в развитии. У девочек развитие болезни более вероятно, чем у мальчиков. Лечение, начатое в первый месяц жизни младенца, в большинстве случаев имеет огромный успех. Такие дети ничем не уступают здоровым сверстникам.
Перед отправкой мамы и ребенка домой из роддома, у малыша берут анализ на выявления наследственных и врожденных заболеваний. Забор крови делают из пятки на специальную бумагу (тест-бланк). Пять кровяных отпечатков высушивают и отправляют в лабораторию на диагностику.
При обнаружении каких-либо отклонений от нормы, о результатах скрининга сообщают родителям и приглашают на повторное обследование, чтобы окончательно удостовериться в диагнозе и при необходимости провести ряд дополнительных анализов. Скрининг – это быстрый способ выявления патологий на ранних этапах жизни ребенка.
Если повторных пяточный тест подтвердил предыдущий результат, родителей ребенка приглашают на консультацию к врачу-генетику, который в свою очередь после детальной беседы, даст направления к более узким специалистам. Ребенку будут сделать дополнительные необходимые анализы и назначено лечение.
Пяточный анализ берут, как правило, на 3-5 день от рождения младенца. Ребенок должен быть доношенным и рожденным в срок. При преждевременном появлении маленького человека, скрининг делают через 7 -10 суток.
Раньше указанных сроков сдавать кровь не имеет смысла, так как результаты могут быть обманчивыми и диагноз будет неверным. Если мать с малышом были выписаны раньше четырехдневного срока, то скрининг нужно провести в поликлинике. Результаты будут доступны через 10 дней у педиатра. Ранняя диагностика болезней повышает шансы на здоровую жизнь.
источник
Фенилкетонурия (ФКУ) — генетическое заболевание, характеризующееся нарушениями обмена фенилаланина. Встречается с частотой 1 на 8000–15 000 новорожденных. Выделяют четыре формы ФКУ; существует свыше 400 различных мутаций и несколько метаболических фенотип
.jpg)
Определение, патогенез, классификация
Фенилкетонурия — наследственная аминоацидопатия, связанная с нарушением метаболизма фенилаланина, в результате мутационной блокады ферментов приводящая к стойкой хронической интоксикации и поражению ЦНС c выраженным снижением интеллекта и неврологическим дефицитом [1, 2].
Основное значение в патогенезе классической ФКУ имеет неспособность фенилаланингидроксилазы перерабатывать фенилаланин до тирозина. В результате в организме накапливается фенилаланин и продукты его аномального обмена (фенилпировиноградная, фенилуксусная, фенилмолочная кислоты) [1–3].
В числе других патогенетических факторов рассматриваются нарушения аминокислотного транспорта через гематоэнцефалический барьер, нарушения церебрального пула аминокислот с последующим нарушением синтеза протеолипидных белков, нарушения миелинизации, низкие уровни нейротрансмиттеров (серотонин и др.) [1–4].
Фенилкетонурия I (классическая или тяжелая) — аутосомно-рецессивное заболевание, вызванное мутацией гена фенилаланингидроксилазы (длинное плечо хромосомы 12); выявлены 12 различных гаплотипов, из которых около 90% ФКУ ассоциировано с четырьмя гаплотипами. Наиболее частые мутации в гене фенилаланингидроксилазы: R408W, R261Q, IVS10 nt 546, Y414C. В основе болезни — дефицит фенилаланин-4-гидроксилазы, обеспечивающей конверсию фенилаланина в тирозин, что приводит к накоплению в тканях и физиологических жидкостях фенилаланина и его метаболитов [1–4].
Особую группу составляют атипичные варианты ФКУ, при которых клиническая картина напоминает классическую форму болезни, но по показателям развития, несмотря на проведение диетотерапии, не отмечается положительной динамики. Эти варианты ФКУ связаны с дефицитом тетрагидроптерина, дегидроптеринредуктазы, 6-пирувоилтетрагидроптеринсинтазы, гуанозин-5-трифосфатциклогидролазы и т. д. [1–4].
Фенилкетонурия II (атипичная) — аутосомно-рецессивное заболевание, при котором генный дефект локализуется в коротком плече хромосомы 4 (участок 4р15.3), характеризующееся недостаточностью дегидроптеринредуктазы, приводящей к нарушению восстановления активной формы тетрагидробиоптерина (кофактор в гидроксилировании фенилаланина, тирозина и триптофана) в сочетании со снижением в сыворотке крови и спинномозговой жидкости фолатов. Результатом являются метаболические блоки в механизмах превращения фенилаланина в тирозин, а также предшественников нейромедиаторов катехоламинового и серотонинового рядов (L-дофа, 5-окситриптофан). Болезнь описана в 1974 г. [1–4].
Фенилкетонурия III (атипичная) — аутосомно-рецессивное заболевание, связанное с недостаточностью 6-пирувоилтетрагидроптеринсинтазы, участвующей в процессе синтеза тетрагидробиоптерина из дигидронеоптеринтрифосфата (описано в 1978 г.). Дефицит тетрагидробиоптерина приводит к расстройствам, сходным с нарушениями при ФКУ II [1–4].
Примаптеринурия — атипичная ФКУ у детей с легкой гиперфенилаланинемией, у которых в моче в больших количествах присутствует примаптерин и некоторые его производные при наличии нормальной концентрации в спинномозговой жидкости нейромедиаторных метаболитов (гомованилиновой и 5-оксииндолуксусной кислот). Энзиматический дефект пока не выявлен [1–4].
Материнская ФКУ — заболевание, сопровождающееся снижением уровня интеллекта (до умственной отсталости) среди потомства женщин, страдающих ФКУ и не получающих специализированную диету в совершеннолетнем возрасте. Патогенез материнской ФКУ детально не изучен, но предполагается ведущая роль хронической интоксикации плода фенилаланином и продуктами его аномального метаболизма [1–4].
R. Koch и соавт. (2008) при аутопсии головного мозга младенца, у матери которого отмечалась ФКУ (без адекватного контроля за уровнем фенилаланина в крови), обнаружили ряд патологических изменений: низкий вес мозга, вентикуломегалию, гипоплазию белого вещества и задержку миелинизации (без признаков астроцитоза); хронических изменений в сером веществе головного мозга не было обнаружено. Предполагается, что нарушения в развитии белого вещества мозга ответственны за формирование неврологического дефицита при материнской ФКУ [5].
В практических целях в медико-генетических центрах РФ используется условная классификация ФКУ, основанная на уровнях содержания фенилаланина в сыворотке крови: классическая (тяжелая или типичная) — уровень фенилаланина выше 20 мг% (1200 мкмоль/л); средняя — 10,1–20 мг% (600–1200 мкмоль/л), а также уровень фенилаланина 8,1–10 мг%, если он устойчив на фоне физиологической нормы потребления белка в рационе питания; легкая (гиперфенилаланинемия, не требующая лечения) — уровень фенилаланина до 8 мг% (480 мкмоль/л) [2].
Клинические проявления и диагностика
При рождении дети с ФКУ I выглядят здоровыми, хотя чаще имеется специфический хабитус (светлые волосы, голубые глаза, суховатая кожа). При отсутствии своевременного выявления и лечения болезни в течение первых двух месяцев жизни у них появляется частая и интенсивная рвота и повышенная раздражительность. Между 4 и 9 месяцами становится очевидным выраженное отставание в психомоторном развитии [1–4].
Пациентов отличает специфический («мышиный») запах кожных покровов. Выраженные неврологические нарушения у них редки, но характерны черты гиперактивности и расстройств аутистического спектра. При отсутствии своевременного лечения уровень IQ составляет
В. М. Студеникин, доктор медицинских наук, профессор
Т. Э. Боровик, доктор медицинских наук, профессор
Т. В. Бушуева, кандидат медицинских наук
НЦЗД РАМН, Москва
источник
Фенилкетонурия представляет собой достаточно тяжелое наследственное заболевание, основная тяжесть проявлений которого сосредоточена, прежде всего, на нервной системе. Фенилкетонурия, симптомы которой чаще всего встречаются среди девочек, возникает по причине нарушения обмена аминокислот, учитывая же поражение при этом ЦНС, ее проявления сводятся к нарушению умственного развития.
В классической своей форме, которая актуальна для большинства случаев, фенилкетонурия, которую также принято определять как фенилпировиноградную олигофрению, связана с резкостью снижения активности печеночного фермента. Им в частности является фениланин-4-гидроксилаз. Нормальное состояние организма предусматривает катализацию им превращения в тирозин фенилаланина. 1% случаев отмечается возникновением атипичной формы фенилкетонурии, которая возникает по причине мутаций в другого типа генах, которые ответственны за процесс кодирования ферментов. Наследование заболевания происходит в соответствии с аутосомно-рецессивной схемой.
Что касается процессов, происходящих при рассматриваемом заболевании, то они заключаются в следующем. Возникновение характерного метаболического блока провоцирует активацию побочных путей по обмену фенилаланина, что приводит к накоплению токсичных производных от его действия. К таким производным в частности относятся фенилмолочная и фенилпировиноградные кислоты, практически не образующиеся при нормальном состоянии организма. Они же влияют на ЦНС, провоцируя нарушения белкового обмена, обмена липопротеидов и обмена гликопротеидов. Одновременно с этим возникают расстройства в транспорте аминокислот, нарушения в обмене серотонина и катехоламинов, актуальность приобретают также и перинатальные факторы.
Помимо этого начинают также образовываться и в норме практически отсутствующие ортофенилацетат и фенилэтиламин. Их избыток провоцирует нарушения в метаболизме липидов, происходящем в головном мозге. Как предполагается, именно это становится причиной прогрессирующего состояния снижения у больных данным заболеванием интеллекта, что может достичь даже идиотии. В целом же окончательно механизм, в соответствии с действием которого происходит нарушение в развитии функций мозга в случае с актуальным для организма заболеванием фенилкетонурией, не ясен.
Здесь, прежде всего, важно отметить, что первые недели жизни ребенка не позволяют внешне определить данного заболевания. Первые его признаки проявляются через два-шесть месяцев с момента рождения малыша. Он становится вялым, наблюдается отсутствие заинтересованности в отношении условий, его окружающих и мира в целом. Также ребенок становится беспокойным, нарушениям подвергается мышечный тонус. Появляется рвота, судороги, тяжелые кожные . Под экземами в частности подразумевается острая или хроническая форма воспалительного и незаразного заболевания, при котором образуется сыпь. Природа заболевания аллергическая, дополнительными проявлениями симптоматики выступает чувство жжения и выраженный зуд кожи. Актуальна и склонность к рецидивам, то есть к повторному возникновению симптоматики после относительного временного его затишья.
Шестой месяц позволяет определить отставание в развитии у ребенка. Одновременно с этим теряется способность к фокусированию взгляда на отдельных предметах, малыш перестает узнавать родителей. Отсутствует реакция на цветные/яркие игрушки. Важно оперативно приступить к лечению, в противном случае отсталость развития будет постепенно подвергаться лишь прогрессированию в актуальных для нее процессах.
Физическое развитие больных младенцев на физическом уровне отмечается меньшими нарушениями, нежели на психическом. В обхвате голова может быть несколько меньших размеров, чем это предусмотрено для показателей нормы. Зубки прорезываются позже, позже ребенок начинает сидеть и ходить. Принятие положения стоя у таких малышей сопряжено с широким расставлением для этого ног, а также со сгибанием их в коленях и в тазобедренных суставах, плечи и голова при этом опущены. Что касается особенностей ходьбы у больных детей, то она характеризуется покачиваниями, шажки небольшие. Сидят дети, поджав под себя ножки, что обуславливается значительным мышечным тонусом, который они испытывают.
Отличаются детки и характерной внешностью со светлыми волосами, кожа у них абсолютно белая, без пигментации, глаза светлые. Учитывая излишнюю белизну кожи, она нередко покрывается у детей сыпью, что объясняется ее особой чувствительностью в отношении воздействия ультрафиолетового излучения.
В числе основных проявлений, свойственных фенилкетонурии, можно также выделить характерный «мышиный» запах, в некоторых случаях возможны , которые, однако, с возрастом исчезают. Выраженными проявлениями выступают синюшность конечностей, дермографизм (изменение в окраске кожи местного типа, происходящее при механическом воздействии на нее), потливость. Чаще среди больных фенилкетонурией отмечается, помимо перечисленных симптомов, наличие , частых запоров, тремор (т.е. дрожание), потеря равновесия и расстройство в виде нарушения координации движений.
Важным, как мы уже отметили, является раннее диагностирование заболевания, что позволит избежать его развития и привести к ряду необратимых и тяжелых последствий. По этой причине в родильных домах к 4-5 дням жизни (для новорожденных доношенных) берется для анализа кровь. У недоношенных детей на предмет фенилкетонурии (ФКУ) кровь берется на 7 день.
Процедура предусматривает взятие капиллярной крови по прошествии часа с момента кормления, ею в частности пропитывается специальный бланк. Концентрация, указывающая на отметку свыше 2,2% фенилаланина в крови малыша, требует направления его с родителями для осмотра в медико-генетический центр. Там же проводится дообследование и, собственно, уточнение диагноза.
Фенилкетонурия может быть спровоцирована следующими факторами:
- Близкородственные браки, при которых, помимо иных патологий, повышается вероятность рождения ребенка с этим заболеванием;
- Мутация гена (т.е. его изменение), произошедшая по тем или иным причинам в области локализации 12 хромосомы.
Сам процесс наследования гена ФКУ может носить случайный характер, что в качестве примера отражено в приведенной ниже схеме.
Единственный метод лечения заключается в своевременной организации диетотерапии, которая требуется с первых дней жизни. Заключается она в резком ограничении фенилаланина, который содержится в отдельных пищевых продуктах. Таким образом, исключаются все белковые продукты. Учитывая продолжительность и полное исключение фенилаланина из пищи, возможным становится расщепление собственных белков, что ведет к истощению организма больного. По этой причине потребность в получении белка возмещается за счет аминокислотных смесей и белковых гидролизатов.
Со сменой снижения концентрации в крови фенилаланина до нормальных показателей, в рацион постепенно добавляются продукты животного происхождения. В рацион добавляются различные фрукты и сезонные овощи, растительные и животные жиры, а также углеводы. Естественно, что контроль над содержанием фенилаланина следует продолжать вести. Организм должен быть снабжен данной аминокислотой в должном объеме для обычного развития и роста малыша, однако, за исключением возможности скапливания его в тканях.
Строжайшая диета соблюдается на протяжении, как минимум, пяти лет. Что касается возраста более взрослого, то здесь в значительной степени снижается подверженность нервной системы к воздействию, оказываемому фенилаланином, а также воздействию, оказываемому продуктами его распада. При соблюдении требуемых мер к 12-14 годам ребенок сможет свободно перейти к обычному питанию.
Примечательно, что медикаментозное лечение при данном заболевании носит синдромный характер. В него включено применение препаратов, ориентированных на устранение судорог, в том числе и препаратов, которые оказывают стимулирующее воздействие на интеллектуальную деятельность. В обязательном порядке детям назначается курс лечебной физкультуры и массажа. Дополнительно назначаются уроки, способствующие развитию логики.
Диагностирование фенилкетонурии производится педиатром и генетиком на основании специальных анализов в комплексе с общей характерной симптоматикой.
Все ли корректно в статье с медицинской точки зрения?
Ответьте только в том случае, если у вас есть подтвержденные медицинские знания
Заболевания со схожими симптомами:
Отек головного мозга – опасное состояние, характеризующееся чрезмерным скоплением экссудата в тканях органа. Как следствие, постепенно увеличивается его объем и растёт внутричерепное давление. Все это приводит к нарушению обращения крови в органе и к отмиранию его клеток.
Переутомление – состояние, с которым сегодня часто сталкиваются не только взрослые, но и дети. Оно характеризуется пониженной активностью, сонливостью, нарушением внимания и раздражительностью. Причём многие люди считают, что переутомление – несерьёзная проблема, и что достаточно хорошо отоспаться, чтобы оно прошло. На самом же деле избавиться от такого нарушения невозможно длительным сном. Все наоборот — постоянное желание спать и неспособность восстановить силы после сна – это основные симптомы переутомления.
Аденома паращитовидной железы представляет собой небольшое доброкачественное образование размером от 1 до 5 см, которое может самостоятельно синтезировать паратгормон, вызывая у человека симптомы гиперкальциемии. Паращитовидные железы располагаются на задней поверхности щитовидки, и их основное назначение заключается в продуцировании паратиреоидного гормона, принимающего участие в кальциево-фосфорном обмене в организме. Аденома приводит к тому, что паратиреоидного гормона начинает вырабатываться больше, чем необходимо, что и обуславливает симптомы этого заболевания.
Гидроцефалия, которую также принято определять в качестве водянки головного мозга, представляет собой заболевание, при котором происходит увеличение объема желудочков в головном мозге, причем зачастую – до весьма внушительных размеров. Гидроцефалия, симптомы которой проявляются по причине избыточной выработки ликвора (спинномозговой жидкости между сообщающимися желудочками мозга) и его скопления в области полостей головного мозга, преимущественно возникает у новорожденных, однако имеет это заболевание и место в заболеваемости других возрастных категорий.
Гидроцефалия (син. водянка) головного мозга у детей – это болезнь, характеризующаяся тем, что во внутренних его полостях и под мозговыми оболочками собирается чрезмерное количество ликвора, что также носит название спинномозговая жидкость. Причин формирования недуга достаточно много, причём они могут отличаться в зависимости от того, в каком возрасте сформировалась патология. Наиболее часто в качестве провоцирующих факторов выступают инфекционные и онкологические процессы, врождённые пороки развития и родовые травмы.
Фенилкетонурия — это тяжёлая наследственная болезнь. Она встречается не так часто, но о ней нужно знать родителям. Какие симптомы имеет заболевание? Как диагностируют болезнь у новорождённых? Об этом и поговорим.
Болезнь под названием фенилкетонурия (ФКУ) — это наследственная патология обмена веществ. На поздних стадиях заболевание протекает тяжело, его важно вовремя выявить, так как дефект может привести к серьёзным последствиям. Считается, что фенилкетонурия появляется у малыша тогда, когда оба родителя являются носителями дефектных генов: это наследует ребёнок, и в его организме возникает недостаток фермента, перерабатывающего фенилаланин. Аминокислота попадает в организм с пищей, она накапливается и оказывает негативное воздействие на органы и системы, в частности повреждает нервную систему. Если не предпринимать никаких мер, то у малыша разовьётся умственная отсталость. Своевременная постановка диагноза важна ещё и потому, что болезнь запускает такие процессы, которые повернуть «вспять» уже нельзя. Если вовремя определить проблему и придерживаться специальной диеты, то малыш с генетической патологией будет развиваться и расти так же, как и его сверстники.
Частота заболевания невелика. В нашей стране наследственную патологию обнаруживают у одного новорождённого из семи тысяч.
Фенилкетонурия — сложная для определения болезнь, так как выраженные симптомы дефекта генов на первых порах отсутствуют. Симптоматика проявляется после того, как ребёнок начинает употреблять белковую пищу. Сначала изменения настолько незначительны, что их тяжело заметить не только родителям, но и педиатру. Малыш становится беспокойным, что часто списывают на другие причины (например, колики, простуда, прочее). Обратите внимание на то, насколько ваш малыш активно двигается и как часто улыбается. Фенилаланин, превращаясь в токсичное вещество, снижает двигательные функции и угнетает эмоциональные реакции.
Симптомы становятся выразительными к шести месяцам. В этом возрасте задержка развития становится заметной: малыш слабо реагирует на родителей и на происходящее вокруг, он не пытается перевернуться и сесть. Так как не перерабатывающаяся аминокислота и её производные выводятся с потом и мочой, то выделения приобретают затхлый запах.
Дальше симптоматика только нарастает. В год ребёнок не умеет выражать эмоции голосом, его мимика невыразительная, он не понимает речь. Если ничего не предпринимать до трёх лет, то болезнь станет очевидной: малыш с патологией по развитию, поведению и даже по внешнему виду полностью отличается от своих сверстников.
Фенилкетонурия, несмотря на тяжесть протекания, относится к «благоприятным» наследственным заболеваниям (среди тех, что связаны с обменом веществ): если ФКУ диагностировать у новорождённых, то адаптация деток с патологией к нормальной жизни возможна. Более того, они не будут уступать в развитии сверстникам.
Для раннего выявления генного дефекта проводят скрининг-тест, то есть, специальный анализ крови. Его делают не позже, чем на пятый день жизни малыша. Скрининг-тест сегодня проводят во многих роддомах, его результаты записываются в обменную карту. При выписке из роддома проверьте, если в карте соответствующий штамп. Если скрининг-тест не проводился, вы можете обратиться в лабораторию самостоятельно. В случае подтверждения ФКУ лечение нужно начинать незамедлительно, тогда ваш малыш, несмотря на свою особенность, будет физически и умственно развиваться согласно возрастным нормам.
Фенилкетонурия — это наследственное нарушение аминокислотного обмена, которое обусловлено недостаточностью определенных ферментов в печени, которые участвуют в обмене фенилаланина до тирозина.
Проверка младенцев на заболевание проводится в роддоме. Основа лечения — коррекция рациона в виде специальной диеты.
В этой статье мы расскажем о фенилкетонурии у новорожденных и детей постарше, а также дадим клинические рекомендации по образу жизни и питанию.
Фенилкетонурия, либо болезнь Феллинга , — это врожденная патология, которая имеет генетическую природу.
Заболевание предполагает нарушение гидроксилирования фенилаланина, а также накопление аминокислоты с продуктами ее обмена в тканях и жидкостях организма с дальнейшим серьезным поражением центральной нервной системы.
Заболевание впервые было описано А. Феллингом в 1934 г. Оно достаточно редкое, встречается в одном случае на 10 000 младенцев .
Болезнь может привести к серьезным нарушениям у ребенка. Желательно выявить его до того, как проявятся симптомы.
На данный момент это очень важная задача для педиатров, неонатологов и генетиков.
Код болезни по МКБ-10 — E70 . Нарушения обмена ароматических аминокислот.
О том, что такое фенилкетонурия, расскажет видео:
Фенилкетонурия — болезнь с аутосомно-рецессивным способом наследования . Чтобы проявились ее характерные признаки, ребенку нужно унаследовать по одной дефектной копии гена от двух родителей, что являются гетерозиготными носителями гена с мутацией.
Наиболее частая причина фенилкетонурии — мутация гена, ответственного за кодировку фермента фенилаланин-4-гидроксилазы и 12 хромосомы.
В данной ситуации речь идет о классической фенилкетонурии 1 типа, на которую приходится 98% случаев болезни.
Гиперфенилаланинемия может быть от 30 мг%. Если терапия не проводится, эта форма патологии будет сопровождаться серьезной интеллектуальной отсталости.
Помимо классической формы, существуют атипичные . Они имеют аналогичную симптоматику, но не поддаются коррекции посредством диетотерапии.
Это заболевания 2 и 3 типа. Есть другие варианты, но более редкие.
Причины заболевания следующие:
- Близкородственные браки, которые кроме ряда других патологий увеличивают риск появления ребенка с данной болезнью.
- Мутация гена в районе 12 хромосомы.
Процесс наследования мутационного гена может иметь случайный характер.
В течение первых недель существования малыша выявить наличие фенилкетонурии у ребенка невозможно. Первые симптомы появляются через 2-6 месяцев после рождения.
Малыш становится вялым, не заинтересован в том, что его окружает, возникает беспокойство, нарушения мышечного тонуса. Возникают судороги, рвота, тяжелые экземы на коже.
Под экземами также поднимаются острые или хронические формы воспалений, не являющихся заразными и провоцирующими сыпь.
Заболевание имеет аллергический характер. Его проявления — жжение и сильный зуд кожи. Часто проявляются рецидивы.
Шестой месяц жизни дает возможность выявить у ребенка отставание в развитии . У больного теряется способность фокусировать взгляд на конкретных предметах, ребенок может перестать узнавать родителей, реагировать на предметы ярких цветов.
Важно как можно раньше начать лечение, иначе отсталость будет проявляться все сильнее.
На физическом уровне отсталость проявляется меньше, чем на психическом. Габариты головы могут быть меньше нормы. Зубы начинают резаться позже нормы.
Когда такие малыши стоят, они широко расставляют ноги, сгибают их в коленях и тазобедренных суставах, опускают плечи и голову.
При ходьбе больные дети покачиваются, делают маленькие шажки. При сидении они поджимают под себя ножки, что связано с серьезным мышечным тонусом, которому он подвергается.
У больных фенилкетонурией детей имеются определенные особенности внешности . Они имеют белую кожу, лишенную пигментации, светлые волосы и глаза.
Кожа часто покрывается сыпью, поскольку она имеет высокую чувствительность к лучам ультрафиолета.
Из основных проявления заболевания — так называемый «мышиный» запах . Могут проявляться эпилептические припадки, которые пропадают по мере роста.
Также заболевание проявляется синюшностью конечностей, повышенной потливостью, дермографизмом (изменение цвета кожи местного типа при определенном действии на нее).
Другие признаки — дерматит, сниженное артериальное давление, частые запоры, дрожание конечностей, нарушение равновесия и координации движений.
Диагностика фенилкетонурии является составляющей программы неонатального скрининга и проводится у всех новорожденных еще в роддоме.
Делается это на 3-5 жизни ребенка (на 7 день, если он родится недоношенным) с помощью забора образца капиллярной крови на предназначенный для этого бланк.
Если обнаруживается гиперфенилаланемия больше 2,2 мг%, проводится полное обследование у детского генетика.
Чтобы подтвердить диагноз, выполняется проверка концентрации в крови фенилаланина и тирозина, определяется активность ферментов печени, делается биохимические исследование мочи.
Дополнительно делается МРТ головного мозга и ЭЭГ, показан осмотр ребенка у детского невролога.
В некоторых случаях генетический дефект обнаруживается еще при беременности на этапе пренатальной инвазивной диагностики будущего ребенка.
Дифференциальный диагноз — при внутричерепных родовых травмах, внутриутробных инфекциях, иных нарушениях метаболизма аминокислот.
Главный и практически единственный метод терапии патологии — соблюдение диеты с ограниченным поступлением в организм белка.
Грудным детям показаны специальные смеси — это Лофенилак и Афенилак, детям старше 1 года — Тетрафен, Фенил-фри, деткам от 8 лет — Максамум-ХР.
Диета базируется на низкобелковых продуктах, белковых гидролизатах и смесях аминокислот . Она может быть расширена по достижении совершеннолетия ввиду повышения толерантности к фенилаланину.
По закону обеспечение людей с фенилкетонурией лечебным питанием бесплатное.
Пациентам могут быть показаны минеральные соединения, витамины группы В, по показаниям — антиконвульсанты и ноотропные препараты.
В комплексном лечении может использоваться ЛФК, массаж, некоторые методы физиотерапии.
Страдающих фенилкетонурией детей должен наблюдать участковый педиатр и психоневролог . Иногда нужен логопед и дефектолог.
Важны мониторинг нервно-психического состояния, контроль фенилаланина в крови и показателей электроэнцефалограммы.
Атипичные формы заболевания, которые не поддаются лечению диетой, предполагают назначение гепатопротекторов, противосудорожных препаратов, заместительную терапию леводопой и 5-гидрокситриптофаном.
Основной метод терапии — это диета, которая нужна с первых дней жизни . Она предполагает резкое ограничение фенилаланина, содержащегося в некоторых продуктах.
Исключается белковая пища. Чтобы предупредить истощение организма, используются аминокислотные смеси, белковые гидролизаты.
По мере снижения в крови фенилаланина до нормальных показателей рацион дополняется продуктами животного происхождения. В питание включают фрукты, овощи, углеводы, животные и растительные жиры.
О продуктах для больного фенилкетонурией:
- Разрешены картофель, растительные масла, чай, сахар, фрукты овощи.
- В небольших количествах можно употреблять мед, сливочное масло, хлеб, рис.
- Исключается мясо, рыба, молоко, молочная продукция, яйца, бобовые, макароны, орехи, шоколад.
Строгая диета продолжается не менее пяти лет . Если все делается правильно, то обычно к 12-14 годам ребенок может переходить на обычное питание. Но важен постоянный контроль фенилаланина.
Осложнения заболевания в основном касаются центральной нервной системы . Ввиду расстройств жирового и белкового обмена снижается интеллект, в сложных ситуациях возможна идиотия.
Прогрессирующая форма при отсутствии лечения может стать причиной летального исхода.
Самые тяжелые последствия фенилкетонурии — поражение мозга, провоцирующее задержки в развитии: физическом — в меньшей мере, психическом — в большей.
Чтобы предупредить негативные последствия, нужно работать с медицинскими специалистами.
Поскольку новорожденным проводится массовый скрининг на фенилкетонурию , выявить заболевание удается на ранней стадии, своевременно организовать диетотерапию и предупредить серьезные церебральные нарушения, нарушения работы печени.
При классической фенилкетонурии и своевременном назначении диеты прогноз развития для ребенка благоприятный.
Неблагоприятен он, если лечение началось несвоевременно. Тогда возможно серьезное нарушение умственного развития.
Поскольку заболевание генетическое, профилактика его невозможна . Для профилактики же осложнений болезни используется массовый скрининг, назначается лечение с длительным соблюдением диеты.
С целью оценки вероятности появления на свет ребенка с фенилкетонурией семьи, у которых уже есть больной ребенок, и они находятся в кровнородственном браке или имеют родственников с данной болезнью, должны предварительно пройти консультацию генетика.
Женщины с фенилкетонурией, желающие стать матерями , до и после зачатия должны соблюдать специальную диету, которая исключит повышение уровня фенилаланина с его метаболитами, предотвратит нарушения развития у плода, являющегося генетически здоровым.
Риски появления на свет больного ребенка у родителей, являющихся носителями дефектного гена — один к четырем.
Фенилкетонурия — редкое, но достаточно опасное заболевание . Если ребенок болен им, важно своевременно начать терапию, организовать для него диету. Тогда прогноз может быть благоприятным.
Эта болезнь характеризуется дефицитом печеночного фермента фенилаланин гидроксилазы (другое название которого фенилаланин-4-монооксигеназы). Этот фермент катализирует превращение аминокислоты фенилаланина («Phe) на тирозин. При дефиците фенилаланин гидроксилазы, фенилаланин не расщепляется, а накапливается и превращается в фенилпировиноградную кислоту, которая, при этом заболевании обнаруживается в моче.
С момента первого описания заболевания появилось много новых методов лечения и сегодня болезнь можно контролировать практически без возникновения каких либо побочных эффектов и неудобств, связанных с лечением. Однако, если расстройство не лечить , то его прогрессирования может привести к возникновению различных проблем, особенно с нервной системой и мозгом в частности, что в свою очередь ведет к умственной отсталости, повреждению головного мозга и вызывает появление эпилептических припадков.
Ранее, лечение ФКУ осуществлялось путем ограничения употребления фенилаланина. Однако, согласно последним исследованиям, только диетического питания может быть недостаточно, для преодоления всех негативных последствий заболевания. Оптимальное лечение заключается в снижении уровня фенилаланина до безопасного уровня и включает постоянный контроль за питанием, и когнитивным развитием. Снижение уровня фенилаланина может быть достигнуто за счет комбинированного применения продуктов с низким содержанием фенилаланина и белковых добавок. На современном этапе нет никаких эффективных лекарств от этого заболевания, однако существуют определенные препараты, предназначенные для устранения симптомов, но положительное влияние от их использования является индивидуальным в каждом отдельном случае.
Обычно фенилкетонурию определяют в процессе и при генетических исследованиях. Специализированные клиники для больных фенилкетонурией существуют во всем мире, именно в них обеспечивается постоянный уход за больными, контролируется уровень фенилаланина, умственное развитие пациентов и обеспечивается оптимальное питание.
История
Впервые фенилкетонурия была обнаружена норвежским врачом Иваром Асбьорн Феллингом (Ivar Asbjørn Følling) в 1934 году, когда он заметил, что гиперфенилаланинемия (HPA) вызывает задержку психического развития. В Норвегии, фенилкетонурия, известная под названием болезнь Феллинга. Д-р. Феллинг был одним из первых врачей, которые начал применять детальный химический анализ при изучении заболевания. Его осторожность и точность при проведении анализа мочи больных брата и сестры, привели к тому, что многие другие врачи (которые работали неподалеку от Осло), стали обращаться к нему с просьбой проанализировать состав мочи их пациентов. При проведении этих исследований, он обнаружил в моче восьми пациентов одно и то же вещество. Для анализа найденного вещества необходимым было проведение более основательного исследования и элементарного химического анализа. Проведя различные опыты, Феллинг выявил наличие реакций, характерных для бензальдегида и бензойной кислоты, что позволило ему предположить, что исследуемое вещество содержит бензольное кольцо. Дальнейшая проверка показала, что температура плавления исследуемого вещества — такая же как у фенилпировиноградной кислоты, что указывало именно на ее наличие в моче. Так, тщательные исследования этого ученого вдохновили многих других исследователей проводить аналогичные детальные исследования при изучении других расстройств.
Скрининг, признаки и симптомы
Обычно, для выявления ФКУ используют высокоэффективную жидкостную хроматографию (HPLC ), но в некоторых клиниках еще используют тест Гатри (который ранее применялся в рамках национальной программы биохимического скрининга). В развитых странах исследования на ФКУ проводят детям, сразу после рождения.
Если ребенок не проходит обычной процедуры , которая обычно выполняется на 6 -14 день после рождения (с использованием образцов крови, полученных из пятки новорожденного ребенка), то первыми проявлениями заболевания могут быть приступы судорог, альбинизм (очень светлые волосы и кожа), «заплесневелый запах» детского пота и мочи (возникает из-за наличия фенилацетата, одного из кетонов, образующихся). Для подтверждения или опровержения диагноза, в возрасте 2 недель, необходимо осуществить повторное исследование.
У новорожденных, больных фенилкетонурией, при рождении нет никаких видимых отклонений, но при отсутствии надлежащего лечения с самого начала, они не развиваются должным образом, кроме того, у них наблюдается и прогрессивное ухудшение мозговой деятельности (и, соответственно, развития). В дальнейшем основными клиническими признаками являются: гиперактивность, отклонения на электроэнцефалограмме (ЭЭГ), эпилептические припадки и трудности при обучении. Запах кожи, волос, пота и мочи (через накопление фенилацетату) — напоминает мышиный (затхлый) запах. Кроме того, у многих больных наблюдается гипопигментация и часто возникает экзема.
У тех детей, у которых заболевание было выявлено, а лечение было начато сразу после рождения, вероятность развития неврологических проблем, умственной отсталости или появления приступов судорог значительно ниже. Хотя иногда, такие клинические нарушения также могут возникать.
Патофизиология
Классическая ФКУ , как правило, возникает в связи с , кодирующего фермент фенилаланин гидроксилазы (PAH). Этот фермент обеспечивает превращение аминокислоты фенилаланина в другие важные для организма соединения. Однако, фенилкетонурия может возникнуть и вследствие других мутаций, которые не связаны с геном PAH. Это является примером неалельной генетической гетерогенности.
Классическая ФКУ
Ген PAH находится на 12 (его 12q22-q24.1). Известно более 400 мутаций этого гена, которые вызывают появление различных заболеваний. Нарушение деятельности PAH является одной из основных причин для целого спектра заболеваний, включая классическую фенилкетонурию (ФКУ) и гиперфенилаланинемию (менее тяжелое заболевание, обусловленное накоплением фенилаланина).
ФКУ — это аутосомно-рецессивное генетическое расстройство. Это означает, что для того, чтобы ребенок унаследовал заболевание ей необходимо, унаследовать по одной мутированой копии гена от каждого из родителей. То есть родители, должны быть носителями этих дефектных генов. Однако, если только один из родителей является носителем, а у другого обе копии гена — нормальные, вероятно, что ребенок может родиться полностью здоровой.
Фенилкетонурия может возникать и у мышей, которые широко используются при исследованиях разнообразных препаратов для лечения ФКУ. Недавно было установлено последовательность генома макаки,при исследовании которой ученые обнаружили, что ген, кодирующий фенилаланин гидроксилазы имеет ту же последовательность, что и ген, который у людей отвечает за возникновение ФКУ.
Гиперфенилаланинемия, которая связана с дефицитом тетрагидробиоптерину
Любопытно, что еще одна форма гиперфенилаланемии, которая встречается очень редко и возникает когда, ген PAH функционирует нормально, но есть определенные недостатки в процессах биосинтеза или рециркуляции кофактора тетрагидробиоптерину (BH4). Этот кофактор необходим в организме для нормального функционирования фермента фенилаланин-4-монооксигеназы. Для лечения этого нарушения возможно использование коэнзима, который называется биоптерин.
Для того чтобы установить различия между двумя выше описанными расстройствами необходимо определить уровень дофамина в организме. Как уже было отмечено, тетрагидробиоптерин необходим для превращения фенилаланина в тирозин, однако помимо этого он играет очень важную роль при преобразовании тирозина в дигидроксифенилаланин (сокращение допа, который катализируется ферментом тирозин гидроскилазой), которий в свою очередь является предшественником дофамина. Если в организме низкий уровень дофамина, то уровень пролактина — растет. Именно такой процесс характерен для гиперфенилаланинемия, связанной с дефицитом тетрагидробиоптерину, тогда как при классической ФКУ, уровень пролактина остается нормальным. Дефицит тетрагидробиоптерину может быть вызван мутациями в четырех разных генах. Согласно названия которых, именуются типы заболевания. Это: HPABH4A, HPABH4B, HPABH4C и HPABH4D.
Метаболический путь
Обычно, фермент фенилаланин гидроксилаза участвует в превращении аминокислоты фенилаланина в аминокислоту тирозин. Если этого преобразования не происходит, то фенилаланин накапливается в организме и, соответственно, возникает дефицит тирозина. Чрезмерное количество фенилаланина может быстро разлагаться на фенил-кетоны в процессе трансаминирования глутамата. Метаболитами, которые образуются при этой реакции, являются: фенилуксусной кислота, фенилпировиноградная кислота и фенилэтиламин. Именно поэтому для правильной диагностики фенилкетонурии, необходимо определить уровень фенилаланина в крови, если же он повышен, а в моче имеющиеся фенилкетоны, то диагноз ясен.
Фенилаланин — это большая, нейтральная аминокислота (LNAA). Эти аминокислоты «конкурируют» между собой за транспортировку через гематоэнцефалический барьер (ГЭБ) с помощью системы активного транспорта больших нейтральных аминокислот (нейтрального транспортера) (large neutral amino acid transporter, LNAAT). Повышенный уровень фенилаланина в крови, соответственно, увеличивает количество его в транспортере. Что, в свою очередь, приводит к тому, что уровень других нейтральных крупных аминокислот в мозге — снижается. Но, как известно, все эти аминокислоты необходимы для синтеза белков и нейротрансмиттеров (нейромедиаторов), именно поэтому, накопление фенилаланина нарушает процесс развития мозга, вызывая умственную отсталость.
Лечение
Если ФКУ обнаружили у ребенка сразу после рождения, то это лицо, может расти и развиваться вполне нормально, однако это возможно только в случае постоянного контроля за уровнем фенилаланина (Phe) и поддержанием его в пределах допустимых норм. Этот процесс осуществляется с помощью особой диеты, или же путем сочетания диетического питания и употребления медицинских препаратов. Как было сказано выше, когда фенилаланин не усваивается нормально организмом, то его накопление в крови токсично для мозга. Если ФКУ не лечить, то заболевание может вызвать появление следующих осложнений: тяжелую умственную отсталость, нарушение функций мозга, микроцефалию, частые смены настроения, нарушение функций моторно-двигательного аппарата и такие неврологические расстройства поведения, как СДВГ ( синдром дефицита внимания и гиперактивности ).
Все больные ФКУ должны придерживаться специальной диеты, при которой ограничивается употребление фенилаланина, по крайней мере первые 16 лет их жизни. Из рациона следует исключить (или ограничить употребление) продуктов, которые содержат высокий уровень фенилаланина, в основном это: мясо, курица, рыба, яйца, орехи, сыр, бобовые, коровье молоко и другие молочные продукты. Употребление продуктов с высоким уровнем крахмала, таких как картофель, хлеб, макаронные изделия, кукуруза, тоже должно контролироваться. Маленькие дети могут продолжать употреблять грудное молоко (для получения всех полезных веществ и преимущества от грудного питания), однако его количество нужно контролировать и, кроме того, ребенку необходимо обеспечить поступление в организм всех отсутствующих питательных веществ, с помощью разнообразных пищевых добавок. Стоит отметить, что употребление многих диетических продуктов питания и диетических напитков, содержащих подсластитель аспартам, тоже следует избегать, ведь аспартам состоит из двух аминокислот: фенилаланина и аспарагиновой кислоты.
Новорожденным детям следует вводить в рацион специальные пищевые добавки , которые позволяют обеспечить организм необходимыми аминокислотами и другими питательными веществами, которые при низко-фенилаланиновой диете не попадают в организм с продуктами питания. Когда ребенок подрастает, то эти специальные добавки могут быть заменены таблетками и специально разработанным рационом, в котором будут учитываться все особенности больного.
Поскольку фенилаланин необходим для синтеза многих белков, то он, бесспорно, нужен в организме, для того, чтобы обеспечить полноценное развитие человека, однако его уровень (у больных ФКУ) необходимо тщательно контролировать. Особое внимание следует обратить на добавки, содержащие тирозин, ведь именно эта аминокислота является производной от фенилаланина.
Пероральное применение тетрагидроптерину (или BH4) (который является кофактором для окисления фенилаланина) у некоторых пациентов может уменьшить уровень этой аминокислоты в крови. Фармацевтическая компания BioMarin Pharmaceutical выпустила препарат, действующим веществом в котором есть сапроптерин дигидрохлорид (Kuvan), который является одной из форм тетрагидроптерину.
Kuvan — это первый препарат, который может обеспечить организм BH4 у больных фенилкетонурией (согласно подсчетам врачей — это около половины всех больных ФКУ), что приведет к снижению уровня фенилаланина до рекомендуемой границы. При сотрудничестве с диетологом, некоторые лица, больные фенилкетонурией (те, организм которых реагирует на лечение Kuvan) могут увеличить уровень различных природных белков в своем рационе. После больших клинических исследований, Kuvan был одобрен FDA для использования при лечении ФКУ. Некоторые исследователи и врачи, работающие с больными фенилкетонурией считают Kuvan безопасным и эффективным дополнением к диетическому питанию и, соответственно, полезным для пациентов с ФКУ.
На сегодня, другие методы лечения ФКУ еще исследуются, в том числе , замещение больших нейтральных аминокислот и соответствующих ферментов фенилаланина аммиак лиазою (PAL). Ранее, больным ФКУ разрешалось питаться без ограничений через 8 лет, позже, через 18 лет. Однако, сегодня большинство врачей рекомендуют больным ФКУ придерживаться диетического питания и контролировать уровень фенилаланина в организме на протяжении всей жизни.
Фенилкетонурия и материнство
Для беременных женщин, больных ФКУ, очень важно удерживать низкий уровень фенилаланина до и во время всей беременности, для того, чтобы ребенок был здоровым. И хотя, развивающийся плод может быть только носителем гена ФКУ, однако внутриутробная среда может иметь очень высокий уровень фенилаланина, который обладает способностью проникать через плаценту. Как следствие, у ребенка может развиваться врожденный порок сердца, возможна задержка развития, микроцефалия и умственная отсталость. Как правило, у больных фенилкетонурией женщин никаких осложнений во время беременности не возникает.
В большинстве стран, женщинам с ФКУ, которые планируют заводить детей, рекомендуется снизить уровень фенилаланина (как правило до 2-6 мкмоль / л), еще до беременности и контролировать его на протяжении всего периода вынашивания ребенка. Это достигается путем проведения регулярных анализов крови и соблюдения строгой диеты, и постоянным наблюдением врача-диетолога. Во многих случаях, как только печень плода начинает нормально производить PAH, уровень фенилаланина в крови матери падает, соответсвенно «необходимо» увеличить его, для удержания безопасного уровня — 2-6 мкмоль / л. Именно поэтому, ежедневное количество потребленного матерью фенилаланина может удвоиться или даже утроиться к концу беременности. Если же уровень фенилаланина в крови матери ниже 2 мкмоль / л, то иногда, у женщин могут возникать различные осложнения, связанные с дефицитом этой аминокислоты, такие как головная боль, тошнота, выпадение волос и общее недомогание. Если низкий уровень фенилаланина у больных ФКУ поддерживается в течение всей беременности, то риск родить больного ребенка не выше, чем у тех женщин, которые не больны ФКУ.
Дети с ФКУ могут питаться грудным молоко в сочетании с их специальными метаболическими добавками. Согласно результатам исследований, питание новорожденных, (больных ФКУ) только грудным молоком может изменить (облегчить) последствия дефицита нужных веществ, но только в том случае, когда во время кормления грудью мать придерживается строгой диеты, для удержания низкого уровня фенилаланина в организме. Однако для подтверждения этих данных, необходимы дополнительные исследования.
В июне 2010 года, американские ученые заявили, что они будут проводить детальное исследование для выявления мутаций генов в . Их основной задачей является изучение природы фенилкетонурии, которая на сегодня, встречается все чаще. Распространение заболевания связано также с тем, что больные ФКУ часто живут более 60 лет и, соответственно, часто рожают детей, которые тоже могут быть поражены этой болезнью, или быть ее носителями.
Фенилкетонурия встречается примерно у 1 человека на 15000 новорожденных. Но частота заболеваемости в разных популяций — отличается. Так, 1 больной ребенок среди 4500 новорожденных среди населения Ирландии, в Норвегии это соотношение составляет 1:13000, в Финляндии этот показатель еще ниже — менее чем одно лицо на 100.000 новорожденных. Чаще заболевание встречается в Турции , ведь им болеет каждый ребенок из 2600 рожденных. Болезнь также более распространена в Италии, Китае, и среди населения Йемена.
Фенилкетонурия (ФКУ) — редкое генетическое заболевание, связанное с нарушением обмена фенилаланина (протеиногенной аминокислоты), поступающего в организм в составе белковой пищи. Вызывает накопление в организме фенилаланина и его токсических производных, что приводит к поражению ЦНС.
| МКБ-10 | E70.0 |
|---|---|
| МКБ-9 | 270.1 |
| DiseasesDB | 9987 |
| MedlinePlus | 001166 |
| eMedicine | ped/1787 derm/712 |
| MeSH | D010661 |
| OMIM | 261600 261630 |
Фенилкетонурия известна с 1934 года, но вследствие отсутствия качественной диагностики заболевание выявлялось только на той стадии, когда в результате токсичного воздействия на головной мозг нарушения умственного развития становятся необратимыми. Именно поэтому заболевание получило второе название — фенилпировиноградная олигофрения.
По статистике нарушение обмена фенилаланина чаще наблюдается у девочек. Распространено больше в Турции, северных странах Европы (исключение – Финляндия), и крайне редко встречается у представителей негроидной расы. Поскольку фенилкетонурия относится к заболеваниям, при которых дефективный ген наследуется от обоих родителей, браки между родственниками увеличивают вероятность рождения детей, страдающих этим заболеванием.
Впервые имевшее успех лечение провели в детском госпитале Бирмингема (Англия) в 50-х гг. XX века, но по-настоящему эффективным этот метод лечения стал после внедрения в начале 60-х гг. ранней диагностики.
Фенилаланин под воздействием ферментов в организме преобразуется в тирозин – аминокислоту, которая выводится из организма. В зависимости от дефекта гена, блокирующего определенный фермент, выделяют:
- Фенилкетонурию I-го типа (классическую или тяжелую). Вызывается генной мутацией, нарушающей выработку печеночного фермента фенилаланингидроксилазы и преобразование фенилаланина в тирозин.
- Фенилкетонурию II-го типа (атипичную). Характеризуется генным дефектом, вызывающим недостаток дигидробиоптерин-редуктазы. Благодаря этому фактору нарушается восстановление активности органического соединения, необходимого для преобразования фенилаланина. Также наблюдается пониженное содержание в спинномозговой жидкости и в сыворотке крови витамина В9, необходимого для утилизации аминокислот.
- Фенилкетонурию III-го типа (атипичную). Провоцируется нехваткой катализатора, необходимого для синтеза тетрагидробиоптерина (нужен для преобразования фенилаланина в тирозин).
- Примаптеринурию — атипичную форму, которая наблюдается при легкой форме гиперфенилаланинемии. Ферментный дефект этого вида ФКУ в настоящее время не выяснен, но данная форма заболевания характеризуется значительным количеством примаптерина и его производных в моче, а количество нейромедиаторных метаболитов в спинномозговой жидкости не отклоняется от нормы.
Выделяется также материнская фенилкетонурия, наблюдающаяся у потомства женщин, больных ФКУ и не соблюдающих специализированную диету. Патогенез данной формы заболевания до конца не изучен, но отмечается, что без постоянного контроля за уровнем фенилаланина у новорожденных обнаруживается ряд патологических изменений:
- недостаточный вес мозга;
- увеличенные в размерах желудочки головного мозга (вентрикуломегалия);
- гипоплазия (недоразвитие) белого вещества и задержка миелинизации.
Фенилкетонурия данного типа вызывает хроническую интоксикацию плода и приводит к умственной отсталости ребенка.
Фенилпировиноградная олигофрения возникает при наличии патологического гена у матери и отца. Тип наследования — аутосомно-рецессивный, то есть не зависит от пола ребенка. Вероятность развития заболевания у новорожденных, родители которых являются носителями дефектного гена, составляет 25%.
В результате вызванного генным дефектом нарушения обмена фенилаланина и его последующего превращения в тирозин в организме накапливаются токсические производные этой аминокислоты (фенилпировиноградная, фенилмолочная и фенилуксусная кислоты), в норме встречающиеся в минимальном количестве. Образуются также не встречающиеся в норме ортофенилацетат и фенилэтиламин, нарушающие липидный обмен в головном мозге, что служит причиной прогрессирующего снижения интеллекта.
Факторами, влияющими на развитие патологии, являются:
- нарушения аминокислотного обмена;
- нарушения миелинизации;
- нарушение синтеза протеолипидных белков,
- пониженный уровень нейротрансмиттеров (адреналина, серотонина и др.).
Сразу после рождения у детей с ФКУ I симптомы болезни не наблюдаются, хотя обычно имеется специфический ряд внешних признаков:
- Суховатая кожа белого оттенка (почти полностью отсутствует пигментация).
- Голубые глаза.
- Волосы светлых оттенков.
В возрасте 2-х – 6-ти месяцев проявляются первые признаки заболевания:
- вялость (не делает попыток перевернуться, сесть);
- пассивное восприятие окружающего (не реагирует на мать, не отвечает улыбкой);
- повышенная раздражительность;
- задержка психомоторного развития.
Возможна интенсивная частая рвота и беспокойство, приступы судорог.
Если заболевание своевременно не выявлено и в рацион ребенка вводят белковую пищу, симптоматика начинает нарастать. У таких детей поздно прорезываются зубы, а череп несколько уменьшен в размерах. Сидеть и ходить начинают позже сверстников, мимика невыразительна, в год не способны выразить голосом эмоции, речь взрослых не понимают. Возможна задержка роста.
Поскольку фенилаланин в организме не преобразуется, он выводится с потом и мочой, поэтому от больных исходит затхлый или «мышиный» запах.
Фенилкетонурия у детей проявляется также в своеобразных позах и походке, так как мышечный тонус у таких больных повышен. В положении стоя ноги у ребенка широко расставлены и согнуты в коленях и тазобедренных суставах, голова и плечи опущены. Походка качающаяся, шаги мелкие. Сидят они в положении портного (поджимают и скрещивают ноги).
Фенилпировиноградная олигофрения после трехлетнего возраста проявляется в:
- повышенной возбудимости и утомляемости;
- нарушениях поведения;
- психотических расстройствах;
- умственной отсталости.
Часто наблюдается экзема, склеродермия и дерматит.
При отсутствии лечения состояние больных ухудшается. Своевременно поставленный диагноз и лечение позволяют предотвратить нарушения развития ребенка.
Диагностировать заболевание можно:
- полуколичественным тестом, который позволяет определить приблизительное количество фенилаланина в крови;
- количественным определением при помощи реагентов, выявляющих количество фенилаланина в высохших кровяных пятнах.
Для этого обследования в роддоме в день выписки или на 5-й день жизни у всех детей после кормления берется кровь из пятки.
Диагностика включает и исследование мочи (проба Феллинга), но оно информативно только после 10-12 дня жизни ребенка. Фенилпировиноградная кислота проявляется сине-зеленой окраской в моче при добавлении в мочу хлорида железа.
Можно также определить активность фермента фенилаланингидроксилазы в материале, полученном методом биопсии, и обнаружить мутации в гене.
Используются также такие методы, как:
- тест Гатри, основанный на добавлении крови в бактериальную культуру, быстро растущую в фенилаланиновой среде;
- тонкослойная хроматография аминокислот, содержащихся в сыворотке крови;
- флуориметрия, позволяющая выявить микродозы фенилаланина благодаря облучению ультрафиолетом.
Фенилкетонурия 2 и 3 типа диагностируется при помощи исследования биоптеринов мочи, перорального нагрузочного теста с тетрагидробиоптерином, энзиматических исследований.
Выявлять фенилкетонурию можно и с помощью генетического анализа, который обычно проводят при наличии членов семьи с данным диагнозом.
При своевременно поставленном диагнозе лечение фенилкетонурии заключается в специализированной диете, ограничивающей поступление пищи, содержащей фенилаланин. Так как все естественные источники белка содержат около 4% фенилаланина, они заменяются содержащими другие аминокислоты синтетическими продуктами. Наиболее эффективна диета, назначенная до 8-й недели жизни.
Грудным детям назначаются полностью очищенные от лактозы смеси на основе гидролизата молочного белка. Материнское молоко допустимо в ограниченном количестве.
Хотя раньше врачи рекомендовали соблюдать диету только до окончания развития головного мозга (20 лет), повышение уровня фенилаланина после прекращения диеты у многих людей вызывает психиатрические проблемы. Фенилкетонурия у взрослых проявляется недостаточностью мотивации, бессонницей и деконцентрацией, импульсивностью и т.д., поэтому диету рекомендуется соблюдать пожизненно.
Диетические ограничения, введенные после 2-х лет, способны только снизить выраженность симптомов.
Для лечения применяются также препараты:
- относящиеся к ноотропной группе (ноотропил и др.). Они стимулируют умственную деятельность и активизируют когнитивные функции;
- содержащие витамины, аминокислоты и белки («Афенилак» и т.д.).
Атипичные формы фенилкетонурии не поддаются диетотерапии и требуют дополнительного медикаментозного лечения, которое включает:
- Дигидробиоптерин, компенсирующий недостаток фолиевой кислоты;
- Леводол, действующий на ЦНС.
Пациентам, нуждающимся в дополнительной коррекции нейромедиаторов, назначают «Мадопар» или «Наком».
Взрослым назначаются растительные препараты, содержащие фенилаланингидроксилазу.
Поскольку фенилкетонурия – генетическое заболевание, полностью предотвратить его развитие нельзя. Профилактические меры направлены на предотвращение необратимых тяжелых нарушений развития мозга путем своевременной диагностики и диетотерапии.
Семьям, в которых уже были случаи данного заболевания, рекомендуется проведение генетического анализа, способного предсказать возможное развитие фенилкетонурии у ребенка.
источник