Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
Идиопатическая тромбоцитопеническая пурпура (болезнь Верльгофа) относится к геморрагическим диатезам с изменением (уменьшением) количества тромбоцитов (тромбоцитопенией).
Обычно тромбоцитопеническая пурпура впервые развивается у детей в возрасте 2-6 лет (до 10 лет), независимо от пола. У взрослых заболевание не так распространено, и страдают от него чаще женщины.
Характерным для данного заболевания является снижение числа тромбоцитов в сыворотке крови ниже уровня 100 х10 9 /л на фоне достаточного их образования в костном мозге, и наличия на поверхности тромбоцитов и в крови антител, вызывающих их разрушение.
В зависимости от длительности и цикличности течения заболевания, выделяют несколько форм тромбоцитопенической пурпуры:
1. Острая.
2. Хроническая.
3. Рецидивирующая.
Для острой формы характерно повышение уровня тромбоцитов крови более 150х10 9 /л в течение 6 месяцев со дня развития болезни, при отсутствии рецидивов (повторных случаев заболевания) впоследствии. Если восстановление уровня тромбоцитов затягивается на срок более 6 месяцев, выставляется диагноз – хроническая тромбоцитопеническая пурпура. При повторном снижении их количества ниже нормы после их восстановления, имеет место рецидивирующая тромбоцитопеническая пурпура.
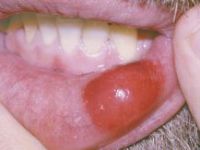
Кровоизлияния могут быть не только на слизистых ротовой полости и миндалин, но и в барабанную перепонку, стекловидное тело, склеру и глазное дно. Редко возможно кровоизлияние в головной мозг, что значительно ухудшает состояние больного. Этому предшествует появление головокружения и головной боли, а также кровотечение в других органах.
При снижении уровня тромбоцитов менее 50х10 9 /л появляются кровотечения из носа, десневые кровотечения, которые в большей степени опасны при удалении зуба. При этом кровотечение возникает сразу же, и обычно не возобновляется после его остановки. У девочек подросткового возраста с тромбоцитопенической пурпурой определенную опасность представляют маточные кровотечения при менструации.
При постановке диагноза идиопатическая тромбоцитопеническая пурпура проводится дифференциальная диагностика с различными заболеваниями крови (инфекционный мононуклеоз, лейкоз, микроангиопатическая гемолитическая анемия, системная красная волчанка, тромбоцитопения на фоне приема лекарственных препаратов и другие).
В комплекс обследования входят следующие диагностические процедуры:
- общий анализ крови с подсчетом количества тромбоцитов;
- определение в крови антитромбоцитарных антител и проба Кумбса;
- пункция костного мозга;
- определение АЧТВ, протромбинового времени, уровня фибриногена;
- биохимический анализ крови (креатинин, мочевина, АЛТ, АСТ);
- реакция Вассермана, определение в крови антител к вирусу Эпштейна-Барр, парвовирусу.
Диагноз «тромбоцитопеническая пурпура» выставляется при отсутствии клинических данных, свидетельствующих о наличии онкологических заболеваний крови и системных заболеваний. Тромбоцитопения чаще всего не сопровождается снижением эритроцитов и лейкоцитов.
У детей до 2-х лет регистрируется инфантильная форма тромбоцитопенической пурпуры. В этом случае заболевание начинается остро, без наличия предшествующей инфекции, протекает крайне тяжело: уровень тромбоцитов опускается менее 20х10 9 /л, лечение неэффективно, очень высок риск хронизации заболевания.
Клинические проявления ИТП зависят от уровня тромбоцитов. Начало заболевания характеризуется появлением пятнисто-синячковых высыпаний на коже и невыраженных кровоизлияний на слизистых оболочках. При снижении уровня тромбоцитов менее 50 х10 9 /л возможно появление различных кровотечений (носовые, желудочно-кишечные, маточные, почечные). Но чаще всего обращают на себя внимание большие «синяки» в местах ушибов, могут быть гематомы при проведении внутримышечных инъекций (уколов). Характерно увеличение селезенки. В общем анализе крови регистрируется тромбоцитопения (снижение тромбоцитов), эозинофилия (увеличение количества эозинофилов), анемия (снижение количества гемоглобина).
Если у пациента нет кровотечения из слизистых, синяки при ушибах умеренные, уровень тромбоцитов в крови не менее 35х10 9 /л, то лечение обычно не требуется. Рекомендуется избегать возможной травматизации, и отказаться от занятий контактными видами спорта (любые виды борьбы).
Лечение идиопатической тромбоцитопенической пурпуры направлено на уменьшение выработки антитромбоцитарных антител и предупреждение их связывания с тромбоцитами.
- В общей дозе — преднизолон в дозе 1-2 мг/кг в сутки на протяжении 21 дня, затем дозу постепенно снижают до полной отмены. Возможен повторный курс через месяц.
- В высоких дозах – преднизолон в дозе 4-8 мг/кг в сутки принимают неделю, или метилпреднизолон в дозе 10-30 мг/кг в сутки, с быстрой последующей отменой препарата, повторный курс проводят через 1 неделю.
- «Пульс-терапия» гидрокортизоном — 0,5 мг/кг в сутки, принимают 4 дня через 28 дней (курс составляет 6 циклов).
Метилпреднизолон вводят внутривенно — 10-30 мг/кг в сутки, от 3 до 7 дней при тяжелом течении заболевания.
При длительном приеме и индивидуально у каждого пациента могут проявляться побочные эффекты от приема глюкокортикоидов: увеличение уровня глюкозы крови и снижение уровня калия, язва желудка, снижение иммунитета, увеличение артериального давления, задержка роста.
2.Иммуноглобулины для внутривенного введения:
- Иммуноглобулин нормальный человека для в/в введения;
- Интраглобин Ф;
- Октагам;
- Сандоглобулин;
- Веноглобулин и др.
При острой форме иммуноглобулины назначаются в дозе 1 г/кг в сутки на 1 или 2 дня. При хронической форме в последующем назначают единичное ведение препарата для поддержания необходимого уровня тромбоцитов.
На фоне применения иммуноглобулинов возможно появление головной боли, аллергической реакции, повышение температуры тела до высоких цифр и озноб. Для уменьшения степени выраженности нежелательных эффектов назначают Парацетамол и Димедрол внутрь, и Дексаметазон внутривенно.
3. Интерферон альфа.
Показан при хронической форме пурпуры в случае неэффективности лечения глюкокортикоидами. Под кожу или в мышцу вводят 2х106 ЕД интерферона-альфа на протяжении месяца 3 раза в неделю, через день.
Нередко во время лечения интерфероном появляются симптомы, схожие с гриппом (повышение температуры тела и озноб, боль в мышцах, головная боль), признаки токсического влияния на печень, у подростков могут быть симптомы депрессии. Применение парацетамола до начала лечения помогает уменьшить выраженность симптомов, свойственных гриппу.
4. Алкалоиды розового барвинка.
Винкристин и Винбластин вводятся в течение месяца, 1 раз в неделю.
Необходимо помнить о возможности появления некрозов тканей при введении алкалоидов розового барвинка подкожно. Возможно нарушение нервной проводимости, появление очагов облысения (алопеции).
5. Даназол.
Применяют препарат через рот, в дозе 10-20 мг/кг в сутки. Необходимо разделить дозу на 3 приема, курс составляет 3 месяца.
Проявляет токсическое влияние на печень, возможно увеличение веса на фоне лечения, появление излишнего оволосения (гирсутизм).
6. Циклофосфан.
Назначается через ротг, в дозе 1-2 мг/кг в сутки. Лечебный эффект проявляется через 7-10 дней.
Как и Даназол, этот препарат токсичен для клеток печени, может привести к увеличению веса и алопеции. У некоторых пациентов вызывает геморрагический цистит.
7. Азатиоприн.
Принимают по 200-400 мг в сутки, на протяжении от 3 месяцев до полугода, после окончания лечения необходима поддерживающая терапия.
На фоне приема препарата больных беспокоит тошнота, снижение аппетита, рвота.
Автор: Пашков М.К. Координатор проекта по контенту.
источник
ТРОМБОЦИТОПЕНИЧЕСКАЯ ПУРПУРА У ДЕТЕЙ
Тромбоцитопения (ТП) – уменьшение количества тромбоцитов в единице объема крови, обусловленное их повышенным разрушением, повышенным потреблением или недостаточным образованием в костном мозге (КМ).
Наиболее частой причиной ТП является повышенное разрушение тромбоцитов, наибольший же удельный вес в группе ТП, связанных с разрушением тромбоцитов, имеют иммунные ТП: аутоиммунные (идиопатическая тромбоцитопеническая пурпура), аллоиммунные (с выработкой антител матери против антигенов плода), изоиммунные (с выработкой антител матери с тромоастенией Гланцмана против антигенов тромбоцитов плода).
Наиболее распространенной и известной иммунной ТП является идиопатическая тромбоцитопеническая пурпура (ИТП). По современному определению, ИТП (первичная аутоиммунная ИТП, болезнь Верльгофа) – аутоиммунное заболевание, характеризующееся изолированной ТП (менее 150 тыс. в 1 мкл) без выраженных анемии и лейкопении, при нормальном или повышенном числе мегакариоцитов КМ (исключение – тяжелые формы со снижением числа мегакариоцитов), присутствием на поверхности тромбоцитов и в сыворотке крови больных антитромбоцитарных антител, вызывающих повышенную деструкцию тромбоцитов, с преждевременным их разрушением макрофагально-моноцитарной системой. Заболевание проявляется кожно-геморрагическим синдромом (петехии, пурпура, экхимозы) и различными кровотечениями из слизистых оболочек. Шифр D 69.3 (МКБ-10).
Распространенность. ИТП наиболее часто (40%) является причиной геморрагического синдрома в гематологической практике, самым частым геморрагическим диатезом.
Частота возникновения новых случаев – от 10 до 125 на 1 млн. взрослого и детского населения (3-8 на 100.000 детей в год). Преобладающий возраст поражения – до 14 лет. Острая ИТП преобладает у детей до 10 лет (мальчики и девочки болеют одинаково часто), хроническая ИТП – у детей-подростков (в преобладанием, в 2-3 раза, девочек).
Этиопатогенез. По современным представлениям, ИТП – наследственно обусловленное заболевание, при котором по аутосомно-доминантному типу передается качественная неполноценность тромбоцитов, в патогенезе основную роль играет срыв иммунологической толерантности к собственным антигенам (АГ) тромбоцитов.
В 1951 г. Харрингтон впервые доказал наличие циркулирующего тромбоцитопенического комплекса, перелив себе плазму от больного ИТП, причем количество тромбоцитов у реципиента при этом снизилось.
Иммунологическая толерантность – отсутствие иммунного ответа организма на собственные АГ организма, она закладывается в эмбриональном периоде и дает возможность отличить «свое» от «чужого».
Главным звеном в системе узнавания является наличие на всех ядросодержащих клетках организма АГ главного комплекса гистосовместимости (MHC-HLA-комплекса), именно его молекулы представляют распознающим чужие клетки Т-лимфоцитам эндогенные аутоантигены.
Нарушение процесса узнавания запускает каскад реакций, ведущих к уничтожению клеток с «чужеродным АГ» антителами (АТ) В-лимфоцитов.
Аутоиммунизацию к собственным тромбоцитам вызывают факторы, следствием действия которых служит срыв иммунной системы: инфекции (вирусные, реже бактериальные), профилактические прививки, психические и физические травмы, переохлаждение, интоксикация, радиация, медикаменты.
В современных условиях наиболее частым провокатором ИТП у детей являются вирусы (корь, эпидемический паротит, краснуха, гепатит А, ВИЧ): они могут непосредственно воздействовать на КМ (с разрушением мегакариоцитов) и вызывать аутоиммунный ответ вследствие молекулярной мимикрии между вирусами и тромбоцитами (сходства участков комплекса гистосовместимости тромбоцитов и генома вирусов) с продукцией АТ и против вирусов, и против тромбоцитов.
При ИТП развивается иммунная реакция гиперчувствительности цитотоксического (II) типа: она играет важную роль в системе иммунитета, когда в качестве АГ выступают чужеродные для организма клетки (микробы, простейшие, глисты, опухолевые, стареющие) и становится патогенной, когда нормальные клетки организма (тромбоциты) приобретают аутоантигенные свойства.
Повреждающий фактор (вирус, медикамент) при соединении с мембраной тромбоцита придает ему свойства аутоантигена с запуском В-зависимой иммунной реакции и выработкой аутоантител (иммуноглобулинов G или М). Кроме того, известно, что альфа-гранулы тромбоцитов содержат иммуноглобулины G – при ИТП содержание последних на поверхности тромбоцита резко превышает его внутреннее содержание, а также в 200 раз выше такового на поверхности тромбоцитов здорового человека. Именно иммуноглобулин G является основным антитромбоцитарным АТ (92%). При острой ИТП на поверхности тромбоцитов содержится также иммуноглобулин М, что связано с предшествующей вирусной инфекцией. На фоне успешного лечения содержание иммуноглобулина G на поверхности тромбоцитов снижается.
Антитромбоцитарные аутоантитела при ИТП направлены к различным гликопротеинам (ГП) мембраны тромбоцитов: ГП V (обычно у таких детей развивается спонтанная ремиссия), ГП Ib, ГП IIb – IIIa (высокий титр типичен для хронической ИТП).
На ранних стадиях развития ИТП происходит деструкция тромбоцитов, покрытых аутоантителами, системой фагоцитирующих мононуклеаров селезенки, печени, КМ. Далее фрагменты разрушенных тромбоцитов взаимодействуют со свободными аутоантителами и образуют циркулирующие иммунокомплексы (ЦИК), в свою очередь, оседающие на мембранах новых тромбоцитов, активизируя комплемент и вызывая их деструкцию клетками РЭС. Таким образом, развивается цепная иммунологическая реакция с уменьшением продолжительности жизни тромбоцитов.
Помимо тромбоцитопении, при ИТП развивается и тромбоцитопатия – антитромбоцитарные АТ взаимодействуют с рецепторами мембран тромбоцитов, отвечающих за взаимодействие последних друг с другом, матриксом сосудистой стенки и гуморальными активаторами тромбоцитарного генеза – все это ведет к нарушению адгезии и агрегации тромбоцитов.
Роль комплемента: если через С3В-фракцию комплемента активизируются макрофаги и прикрепляются к мембране тромбоцитов, они фагоцитируются в клетках РЭС, если же С3В-фракция комплемента непосредственно взаимодействует с мембраной тромбоцита без участия макрофага, происходит внутрисосудистая его деструкция, характерная для очень тяжелого течения ИТП.
Роль селезенки: в ответ на образование аутоантигена селезенка начинает вырабатывать аутоантитела (иммуноглобулины G и М), в 5 раз выше, чем у здорового человека. Кроме того, селезенка является местом деструкции нагруженных аутоантителами тромбоцитов (наряду с печенью и КМ) с преждевременной гибелью последних (при ИТП продолжительность жизни тромбоцитов 8-24 часа при норме 6-10 дней).
Состояние костного мозга: в ответ на ТП повышается синтез поэтинов с повышением тромбоцитопоэза, однако быстрота отшнуровки тромбоцитов и выход их в кровь не компенсирует их быстрой гибели под воздействием аутоантител, несмотря на гиперплазию мегакариоцитов. При тяжелом течении ИТП процесс формирования и освобождения тромбоцитов нарушается, так как антитромбоцитарные АТ при повышенном их количестве могут реагировать и с мембранами мегакариоцитов и разрушать последние.
Состояние сосудистой стенки: из-за нарушения ангиотрофической функции тромбоцитов-«кормильцев» и снижения содержания тромбоцитарного фактора роста (стимулирует синтез ДНК и пролиферацию эндотелия) идет дистрофизация эндотелия. Кроме того, из-за общности антигенных структур тромбоцитов и эндотелия антитромбоцитарные АТ разрушают и эндотелий, что усиливает геморрагический синдром.
Состояние плазменного гемостаза: страдает вторично в связи со снижением темпа образования активного тромбопластина и повышения фибринолиза.
По современным представлениям, можно предположить следующую концепцию развития ИТП:
Наследственная функциональная неполноценность тромбоцитов (дефект GP IIb/IIIa, GP Ib/IX, GP V, GMP –140) |
| Дизрегуляторные изменения иммуннной системы (пролиферация, активация Т- и В-клеток (↑CD3, CD4, CD19, CD3DR, CD8DR, ↓CD8) |
| Образование аутоантител к «мажорным» антигенам тромбоцитов (GP IIb/IIIa, GP Ib/IX, GP V, GMP –140) |
| Идиопатическая тромбоцитопеническая пурпура (повышенная деструкция сенсибилизированных тромбоцитов в РЭС |
Классификация. По течению различают острое (менее 6 месяцев) и хроническое (более 6 месяцев) – с частыми рецидивами, редкими рецидивами или непрерывно-рецидивирующее.
По тяжести различают легкую («сухую» пурпуру) форму с изолированными кожными проявлениями и среднетяжелую и тяжелую формы («влажную» пурпуру) с присоединением кровотечений из слизистых оболочек.
По периоду заболевания выделяют период криза (обострения), клинической ремиссии (отсутствие кровоточивости при сохраняющейся тромбоцитопении) и клинико-гематологической ремиссии.
Среди осложнений ИТП выделяют маточное кровотечение, постгеморрагическую анемию, постгеморрагическую энцефалопатию и т.д.
Клиническая картина. Острое течение ИТП чаще встречается у детей. Пик заболеваемости приходится на возраст 2-8 лет. Мальчики и девочки болеют одинаково часто, в пубертатном периоде девочки болеют в 2 раза чаще. Сезонность – весна.
Обычно за 2-4 недели до появления ИТП дети переносят ОРВИ или вакцинируются (80-90% случаев), после чего внезапно развивается геморрагический синдром (после скрытого периода формирования аутоиммунного ответа).
Выраженность клинических проявлений определяется степенью ТП: геморрагии появляются при уровне тромбоцитов менее 100 тыс. в 1 мкл, кровоточивость – менее 50 тыс. в 1 мкл, угроза серьезных кровотечений – менее 30 тыс. в 1 мкл.
Начало острое, с геморрагического синдрома (геморрагическая сыпь на коже и слизистых + кровоточивость), возможно повышение температуры тела до субфебрильных цифр. Состояние больного часто существенно не меняется.
Геморрагическая сыпь при ИТП – петехиально-экхимозная (синячковая), в тяжелых случаях кровоподтеки распространены по всему телу. Главным образом, геморрагии наблюдаются на коже над местами, где создается давление (область таза и грудной клетки) и в областях наибольшей травматизации (голени, лодыжки, локти). Мелкие петехии появляются в местах наименьшего натяжения кожи (надключичные ямки). Наиболее излюбленной локализацией сыпи являются ягодицы, внутренняя поверхность бедер, грудь, лицо.
Отличительные особенности сыпи при ИТП:
- Полихромность – геморрагии появляются неодновременно, присутствуют элементы на разных стадиях развития – от красновато-синеватых до зеленых и желтых.
- Полиморфность – наряду с различной величины экхимозами имеются петехии, кожа становится как бы пятнистой, по типу «шкуры леопарда».
- Несимметричность.
- Спонтанность возникновения (преимущественно по ночам) – в ночное время кровоток замедляется (под действием вагуса), эритроциты в большом количестве диапедезно выходят через порозную стенку в окружающую ткань и утром определяется свежий кровоподтек.
Кровоточивость при ИТП представлена в большинстве случаев редкими и кратковременными носовыми и желудочно-кишечными кровотечениями. У части больных отмечаются и повторные носовые и желудочно-кишечные кровотечения (с меленой), из полости рта (десен), почечные (макрогематурия), «кровавые» слезы, маточные кровотечения (или обильные меноррагии при месячных у девочек пубертатного возраста).
У 1% больных при ТП менее 20 тыс. в 1 мкл возможны фатальные внутричерепные кровоизлияния в течение 1 месяца от начала заболевания.
В 10% случаев имеется умеренная спленомегалия (+1-2 см). С учетом предшествующей ОРВИ возможна небольшая болезненная лимфоаденопатия шейных узлов.
Исходом острой ИТП в 75% случаев является нормализация числа тромбоцитов за 1-2 недели от начала заболевания без специфической терапии, в 50-65% – через 4 недели.
Хроническое течение ИТП регистрируется при ТП менее 150 тыс. в 1 мкл в течение 6 и более месяцев. Этот вариант заболевания начинается, как правило, постепенно, не имеет связи с вирусной инфекцией и другими провокаторами (острое начало регистрируется лишь в 10-22% случаев данного течения).
Критериями хронического течения являются: длительность более 2-4 недель до момента диагностики, ТП менее 50 тыс. в 1 мкл, пол (девочка), возраст старше 10 лет.
Исходо м хронической ИТП в 10-30% случаев служит спонтанная ремиссия через несколько месяцев или лет после постановки диагноза. Частота осложнений (внутричерепных кровоизлияний) повышается до 3,3-5%.
Клинико-лабораторная диагностика. Общий анализ крови: постгеморрагическая анемия, тромбоцитопения (норма 150-400 тыс. тромбоцитов в 1 мкл).
Увеличение продолжительности кровотечения по Дьюке. Кончик пальца или мочку уха прокалывают скарификатором на глубину 3 мм, самопроизвольно выступающую кровь снимают каждые 30 секунд прикосновением бумажного круга (норма 2-4 минуты). При ИТП отсутствует образование белого (тромбоцитарного) тромба, теряется способность сосудистой стенки к сокращению (из тромбоцитов не выделяется вазоконстриктор – серотонин), длительность кровотечения удлиняется.
Ретракция кровяного сгустка отсутствует или замедляется. Данный показатель отражает число и активность тромбоцитов, поскольку ретракция (сжатие) происходит под воздействием выделяемого тромбоцитами фермента (ретрактозима). 3-5 мл венозной крови наливают в градуированную пробирку и помещают в термостат на сутки при Т° 37°, далее отделившуюся от сгустка сыворотку сливают. Разделив объем сыворотки на объем взятой крови, получают индекс ретракции (норма 0,3-0,5).
Положительны пробы на резистентность капилляров: проба Кончаловского-Румпеля-Лееде (после наложения жгута на коже дистальнее места наложения в норме через 3 минуты появляются петехии, при ИТП – намного раньше), симптом щипка (на месте щипка появляется геморрагическое пятно, оно постепенно увеличивается и становится интенсивным, симптом определяется и в стадии клинической ремиссии), молоточковый симптом (синяки на коже после поколачивания перкуссионным молоточком).
Общий анализ мочи: гематурия при почечной кровотечении.
Иммунограмма: увеличение содержания ЦИК.
Миелограмма: гиперплазия мегакариоцитов, при тяжелом течении – снижение их количества.
Дополнительными методами исследования при ИТП служат определение уровня тромбоцитассоциированных АТ (иммуноглобулинов G на мембранах тромбоцитов), биохимические тесты, агрегатограмма тромбоцитов (выявление тромбоцитопатии), рентгенография органов грудной клетки (выявление кровоизлияний), УЗИ органов брюшной полости (выявление спленомегалии), коагулограмма, определение комплемента и иммуноглобулинов сыворотки.
Дифференциальная диагностика. Стойкая гиперплазия мегакариоцитарного ростка, изменения миелоидного и эритроцитарного ростков костного мозга при отсутствии постгеморрагической анемии нехарактерны для ИТП и требуют поисков других причин тромбоцитопении.
Инфекционные заболевания, помимо тромбоцитопении, характеризуются лихорадкой, увеличением лимфатических узлов, спленомегалией, лейкоцитозом с нейтрофильным сдвигом, повышением СОЭ.
Вторичная симптоматическая ТП при коллагенозах, лимфолейкозе, приеме медикаментов. При лейкозе число мегакариоцитов и отшнуровка тромбоцитов снижены, при ИТП число мегакариоцитов снижается только при тяжелом течении.
Наследственная гипопластическая ТП с амегакариоцитозом или мегакариоцитарной гипоплазией – появляется в первые дни жизни, сочетается с пороками развития (аплазия лучевой кости).
Наследственные тромбоцитолитические пурпуры – синдром Вискотта-Олдрича (микроцитарная ТП с диаметром клеток менее 2 мкм, с рецидивирующей гнойной экземой), синдром Бернара-Сулье (геморрагическая тромбоцитодистрофия, макроцитарная ТП, с низкой адгезией и агрегацией, пурпура и кровоточивость с первых месяцев жизни), синдром Мая-Хегглина (макроцитарная ТП, проявляется в дошкольном и школьном возрасте, кровоточивость нетяжелая).
Врожденная изоиммунная ТП – возникает при наличии у плода тромбоцитарного АГ PLA I (2-5% в популяции), что приводит к сенсибилизации матери, синтезу в ее организме антитромбоцитарных АТ, которые проникают через плаценту и вызывают лизис тромбоцитов плода. Петехии и геморрагии появляются в первые часы жизни. Диагностируется по положительной реакции тромбоагглютинации тромбоцитов ребенка в сыворотке крови матери.
Врожденная трансиммунная ТП – возникает у 30-50% детей от матерей с ИТП (в половине случаев – с геморрагическими расстройствами), когда от матери к плоду проникают антитромбоцитарные АТ и сенсибилизированные лимфоциты с развитием ТП плода.
В 1-3% случаев регистрируется переход в ИТП. Диагностируется по обнаружению у матери антитромбоцитарных аутоантител, у матери и ребенка – сенсибилизированных к АГ тромбоцитов лимфоцитов.
Гетероиммунные пурпуры – в этих случаях АТ вырабатываются против чужого АГ, фиксированного на поверхности тромбоцитов (лекарств типа дигитоксина, ПАСК, сульфаниламидов, гипотиазида, а также вирусов краснухи, ветряной оспы, кори), когда через 2-3 суток от начала приема или вирусной инфекции возникают петехии и кровоизлияния, но через 2-3 недели наступает полное выздоровление (при переходе в хроническое течение ставится диагноз ИТП).
Исходы. У большинства больных происходит самоизлечение в течение 1-6 месяцев (у детей – в 10-30% случаев). Факторами риска развития хронической ИТП служат: женский пол, возраст более 10 лет, выраженные кровотечения в дебюте заболевания. Уровень смертности при ИТП – менее 1% (причина – кровоизлияния в ЦНС, тяжелая постгеморрагическая анемия).
Принципы лечения. Основными принципами лечения, исходя из деструкции нагруженных аутоантителами тромбоцитов клетками РЭС, являются:
- Уменьшение продукции аутоантител.
- Нарушение связывания аутоантител с тромбоцитами.
- Устранение деструкции нагруженных аутоантителами тромбоцитов клетками РЭС.
Показания для госпитализации:
- Тяжелые, угрожающие жизни кровотечения, независимо от числа тромбоцитов.
- ТП менее 20 тыс. в 1 мкл.
- Необходимость стационарного лечения (тампонады).
- Проживание вдали от стационара или по просьбе родителей.
Показания для амбулаторного лечения:
- ТП 20-30 тыс. в 1 мкл при отсутствии геморрагического синдрома.
- ТП более 30 тыс. в 1 мкл при отсутствии или минимальных проявлениях геморрагического синдрома.
С учетом того, что 30-70% детей с тяжелой ИТП достигают уровня тромбоцитов 50-100 тыс. в 1 мкл через 3 недели только на симптоматической терапии, требуется индивидуальный подход к лечению каждого больного.
В остром периоде назначают ПОСТЕЛЬНЫЙ РЕЖИМ, далее режим постепенно расширяют. ДИЕТА с исключением облигатных аллергенов.
ПРЕПАРАТЫ, УЛУЧШАЮЩИЕ АДГЕЗИВНО-АГГРЕГАЦИОННУЮ ФУНКЦИЮ ТРОМБОЦИТОВ, показаны при любой форме ИТП (если исключен ДВС-синдром):
Эпсилон-аминокапроновая кислота – порошки, гранулы во флаконе (при разведении до метки 100 мл водой получают 20% раствор – в 1 мл 0,2 г). Разовая доза (РД) при умеренной фибринолитической активности для детей до 1 года 2,5 мл (0,5 г), 1-7 лет 2,5-5 мл (0,5-1 г), 7-10 лет 15 мл (3 г). РД при остром кровотечении у детей до 1 года 5 мл (1 г), 1-4 лет 5,0-7,5 мл (1-1,5 г), 4-8 лет 7,5-10 мл (1,5-2 г), 8-10 лет 15 мл (3 г). В экстренных случаях назначается внутривенно в виде 5% раствора на 0,9% растворе хлорида натрия в дозе 1 мл/кг со скоростью 20-30 капель в минуту, повторная капельная инфузия при продолжающемся кровотечении – через 6-8 часов.
Рекомбинантный активированный фактор VII (эптагон-альфа) является наиболее эффективным гемостатическим препаратом, позволяющим корригировать массивные диффузные геморрагии при ИТП и тромбоцитарных дисфункциях, рефрактерных к трансфузиям компонентов крови. При тяжелых геморрагических осложнениях предпочтительно использование препарата в максимально ранние сроки от начала кровотечения, в дозе 90 мкг/кг.
Карбазохром (адроксон) – ампулы 0,025% раствора по 1,0 мл. Назначается подкожно или внутримышечно по 0,5-1,0 мл 1-4 раза в сутки.
Этамзилат (дицинон) – таблетки по 0,25 (по ¼-1 таб. через 4-6 часов), ампулы 12,5% раствора по 2,0 мл (по 2-4 мл внутривенно или внутримышечно в хирургии для профилактики и лечения послеоперационных кровотечений).
Кальция пантотенат (витамин В5) – таблетки по 0,1. РД у детей 1-3 лет 0,05-0,1, 3-14 лет 0,1-0,2 2 раза в день, после еды.
Препараты магния перорально: магния карбонат основной в порошках, РД у детей до 1 года 0,5, 2-5 лет 1-1,5, 6-12 лет 1-2 г 2-3 раза в сутки.
Рекомбинантный активированный фактор VII свертывания крови (препарат НовоСэвен, фирма «Ново Нордиск», Дания) оказался эффективным в лечении и профилактике геморрагического синдрома, вызванного снижением количества или нарушением функции тромбоцитов. Использование препарата находится в стадии изучения, по данным М.Б.Белогуровой с соавторами (2004) при геморрагическом синдроме на фоне ИТП НовоСэвен используется в дозе 100 мкг/кг 2-кратно (острая ИТП) или 70-120 мкг/кг однократно (хроническая ИТП).
СОСУДОУКРЕПЛЯЮЩИЕ ПРЕПАРАТЫ также показаны при любой форме ИТП.
Аскорбиновая кислота – в порошках. РД у детей до 1 года 50 мг, 1-7 лет 75-100 мг, 7-14 лет 100-200 мг 3 раза в день.
Рутин (витамин Р) – таблетки по 0,2,порошки. РД у детей до 1 года 5-10 мг, 1-2 лет 10 мг, 3-5 лет 10-15 мг, 6-8 лет 15-20 мг, 9-15 лет 20-40 мг.
Комбинация аскорбиновой кислоты и рутина, аскорутин (аскорбиновая кислота 0,1 или 0,2 + рутин 0,02 или 0,01) в таблетках.
Кальция хлорид 5% раствор у детей до 1 года, 10% – старше 1 года, назначается по 1 чайной – 1 столовой ложке 3 раза в день после еды.
Кальция глюконат – порошки, таблетки по 0,5. Суточная доза (СД) у детей до 1 года 0,5, 2-4 года 1,0, 5-6 лет 1-1,5, 7-9 лет 1,5-2, 10-14 лет 2-3 г 3 раза в день, перед едой.
АНТИГИСТАМИННЫЕ ПРЕПАРАТЫ назначаются курсами по 7-10 дней с учетом иммунопатологического генеза ИТП.
СОВРЕМЕННАЯ СПЕЦИФИЧЕСКАЯ ТЕРАПИЯ ИТП включает в себя применение глюкокортикоидов (ГК), внутривенного иммуноглобулина (ВВИГ), антирезусного-D-иммуноглобулина, препаратов альфа-2-интерферона, оперативное удаление селезенки (спленэктомию).
ГЛЮКОКОРТИКОИДЫ обладают противовоспалительной, десенсибилизирующей, антиаллергической активностью, иммуносупрессивным действием. До внедрения в практику блокаторов клеток РЭС (ВВИГ, анти-Rh-D-иммуноглобулин) ГК являлись единственным терапевтическим средством для лечения больных с острой ИТП и до настоящего времени являются базовой поддерживающей терапией для больных с хронической ИТП. Показаниями для назначения ГК являются генерализованный кожный геморрагический синдром в сочетании с кровоточивостью слизистых оболочек, кровоизлияния в склеры и сетчатку глаз, «влажная» пурпура с постгеморрагической анемией, кровоизлияния во внутренние органы.
При ИТП наиболее часто применяют три режима введения ГК:
- Стандартные дозы пероральных ГК: преднизолон 1-2 мг/кг в сутки или 60 мг на м кв. в течение 21 дня.
- Высокие дозы пероральных ГК: преднизолон 4-8 мг/кг в сутки 7 дней или метилпреднизолон 10-30 мг/кг в сутки 3-7 дней с быстрой отменой препарата.
- Высокие дозы парентеральных ГК: метилпреднизолон 10-30 мг/кг в сутки 3-7 дней («пульс-терапия»).
Наиболее эффективен у детей последний режим – число тромбоцитов повышается более 50 тыс./мкл на 4-й день (на 16-й день – у нелеченных или получавших стандартные дозы ГК).
При хронической ИТП достижение полного ответа (более 100 тыс./мкл) возможно у 30% больных, частичного (менее 40 тыс./мкл) – у 15-20%, в 50% случаев ответа нет. Полная продолжительная ремиссия отмечена лишь в 10-20% случаев.
При стероидорезистентной ИТП проводится пульс-терапия дексаметазоном в дозе 0,5 мг/кг в сутки (не более 40 мг) по 4 дня каждые 28 дней перорального приема, всего 6 циклов.
Иммуноглобулин человеческий нормальный для внутривенного введения, ВНУТРИВЕННЫЙ ИММУНОГЛОБУЛИН (ВВИГ) – препарат нормального полиспецифического иммуноглобулина G, полученного из пула сывороток нескольких тысяч доноров, с таким же распределением по субклассам, что и в нормальной сыворотке и периодом полувыведения около 3 недель (например, сандоглобулин фирмы «Сандос», октагам фирмы «Октафарма»).
Механизм действия ВВИГ – обратимая блокада Fс-рецепторов клеток РЭС, которая предотвращает удаление из кровяного русла циркулирующих тромбоцитов, сенсибилизированных аутоантителами (иммуноглобулинами G), обратимая блокада Fс-рецепторов лейкоцитов, Fс-зависимая обратная ингибиция синтеза аутоантител В-лимфоцитами, модуляция супрессорной и хелперной активности Т-лимфоцитов, подавление комплементзависимого повреждения тканей. Блокада Fс-рецепторов клеток РЭС объясняет быстрое увеличение тромбоцитов в течение нескольких часов после введения ВВИГ.
Назначается ВВИГ в дозе 1000 мг/кг однократно или 2000 мг/кг в течение 2-5 дней с одинаковой эффективностью (в 83% случаев отмечается повышение тромбоцитов выше 50 тыс./мкл, в 64% – выше 100 тыс./мкл). Если в первые 48 часов терапии число тромбоцитов повышается менее чем на 30 тыс./мкл, дальнейшая терапия бесполезна.
У детей с острой ИТП полная гематологическая ремиссия в течение длительного времени достигается в 62-68% случаев. При хронической ИТП эффект менее выражен (транзиторный в 50%, полный и частичный – по 25%), однако повторные инфузии позволяют избежать спленэктомии у 50-67% детей, что особенно важно при возрасте менее 6-10 лет.
Основными недостатками лечения ВВИГ являются высокая стоимость ($5.000-10.000 на курс ребенку 10 лет) и транзиторный эффект при хронической ИТП.
Анти-D (Rh) иммуноглобулин, АНТИРЕЗУСНЫЙ-D-ИММУНОГЛОБУЛИН – стерильная лиофильно высушенная фракция иммуноглобулина G, содержащая антитела к резус (D). Механизм действия сходен с ВВИГ – происходит блокада Fс-рецепторов клеток РЭС антиэритроцитарными антителами – изогемагглютининами.
Препарат выпускается в дозировке 15.000 МЕ (300 мкг антирезусного-D-иммуноглобулина), 1250 МЕ (Резонатив, Октафарма), вводится резус-положительным больным внутримышечно и внутривенно. В связи с риском развития гемолитической анемии доза зависит от концентрации Hb: 25-40 мкг/кг при Hb менее 100 г/л, 40-60 мкг/кг при Hb более 100 г/л (оптимальная доза 50 мкг/кг). Возможно однократное внутривенное введение или 2-5 ежедневных внутримышечных введений. Препарат эффективен в 79-90% (отмечается повышение тромбоцитов на 2-8 день лечения, продолжительность ответа в среднем 5 недель). При угрожающих жизни состояниях данный препарат не используется (медленно повышает уровень тромбоцитов).
Стоимость антирезусного-D-иммуноглобулина составляет 1/10 ВВИГ. Препарат используется в качестве длительной поддерживающей терапии у больных хронической ИТП, позволяет отсрочить спленэктомию. Побочным эффектом может быть гемолитическая анемия (транзиторная, на 3-7 день после введения, длится 1-2 недели, Hb снижается на 5-20 г/л).
АЛЬФА-2-ИНТЕРФЕРОН – генно-инженерный препарат (Реаферон, Интрон А, Реаферон-А), вводится подкожно или внутримышечно 3 раза в неделю в течение 3 месяцев. Детям до 5 лет доза препарата составляет 500.000 МЕ/сутки, 5-12 лет 1.000.000 МЕ/сутки, старше 12 лет 2.000.000 МЕ/сутки. Эффективность составляет 72,5%, у большинства больных гематологический эффект отмечается уже через 2 недели. Длительность терапии должна быть не менее 4 недель. При повышении количества тромбоцитов в течение первых 4-х недель терапия в этой же дозе продолжается до 9 недель, затем продолжается в виде поддерживающей терапии.
ТРАНСФУЗИИ ТРОМБОЦИТАРНОЙ МАССЫ при ИТП не эффективны, они проводятся только при угрожающих жизни кровотечениях. Количество тромбоцитов в периферической крови при этом не увеличивается, но возможен местный гемостатический эффект.
СПЛЕНЭКТОМИЯ показана при отсутствии эффекта от консервативной терапии, наличии полной глубокой ТП, геморрагического синдрома с угрожающим для жизни кровотечением.
Гематологическими показаниями для спленэктомии являются: 1. Длительность ИТП более 12 месяцев. 2. ТП менее 10 тыс./мкл с кровоточивостью в анамнезе. 3. ТП 10-30 тыс./мкл с тяжелым кровотечением.
В 72-80% случаев после операции достигается полная гематологическая ремиссия, в 15% – возникает рецидив из-за наличия дополнительных селезенок, что подтверждается отсутствием в крови оперированных больных эритроцитов с тельцами Ховеля-Жоли (обязательно появляются при полном удалении селезенки). В этом случае проводится дополнительная спленэктомия.
В случае неэффективности спленэктомии, вновь кратковременно назначают глюкокортикоиды, а если и это не приводит к увеличению числа тромбоцитов, назначаются ЦИТОСТАТИКИ: винкристин 1,5 мг/м 2 внутривенно 1 раз в неделю. Эффект наступает после 2-4 введений (более длительное назначение нецелесообразно).
Помимо цитостатиков, после спленэктомии возможно использование СИНТЕТИЧЕСКИХ АНДРОГЕНОВ: даназол в дозе 20 мг/кг в сутки (не более 800 мг, разделенных на 2 дозы) в течение 1-12 месяцев.
Альтернативой спленэктомии является РЕНТГЕНЭНДОВАСКУЛЯРНАЯ ОККЛЮЗИЯ СЕЛЕЗЕНКИ (РЭО) – введение по катетеру в селезеночную артерию вазопрессина, вызывающего ее спазм, с последующим развитием инфаркта селезенки. Если у больных с хронической ИТП нет эффекта от РЭО, не поможет и спленэктомия. В лечении ИТП при противопоказаниях к спленэктомии показано облучение селезенки, однако детям с хронической ИТП такое лечение не рекомендуется.
Диспансерное наблюдение. В стадии клинической ремиссии контроль уровня тромбоцитов проводится ежемесячно. При длительной клинико-гематологической ремиссии (более 5 лет после острой ИТП) ребенок снимается с диспансерного учета. При хронической ИТП ребенок наблюдается до перехода во взрослую поликлинику.
При выписке из стационара рекомендуется: наблюдение гематолога по месту жительства; отказ от физиолечения, инсоляции; отказ от аспирина, карбенициллина; фитотерапия для профилактики кровоточивости (настои ромашки, крапивы, шиповника) курсами по 15 дней каждые 3 месяца; освобождение от физкультуры и спорта; оформление инвалидности при стойкой хронизации ИТП.
Необходимо соблюдать режим питания с исключением острых блюд, уксуса, консервированных овощей, алкоголя. Следует также назначать продолжительное время кунжутное масло, орехи арахиса.
Прививки на фоне приема антигистаминных средств возможны лишь через 1 год после острой ИТП. Прививки живыми вирусными вакцинами противопоказаны.
источник
Заболевание, характеризующееся склонностью к кровоточивости, обусловленной тромбоцитопенией (снижением содержания тромбоцитов в крови до 150х10 9 /л) при нормальном или увеличенном количестве мегакариоцитов в красном костном мозге — это тромбоцитопеническая пурпура (болезнь Верльгофа). Рассмотрим причины заболевания, а также способы, которыми проводится его лечение у маленьких детей.
Это наиболее распространённое заболевание из группы геморрагических диатезов. Частота выявления новых случаев заболевания составляет от 10 до 125 на 1 млн населения в год. Как правило, заболевание манифестирует в детском возрасте. До 10-летнего возраста симптомы болезни встречаются с одинаковой частотой у мальчиков и девочек, а после 10 лет и у взрослых — в 2 — 3 раза чаще у лиц женского пола.
Причины возникновения тромбоцитопенической пурпуры
Возникновение симптомов заболевания провоцируется вирусными инфекциями, прививками, физическими и психическими травмами; имеет значение также наследственная предрасположенность.
Тромбоцитопения развивается вследствие разрушения тромбоцитов посредством иммунных механизмов. AT к собственным тромбоцитам могут появляться спустя 1 — 3 нед. после перенесённых вирусных или бактериальных инфекций, профилактических прививок, приёма лекарственных препаратов при индивидуальной их непереносимости, переохлаждения или инсоляции, после хирургических операций, травм.
В ряде случаев какую-либо определённую причину выявить не удаётся. Поступившие в организм Аг (например, вирусы, лекарственные средства, в том числе вакцины) оседают на тромбоцитах больного и индуцируют иммунный ответ. Антитромбоцитарные AT относят преимущественно к IgG. Реакция «Аг-AT» происходит на поверхности тромбоцитов. Продолжительность жизни тромбоцитов, нагруженных AT, при тромбоцитопенической пурпуре снижена до нескольких часов вместо 7 — 10 дней в норме. Преждевременная гибель тромбоцитов происходит в селезёнке.
Такой симптом, как кровоточивость, обусловлена снижением количества тромбоцитов, вторичным повреждением сосудистой стенки в связи с выпадением ангиотрофической функции тромбоцитов, нарушением сократительной способности сосудов из-за понижения концентрации серотонина в крови, невозможностью ретракции кровяного сгустка.
Заболевание может начинаться постепенно или остро с геморрагического синдрома.
Патогномоничные симптомы — кожные геморрагии, кровоизлияния в слизистые оболочки, кровотечения. Характерными чертами являются: полихромность (геморрагии на коже одновременно в разной стадии развития — от красных до зеленоватых), полиморфность высыпаний (от петехий до крупных кровоизлияний), несимметричность, спонтанность возникновения (вне связи с серьезными травмами, преимущественно ночью), безболезненность.
Нередко возникают кровотечения из лунки удаленного зуба, носовые и десневые, возможны кровоизлияния во внутренние органы.
Во время клинической ремиссии геморрагический синдром исчезает, время кровотечения сокращается, изменения в свертывающей системе крови купируются. При этом тромбоцитопения в большинстве случаев сохраняется.
Количество экхимозов варьирует от единичных до множественных. Основные характеристики кожного геморрагического синдрома при ТП следующие:
- Несоответствие выраженности геморрагии степени травматического воздействия; возможно их спонтанное появление (преимущественно ночью).
- Полиморфизм геморрагических высыпаний (от петехий до крупных кровоизлияний).
- Полихромность кожных геморрагии (окраска от багровой до синезеленоватой и жёлтой в зависимости от давности их появления), что связано с постепенным превращением, но через промежуточные стадии распада в билирубин.
- Асимметрия (нет излюбленной локализации) геморрагических элементов.
- Безболезненность.
Нередко возникают кровоизлияния в слизистые оболочки, наиболее часто миндалин, мягкого и твёрдого нёба. Возможны кровоизлияния в барабанную перепонку, склеру, стекловидное тело, глазное дно. Лечение нужно начинать оперативно.
Кровоизлияние в склеру может указывать на угрозу возникновения самого тяжёлого и опасного осложнения тромбоцитопенической пурпуры — кровоизлияния в головной мозг. Как правило, оно возникает внезапно и быстро прогрессирует. Клинически кровоизлияние в головной мозг проявляется головной болью, головокружением, судорогами, рвотой, очаговой неврологической симптоматикой. Исход кровоизлияния в мозг зависит от объёма, локализации патологического процесса, своевременности диагностики и адекватной терапии.
Заболевание характеризуется кровотечениями из слизистых оболочек. Нередко они имеют профузный характер, вызывая тяжёлую постгеморрагическую анемию, угрожающую жизни больного. У детей наиболее часто возникают кровотечения из слизистой оболочки полости носа. Кровотечения из дёсен обычно менее обильны, но и они могут стать опасными при экстракции зубов, особенно у больных с недиагностированным заболеванием. Кровотечение после удаления зуба при данном заболевании возникает сразу же после вмешательства и не возобновляется после его прекращения в отличие от поздних, отсроченных кровотечений при гемофилии. У девочек пубертатного периода возможны тяжёлые мено и метроррагии. Реже бывают желудочнокишечные и почечные кровотечения.
Характерные изменения внутренних органов при ТП отсутствуют. Температура тела обычно нормальная. Иногда выявляют симптомы тахикардии, при аускультации сердца — систолический шум на верхушке и в точке Боткина, ослабление I тона, обусловленные анемией. Увеличение селезёнки нехарактерно и скорее исключает диагноз ТП.
Течение тромбоцитопенической пурпуры у детей
По течению выделяют острые (длительностью до 6 мес) и хронические (продолжительностью более 6 мес) формы заболевания. При первичном осмотре установить характер течения заболевания невозможно. В зависимости от степени проявления геморрагического синдрома, показателей крови в течении заболевания выделяют три периода: геморрагический криз, клиническая ремиссия и клиникогематологическая ремиссия.
Геморрагический криз характеризуется выраженным синдромом кровоточивости, значительными изменениями лабораторных показателей.
Во время клинической ремиссии исчезает геморрагический синдром, сокращается время кровотечения, уменьшаются вторичные изменения в свёртывающей системе крови, но тромбоцитопения сохраняется, хотя она менее выраженная, чем при геморрагическом кризе.
Клиникогематологическая ремиссия подразумевает не только отсутствие кровоточивости, но и нормализацию лабораторных показателей.
Для нее характерны снижение содержания тромбоцитов в крови вплоть до единичных в препарате и увеличение времени кровотечения. Длительность кровотечения не всегда соответствует степени тромбоцитопении, так как она зависит не только от количества тромбоцитов, но и от их качественных характеристик. Значительно снижена или не наступает вообще ретракция кровяного сгустка. Вторично (в результате тромбоцитопении) изменяются плазменно-коагуляционные свойства крови, что проявляется недостаточностью образования тромбопластина в связи с дефицитом 3го тромбоцитарного фактора. Нарушение образования тромбопластина приводит к снижению потребления протромбина в процессе свёртывания крови.
В некоторых случаях в период криза отмечают активацию фибринолитической системы и повышение антикоагулянтной активности (антитромбины, гепарин). У всех больных снижена концентрация серотонина в крови. Эндотелиальные пробы (жгута, щипка, молоточковая, уколочная) в период гематологического криза положительны.
В красной крови и лейкограмме (при отсутствии кровопотерь) изменений не находят. При исследовании красного костного мозга обычно выявляют нормальное или повышенное содержание мегакариоцитов.
Дифференциальная диагностика тромбоцитопенической пурпуры
Болезнь необходимо дифференцировать от острого лейкоза, гипо или аплазии красного костного мозга, СКВ, тромбоцитопатий.
- При гипо- и апластических состояниях при исследовании крови выявляют панцитопению. Пунктат красного костного мозга беден клеточными элементами.
- Властная метаплазия в красном костном мозге — основной критерий острого лейкоза.
- ТП может быть проявлением диффузных заболеваний соединительной ткани, чаще всего СКВ. В этом случае необходимо опираться на результаты иммунологического исследования. Высокий титр антинуклеарного фактора, наличие LE клеток свидетельствуют о СКВ.
- Основное отличие ТП от тромбоцитопатий — снижение содержания тромбоцитов.
В период геморрагического криза ребёнку показан постельный режим с постепенным его расширением по мере угасания геморрагических явлений. Специальной диеты не назначают, однако при кровоточивости слизистой оболочки полости рта дети должны получать пищу в охлаждённом виде.
Патогенетическая терапия аутоиммунной формы заболевания включает назначение глюкокортикоидов, выполнение спленэктомии и использование иммунодепрессантов.
Лечение тромбоцитопенической пурпуры у ребенка
- В качестве патогенетической терапии применяют глюкокортикоиды (2 мг/кг в сутки перорально), спленэктомию и иммунодепрессанты.
- Также используют Ig человеческий в дозе 0,4 или 1 г/кг в течение 5 или 2 дней соответственно.
- Иммунодепрессанты (цитостатики) используют лишь в случае неэффективности перечисленных методов (винкристин 1,5 — 2 мг/м 2 поверхности тела внутрь, циклофосфамид 10 мг/кг 5 — 10 инъекций в течение 1 — 2 месяцев).
- В последнее время применяют даназол (синтетический препарат андрогенного действия), препараты интерферона (реаферон, интрон-А, роферон-А), анти-D-Ig (анти-D).
- Из симптоматических препаратов используются: аминокапроновая кислота (0,1 г/кг), гемостатическое средство этамзилат (5 мг/кг в сутки), переливание тромбоцитарной массы, фитотерапия, местная кровоостанавливающая терапия (тампоны с перекисью водорода, адреналином, гемостатическая губка, фибринная пленка).
Средства лечения тромбоцитопенической пурпуры
Преднизолон назначают в дозе 2 мг/кг/сут на 2 — 3 нед. с последующими снижением дозы и полной отменой препарата. Преднизолон в более высоких дозах (3 мг/кг/сут) назначают короткими курсами по 7 дней с перерывом в 5 дней (не более трёх курсов). При резко выраженном геморрагическом синдроме, угрозе кровоизлияния в мозг возможна «пульстерапия» метилпреднизолоном (30 мг/кг/сут внутривенно в течение 3 дней). В большинстве случаев эта терапия вполне эффективна. Вначале исчезает геморрагический синдром, затем начинает увеличиваться содержание тромбоцитов. У некоторых больных после отмены гормонов наступает рецидив.
В последние годы в лечении тромбоцитопенической пурпуры с хорошим эффектом используют внутривенное введение Ig человеческого нормального в дозе 0,4 или 1 г/кг в течение 5 или 2 дней соответственно (курсовая доза 2 г/кг) как монотерапию или в сочетании с глюкокортикоидами.
Спленэктомию или тромбоэмболизацию сосудов селезёнки проводят при отсутствии или нестойкости эффекта от консервативного лечения, повторяющихся обильных длительных кровотечениях, приводящих к выраженной постгеморрагической анемии, тяжёлых кровотечениях, угрожающих жизни больного. Операцию обычно выполняют на фоне глюкокортикоидной терапии у детей старше 5 лет, так как в более раннем возрасте велик риск развития постспленэктомического сепсиса. У 70 — 80% больных операция приводит к практически полному выздоровлению. Остальные дети и после спленэктомии нуждаются в продолжении лечения.
Иммунодепрессанты (цитостатики) для лечения используют лишь при отсутствии эффекта от других видов терапии, так как эффективность их применения значительно меньше, чем спленэктомии. Применяют винкристин в дозе 1,5 — 2 мг/м 2 поверхности тела внутрь, циклофосфамид в дозе 10 мг/кг- 5-10 инъекций, азатиоприн в дозе 23 мг/кг/сут в 2 — 3 приёма в течение 1 — 2 мес.
В последнее время для лечения тромбоцитопенической пурпуры применяют также даназол (синтетический препарат андрогенного действия), препараты интерферона (реаферон, интронА, роферонА), антиDIg (антиD). Однако положительный эффект от их применения нестойкий, возможны побочные действия, что делает необходимым дальнейшее изучение механизма их действия и определения их места в комплексной терапии данного заболевания.
Для уменьшения выраженности геморрагического синдрома в период повышенной кровоточивости назначают внутривенно или внутрь аминокапроновую кислоту из расчёта 0,1 г/кг (противопоказана при гематурии). Препарат лечения относится к ингибиторам фибринолиза, а также усиливает агрегацию тромбоцитов.
Применяют также гемостатическое средство этамзилат в дозе 5 мг/кг/сут внутрь или внутривенно капельно. Препарат обладает также ангиопротекторным и проагрегантным действием. Для остановки носовых кровотечений используют тампоны с перекисью водорода, адреналином; аминокапроновой кислотой; гемостатическую губку, фибринную, желатиновую плёнки.
При лечении постгеморрагической анемии у детей с тромбоцитопенической пурпурой применяют средства, стимулирующие кроветворение, так как регенераторные способности кроветворной системы при этом заболевании не нарушаются. Переливание отмытых эритроцитов, подобранных индивидуально, проводят только при выраженной острой анемии.
Прогноз лечения. Исходом могут быть выздоровление, клиническая ремиссия без нормализации лабораторных показателей, хроническое рецидивирующее течение с геморрагическими кризами и в редких случаях — летальный исход в результате кровоизлияния в головной мозг (1-2%). При современных методах лечения прогноз для жизни в большинстве случаев благоприятный.
Первичная профилактика не разработана. Вторичная профилактика сводится к предупреждению рецидивов заболевания. При вакцинации детей необходимы индивидуальный подход и особая осторожность. Школьников освобождают от занятий физкультурой; следует избегать инсоляции. С целью профилактики геморрагического синдрома больным не следует назначать препараты, тормозящие агрегацию тромбоцитов (например, салицилаты, индометацин, барбитураты, кофеин, карбенициллин, нитрофураны и др.) После лечения тромбоцитопенической пурпуры и выписки из стационара дети подлежат диспансерному наблюдению в течение 5 лет. Показано исследование крови с подсчётом содержания тромбоцитов 1 раз в 7 дней, в дальнейшем (при сохранении ремиссии) ежемесячно. Обязательно исследование крови после каждого перенесённого заболевания.
источник
Идиопатическая (аутоиммунная) тромбоцитопеническая пурпура — заболевание, характеризующееся изолированным снижением количества тромбоцитов (менее 100 000/мм3) при нормальном или повышенном количестве мегакариоцитов в костном мозге и наличием на поверхности тромбоцитов и в сыворотке крови антитромбоцитарных антител, вызывающих повышенную деструкцию тромбоцитов.
Распространенность, факторы риска и этиология. Частота идиопатической тромбоцитопенической пурпуры у детей около 1,5-2 на 100 000 детей без различий по полу при равной частоте острых и хронических форм. В подростковом возрасте число больных девушек становится вдвое больше, чем юношей.
Причины тромбоцитопенической пурпуры точно не установлена; среди предшествующих развитию идиопатической тромбоцитопенической пурпуры факторов отмечают вирусные и бактериальные инфекции (40% случаев), прививки и введение гамма-глобулина (5,5%), хирургические операции и травмы (6%); в 45% случаях заболевание возникает спонтанно без предшествующих причин. У большинства больных идиопатической тромбоцитопенической пурпурой преморбидный фон, физическое и психомоторное развитие не отличаются от здоровых детей.
Термин «идиопатическая» указывает на спонтанное начало болезни и не идентифицированную до настоящего времени этиологию.
Патогенез тромбоцитопенической пурпуры. Тромбоцитопения приводит к нарушению в тромбоцитарном звене гемостаза и способствует развитию геморрагического синдрома петехиально-пятнистого (микроциркуляторного) типа. Тромбоцитопения сопровождается ангиотрофической недостаточностью, что вызывает дистрофические изменения в эндотелии мелких сосудов и капилляров и приводит к снижению резистентности сосудистой стенки и повышению ее порозности для эритроцитов. Это проявляется мелкоточечными кровоизлияниями (петехиями) в местах с более высоким гидростатическим давлением (нижние конечности); количество петехий можно легко увеличить, используя сдавление конечностей жгутом.
Для геморрагического синдрома при идиопатической тромбоцитопенической пурпуре характерны длительные кровотечения из мелких сосудов, в связи с неспособностью тромбоцитов сформировать тромбоцитарную пробку в местах повреждения эндотелия. Значительные изменения происходят в сосудистой стенке и под воздействием патоиммунного процесса. Из-за общности антигенных структур тромбоцитов и эндотелиальных клеток происходит разрушение эндотелиоцитов антитромбоцитарными антителами, что усиливает клинические проявления геморрагического синдрома.
В патогенезе идиопатической тромбоцитопенической пурпуры имеет ключевое значение иммунопатологический синтез лимфоцитами селезенки антитромбоцитарных аутоантител (IgG), которые фиксируются на различных рецепторах мембран тромбоцитов и мегакариоцитов, что подтверждает патоиммунную природу заболевания и гипотезу о первичной дисфункции лимфоидной системы при идиопатической тромбоцитопенической пурпуре. Вследствие аутоиммунного процесса тромбоциты теряют адгезивно-агрегационные свойства и быстро гибнут, поглощаясь мононуклеарами в селезенке, а в более тяжелых случаях — в печени и других органах ретикуло-эндотелиальной системы («диффузный» тип секвестрации). При «диффузном» типе секвестрации тромбоцитов спленэктомия недостаточно эффективна. Полупериод их исчезновения равен получасу и менее.
При идиопатической тромбоцитопенической пурпуре количество мегакариоцитов в костном мозге хотя и значительно увеличивается, но они отличаются функциональной незрелостью (количество незрелых форм увеличивается, а функционально активных — снижается).
Идиопатическая (аутоиммунная) тромбоцитопеническая пурпура бывает острой, хронической и рецидивирующей. При острой форме количество тромбоцитов нормализуется (более 150 000/мм3) в течение 6 мес после постановки диагноза без возникновения рецидивов. При хронической форме тромбоцитопения менее 150 000/мм3 длится более 6 мес. При рецидивирующей форме количество тромбоцитов после возврата к нормальному уровню снова снижается. Для детей более характерна острая форма, для взрослых — хроническая.
Вследствие того, что идиопатическая тромбоцитопеническая пурпура часто протекает транзиторно, истинная заболеваемость не установлена. Учтённая заболеваемость составляет около 1 на 10 000 случаев в год (3-4 на 10 000 случаев в год среди детей до 15 лет).
Как сказано выше, в основе патогенеза идиопатической тромбоцитопенической пурпуры — повышенное разрушение нагруженных аутоантителами тромбоцитов клетками ретикулогистиоцитарной системы. В опытах с меченными тромбоцитами установлено, что продолжительность жизни тромбоцитов снижается от 1-4 ч до нескольких минут. Повышение содержания иммуноглобулинов (IgG) на поверхности тромбоцитов и частота деструкции кровяных пластинок при идиопатической тромбоцитопенической пурпуре пропорциональны уровню тромбоцит-ассоциированных IgG (PAIgG). Мишенями для аутоантител являются гликопротеины (Gp) мембраны тромбоцитов: Gp Ilb/IIIa, Gp Ib/IX и Gp V.
Люди с HLA-фенотипом В8 и В12 имеют повышенный риск развития заболевания при наличии у них преципитирующих факторов (комплексы антиген-антитело).
Пик заболеваемости идиопатической тромбоцитопенической пурпурой приходится на возраст от 2 до 8 лет, при этом мальчики и девочки болеют с одинаковой частотой. У детей младше 2 лет (инфантильная форма) заболевание характеризуется острым началом, тяжёлым клиническим течением с развитием глубокой тромбоцитопении менее 20 000/мм3, плохим ответом на воздействие и частой хронизацией процесса — до 30% случаев. Риск дебюта хронической идиопатической тромбоцитопенической пурпуры у детей также увеличен у девочек старше 10 лет при длительности заболевания более 2-4 нед до момента постановки диагноза и количестве тромбоцитов более 50 000/мм3.
В 50-80% случаев заболевание возникает через 2-3 нед после инфекционного заболевания или иммунизации (натуральная оспа, живая коревая вакцина и др.). Наиболее часто начало идиопатической тромбоцитопенической пурпуры ассоциируют с неспецифическими инфекциями верхних дыхательных путей, приблизительно в 20% случаев — специфическими (коревая краснуха, корь, ветряная оспа, коклюш, эпидемический паротит, инфекционный мононуклеоз, бактериальные инфекции).
Симптомы идиопатической тромбоцитопенической пурпуры зависят от выраженности тромбоцитопении. Геморрагический синдром проявляется в виде множественных петехиально-синячковых высыпаний на коже, кровоизлияний на слизистых оболочках. Так как петехии (1-2 мм), пурпура (2-5 мм) и экхимозы (более 5 мм) могут также сопровождать другие геморрагические состояния, дифференциальный диагноз ставят по количеству тромбоцитов в периферической крови и продолжительности кровотечения.
Кровоточивость появляется при снижении количества тромбоцитов менее 50 000/мм3. Угроза серьёзных кровотечений возникает при глубокой тромбоцитопении менее 30 000/мм3. В начале заболевания носовые, десневые, желудочно-кишечные и почечные кровотечения обычно нехарактерны, редко бывают рвота кофейной гущей и мелена. Возможны тяжёлые маточные кровотечения. В 50% случаев заболевание проявляется в склонности к образованию экхимозов в местах ушибов, на передней поверхности нижних конечностей, над костными выступами. Глубокие мышечные гематомы и гемартрозы также не характерны, но могут быть следствием внутримышечных инъекций и обширных травм. При глубокой тромбоцитопении происходят кровоизлияния в сетчатку глаза, редко — кровотечение в среднее ухо, приводящее к снижению слуха. Кровоизлияние в мозг бывает в 1% случаев при острой идиопатической тромбоцитопенической пурпуре, в 3-5% — при хронической идиопатической тромбоцитопенической пурпуре. Обычно ему предшествует головная боль, головокружение и острое кровотечение какой-либо другой локализации.
При объективном обследовании у 10-12% детей, особенно раннего возраста, можно выявить спленомегалию. В этом случае дифференциальный диагноз проводят с лейкозом, инфекционным мононуклеозом, системной красной волчанкой, синдромом гиперспленизма. Увеличение лимфатических узлов при идиопатической тромбоцитопенической пурпуре быть не должно, если только это не связано с перенесённой вирусной инфекцией.
Вторичная тромбоцитопеническая пурпура
Как было сказано ранее, тромбоцитопения может быть идиопатической или вторичной в результате ряда известных причин. Вторичная тромбоцитопения, в свою очередь, может быть разделена в зависимости от количества мегакариоцитов.
Редкой врождённой причиной хронической тромбоцитопении с появлением многочисленных незрелых мегакариоцитов в костном мозге является дефицит тромбопоэтина.
Лечение состоит в трансфузиях плазмы от здоровых доноров или пациентов с идиопатической тромбоцитопенической пурпурой, которое приводит к повышению количества тромбоцитов и появлению признаков созревания мегакариоцитов, либо заместительного применения тромбопоэтина.
Лабораторная диагностика тромбоцитопенической пурпуры
При лабораторном обследовании выявляют тромбоцитопению менее 100 000/мм3, увеличение среднего объёма тромбоцита (MPV) по данным автоматического анализатора крови до 8,9±1,5 мкм3.
В периферической крови у пациентов с идиопатической тромбоцитопенической пурпурой, помимо тромбоцитопении, может быть умеренная эозинофилия. При выраженной кровопотере развивается анемия.
В пунктате костного мозга, который проводят для исключения других онкогематологических заболеваний, находят раздражение мегакариоцитарного ростка, слабую «отшнуровку» тромбоцитов при нормальных эритроидном и миелоидном ростках. У части больных обнаруживают умеренную эозинофилию.
При исследовании коагуляционного профиля, необязательном при стандартном идиопатической тромбоцитопенической пурпуры, выявляют увеличение времени кровотечения, снижение или отсутствие ретракции сгустка, нарушение утилизации протромбина при нормальных уровнях фибриногена, протромбинового времени и активированного парциального тромбопластинового времени.
Лабораторные исследования у пациентов с тромбоцитопенией включают:
общий анализ крови с мазком и определением количества тромбоцитов;
исследование пунктата костного мозга;
анализ крови на АНФ, анти-ДНК, фракции комплемента СЗ, С4, антитромбоцитарные антитела, уровень плазменного гликокалицина, проведение пробы Кумбса;
определение протромбинового времени, активированного парциального тромбопластинового времени, уровня фибриногена, продуктов распада фибриногена;
определение мочевины, креатинина крови, печёночных проб;
анализ крови на оппортунистические инфекции (ВИЧ, Эпстайна-Барр вирус, парвовирус);
исключение вторичных форм тромбоцитопении.
Основные критерии для постановки диагноза идиопатической тромбоцитопенической пурпуры:
отсутствие клинических признаков системных и онкогематологических заболеваний;
изолированная тромбоцитопения при нормальном количестве эритроцитов и лейкоцитов;
нормальное или повышенное количество мегакариоцитов в костном мозге при нормальных эритроидных и миелоидных элементах;
исключение вторичных форм тромбоцитопении при гиперспленизме, микро-ангиопатической гемолитической анемии, ДВС-синдроме, лекарственно-индуцированной тромбоцитопении, системная красная волчанка, вирусных инфекциях (Эпстайна-Барр вирус, ВИЧ, парвовирус).
Поскольку в основе патогенеза идиопатической тромбоцитопенической пурпуры лежит деструкция нагруженных аутоан-тителами тромбоцитов клетками ретикулогистиоцитарной системы, основными принципами лечения тромбоцитопенической пурпуры являются:
уменьшение продукции аутоантител;
нарушение связывания аутоантител с тромбоцитами;
устранение деструкции сенсибилизированных антителами тромбоцитов клетками ретикулогистиоцитарной системы.
При отсутствии кровотечений из слизистых оболочек, слабо выраженных экхимозах после ушибов, количестве тромбоцитов более 35 000/мм3 лечение обычно не требуется. Больным следует избегать занятий контактными видами спорта. Менструирующим девочкам полезны длительно действующие препараты прогестерона (Депо-провера и другие) для задержки менструации на несколько месяцев с целью профилактики интенсивных маточных кровотечений.
Угнетение фагоцитоза тромбоцитов с фиксированными на их поверхности антителами в селезёнке.
Нарушение выработки антител.
Нарушение связывания аутоантител с антигеном.
Кровотечения из слизистых оболочек; выраженная пурпура и обильные гематомы на местах ушибов, особенно на голове и шее; прогрессирующая пурпура; тромбоцитопения более 3 нед; рецидивирующая тромбоцитопения; количество тромбоцитов менее 20 000/мм3 у первичных пациентов с минимальной пурпурой.
Стандартные дозы пероральных кортикостероидов — преднизолон 1-2 мг/кг в сутки или 60 мг/м2 в сутки в течение 21 дня с постепенной отменой. Дозу снижают независимо от количества тромбоцитов, ремиссию оценивают по окончании курса. При отсутствии ремиссии или снижение количества тромбоцитов после достижения нормальных показателей глюкокортикоидное воздействие не продолжают. При отсутствии полного гематологического ответа во время стандартного курса кортикостероидов отмену преднизолона производят «прерывистым курсом» (через день после перерыва по 5 мг). Возможно повторение курса кортикостероидов спустя 4 нед. Длительное применение кортикостероидов при идиопатической тромбоцитопенической пурпуре нежелательно, так как может привести к депрессии тромбоцитопоэза.
Высокие дозы пероральных кортикостероидов 4-8 мг/кг в сутки в течение 7 дней или 10-30 мг/кг в сутки метилпреднизолона в течение 3-7 дней с быстрой отменой препарата. Через неделю курсы повторяют (2-3 курса).
Высокие дозы парентеральных кортикостероидов 10-30 мг/кг в сутки метилпреднизолона или солюмедрол 500 мг/м2 в сутки внутривенно в течение 3-7 дней в тяжёлых случаях для более быстрого купирования геморрагического синдрома. При необходимости дальнейшего лечения пациента переводят на приём стандартных доз внутрь.
Для стероидорезистентных пациентов с идиопатической тромбоцитопенической пурпурой возможна «пульс-терапия» дексаметазоном — 6 циклов по 0,5 мг/кг в сутки (максимально 40 мг/сут) по 4 дня каждые 28 дней, приём внутрь.
Эффективность приёма котрикостероидов, по данным разных авторов, составляет 50-80%. Побочные эффекты при их применении: симптому гиперкортицизма, язвенная болезнь, гипергликемия, гипертензия, увеличение риска инфекции, миопатия, гипокалиемия, стероидный психоз, нарушение функции яичников у девочек, задержка роста.
обратимая блокада Fc-рецепторов макрофагов;
подавление синтеза аутоантител В-лимфоцитами;
защита тромбоцитов и/или мегакариоцитов от антител;
модуляция хелперной и супрессорной активности Т-лимфоцитов;
подавление комплемент-зависимого повреждения тканей;
выздоровление от персистирующих вирусных инфекций за счёт введения специфических антител.
Показания при острой идиопатической тромбоцитопенической пурпуре:
при возможности — воздействие первой линии;
неонатальная симптоматическая иммунная тромбоцитопения;
дети в возрасте до 2 лет, резистентные к воздействию кортикостероидов.
Современные препараты внутривенного иммуноглобулина (ВВИГ) должны соответствовать требованиям ВОЗ, определённым в 1982 г.: минимум 1000 порций крови, минимум 90% иммуноглобулинов G, нативный иммуноглобулин G (высокая активность Fc-фрагмента), нормальное деление иммуноглобулинов G на подклассы, физиологичный период полураспада. Кроме того, ВВИГ должны иметь низкую антикомплементарную активность и двойную вирус-инактивацию (чистый иммуноглобулин G).
Режимы введения внутривенного иммуноглобулина
При острой идиопатической тромбоцитопенической пурпуре — общая доза 1-2 г/кг на курс по схеме: 400 мг/кг в сутки в течение 5 дней или 1 г/кг в сутки в течение 1-2 дней. Дети моложе 2 лет легче переносят 5-дневный протокол приёма препаратов I и II поколений.
При хронической идиопатической тромбоцитопенической пурпуре — начальная доза 1 г/кг в сутки в течение 1-2 дней, затем единичные инфузии в дозе 0,4-1 г/кг, в зависимости от ответа, для поддержания безопасного уровня тромбоцитов (более 30 000/мм3). Использование ВВИГ полезно сочетать с альтернирующими курсами кортикостероидов.
Ответ на воздействие у пациентов с острой идиопатической тромбоцитопенической пурпурой происходит в 80-96,5% случаев. По сравнению с применением кортикостероидов быстрее увеличивается количество тромбоцитов при эпизодах кровотечения сопоставимой длительности. Около 65% детей с идиопатической тромбоцитопенической пурпурой, резистентных к кортикостероидоам, достигают длительной ремиссии после курса ВВИГ.
Побочные эффекты препаратов ВВИГ:
анафилактические реакции (у пациентов со сниженным уровнем IgA);
лихорадка с ознобом (1-3% случаев);
гемолитическая анемия с положительной пробой Кумбса.
В научной литературе был описан случай развития асептического менингита после инфузии ВВИГ, а также инфицирование реципиентов ВВИГ (Гаммагард \ «Бакстер») вирусом гепатита С, но с 1994 г., после совершенствования технологии производства препаратов, такие ситуации больше не встречались.
Профилактическое назначение парацетамола (10-15 мг/кг каждые 4 ч) и дифенгидрамина (димедрола) (1 мг/кг каждые 6-8 ч) уменьшает частоту и тяжесть лихорадки с ознобом, а внутривенное введение дексаметазона в дозе 0,15-0,3 мг/кг позволяет купировать головную боль при инфузиях ВВИГ.
Комбинированное применение глюкокортикоидов и внутривенного иммуноглобулина
кровотечение из слизистых оболочек;
обширные петехии, пурпура и экхимозы;
симптомы и/или признаки внутренних кровотечений, в особенности внутричерепных.
Комбинированное применение вызывает более быстрое увеличение числа тромбоцитов, чем каждый препарат по отдельности. Его применяют при угрожающих жизни кровотечениях и при подготовке к хирургическому вмешательству. В неотложных случаях в качестве глюкокортикоида можно применять метилпреднизолон 30 мг/кг в сутки в течение 3 дней или солюмедрол в дозе 500 мг/м2.
блокада Fc-рецепторов макрофагов нагруженными антителами эритроцитами;
подавление образования антитромбоцитарных антител;
Условия применения при идиопатической тромбоцитопенической пурпуре — RhD-позитивные не спленэктомированные пациенты.
Препараты анти-RhD-иммуноглобулина: «WinRho» (Winnipeg, Manitoba, Канада), «NABI» (Boca Ration, FL, США), «Partogamma» (Biagini, Pisa, Италия), «Resogam» (Genteon Pharma, Германия).
оптимальная курсовая доза 50 мкг/кг на курс в виде однократной внутривенной инфузии или дробного внутримышечного введения в течение 2-5 дней;
при концентрации гемоглобина в крови больного менее 100 г/л, доза препарата составляет 25-40 мкг/кг на курс, при гемоглобине 100 г/л — 40-80-100 мкг/курс;
повторные курсы анти-D-иммуноглобулина с интервалом 3-8 нед для поддержания количества тромбоцитов более 30 000/мм3.
Количество тромбоцитов и уровень гемоглобина контролируют на 3-4-е сут после начала воздействия. Отсутствие гематологического ответа на первый курс анти-D-иммуноглобулина не является противопоказанием для проведения второго курса, так как 25% пациентов, не ответивших на лечение, достигают гематологического ответа при повторном введении препарата. Среди пациентов, резистентных к кортикостероидам 64% достигают ремиссии после курса анти-D-иммуноглобулина. Значимое увеличение количества тромбоцитов отмечают через 48 ч после введения препарата, поэтому его не рекомендуют применять в угрожающих жизни ситуациях.
гриппоподобный синдром (температура, озноб, головная боль);
падение уровня гемоглобина и гематокрита вследствие гемолиза, подтверждаемого положительной пробой Кумбса.
Случаев инфицирования вирусами при применении препаратов анти-D-иммуноглобулина не зарегистрировано. Острые аллергические реакции маловероятны. Описаны IgE-опосредованные и вызванные иммунными комплексами аллергические реакции. У пациентов с дефицитом IgA аллергические реакции не описаны. Гемолиз обычно внесосудистый. В описанных немногочисленных случаях внутрисосудистого гемолиза хроническая почечная недостаточность не развивалась. Среднее снижение уровня гемоглобина составляет 5-20 г/л и бывает кратковременным (1-2 нед).
Применение анти-RhD-иммуноглобулина безопасно, удобно, дёшево и эффективно у 79-90% пациентов с хронической идиопатической тромбоцитопенической пурпурjq, причём у детей больше, чем у взрослых.
Интерферон-альфа-2b может применяться при лечении пациентов с хронической идиопатической тромбоцитопенической пурпурой, резистентных к кортикостероидами. Гематологический ответ достигается у 72% пациентов, в том числе у 33% не ответивших на кортикостероиды.
Механизм действия при идиопатической тромбоцитопенической пурпуре: подавление продукции аутоантител за счёт ингибирующего эффекта интерферон-альфа-2b на выработку иммуноглобулинов В-лимфоцитами.
Режим введения: 0,5-2×106 ЕД, в зависимости от возраста, подкожно или внутримышечно 3 раза в неделю (обычно понедельник-среда-пятница) в течение 1-1,5 мес. Гематологический ответ отмечают на 7-39-й день от начала лечения. При отсутствии гематологического ответа лечение прекращают, при наличии — продолжают до 3 мес. После окончания курса препарат либо отменяют, либо назначают в поддерживающей дозе с уменьшением кратности введения до 1-2 раз в неделю (подбирают индивидуально). При рецидиве заболевания (обычно через 2-8 нед после окончания применения) показан повторный курс, который имеет такую же эффективность. Длительность поддерживающего лечения интерферон-альфа-2b при наличии гематологического ответа не определена.
Побочные эффекты: гриппоподобный синдром (лихорадка, озноб, головная боль, миалгии), боль и покраснение в месте инъекции, печёночная токсичность, угнетение миелопоэза (при дозах, превышающих 2×106 ЕД), депрессии у подростков.
Для уменьшения выраженности побочных эффектов (гриппоподобный синдром) перед первыми введениями препарата рекомендуют профилактическое назначение парацетамола.
Даназол представляет собой синтетический андроген со слабой вирилизирующей активностью и иммуномодулирующим действием (восстановление функции Т-супрессоров).
Механизм действия даназола при идиопатической тромбоцитопенической пурпуре:
модулирует экспрессию Fc-гамма-рецепторов на мононуклеарных фагоцитах и препятствует деструкции нагруженных антителами тромбоцитов;
подавляет продукцию аутоантител;
обладает синергизмом с кортикостероидами, способствует освобождению стероидов от связи с глобулинами и увеличивает их доступ к тканям.
10-20 мг/кг в сутки внутрь (300-400 мг/м2) в 2-3 приёма в течение 3 мес и более для стабилизации эффекта.
акне, гирсутизм, увеличение веса, печёночная токсичность.
Гематологический ответ происходит примерно у половины детей с хронической идиопатической тромбоцитопенической пурпурой, в том числе у пациентов, резистентных к кортикостероидам. Эффективность лечения увеличивается после проведения спленэктомии. В большинстве случаев ответ неполный.
Применяют винкристин в дозе 0,02 мг/кг (максимально 2 мг) внутривенно, еженедельно, всего 4 введения.
Винбластин применяют в дозе 0,1 мг/кг (максимально 10 мг) внутривенно, еженедельно, всего 4 введения.
В случае эффективности воздействия винкристина и винбластина происходит быстрое увеличение количества тромбоцитов, часто до нормального уровня. Большинство детей нуждаются в повторных введениях препарата с 2-3-недельным интервалом для поддержания безопасного количества тромбоцитов. При отсутствии ответа на лечение в течение 4 нед дальнейшее использование препаратов не показано.
Полная гематологическая ремиссия в течение 0,5-4 лет описана приблизительно у 10% пациентов, транзиторный ответ — у половины.
Побочные эффекты: периферическая нейропатия, лейкопения, алопеция, запоры, некрозы при попадании в подкожную клетчатку.
Циклофосфамид (циклофосфан) применяют в качестве иммунодепрессанта. Гематологический ответ у пациентов с хронической идиопатической тромбоцитопенической пурпурой во время лечения достигает 60-80% и сохраняется дольше по сравнению с другими препаратами. Полный гематологический ответ после окончания лечения происходит в 20-40% случаев. Лучшие результаты показаны у спленэктомированных пациентов с малой длительностью заболевания.
Механизм действия — подавление пролиферации лимфоцитарных клонов, участвующих в иммунном ответе.
Режим введения: 1-2 мк/кг в сутки, принимают внутрь. Гематологический ответ достигают через 2-10 нед от начала курса.
Побочные эффекты: угнетение миелопоэза, алопеция, печёночная токсичность, геморрагический цистит, лейкемия (отдалённое осложнение).
У пациентов с аутоиммунными заболеваниями азатиоприн применяют в качестве иммунодепрессанта. Увеличение числа тромбоцитов отмечают у 50% пациентов с идиопатической тромбоцитопенической пурпурой, а полный гематологический ответ — у 10-20%.
Режим введения: 1-5 мг/кг в сутки (200-400 мг). До достижения максимального ответа продолжительность лечения может составлять 3-6 мес. Так как после окончания применения препарата заболевание рецидивирует, необходимо поддерживающее лечение.
Побочные эффекты: анорексия, тошнота, рвота, умеренная нейтропения, лимфомы (отдалённое осложнение).
Преимущество данного препарата у детей заключается в более низкой частоте развития опухолей по сравнению с циклофосфамидом (циклофосфаном).
Циклоспорин (циклоспорин А) — нестероидный иммуносупрессант, вызывающий угнетение клеточного иммунитета. Препарат действует на активированные Т-лимфоциты-эффекторы, подавляя продукцию цитокинов (интерлейкина-2, интерферона-гамма, фактора некроза опухоли).
Режим введения: принимают внутрь в дозе 5 мг/кг в сутки в течение нескольких месяцев. Гематологический ответ наблюдается через 2-4 нед от начала приёма в виде некоторой стабилизации клинико-гематологических показателей, снижения уровня антитромбоцитарных антител. Рецидивы заболевания возникают сразу после отмены препарата.
Побочные эффекты: гипомагнийемия, гипертензия, печёночная и почечная токсичность, вторичные опухоли (отдалённые осложнения). Серьёзность побочных эффектов и неубедительный эффект, вызываемый применением циклоспорина, делает его применение при идиопатической тромбоцитопенической пурпуре нежелательным.
Проведение трансфузии тромбоцитов показано в случае развития неврологической симптоматики, указывающей на возможность внутричерепных кровоизлияний, а также при проведении оперативных вмешательств у пациентов с глубокой тромбоцитопенией, резистентных к консервативному лечению. Хотя продолжительность жизни кровяных пластинок невелика, трансфузии тромбоцитов могут оказать временный гемостатический эффект. При этом боязнь увеличения продолжительности идиопатической тромбоцитопенической пурпуры вследствие риска сенсибилизации только теоретическая. Трансфузии тромбоцитов применяют у пациентов с идиопатической тромбоцитопенической пурпурой высокого риска с положительным клиническим эффектом. Переливание тромбоконцентрата осуществляют дробно по 1-2 дозы в час или по 6-8 доз каждые 4-6 ч до достижения клинико-гематологического ответа. Эффект трансфузии усиливают предварительным введением ВВИГ.
В случае отсутствия эффекта от консервативного лечения тромбоцитопенической пурпуры, наличия глубокой тромбоцитопении, геморрагического синдрома и угрозы развития опасных для жизни кровотечений, больным показано проведение спленэктомии. Вопрос об операции решают индивидуально при каждом случае.
тяжёлая острая идиопатической тромбоцитопенической пурпура с наличием жизнеугрожающих кровотечений при отсутствии ответа на медикаментозное воздействие;
длительность заболевания больше 12 мес, тромбоцитопения менее 10 000/мм3 и кровотечения в анамнезе;
хроническая идиопатической тромбоцитопенической пурпура с признаками кровоточивости и постоянным уровнем тромбоцитов менее 30 000/мм3 при отсутствии ответа на лечение в течение нескольких лет.
У ведущих активный образ жизни, часто травмирующихся пациентов спленэктомия может быть произведена ранее.
Вследствие риска развития после операции генерализованных инфекций, сплен-эктомию проводят только при наличии чётких показаний. Операция редко бывает необходима в течение 2 лет с момента постановки диагноза, так как тромбоцитопения хорошо переносится и легко контролируется благодаря применению кортикостероидов и ВВИГ. Спонтанное восстановление количества тромбоцитов может наступить через 4-5 лет, следовательно, необходим очень осторожный подход к выполнению операции. У детей с хронической идиопатической тромбоцитопенической пурпурой случаи спонтанной ремиссии отмечают в 10-30% случаев через несколько месяцев или лет после постановки диагноза, у взрослых очень редко.
Подготовка к спленэктомии включает в себя назначение кортикостероидов, ВВИГ или анти-D-иммуноглобулина. Кортикостероиды назначают в полной дозе за день до, в день операции и в течение нескольких дней после её проведения, так как большинство пациентов имеют надпочечниковую недостаточность вследствие предыдущего их применения. При появлении активного кровотечения непосредственно перед операцией может потребоваться трансфузия тромбоцитов и эритромассы, а также введение метилпреднизолона (солюмедрола) в дозе 500 мг/м2 в сутки. Перед плановой операцией обязательно ультразвуковое исследование органов брюшной полости для выявления дополнительных селезёнок (15% случаев), а в спорных случаях — радиоизотопное скенирование.
Полное и длительное восстановление количества тромбоцитов после спленэктомии бывает приблизительно у 50% пациентов. Хорошим прогностическим признаком считается ответ на приём кортикостероидов и ВВИГ до операции (эффективность спленэктомии в 80-90%), а также отсутствие антитромбоцитарных антител после её проведения. 25% детей, перенёсших спленэктомию, не достигают клинико-гематологического ответа и нуждаются в дальнейшем лечении.
Предпочтительно выполнение операции лапароскопическим методом (возможно у 90% пациентов) позволяет уменьшить объём оперативного вмешательства, уровень операционной кровопотери, обеспечить пациенту более быстрое возвращение к активной жизни и сократить сроки госпитализации. Послеоперационный рубец при этом имеет длину около 1 см и не вызывает дискомфорта.
Случаи смертельного исхода от бактериальных инфекций в позднем послеоперационном периоде, особенно у детей, перенесших спленэктомию до 5 лет, составляет 1:300 больных в год. Большинство из них происходит в течение 2 лет после операции. К основным причинам относят пневмококковую и менингококковую инфекции, развивающиеся по типу молниеносного сепсиса с ДВС крови и кровоизлияниями в надпочечники. Поэтому не позднее, чем за две недели до операции рекомендовано введение пневмококковой, менингококковой и вакцины против Haemophilus influenzae и длительный, не менее 2 лет, профилактический приём бензилпенициллина после спленэктомии. Некоторые авторы предлагают ограничиться введением бициллина-5 (бензатина бензилпенициллин + бензилпенициллин прокаин) ежемесячно в течение 6 мес после операции.
Возможной альтернативой спленэктомии является эндоваскулярная окклюзия селезёнки, проведение которой возможно и у пациентов с глубокой тромбоцитопенией. Для достижения стойкого клинико-гематологического эффекта необходимо поэтапное выключение 90-95% паренхимы органа. Иммунологическая реактивность организма после проведения эндоваскулярной окклюзии селезёнки сохраняется за счёт функционирования 2-5% селезёночной ткани, сохраняющих кровоснабжение за счёт коллатералей, что важно в педиатрической практике. Возможно использование проксимальной эндоваскулярной окклюзии селезёнки за несколько дней до спленэктомии с целью уменьшения риска операции.
У пациентов с персистирующей тромбоцитопенией и жизнеугрожающими кровотечениями, несмотря на медикаментозное вмешательство и проведение спленэктомии, возможно использование реинфузии плазмы, пропущенной через колонки с протеином А для быстрого удаления антитромбоцитарных антител. У пациентов с тяжёлой идиопатической тромбоцитопенической пурпурой при этом ускоряется элиминация циркулирующего антитромбоцитарного фактора.
Лечение детей с жизнеугрожающими кровотечениями:
солюмедрол 500 мг/м2 в сутки внутривенно в 3 введения;
внутривенно иммуноглобулин 2 г/кг на курс;
Данные мероприятия могут быть произведены по отдельности или в комбинации в зависимости от тяжести и ответа на лечение.
Прогноз у детей с идиопатической тромбоцитопенической пурпурой
У 70-80% пациентов ремиссия наступает в течение 6 мес, у 50% — в течение 1 мес от начала заболевания.
Наступление спонтанной ремиссии после года заболевания нехарактерно, но может быть отмечено даже через несколько лет.
Прогноз заболевания не зависит от пола, тяжести инициального состояния и обнаружения эозинофилии в костном мозге.
При выявлении причины идиопатической тромбоцитопенической пурпуры прогноз зависит от её устранения.
Состояние приблизительно 50-60% пациентов с хронической идиопатической тромбоцитопенической пурпурой стабилизируется без какого-либо лечения и спленэктомии
источник