В диагностике вирусных болезней человека и животных широко применяют методы, основанные на использовании ферментов в качестве метки антигенов и антител. Это группа методов носит название иммуноферментного анализа.
ИФА применяют в двух вариантах: гистохимическом и твердофазном.
Гистохимический вариант ИФА, или иммунопероксидазную реакцию, используют редко. Он аналогичен методу иммунофлуоресценции, но отличается тем, что для постановки реакции используют антитела, меченные не флуорохромом, а ферментом.
Для метки антител обычно применяют ферменты: пероксидазу хрена (чаще), щелочную фосфатазу, галактозидазу и др.
Таким образом, в комплекс антиген + антитело включаются антитела, меченные ферментом, и для обнаружения этого комплекса вносят субстрат (фермент-чувствительное вещество), которое под действием фермента разлагается, образуя цветной продукт ферментативной реакции, хорошо видимый в световом микроскопе.
В качестве субстрата используют ортофенилендиамин, 5-аминосалициловую кислоту или бензидин. К ним добавляют пероксид водорода (Н2O2).
Материалом для выявления вирусных антигенов при этом варианте могут быть: мазки; отпечатки различных органов; парафиновые срезы; культуры клеток. При этом можно использовать как прямой, так и непрямой метод.
Прямой метод. На фиксированный препарат наносят конъюгат (антитела к предполагаемому вирусу, меченные ферментом), выдерживают при 37 °С в течение 1—2 ч во влажной камере, затем препарат отмывают физиологическим раствором от несвязанного конъюгата, подсушивают на воздухе, наносят несколько капель раствора субстрата, инкубируют 5— 10 мин и промывают физиологическим раствором. Затем споласкивают дистиллированной водой, и результат учитывают с помощью светового микроскопа. В положительных случаях, т. е. при наличии антигена в исследуемом материале, видны или диффузное желто-коричневое окрашивание, или гранулы коричнево-черного цвета. В контрольных препаратах окрашивания не обнаруживают.
Непрямой метод. На фиксированный препарат наносят специфическую к предполагаемому вирусу сыворотку, выдерживают при 37 °С в течение 1—2 ч во влажной камере, промывают физиологическим раствором, подсушивают на воздухе и наносят меченную ферментом антивидовую сыворотку, выдерживают при 37 °С 1—6 ч. Далее следует процедура, как в прямом методе.
Твердофазный иммуноферментный анализ (ТФИФА, РЭМА — реакция энзиммеченых антител, ELISA — enzyme-linked immunosorbent assay) в последние годы широко используют в биологии, в том числе и в вирусологии. Характерная особенность метода в том, что один из компонентов реакции (антиген или антитело) фиксируют на твердом носителе. В качестве носителей используют полистироловые микропанели, шарики, палочки и др.
Этим методом можно обнаружить и идентифицировать антиген, а также выявить антитела и определить их титр в сыворотках крови.
Существует много вариантов метода. Наиболее часто для обнаружения антигенов используют прямой метод («сандвич»-метод). Для этого специфические к предполагаемому антигену антитела фиксируют в лунках микропанелей, в которые вносят исследуемый антиген и выдерживают при 37 °С 1—2 ч. Затем микропанели промывают буферным раствором и вносят в лунки меченные ферментом к предполагаемому антигену антитела, выдерживают при 37 °С 1—2 ч, промывают микропанели, вносят раствор субстрата и выдерживают 5—30 мин. Реакцию останавливают добавлением раствора серной кислоты и учитывают визуально по разности в окраске опытных и контрольных образцов или при помощи спектрофотометрии. Положительные образцы имеют окраску от желтой до оранжево-коричневой.
Обнаружение и определение титра антител проводят непрямым твердофазным методом.
В крупных диагностических лабораториях применяют полностью автоматизированные установки для проведения твердофазного ИФА, позволяющие анализировать от 1000 до 4000 проб ежедневно.
Достоинства ИФА: высокая чувствительность; специфичность; простота техники постановки; требуется минимальное количество компонентов; не требуется специальных приборов; оценку можно проводить визуально; возможность автоматизации, что позволяет его применять для массовых исследований; исследуемые сыворотки не требуют предварительной обработки. Это — экспресс-метод диагностики, так как в течение нескольких часов можно получить ответ.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
источник
Наиболее часто на практике используются три варианта твердофазного иммуноанализа — непрямой иммуноанализ, прямой иммуноанализ и иммуноанализ сэндвич-типа. Различия между этими типами иммуноанализа заключаются в следующем. В непрямом варианте иммуноанализа на первой стадии на поверхность лунок полистирольного планшета сорбируется антиген. После удаления несвязавшихся молекул антигена добавляется образец, содержащий специфичные к данному антигену антитела. Образовавшиеся комплексы антиген-антитело детектируются с помощью анти-видовых антител, конъюгированных с какой-либо меткой (Рис. 1А). В прямом варианте иммунанализа детекция сорбированного антигена осуществляется непосредственно с помощью специфичных антител, конъюгированных с меткой (Рис. 1Б). В иммуноанализе сэндвич-типа на первой стадии на поверхность планшета сорбируется не антиген, а антитела, специфичные к исследуемому антигену (антитела подложки). После удаления не связавшихся молекул антител добавляется образец, содержащий антиген. Для детекции образовавшегося комплекса антитела подложки-антиген добавляются вторые антитела, специфичные к другому, пространственно удаленному, эпитопу антигена, конъюгированные с какой-либо меткой (Рис. 1В). Использование в иммуноанализе сэндвич-типа антител, специфичных к двум различным эпитопам антигена, позволяет добиться высокой чувствительности и специфичности при определении антигена даже в таких гетерогенных образцах, как плазма крови.
Рис. 1. Принцип непрямого (А), прямого (Б) и иммуноанализа сэндвич-типа (В)
Метод непрямого иммуноанализа характеризуется осуществлением 3-х стадийного процесса, на первой стадии которого антиген адсорбируется на специально подготовленном пластике, на второй с антигеном взаимодействуют специфичные к нему антитела, а на третьей в систему вводят антивидовые антитела, конъюгированные с ферментом, обуславливающим проведение индикаторной ферментативной реакции. В данной методике в качестве фермента используют пероксидазу хрена. Реакция проводится в специальных 96-луночных планшетах.
Влунки 96-луночного планшета для проведения иммуноанализа сорбируют антиген 0,1-0,5 мкг в лунку в 100 мкл фосфатно-солевого буфера (PBS). Инкубация проводится в течение 30 минут при комнатной температуре и встряхивании на горизонтальном шейкере для планшетов. Отмывка (2-х кратная) несвязавшихся молекул антигена осуществляется фосфатно-солевым буфером содержащим 0.1% Tween-20 (PBSТ).
Для блокирования мест неспецифического связывания лунки планшета заполняют PBST и инкубируют в течение 10-15 минут при комнатной температуре.
Раститровку можно проводить как по горизонтальным, так и по вертикальным рядам планшета. Необходимо отметить, что раститровка антител проводится в том случае, если необходимо подобрать оптимальную концентрацию антител или определить титр. В том случае, если оптимальная концентрация и/или титр антител определены, то используют рекомендованное для данных конкретных антител разведение.
При раститровке в первую лунку ряда вносят готовое разведение антител — в среднем 1-10 мкг в лунку, далее проводят последовательное разведение антител в лунках. Инкубацию со специфичными антителами проводят в течение 30 минут при комнатной температуре и встряхивании на горизонтальном шейкере для планшетов. Отмывка осуществляется с помощью PBSТ 3 раза.
В качестве детекторных (вторичных) антител используются антивидовые поликлональные антитела, конъюгированные с пероксидазой хрена. Чаще всего используются козьи или кроличьи антитела, специфичные к целой молекуле или к Fc-фрагментам специфичныхантител. Концентрация детекторных антител как правило указывается производителем в виде разведения исходного раствора (например, 1:1000). Инкубация со вторичными антителами проводится в течение 30 минут при комнатной температуре и встряхивании на горизонтальном шейкере для планшетов. Отмывка осуществляется с помощью PBSТ 5-6 раз.
Пероксидаза хрена катализирует реакцию окисления субстрата перекисью водорода. В качестве субстрата пероксидазы хрена используется о-фенилендиамин (ОФД). В результате прохождения реакции образуется окрашенный продукт окисления ОФД.
Раствор субстрата: К 10 мл субстратного буфера (0,1 М Na-цитратный буфер, рН 4,5) добавить 0,01 мл 30% перекиси водорода и 0,2 мл 50х раствора ОФД (340 мг ОФД в 10 мл этилового спирта; хранить при –20°С).
Инкубация проводится в течение 10 минут при комнатной температуре и встряхивании на горизонтальном шейкере для планшетов.
Перед измерением оптической плотности проводят остановку цветной реакции с помощью 0,5 М H2SO4. В лунки с рабочим раствором ОФД после инкубации вносят по 50 мкл раствора 0,5 М серной кислоты. После этого можно сразу приступать к измерению оптической плотности.
Оптическая плотность раствора окрашенного продукта измеряется при λ=490 нм с использованием планшетного спектрофотометра.
Методика прямого иммуноанализа имеет лишь небольшие отличия посравнению с методикой непрямого иммуноанализа. Так, стадии I и II одинаковы в обоих типах анализа. Отличие заключается в том, что в прямом варианте иммуноанализа на стадии III используют специфичные антитела, конъюгированные с ферментной меткой. При необходимости также можно проводить раститровку специфичных антител, конъюгированных с ферментной меткой, аналогично описанному ранее для неконъюгированных антител. Стадия IV опускается, а дальнейшие стадии (V-VII) проводятся аналогично описанному выше для непрямого варианта иммуноанализа.
Рис. 2. Схематическое изображение иммуноанализа «сэндвич»-типа. АТп — антитело подложки, АТд — детекторное антитело, АГ — антиген, М — метка, ковалентно связанная с детекторным антителом, П — подложка, на которую сорбируется антитело подложки.
В данном варианте иммуноанализа (Рис.2) используется пара антител, специфичных к пространственно удаленным эпитопам исследуемого антигена.
В лунки 96-луночного планшета для проведения иммуноанализа сорбируют антитела подложки 1-2 мкг в лунку в 100 мкл фосфатно-солевого буфера (PBS). Инкубация проводится в течение 30 минут при комнатной температуре и встряхивании на горизонтальном шейкере для планшетов. Отмывка (2-х кратная) несвязавшихся молекул антигена осуществляется фосфатно-солевым буфером содержащим 0,1% Tween-20 (PBSТ).
Для блокирования мест неспецифичногосвязывания лунки планшета заполняют PBST и инкубируют в течение 10-15 минут при комнатной температуре.
В лунки планшета с преадсорбироваными антителами вносят по 50 мкл исследуемого раствора либо стандартных разведений антигена. Разведения антигена должны быть приготовлены на основе PBST, поскольку Tween-20 снижает неспецифичное связывание белковых молекул друг с другом и с поверхностью планшета. И исследуемый раствор, и стандартные разведения антигена вносят попарно (либо по 3 повторности), используя по две (три) лунки на каждое разведение белка. Инкубацию проводят при комнатной температуре в течение 30 мин при постоянном перемешивании. Отмывка осуществляется раствором PBST 3 раза.
В лунки планшета вносят по 100 мкл раствора специфичныхантител, конъюгированных с ферментной меткой. Оптимальная концентрация конъюгированных антител как правило указывается производителем (обычно используют концентрацию 2-4 мкг/мл). Инкубация с антителами, содержащими ферментную метку, проводится в течение 30 минут при комнатной температуре и встряхивании на горизонтальном шейкере для планшетов. Отмывка осуществляется с помощью PBSТ 5-6 раз.
В лунки вносят по 100 мкл раствора субстрата и инкубируют в течение 10 мин при комнатной температуре и постоянном перемешивании.
Перед измерением оптической плотности проводят остановку цветной реакции с помощью 0,5 М H2SO4. В лунки с рабочим раствором ОФД после инкубации вносят по 50 мкл раствора 0,5 М серной кислоты. После этого можно сразу приступать к измерению оптической плотности.
Оптическая плотность раствора окрашенного продукта измеряется при λ=490 нм с использованием планшетного спектрофотометра.
Иммунофериентный анализ (ИФА)
Иммунофериентный анализ, или метод (ИФА) — выявление антигенов с помощью соответствующих им антител, конъюгированных с ферментом-меткой (пероксидазой хрена, бета-галактозидазной и или щелочной фосфатазой). После соединения антигена с меченой ферментом иммунной сывороткой в смесь добавляют субстрат/хромоген. Субстрат расщепляется ферментом и изменяется цвет продукта реакции — интенсивность окраски прямо пропорциональна количеству связавшихся молекул антигена и антител.
ИФА применяют для диагностики вирусных, бактериальных и паразитарных болезней, в частности для диагностики сальмонеллеза, микоплазмозов и др., а также определения гормонов, ферментов, лекарственных препаратов и других биологически активных веществ, содержащихся в исследуемом материале в минорных концентрациях — 1010 — 1012 г/л.
Твердофазный ИФА — вариант теста, когда один из компонентов иммунной -реакции (антиген  или антитело или антитело  ) сорбирован на твердом носителе, напр., в лунках планшеток из полистирола. ) сорбирован на твердом носителе, напр., в лунках планшеток из полистирола. Компоненты выявляют добавлением меченых антител или антигенов. При положительном результате изменяется цвет хромогена. Каждый раз после добавления очередного компонента из лунок удаляют не связавшиеся реагенты путем промывания. II. При определении антигена в лунки с сорбированными антителами вносят антиген (напр., сыворотку крови с искомым антигеном), добавляют диагностическую сыворотку против него и вторичные антитела (против диагностической сыворотки), меченные ферментом, а затем субстрат/хромоген для фермента. |
|
 |
Конкурентный ИФА для определения антител: искомые антитела и меченые ферментом антитела конкурируют друг с другом за антигены, сорбированные на твердой фазе.
Определение пероксидазной метки с помощью усиленной хемилюминесценции. Разработка быстрых методов иммуноферментного анализа, выполняемых с помощью портативных приборов. Синергизм и степень усиления. Интенсивность и продолжительность излучения света.
Иммуноферментный анализ с усиленной хемилюминесценцией
Определять ферментную метку количественно можно различными методами, например, с помощью колориметрии, флуориметрии, радиометрии и потенциометрии.
Недавно для этой цели стали применять также хемилюминесценцию или биолюминесценцию. Ферментные метки, которые можно определять с помощью реакций, сопровождающихся излучением света, представлены в табл. 1. В общем случае чувствительность хеми- и биолюминесцентных методов определения очень высока, а если использовать еще и усиление сигнала от ферментной метки, то чувствительность соответствующих методик иммуноанализа должна быть чрезвычайно высокой.
Возможности биолюминесцентного метода недавно были продемонстрированы на примере определения Д-галак-тозидазы. С помощью сопряженной реакции галактозо-дегидроге-наза АОН:РМ№оксидоредуктаза-бактериальная люцифераза удалось обнаружить 2 * 10″22 моля /3-галактозидазы.
В качестве метки в иммуноферментном анализе широко применяют пероксидазу хрена, методы получения и стабилизации конъюгатов с которой хорошо изучены.
Пероксидазу хрена чаще всего определяют колориметрически, но для этой цели можно также использовать различные хеми- и биолюминесцентные реакции.
Детально изучено определение пероксидазы с помощью хеми-люминесцентной реакции в системе люминол — пероксид водорода, усиленной фенольными соединениями.
Такой подход к определению активности фермента имеет ряд преимуществ в сравнении с другими методами определения; его основные характеристики перечислены в табл. 2.
Усилители. Способностью усиливать излучение света в реакции окисления люминала пероксидом водорода, катализируемой пероксидазой, обладают различные соединения, в том числе 6-гидроксибензотиазолы, например люциферин, фенолы, нафтолы и амины.
На рис. 1 изображены структуры представителей веществ каждого класса. Степень усиления излучения света зависит от концентрации реагентов. Типичная зависимость интенсивности свечения от концентрации усилителя в реакции люмино-ла с пероксидом водорода, катализируемой пероксидазой и усиливаемой 6-гидрокси-бензотиазолом, представлена на рис.
Синергизм и степень усиления. В системе перокси-даза — люминал — пероксид водорода наблюдается эффект сине-
ргизма, о чем свидетельствуют данные, приведенные в табл. 3. На степень усиления влияют многие факторы; тем не менее достигнуто усиление излучения света более чем в 500 раз.
В присутствии некоторых усилителей фоновое излучение света в системе люминол — пероксид водорода уменьшается. При определении активности пероксидазы это позволяет на несколько порядков повысить отношение сигнала к шуму только, за счет применения таких усилителей.
Усиление свечения характерно для различных циклических диацилгидразидов, при действии окислителей в присутствии пероксндазы. Усиление не наблюдается в случае некоторых веществ с пероксидазной активностью, например гемоглобина, который катализирует только колориметрические реакции.
Этот факт свидетельствует о более высокой специфичности усиленного хемилюминесцентного анализа по сравнению с колориметрическими методами. Спектры излучаемого света практически одинаковы в усиленных и неусиленных реакциях. Это «говорит о том, что сам по себе усилитель не излучает свет.
В отсутствие усилителей хемилюминесценция в системе пе-роксидаза-люминол-пероксид, по-видимому, лимитируется относительно медленной реакцией пероксндазы, находящейся в форме так называемого соединения II, с люминолом, в результате которой образуются люминольные радикалы и регенерируется пероксидаза.
Усилители, способные быстро реагировать с таким соединением, могут увеличивать излучение света, ускоряя превращение соединения II в активную пероксидазу.
Продукты превращения усилителя могут затем быстро реагировать с люминолом, образуя дополнительные люминольные радикалы и тем самым способствуя дальнейшему усилению излучения света. Усилители могут воздействовать и на неактивные пероксидазные интермедиа™, например, на соединение III.
Важным фактором в определении пероксидазной активности с помощью усиленной хемилюминесценции является химическая чистота циклических диацилгидразидов.
Изучение различных образцов люминола показало, что примеси отрицательно влияют на излучение света. В результате фотохимических и термических процессов люминол частично разлагается, а образующиеся примеси влияют на кинетику и интенсивность излучения света.
В табл. 4 представлены результаты сравнения чистоты и свойств некоторых поступающих в продажу препаратов люминола, а также натриевой соли люминола, очищенной перекристаллизацией из раствора гидроксида натрия.
2. УСИЛЕННЫЙ ХЕМИЛЮМИНЕСЦЕНТНЫЙ ИММУНОАНАЛИЗ
Усиленный хемилюминесцентный иммуноанализ с пероксидазой в качестве ферментной метки применяли для определения многих соединений. Ряд примеров приведен в табл. 5. В этих иммуноанализах применяли конкурентные методы и методы с экстракцией иммунного комплекса, а также большинство обычно используемых твердых носителей.
а Отношение сигнал/фон при хемилюминесцентном определении пероксидазы хрена с усилением л-иодфенолом; 6 ТСХ — тонкослойная хроматография.
рис. 3 представлена схема определения фолликулстимулирующего гормона. В этом методе предел обнаружения FSH на микротитровальном планшете равен около 0,01 м.ед. Метод характеризуется отличной воспроизводимостью как в одном анализе, так и между анализами.
Метод усиленной хемилюминесценции успешно применялся также для обнаружения пероксидазной метки при изучении гибридизации ДНК.
метод количественного определения с использованием фотометра для планшетов и качественного анализа с применением фотографического обнаружения с чувствительностью несколько пикограмм.
В настоящее время промышленность выпускает несколько типов люминометров, пригодных для измерения света, излучаемого в реакциях усиленной хемилюминесценции.
Некоторые из этих люминометров были модернизированы специально для усиленного хемилюминесцентного анализа. Интенсивность и продолжительность излучения света в реакциях с усилением люминесценции облегчили создание простых люминометров, в которых в качестве детекторов используются кремниевые’ фотодиоды или высокочувствительная фотографическая пленка.
Такие люминометры относительно недороги, портативны, и поэтому их можно применять и вне лабораторий. В настоящее время фирма MAST Immunosystems выпускает специальные фотокамеры для хемилюминесцентной детекции в методе ИФА аллергенспецифического иммуноглобулина Е. Можно предположить, что в будущем будут созданы наборы с фотографической регистрацией результатов ИФА и других соединений, определение которых необходимо проводить в клиниках, больницах или на дому.
Выпускаемые приборы и наборы реагентов.
Наборы для усиленного хемилюминесцентного иммуноферментного анализа и соответствующие приборы сейчас выпускаются под названием Amerlite фирмой Amersham International pic.
Анализ выполняется на стрипах микротитровальных планшетов белого цвета, а измерение люминесценции быстро и автоматически выполняет специальный люминометр для микропланшетов.
В настоящее время выпускаются наборы для определения тироидстимулирующего гормона, хориогонадотропина человека, карциноэмбрионального антигена, альфа-фетопротеина, тироксина, трииодтиронина и для определения индекса свободного тироксина. Эти анализы имеют высокую чувст витальность и прекрасную воспроизводимость.
Определение пероксидазной метки с помощью усиленной хемилюминесценции отличается высокой чувствительностью, специфичностью и простотой и может быть положено в основу при разработке удобных и быстрых методов иммуноферментного анализа, выполняемых с помощью недорогих портативных приборов.
Принципы иммуноферментного анализа, основные виды ИФА, применение в диагностике
Методы иммунного анализа в медицинской практике, взаимодействие антигена и антитела в его основе.
Виды иммунного анализа в зависимости от типа метки и условий постановки теста. Характеристика компонентов, используемых в иммуноферментном анализе.
реферат [373,7K], добавлен 07.11.2011
Серологические реакции как реакции между антигенами и антителами in vitro.
Классификация серологических реакций в зависимости от характера и физического состояния антигена. Реакция преципитации в геле по Оухтерлони. Мктод иммуноферментного анализа.
презентация [2,3 M], добавлен 03.06.2015
Спектральный анализ электрокардиограммы
Средства регистрации и анализа электрокардиограмм. Сравнение аналоговой и цифровой обработки сигналов.
Исследование электрокардиосигналов, полученных с помощью электрокардиографа сверхвысокого разрешения. Возможности анализа с помощью пакета MatLab.
реферат [1,7 M], добавлен 09.12.2011
Применение излучения в медицине
Лечение бронхиальной астмы инфракрасным излучением. Искусственные источники ультрафиолетового (УФ) излучения в медицине. Озонные и безозонные бактерицидные лампы.
Дезинфекция питьевой воды с помощью УФ-излучения. Рентгенодиагностика, устройство аппарата.
реферат [25,4 K], добавлен 27.08.2009
Акромегалия — заболевание, связанное с усиленной продукцией гормона роста (соматотропного гормона). Клиническая картина заболевания. Характерный лабораторный показатель акромегалии при диагностике. Проба с тиролиберином. Лечение рентгеновским облучением.
презентация [2,9 M], добавлен 03.05.2012
Онкомаркеры в клинической практике
Использование лабораторного анализа для диагностики онкологических заболеваний и послеоперационного мониторинга эффективности операции и химиотерапии.
Определение онкомаркеров методами иммуноферментного, иммунолюминесцентного и радиоиммунного анализа.
реферат [40,9 K], добавлен 09.10.2010
Физико-химических методы анализа лекарственных средств
Классификация физико-химических методов анализа. Молекулярно-абсорбционный спектральный анализ. Законы поглощения излучения. Визуальная колориметрия. Определение концентрации в фотоэлектроколориметрии. Спектрофотометрия лекарственных препаратов.
реферат [492,7 K], добавлен 14.11.2010
Основные направления применения активированной хемилюминесценции
Механизм реакций, сопровождающихся свечением живых организмов, видимым простым глазом.
Использование активированной хемилюминесценции и биолюминесценции как инструмента в медико-биологических исследованиях сыворотки крови, мочи, ликвора и слюны.
курсовая работа [252,3 K], добавлен 25.10.2011
Современные методы диагностики инфекционных болезней
Методы диагностики инфекционных болезней животных.
Полимеразная цепная реакция. Иммуноферментный анализ, его цели. Диагностика инфекций, вызываемых стафилококками, пневмококками и сальмонелезной инфекции. Возбудитель бруцеллеза, его диагностика.
реферат [20,2 K], добавлен 26.12.2013
Понятие люминесценции, ее физическая природа и причины возникновения.
Правило Стокса. Типы люминесценции (фотолюминесенция, хемилюминесенция) и ее выход. Основные законы теплового излучения. Люминесцентный, качественный и количественный анализы веществ.
презентация [1,3 M], добавлен 05.05.2016
Ишемическая болезнь сердца
ИБС включает в себя несколько заболеваний, существенно различающихся по клиническим проявлениям.
В соответствии с рекомендациями комитета экспертов ВОЗ в 1984 году выделили следующие варианты течения ишемической болезни сердца: 1…
Клиника хронических пульпитов: фиброзный, гипертрофический, гангренозный
Острый пульпит гиперемия пульпы серозный ограниченный серозный диффузный гнойный травматический Хронический пульпит фиброзный гангренозный гипертрофический (пролиферативный) Обострение хронического пульпита Хронический…
Хирургическая классификация маститов: I. По причине заболевания: 1. Неспецифический. 2. Специфический. II. По функциональному состоянию МЖ: 1. Лактационный.
2. Нелактационный. III. По течению воспалительного процесса: 1. Острый. 2. Хронический. IV…
Лекарственные растения и лекарственное растительное сырье, применяемые в медицине при мочекаменной болезни
Мочекаменную болезнь можно классифицировать по локализации камней: камни почек и мочеточников (нефроуретеролитиаз), камни мочевого пузыря. Возможно подразделение уролитиаза в соответствии с составом конкрементов…
Согласно отечественной классификации рака гортани (Сборник инструкций Министерства здравоохранения, различают 4 стадии: I стадия: опухоль занимает лишь часть одного отдела гортани не проникает глубже подслизистого слоя…
Новообразования мочевого пузыря в большинстве представлены переходноклеточным раком.
Тем не менее, для предотвращения диагностических ошибок нельзя забывать о том…
Международная гистологическая классификация опухолей пищевода (1990 г.) [2]: Эпителиальные опухоли. Доброкачественные опухоли. Плоскоклеточная папиллома. Вирусная бородавка. Аденома. Злокачественные опухоли.
Раны, классификация ран, механическая антисептика в лечении ран
Существует несколько классификаций ран. По характеру повреждения тканей различают раны: колотые, резаные, рубленые, ушибленные, рваные, укушенные, отравленные, огнестрельные. Колотые раны наносят колющим оружием (штык, игла и др.)…
Растительные источники танина и их применение в медицине
Все танины делят на дубильные вещества группы: гидролизуемые и конденсированные. Гидролизуемые танины при действии разбавленных минеральных кислот, оснований и ферменов танинацилгидролаз распадаются на углеводы и фенолкарбоновые кислоты…
В настоящее время в РФ используется классификация К.А.
Семеновой (1974). -спастическая диплегия — наблюдается преимущественное поражения ног -двойная гемиплегия — спастический тетрапарез, руки поражены несколько больше…
Ревматоидный артрит на протяжении десятилетий остается в центре внимания ревматологической науки, что является отражением большой значимости болезни в общемедицинском и социальном плане…
Роль немедикаментозных методов лечения бронхиальной астмы
Бронхиальная астма (БА) делится на фазу обострения (разгара заболевания) и ремиссии (когда нет практически никаких признаков заболевания).
Вприступе астмы выделяют период предвестников (чихание, насморк и пр….
Роль фельдшера в диагностике, лечении и профилактике столбняка. Противоэпидемические мероприятия в очаге инфекционных заболеваний. Динамика и сравнительный анализ заболеваний столбняка в Сальском районе за период 2013-2014 гг.
В классификационных характеристиках учитываются различные факторы — механизм заражения, распространенность и выраженность судорожного синдрома, особенности клинического течения.
С учетом этих факторов выделяют следующие формы столбняка: 1…
Роль фельдшера в организации и проведении диагностических, лечебных и профилактических мероприятий по борьбе с гипертонической болезнью
За все время изучения болезни была разработана не одна классификация гипертонии: по внешнему виду больного, причинам повышения давления, этиологии, уровню давления и его стабильности, степени поражения органов, характеру течения…
Существует несколько типов классификации сахарного диабета, в основу которых положены клиническая картина, этиология, степень компенсации углеводного обмена, тяжесть лечения, осложнения…

Результаты ИФА могут выдаваться качественно и количественно.
В настоящее время ИФА применяется в следующих ситуациях:
1) Поиск специфических антител к любому инфекционному заболеванию;
2) поиск антигенов каких-либо заболеваний (инфекционных, венерологических);
3) исследование гормонального статуса пациента;
4) обследование на онкомаркеры;
5) обследование на предмет наличия аутоиммунных заболеваний.
1) Высокая специфичность и чувствительность метода ИФА (более 90%).
2) Возможность определения заболевания и отслеживания динамики процесса, то есть сравнивание количества антител в разных временных промежутках.
3) Доступность ИФА-диагностики в любом медицинском учреждении.
1) Выявление иммунного ответа (антител), но не самого возбудителя.
Перед тем, как прояснить суть метода ИФА, кратко разберемся в некоторых понятиях.
Антитела (или иммуноглобулины — Ig) – специфические белки, вырабатываемые B —
лимфоцитами (иммунные клетки) в ответ на попадание в организм какого-либо инфекционного патогена (вирусы, бактерии, грибы и др).
Выделяют иммуноглобулины А (IgA), иммуноглобулины Е (IgE), иммуноглобулины М (IgM), иммуноглобулины G (IgG), иммуноглобулины D (IgD). Отличаются они друг от друга молекулярной формой и массой, периодом полураспада, участием/неучастием в инфекционных процессах, сроками обнаружения с момента инфицирования. Если рассмотреть молекулярный вес, то больше всего он у IgM – это пентамер (950 000 дальтон) в отличие от остальных Ig (от 150 до 200 000 Да), благодаря чему IgM просто не могут проходить через плацентарный барьер.
Поэтому обнаружение IgM у ребенка 1 года жизни всегда является признаком наличия инфекции у плода. В сыворотке крови основная масса иммуноглобулинов представлена именно IgG (75-85%), а самая низкая — IgE (0,003%). В инфекционном процессе непосредственное участие принимают только IgA, M, G. IgE являются признаком аллергических реакций и заболеваний, а IgD – можно обнаружить лишь в ткани лимфоузлов и миндалин, играет роль в формировании местного иммунитета.
Антигены – высокомолекулярные вещества органического происхождения, в частности возбудителей инфекционных и других заболеваний, а также вещества различных измененных клеток, образующихся при той или иной болезни (аутоиммунные заболевания, онкология).
Иммунный комплекс – комплекс антиген-антитело, участвующий в иммунном процессе.
Выделяют несколько разновидностей ИФА (прямой, непрямой, метод блокирования, конкурентный), однако на практике чаще всего используется гетерогенный твердофазный иммунный анализ или ELISA (enzyme linked immunosorbent assay)
Основу иммуноферментного анализа составляет иммунная реакция антигена и антитела с образованием иммунного комплекса: антиген-антитело, в результате которого происходит изменение ферментативной активности специфических меток на поверхности антител.
Простым языком этот процесс можно разделить на несколько этапов:
1) На поверхности лунок планшета доктора, проводящего обследование, находится очищенный антиген определенного возбудителя.
При добавлении биологического материала (сыворотки крови) пациента происходит специфическая реакция между этим антигеном и искомым антителом (иммуноглобулином). Это соединение будет выступать «особым антигеном» в следующем этапе.
2) На данном этапе идет образование ИК (иммунных комплексов) — реакция между «особым антигеном» и конъюгатом (это иммуноглобулин, меченый ферментом пероксидазой). Добавляется особый хромоген. Результатом такой ферментативной реакции является образование окрашенного вещества в лунке планшета, интенсивность окраски которого зависит от количества содержащихся в материале пациента иммуноглобулинов (антител).
3) Далее происходит оценка результата: фотометрирование с помощью многоканального спектрофотометра, сравнение оптической плотности исследуемого материала с оптической плотностью контрольных проб, математическая обработка результатов.
Количество антител у пациента напрямую зависит от высоты оптической плотности данной лунки.
Обычно на практике используют 96 луночные планшеты.
При измерении оптической плотности (ОП) исследуемой жидкости подсчитывается количество (или концентрация) антител в определенной единице объема.
Затем результат сравнивается с контрольным образцом.
Нужно помнить:для каждой тест-системы разрабатываются индивидуальные показатели для учета результатов, показатели нормы и патологии (то есть «референтные значения»). Это нужно учитывать при оценке результатов каждого конкретного исследования. Некорректно интерпретировать результаты одной лаборатории по «референтным значениям» другой лаборатории.
Также некорректно сравнивать результаты разных лабораторий между собой.
При постановке реакций ИФА имеет значение и такое понятие как авидность антител.
Авидность антител – это прочность связи антитела с антигеном и то количество антигена, находящегося во взаимосвязи с иммноглобулинами (антителами).
Авидность имеет большое значение при оценке предполагаемого срока инфицирования, что чрезвычайно важно при диагностике первичного инфицирования у беременных.
Основа теста на авидность антител состоит из обработки иммунного комплекса (антиген-антитело) раствором мочевины с целью разрушения белка.
Высокоавидные связи остаются целыми, а низкоавидные разрушаются. Результат выдается в виде индекса авидности, выражаемого в процентах (%).
1. Инфекционные заболевания
1.1 Вирусные гепатиты А (IgM, G), В антигены -HBsAg, HBeAg, антитела — IgM HBcorAg, Ig суммарные HBcorAg, IgG HBeAg), С (антитела Ig M, G HCV), D (IgM, G), E (Ig M, G) и другие.
1.2 ВИЧ-инфекция (IgG)
1.3 Цитомегаловирусная инфекция (антитела IgM, G)
1.4 Эпштейн-Барр инфекция или мононклеоз (антитела IgM, G к EA, VCA, NA белкам вируса)
1.5 Герпетические инфекции (антитела IgM, G)
1.6 Токсоплазмоз (антитела IgM, G)
1.7 Краснуха (IgM, G)
1.8 Корь (IgM, G), Бруцеллез (IgM, G), Псевдотуберкулез (IgM, G), Салмонеллез (IgM, G), Шигеллез или дизентерия (IgM, G), Аспергиллез (IgM, G), Клещевой энцефалит, Боррелиоз и многие другие.
1.9 Паразитозы (лямблиоз, токсокароз, трихинеллез, описторхоз, эхинококкоз, альвеококкоз и другие), при которых выявляются IgG
1.10 ЗППП (заболевания, передающиеся половым путем) – Микоплазмоз (IgM, G), Уреаплазмоз (IgM, G), Хламидиоз (IgA, M, G), Сифилис (IgG)
1.11 Хеликобактерная инфекция (IgG)
Маркеры аутоиммунных заболеваний и показатели иммунитета человека (общий IgE, общий IgG, общий IgA, общий IgM, общий IgD, секреторный IgA, IgG 2, IgG4, ЦИК-циркулирующие иммунные комплексы, IgA и IgG к глиадину и другие)
3. Онкологичсекие маркеры (ФНО – фактор некроза опухоли, РЭА – раково-эмбриональный антиген, ПСА – простатспецифический антиген, ХГ – хорионический гонадотропин, СА 125, альвеомуцин и многие другие)
Репродуктивные нарушения (эстрадиол, прогестерон, пролактин, тестостерон, АФП- альфафетопротеин, ФСГ – фолликулостимулирующий гормон и другие)
5. Заболевания щитовидной железы (свободные и связанные Т3, Т4, тиреоглобулин, тиреопероксидаза – ТПО, тиреотропный гормон — ТТГ).
Данный список представлен далеко не всеми заболеваниями, которые диагностируются с помощью иммуноферментного анализа.
Наиболее распространенный материал для реакции ИФА – это сыворотка крови пациента, взятая натощак.
Материалом также могут служить спинномозговая жидкость, околоплодные воды, содержимое стекловидного тела, слизь цервикального канала и уретры, мазки.
Кровь забирается натощак. Перед сдачей крови не нужно принимать никакие препараты.
Специфическое лечение (антибактериальное, противовирусное, противопаразитарное и прочее) нужно прекратить не менее, чем за 2 недели до исследования.
Иммуноферментный анализ материала проводится быстро, в течение суток.
Задержки могут быть в разных лабораториях из-за накопления определенного количества сывороток.
При оценке результатов на конкретные инфекции имеет значение класс обнаруженных антител и их количество.
От этого зависит не только вопрос этиологии инфекции (есть она или нет), но и предполагаемая стадия заболевания (острая, хроническая), а также наличие активной инфекции (острой или обострения хронической) на момент обследования.
Самыми ранними антителами являются IgM.
Выявить их можно через 1-3 недели после возможного инфицирования, что характеризует острую фазу инфекционного процесса. Вторая ситуация появления антител IgM – активация (или обострение) хронического процесса. Антитела IgM циркулируют в среднем около 3х месяцев, затем их количество постепенно исчезает. Однако у некоторых пациентов следовые количества IgM могут обнаруживаться в течение 1-2х лет с момента инфицирования.
Современные тест-системы обладают высокой чувствительностью, вследствие чего встречаются неспецифические ложноположительные результаты (нередко у беременных).
Поэтому у данной группы пациентов положительные IgM нужно перепроверять!
Антитела IgA появляются через 2-4 недели после инфицирования, но в количестве, достаточном для обнаружения – через месяц. Сывороточные IgA синтезируются плазматическими клетками селезенки, лимфоузлов и слизистых оболочек,Секреторные IgA концентрируются на слизистых оболочках для выполнения своей защитной функции – участвуют в местном иммунитете.
С 4й недели после инфицирования начинают появляться антитела IgG.
При большинстве инфекций титр их постепенно увеличивается с максимумом в разные сроки (в среднем через 1,5-2 мес), далее титр остается на невысоком уровне и указывает на иммунитет. При некоторых заболеваниях (микоплазмоз, хламидиоз, трихомониаз) уровень IgG не бывает высоким, снижается существенно из-за отсутствия иммунитета при данных инфекциях.
— Изолированное обнаружение антител IgM предполагает наличие первичного
инфицирования.
— Одновременное выявление в крови IgM и IgG характерно для первичного инфицирования
в предыдущие 2-3 месяца, а также при обострении хронического заболевания.
Следовательно, при беременности наличие IgM не всегда является признаком первичного инфицирования.
— Выявление изолированно IgG может указывать как на иммунитет к данному заболеванию,
так и на хроническую инфекцию. Во второй ситуации имеет значение и количество антител (титр), и изменение этого титра в динамике. Обычно исследования проводят с интервалом в 2-4-6 недель.
— Обнаружение IgA изолировано или с IgM указывают на первичную инфекцию. При
появлении IgA вместе с IgG предполагается активация хронической инфекции (в среднем 2 недели от момента обострения).
Определение авидности антител IgG является прекрасным дополняющим этапом диагностики первичной инфекции от давнего заражения, что имеет свое клиническое значение, прежде всего, при оценке риска внутриутробного заражения плода.
Обнаружение низкоавидных IgG указывает на первичную инфекцию и выявляются в среднем спустя 4-6 месяцев после инфицирования, реже дольше. Низкоавидные IgG требуют других лабораторных подтверждений первичного инфицирования (IgM).
Высокоавидные антитела являются либо признаком хронического заболевания и его обострения, либо сформировавшегося иммунитета.
Особенности у детей грудного возраста:у детей до года, а иногда и 1,5 лет в крови циркулируют материнские IgG к разным инфекциям (то есть произошло их проникновение через плаценты от матери к плоду в период внутриутробного развития).
Она не являются сами по себе признаком наличия инфекции в настоящем. Если же в такjм возрасте обнаруживаются IgM (напомним, что материнские IgM проникнуть через плаценту не могут), то это признак внутриутробного инфицирования или приобретенной после рождения инфекции.
Результат ИФА-диагностики (с помощью иммуноферментного анализатора) выдается в определенных единицах измерения:
— Оптическая плотность (ОП) пробы – концентрация специфических антител в единице объема.
Чем выше ОП пробы, тем выше концентрация антител. В некоторых результатах говорится о коэффициенте позитивности (КП) – это тоже оптическая плотность образца.
— Единицы концентрации антител (нанограмм/ миллилитр или нг/мл).
— В виде титров сывороток: 1:20, 1:40, 1:100, 1:200, 1:400, 1:800, 1:1200 и так далее. Диагностические титры (при которых ставится диагноз именно болезни, а не факт инфицирования) для разных болезней разные.
— В виде символов – «+», «-», «?» (+, ++, +++, ++++).
— В виде качественной оценки по заданному критерию (положительно или отрицательно).
Правильно оценить количество антител, вариант классового выявления иммуноглобулинов, а, следовательно, выставить стадию болезни и необходимость лечения может только врач.
Нельзя забывать, что для любой тест-системы разрабатываются свои «референтные значения» (варианты нормы), при превышении которых и диагностируется то или иное заболевание (варианты патологии).
Для разных тест-систем «референтные значения» различные.
Корректное сравнивание результатов ИФА, взятых в динамике, возможно только в случае их изготовления в одной и той же лаборатории.
источник
5.1 Сущность и классификация ИФА.
ИФА появился в середине 60-х годов и первоначально был разработан как метод для индификации антигена в гистологическом препарате, а также для визуализации линий преципитации в тесте иммунодиффузии и иммуноэлектрофореза, а затем стал использоваться для количественного определения антигенов и антител в биологических жидкостях. В разработке метода принимали участие Е.Энгвалл и Р.Пэлман, а также независимо от них В. Ван Вееман и Р.Шурс.
Рис. 6 Основной принцип ИФА:
для выявления антигенов; 2) для выявления антител
Метод основан на специфическом связывании антитела с антигеном, при этом один из компонентов конъюгирован с ферментом, в результатереакции с соответствующим хромогенным субстратом образовывается окрашенный продукт, количество которого можно определить спектрофотометрически (рис. 6).
Открытие возможности иммобилизации антигена и антитела на различных носителях с сохранением их связывающей активности позволило расширить использование ИФА в различных областях биологии и медицины.
Появление моноклональных антител послужило дальнейшему развитию ИФА, что позволило повысить его чувствительность, специфичность и воспроизводимость результатов.
Теоретически ИФА основывается на данных современной иммунохимии и химической энзимологии, знании физико-химических закономерностей реакции антиген-антитело, а также на главных принципах аналитической химии. Чувствительность ИФА и время его проведения определяется несколькими основными факторами: кинетическими, термодинамическими характеристиками реакции антиген-антитело, соотношением реагентов, активностью фермента и разрешающей способностью методов его детекции. В общем виде реакция антиген-антитело может быть описана простой схемой:
Разнообразие объектов исследования от низкомолекулярных соединений до вирусов и бактерий, а также необычайно широкий круг задач, связанных с многообразием условий применения ИФА, обусловливают разработку чрезвычайно большого количество вариантов этого метода.
Любой вариант ИФА содержит 3 обязательные стадии:
1. стадия узнавания тестируемого соединения специфическим к нему антителом, что ведет к образованию иммунного комплекса;
2. стадия формирования связи конъюгата с иммунным комплексом или со свободными местами связывания;
3. стадия превращения ферментной метки в регистрируемый сигнал. В основу классификации методов ИФА положено несколько подходов:
1. По типу реагентов, присутствующих на первой стадии ИФА, различают конкурентный и неконкурентный методы.
А) В конкурентном ИФА на первой стадии в системе присутствуют одновременно анализируемое соединение и его аналог, меченный ферментном и конкурирующий за центры специфического связывания с ним.
Б) Для неконкурентных методов характерно присутствие в системе на первой стадии только анализируемого соединения и специфичных к нему центров связывания.
2. Все методы ИФА делются на гомогенные и гетерогенные.
Если все три стадии ИФА проходят в растворе и между основными стадиями нет дополнительных этапов разделения образовавшихся иммунных комплексов от непрореагировавших компонентов, метод относится к группе гомогенных.
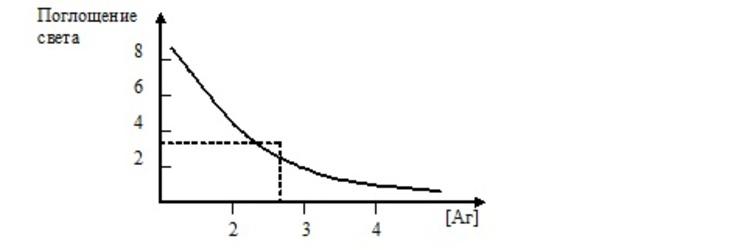
В основе гомогенного ИФА, применяемого, как правило, для определения низкомолекулярных субстанций, лежит ингибирования активности фермента при его соединении с антигеном или антителом. Активность фермента восстанавливается в результате реакции антиген-антитело.
При связывании антитела с антигеном, содержащим ферментную метку, происходит ингибирование активности фермента на 95% по отношению к высокомолекулярному субстрату, что обусловлено стерическим исключением субстрата из активного центра фермента. По мере увеличения концентрации антигена связывается все больше антител и сохраняется все больше свободных конъюгатов антиген-фермент, способных гидролизовать высокомолекулярный субстрат. Анализ проводят очень быстро, для одного определения требуется 1 минута. Чувствительность метода достаточно высока. С его помощью можно определить вещество на уровне пикомолей.
Для гетерогенных методом характерно проведение анализа в двухфазной системе с участием твердой фазы – носителя, и обязательная стадия разделения иммунных комплексов от непрореагировавших компонентов (отмывка), которые находятся в разных фазах (образовавшиеся иммунные комплексы находятся на твердой фазе, а непрореагировавшие комплексы – в растворе). Гетерогенные методы, в которых формирование иммунных комплексов на первой стадии протекает на твердой фазе, называют твердофазными методами.
Методы относятся к гомогенно- гетерогенным, если 1 стадия – образование специфических комплексов происходит в растворе, а затем для разделения компонентов используют твердую фазу с иммобилизированным реагентом.
3. По принципу определения тестируемого вещества:
А) Прямое определение концентрации вещества (антигена или антитела) по числу провзаимодействующих с ним центров связывания. В этом случае ферментная метка будет находиться в образовавшемся специфическом комплексе АГ-АТ. Концентрация определяемого вещества будет прямо пропорциональна регистрируемому сигналу.
Б) Определение концентрации вещества по разности общего числа мест связывания и оставшихся свободными центров связывания. Концентрация определяемого вещества при этом будет возрастать, а регистрируемый сигнал снижаться, следовательно, в данном случае прослеживается обратная зависимость от величины регистрируемого сигнала.
5.2 Характеристика компонентов, используемых в ИФА.
Ферментные метки обладают чрезвычайно мощьным каталитическим действием, одна молекула фермента может реагировать с большим количеством молекул субстрата. Таким образом, фермент, присутствующий в ничтожных количествах, можно выявить и количественно определить по образованию продуктов, катализируемой им реакции. Другое преимущество применения ферментов в качестве меток обусловлено наличием в молекуле многочисленных функциональных групп (сульфгидрильных, карбоксильных, остатков тиразина и др.), через которые можно ковалентно присоединить молекулы лиганда.
Ферментные маркеры, используемые в ИФА, должны обладать следующими свойствами:
– высокая активность и стабильность фермента в условиях анализа, при модификации и в конъюгате с антителами или другими белками;
– наличие чувствительных субстратов и простота метода определения продуктов или субстратов ферментативной реакции;
– возможность адаптации субстратных систем к дальнейшему усилению;
– отсутствие фермента и его ингибиторов в исследуемой биологической жидкости.
В ИФА может использоваться не менее 15 различных ферментов. Наибольшее применение, в соответствии с вышеназванными требованиями, нашли пероксидаза хрена (ПХ), щелочная фосфотаза (ЩФ) и β-D-галактозидаза. Все три стабильны и катализируют высокочувствительные реакции. Кроме того, продукты, получаемые в результате реакций, катализируемых этими ферментами, в зависимости от используемого субстрата, могут выявляться не только колориметрическими методами, но также флуоресцентными методами. Другие ферменты используются значительно реже. Это объясняется их более низкой в сравнении с ПХ и ЩФ удельной активностью.
Выбор субстрата в первую очередь определяется используемым в качестве метки ферментом, так как реакция фермент-субстрат высоко специфична.
Основные требования к субстрату:
– обеспечение высокой чувствительности метода при выявлении фермента в конъюгате;
– образование хорошо учитываемых (например, окрашенных) продуктов реакции фермент-субстрат;
– субстрат должен быть безопасным, дешевым, доступным и удобным для применения.
Чаще используют хромогенные субстраты, которые, разрушаясь, образуют окрашенное вещество. Перспективным является использование высокоэнергетических субстратов – флуоресцентных, хемипюминесцентных. Применение таких субстратов позволяет теоретически повысить чувствительность ИФА на два порядка.
Конъюгат – это антиген или антитело, меченные ферментной меткой. Образование коньюгата – один из важных этапов проведения ИФА.
При формировании конъюгата подбирают такой оптимальный метод введения ферментной метки, чтобы оба компонента конъюгата сохраняли свою биологическую активность: фермент — способность взаимодействовать с субстратом, а антиген или антитело — антигенность и антигенсвязывающую активность, соответственно. Наличие меченого, высокоочищенного антигена позволяет использовать конкурентные методы. В этом случае на конечном этапе можно измерять активность конъюгата, не связанного с иммобилизованными антителами, что позволяет избежать процедуры отмывки и делает анализ более удобным. Однако антигены разнообразны по своим физико-химическим свойствам и строению, а значит невозможно разработать универсальные методики для получения конъюгата с антигеном. В этом случае получение конъюгата антигена с ферментом представляет собой отдельную сложную задачу. Приготовление меченых антител для ИФА методически более доступно.
Конъюгирование фермента с иммунохимически активными белками производится различными методами: химическая сшивка, ковалентное связывание молекулы фермента с АГ или AT и образование соединений через нековалентные связи, например, когда связь между ферментом и АГ или AT осуществляется иммунологически, через взаимодействие антиген-антитело.
Наиболее широкое распространение получили ковалентные способы приготовления конъюгатов. Выбор реакции связывания определяется типом доступных функциональных групп в данных белковых молекулах. В качестве реагентов, используемых для введения фермента в молекулы антигенов и антител, используют глутаровый альдегид, периодат натрия и др.
Существует одноэтапный и двухэтапный методы получения конъюгатов с помощью глутарового альдегида. Могут образовываться конъюгаты различных размеров с редуцированной ферментативной активностью (15 — 60 % от свободного фермента). Образовавшийся конъюгат больших размеров может стерически затруднять определение тестируемого вещества. Конъюгаты с относительно низкой молекулярной массой состоят из Fab-фрагмента и одной молекулы фермента.
В результате двухэтапного синтеза, который заключается в поэтапном получении сначала модифицированного с помощью сшивающего агента фермента, его выделении, а затем последующем взаимодействии его с антигеном (антителом), образуются молекулы однородного состава, содержащие 1-2 молекулы фермента на молекулу иммуноглобулина и сохраняющие высокую ферментативную и иммунологическую активность. Однако количество таких образовавшихся конъюгатов невелико (для пероксидазы хрена составляет 5 — 10 %).
Наибольшее практическое применение нашел метод получения иммунопероксидазных конъюгатов, основанный на окислении углеводного компонента фермента периодатом натрия (связывание пероксидазы в конъюгат достигает 70-90 % от начального количества фермента).
Надежный конъюгат должен обладать следующими свойствами:
— высоким антительным тигром и высокой афинностью к антигену, чтобы его можно было использовать в большом разведении, и таким образом, уменьшить неспецифическое связывание;
— достаточной специфичностью в рабочем разведении;
— преобладанием мономерных форм над полимерными, т.к. полимерные формы имеют тенденцию к неспецифической адгезии на пластике, что приводит к высокому фоновому уровню реакции;
— оптимальным молярным соотношением между ферментом и антителами (оптимальное соотношение составляет около 1:1);
— достаточной ферментативной активностью конъюгата. Это свойство определяется главным образом условиями конъюгации и соотношением молекул фермента и антител в конъюгате.
5.3 Гетерогенные методы ИФА.
Гетерогенные ИФА (или твердофазные ИФА) включают методы, в которых анализируемое соединение находится в двух фазах. Для разделения компонентов иммунохимической реакции используют твердую фазу (нерастворимый носитель, как правило, пластик) с иммобилизованными на ней антителами или антигеном, которую отмывают на каждой стадии с целью удаления промежуточных продукто непрореагировавших компонентов.
Иммобилизацию можно проводить путем ковалентного связывания антител (антигенов) с активированным носителем, используя химические подходы, а также путем физической адсорбции антител (антигенов) на поверхности твердых полимеров (например, полистирольных пластин). В зарубежной литературе это направление получило название ELISA-тест или энзимсвязанный иммуносорбентный метод (от англ. enzyme-linked immunosorbent assay).
Неконкурентный ИФА определения антигенов на примере использования меченых ферментом специфических антител и иммобилизованных антител.
К носителю с иммобилизованными антителами добавляют раствор, содержащий анализируемый антиген. В процессе инкубации образуется специфический комплекс антиген-антитело. Затем носитель отмывают от несвязавшихся антигенов и добавляют меченые антитела – конъюгат. При этом количество связавшегося конъюгата прямо пропорционально количеству антигена в исследуемом образце. После вторичной инкубации и удаления избытка конъюгата добавляют хромогенный субстрат для используемого фермента, который изменяет цвет под действием фермента, т. е. происходит ферментативная реакция с окрашиванием раствора в лунках. Степень окраски прямо пропорциональна количеству меченых ферментом специфических антител, фермента и, соответственно, исследуемого антигена. Измерения оптической плотности раствора в лунках при определенной волне (в зависимости от используемого субстрата) проводят с помощью специальных спектрофотометров, адаптированных для микропланшетов – ридеров. Количественную оценку концентрации антигена в пробе определяют, сравнивая результаты с калибровочной кривой зависимости оптической плотности раствора от концентрации стандартного раствора антигена.
Поскольку на стадии выявления специфического иммунокомплекса антиген оказывается связанным с молекулами иммобилизованных и меченых антител, в литературе этот метод часто называют «сэндвич»-метод (от англ. sandvich) или двухцентровый метод ИФА (от англ. two-site assay).
Этот метод может быть использован для анализа только тех антигенов, на поверхности которых имеется, по крайней мере, две антигенные детерминанты. Для анализа большого количества моновалентных антигенов (лекарственных соединений, пестицидов и др.) он неприемлем.
Основное достоинство данного метода – высокая чувствительность. Предел обнаружения соединений данным методом в настоящее время достигает величины порядка 10-21 моль, что соответствует обнаружению в образце всего 600 молекул анализируемого вещества. Максимальная чувствительность достигается при проведении каждой иммунологической реакции в равновесном режиме, что сказывается на длительности проведения анализа, которая в среднем составляет 4 – 6 часов. Неконкурентный ИФА определения антител на примере использования меченых ферментом вторичных антител и иммобилизованных антигенов.
К иммобилизованному антигену добавляют исследуемую сыворотку. После инкубации и отмывания от несвязавшихся антител добавляют меченые вторичные антитела, которые специфичны к анализируемым антителам. После вторичной инкубации и удаления избытка меченых вторичных антител содержание ферментной метки на носителе пропорционально концентрации специфических антител в сыворотки.
Данная схема является одной из наиболее распространенных ИФА определения антител, поскольку позволяет выявлять антитела к разным антигенам.
Гетерогенный конкурентный ИФА определения антигена на примере использования меченого антигена и иммобилизованных антител.
К иммобилизованным на носителе антителам добавляют раствор, содержащий анализируемый антиген и фиксированную концентрацию конъюгата антигена с ферментом. После проведения инкубации носитель отмывают от несвязавшихся свободного и меченого антигена и регистрируют ферментативную активность на носителе, которая обратно пропорциональна концентрации определяемого антигена.
Гомогенный иммуноферментный анализ (ГИФА) — наиболее простой в методическом отношении вид ИФА. При его постановке один из участников иммунной реакции (обычно это низкомолекулярный антиген) метится ферментом и за ходом формирования комплекса антиген-антитело следят, регистрируя изменение активности фермента.
Такое нарушение ферментативной активности может возникать либо за счет пространственного разобщения фермента и субстрата, либо за счет конформационных изменений в молекуле фермента, сопровождающих формирование иммунного комплекса. ГИФА имеет ряд существенных преимуществ перед другими иммунохимическими методами. Во-первых, высокая экспрессия (весь анализ с помощью ГИФА , занимает минуты и даже доли минут).
Рис.8 Варианты гомогенного иммуноферментного анализа(А- эффект разобщения фермента (Ф) и субстрата (С) за счет стерических препятствий при взаимодействии антигена (Аг) и антитела (Ат); Б- эффект изменения конформации фермента при формировании комплекса антиген- антитело).
Во-вторых, метод имеет одну стадию и не требует трудоемких и требующих времени этапов промывки. И наконец, в-третьих, метод требует минимальных объемов (8-50 мкл) и количеств биологического или клинического образца. Однако у метода ГИФА имеется один крайне существенный недостаток — на его основе можно создавать диагностические тест-системы только для низкомолекулярных антигенов. Только, в этом случае антитело, взаимодействуя с антигеном, может эффективно экранировать или модифицировать связанную с этим антигеном молекулу фермента. Именно в связи с этим, ( несмотря на кажущуюся простоту и очевидные преимущества перед другими методами, на основе ГИФА были созданы диагностикумы для выявления только гормонов, пептидов, лекарственных и наркотических веществ и некоторых низкомолекулярных белков.
5.5 «Сэндвич» — вариант ИФА для выявления антигенов.
Антигены, определяемые с помощью данного варианта ИФА, должны иметь несколько эпитопов, способных связывать антитела, или обладать повторяющимися, пространственно разделенными эпитопами одинаковой специфичности.
При проведении этого варианта ИФА высокоспецифичные поли- или моноклональные антитела, адсорбированные на твердой фазе, инкубируют с исследуемым образцом. После процедуры отмывания в лунки вносят меченные ферментом антитела (конъюгат) к тому же антигену и далее проводят все остальные этапы реакции. Эффективность образования специфического комплекса на каждой стадии анализа зависит от константы связывания реакции антиген-антитело.
источник


 и субстрат/хромоген для фермента.
и субстрат/хромоген для фермента.