Природная вода содержит большое количество растворенных в воде веществ – соли, кислоты, щелочи, газы (углекислый газ, азот, кислород сероводород), отходы промышленных предприятий и нерастворимые частицы минерального и органического происхождения. В связи с вышесказанным, проблема оценки качества воды очень актуальна. В нашем селе несколько водоемов — это родники, река Куда, карьеры, озеро Цыганское. Из родников мы набираем воду для питья и приготовления пищи, а река Куда, карьеры и озеро – это излюбленное место для купания и отдыха. Каково качество воды, которой мы пользуемся? Именно изучению этой проблемы посвящена наша работа.
Цель работы: Изучить качество воды различных водоемов в районе с. Хомутово, с помощью лабораторных исследований и метода биоиндикации.
Управление образования администрации
Иркутского районного муниципального образования
МОУ ДОД ИРМО «Станция юных натуралистов»
«Качество воды открытых водоемов
Руководитель: Горбунова Надежда Сергеевна, учитель биологии МОУ ИРМО «Хомутовская СОШ №2»
2.1. Роль питьевой воды для здоровья человека…………………….
2.3. Органолептические характеристики воды………………………
2.4. Химический анализ воды…………………………………………
2.4.2. Содержание двуокиси углерода и ионов НСО 3 ……………..
2.4.3. Содержание хлора в пробах воды………………………………
2.5. Биоиндикация как метод исследования экосистем ……………..
2.5.1. Методика оценки состояния водоема по индексу Майера …..
3. Экспериментальная часть……………………………………………
3.2. Оборудование и материалы……………………………………….
3.3.2. Определение цветности ………………………………………
3.3.4. Определение кислотности природных вод………………….
3.3.5. Метод определения СО 2 свободной…………………………..
3.3.6 Определение хлора в пробах воды………………………………
3.3.7. Определение индекса Майера…………………………………..
Мы познаём ценность воды лишь когда колодец пересыхает.
Вода – одно из самых удивительных веществ в природе. Это единственная жидкость, которая существует на Земле сразу в трех агрегатных состояниях. Это самое распространенное на Земле химическое соединение (гидросфера занимает 71% поверхности Земли). Одно из удивительных свойств воды – это свойство универсального растворителя.
Вода – является источником жизни на Земле. Она необходима для жизни всех без исключения живых существ на Земле. Вода оказывает огромное влияние на здоровье человека. По данным Всемирной организации здравоохранения около 90% болезней человека вызывается употреблением для питьевых нужд некачественной воды, а также использование неподготовленной воды в бытовых целях (душ, ванна, бассейн, мытье посуды, стирка белья и т.д. ).
Природная вода содержит большое количество растворенных в воде веществ – соли, кислоты, щелочи, газы (углекислый газ, азот, кислород сероводород), отходы промышленных предприятий и нерастворимые частицы минерального и органического происхождения. В связи с вышесказанным, проблема оценки качества воды очень актуальна. В нашем селе несколько водоемов — это родники, река Куда, карьеры, озеро Цыганское. Из родников мы набираем воду для питья и приготовления пищи, а река Куда, карьеры и озеро – это излюбленное место для купания и отдыха. Каково качество воды, которой мы пользуемся? Именно изучению этой проблемы посвящена наша работа.
Цель работы: Изучить качество воды различных водоемов в районе с. Хомутово, с помощью лабораторных исследований и метода биоиндикации.
— изучить информационные материалы по теме исследования;
— освоить методику определения качества питьевой воды;
— определить качество питьевой воды в лабораторных условиях;
— освоить метод биоиндикации воды;
— определить качество воды при помощи гидробионтов;
— сделать выводы о качестве воды.
Объекты исследования: река Куда, озеро Цыганское.
Методики исследования: измерение, наблюдение, съемка местности, исследование.
Воде принадлежит важнейшая роль в геологической истории Земли и возникновении жизни, в формировании физической и химической среды, климата и погоды на Земле. Молекулы воды зарегистрированы также в межзвездном пространстве, она входит в состав комет.
Академик Вернадский писал: «Вода стоит особняком в истории нашей планеты. Нет природного тела, которое могло бы сравниться с ней по влиянию на ход основных, самых грандиозных геологических процессов. Нет земного вещества — минерала, горной породы, живого тела, которое бы ее не заключало. Все земное вещество ею проникнуто и охвачено».
Запасы воды на Земле огромны, но большая ее часть соленая, не пригодная для питья, применения в быту, сельском хозяйстве и производстве. Запасы же пресной воды ограничены. Ежедневно в среднем каждым человеком тратится не менее 150 литров воды в сутки для удовлетворения бытовых нужд.
Без воды невозможно существование живых организмов. Вода является одним из важнейших для жизнедеятельности организма человека веществ, поступающих из внешней среды. Взрослый может прожить, не потребляя воду, около недели, без других веществ можно обойтись недели, месяцы и даже годы. Если у человека нарушается водный баланс на 2%, то возникает обычная жажда, если теряется 8% воды, то человек близок к обмороку, при 10% начинаются галлюцинации и нарушается процесс глотания. 20% потери воды в организме смертельно опасны для человеческой жизни.
Значение воды для человека трудно переоценить, поскольку известно, что организм взрослого человека на 70% состоит из воды, присутствующей во всех его тканях. В крови взрослого 83% воды, в мозгу, сердце, легких, почках, печени, мышцах 70-80 %; в костях — 20-30%. Суточная норма воды для среднестатистического взрослого человека, проживающего на территории нашей страны, составляет 2,5-3л в сутки. Вода является основой для протекания всех обменных процессов в человеческом организме. Проникая внутрь человека, она осуществляет функцию обогащения клеток питательными веществами и очищения их от шлаков. Она принимает непосредственное участие в дыхательных процессах и процессах терморегуляции. Соблюдение водного режима — одно из важных условий здоровья. Поэтому ежедневно следует выпивать достаточное количество чистой воды. Именно чистой, поскольку только чистой воде под силу эффективно выполнять или поддерживать все транспортные и обменные функции в организме. Чистая питьевая вода активизирует защитные функции организма, она способствует разжижению крови и снижению артериального давления, помогает бороться с усталостью, стрессами и избыточным весом, стимулирует работу сердечно -сосудистой системы и системы кровообращения, повышает сопротивляемость организма к различным заболеваниям.
В 1766 году английский ученый Г. Кавендиш открыл, что вода — это жидкость без запаха, вкуса и цвета, ее молекула состоит из двух атомов водорода и одного атома кислорода. Вода не бывает абсолютно чистой.
Под влиянием климатических и других условий химический состав природных вод изменяется и приобретает характерные черты, иногда специфические для различных видов природных вод (атмосферные осадки, реки, озера, подземные воды). Она содержит многочисленные растворенные вещества – соли, кислоты, щелочи, газы (углекислый газ, азот, кислород, сероводород), продукты отходов промышленных предприятий, а также нерастворимые частицы минерального и органического происхождения. Свойства и качество воды зависят от состава и концентрации содержащихся в ней веществ. Наиболее чистой водой считается дождевая, но и она содержит примеси и растворенные вещества (до 50 мг/л). Воду, в которой содержится до 0,1% растворенных веществ, принято называть пресной, от 0,1 до 5% — минерализованной, свыше 5% — соленой.
2.3. Органолептические характеристики воды.
Органолептические свойства воды- это именно те ее признаки, которые воспринимают органы чувств человека. К ним относится запах, цвет и прозрачность. Данные свойства оцениваются по интенсивности восприятия. Мутная, окрашенная в какой-либо цвет или имеющая неприятный запах и вкус вода неполноценна в санитарно-гигиеническом отношении, т.к наличие в воде постороннего запаха, привкуса, окраски может указывать на загрязнение воды посторонними веществами.
2.4. Химический анализ воды.
2.4.1.Водородный показатель pH.
Водородный показатель (pH) определяет концентрацию в воде ионов водорода и показывает ее кислотность или щелочность. Для природной воды он обычно имеет значение от 6,5 до8,5. Изменение рН воды является следствием большого числа факторов, например, загрязнения воздуха кислотными примесями, загрязнения водоема промышленными сточными водами; характером почвы, грунтов, местности, на которой расположен водоем.
Природные воды в зависимости от рН делят на семь групп:
Результат гидролиза солей тяжелых металлов (шахтные и рудничные воды)
источник
Нормирование качества воды рек, озер и водохранилищ проводят в соответствии с «Санитарными правилами и нормами охраны поверхностных вод от загрязнения» (1988 г). Эти правила устанавливают две категории водоемов (или их участков):
водоемы питьевого и культурно-бытового назначения;
водоемы рыбо-хозяйственного назначения.
Состав и свойства воды водных объектов первого типа должны соответствовать нормам в створах, расположенных в водотоках на расстоянии 1 км выше ближайшего по течению, а в не проточных водоемах в радиусе одного километра от пункта водопользования. Состав и свойства воды в рыбохозяйственных водоемах должен соответствовать нормам в месте выпуска сточных вод при рассеивающем выпуске (наличие течений), а при отсутствии рассеивающего выпуска не далее, чем в 500 м от места выпуска.
Нормируемые значения параметров воды водоемов:
Содержание плавающих примесей и взвешенных веществ;
Запах, привкус, окраска и температура воды;
Значение рН, состав и концентрация минеральных примесей и растворенного кислорода;
Биохимическая потребность в кислороде;
Возбудители заболеваний, концентрация и состав ядовитых и вредных веществ.
Вредные и ядовитые вещества нормируют по принципу лимитирующего показателя вредности (ЛПВ), под которым понимают наиболее вероятное неблагоприятное воздействие каждого вещества.
При нормировании качества воды в водоемах питьевого и культурно-бытового назначения используют три вида ЛПВ:
Для водоемов рыбохозяйственного назначения наряду с указанными используют еще два вида ЛПВ:
Санитарное состояние водоема отвечает требованиям норм при выполнении соотношения:
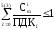
где 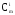
ПДКi предельно допустимая концентрация i-ro вещества, мг/л.
Для водоемов питьевого и культурно-бытового назначения проверяют выполнение трех, а для водоемов рыбохозяйственного назначения пяти неравенств. При этом каждое вещество можно учитывать только в одном неравенстве. «Санитарные правила и нормы охраны поверхностных вод от загрязнения» запрещают:
сбрасывать в водоемы сточные воды, если этого можно избежать (используя рациональную технологию, безводные процессы и системы повторного и оборонного водоснабжения);
если сточные воды содержат ценные отходы, которые можно утилизировать;
если сточные воды содержат сырье, реагенты и продукцию предприятий в количествах, превышающих технологические потери;
если сточные воды содержат вещества, для которых не установлены ПДК.
Контроль требований к нормируемым показателям качества воды в водоемах осуществляется периодическим отбором и анализом проб воды из поверхностных водоемов. Согласно ГОСТ 2874-82 анализ проб из поверхностных вод источников водоснабжения отбирают не реже 1 раза в месяц.
Количество проб и места их отбора определяют в соответствии с гидрологическими и санитарными характеристиками водоема и согласовывают с местными органами санитарно-эпидемиологической службы (СЭС). При этом считается обязательным отбор непосредственно в месте водозабора и на расстоянии 1 км выше по течению рек и каналов, а для озер и водохранилищ на расстоянии 1 км от водозабора в 2-х диаметрально расположенных точках.
В настоящее время наряду с анализом проб воды в лабораториях используют автоматические станции контроля качества воды, которые могут одновременно измерять 8-10 показателей качества воды: концентрацию растворенного кислорода, электрическую проводимость, рН, температуру, уровень воды в водоеме, концентрацию взвешенных веществ, концентрацию меди и т.д.
На очистных сооружениях машиностроительных предприятий осуществляют контроль состава исходных и очищенных сточных вод, а также контроль эффективности работы очистных сооружений.
Контроль состава исходных и очищенных сточных вод осуществляют один раз в 10 дней. Анализ следует проводить не позднее, чем через 12 часов после отбора пробы. Контроль состава сточных вод заключается в измерении:
органолептических показателей воды (запах, цвет, мутность );
содержания грубодисперсных взвешенных веществ (массовая концентрация и фракционный состав);
химического потребления кислорода (ХПК);
количества растворенного в воде кислорода;
биохимического потребления кислорода (ВПК);
концентрации вредных веществ, для которых существуют нормируемые значения ПДК;
Под ХПК понимается величина, характеризующая общее содержание в воде восстановителей, реагирующих с сильными окислителями. Выражается ХПК количеством кислорода, необходимого для окисления всех содержащихся в воде восстановителей. На практике окисление пробы сточной воды проводят бихроматом калия в серной кислоте по специальной методике.
Содержание растворенного кислорода измеряют после заключительного процесса очистки непосредственно перед сбросом воды в водоемы. Это необходимо знать для оценки коррозионных свойств воды, а также для вычисления БПК. Концентрацию растворенного в воде кислорода определяют, либо используя иодометрический метод Винклера, либо отечественные ЭГ-152-03, АКП-100,1, «Оксиметр». Под БПК подразумевается количество кислорода (в миллиграммах), необходимое для окисления в аэробных условиях в результате происходящих в воде биологических процессов органических веществ, содержащихся в 1л сточной воды. Определение БПК производят на основе анализа изменения количества растворенного кислорода с течением времени. На практике обычно используют пятисуточное БПК — БПК5.
Измерение концентрации вредных веществ, для которых установлены ПДК, проводят на различных ступенях технологической схемы очистки, в том числе перед выпуском сточной воды в водоем. Для этих целей используют газовые и жидкостные хроматографы, фотоэлектроколориметры, химические методы.
источник
Полностью готовый научный проект по химии. Содержит все материалы.
Отзыв научного консультанта
« Анализ качества воды в водоемах и колодцах Тайыншинского района»
Ознакомился с научным, проектом по химическому анализу воды.
В дальнейшем проект может использоваться как информационный материал.
Заслушал: учащегося 11-го класса Тарадаеву Алину, которая ознакомила со своим проектом и продемонстрировала исследовательскую работу.
В проекте рассмотрены методы химического анализа воды. Автор применяет современные инструментальные средства из базового набора кабинета химии для реализации исследовательской части поставленной задачи. Подобраны материалы о химическом анализе, рассмотрена возможность проведения эксперимента с учетом имеющихся реактивов.
Научный проект «Анализ качества воды в водоемах и колодцах Тайыншинского района» может являться информационным материалом,при проведении каких либо действий с водой.
Решение: ходатайствовать перед районным методическим кабинетом об обобщении результатов исследовательской работы учащегося СШ № 4 Тарадаевой Алины
Научный консультант: ………………………. Трофимец М.П.
« Анализ качества воды в водоемах и колодцах Тайыншинского района»
Проект поможет решению актуальных на сегодняшний день задач по сохранению и укреплению здоровья, доведет до жителей района информацию о качестве питьевой воды, которую они потребляют..
В проекте автором рассмотрены методы химического анализа воды.
Автор применяет современные инструментальные средства, входящие в комплект базового набора кабинета химии для реализации исследовательской части и доказательства поставленной в проекте задачи.
Научный проект состоит из введения, 2-х глав, заключения и списка использованной литературы.
Во введении автор раскрывает актуальность проблемы, цель, задачи и методы её достижения, научную новизну и практическую значимость работы.
В первой главе – теоретическая часть исследования, методы анализа, влияние реагентов на самочувствие людей.
Во второй – практическая часть, в которой описаны все проведенные эксперименты и показан их результат.
Представляют интерес и имеют, на наш взгляд, особую значимость обоснованные фактическим материалом и исследованные автором следующие научные результаты – вода потребляемая в нашем районе, не содержит вредных ионов тяжелых металлов.
В целом проект имеет достаточно высокий уровень работы.
Работа по актуальности соответствует требованиям, предъявляемым к научным проектам, оценивается как незаконченное научное исследование, имеющее научную новизну и практическую ценность и допускается к защите.
Научный руководитель: ………………………….Трофимец М.П..
Research objective: to carry out the chemical analysis of tests of water from various sources of the area.
As a hypothesis the assumption that in the territory of the area water with a different chemical composition is used acts, but in the absence of harmful production on proximity the content of harmful substances should be minimum. Procedure of research consisted of the following stages – theoretical and practical. As methods of research the chemical analysis was applied. Novelty of research consists in lack of an information about qualitative composition of water.
On the basis of received these (results) authors came to the following conclusions: water in the area is not strongly differs on a chemical composition, and the content of harmful substances are in norm or isn’t revealed. Water is quite suitable for use and doesn’t influence health of the person
1) Area of practical use of results of this work — the chemical analysis of tests of water.
The project is calculated on some years for the purpose of more detailed analysis of a large number of tests of water
Министерство образования и науки Республики Казахстан
Управление образования Северо-Казахстанской области
Тайыншинская средняя школа №4
Определение качества воды в водоемах и колодцах
Направление: «Здоровая природная среда — основа реализации стратегии «Казахстан-2030»
Научный руководитель: Трофимец М.П
1.1 Основные сведения о воде 6
1.2 Химические показатели воды 7
1.3 Лаборатория биологии 12
2.3 Вода из водонапорной башни 17
Цель исследования: провести химический анализ проб воды из различных источников района.
В качестве гипотезы выступает предположение о том, что на территории района используется вода с разным химическим составом, но из-за отсутствия вредного производства по близости содержание вредных веществ должно быть минимальным. Процедура исследования состояла из следующих этапов – теоретического и практического. В качестве методов исследования применялся химический анализ. Новизна исследования заключается в отсутствии иформации о качественном составе воды.
На основании полученных данных (результатов) авторы пришли к следующим выводам: вода в районе не сильно отличается по химическому составу, и содержание вредных веществ в норме или их не обнаружено. Вода вполне пригодна для использования и не влияет на здоровье человекаю
Область практического использования результатов данной работы — химический анализ проб воды.
Проект рассчитан на несколько лет с целью более детального анализа большого количества проб воды
Основополагающий вопрос нашего исследования – одинаковая ли вода по составу и свойствам в разных уголках нашего района?
Какие методы можно использовать для химического анализа воды?
Каковы показатели качества воды по району?
Какая вода из исследованной найболее благоприятна ?
Предлагаемый химический исследовательский проект призван показать химический состав воды из разных источников. В процессе работы учениками 9 и11 классов были организованы экскурсии на некоторые уголки города с целью забора проб воды на анализ. Предлагаемые исследования можно использовать для ознакомления.
Дидактические цели проекта:
Формирование компетентности в сфере самостоятельной познавательной деятельности в области химии, критического мышления, навыков работы в команде.
Приобретение навыков самостоятельной работы с дополнительным объемом информации.
Привитие умений увидеть проблемы ближайшего окружения и наметить пути их решения.
сформировать умения и навыки, необходимые для проведения химического анализа;
продолжить воспитание ответственного отношения к воде;
привлечь внимание жителей, общественности и учащихся к проблеме питьевой воды в районе;
Темы самостоятельных исследований:
«Какие методы используются для химического анализа питьевой воды?»
«Как влияет химический состав воды на самочувствие людей?»
«Состояние источников пресной воды»
Анализ, синтез, экскурсии, лабораторные исследования
Вода, является одним из самых распространенных веществ в природе, представляет собой уникальное соединение, благодаря которому на Земле зародилась жизнь. Она распределена весьма неравномерно. Вода находится в постоянном и активном кругообороте. Его движущей силой является Солнце, а основным источником воды – Мировой океан. Почти четверть всей падающей на Землю солнечной энергии расходуется на испарение воды с поверхностей водоемов. Таким образом, вода находится на Земле в постоянном движении. Среднее время ее пребывания в атмосфере оценивается 10 сутками. В здоровом организме взрослого человека наблюдается состояние водного равновесия или водного баланса. Оно заключается в том, что количество воды, потребляемое человеком, равно количеству воды, выводимой из организма. Общий объем воды, потребляемый человеком в сутки при питье и с пищей, составляет 2. . . 2, 5 л. Благодаря водному балансу столько же воды и выводится из организма. . Потеря 10% воды может привести к необратимым изменениям в организме, а потеря 15. . . 20% приводит к смерти, поскольку кровь настолько густеет, что с ее перекачкой не справляется сердце. Водный обмен в организме человека регулируется центральной нервной системой и гормонами. Нарушение функции этих регуляторных систем вызывает нарушение водного обмена, что может приводить к отекам тела. Вода – универсальный растворитель. В той или иной степени в ней растворены все элементы земной коры. Чистой воды в природе нет, — она всегда содержит примеси. Состав воды (по массе): 11, 19 % водорода и 88, 81 % кислорода. Чистая вода прозрачна, не имеет запаха и вкуса. Наибольшую плотность она имеет при 0°С (1 г/см 3 ). Плотность льда меньше плотности жидкой воды, поэтому лед всплывает на поверхность. Вода замерзает при 0°С и кипит при 100° С при давлении 101 325 Па. Она плохо проводит теплоту и очень плохо проводит электричество. Вода — хороший растворитель. Молекула воды имеет угловую форму, атомы водорода по отношению к кислороду образуют угол равный 104, 5°. Поэтому молекула воды — диполь: та часть молекулы, где находится водород, заряжена положительно, а часть, где находится кислород — отрицательно. Благодаря полярности молекул воды электролиты в ней диссоциируют на ионы.
Какой должна быть питьевая вода? Качество воды выступает как характеристика
ее состава и свойств, определяющая пригодность воды для конкретных видов использования. Большую часть водных запасов на Земле составляет соленая вода морей и океанов. Животные и растения живут как в соленых, так и в пресных водоемах, но каждый из видов приспособлен к определенному местообитанию, и
способен переносить лишь незначительные отклонения в физических и химических параметрах среды, к которой он приспособился.). Соленость воды определяется растворенными в ней солями (карбонаты, сульфаты, хлориды калия, натрия).
При централизованном водоснабжении законодательно определено, что вода, поступающая к потребителю, должна быть приятной в органолептическом отношении и безопасной для здоровья; при этом подразумевается, что содержание вредных веществ в воде не должно превышать предельно допустимых концентраций.
Химические показатели воды
Определение pH универсальным индикатором
Определение окисляемости воды
Определение концентрации катионов железа
Определение органических веществ в воде
1. Водородный показатель рН
В пробирку наливают 5 мл исследуемой воды, 0. 1 мл универсального индикатора, перемешивают и по окраске раствора оценивают величину рН.
источник
Исследовательский проект «Исследование качества воды водоемов и водоисточников села Белавка воротынского района»

МБОУ БЕЛАВСКАЯ ОСНОВНАЯ ШКОЛА.
НОМИНАЦИЯ « ИССЛЕДОВАНИЕ КАЧЕСТВА ВОДЫ».
ученики 9 класса Белавская основная школа
Садовникова Анна и Камалов Эдуард.
Руководитель : Учитель химии Белавской основной школы
Как только не называют обыкновенную воду. И самым удивительным веществом, и волшебным. Гениальный Леонардо да Винчи назвал ее соком жизни на земле, и следует признать, что он был прав. Водная оболочка Земли – гидросфера включает в себя совокупность всех водных объектов земного шара: океанов, морей, рек, озер, водохранилищ, подземных вод, ледников и снежного покрова. Она содержит около 1,4 миллиарда кубических метров воды.
В настоящее время гидросфера охвачена неожиданными по скорости и масштабам преобразованиями, связанными с деятельностью человечества. Ежегодно используется около 5 тысяч кубических метров воды, при этом загрязняется примерно в 10 раз больше. Большая часть воды сосредоточена в морях и океанах. На пресные воды приходится всего 2%. Многие страны начали испытывать нехватку пресной воды. Но это еще не значит, что ее на земле мало, беда в том, что мы не научились рационально использовать воду. Возросший дефицит воды связан с загрязнением водоемов промышленными и бытовыми стоками.
Как не тревожиться, если медики сигнализируют: от болезней, вызванных нехваткой чистой питьевой воды, на земном шаре страдает свыше 800 миллионов человек! Как не тревожиться, если тонна нефти, растекаясь по поверхности водоема, образует пленку, площадью 12 квадратных километра, и это препятствует проникновению в толщу воды кислорода, а ведь он так нужен для жизни рыб, для процесса самоочищения водоемов. Как не тревожиться, если в мировой океан со сточными водами городов, нефтеперерабатывающих заводов и в результате аварий установок по добыче нефти и танкеров ежегодно поступает до 13 миллионов тонн нефти? За такой же период стоки
« поступают» в моря до 6000 тон ртути – сильнейшего яда, который очень трудно вывести из организма.
Растущее вмешательство человека в природу, непродуманная, а порой бесхозяйственная деятельность людей приводит к необратимым экологическим и биологическим последствиям, к резкому ухудшению качественного состояния окружающей среды. Результатом такого воздействия общества на природу являются истощение ее ресурсов и загрязнение.
Первые стандарты питьевой воды были утверждены в США и России в 1937 году. В этих стандартах содержатся нормы качества питьевой воды (требования к микробному составу, физическим и химическим характеристикам воды). А с 1994 года по инициативе Международной ассоциации водопользователей 22 марта был утвержден Всемирный день воды. Чтобы еще раз обратить внимание на остроту и важность данной проблемы, 2003 год был объявлен ООН Всемирным годом пресной воды.
Забота о здоровье людей должна занимать центральное место в усилиях по обеспечению устойчивого развития, каждый человек имеет право на здоровую и плодотворную жизнь в гармонии с природой.
Вода – одно из самых распространенных веществ на земле. Она покрывает большую часть земной поверхности. Для многих видов животных и растений вода продолжает оставаться средой обитания. Значение воды в процессах жизнедеятельности очень велико. Ведь в ней протекают различные химические реакции нашего организма.
Когда-то можно было брать воду прямо из рек. Теперь равнинные реки, их притоки уже не те, и пить из них без специальной очистки не позволят врачи. А во многих индустриальных странах не то, что не попьешь, но и не искупаешься. На берегах рек, озер, стоят предостерегающие щиты с надписью
«Водная проблема», «Водный голод», «Водный кризис» — этими и подобными тревожными заголовками полны в последнее время газеты и журналы мира. Как не тревожиться, если появление все новых химических веществ в отходах производства, смытые дождями с полей удобрения и ядохимикаты, приводят к резкому увеличению количества стоков, содержащих вещества, опасные для всего живого.
Изучение экологических проблем малых рек Воротынского района,
водоемов и источников питьевой воды села Белавка,
освоение способов анализа воды.
1. Выявление экологических проблем малых рек.
2. Практическое исследование воды ближайших водоемов (реки и пруда):
качественное определение примесей воды,
колориметрическим способом определения рН среды,
методикой определения жесткости воды,
биоиндикаторами чистой воды
Проведение анализа питьевой воды из различных источников на территории села Белавка.
Изучение качества воды в водоемах села Белавка.
Исследование питьевой воды.
Водоемы с. Белавка (река и сельский пруд), источники питьевой воды на территории села.
Учащиеся Белавской СОШ Воротынского района решили исследовать водоемы села Белавка: реку Белавку, которая впадает в Суру и искусственный пруд, находящийся на территории села (схема № 4) на качество природной воды, провести мониторинг этих водоемов. В связи с этим была создана группа, состоящая из учащихся 11 и 9 класса, которая проводила исследования. Руководителем группы является учитель химии Костерина Татьяна Викторовна.
2. Характеристика Воротынского района .
Территория Воротынского района (карта –схема №3) характеризуется довольно развитой гидрографической сетью рек, речек, ручьев. Основными реками Волжского речного бассейна (карта –схема № 1) являются судоходная Сура с Ургой, Дорогуча, Чугунка. Эти реки имеют мелкие притоки второго порядка с впадающими в них ручьями.
СУРА – один из больших притоков Волги, пограничной реки между Нижегородской областью и Чувашской республикой, протекает в 4-5 км от села Белавка, в нее же впадает река Белавка (карта –схема № 2). Протяженность реки Суры в нашей местности – около 16 км, а общая протяженность 841 км.
Издревле различные средства плавания, большие и малые суда ходили по этой красивой реке. Сура была судоходна на протяжении 360 км. Белавцы со дня освоение края кормились Сурой, но эта славная река является не только кормилицей рыбой, сеном заливных лугов, лесной и другой продукцией, но и местом отдыха, вдохновения, романтических помыслов.
К сожалению, в последние годы ситуация значительно изменилась не в лучшую сторону. Залита Чебоксарским водохранилищем волжская пойма, по-прежнему загрязняются Сура и Волга. От промышленных стоков и нечистот ежегодно погибает много рыбы, в том числе и ценных пород. Источником загрязнения воды в Суре является Алатырский химический завод.
Как Хохлома означает художественную роспись, Дивеево – святые места, связанные с преподобным Серафимом Саровским, так Воротынец является синонимом хорошей рыбалки. Не только нижегородцы ездят изведать клев местной рыбы, но и москвичи, владимирцы, из Казани, из Чебоксар, из Рязани, из Саратова.
Самой благородной рыбой наших мест, несомненно, является стерлядь, представительница класса высших рыб осетровых. Высоко ценится мясо стерляди, деликатесом считается икра. Во времена правления Петра 1 живую стерлядь доставляли из реки Суры в Петербург. Другие виды «царь – рыбы» — осетр, севрюга, белуга — перестали заходить в наши места, как только Волга превратилась в каскад водохранилищ. Вкус пойманной стерляди изменился, она стала пахнуть нефтью.
Несмотря на огромный урон, нанесенный Чебоксарской ГЭС, наш Воротынский район остается одним из красивейших и богатейших мест не только в Нижегородской области, но и всего Поволжья. Это один из редких районов, который делит Волгой на две части не только территорию района, но и климат, природные особенности, флору и фауну.
3.
Село Белавка находится на границе Чувашской республики и Нижегородской области.
На территории села Белавка находится два водоема: река Белавка и искусственный пруд.
Водоемы украшают землю, радуют своей красотой. Люди стремятся к водоему отдохнуть, поплавать. Вода успокаивает.
Еще недавно, всего сто лет назад, люди брали воду для питья из чистейших ручьев и сверкающих голубизной озер. Такими люди получили их в наследство от предшествующих поколений. Как же распорядились мы этим богатством? Некоторые реки и озера исчезли с лица Земли, а многие отравлены химикатами и непригодны для питья. Сегодня никому и в голову не придет набрать воды из ближайшей реки: чистой воды остается все меньше. И виноваты в этом люди.
В Воротынском районе 20 рек и речек. Одна из них река Белавка , протекает через село Белавка, длиной 16 км, впадает в реку Суру, которая несет свои воды в реку Волгу и впадает в нее в районе поселка Васильсурска. Река Белавка имеет несколько притоков, которые берут начало в оврагах за селом в виде родников.(карта –схема № 4) Пойма реки, особенно на территории села сильно заболочена, прежде здесь было много ольхи, некоторые деревья достигали диаметра почти в 1 м, сейчас заросла ивняком. Из-за того, что речка питается родниками вода в ней почти всегда холодная и проточная. Несколько лет назад речка имела красивый вид: широкая, глубокая, имела деревянную плотину – шлюз, которая регулировала уровень воды в реке. Через речку был сооружен широкий, красивый, большой мост.
Люди села приходили отдыхать на берег реки, купаться, брали воду для питья и хозяйственных целей. Постепенно деревянная плотина разрушилась, построили насыпную, которая подвергается размыванию каждую весну, река обмелела, по берегам выросли деревья и кустарники. По левому берегу реки шла разработка добычи торфа. Весь берег изрыт торфяными ямами. Сейчас они заполнены водой, появляется типичная болотная растительность. Река потеряла свой красивый вид, хотя купаться в нем можно, но вода быстро грязнится из-за мелководья.
На территории села находится искусственный пруд, (карта-схема №4) возраст которого — 60 лет, имеющий природные родники. Они в свое время питали своими водами данный пруд. Родники имели чистую прозрачную воду.
Мероприятия по созданию искусственного пруда происходили после Великой Отечественной войны, под руководством председателя колхоза Коровина Николая Алексеевича. Разведением прудовых рыб занимался Семеров Иван Степанович – лесник, который следил за состоянием пруда. На пруду были построены мостки, с которых брали воду для хозяйственных целей, дети – купались. Вода была чистая и прозрачная, а пруд – очень глубокий.
Постепенно родники на дне пруда заилились, дно превратилось в свалку бытовых отходов. Чистый пруд постепенно стал превращаться в болото, с типичной болотной растительностью, обмелел. Цвет воды стал зеленый, а запах — болотный. Купаться в этом пруду стало неприятно т.к. можно получить травму при купании из-за множества отходов, загрязняющих дно, и в воде появилось много животных-паразитов.
4. 
В журнале «Химия в школе» № 4 за 1993 год было опубликовано лабораторно — практическое занятие «Анализ воды ближайшего водоема», а в газете «Берегиня»№2,2006 года «Инструкция к изучению воды».
Наша исследовательская группа в феврале 2012 года взяла пробы из водоемов, находящихся на территории с. Белавка, т.е. сельского пруда и реки и провела анализ воды, согласно этим методикам. Для проведения анализа воды следует правильно отобрать пробу. Воду следует брать не у самого берега, ибо она будет более мутная и загрязненная продуктами стока, иметь много растительных и животных организмов и их остатков. Следовательно, воду нужно брать на глубине 1 м, используя какое-либо плавучее средство. Т.к. это была зима, чтобы взять пробы прорубали лунки. ( См. приложение)
рис.1 Лабораторное исследование воды.
Органолептические характеристики воды — это цветность, запах, прозрачность, количество взвешенных частиц (осадок).
Табл. №1. Сравнительная таблица органолептических характеристик воды.
Методика проведения опытов.
Цветность природной воды зависит от присутствия солей железа и гуминовых кислот. Качественную оценку цветности можно провести путем сравнивания ее с дистиллированной водой на фоне листа белой бумаги при боковом освещении.
светло-желтая. Близкая к бесцветной
Питьевая вода не должна обнаруживать окраску в столбике 10-12 см.
Вода из пруда не пригодна для питья и хозяйственных нужд.
Прозрачность обусловлена цветом и мутностью. Для определения набирают в пробирку воду и помещают перед источником света, смотрят на нее перпендикулярно направлению света.
Шкала мутности: прозрачная,
слабо мутная, мутная, очень мутная.
Вода считается непригодной для питья, если прозрачность меньше 30 см.
Вода пруда не пригодна для питья. Воду реки можно употреблять в качестве питьевой, только при кипячении.
О состоянии воды можно судить по осадку, в который выпадают взвешенные вещества: частицы глины, песка и т.д.Чтобы исследовать осадок , надо набрать в мерный цилиндр 1 литр воды и дать отстояться в течении часа.
Объем осадка- незначительный.
Характер осадка- хлопьевидный,
илистый, глинистый, песчаный.
Бурый(старые водные растения
После выпадения осадка цвет воды реки не изменился, у воды пруда произошло слабое осветление. Вода из реки практически прозрачная.
Естественные запахи воды связаны с жизнедеятельностью растений и животных или гниением их остатков.
Определение запаха: в чистую колбу объемом 100 мл наливают исслед. воду на 2/3 ее объема, прикрывают стеклышком и осторожно взбалтывают. Сдвинув с колбы стекло, определяют запах.
Различают:ароматический, болотный, гнилостный, древесный, землистый, плесневелый, рыбный, сероводородный, травянистый, неопределенный.
По Государственному стандарту интенсивность запаха воды при 20 С не должна превышать 2-х баллов.
Вода в пруду не соответствует Гос. Стандарту, имеет интенсивность запаха 3 балла. В реке вода пригодна для питья, имеет интенсивность запаха 1 балл, только при кипячении.
0 баллов — никакого запаха,
1 балл – запах очень слабый, обнаруживается только при нагревании,
2 балла – запах обнаруживается без нагревания, но при тщательном «принюхивании».
3 балла – запах заметный, легко обнаруживается,
4 балла – запах отчетливый, заставляет воздерживаться от питья.
5 баллов – запах очень сильный — вода не годится для употребления.
Микроскопическое обследование воды пруда и речки. (февраль 2007 года)
Под микроскопом было обнаружено в воде из пруда много живых организмов.
Рис. Зеленая водоросль . Увеличение. Фотография под микроскопом. Циклоп..
Фотография под микроскопом. Циклоп. Инфузория – туфелька.
В пресных водоемах живет множество видов мелких ракообразных, составляющих планктон. Наиболее обычны из них пресноводные рачки дафнии и циклопы. Мелкие рачки питаются простейшими, одноклеточными водорослями, бактериями, гниющими органическими остатками. Мелкие ракообразные – основной корм молоди рыбы, других водных животных. В теле некоторых проходят развитие паразитические черви. Так, в частности, циклопы служат промежуточными хозяевами широкого лентеца.
Из одноклеточных животных водоема встречаются: амеба, инфузория – туфелька, эвглена зеленая.
В данном образце прудовой воды находилось очень много живых организмов, а зеленый цвет воде придавали зеленые водоросли.
В речной воде живых организмов было практически мало — незначительно, так как вода в реке проточная, а в пруду – стоячая.
В октябре 2014 года были сделаны повторные анализы воды сельских водоемов.
Например: определение рН воды колориметрическим способом, определение жесткости воды при помощи мыла, обнаружение различных ионов, биологические индикаторы качества воды, одинаковы ли показатели в разных источниках? Для этого был проведен следующий химический эксперимент, методика проведения которого взята из книги: Н.В. Ширшиной «Проектная деятельность учащихся», стр. 82-84.
1.Определение рН (концентрации водородных ионов) в растворах колориметрическим способом.
Для определения рН испытуемого раствора использовался прибор Алямовского.
Определение производится в с л е д у ю щ е й п о с л е д о в а т е л ь н о с т и :
В пробирку наливают 5 мм испытуемой жидкости и 0,5 мл универсального индикатора. Перемешивают содержимое пробирки.
После этого определяют рН испытуемой жидкости путем сопоставления ее окраски с окраской эталонов стандартной шкалы следующим образом:
В стандартной шкале находят эталон, окраска которого близка к окраске испытуемой жидкости.
Вынимают из штатива этот и 2 соседних с ним эталона ( один с более низким, другой – с более высоким значением рН) и производят более тщательное сравнение окраски испытуемой жидкости с окраской эталонов. Делать это надо на белом фоне.
Прибор позволяет определить реакцию испытуемой жидкости с точностью до 0,1 рН.
Воспользовавшись данной инструкцией, исследовали воду из различных источников: реки, пруда, колонки по ул. Заречная, дистиллированной. Получены следующие результаты. (См табл. № 2)
Таблица № 2. Сравнительная таблица показателей воды.
Величина рН природной воды служит важным показателем их кислотности или щелочности и является результирующей величиной кислотно-основного взаимодействия ряда минеральных и органических веществ.
рН природной воды села Белавка слабощелочная.
Обнаружение сульфат — ионов
Обнаружение катионов железа ( III )
Концентрация ионов железа ( III ) более 2,0 мг
Красное окрашивание Концентрация ионов железа( III ) более10 мг/л.
(взято из протокола №393-398 исследование питьевой воды, См. приложение).
Обнаружение хлорид — ионов
Концентрация более 10 мг/л
Обнаружение катионов свинца
Качественное определение главных примесей природной воды позволяет оценить экологическое благополучие водоемов: чем меньше примесей, тем лучше его состояние.
Из кн. Л.Г.Волыновой «Химия. Планы и конспекты». Стр.105-108.
Таблица №3.. Памятки по обнаружению различных ионов
К 1 мл пробы воды по каплям добавляют реагент.
Бледно-голубое окрашивание наблюдается при концентрации нитрат- ионов более 0, 001 мг/л, голубое – более 1 мг/л, синее – более 100мг/л
Тиоцианат аммония (20 г) растворить в дистиллированной воде и довести до 100 мл, азотная кислота (конц), перекись водорода(5%)
Действием пероксида водорода ионы железа( II ) переходят в ионы железа( III ).
К 10 мл пробы воды добавляют 1 каплю азотной кислоты, 2-3 капли пероксида водорода и вводят 0,5 мл тиоцианата аммония.
При концентрации ионов железа более 2,0 мг/л появляется розовое окрашивание, При концентрации более 10 мг/л окрашивание становится красным.
(10 г растворить в 90 г воды): соляную кислоту
Растворить в воде и довести объем до100 мл)
рН кислая, температура комнатная.
К 10 мл пробы воды прибавляют 2-3 капли соляной кислоты и приливают 0,5 мл раствора хлорида бария.
При концентрации сульфат – ионов более 10 мг/л выпадает осадок.
Если наблюдается опалесценция, то концентрация ионов более 1 мг/л
(5г растворить в 95 мл воды), азотная кислота(1:4)
Среда кислая, температура комнатная
К 10 мл пробы воды прибавляют 3-4 капли азотной кислоты и приливают 0,5 мл раствора нитрата серебра.
Белый осадок выпадает при концентрации хлорид -ионов более 100 мг/л
Помутнение раствора наблюдается, если концентрация более 10 мг/л, опалесценция –более 1 мг/л.
рН=7, среда нейтральная, температура комнатная.
В пробирку помещают 10 мл пробы воды, прибавляют 1 мл раствора реагента.
Если выпадает желтый осадок, то содержание катионов свинца более 100мг/л, помутнение- более 20 мг/л, опалесценция – 0,1 мг/л
: Биоиндикаторы чистоты воды (в зоне прибрежных обрастаний предметов )
Ярко-зеленые водоросли, буроватые налеты водорослей.
В пруду и реке растут зеленые водоросли, что показывает фотография, сделанная при увеличения микроскопа в 400 раз.
Наяды, сальвинии, водяной орех, водокрас обыкновенный, водокрас лягушачий, кувшинка белоснежная, аир болотный, тростник высотой до 4 м Раки, большое разнообразие рыб.
Массовое развитие роголистника,. рдеста плавающего, ряски, тростник высотой до 0,5 м, наличие больных рыб.
5.« КАКОЙ ДОЛЖНА БЫТЬ ПИТЬЕВАЯ ВОДА».
«Восточная мудрость гласит: «Ты то, что ты пьешь». Оказывается, не меньшее значение для нашего здоровья имеет вода, которую мы пьем.
Не каждая вода может служить для питья. Природные воды могут содержать минеральные примеси, некоторые из которых вредны для организма. Кроме того , в природной воде могут содержаться болезнетворные бактерии. Поэтому прежде чем пить воду из родников, колодцев и тем более открытых водоемов , ее необходимо обработать. Простейшим способом является кипячение. Согласитесь, не всегда есть возможность прокипятить воду, да и жарким летним днем так приятно попить прохладной родниковой воды. Что же делать?
Во-первых, если вы берете воду из «окультуренного» родника, то вам опасаться нечего: состав воды наверняка был подвергнут анализу.
Во-вторых, мы бы рекомендовали вам запастись перед походом фляжкой с опущенной в нее серебряным предметом: монеткой, колечком, сережкой и т.д. Еще в древности замечали, что вода при соприкосновении с серебром долго не портиться.
Питьевая вода должна содержать небольшое количество растворенных в ней солей и газов. Поэтому, когда для очистки питьевой воды применяют перегонку, к дистиллированной воде прибавляют нужное количество солей и насыщают воду газами воздуха. В каждой стране существуют определенные нормы содержания примесей, допустимых для питьевой воды.
Некоторые показатели питьевой воды.
Вода и неинфицированные заболевания.
Каждый год Центр Госсанэпиднадзора Воротынского района нижегородской области проводит исследования питьевой воды из водоисточников, находящихся на территории села Белавка. Протокол 393-398 от 2 сентября 2005 года показывает, что в селе взяты пробы из 6 источников. Поведя анализ было выявлено, что в пробе № 5 из колонки по ул Шепыриха самое большое содержание сульфатов и хлоридов (300, 207 ), нормы ПДК- 500, 300. вода в этой колонке соленая.
Вода в этой колонке самая мягкая (2,5) при норме -7.
источник
Набор «Река, пруд, аквариум» предназначен для оценки безопасности открытых водоёмов, которые используются для пляжного отдыха и купания.
Кроме прудов и других природных водоёмов такой анализ будет полезен для исследования воды в аквариумах или рыбоводческих хозяйствах, а также в домашних бассейнах, владельцы которых не обеззараживают воду путём хлорирования или озонирования.
Исследование поможет Вам убедиться в том, что вода в Вашем водоёме не наносит вреда организму, а получив тревожные результаты, взяться за решение выявленных проблем.
Срок выполнения: 6–8 рабочих дней.
Минимальный объём пробы (материал тары): 1,5 л (пластик) и 0,2 л (стекло).
- подходит для оценки безопасности и полезных свойств природной и аквариумной вод;
- учитывает специфику природной воды в целом и поверхностных водоёмов в частности;
- включает определение содержания наиболее опасных тяжёлых металлов и органических загрязнителей, таких как ртуть, свинец, кадмий и фенол;
- включает определение показателей БПК и ХПК, которые необходимы для оценки состояния водной экосистемы и качества, растворенного в воде органического вещества;
- обладает высокой точностью, подтверждённой Межлабораторными Сличительными Испытаниями и поверками.
- может потребовать дополнительного времени для проведения испытаний – до 5 рабочих дней;
- может потребоваться дополнительная тара для отбора воды для определения рядя показателей: нефтепродукты, фенол, ХПК и БПК.
| Определяемый показатель | Нормативный документ на методику |
|---|---|
| Обобщённые показатели | |
| pH | РД 52.24.495-2017 |
| БПК5 | ПНД Ф 14.1:2:3:4.123-97 (йодометрический метод) (издание 2004 г.) |
| Нефтепродукты | выбирается лабораторией |
| Химическое потребление кислорода | ГОСТ 31859-2012 |
| Неорганические соединения | |
| Ионы аммония | ПНД Ф 14.1:2:4.276-2013 (издание 2013 г.) |
| Нитрат-ионы | ПНД Ф 14.1:2:4.132-98 (издание 2008 г.) |
| Нитрит-ионы | ПНД Ф 14.1:2:4.132-98 (издание 2008 г.) |
| Сульфат-ионы | ПНД Ф 14.1:2:4.132-98 (издание 2008 г.) |
| Фосфат-ионы | ПНД Ф 14.1:2:4.132-98 (издание 2008 г.) |
| Фторид-ионы | ПНД Ф 14.1:2:4.132-98 (издание 2008 г.) |
| Хлорид-ионы | ПНД Ф 14.1:2:4.132-98 (издание 2008 г.) |
| Элементы | |
| Железо | выбирается лабораторией |
| Кадмий | ЦВ 3.18.05-2005 |
| Марганец | ЦВ 3.18.05-2005 |
| Медь | ЦВ 3.18.05-2005 |
| Мышьяк | ЦВ 3.18.05-2005 |
| Никель | ЦВ 3.18.05-2005 |
| Ртуть | выбирается лабораторией |
| Свинец | ЦВ 3.18.05-2005 |
| Цинк | ЦВ 3.18.05-2005 |
| Органические соединения | |
| АПАВ | ПНД Ф 14.1:2:4.158-2000 (издание 2014 г.) |
| Фенол | ПНД Ф 14.1:2:4.225-2006 (издание 2018 г.) |
Анализ проводится с использованием передовых методик и техник анализа, в том числе фотометрии, ионной хроматографии, атомной абсорбции и потенциометрии, масс-спектрометрии, жидкостной хроматографии, что обеспечивает высокую точность и низкие уровни риска получения недостоверных результатов.
источник
- Область применения
- Санитарно-микробиологические исследования
- Отбор, хранение и транспортирование проб
- Аппаратура, расходные материалы, реактивы, питательные среды
- Подготовка посуды и материалов
- Приготовление питательных сред и реактивов
- Подготовка к анализу
- Методика работы при использовании мембранных фильтров
- Определение общих и термотолерантных колиформных бактерий методом мембранной фильтрации
- Определение общих и термотолерантных колиформных бактерий титрационным методом
- Определение колифагов прямым методом
- Определение патогенных бактерий семейства Enterobacteriaceae рода Salmonella
- Определение кишечных вирусов
- Санитарно-паразитологические исследования
- Отбор, хранение и транспортирование проб
- Методики санитарно-паразитологического исследования воды поверхностных водоемов
- Флотационный метод исследования воды
- Метод санитарно-паразитологического исследования воды с применением прозрачных аналитических трековых мембран
- Методика санитарно-паразитологического исследования воды на наличие ооцист криптоспоридий
- Идентификация выявленных возбудителей кишечных паразитарных болезней
- Визуальная оценка вероятной жизнеспособности цист патогенных простейших кишечника и яиц гельминтов
- Библиографические данные
- Приложения для микробиологических исследований
- Приложение 1 (обязательное) Определение общего числа микроорганизмов, образующих колонии на питательном агаре
- Приложение 2 (обязательное) Определение спор сульфитредуцирующих клостридий
- Приложение 3 (обязательное) Определение Esherichia coli методом мембранной фильтрации
- Приложение 4 (обязательное) Определение Escherichia coli титрационным методом
- Приложение 5 (обязательное) Определение энтерококков методом мембранной фильтрации
- Приложение 6 (обязательное) Определение энтерококков титрационным методом
- Приложение 7 (обязательное) Метод определения числа стафилококков
- Приложение 8 (обязательное) Таблицы расчета наиболее вероятного числа микроорганизмов
- Приложение 9 (справочное) Схема посева воды из различных объектов при работе методом мембранных фильтров
- Приложение 10 (справочное) Схема посева воды из различных объектов при работе титрационным методом
- Приложение 11 Цисты патогенные кишечных простейших и яйца гельминтов, определяемые методикой санитарно-паразитологического исследования воды
- Приложение 12 Яйца гельминтов, определяемые методикой санитарно-паразитологического исследования воды
- Приложение 13 Схема выполнения методики использования прозрачных аналитических трековых мембран
1.1. Настоящие методические указания по методам контроля (далее — МУК) устанавливают методы санитарно-микробиологического и санитарно-паразитологического контроля качества воды поверхностных водных объектов в пунктах питьевого, хозяйственно-бытового и рекреационного водопользования, а также у населенных мест в соответствии с СанПиН 2.1.5.980-00 «Гигиенические требования к охране поверхностных вод», СанПиН 2.1.4.1074-01 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества».
1.2. Методические указания предназначены для органов и учреждений государственной санитарно-эпидемиологической службы, обеспечивающих государственный санитарно-эпидемиологический надзор и контроль за качеством воды поверхностных водоемов, используемых или намечаемых к использованию в качестве источников централизованного водоснабжения, зон рекреации, а также могут быть использованы лабораториями организаций, осуществляющих производственный контроль.
1.3. Санитарно-микробиологический анализ воды подземных источников проводят в соответствии с МУК 4.2.1018-01 «Санитарно-микробиологический анализ питьевой воды».
1.4. Санитарно-микробиологический анализ воды действующих источников в черте населенных мест, зонах рекреации осуществляют по показателям СанПиН 2.1.5.980-00 «Гигиенические требования к охране поверхностных вод»: общие и термотолерантные колиформные бактерии, колифаги, возбудители кишечных инфекций (сальмонеллы, энтеровирусы).
1.5. При выборе нового поверхностного источника централизованного питьевого водоснабжения, а также при решении вопроса о необходимости проведения оздоровительных мероприятий или закрытия зоны рекреации, анализ качества воды проводят по более широкому набору микробиологических показателей в соответствии с действующими документами. Методы определения дополнительных показателей приведены в прилож. 1- 10.
Отбор проб осуществляют в соответствии с требованиями ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб» и ГОСТ Р 51593-2000 «Вода питьевая. Отбор проб».
Пробы для санитарно-микробиологического анализа отбирают в стерильные емкости.
Для отбора проб воды используют специально предназначенную для этих целей одноразовую посуду или емкости многократного применения, изготовленные из материалов, не влияющих на жизнедеятельность микроорганизмов.
Емкости должны быть оснащены плотно закрывающимися пробками (силиконовыми, резиновыми или из других материалов) и защитным колпачком (из алюминиевой фольги, плотной бумаги) или завинчивающимися крышками. Многоразовая посуда, в т.ч. пробки, должна выдерживать стерилизацию сухим жаром или автоклавированием.
Стерильные емкости открывают непосредственно перед отбором, удаляя пробку вместе со стерильным колпачком. Во время отбора пробка и края емкости не должны чего-либо касаться. Ополаскивать посуду не следует.
После наполнения емкость закрывают стерильной пробкой, обеспечивающей герметичность и не намокающей при транспортировании (ватные пробки не применять), и стерильным колпачком.
При заполнении емкостей должно оставаться пространство между пробкой и поверхностью воды, чтобы пробка не смачивалась при транспортировании.
Поверхностные пробы отбирают с глубины 10-15 см от поверхности воды или от нижней кромки льда. Придонные пробы отбирают в 30-50 см от дна. Отбор проб следует производить с использованием различных плавсредств, с мостов, помостов и т.п. в местах, где глубина водоемов не менее 0,5 м. Недопустимо производить отбор проб с берега.
Поверхностные пробы отбирают батометром с устройством для закрепления стерильных емкостей. Глубинные пробы отбирают специальным батометром, предназначенным для этих целей. Допускается использовать другие приспособления, установленные в приложении к ГОСТ Р 51592-00.
При отборе одним батометром нескольких проб, его каждый раз стерилизуют фламбированием. Из одной точки в первую очередь отбирают пробы для микробиологических исследований, а затем для других целей. Проруби делают, избегая внесения загрязнения со льда и инструментов. Руки перед отбором проб должны быть обеззаражены.
Для воды, содержащей токсичные металлы (бериллий, ртуть, кадмий, таллий) массовой концентрацией более 0,01 мг/л, в емкости до их стерилизации добавляют 0,3 мл 15%-ного раствора нитрилотриуксусной кислоты на 500 мл пробы.
Отбор проб производит специалист после прохождения инструктажа по технике выполнения отбора проб для микробиологического анализа.
Отобранную пробу маркируют и сопровождают документом отбора проб воды с указанием места, даты, времени забора, фамилии специалиста, отбиравшего пробу, и другой информации (температуры воды, погодных условий).
Объем пробы зависит от того, какие микроорганизмы должны быть определены, например, при анализе воды:
— на индикаторные микроорганизмы — не менее 500 мл;
— на индикаторные и патогенные бактерии (сальмонеллы) — 1,5 л.
Доставку проб воды осуществляют в контейнерах-холодильниках при температуре (4-10) °С. В холодный период года контейнеры снабжают термоизолирующими прокладками, обеспечивающими предохранение проб от промерзания. В лаборатории, если анализ по каким-либо причинам откладывают, пробы следует поместить в холодильник.
При соблюдении указанной температуры транспортирования и хранения срок начала исследований от момента отбора проб не должен превышать 6 ч. Если пробы нельзя охладить, их анализ проводят в течение 2 ч после забора.
Если не может быть соблюдено время доставки пробы и температура хранения, анализ пробы по бактериологическим показателям не проводят.
Метод отбора и концентрирования кишечных вирусов из воды поверхностных водоемов представлен в п. 2.11.
2.2.1. Аппаратура
Термостаты для температурного режима (37±1) °С
Термостат и водяная баня с автоматическим регулированием температуры (44 ± 0,5) °С
Водяная баня для температурного режима (75 ± 5) °С
Водяная баня или термостат для температурного режима 45-49 °С (для питательных сред)
Прибор для мембранной фильтрации под вакуумом с диаметром фильтрующей поверхности 35 или 47 мм и устройство для создания разрежения 0,5-1,0 атм.
Весы лабораторные общего назначения 4 класса точности, с пределом взвешивания до 1000 г, допустимая погрешность не более 0,1 г
Весы лабораторные общего назначения 4 класса точности, с пределом взвешивания до 200 г, допустимая погрешность не более 0,02 г
Весы торсионные с диапазоном измерений от 0 до 500 мг
Термометр ртутный с диапазоном измерения от 0 до 50 °С с ценой деления шкалы 0,5 °С
Термометр ртутный с диапазоном измерения от 0 до 200 °С с ценой деления шкалы 1 °С
Термометр спиртовой с диапазоном измерения от -50 до +50 °С с ценой деления шкалы 1°С
РН-метр, обеспечивающий измерение с погрешностью до 0,01
Дистиллятор, обеспечивающий качество дистиллированной воды не ниже
Стерилизатор суховоздушный для температурного режима (180 ± 5) °С
Стерилизатор паровой, режим работы от 0 до 2,5 кгс/см 3
Холодильники бытовые электрические с температурой в камере 4-6 °С
Холодильник глубокого замораживания (-20 °С) *
Вытяжной шкаф для работы с хлороформом при исследованиях на колифаги *
Нагревательный прибор для варки питательных сред, либо магнитные мешалки с подогревом до 300 °С
Прибор для счета колоний бактерий
Лупа с двукратным увеличением
Дозаторы для разлива жидких питательных сред и растворов
Оптический стандарт мутности на 10 ед.
Микроскоп стереоскопический, обеспечивающий увеличение от 3,5х до 119х, с полем зрения 39-1,9 мм
Инвертированный микроскоп для просмотра флаконов с культурами клеток при анализе на энтеровирусы *
Микроскоп биологический, обеспечивающий увеличение от 84х до 1350х
Батометр с устройством для закрепления стерильных емкостей
Батометр специальный для отбора проб с разных глубин
Часы сигнальные или песочные
Центрифуга лабораторная рефрижераторная ЦЛР-1МР *
Ламинарный шкаф для культуры клеток (класс не ниже 2) *
Микродозаторы переменного объема: на 0,5-10 мкл; 40-200 мкл; 200-1000 мкл
Штатив для микродозаторов 5-поз.
Наконечники на 200, 1000 мкл
1) * Аппаратура, используемая для вирусологического анализа.
2) Для экспресс анализа индикаторных и патогенных микроорганизмов в воде может использоваться микробиологический анализатор «БакТрак 4000» в соответствии с МУК 4.2.1111-02.
2.2.2. Посуда лабораторная стеклянная
Пробирки (многоразового или одноразового использования)
Цилиндры, вместимостью 100, 250, 500 мл или мензурки, вместимостью 250, 500, 1000 мл
Чашки бактериологические (Петри)
Пипетки, вместимостью 1, 2, 5, 10 мл с ценой деления 0,1 мл (многоразового или одноразового использования)
Стеклянные бюретки, диаметром 12-13 мм и высотой 35-40 см
Флаконы стеклянные или пластиковые (одноразовые) для культивирования культур тканей емкостью: 5, 100, 200, 500 и 1000 мл
2.2.3. Расходные материалы
Мембранные фильтры для микробиологических целей с диаметром пор не более 0,45 мкм и размером диска 35 или 47 мм или другие фильтрующие мембраны с аналогичной способностью фильтрации, имеющие сертификат качества
Индикаторы бумажные для определения рН в диапазоне 6-8 с интервалом определения 0,2
Фольга алюминиевая, колпачки металлические
Горелки газовые или спиртовки
Пинцеты для работы с мембранными фильтрами
Пробки различных размеров: силиконовые, резиновые и другие, выдерживающие стерилизацию сухим жаром или автоклавированием
Вата хлопковая медицинская гигроскопическая
Бумага плотная для упаковки посуды
Штативы комбинированные для пробирок 0,6 и 1,5 мл
Штативы для культивирования клеток культур ткани в пробирках в статическом состоянии
Планшеты пластиковые для культивирования культур тканей
2.2.4. Химические реактивы
Железо серно-кислое закисное 7-водное
Натрий серноватисто-кислый (тиосульфат натрия) 5-водный
Спирт этиловый технический
Натрий сернисто-кислый (сульфит натрия)
N,N,N’,N’,-тетраметил-п-фенилендиамин гидрохлорид или N,N-диметил-п-фенилендиамин соляно-кислый
Калий фосфорно-кислый однозамещенный
Калий фосфорно-кислый двузамещенный
Натрий фосфорно-кислый двузамещенный безводный
Натрий фосфорно-кислый однозамещенный
Кристаллический фиолетовый водорастворимый
Трис (Tris (hydroxymethyl) aminomethone) M. в 121, Sigma T 1378*
Бифэкстракт (сухой) Sigma B-4888*
Макропористое стекло — МПС 1000 ВГХ
Все химические реактивы должны соответствовать квалификации не ниже ЧДА.
* Вещества, используемые для вирусологического анализа.
** Вещества обладают канцерогенным и мутагенным действием, работа с ними требует соблюдения мер предосторожности.
*** Вещества, используемые для исследований на колифаги и энтеровирусы.
2.2.5. Питательные среды
Питательная среда для выделения энтеробактерий, сухая (типа Эндо)
Сухой препарат с индикатором ВР и лактозой или среда Гисса с лактозой
Сухой препарат с индикатором ВР и глюкозой или среда Гисса с глюкозой
Пептон сухой ферментативный для бактериологических целей
Системы индикаторные бумажные (СИБ)
Питательная среда для накопления сальмонелл, сухая (селенитовый бульон)
Питательная среда для выделения энтерококков, сухая
Питательная среда для выделения стафилококков, сухая
Агар с эозин-метиленовым синим, сухой (среда Левина)
Питательная среда для первичной идентификации энтеробактерий (агар Клиглера)
Сыворотки агглютинирующие адсорбированные сальмонеллезные О и Н (сухие)
Сыворотки агглютинирующие адсорбированные поливалентные к сальмонеллам
Антибиотики: бензилпенициллин натриевая соль, сульфат стрептомицина*
Раствор Эрла 10-кратный 5860-68*
Среда Игла-МЭМ с двойным набором аминокислот*
Перевиваемые линии клеток RD, BGM, Нер-2*
Набор диагностических сывороток для типирования вирусов*
* Реактивы и питательные среды для вирусологического анализа.
Допускаются к использованию оборудование, расходные материалы, реактивы, питательные среды, диагностические препараты и системы идентификации с аналогичными характеристиками, разрешенные к применению для этих целей в установленном порядке.
Питательные среды и биологические препараты зарубежного производства должны иметь международный сертификат качества ISO 9000 или EN 29000.
При использовании следует руководствоваться рекомендациями фирмы-производителя.
Все обезвоженные питательные среды должны иметь сертификат соответствия.
2.2.6. Тест-культуры микроорганизмов
Контрольный колифаг MS-2 штамм ВКПМ РН 1505, штамм ВКПМ-3254 Е. coli К12 F + Str-r, штамм Escherichia coli 675, Staphylococcus aureus 906 и один из штаммов: Pseudomonas aeruginosa 10145 АТСС или Pseudomonas fluorescens 948 АТСС.
Штаммы получают во Всероссийской Коллекции Промышленных Микроорганизмов (Государственном НИИ генетики) и (или) в Национальном органе контроля (Государственном НИИ стандартизации и контроля медицинских и биологических препаратов им. Л.А. Тарасевича).
Примечание. В производственных лабораториях, расположенных на территории водопроводных станций, следует использовать штамм Pseudomonas fluorescens (температура инкубации культуры 25-28°С).
2.2.7. Внутренний контроль качества микробиологических исследований
Комплекс выполняемых лабораторией мероприятий и процедур, направленных на обеспечение и контроль стабильности требуемых условий роста микроорганизмов, ведения эталонных бактериальных культур, а также предупреждения неблагоприятного воздействия факторов, возникающих в процессе выполнения анализа и оценки его результатов, изложены в МУ 2.1.4.1057-01 «Организация внутреннего контроля качества санитарно-микробиологического исследования воды».
Вся посуда, применяемая для микробиологического анализа, должна быть стерильной.
Правила подготовки посуды и материалов — в соответствии с МУК 4.2.1018-01 «Санитарно-микробиологический анализ питьевой воды».
Срок хранения стерильной посуды не более 30 дней.
Лабораторная посуда для вирусологических исследований должна быть химически чистой, а именно, хорошо обезжирена, тщательно вымыта до полного удаления моющих средств и других посторонних примесей, высушена и простерилизована.
Новая стеклянная посуда должна выдерживаться в течение 2 ч в 15-20 %-ном растворе серной кислоты (применяется только химически чистая серная кислота) или в течение 10-12 ч в 4 %-ном растворе соляной кислоты. Работу необходимо проводить с соблюдением правил техники безопасности — в защитных очках, резиновом фартуке и резиновых перчатках. После обработки кислотой посуду тщательно промывают струей горячей воды (не менее 10 раз) и троекратно — дистиллированной водой, высушивают, монтируют в металлические контейнеры или в бумагу.
Посуду для микробиологического анализа стерилизуют в сухожаровом шкафу в течение 2 ч при 180 °С.
Контроль стерильности посуды проводят в соответствии с МУ 2.1.4.1057-01 «Организация внутреннего контроля качества санитарно-микробиологических исследований воды».
2.4.1. Общие требования
При выполнении микробиологического анализа следует отдавать предпочтение стандартизованным сухим питательным средам промышленного производства. При использовании промышленных сухих питательных сред их приготавливают в соответствии с указаниями изготовителя на этикетке. В этом случае следует соблюдать способ применения и срок хранения питательных сред, указанных на упаковках.
Общие требования к питательным средам даны в ГОСТ Р 51456-00.
Вновь приобретенная партия питательных сред должна пройти внутренний контроль качества в соответствии с МУ 2.1.4.1057-01 «Организация внутреннего контроля качества санитарно-микробиологических исследований воды».
По этому же документу выполняют контроль питательных сред на этапе приготовления, контроль условий и сроков хранения готовых питательных сред, контроль их биологических свойств, характеристик роста бактерий и т.п.
Питательные среды, разлитые в чашки и хранящиеся в холодильнике, перед посевом должны быть прогреты до комнатной температуры.
При наличии следов влаги на поверхности агаризованных сред проводят подсушивание в термостате, приоткрывая крышку, до исчезновения конденсата.
2.4.2. Растворы для разбавлений
2.4.2.1. Солевой (физиологический) раствор
В 1 л дистиллированной воды растворяют 8,5 г хлорида натрия, устанавливают рН с расчетом, чтобы после стерилизации рН = 7,0 ± 0,1. Разливают во флаконы, стерилизуют при температуре (120 ± 2) °С 20 мин. Разливают мерно непосредственно перед посевом.
Срок хранения — до 1 месяца при комнатной температуре.
В 1 л дистиллированной воды растворяют при кипячении 1 г пептона. Устанавливают рН с расчетом, чтобы после стерилизации рН = 7,0 ± 0,1. Разливают во флаконы. Стерилизуют при температуре (120 ± 2) °С 20 мин. Разливают мерно непосредственно перед посевом.
Срок хранения — до 1 месяца при комнатной температуре.
2.4.2.3. Пептонный солевой раствор
В 1 л дистиллированной воды растворяют при кипячении 8,5 г хлорида натрия и 1 г пептона. Устанавливают рН с расчетом, чтобы после стерилизации рН = 7,0 ± 0,1. Стерилизуют при температуре (120 ± 2) °С 20 мин. Разливают мерно непосредственно перед посевом.
Срок хранения — до 1 месяца при комнатной температуре.
2.4.3. Питательный бульон
Готовят из сухого препарата промышленного производства по способу, указанному на этикетке.
Питательный бульон (десятикратный) для колифагов готовят путем увеличения в 10 раз навески сухого препарата, указанной на этикетке.
2.4.4. Питательный агар
Готовят из сухого препарата промышленного производства по способу, указанному на этикетке.
Питательный агар не допускается выдерживать в расплавленном состоянии более 8 ч. Оставшийся неиспользованным агар повторному расплавлению не подлежит.
Питательный агар для определения колифагов прямым методом при посеве 20 мл пробы на чашку Петри готовят, увеличивая навеску сухого препарата в 2 раза от прописи. Разливают в емкости, автоклавируют при температуре (120 ± 2) °С 20 мин.
Полужидкий питательный агар готовят с использованием одной трети навески сухого препарата, указанной на этикетке. Разливают в пробирки и автоклавируют при температуре (120 ± 2) °С 20 мин.
Питательный агар со стрептомицином готовят из расчета содержания 100 мкг стрептомицина на 1 мл питательного агара, приготовленного по стандартной прописи. Стерильно на стерильной дистиллированной воде готовят раствор стрептомицина в концентрации 10 мг на 1 мл. В готовый питательный агар, отмеренный по объему и остуженный до температуры 45-49 °С, вносят приготовленный стерильный раствор стрептомицина из расчета 0,1 мл на 10 мл питательного агара. Разливают в пробирки для приготовления скошенного агара. Срок хранения питательного агара со стрептомицином не более 2 недель. Повторное расплавление питательной среды со стрептомицином запрещается.
2.4.5. Фуксин-сульфитная среда Эндо
Готовят из сухого препарата по способу, указанному на этикетке.
Готовую среду охлаждают до 60-70 °С и разливают в чашки Петри.
Если после застывания на поверхности среды заметны следы влаги, чашки перед посевом необходимо подсушить. Срок хранения чашек со средой не более 3-5 суток в темноте, если производителем не оговорены другие сроки.
Примечание. В соответствии со стандартом ИСО 9308-1-00 для определения колиформных бактерий методом мембранной фильтрации может использоваться лактозный ТТХ-тергитол-агар.
2.4.6. Лактозопептонная среда
Растворяют при нагревании в 1 л дистиллированной воды 10 г пептона, 5 г натрия хлористого, 5 г лактозы. После растворения ингредиентов добавляют индикатор (2 мл 1,6 %-ного спиртового раствора бромтимолового синего), устанавливают рН (7,4-7,6), разливают по 10 мл в пробирки. Для приготовления концентрированной лактозопептонной среды все ингредиенты, кроме воды, увеличивают в 10 раз, разливают по 1 мл в пробирки и по 10 мл во флаконы.
Готовую среду стерилизуют при (112 ± 2) °С 12 мин.
2.4.7. Питательные среды для подтверждения способности ферментировать лактозу до кислоты и газа
2.4.7.1. Полужидкая среда с лактозой из сухого препарата
Готовят по способу, указанному на этикетке.
Срок хранения не более 2 недель при комнатной температуре. В холодильнике не хранить.
Посев производят уколом до дна пробирки. При образовании кислоты цвет питательной среды изменяется в соответствии с использованным индикатором. При газообразовании газ скапливается или по уколу, или на поверхности, или в толще среды появляются разрывы. При инкубации посевов более 5 ч газ может улетучиться. В таких случаях на присутствие газа указывают оставшиеся в толще среды «карманы» — потемнения среды на месте бывшего пузырька газа.
2.4.7.2. Жидкая лактозопептонная среда
Готовят в соответствии с п. 2.4.6 с добавлением 1 мл 1,6 %-ного спиртового раствора бромтимолового синего на 1 л среды, разливают по 3-5 мл в пробирки с поплавком или комочком ваты.
Готовят по прописи завода-изготовителя.
Примечание. При выборе среды для подтверждения ферментации углеводов целесообразно использовать полужидкие среды, которые позволяют улавливать небольшое количество газа и на ранних стадиях ферментации, что повышает чувствительность метода и скорость получения ответа через 4-6 ч.
2.4.8. Приготовление лактозного бульона с борной кислотой
Растворяют в 1 л дистиллированной воды 10 г пептона, 12,2 г калия фосфорно-кислого двузамещенного (безводного), 4,1 калия фосфорно-кислого однозамещенного (безводного), 3,2 г борной кислоты, 5 г лактозы, разливают по 5 мл в пробирки с поплавками или комочками ваты, стерилизуют при (112 ± 2) °С 12 мин. Срок хранения не более 2 недель.
Примечание. Каждую новую партию борной кислоты следует испытывать: при выращивании Е. coli при температуре 44°С среда дает положительную реакцию — помутнение и газ.
2.4.9. Реактивы для оксидазного теста
Раствор 1%-ный водный тетраметил-п-фенилендиамина гидрохлорида. Готовят перед употреблением.
Реактив N 1. Раствор 1 %-ный спиртовой α-нафтола.
Реактив N 2. Раствор 1 %-ный водный диметил-п-фенилендиамина дигидрохлорида.
Растворы сохраняют в темных флаконах с притертыми пробками: 1-й — до одного месяца, 2-й — до одной недели. Перед употреблением к трем частям первого раствора добавляют семь частей второго раствора.
Могут быть использованы коммерческие тест-системы для постановки оксидазного теста (СИБ-оксидаза или аналоги). Каждую новую партию и периодически раз в месяц реактивы или тест-системы на оксидазу следует испытывать с тест-культурами микроорганизмов, дающих положительную (Ps. aeruginosa, Ps. fluorescens) и отрицательную (Е. coli) оксидазную реакцию.
2.4.10. Железосульфитный агар
В 1000 мл стерильного расплавленного питательного агара (по п. 2.4.4) добавляют 10 г глюкозы, нагревают до растворения, разливают мерно во флаконы, автоклавируют при (112 ± 2) °С 12 мин (основная среда).
Непосредственно перед употреблением готовят 20 %-ный раствор сульфита натрия (Na2SO3) и 8%-ный раствор железа серно-кислого закисного (FeSO4) или железа хлористого (FeCl2) в стерильной посуде на стерильной дистиллированной воде. Раствор сульфита натрия нагревают до полного растворения. Перед выполнением анализа в 100 мл расплавленной основной среды вносят 5 мл 20 %-ного раствора сульфита натрия, перемешивают, затем вносят 1 мл 8 %-ного раствора серно-кислого железа, перемешивают и стерильно разливают во флаконы.
2.4.11. Щелочно-полимиксиновая среда (ЩЕС)
Растворы 1, 2 и 3 стерилизуют раздельно при 112 °С 12 мин. После стерилизации растворы смешивают, проверяют рН (10,0-10,2), прибавляют 20000 единиц полимиксина М, 0,5 мл 1,6 %-ного спиртового раствора бромтимолового синего, разливают в пробирки по 5 мл. В среду удвоенной концентрации добавляют 40000 единиц полимиксина М и 1 мл бромтимолового синего. Разливают в колбы или флаконы по 10, 50 и 100 мл соответственно количеству исследуемой воды.
2.4.12. Приготовление молочно-ингибиторной среды
Хорошо смешивают и разливают в чашки Петри 85 мл готового питательного агара, 15 мл стерильного обезжиренного (0,5 % жирности) молока, 1,25 мл 0,01 %-ного водного раствора кристаллического фиолетового, 1 мл 2 %-ного водного раствора теллурита калия.
2.4.13. Приготовление дрожжевого экстракта
Распределяют равномерно 1000 г прессованных (пекарских) дрожжей в 2000 мл дистиллированной воды, прогревают в автоклаве при 100 °С 30 мин, отстаивают в холодильнике 4-5 суток. Надосадочную жидкость разливают во флаконы по 50-100 мл, прибавляют на каждые 100 мл экстракта 1,25 мл 0,01 %-ного водного раствора кристаллического фиолетового, вновь прогревают при 100 °С 30 мин. Хранят экстракт в холодильнике. Экстракт можно готовить по этой же методике из 1000 г сухих дрожжей на 6000 мл дистиллированной воды. Можно применять сухой дрожжевой экстракт промышленного производства, уменьшив концентрацию в 10 раз от указанного в прописи п. 2.4.11.
2.4.14. Азидная среда Сланеца-Бертли
Сухой питательный агар промышленного производства по указанию на этикетке, 4 г калия фосфорно-кислого однозамещенного расплавляют при нагревании в 1000 мл дистиллированной воды, устанавливают рН 7,0, разливают мерно в емкости, стерилизуют при (120 ± 2) °С 20 мин.
Перед употреблением в расплавленный и слегка остуженный агар добавляют из расчета на 100 мл среды: дрожжевого экстракта — 2,0 мл, глюкозы — 1,0 г, азида натрия — 0,04 г, 1 %-ного водного раствора 2,-3,-5-трифенилтетразолий хлорида (ТТХ) — 1 мл. Тщательно смешивают, разливают в чашки по 20-25 мл. Хранят в холодильнике не более 2 недель. Среду можно готовить перед употреблением без стерилизации в автоклаве.
Допускается использовать сухой препарат промышленного производства — энтерококкагар.
2.4.15. Солевой агар с ТТХ
Сухой питательный агар по прописи на этикетке, хлорид натрия 65 г расплавляют при нагревании в 1000 мл дистиллированной воды. Осадок отфильтровывают, разливают мерно во флаконы, стерилизуют при (120 ± 2) °С 20 мин. Перед употреблением в расплавленную основу из расчета на 100 мл добавляют: 1 г глюкозы, 2 мл дрожжевого экстракта или другого дрожжевого препарата, 1 мл водного 1%-ного раствора ТТХ. Тщательно смешивают, разливают в чашки.
2.4.16. Желточно-солевой агар (ЖСА)
Сухой питательный агар по указанию на этикетке и 65 г хлорида натрия растворяют при нагревании в 1000 мл дистиллированной воды, разливают мерно в емкости, стерилизуют при (120 ± 2) °С 20 мин. Перед употреблением в расплавленный и остуженный до 50-55 °С солевой агар прибавляют один стерильно приготовленный яичный желток, тщательно смешанный с 50 мл физиологического раствора с помощью стеклянных бус, перемешивают и разливают в чашки Петри тонким слоем по 12 — 15 мл.
Допускается использовать сухой препарат промышленного производства (стафилококкагар).
2.4.17. Среда Мюллера-Кауфмана
В 500 мл исследуемой воды вносят 25 мл 10 %-ного пептона, 0,5 г желчных солей, 5 г кальция углекислого, 15 г натрия тиосульфата, 0,5 мл 0,1 %-ного водного раствора бриллиантового зеленого, 10 мл раствора Люголя. Для приготовления раствора Люголя в 10 мл воды вносят 3 г йода кристаллического и 2,5 г калия йодистого.
2.4.18. Приготовление желчной соли по Олькеницкому
К 1000 мл желчи крупного рогатого скота прибавляют 40 г натрия гидрата окиси, гидролизуют в автоклаве при 120 °С 3 ч или 2 раза по 2 ч в посуде, исключая алюминиевую. После охлаждения в гидролизат прибавляют 100 мл 20 %-ного водного раствора бария хлористого и прогревают в автоклаве при 100 °С 1 ч. Через 18-24 ч отстаивания сливают жидкость с осадка и фильтруют. К профильтрованному гидролизату прибавляют при постоянном помешивании 20 %-ный раствор соляной кислоты до кислой реакции (рН 6,4-6,6) и оставляют на 18-24 ч. Надосадочную жидкость сливают, осадок промывают водой, прибавляют при нагревании 40 %-ный раствор натрия гидрата окиси до слабо щелочной реакции (рН 7,2-7,4) и выливают на противень для подсушивания в сушильном шкафу при 115 °С до порошкообразного состояния. Из 1 000 мл желчи можно получить 36 г смеси желчных солей. Следует остерегаться перещелачивания при последней операции. Хранят соли в темной банке с притертой пробкой.
2.4.19. Селенитовая среда Лейфсона
Готовят из сухого препарата промышленного производства по указанию на этикетке.
Для приготовления селенитового бульона двойной концентрации увеличивают навеску сухого препарата в два раза на тот же объем дистиллированной воды.
2.4.20. Магниевая среда
Приготовление 100 мл среды обычной и двойной концентрации.
Готовят раздельно растворы А, Б, В по нижеследующей прописи:
Калий фосфорно-кислый однозамещенный
Магний хлористый кристаллический
Бриллиантовый зеленый 0,1 %-ный водный раствор
Ингредиенты растворяют, кипятят в течение 10 мин, затем растворы А, Б и В сливают в одну колбу.
Для посева больших объемов воды можно предварительно готовить навески и растворы ингредиентов среды в расфасованном виде, которые затем вносят в исследуемую воду в соответствии с нижеследующей прописью:
Магний хлористый кристаллический
Калий фосфорно-кислый однозамещенный безводный
Бриллиантовый зеленый 0,1 %-ный водный раствор
Все навески можно соединить в одной емкости в виде жидкой кашицы. Уже через 24 ч хранения при комнатной температуре происходит стерилизация концентрата. Дополнительная стерилизация не требуется.
2.4.21. Тетратианатная среда накопления по Preuss
К 1000 мл мясопептонного бульона добавляют 5 мл 0,1 %-ного водного раствора кристаллического фиолетового, стерилизуют при (112 ± 2) °С 12 мин. После охлаждения добавляют 20 г тетратианата калия, устанавливают рН 6,5. Среду разливают в стерильные емкости, необходимого для последующего посева размера. Срок хранения — до одной недели при температуре 4 °С.
2.4.22. Висмут-сульфит агар
Готовят из сухого препарата промышленного производства по указанию на этикетке.
2.4.23. Приготовление SS-агара
Готовят из сухого препарата промышленного производства по указанию на этикетке.
2.4.24. Приготовление индикаторных бумажек для определения продукции индола
Растворяют 4 г пара-диметиламинобензальдегида в 50 мл этилового спирта 96°, добавляют 10 мл орто-фосфорной кислоты (очищенной, концентрированной). Реактивом смачивают полоски из фильтровальной бумаги на 1/3 их длины. Смоченный конец — лимонно-желтый. Высушенные индикаторные бумажки можно сохранять в темноте длительное время. Чувствительность бумажек возрастает при замене этилового спирта на амиловый или изоамиловый.
2.4.25. Среда с триптофаном
Растворяют 10 г ферментативного пептона, 5 г натрия хлористого, 1 г триптофана в 1000 мл дистиллированной воды, устанавливают рН 7,2, разливают в стерильные пробирки по 5-6 мл и автоклавируют при (120 ± 2) °С 20 мин.
2.4.26. Реактив Ковача
Растворяют 5 г пара-диметиламинобензальдегида в 75 мл амилового спирта на водяной бане при 60 °С. Затем медленно добавляют 25 мл концентрированной соляной кислоты. Приблизительно через 6 ч, после изменения цвета, реактив готов для употребления. Цвет готового реактива должен быть от светло-желтого до светло-коричневого. При использовании некачественного амилового спирта реактив может приобрести темный цвет. Реактив следует хранить при температуре 4 °С в темном месте во флаконе из коричневого стекла. Срок хранения — две недели.
2.5.1. Подготовка проб воды
Перед посевом пробу тщательно перемешивают и фламбируют горящим тампоном край емкости. Используемые пробирки и чашки маркируют.
Перед каждым отбором новой порции воды для анализа пробу перемешивают продуванием воздуха стерильной пипеткой.
2.5.2. Приготовление разбавлений
Для посева объемов воды, меньших, чем 1 мл, используют разбавления анализируемой воды. Перед посевом растворы для разбавления ( п. 2.4.2) разливают по 9 мл в пробирки с соблюдением правил стерильности. Затем в первую пробирку с 9 мл раствора вносят 1 мл анализируемой воды. При этом пипетка не должна быть опущена ниже поверхности воды, чтобы избежать смывания бактерий с наружной стороны. Другой стерильной пипеткой продуванием воздуха тщательно перемешивают содержимое пробирки, отбирают из нее 1 мл и переносят в чашку Петри, что будет соответствовать посеву 0,1 мл анализируемой воды. При необходимости посева меньших объемов, этой же пипеткой переносят 1 мл содержимого первой пробирки в следующую пробирку с 9 мл раствора для разбавления. Другой стерильной пипеткой делают посев 1 мл из второй пробирки, что будет соответствовать посеву 0,01 мл анализируемой воды. В случаях высокого уровня загрязнения воды разбавление продолжают аналогично, каждый раз меняя пипетку.
Время от момента приготовления разбавлений и заливки питательным агаром не должно превышать 30 мин.
Подготовка мембранных фильтров, фильтровального аппарата, выполнение фильтрования воды — в соответствии с МУК 4.2.1018-01 «Санитарно-микробиологический анализ питьевой воды».
2.7.1. Определение понятия показателей
Общие колиформные бактерии (ОКБ) — грамотрицательные, оксидазоотрицательные, не образующие спор палочки, способные расти на дифференциальных лактозных средах, ферментирующие лактозу до кислоты и газа при температуре (37 ± 1) °С в течение 24-48 ч.
Термотолерантные колиформные бактерии (ТКБ) входят в число общих колиформных бактерий, обладают всеми их признаками и, кроме того, способны ферментировать лактозу до кислоты и газа при температуре (44 ± 0,5) °С в течение 24 ч.
2.7.2. Значение показателей и область применения
ОКБ — основной нормируемый показатель при оценке качества воды водоемов в местах водозаборов для централизованного водоснабжения, рекреации, в черте населенных пунктов. ОКБ — интегральный показатель степени фекального загрязнения, который включает ТКБ, Е. coli, и поэтому обладает индикаторной надежностью в отношении возбудителей бактериальных кишечных инфекций. ОКБ — наиболее чувствительный показатель при выявлении источников фекального загрязнения, в т. ч. небольших.
ТКБ рекомендуется определять одновременно в одном и том же посеве с ОКБ для подтверждения фекального происхождения загрязнения. Уровни ОКБ и ТКБ в воде водоемов, загрязняемых сточными водами, близки, различия находятся в пределах ошибки метода. По мере удаления от источника загрязнения и воздействия факторов самоочищения различия в численности этих групп индикаторов возрастают.
При высоком антропогенном, в частности, химическом загрязнении водоемов, сбросах недостаточно обеззараженных сточных вод, нарушении естественного статуса водоема (зарегулированные водоемы, каналы и т.п.) возможно снижение индикаторного значения лактозоположительных ОКБ и ТКБ в результате их более интенсивного отмирания, чем патогенных (сальмонеллы) и условно-патогенных бактерий семейства Enterobacteriaceae. Если при этом центром Госсанэпиднадзора установлено несоответствие данных анализа по ОКБ и ТКБ (менее 1000 и 100 КОЕ соответственно) и неблагоприятной санитарно-гигиенической обстановки (нарушение режима в зонах санитарной охраны водопроводов, сброс сточных вод, урбанизации территорий водосбросов и т.п.), следует обратить внимание на рост лактозоотрицательных колоний, определить их принадлежность к бактериям семейства Enterobacteriaceae (по отрицательному оксидазному тесту и ферментации глюкозы до кислоты и газа) и включить их в число ОКБ при выдаче результата.
2.7.3. Выполнение анализа
2.7.3.1. Определение общих колиформных бактерий
Объем воды для посева выбирают в зависимости от степени ее предполагаемого загрязнения с таким расчетом, чтобы не менее чем на 2 фильтрах выросли изолированные колонии. При этом можно ориентироваться на результаты предыдущих исследований и на рекомендации прилож. 9.
При исследовании воды неизвестной степени бактериального загрязнения следует засевать не менее 4 десятикратных ее объемов.
Отмеренный объем воды фильтруют через мембранные фильтры с соблюдением требований, изложенных в п. 2.6.
Фильтр переносят не переворачивая на среду Эндо, приготовленную по п. 2.4.5, и добиваются полного прилегания его к среде без пузырьков воздуха. Чашки с посевами помещают в термостат дном вверх и инкубируют при температуре (37 ± 1)°С в течение 18-24 ч.
Для учета выбирают фильтры, на которых выросли изолированные типичные для лактозоположительных бактерий колонии: темно-красные, красные, с металлическим блеском и без него, слизистые с темно-малиновым центром с отпечатком на обратной стороне фильтра. Для повышения точности анализа учет ведут не менее чем на двух фильтрах с числом типичных для колиформных бактерий колоний не менее 10 и не более 30 для фильтров с диаметром диска 35 мм и не менее 15 и не более 50 для фильтров с диаметром диска 47 мм. Допустимо вести учет по 1 фильтру или на фильтрах с более густым ростом, но с обязательной оговоркой в приложении к протоколу анализа.
Выполняют оксидазный тест одним из методов.
1. Мембранный фильтр с выросшими на нем колониями переносят на кружок фильтровальной бумаги несколько большего диаметра, чем фильтр, обильно смоченный реактивом для определения оксидазной активности ( п. 2.4.9, вар. 1 или 2) или на диск СИБ-оксидаза, смоченный дистиллированной водой. При появлении первых признаков положительной реакции, но не более чем через 5 мин, мембранный фильтр переносят обратно на среду Эндо. После четкого проявления реакции определяют результат. При появлении фиолетово-коричневого или синего окрашивания колоний (в зависимости от примененного реактива) оксидазный тест считают положительным.
2. Полоску фильтровальной бумаги помещают в чистую чашку Петри и смачивают 2-3 каплями реактива для оксидазного теста. Бумажные системы промышленного производства смачивают дистиллированной водой. Подсчитывают типичные колонии каждого типа и по 3-4 — изолированные колонии, из них платиновой петлей или стеклянной палочкой (металлическая петля из нихрома дает ложноположительную реакцию при работе с реактивом — тетраметил-п-фенилендиамином) наносят штрихом на подготовленную фильтровальную бумагу. Реакция считается положительной, если в течение 1 мин появляется сине-фиолетовое окрашивание штриха. При отрицательной реакции цвет в месте нанесения культуры не меняется.
Методом 2 следует проводить определение оксидазной активности при росте на фильтрах изолированных колоний или при получении чистых культур после рассева на среде Эндо, поскольку при наложении или соприкосновении колоний колиформных бактерий с оксидазоположительными колониями посторонних бактерий можно получить ложноположительную реакцию и неоправданно отбросить из учета колонии бактерий, являющихся индикаторами фекального загрязнения.
Метод 2 дает ошибку определения при нерепрезентативной выборке колоний для исследования, в отличие от метода 1, с помощью которого выявляется оксидазная активность одновременно всех выросших колоний.
Все оксидазоположительные колонии из учета исключают. Среди колоний, не изменивших первоначального цвета (оксидазоотрицательных), подсчитывают число типичных лактозоположительных колоний (с отпечатками на обратной стороне фильтра до выполнения оксидазного теста).
При лабораторно-производственном контроле за эксплуатируемыми объектами анализ может быть завершен подсчетом таких колоний, которые отнесены к ОКБ по двум признакам: отрицательному оксидазному тесту и ферментации лактозы на лактозной среде Эндо до кислоты.
Дальнейшее подтверждение ОКБ по способности образовывать газ на лактозных средах проводят в следующих случаях:
— при отсутствии достаточно четкой дифференциации лактозоположительных колоний;
— при росте мелкоточечных или мелких плоских колоний, не характерных для колиформных бактерий;
— при небольшом опыте работы выполняющего анализ.
В этих случаях по 2-3 колонии каждого подсчитанного типа оксидазоотрицательных колоний сразу же после постановки оксидазного теста пересевают в одну из подтверждающих сред с лактозой ( п. 2.4.7).
Посевы инкубируют при температуре (37 ± 1) °С в течение 48 ч. Первичный учет на подтверждающих полужидких средах и СИБ возможен через 4-6 ч. При обнаружении кислоты и газа дают положительный ответ. При отсутствии кислоты и газа или при наличии только кислоты пробирки с посевами оставляют для следующего просмотра через 24 ч, а при отрицательном результате для окончательного учета через 48 ч.
2.7.3.2. Определение термотолерантных колиформных бактерий
После постановки оксидазного теста с тех же фильтров с изолированными колониями, которые были выбраны для учета ОКБ, выполняют посев типичных оксидазоотрицательных колоний на одну из подтверждающих сред с лактозой ( п. 2.4.7). При числе колоний менее 15 они исследуются все, а более 15 — подсчитывают колонии разных типов и исследуют по 4-5 колоний каждого из них. Среда перед посевом должна быть прогрета до температуры 44 °С. Посевы сразу же переносят в термостат и инкубируют при температуре (44 ± 0,5) °С в течение (24 ± 1) ч. При использовании полужидких сред и СИБ первичный учет можно проводить через 4-6 ч. При обнаружении кислоты и газа дают положительный ответ. При иных реакциях посевы оставляют в термостате для окончательного учета через 24 ч.
2.7.4. Учет результатов
Типичные колонии учитывают как ОКБ при отрицательном оксидазном тесте и образовании кислоты на лактозной среде Эндо. Среди этих колоний учитывают как ТКБ при подтверждении ферментации лактозы с образованием кислоты и газа при температуре 44 °С.
Если при выборочной проверке колоний одного типа получены неодинаковые результаты, то вычисляют числа ОКБ, ТКБ среди этого типа по формуле:
, где
X — число подтвержденных бактерий одного типа;
а — общее число колоний этого типа;
b — число проверенных из них;
с — число колоний с положительным результатом.
Подсчитывают число подтвержденных колоний ОКБ, ТКБ каждой группы отдельно. Подсчет ведут только на тех фильтрах, где количество изолированных колоний колиформных бактерий не более 30-50. Результат подсчета на каждом фильтре суммируют и по формуле определяют число КОЕ в 100 мл.
, где
X — число КОЕ ОКБ или ТКБ в 100 мл;
а — число подтвержденных колоний в сумме;
V — объем воды, профильтрованный через фильтры, на которых велся учет.
Окончательный результат в протоколе анализа выдают: число КОЕ ОКБ в 100 мл, из них число КОЕ ТКБ в 100 мл.
В случаях сплошного роста на всех фильтрах и невозможности учета результатов анализа в протоколе отмечают «зарост фильтров» и анализ повторяют.
При отсутствии на фильтрах колоний колиформных бактерий число КОЕ будет меньше той величины, которая была бы определена в случае обнаружения в анализируемом объеме одной клетки ОКБ, ТКБ. При повторном анализе объем исследуемой воды увеличивают. В чистых водоемах фильтруют 100 мл.
2.8.1. Определение понятия показателя и его значение по п.п. 2.7.1 и 2.7.2
2.8.2. Область применения
Титрационный метод может быть использован:
— при отсутствии материалов и оборудования, необходимых для выполнения анализа методом мембранной фильтрации;
— при анализе воды с большим содержанием взвешенных веществ;
— в случае преобладания в воде посторонней микрофлоры, препятствующей получению на фильтрах изолированных колоний общих колиформных бактерий.
2.8.3. Выполнение анализа
Объем воды для посева выбирают с таким расчетом, чтобы в минимальных объемах или в наибольшем разбавлении получить один или несколько отрицательных результатов. При этом следует ориентироваться на результаты предыдущих исследований воды в этом же месте водоема и на рекомендации прилож. 10, а также таблиц расчета НВЧ ( прилож. 8).
Выбирают схему посева в 2 или 3 параллельных рядах, учитывая при этом, что чем больше повторностей, тем выше точность получаемых результатов.
Каждый объем воды или ее разбавления засевают в лактозопептонную среду, приготовленную в соответствии с п. 2.4.6. Посев 10 мл анализируемой воды вносят в пробирки с 1 мл концентрированной лактозопептонной среды, 1 мл пробы воды и 1 мл из разбавлений вносят в пробирки с 10 мл среды нормальной концентрации.
Посевы инкубируют при температуре (37 ± 1) °С в течение 24 ч.
Полное отсутствие изменения среды позволяет дать отрицательный ответ.
Из посевов в среду накопления, где отмечено помутнение, образование кислоты и газа или только помутнение, производят высев петлей на сектора среды Эндо с таким расчетом, чтобы получить изолированные колонии. Посевы на среде Эндо инкубируют при температуре (37 ± 1) °С в течение 16-18 ч.
2.8.3.1. Определение общих колиформных бактерий
При наличии в среде накопления помутнения и газообразования, а при высеве на подтверждающую среду типичных для лактозоположительных колоний (темно-красных с металлическим блеском или без него), выполняют оксидазный тест в соответствии с п. 2.7.3.1 методом 2 или путем нанесения капель реактива на часть сектора. При обнаружении оксидазоотрицательных колоний дают положительный ответ на наличие ОКБ в данном объеме пробы.
Наличие ОКБ требуется подтвердить:
— если в среде накопления имеет место сомнительная реакция (небольшое газообразование или только помутнение);
— если на среде Эндо выросли колонии с недостаточно четкими дифференциальными признаками лактозоположительных колиформных бактерий.
— проверяют наличие отпечатка на среде Эндо после снятия петлей подозрительных колоний;
— подтверждают способность к газообразованию при посеве изолированных 1-2 колоний каждого типа с каждого сектора на среду с лактозой в соответствии с п. 2.4.7 с последующей инкубацией посевов при температуре (37 ± 1) °С в течение 24 ч.
При отсутствии изолированных колоний проводят рассев на среду Эндо общепринятыми бактериологическими методами. Отрицательный ответ дают, если:
— в среде накопления нет признаков роста;
— на секторах среды Эндо нет роста;
— на секторах среды Эндо выросли не характерные для колиформных бактерий колонии (прозрачные, с неровными краями, расплывчатые, а также розовые без отпечатков на среде и т. п.);
— все колонии оказались оксидазоположительные;
— если в подтверждающем тесте на среде с углеводом не отмечено газообразования.
2.8.3.2. Определение термотолерантных колиформных бактерий
Для определения ТКБ работают с секторами среды Эндо, где выросли типичные лактозоположительные колонии, а в среде накопления обнаружено газообразование. Делают посев 2-3 изолированных колоний каждого типа с каждого сектора в пробирки с любой из лактозных сред, приготовленных в соответствии с п. 2.4.7.
Среду перед посевом нагревают на водяной бане или в термостате до 44 °С. Немедленно после посева пробирки помещают в термостат и инкубируют при температуре (44 ± 0,5) °С в течение 24 ч. Допускается просмотр посевов через 4-6 ч.
При образовании газа в среде накопления, росте на среде Эндо лактозоположительных бактерий и выявлении способности этих бактерий ферментировать лактозу до кислоты и газа в течение 24 ч при температуре 44 °С, дают положительный ответ на наличие в этом объеме пробы воды ТКБ. Во всех остальных случаях дают отрицательный ответ.
Для ускорения выдачи ответа на присутствие ТКБ производят высев 1 мл из объемов среды накопления, где отмечено помутнение и газообразование, в пробирки с лактозо-пептонной средой и поплавком или ваткой по п. 2.4.7.2 и прогретой предварительно до температуры 44 °С. Посевы выдерживают в термостате при температуре (44 ± 0,5) °С в течение 24 ч. При обнаружении кислоты и газа дают положительный ответ.
2.8.4. Учет результатов
После определения положительных и отрицательных результатов на наличие ОКБ, ТКБ в объемах воды, засеянной в среду накопления, вычисляют наиболее вероятное число (НВЧ) КОЕ в 100 мл по одной из таблиц прилож. 8, соответствующих схеме посева и полученным результатам.
Для расчета выбирают 3 таких последовательных десятикратных разбавления или объема воды, засеянной в среду накопления, в которых получены как положительные, так и отрицательные результаты. Если имеют место сочетания положительных и отрицательных результатов, отсутствующие в таблицах, то при повторении таких сочетаний более чем в 1% случаев следует искать причины в неправильной технике выполнения анализа.
В протоколе анализа указывают: НВЧ КОЕ ОКБ в 100 мл, НВЧ КОЕ ТКБ в 100 мл. Доверительный интервал не указывают.
2.9.1. Определение понятия показателя
Колифаги — бактериальные вирусы, способные лизировать кишечную палочку и формировать зоны лизиса (бляшки) через (18 ± 2) ч при температуре (37 ± 1) °С на ее газоне на питательном агаре.
2.9.2. Значение показателя и область применения
Колифаги являются нормируемым показателем и предназначены для проведения текущего контроля качества воды поверхностных водоемов, служащих источником для питьевого и хозяйственно-бытового водоснабжения, водоснабжения пищевых предприятий, для рекреационного водопользования, а также в черте населенных мест в отношении возможного вирусного загрязнения.
2.9.3. Подготовка тест-культуры Е. coli K12F + Str-r
На всех этапах исследования используют бактериальную взвесь, приготовленную следующим образом: культуру Е. coli K12F + Str-r ( п. 2.2.6) засевают в пробирку со скошенным питательным агаром со стрептомицином ( п. 2.4.4). Через (18 ± 2) ч инкубации при температуре (37 ± 1) °С производят смыв бактерий с косяка 5 мл стерильного солевого раствора ( п. 2.4.2.1) и по стандарту мутности готовят взвесь Е. coli в концентрации 10 9 бактериальных клеток в 1 мл.
Допускается в день анализа внести культуру Е. coli K12F + Str-r в питательный бульон, при 37 °С инкубировать в течение 4 ч и использовать при внесении в питательный агар, расплавленный и остуженный до (44 ± 1) °С.
2.9.4. Выполнение анализа
Объем воды для посева выбирают в зависимости от степени ее загрязнения с таким расчетом, чтобы на чашках выросло до 300 БОЕ, без образования сливных зон. При посеве на чашку Петри 1 мл или соответствующих десятикратных разбавлений используют питательный агар в обычной прописи ( п. 2.4.4), при посеве 100 мл исследуемой воды — питательный агар двойной концентрации ( п. 2.4.4). В зависимости от плотности используемого агара проводят посевы воды по 10 мл на 10 чашек или по 20 мл на 5 чашек. Для освобождения исследуемой воды от сопутствующей бактериальной флоры, ее обрабатывают хлороформом из расчета 1 мл хлороформа на 10 мл воды. Пробу тщательно встряхивают и отстаивают в течение 15 мин при комнатной температуре для осаждения хлороформа. На исследование берут воду над хлороформом. В питательный агар ( п. 2.4.4), расплавленный и остуженный до (44 ± 1) °С, добавить смыв Е. coli K12F + Str-r (п. 2.9.3) из расчета 1,0 мл смыва на каждые 100 мл агара, перемешать. Для контроля культуры Е. coli на возможную контаминацию ее посторонними колифагами в одну чашку Петри вносят 10 мл стерильной водопроводной воды, прогретой до 20-25 °С, заливают 25 мл приготовленного агара с Е. coli K12F + Str-r и осторожно перемешивают.
Исследуемые объемы воды вносят в стерильные чашки Петри и заливают, слегка приоткрывая крышки, 25 мл смеси агара с кишечной палочкой. При посеве 100 мл воды температуру пробы предварительно доводят до 20-25 °С.
Содержимое чашек осторожно перемешивают и оставляют при комнатной температуре до застывания. Чашки с застывшим агаром помещают дном вверх в термостат и инкубируют при температуре (37 ± 1) °С в течение (18 ± 2) ч.
2.9.5. Учет результатов
Просмотр посевов осуществляется в проходящем свете.
При исследовании 100 мл воды (5 чашек по 20 мл) подсчитывают и суммируют все бляшки, выросшие на чашках Петри.
Если посевная доза была меньше 100 мл, то число колифагов вычисляют по формуле:
, где
а — сумма бляшек на чашках;
V — объем исследуемой воды.
При исследовании децинормальных разведений, число колифагов в 100 мл воды вычисляют по формуле:
, где
Результаты выражают в бляшкообразующих единицах (БОЕ) на 100 мл пробы воды. В контрольной чашке бляшки должны отсутствовать.
Предварительный учет результатов можно проводить через 5-6 ч инкубации. На этом этапе при наличии четких зон лизиса может быть выдан предварительный ответ о присутствии колифагов в воде.
Окончательный количественный учет прямого посева проводится через (18 ± 2) ч. Результаты выражают количеством бляшкообразующих единиц (БОЕ) на 100 мл пробы воды.
Если отмечен сливной рост бляшек и счет затруднителен, то по данным прямого посева может быть выдан качественный результат: «обнаружено в 100 мл воды».
При наличии зон лизиса в контрольной чашке результат исследования считается недействительным.
2.9.6. Постановка контролей
«Отрицательный контроль» — подтверждает отсутствие контаминации фагом питательных сред, лабораторной посуды, оборудования на этапах подготовки и проведения анализа, а также позволяет оценить способность тест-культуры Е. coli давать равномерный газон.
«Отрицательным контролем» служит исследование стерильной водопроводной воды, проводимое аналогично анализируемой пробе воды. С этой целью, в зависимости от посевной дозы исследуемой воды, в стерильную чашку Петри вносят от 1 до 20 мл стерильной водопроводной воды, заливают смесью мясопептонного агара с Е. coli и инкубируют (18 ± 2) ч при 37 °С.
В случае обнаружения бляшек колифагов в чашках с «отрицательным» контролем результаты исследования всей серии проб воды недействительны.
Следует проверить стерильность лабораторного оборудования, посуды, питательных сред, а также повторить контрольный посев на лизогенность тест-штамма Е. coli K12 F + Str-r.
Для проверки культуры на лизогенность необходимо использовать новую пробирку с культурой, хранящейся на полужидком агаре ( п. 2.4.7.1). В стерильную чашку Петри помещают 1 мл бактериальной взвеси и заливают расплавленным и остуженным до 45-49 °С питательным агаром, инкубируют при температуре 37 °С в течение (18 ± 2) ч.
Просмотр посевов осуществляют в проходящем свете. Наличие зон лизиса в контрольном посеве свидетельствует о спонтанно проявившемся свойстве культуры продуцировать фаги или контаминации ее колифагом в процессе работы.
Использование в работе лизогенной культуры запрещается. Необходимо получить новую лиофилизированную культуру ( п. 2.2.6).
2.9.7. Методика подтверждения фаговой природы лизиса
В сомнительных случаях необходимо провести контрольный посев на подтверждение фаговой природы лизиса.
С этой целью бактериологической петлей извлекают участок агара с бляшкой колифага, вызывающей сомнение, помещают его в 5 мл питательного бульона, куда добавляют каплю тест-культуры Е. coli K12F + Str-r и инкубируют при 37 °С в течение (18 ± 2) ч. Полученную культуру обрабатывают хлороформом или фильтруют через мембранный фильтр и исследуют на наличие фага. Высев осуществляют петлей или пипеткой на поверхность питательного агара, содержащего взвесь Е. coli, чашки инкубируют в термостате при 37 °С в течение (18 ± 2) ч. Наличие зон лизиса на поверхности агара расценивается как подтверждение наличия фага.
2.10.1. Область применения показателя
В соответствии с требованиями СанПиН 2.1.5.980-00 «Гигиенические требования к охране поверхностных вод» об отсутствии патогенных микроорганизмов в местах водопользования, контроль воды поверхностных водоемов осуществляют по определению бактерий рода Salmonella семейства Enterobacteriaceae и учитывают их отсутствие в 1000 мл воды как наиболее устойчивых из патогенных представителей этого семейства. Анализ на выделение других возбудителей инфекционных заболеваний с водным путем передачи выполняют только по эпидпоказаниям.
Бактерии рода Salmonella определяют: при выборе новых источников водоснабжения и зон рекреации; при установлении влияния выбросов сточных вод на водоем; при превышении нормативов по ОКБ и ТКБ и в повторно отобранных пробах; при ухудшении санитарно-гигиенической обстановки (появление новых источников загрязнения, при метереологических условиях, приводящих к смыву загрязнений с прилегающих территорий, экстремальных ситуациях и т.п.), а также при неблагоприятной санитарно-гигиенической и эпидемической ситуации. Частоту контроля определяют в каждом конкретном случае в соответствии с программой центров госсанэпиднадзора.
В водоемах, где уровни индикаторных микроорганизмов в местах водозаборов соответствуют требованиям СанПиН 2.1.5.980-00 «Гигиенические требования к охране поверхностных вод», периодический контроль на обнаружение сальмонелл необходимо предусмотреть: при несоблюдении режимов в зонах санитарной охраны водозаборов, особенно при сбросах недостаточно обеззараженных сточных вод; при химическом загрязнении; в водоемах с нарушенным естественным статусом (водохранилищах, каналах, нижних бьефах ГЭС и др.). При этом необходимо иметь в виду более длительные сроки выживаемости сальмонелл по сравнению с колиформами и, следовательно, снижение их индикаторного значения.
При обнаружении сальмонелл в местах рекреации необходимо рассмотреть вопрос о закрытии пляжа.
При обнаружении сальмонелл в местах водозаборов централизованного питьевого водоснабжения следует принять меры по усилению режимов очистки и обеззараживания, а при контроле их эффективности иметь в виду большую устойчивость сальмонелл в процессах обеззараживания по сравнению с ОКБ и ТКБ.
2.10.2. Выполнение анализа
Для определения сальмонелл исследуют 1000 мл воды водоемов, засевая по 500 мл в две из следующих сред накопления: селенитовый бульон по п. 2.4.19, магниевая среда по п. 2.4.20, среда Мюллера-Кауфмана по п. 2.4.17, тетратионатная среда по Preuss по п. 2.4.21 и другие апробированные для этих целей среды накопления.
2.10.2.1. Посев воды в среду Мюллера-Кауфмана для определения сальмонелл
К 500 мл исследуемой воды добавляют ингредиенты по прописи 2.4.17.
2.10.2.2. Посев воды в селенитовый бульон для определения
К 500 мл воды добавляют 500 мл селенитового бульона двойной концентрации по п. 2.4.19.
2.10.2.3. Посев воды в магниевую среду
К 500 мл исследуемой воды прибавляют навески и растворы ингредиентов по прописи п. 2.4.20.
2.10.2.4. Посев воды в тетратионатную среду
К 500 мл исследуемой воды добавляют 10 мл тетратианатной среды по п. 2.4.21.
2.10.2.5. Посев воды в магниевую среду для определения сальмонелл количественным методом
В случае необходимости количественного определения сальмонелл можно установить их концентрацию посевом в магниевую среду с титрованием в двух или трех параллельных рядах десятикратных разбавлений от 100 до 1 мл, прибавляя навески и растворы по прописи 2.4.20. Индекс сальмонелл определяют по таблицам прилож. 8.
2.10.2.6. Посев воды для определения сальмонелл методом мембранной фильтрации
Для посева 2 объемов по 500 мл отбирают 1000 мл воды. Каждый объем профильтровывают через один или несколько мембранных фильтров. Полученные фильтры из каждого объема помещают в 50-100 мл в любые две из перечисленных сред накопления. При затрудненной фильтрации большого объема пробы следует на фильтр с диаметром пор 0,45 мкм наложить фильтр с большим диаметром пор для задержания взвешенных частиц с последующим помещением на питательную среду обоих фильтров.
2.10.3. Ход анализа
Посевы воды в среды накопления инкубируют при температуре 37 °С в течение 18-20 ч. При обнаружении роста (помутнения) производят высев бактериологической петлей на две чашки с висмут-сульфитным агаром ( п. 2.4.22). Рассев производят одним из методов получения изолированных колоний. Чашки с посевами инкубируют при температуре 37 °С в течение 18-20 ч.
На висмут-сульфитном агаре колонии сальмонелл круглые, черные, с металлическим блеском, с сероватым металлическим ободком вокруг колоний, так называемое «зеркало», зеленые с темным центром и без него, вызывающие потемнение среды под колонией.
При дальнейшей работе с культурами сальмонелл возможно использование SS агара ( п. 2.4.23). На SS-arape колонии сальмонелл вырастают бесцветными. Колонии нежные, гладкие, круглые, слегка выпуклые с ровными краями, блестящие, полупрозрачные, диаметром 1,0-2,0 мм.
В отличие от патогенных бактерий, Е. coli образуют круглые, выпуклые, гладкие, малинового цвета колонии.
При обнаружении колоний, подозрительных на сальмонеллы, по 4-5 изолированных колоний с каждой чашки снимают для посева в пробирки с комбинированными средами для определения биохимических свойств, подтверждающих принадлежность к родам Salmonella (типа Клиглера, Олькеницкого и др.).
Окончательное определение биохимических и серологических свойств сероваров проводят по действующим инструкциям.
При санитарно-вирусологическом контроле воды поверхностных водоемов проводят концентрирование, детекцию и идентификацию вирусов.
2.11.1. Определение понятия показателя
Кишечные вирусы — вирусы, обитающие или транзиторно проходящие через желудочно-кишечный тракт, патогенные для человека, вызывающие заболевания с различной клинической картиной и степенью тяжести. В настоящее время из группы кишечных вирусов приведенным ниже методом определяются: энтеровирусы (вирусы полиомиелита 1, 2, 3 типа, вирусы группы ECHO, Коксаки В и некоторые серотипы Коксаки А); ротавирусы, антигены гепатита А и Е; аденовирусы.
2.11.2. Область применения
Кишечные вирусы в воде поверхностных водоемов рекомендуется определять:
— при превышении нормативного уровня колифагов;
— в случаях несоответствия качества воды по основным индикаторным микробиологическим показателям, а также при эпидемической ситуации в отношении кишечных вирусных инфекций в населенном пункте.
Информация о наличии или отсутствии энтеровирусов позволит судить:
— о степени риска для здоровья населения при использовании загрязненной вирусами воды;
— о возможности использования воды поверхностного водоема на данном участке в качестве источника хозяйственно-питьевого водоснабжения и в рекреационных целях;
— при проведении эпидемиологических исследований;
— эффективности работы очистных сооружений в отношении вирусного загрязнения.
2.11.3. Принцип метода
Метод основан на принципе сорбции вирусных частиц высокоэффективным сорбентом класса кремнеземов — макропористым стеклом марки МПС 1000 ВГХ и последующей десорбцией их небольшим объемом элюэнтов. Технологическая особенность метода заключается в том, что сорбент помещен в водопроницаемый флизелиновый пакет, который опускают в водный поток, что позволяет:
— исследовать большие объемы воды, и тем самым увеличить вероятность сорбции вирусных частиц;
— избежать механического загрязнения сорбента.
Достоинством использования флизелинового пакета с сорбентом является:
— высокая сорбционная емкость стекла;
— небольшой объем используемых элюирующих растворов, что обеспечивает дополнительное концентрирование вирусных частиц.
2.11.4. Подготовка и проведение исследования
2.11.4.1. Приготовление растворов
Десятикратные концентраты элюирующих растворов готовят на стерильной дистиллированной воде.
1) Растворяют 30,3 г триса (Tris [hydroxymethyl] aminomethane) в 300-400 мл воды, доводят значение рН до 9,1 концентрированной НС l и оставляют на 1 сутки при комнатной температуре. Затем проверяют (и при необходимости доводят еще раз) значение рН до 9,1. Конечный объем раствора (500,0 мл) получают добавлением дистиллированной воды.
2) 30,3 г триса + 145 г NaCl на 500,0 мл раствора, рН 9,1.
3) 150,0 г мясного экстракта (Beef Extract Powder) + 350 мл трис-буфера рН 9,1.
Растворы автоклавируют 15 мин при 1 атмосфере (121 °С).
Рабочие разведения элюэнтов получают добавлением 9 частей стерильной дистиллированной воды к 1 части концентрированного раствора.
2.11.4.2. Подготовка макропористого стекла
Для повышения сорбционных свойств макропористое стекло, представляющее собой белый порошок, обрабатывают следующим образом:
1) один объем стекла заливают в колбе одним объемом смеси (1:1) 3 %-ным раствором Н2О2 и 6 М НC l и кипятят в вытяжном шкафу в течение 1 ч (без пробки), соблюдая меры предосторожности. Полученное МПС отмывают большим количеством дистиллированной воды до нейтрального значения рН и высушивают при 100 °С;
2) в пакет из флизелина размером 5×7 см помещают 1 г подготовленного сорбента.
2.11.4.3. Подготовка хроматографической колонки
Колонки обрабатывают силиконовой жидкостью (Serva) для предотвращения адсорбции вирусов. Для этого внутреннюю поверхность колонки смачивают данной силиконовой жидкостью, после чего колонку выдерживают 1 ч при t = 100 °С. Силиконовую жидкость можно использовать многократно.
2.11.4.4. Отбор проб и обработка проб
Пакет с сорбентом закрепляют с помощью лески так, чтобы он оказался в потоке воды. После экспозиции в течение 3-7 суток пакет вынимают, помещают в новый полиэтиленовый мешочек и стерильный флакон и транспортируют в лабораторию в сумке-холодильнике. Каждую пробу маркируют с указанием населенного пункта, точки отбора, даты установки и времени экспозиции пакета. Материал доставляют в лабораторию в максимально короткий срок (не более 6 ч). Доставленные в лабораторию пробы регистрируют в рабочем журнале.
До проведения элюции вирусов пакеты в полиэтиленовом мешке или стерильном флаконе можно хранить в холодильнике при 4 °С не более 1 суток.
В лаборатории пакет с сорбентом извлекают из транспортировочной емкости и помещают в стерильную чашку Петри. Обрезают край пакета, вымывают стекло стерильной дистиллированной водой (
5 мл) с помощью пипетки в эту же чашку Петри и переносят пипеткой или через воронку в колонку объемом 5-10 мл. Вирусы элюируют последовательно 3 рабочими растворами элюэнтов по 3,0 мл каждый (рабочие разведения элюэнтов п. 2.11.4.1), собирая их в отдельные пенициллиновые флаконы.
В тех случаях, когда дальнейшие вирусологические исследования проводят на культуре клеток, полученные элюаты обрабатывают хлороформом и антибиотиками для удаления бактериальной флоры. Для этого к 1 объему элюата добавляют 1 объем хлороформа, интенсивно встряхивают 5-10 мин и центрифугируют 10 мин при 2000 об./мин для разделения фракций. Водную фракцию (верхнюю) аккуратно отбирают пипеткой в стерильный флакон и добавляют 1000 ЕД пенициллина (бензилпенициллина натриевую соль) и 10,0 мг сульфата стрептомицина. Обработанные элюаты до заражения культур ткани можно хранить при 4 °С в течение 3 суток. При температуре –20 °С элюаты можно хранить в течение 1 года. В случае необходимости многократного исследования элюаты делят на несколько порций, чтобы избежать повторного замораживания.
Исследования полученных элюатов на наличие энтеровирусов на культуре ткани рекомендуется проводить в соответствии с «Руководством по вирусологическим исследованиям на полиомиелит» (ВОЗ, 1998).
Отбор проб из поверхностных источников питьевого водоснабжения по количеству и кратности проводят в соответствии с СанПиН 2.1.5.980-00 «Гигиенические требования к охране поверхностных вод».
Отбор проб воды производят в чистые емкости. Сосуды больших объемов — молочные фляги, металлические и пластмассовые ведра и т.п., которые тщательно промывают кипяченой водой и ополаскивают отбираемой для анализа водой.
Пробы воды необходимо брать в створах, расположенных выше и ниже сброса стоков, у причалов, мест стоянок пассажирских и грузовых судов, выше и ниже населенных мест, в зонах рекреации, оздоровительных детских, спортивных и военных лагерей, по берегам и в середине водоема. Пробы отбирают с поверхности водоема, а также с различных глубин, начиная с 10-15 см от поверхности воды или от нижней кромки льда. Глубинные пробы можно отбирать с помощью пробоотборника гидробиологического типа «Пробоконг», снабженного погружным насосом, в соответствии с инструкцией по применению или другого с аналогичными характеристиками, разрешенного к применению в установленном порядке.
Пробы воды с поверхности водоема следует отбирать емкостями 1,5-2,0 л с интервалами 3-5 мин. Это позволяет в течение 40-60 мин взять усредненную пробу объемом 25 л.
Пробы воды могут доставляться в лабораторию без обработки или, в целях облегчения их транспортирования, после предварительной обработки (концентрирования материала путем фильтрования на месте отбора проб, в лаборатории водопроводной станции и др., с использованием типа ПВФ-142 полевая модификация).
С этой же целью может быть использована методика первичной концентрации паразитарных патогенов с помощью таких коагулянтов, как сульфат аммония, сульфат железа, сульфат меди в дозе 0,1-0,3 г/л.
В пробу воды на месте отбора добавляют коагулянт, затем тщательно перемешивают и отстаивают 1-2 ч. После этого надосадочную жидкость удаляют, а осадок переносят в сосуд объемом 1 л и доставляют в лабораторию. Содержимое этого сосуда вновь отстаивают 1-2 ч, а осадок после удаления надосадочной жидкости переносят в центрифужные пробирки 10-50 мл (в зависимости от объема осадка) и центрифугируют в течение 5 мин при 1500 об./мин. Надосадочную жидкость сливают, а к осадку добавляют 3 мл 1 %-ного раствора хлористоводородной кислоты для растворения хлопьев коагулянта, перемешивают и центрифугируют в таком же режиме. Надосадочную жидкость удаляют, а осадок обрабатывают по нижеописанной методике.
Пробы, не прошедшие предварительную обработку, хранят при температуре 15-20 °С не более двух суток.
В случае если первичная обработка пробы воды (фильтрование) проводилась вне лаборатории, использованные фильтры помещают в широкогорлый флакон или стеклянную банку, добавляют 30-50 мл исходной воды; закрывают флакон или банку завинчивающейся или притертой крышкой, маркируют, указывают дату, место отбора, количество профильтрованной воды и транспортируют в лабораторию для дальнейшего исследования. При невозможности исследования в день отбора материал хранят при 4 °С не более суток; при отсутствии необходимости определения жизнеспособности цист кишечных простейших и яиц гельминтов материал хранят при 4 °С не более 3-4 суток после добавления в него формальдегида с таким расчетом, чтобы концентрация его в суспензии составила 2 %.
Методики предназначены для обнаружения в воде цист патогенных простейших кишечника (лямблий, криптоспоридий, амебы дизентерийной, балантидия) и яиц гельминтов, представляющих непосредственную угрозу для здоровья человека при их заглатывании, при осуществлении контроля качества воды по паразитологическим показателям в источниках хозяйственно-питьевого водоснабжения и в водоемах рекреационного назначения.
3.2.1. Принцип методик с использованием флотантов
Цисты патогенных простейших кишечника и яйца гельминтов обнаруживаются при микроскопическом исследовании осадка, получаемого после центрифугирования не менее 4-кратно разведенного раствора флотанта с плотностью 1,26, в который искомые паразитарные агенты попадают из осадка, смываемого с мембранных фильтров поcле фильтрации через них исследуемой воды. Осаждение цист простейших и яиц гельминтов происходит за счет резкого снижения плотности флотанта, которая после разведения достигает 1,03 и менее, что ниже плотности паразитарных агентов.
— прибор для фильтрования типа ПВФ-142, ПМФ-70, УППВ;
— мембранные фильтры типа МФАС-СПА с размерами пор 1,5-3,0 мкм, МФАС-СПА-4 с размерами пор 2,4-4,5 мкм, прозрачные ATM с размерами пор 1,0-3,05. префильтры — капроновая сетка с ячейками 60-70 мкм;
— лотки, эмалированные кастрюли или ведра, акварельные кисточки, пинцеты.
Примечание. Допускается к использованию оборудование с аналогичными характеристиками, разрешенное к применению для этих целей в установленном порядке
— 33 %-ный водный раствор семиводного сульфата цинка (ZnSO4×7Н2О) — 331 г ZnSO4×7Н2О растворить в 1 л кипящей дистиллированной воды. После охлаждения до комнатной температуры измерить удельную плотность ареометром, которая должна быть не менее 1,25-1,26;
или 30 %-ный водный раствор сахарозы — 300 г сахарозы растворяют в 1 л горячей дистиллированной воды;
Пробу воды фильтруют через мебранные фильтры типа МФАС-СПА или прозрачные аналитические трековые мембраны (ATM) в соответствии с инструкцией.
Весь полученный смыв с мембранных фильтров или после концентрации химреактивами центрифугируют в пробирках емкостью 10 мл и более в течение 5 мин при 1500 об./мин.
Надосадочную жидкость осторожно сливают.
Добавляют 6-8 мл 2 %-ного водного раствора формалина (или дистиллированной воды) и размешивают.
Суспензию вновь центрифугируют в течение 5 мин при 1500 об./мин.
Надосадочную жидкость осторожно сливают или отсасывают пипеткой.
К осадку добавляют 3 мл одного из флотантов с удельным весом не менее 1,26 (33 %-ный водный раствор семиводного сульфата цинка или 30 %-ный водный раствор сахарозы и т. п.) и тщательно перемешивают стеклянной палочкой.
Центрифугируют в течение 5 мин при 2000 об./мин или 10 мин при 1500 об./мин.
Надосадочную жидкость осторожно сливают или отсасывают пипеткой и переносят в центрифужную пробирку, разбавляя в 4 раза дистиллированной водой, и центрифугируют в течение 5 мин при 1500 об./мин.
Надосадочную жидкость осторожно сливают. Из осадка готовят препараты на предметных стеклах и микроскопируют под покровным стеклом при увеличении: объектив 10х-40х, окуляр 10х. Для исследования на цисты лямблий микропрепараты окрашивают раствором Люголя.
При микроскопии и идентификации паразитарные патогены в пробах воды необходимо дифференцировать от фитопланктона и гидробионтов.
3.4. Метод санитарно-паразитологического исследования воды с применением прозрачных аналитических трековых мембран
3.4.1. Характеристика аналитических трековых мембран
Аналитическая трековая мембрана (далее — трековая мембрана) из тонкой прозрачной полиэтилентерефталатной пленки со сквозными порами диаметром от 0,1 до 5,0 мкм.
Выпускаются диски мембран диаметром (25; 37; 47; 70; 142 мм), в соответствии с используемыми в лаборатории фильтровальными приборами.
При первичном использовании трековых мембран их микроскопируют до фильтрации, чтобы ознакомиться с формой и расположением пор.
Для фиксации диска трековой мембраны (или его фрагмента) на поверхность предметного стекла наносят 1-2 капли 50 %-ного раствора глицерина. Затем сверху накладывают трековую мембрану или ее фрагмент в виде полоски (размером с предметное стекло) и накрывают покровным стеклом. Микроскопируют при увеличениях: окуляр 7х, 10х; объектив 10х, 40х.
На трековой мембране будут хорошо видны сквозные поры в виде круглых образований с ровными краями без содержимого (напоминают пузырьки).
Дифференцировка пор трековой мембраны с паразитологическими объектами не представляет затруднений, т. к. размеры яиц гельминтов в 10-20 раз, а цист лямблий в 2-4 раза превышают размеры пор. Поры трековых мембран имеют четкие контуры, не имеют внутреннего содержимого и при микроскопии занимают все поля зрения.
3.4.2. Подготовка трековых мембран к фильтрации
Трековую мембрану (которая находится между бумажными прокладочными дисками, изготовленными из силиконизированной бумаги) извлекают пинцетом из заводской упаковки и помещают на фритту фильтродержателя прибора для фильтрования (диаметр диска трековой мембраны подбирают в зависимости от имеющейся в лаборатории фильтровальной установки), закрепляют крышкой или в корпусе и проводят фильтрование пробы воды в соответствии с инструкцией к прибору.
При фильтрации мутной, с видимыми загрязнениями, воды необходимо использовать предфильтры (прилагаемые к прибору для фильтрования или к набору аналитических трековых мембран).
3.4.3. Подготовка и микроскопия аналитических трековых мембран
После фильтрования пробы воды, трековую мембрану извлекают пинцетом, помещают в чашку Петри или эмалированный лоток поверхностью, которая прилегала к фритте.
Затем, придерживая трековую мембрану за края пинцетом, не задевая поверхности фильтрации во избежание нарушения целостности препарата и потери искомых патогенов, разрезают ее на отдельные полоски, размер которых соответствует размеру предметного стекла. Диски трековых мембран диаметром 25; 37; 47 мм можно микроскопировать на больших предметных стеклах не разрезая их на части.
Полоску трековой мембраны, поверхностью, которая прилегала к фритте помещают на предметное стекло, предварительно обработав его 50 %-ным раствором глицерина (для этого на поверхность предметного стекла наносят 1-2 капли 50 %-ного раствора глицерина и стеклянной палочкой распределяют по всей поверхности). Всю поверхность полоски трековой мембраны накрывают сверху покровными стеклами (24×24 мм). Микроскопируют при увеличениях: окуляр 7х или 10х; объектив 10х; 40х.
При исследовании на цисты лямблии, на полоску трековой мембраны, которая уже помещена на предметное стекло с глицерином, наносят сверху каплю 1 %-ного раствора Люголя (пропись см. в прилож. 13) и накрывают покровными стеклами (24×24 мм) всю поверхность полоски. Микроскопируют при увеличениях: окуляр 7х или 10х; объектив 40х.
Использование прозрачных аналитических трековых мембран облегчает санитарно-паразитологический анализ воды и значительно сокращает время его проведения. Их использование может проходить по двум вариантам:
первый — трековые мембраны применяют при пробоподготовке воды и выполнении вышеописанной стандартной методики в соответствии с МУК 4.2.964-00 «Санитарно-паразитологические исследования воды хозяйственного и питьевого использования»;
второй — отфильтрованный с помощью трековой мембраны осадок непосредственно микроскопируют на ней в соответствии с методическими рекомендациями Минздрава России N 22 ФЦ/3314 от 26.03.03 «Использование прозрачных аналитических трековых мембран для санитарно-паразитологических исследований воды» (п. 2.1.2).
При использовании трековых мембран на приборах вакуумного фильтрования (ПВФ-142 и др.) необходимо учитывать, что толщина диска трековой мембраны меньше стандартных мембранных фильтров МФАС-СПА, что может послужить причиной отсутствия вакуума
Для избежания погрешности, перед укладкой диска трековой мембраны на фритту, по краю фильтродержателя укладывают (в соответствии с инструкцией) уплотнительные кольца, которые прилагаются к каждой стандартной заводской упаковке трековых мембран.
Методика предназначена для обнаружения в воде ооцист криптоспоридий, а также может использоваться для определения цист лямблий и яиц гельминтов.
3.5.1. Исследование воды методом последовательной фильтрации через систему аналитических трековых мембранных фильтров (АТМ)
Оборудование и инструментарий:
— прозрачные аналитические трековые мембраны (ATM) с диаметром пор 5,0 и 2,5 мкм и капроновая сетка (префильтр) с диаметром пор 25,0;
— префильтр (капроновая сетка) с диаметром пор 67-70 мкм;
— прибор для фильтрования типа ПВФ-142; ПВФ-35; ПНФ-70;
— пинцеты, кисточки акварельные (широкие, мягкие или полужесткие), пластмассовые пластины, лотки, эмалированные кастрюли или ведра.
— краска по Циль-Нильсену — фуксин основной 2 г растворить в 12 мл спирта 96 %; фенола 5 г растворить в 50 мл дистиллированной воды; слить вместе растворы фуксина и фенола, долить дистиллированной воды до 100 мл и тщательно перемешать;
3.5.2. Ход исследования на цисты лямблий, яйца и личинки гельминтов
Предварительно на заборное устройство прибора для фильтрования ПВФ-142 крепится префильтр в виде капроновой сетки с размерами ячейки 67-70 мкм (поставляется в комплекте с ATM).
Аналитическую трековую мембрану (ATM) с диаметром пор 5,0 мкм помещают на фритту* фильтродержателя прибора для фильтрования и сверху укладывают фильтр с размером пор 25,0 мкм, уплотняют кольцом из эластичной резины. Далее закрепляют крышкой и проводят фильтрацию в соответствии с инструкцией к прибору. Необходимо профильтровывать пробу воды в отдельную емкость, т. к. она будет подвергаться повторной фильтрации.
После фильтрации обе мембраны последовательно по одной осторожно снимают пинцетом с фритты на заранее подготовленные тонкие пластмассовые квадратные пластинки размером 150×150 мм 2 (поставляются в комплекте с ATM) и переносят в лоток.
Профильтрованную в отдельную емкость пробу воды повторно фильтруют с использованием ATM с диаметром пор 2,5 мкм, которую укладывают на фритту* фильтродержателя между двумя уплотнительными кольцами из полиэтилена или обрезиненного лавсана (поставляются в комплекте с ATM).
После фильтрации ATM осторожно снимают пинцетом с фритты на заранее подготовленные тонкие пластмассовые квадратные пластинки размером 150×150 мм 2 (поставляются в комплекте с ATM) и переносят в лоток.
Со всех трех фильтров аккуратно и тщательно, придерживая диск с мембраной пинцетом за край, производят смыв осадка с обеих поверхностей мембран и с пластиковых дисков, на которых эти фильтры лежали. Смыв проводят плоской, средней жесткости кисточкой (поставляемой в комплекте с ATM) в лоток с дистиллированной водой. При этом периодически споласкивают мембраны и диски дистиллированной водой из химического стакана. Общий объем дистиллированной воды при смыве осадка со всех 3 фильтров не должен превышать 300-500 мл.
Концентрированный смыв сливают из лотка в воронки прибора для фильтрации типа ПВФ-35 или ПВФ-47 и фильтруют через ATM с диаметром пор 2,5 мкм. В зависимости от первоначальной загрязненности воды используют 1-2 или 3 воронки. Если прибор с одной воронкой, то фильтруют последовательно, меняя мембраны.
После фильтрации ATM осторожно снимают пинцетом и переносят на предметное стекло, предварительно обработав его 50%-ным раствором глицерина (для этого на поверхность предметного стекла наносят 1-2 капли 50 %-ного раствора глицерина и стеклянной палочкой распределяют по всей поверхности), затем сверху мембраны наносят каплю 1 %-ного раствора Люголя и накрывают покровным стеклом (24×24 мм) всю поверхность мембраны.
Микроскопируют при увеличениях: окуляр 7х или 10х; объектив 10х; для идентификации яиц гельминтов и исследования на цисты лямблий — объектив 40х.
* Для плотного (без складок) прилегания ATM к фритте рекомендуется:
а) ATM вместе с калькой уложить мембраной на фритту и провести ладонью несколько раз по кальке. За счет появления электростатики мембрана прилипнет к фритте, а калька легко отделится от мембраны;
б) смочить фритту и мембрану дистиллированной водой и плотно уложить ATM на фритту без кальки.
3.5.3. Ход исследования на ооцисты криптоспоридий
После проведения фильтрации через ATM с диаметром пор 2,5 мкм на приборе типа ПВФ-35 или ПВФ-47, полученного концентрированного смыва, мембрану(ы) тщательно высушивают в лотке на воздухе.
Затем окрашивают ATM в кювете (лотке, чашке Петри) карболовым фуксином (краска по Циль-Нильсену) в течение 20 мин.
После окраски фильтры промывают под проточной водой, предварительно закрепив ATM за край химического стакана, с таким расчетом, чтобы струя воды не попадала на поверхность мембраны, а закрепленный фильтр свободно плавал в воде. Фильтр считается промытым, когда из стакана польется прозрачная вода.
Затем обесцвечивают (дифференцируют) 5-10 %-ной серной кислотой, в течение 10-20 с и снова промывают под проточной водой, предварительно закрепив ATM за край химического стакана, с таким расчетом, чтобы струя воды не попадала на поверхность мембраны, а закрепленный фильтр свободно плавал в воде. Фильтр считается промытым, когда из стакана польется прозрачная вода.
Затем дополнительно окрашивают 0,2 %-ным водным раствором метиленового синего или 5 %-ной малахитовой зелени в 10 %-ном этиловом спирте в течение 3-5 мин (при отсутствии этих ингредиентов данный этап можно исключить). Промывают под струей проточной воды, предварительно закрепив ATM за край химического стакана, с таким расчетом, чтобы струя воды не попадала на поверхность мембраны, а закрепленный фильтр свободно плавал в воде. Фильтр считается промытым, когда из стакана польется прозрачная вода.
Пинцетом фильтр из воды переносят в кювет (лоток, чашку Петри) и тщательно высушивают на воздухе.
Окрашенный фильтр (ATM) помещают на предметное стекло, предварительно смазанное иммерсионным маслом (для лучшей адгезии), накрывают покровным стеклом и микроскопируют под иммерсией при увеличении микроскопа: окуляр 10х, объектив 90х или 100х.
Ооцисты криптоспоридий окрашиваются в разные оттенки ярко красного (малинового, вишневого) цвета и имеют вид округлых образований диаметром 5-6 микрон с отчетливо видимой оболочкой и структурированным содержанием (можно наблюдать наличие 4 веретенообразных темно-окрашенных спорозоитов) на синем или зеленом основном фоне.
Примечание. Для определения в воде цист лямблий и ооцист криптоспоридий при наличии в лабораториях специального оборудования, иммунореагентов, химреактивов может быть использован метод иммуномагнитной сепарации с флуорохромами.
При микроскопировании подсчитывают число паразитарных патогенов во всем объеме осадка, что соответствует их числу во всей исследованной пробе. Одновременно определяют систематическую принадлежность обнаруживаемых паразитических организмов; идентификация их проводится по следующим признакам.
Цисты лямблий — овальная форма, размеры 10-14 мк в длину и 6-10 мк в ширину; незрелые цисты содержат 2 ядра, зрелые — 4; ядра находятся у переднего полюса цисты. Оболочка цисты отчетливо выражена и большей частью отстает от протоплазмы, что является одним из характерных отличий цист лямблий от цист других простейших. Внутри цисты вдоль по средней линии проходят две опорные нити — аксостили; в косом или поперечном направлении лежат характерные парабазальные тела (2 — в незрелых и 4 — в зрелых цистах), нередко заметен сложно свернутый жгутиковый аппарат. Плотность — 1,06-1,09.
Цисты амебы дизентерийной — округлая, редко овальная форма, размеры от 10 до 16 мк; молодые цисты содержат 1-2 ядра с центрально расположенной звездчатой кариосомой, зрелые цисты содержат 4 ядра, в зрелых четырехъядерных и незрелых двухъядерных цистах ядра расположены в различных плоскостях; оболочка цист двухконтурная в виде светлого прозрачного ободка. Одноядерные цисты почти всегда содержат в большом количестве гликоген, который в виде крупной вакуоли с нерезкими очертаниями занимает обычно больше половины цисты и раствором Люголя окрашивается в темно-коричневый цвет. Плотность — 1,08-1,1.
Следует иметь в виду, что в природной воде могут встречаться цисты Entamoeba dispar, идентичные цистам дизентерийной амебы, но не обладающие патогенными свойствами для человека. В этом случае следует в протоколе исследования отмечать находки без указания видовой принадлежности таких цист. Для идентификации их необходимы дополнительные специальные исследования. Однако и в данной ситуации должна быть настороженность в отношении эпидемического неблагополучия.
Цисты Балантидия кишечного — правильная круглая форма, плотная двухконтурная оболочка, средний размер около 50 мк. Внутри цист имеется крупное бобовидное ядро. Протоплазма однородна, гликоген в ней распылен равномерно. Под оболочкой в некоторых цистах заметно углубление, представляющее собой редуцированный цитостом — органеллу, соответствующую началу пищеварительной трубки многоклеточных. Ресничный покров отсутствует. Плотность — 1,1.
Яйца аскариды человеческой (свиной) — оплодотворенные яйца овальной или шаровидной формы. Наружная оболочка крупнобугристая, толстая, коричневого цвета (иногда встречаются яйца без наружной бугристой оболочки). Размеры яиц 50-70×40-50 мк. Яйцеклетка мелкозернистая и шаровидная, расположена в центре яйца. Плотность — 1,10-1,14.
Зрелое яйцо (способное заразить при заглатывании) содержит внутри подвижную личинку, свернувшуюся кольцевидно или перекрестно.
Яйца токсокары (аскариды собачьей) — почти круглые, 65-75 мк в диаметре, с нежноячеистой наружной толстой оболочкой темно-коричневого цвета, внутри яйца видна округлая зародышевая клетка. Зрелые инвазионные яйца содержат внутри подвижную свернувшуюся кольцом или перекрестно личинку. Плотность — 1,22.
Яйца власоглава — симметричные, имеют лимонообразную или бочонковидную форму. Оболочка темно-коричневая, толстая. На обоих полюсах имеются светлоокрашенные пробковидные образования. Размеры яиц 50-54×23-26 мк. В зрелых инвазионных яйцах видна подвижная личинка. Плотность — 1,16-1,22.
Яйца острицы — асимметричные. Одна сторона заметно уплощена, другая выпукла. Размеры яиц 50-60×30-32 мк. Оболочка тонкая, гладкая и бесцветная. Яйца могут быть на различных стадиях созревания, до головастикоподобной личинки включительно. Плотность — 1,14.
Яйца цепня карликового — оболочка яйца бесцветная, тонкая, гладкая. Форма овальная. Размер яиц 40×50 мк, эмбриофора (зародыш) почти шаровидная (29×30 мк), с длинными нитевидными придатками на полюсах. Плотность — 1,12.
Онкосферы тениид (цепня свиного и эхинококков) — овальная форма, размеры 31-40×20-30 мк; имеют тонкую наружную оболочку и толстую радиально-исчерченную внутреннюю оболочку темно-коричневого цвета. Внутри онкосферы находится зародыш-эмбриофора с шестью зародышевыми крючьями. Плотность — 1,24.
Отрицательный результат анализа не гарантирует отсутствия паразитарных патогенов в пробе, поэтому результат исследования должен представляться в протоколе термином «не обнаружены». Обнаружение даже одного экземпляра паразитарных патогенов в 1 пробе питьевой воды указывает на эпидемическое неблагополучие в системе питьевого водоснабжения.
3.7. Визуальная оценка вероятной жизнеспособности цист патогенных простейших кишечника и яиц гельминтов
Оценка вероятной жизнеспособности цист патогенных простейших и яиц гельминтов визуально проводится по следующим критериям, подтверждающим жизнеспособность:
— целость наружной оболочки (отсутствие ее разрывов, вдавлений, выбухания, сморщивания);
— четкая внутренняя структура цисты или яйца — у цист четко видны ядра, отсутствует зернистость. У цист лямблий, кроме того, видны аксостили, жгутиковый аппарат, медиальное тело. Для яиц гельминтов (аскарид, токсокар, власоглавов, остриц) характерно наличие дробящейся зародышевой клетки или подвижной личинки. У живых онкосфер тениид и карликового цепня зародышевые крючья расположены попарно, а у мертвых — беспорядочно;
— при окраске препарата 1 %-ным водным раствором эозина жизнеспособные цисты лямблий не воспринимают окраску в течение первых 5 мин, мертвые окрашиваются сразу же в розовый цвет. Поэтому указанную окраску следует использовать до микроскопии только в том случае, когда на изучение препарата потребуется не более 5 мин. Часто просмотр мазка длится 15-30 мин, тогда 1 %-ный водный эозин можно вводить аккуратно, не сдвигая препарат под покровное стекло пипеткой в точке, где при предварительном просмотре уже обнаружены цисты лямблий;
— жизнеспособность онкосфер тениид и яиц аскарид, содержащих личинку, определяют путем окрашивания препарата смесью, содержащей метиленовый синий. Живые онкосферы тениид, а также личинки, находящиеся внутри яиц аскарид, не окрашиваются в течение первых 15 мин. Мертвые окрашиваются сразу в синий цвет;
— жизнеспособность онкосфер тениид можно также определить по движению зародышей при воздействии на них пищеварительными ферментами. Для этого исследуемый осадок, содержащий онкосферы, помещают на часовое стекло в искусственный дуоденальный сок. Стекло ставят в термостат при 36-38 °С на 4 ч. Живые зародыши освобождаются от оболочек, а мертвые — нет;
— оболочки жизнеспособных онкосфер растворяются также в подкисленном пепсине (рН 5-6) и в щелочном растворе трипсина (рН 8-8,5) через 6-8 ч при температуре 38 °С.
Схема выполнения методики санитарно-паразитологического исследования воды и изображения определяемых с ее помощью цист кишечных простейших и яиц гельминтов представлены в прилож. 11, 12, 13.
1. Федеральный закон от 30 марта 1999 г. N 52-ФЗ «О санитарно-эпидемиологическом благополучии населения».
2. Постановление Правительства Российской Федерации от 24 июля 2000 г. N 554 «Об утверждении Положения о государственной санитарно-эпидемиологической службе Российской Федерации и Положения о государственном санитарно-эпидемиологическом нормировании».
3. Водный Кодекс Российской Федерации от 16 ноября 1995 г.
4. СанПиН 2.1.5.980-00 «Гигиенические требования к охране поверхностных вод».
5. СанПиН 2.1.4.1074-01 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества».
6. СП 1.2.731-99 «Безопасность работы с микроорганизмами III-IV групп патогенности и гельминтами».
7. МУ 2.1.4.1057-01 «Организация внутреннего контроля качества санитарно-микробиологических исследований воды».
8. МУК 4.2.1018-01 «Санитарно-микробиологический анализ питьевой воды».
9. ГОСТ Р 51592-00 «Вода. Общие требования к отбору проб».
10. ГОСТ Р 51593-00 «Вода питьевая. Отбор проб».
11. ГОСТ 2761-84 «Источники централизованного хозяйственно-питьевого водоснабжения. Гигиенические, технические требования и правила выбора».
12. ГОСТ 17.1.5.02-80 «Охрана природы. Гидросфера. Гигиенические требования к зонам рекреации водных объектов».
13. Методические рекомендации по санитарно-вирусологическому контролю объектов окружающей среды. М., 1982.
14. Руководство по контролю качества питьевой воды / ВОЗ. Женева, 1994. Т. 1
15. Руководство по вирусологическим исследованиям полиомиелита / ВОЗ. Женева, 1998.
В приложениях даны методы определения санитарно-микробиологических показателей для комплексной оценки качества воды при выборе новых источников водоснабжения и решении вопроса во время проведения оздоровительных мероприятий или закрытия пляжа в зонах рекреации в соответствии с требованиями ГОСТ 2761-84 «Источники централизованного хозяйственно-питьевого водоснабжения» и ГОСТ 17.1.5.02-80 «Охрана природы. Гидросфера. Гигиенические требования к зонам рекреации водных объектов».
Показатели определяют дополнительно к основным, приведенным в п.п. 2.7 — 2.11.
1.1. Определение понятия показателя
К общему числу микроорганизмов (ОМЧ) относят мезофильные аэробы и факультативные анаэробы (МАФАМ), способные образовывать на питательном агаре колонии, видимые при увеличении в 2 раза при температуре 37 °С в течение 24 ч (ОМЧ 37 °С) и при температуре 22 °С в течение 72 ч (ОМЧ 22 °С).
1.2. Значение показателя и область применения
Общее число микроорганизмов не нормируется в воде водоемов в местах действующих водозаборов централизованного питьевого водоснабжения, черте населенных мест, зонах рекреации, поскольку уровень этой группы микроорганизмов в большей мере зависит от природных особенностей каждого объекта, времени года и т.п.
Однако при выборе нового источника водоснабжения или места рекреации в воде водоемов дополнительно следует определять число колоний, вырастающих:
— при температуре 37 °С в течение 24 ч;
— при температуре 22 °С в течение 72 ч.
ОМЧ при температуре инкубации 37 °С — индикаторная группа микроорганизмов, в числе которых определяют в большей мере аллохтонную микрофлору, внесенную в водоем в результате антропогенного загрязнения, в т. ч. фекального.
ОМЧ при температуре инкубации 20-22 °С — индикаторная группа микроорганизмов, в числе которых, помимо аллохтонной, определяют водную микрофлору данного водоема (автохтонную).
При температуре 22 °С, как правило, вырастает больше сапрофитных микроорганизмов, чем при температуре 37 °С. Соотношение численности этих групп микроорганизмов позволяет судить об интенсивности процесса самоочищения, активными участниками которого они являются. Эта разница более выражена при завершении процесса самоочищения (коэффициент соотношения ОМЧ 22 °С : ОМЧ 37 °С равен четырем и выше). В местах загрязнения хозяйственно-бытовыми сточными водами численные значения обеих групп близки.
Показатель позволяет получать дополнительную информацию о санитарном состоянии водоемов, источниках загрязнения, процессах самоочищения.
При производственном контроле исходной воды, поступающей на сооружения водопроводных станций, определяют ОМЧ 37 °С с целью установления эффективности очистки и обеззараживания.
1.3. Выполнение анализа при определении ОМЧ 37 °С
Из каждой пробы делают посев 1 мл и по 1 мл из одного или двух разбавлений, выбирая объем воды для посева из расчета, чтобы не менее чем на 2-х чашках выросло от 20 до 300 колоний. Выбранный объем засевают в 2-х повторностях.
При исследовании заведомо чистых вод с содержанием сапрофитов до 300 КОЕ в 1 мл делают посевы пробы воды без разбавления по 1 мл в 2 повторностях. При исследовании воды неизвестной степени микробного загрязнения производят посев 3-4 десятикратных объемов, начиная с 1 мл.
После тщательного перемешивания пробы готовят разбавления ( п. 2.5) и немедленно вносят по 1 мл воды из пробы или из соответствующего разбавления в стерильные чашки Петри, слегка приоткрывая крышки, заранее промаркированные. Сразу же после внесения воды в каждую чашку вливают 8-10 мл (на чашку диаметром 95 мл) расплавленного и остуженного до 45-46 °С питательного агара после фламбирования края посуды, в которой он содержался. Затем быстро смешивают содержимое чашек, равномерно распределяя по всему дну, избегая образования пузырьков воздуха, попадания агара на края и крышку чашки. Эту процедуру производят на горизонтальной поверхности, где чашки оставляют до застывания агара. Целесообразно сохранять расплавленный агар во время посевов в водяной бане, автоматически поддерживающей температуру 45-49 °С, или в термостате.
Тонкий слой агара увеличивает эффективность учета сапрофитной микрофлоры водоемов за счет лучших условий для роста аэробных и факультативно анаэробных бактерий, преобладающих в водоемах. Колонии вырастают более крупные, легко подсчитываемые на фоне прозрачного тонкого слоя агара. Ограничен рост расплывчатых колоний.
Две чашки Петри с посевами одной повторности помещают в термостат и инкубируют при температуре (37 ± 1) °С в течение (24 ± 2) ч.
Две другие чашки Петри с посевами инкубируют при температуре 20-22 °С в течение (72 ± 2) ч.
1.4. Учет результатов
После инкубации подсчитывают все выросшие на чашке колонии, видимые при увеличении в 2 раза. Подсчет следует производить только на тех чашках, на которых выросли изолированные колонии в количестве от 20 до 300. При посеве 1 мл неразбавленной воды ведут подсчет на чашках с любым количеством колоний, меньшим 300, и не менее чем на двух чашках.
Подсчитанное число колоний на каждой чашке суммируют и делят на объем воды в мл, засеянной на те чашки, на которых производился подсчет. Результат выражают в числе колониеобразующих единиц (КОЕ) в 1 мл исследуемой воды, округляя до 2-3 значимых чисел.
В протокол анализа заносят результат «число КОЕ ОМЧ 37 °С в 1 мл» или «число КОЕ ОМЧ 22 °С в 1 мл».
Результат можно представить на основании подсчета колоний на одной чашке (с отметкой в протоколе анализа), если на других чашках:
а) рост расплывчатых колоний распространился на всю поверхность чашки;
б) число колоний превышает 300-500;
в) при посеве из разбавлений выросло менее 20 колоний.
Если на всех чашках имеет место рост расплывчатых колоний, не распространившийся на всю поверхность, или выросло более 300 колоний и анализ нельзя повторить, подсчитывают колонии на секторе чашки с последующим пересчетом на всю поверхность. В этих случаях в протоколе отмечают «число КОЕ ОМЧ в 1 мл ориентировочно».
Если рост расплывчатых колоний распространился на всю поверхность чашки, и подсчет невозможен, то в протоколе анализа отмечают «ползучий рост». Если подсчет невозможен из-за слишком многочисленного роста, то в протоколе записывают «сплошной рост».
В примечании отмечают особые обстоятельства, которые могут повлиять на результат (превышение срока хранения пробы, изменение температуры и времени инкубации посевов, отклонения от правил при учете результатов и т. д.).
Воспроизводимость результатов метода может быть достигнута при строгом соблюдении деталей техники анализа, а также при использовании питательного агара одинакового состава. Каждую новую партию агара проверяют при посеве воды водоемов (по сравнению с предыдущей партией) в соответствии с МУ 2.1.4.1057-01 «Организация внутреннего контроля качества санитарно-микробиологических исследований воды», отмечая кроме числа колоний их размер и скорость образования видимого роста.
2.1. Определение понятия показателя
Сульфитредуцирующие клостридии — спорообразующие анаэробные палочковидные микроорганизмы, редуцирующие сульфит натрия до сульфидов на железосульфитном агаре при температуре 44 °С в течение 16-18 ч.
2.2. Значение показателя
В воде источников централизованного питьевого водоснабжения клостридии определяют в связи с использованием этого показателя для оценки эффективности обработки питьевой воды на этапах технологических процессов, поскольку споры сульфитредуцирующих клостридий являются более устойчивыми, чем вегетативные клетки бактерий к воздействию обеззараживающих агентов, а также неблагоприятных факторов, действующих на микроорганизмы в воде водоемов.
Общепринятым является представление о том, что клостридии указывают на давнее фекальное загрязнение. Однако длительность выживаемости этих споровых микроорганизмов в воде водоемов превышает таковую сальмонелл, что свидетельствует о наличии у этого показателя одного из наиболее важных свойств индикаторного микроорганизма.
2.3. Выполнение анализа
Споры сульфитредуцирующих клостридий определяют методом прямого посева.
Пробу воды 20-100 мл перед посевом прогревают на водяной бане при температуре (75 ± 5) °С в течение 15 мин для исключения вегетативных форм (время отсчитывают после достижения указанной температуры).
Железосульфитный агар готовят во флаконах в соответствии с п. 2.4.10 небольшими порциями непосредственно перед посевом (повторному расплавлению агар не подлежит). В течение посева поддерживают среду нагретой до 70-80 °С в водяной бане.
Для посева выбирают 2-3 объема воды с таким расчетом, чтобы выросли изолированные колонии, ориентируясь на результаты, полученные ранее при анализе воды в этой же точке. Посевы вносят в стерильные пробирки и заливают горячим железо-сульфитным агаром высоким столбиком. Агар наливают по стенке пробирки во избежание попадания воздуха. Немедленно после заливки пробирки опускают в емкости с холодной водой для создания анаэробных условий в толще агара. После застывания посевы инкубируют при температуре 44 °С в течение 18-24 ч.
Учет результатов в соответствии с МУК 4.2.1.1018-00 «Санитарно-микробиологический анализ питьевой воды».
3.1. Определение понятия показателя
Esherichia coli (преимущественно Е. coli) — индикаторная группа бактерий, включает такие термотолерантные колиформы, которые помимо ферментации лактозы при температуре 44 °С образуют индол из триптофана.
3.2. Значение показателя и область применения
Е. coli определяют дополнительно при выборе источника водоснабжения для оценки качества воды поверхностных водоемов с целью расшифровки характера и происхождения микробного загрязнения, превышающего норматив. При оценке полученных данных имеет значение число Е. coli в воде и их соотношение с числом ОКБ.
Наличие в воде Е. coli свыше 100 КОЕ в 100 мл свидетельствует о недавнем поступлении фекального загрязнения, о незавершенных процессах самоочищения, о несоблюдении требований к очистке сточных вод и т. п. В этих случаях соотношение числа колиформных бактерий и Е. coli, как правило, менее 10 и водопользование из такого водоема представляет потенциальную эпидемическую опасность.
3.3. Выполнение анализа
Для определения числа Е. coli используют посевы, которые сделаны на мембранных фильтрах для проведения анализа на ОКБ.
На фильтрах, где выросли изолированные колонии, подсчитывают темно-красные колонии с металлическим блеском. Каждую колонию при росте до 10-15 КОЕ или по 3-4 колонии каждого подсчитанного типа подтверждают на принадлежность к Е. coli. Одновременно с пересевом в среду с лактозой в соответствии с п. 2.4.7 для подтверждения термотолерантных свойств эту же колонию пересевают в пробирку со средой, содержащей триптофан ( п. 2.4.25), для определения образования индола. Обе среды перед посевом должны быть прогреты до температуры (44-45) °С и немедленно перенесены в термостат для инкубации при температуре (44 ± 0,5) °С в течение 24 ч. Образование кислоты и газа в среде с лактозой подтверждает наличие ТКБ.
Продукцию индола определяют одним из общепринятых методов — с помощью индикаторных бумажек ( п. 2.4.24) или с реактивами Эрлиха, Ковача ( п. 2.4.26) и др. Положительный ответ на наличие Е. coli дают при ферментации лактозы до кислоты и газа при температуре 44 °С и при образовании индола.
Для упрощения анализа тест на образование индола можно заменить посевом в лактозный бульон с борной кислотой ( п. 2.4.8), прогретый до температуры 44-45 °С с последующей инкубацией при температуре (44 ± 0,5) °С в течение 24 ч. Положительный ответ на Е. coli дают при помутнении и газообразовании.
Типичные оксидазоотрицательные колонии учитывают как Е. coli при ферментации лактозы до кислоты и газа при температуре 44 °С и образовании индола из триптофана или при ферментации лактозы в среде с борной кислотой до образования газа при температуре 44 °С.
Если в посевах в среду накопления обнаружен газ, а при высеве на среду Эндо выросли темно-красные колонии с металлическим блеском, то одновременно подтверждают наличие ТКБ и Е. coli, для чего по 2-3 типичные колонии с каждого сектора засевают параллельно в две пробирки: с лактозной средой по п. 2.4.7 и со средой, содержащей триптофан ( п. 2.4.25) для установления способности ферментировать лактозу до кислоты и газа при температуре 44 °С и продуцировать индол.
Посев производят в среды, прогретые до температуры 44-45 °С, немедленно переносят в термостат и инкубируют при температуре(44 ± 0,5) °С в течение 24 ч.
Продукцию индола определяют одним из общепринятых методов — с помощью индикаторных бумажек ( п. 2.4.24) или с реактивом Ковача ( п. 2.4.26). Положительный ответ дают при наличии кислоты и газа в лактозной среде и при образовании индола.
Вместо среды, содержащей триптофан, можно сделать посев в лактозный бульон с борной кислотой ( п. 2.4.8), соблюдая описанные выше условия посева и инкубации. Положительный ответ на наличие в среде накопления Е. coli дают при помутнении и образовании газа. При использовании этой среды индол не определяют.
5.1. Определение понятия показателя
Энтерококки — грамположительные, каталазоотрицательные, полиморфные, круглые, чаще слегка вытянутые с заостренными концами кокки, располагающиеся попарно или в коротких цепочках, способные расти на питательных средах с 0,04 % азида натрия, а также устойчивые при развитии к тестам Шермана (повышенной температуре 45 °С, щелочности рН 9,6, содержанию 40 % желчи и 6,5 % натрия хлористого). К группе энтерококков относят Enterococcus faecalis, который имеет основное индикаторное значение, Enterococcus faecium и Enterococcus durans.
5.2. Значение показателя и область применения
Энтерококки определяют в качестве дополнительного показателя при выборе нового источника централизованного водоснабжения. В воде действующих источников водоснабжения и в местах рекреации этот показатель используют для подтверждения фекального характера загрязнения. Энтерококки рекомендуется определять при превышающем нормативы уровне общих колиформных бактерий и при низком числе Е. coli (менее 50-100 в 100 мл воды), а также в случаях несоответствия оценки качества воды по основным показателям и санитарной ситуации на водных объектах.
При числе энтерококков свыше 50 в 100 мл предполагается поступление свежего фекального загрязнения и потенциальная эпидемическая опасность.
5.3. Выполнение анализа
Объем испытуемой воды для посева выбирают с таким расчетом, чтобы не менее чем на двух фильтрах выросли изолированные колонии в количестве от 5 до 50 при диаметре фильтра 35 мм и от 10 до 100 при диаметре фильтра 47 мм.
При этом можно ориентироваться на результаты предыдущих исследований воды в этом же месте водоема и на рекомендации таблицы прилож. 9.
При исследовании воды неизвестного качества количество засеваемых десятикратных объемов увеличивают до 3-4.
Отмеренный объем воды фильтруют через мембранные фильтры, как это описано в п. 2.6.
Фильтры с посевами помещают на азидную среду ( п. 2.4.14) и инкубируют при температуре (37 ± 1) °С в течение 48 ч.
Для учета выбирают фильтры, на которых выросло число колоний, указанное выше.
Подсчитывают колонии, характерные для энтерококков: выпуклые, с ровными краями, темно-малиновые, розовые, светло-розовые, равномерно окрашенные или с темно-красным не четко оформленным центром.
Очень мелкие (на пределе видимости невооруженным глазом), плоские разных оттенков, ярко-малиновые с четко выраженным центром и бесцветным ободком колонии не учитывают. Дифференциацию энтерококков от посторонней микрофлоры можно проводить по морфологии колоний под бинокулярной лупой.
При необходимости подтвердить наличие энтерококков по 2-3 колонии каждого типа:
— микроскопируют после окраски по Граму ( МУК 4.2.1018-01) и при обнаружении в мазках грамположительных, как правило, слегка вытянутых с заостренными концами диплококков, дают положительный ответ;
— пересевают секторами на солевой агар с ТТХ ( п. 2.4.15) и после 24-48 ч инкубации посевов при температуре 37 °С энтерококки на среде дают равномерный нежный рост на протяжении всего штриха. Иные бактерии на этой подтверждающей среде не растут;
— выполняют каталазный тест, нанося петлей культуру на предметное стекло. После подсушивания на воздухе добавляют каплю свежеприготовленной 3 %-ной перекиси водорода, прикрывают покровным стеклом. При отсутствии пузырьков газа — каталазоотрицательный тест. Контрольная каталазоположительная культура — любой вид стафилококков.
5.4. Учет результатов
Подсчитывают число колоний энтерококков на фильтрах, где выросло менее 50-70 колоний, суммируют и определяют по формуле
, где
X — число КОЕ энтерококков в 100 мл исследуемой воды;
а — число подсчитанных энтерококков в сумме;
V — объем воды, профильтрованной через фильтры, на которых велся учет.
В протоколе исследования выдают «число КОЕ энтерококков в 100 мл».
6.1. Выполнение анализа
Объем воды выбирают с таким расчетом, чтобы в минимальных объемах или разбавлениях получить один или несколько отрицательных результатов. При этом следует ориентироваться на результаты предыдущих анализов воды в этом же месте водоема и на рекомендации таблицы прилож. 10.
Каждый объем воды или ее разбавление засевают параллельно в 2 или 3 порции щелочно-полимиксиновой среды (ЩЭС) в соответствии с п. 2.4.11. Объемы 100, 50 и 10 мл засевают в равные объемы среды двойной концентрации; 1 мл исследуемой воды или ее разбавления засевают в 5 мл среды нормальной концентрации. Посевы инкубируют при температуре (37 ± 1) °С.
Через 24 ч производят предварительный учет. Из посевов, где отмечены признаки роста (помутнение или помутнение и изменение цвета среды), высевают на 4-6 секторов одной из плотных питательных сред — молочно-ингибиторной ( п. 2.4.12), энтерококкагар или азидной ( п. 2.4.14). Порции среды, в которых признаки роста отсутствуют, оставляют при температуре 37°С еще на 24 ч, после чего из сосудов, в которых дополнительно появилось помутнение и изменение цвета среды, делают высев на сектора одной из перечисленных выше плотных питательных сред.
Через 24-48 ч инкубации посевов на молочно-ингибиторной среде при температуре (37 ± 1) °С в качестве положительных результатов отмечают наличие аспидно-черных, выпуклых с металлическим блеском (Enterococcus faecalis), а также сероватых мелких колоний (Enterococcus faecium, Enterococcus durans).
При высеве на сектора азидной среды учет энтерококков после инкубации посевов проводят в соответствии с п. 5.3.
В сомнительных случаях убедиться в наличии на секторах энтерококков можно путем посева на солевой агар с ТТХ в соответствии с п. 2.4.15, микроскопии после окраски мазков по Граму.
6.2. Учет результатов
После определения положительных и отрицательных результатов в объемах посеянной в среду накопления воды определяют наиболее вероятное число (НВЧ) энтерококков в 100 мл воды по одной из таблиц прилож. 8, соответствующей схеме посева и полученным результатам.
В протоколе анализа выдают — НВЧ КОЕ энтерококков в 100 мл.
6.3. Упрощенный метод определения энтерококков
Допускается использовать лактозо-пептонную среду не только для накопления колиформных бактерий при работе титрационным методом, но и для накопления энтерококков. Упрощенный метод может быть применен при исследовании воды водоемов, где уровень загрязнения по ОКБ не превышает 10 3 /100 мл. Метод непригоден при исследовании сточных вод и воды водоемов в местах их выпуска, так как дает заниженный результат.
После высева на сектора среды Эндо для определения колиформных бактерий посевы в лактозо-пептонную среду продолжают инкубировать до 48 ч при температуре (37 ± 1) °С. Из посевов, где имеет место помутнение, независимо от наличия или отсутствия газа, делают высев на сектора азидной среды. При высеве из среды накопления необходимо часть среды сверху осторожно, не взбалтывая, удалить пипеткой, оставшуюся часть размешать и троекратно нанести материал бактериологической петлей диаметром 2-3 мм на поверхность плотной азидной среды п. 2.4.14. Посев производят штрихом, к концу которого должны быть получены изолированные колонии. Молочно-ингибиторную среду и энтерококкагар при выполнении этого метода не применять.
При необходимости подтвердить наличие энетерококков на секторах делают микроскопию окрашенных по Граму мазков, пересевают на подтверждающую среду и определяют каталазную активность в соответствии с п. 5.3. Определяют НВЧ энтерококков в 100 мл по соответствующим полученным результатам таблиц прилож. 8.
Стафилококки определяют в воде водоемов, используемых для купания, как показатель загрязнения воды микрофлорой верхних дыхательных путей и кожных покровов человека.
При оценке качества воды индикаторами считают стафилококки, обладающие лецитовителлазной активностью, в основном Staphylococcus aureus. Сигнальное значение для регламентации нагрузки на зону купания имеет обнаружение свыше 10 стафилококков в 100 мл воды.
7.1. Метод мембранных фильтров
Пробу в объеме 50 мл фильтруют через 2-3 фильтра с таким расчетом, чтрбы получить изолированные колонии.
Фильтры помещают на желточно-солевой агар ( п. 2.4.16) и инкубируют при температуре 37 °С в течение 24 ч.
Подсчитывают блестящие выпуклые колонии белого, палевого, золотистого цвета, окруженные радужной с перламутровым блеском зоной; 96-98 % таких колоний образованы Staphylococcus aureus.
При необходимости подтвердить принадлежность таких бактерий к Staphylococcus aureus подозрительные колонии пересевают на желточно-солевой агар бляшками, микроскопируют, определяют плазмокоагулазную активность. При наличии мелких грамположительных кокков, располагающихся в виде гроздей, и коагулировании плазмы дают положительный ответ.
Число колоний стафилококков делят на объем воды, профильтрованной через фильтры, на которых велся учет, и умножают на 100.
7.2. Титрационный метод
Делают посевы 10, 1 и 0,1 мл исследуемой воды в 2-3 повторностях в стерильную пептонную воду с хлоридом натрия; 1 и 0,1 мл вносят в среду накопления, содержащую 10% хлорида натрия и 1% пептона.
Для посева 10 мл заготавливают впрок сухие навески хлорида натрия по 1 г, стерилизуя их сухим жаром, и 25%-ный стерильный раствор пептона.
К 10 мл исследуемой воды прибавляют соответственно 1 г хлорида натрия и 1 мл 25 %-ного раствора пептона.
Посевы инкубируют при температуре 37 °С в течение 48 ч. Высев из посевов производят на желточно-солевой агар.
Вычисление числа стафилококков в 100 мл воды производят по соответствующим таблицам прилож. 8.
Расчет наиболее вероятного числа бактерий в 100 мл воды поверхностных водоемов, обеззараженных сточных вод
источник














