Проверить все составляющие питательной воды и в зависимости от характера нарушения принять меры:
- при повышении жесткости — дежурному по химконтролю проверить конденсат турбин, теплообменников, воду в дренажном баке, баке нижних точек, добавочную воду с ХВО; одновременно увеличить дозировку фосфатов;
- при отсутствии окраски по фенолфталеину дежурному по химконтролю необходимо срочно сообщить на ХВО, а также проверить рН котловой воды чистых отсеков; при приближении рН к 9,3 ввести в питательную воду раствор щелочи с бака в питательную воду;
- при повышенном содержании кислорода дежурный по химконтролю должен замерить содержание кислорода после деаэраторов, немедленно сообщить НСС для принятия мер. Проверить качество отбора проб, качество реактивов;
- при высокой щелочности дежурному по хим.контролю проверить конденсат теплообмнников, баки дренажей и нижних точек, деаэраторы, добавочную воду с ХВО.
До устранения причин нарушения качества питательной воды увеличиваются непрерывная и периодическая продувки при более частом контроле за качеством пара, а при превышении норм по содержанию общей жесткости проводится усиленное фосфатирование котловой воды.
Признаки: вспенивание, повышение уровня в барабане котла, понижение температуры перегретого пара, превышение солесодержания (щелочности питательной воды и фосфатов в котловой воде) по сообщению дежурного химконтроля.
Действия: необходимо найти источник поступления солей в котел (высокая щелочность добавочной воды с ХВО либо попадание продувочной воды из БПТС обратно в котел), увеличить непрерывную продувку, произвести периодическую продувку, понизить уровень в барабане котла, участить проведение анализов котловой воды. Регулировать температуру перегретого пара. В случае недопустимого повышения солесодержания котловой воды котел должен быть остановлен по распоряжению главного инженера станции.
Уточнить содержание аммиака в питательной воде. Если концентрация ниже 1000 мкг/дм3, увеличить дозировку триаммонийфосфата либо увеличить производительность аммиачного насоса на ХВО.
Если концентрация больше или равна 1000 мкг/дм3, проверить наличие углекислоты в турбинном конденсате и при больших ее концентрациях доложить НСС для устранения присосов.
При сообщении лаборанта химанализа дневной лаборатории водной группы о повышенном содержании соединений натрия и кремниевой кислоты произвести периодическую продувку, увеличить непрерывную продувку. При дальнейшем увеличении содержания соединений натрия и кремниевой кислоты отрегулировать нагрузку на котле. В случае недопустимого повышения соединений натрия и кремниевой кислоты котел должен быть остановлен по распоряжению главного инженера станции.
При повышении содержания натрия в перегретом паре оперативному персоналу проверить плотность пароохладителей котлов.
Действия: дежурному химконтроля проверить наличие раствора фосфата в расходных баках турбинного и котельного отделений и его концентрацию. Продуть точки отбора проб. Старшему машинисту котлов закрыть непрерывную продувку, проверить плотность арматуры на линиях непрерывной и периодической продувок, работу фосфатных насосов, положение арматуры на линии ввода фосфатов. При необходимости подключить резервный фосфатный насос или увеличить концентрацию фосфатов фосфатных баках.
Действия: Убедившись в правильности анализа, дежурный химконтроля немедленно сообщает НСС о случившемся. По распоряжению НСС по возможности отключают теплообменник.
Хлориды в питательную и котловую воду могут попасть с ХВО и с сырой водой. При попадании хлоридов с сырой водой резко увеличивается жесткость. При попадании воды с ХВО – увеличиваются хлориды, а жесткость повышается незначительно. В нормальных условиях необходимо помнить увязку хлоридов, щелочности и солесодержания в котловой воде.
При попадании поваренной соли с ХВО резко нарушается соотношение хлоридов с сухим остатком и щелочностью. Хлориды возрастают быстрее солесодержания.
Действия: Увеличить непрерывную продувку, уменьшить добавок с ХВО, найти место присоса солевого раствора и немедленно устранить присос.
Неправильная работа точек отбора искажает действительные результаты отбираемой на анализ пробы.
Присос охлаждающей воды в холодильниках точек отбора котловой и питательной воды.
В пробе котловой воды занижены фосфаты, щелочность и хлориды, а повышена жесткость. Общая щелочность характеризуется резким уменьшением гидратной щелочности (слабая окраска на фенолфталеин). В пробе питательной воды завышена щелочность, жесткость, содержание кислорода и хлоридов.
Недостаточность охлаждения пробы и засоренность в трубах.
Не отражает действительности исследуемой воды за счет увеличения концентрации (выпаривания) и при засоренности – застаивание пробы. При непрерывном отборе необходима определенная скорость истечения — 50л/час, чем и определяются требования к точкам отбора.
Действия: устранить дефект с оформлением записей в журнале соответствующих цехов: при засорении необходимо продуть точку отбора. Когда через холодильник пробу взять нельзя, то, как крайняя мера на время ремонта, пробу берут от водомерного стекла с учетом испарения; результаты анализов умножают на коэффициент 0,8.
Непригодность реактивов при проведении анализов создают неправильность ведения режима, а поэтому к чистоте реактивов предъявляются строгие требования. Погрешность может привести к самым запутанным явлениям в режиме, к примеру:
- cмешивание азотной кислоты при определении хлоридов с малым количеством азотнокислой ртути приводит к завышенному содержанию хлоридов в пробе воды и усилением продувки, к перерасходу топлива.
- занижение определения фосфатов в котловой воде — к излишним вводам фосфата в котел.
Грамотный подход к ведению режима исключает ошибки, не допускает нарушений режима. Поэтому при ведении режима дежурный по химконтролю должен увязывать отдельные показатели и нормы.
источник
В составе питательной воды присутствуют вещества, имеющие ограниченную растворимость в условиях рабочих параметров котлов. Это прежде всего – соединения кальция и магния, а также оксиды железа, меди, цинка и алюминия. В котлах вследствие испарения воды концентрация растворенных в ней солей увеличивается, и по достижении предела растворимости некоторые из них будут выпадать в виде твердой фазы на поверхности металла или в виде шлама в объеме котловой воды. Такие вещества, как силикат кальция, сернокислый кальций, гидрооксид магния, фосфат магния выделяются из котловой воды в твердом виде, образуя преимущественно накипь. Карбонат кальция, гидроксилаппатит, силикат магния выделяются в виде шлама.
С целью предотвращения образования в котлах твердой кальциевой накипи ведут фосфатную обработку котловой воды. Фосфатный режим является надежным средством предотвращения кальциевого накипеобразования и не должен рассматриваться как способ исключения накипеобразования вообще.
В результате взаимодействия ионов 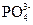
Образование фосфорита отмечается в питательном тракте и экономайзере при относительно низких значениях рН в сравнении с котловой водой, а образование гидроксилаппатита происходит в щелочной среде котловой воды. Этим обстоятельством и определены оптимальные условия ввода раствора фосфата не в питательную, а непосредственно в котловую воду.
Действие фосфата натрия на процесс кальциевого накипеобразования можно объяснить следующим образом: при избытке в котловой воде ионов 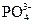
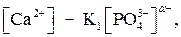 |
где К1 и α – некоторые параметры. Возможность образования твердой накипи может быть исключена, если концентрация 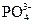
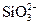
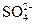
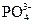
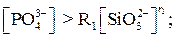 |
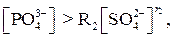 |
где R1, R2, r1, r2 – некоторые эмпирические параметры.
При определении гарантирующих избытков 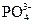
В связи со сложным составом котловой воды, содержащей наряду с катионами Са 2+ , Mg 2+ , Fe 3+ и анионы 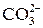
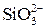
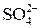
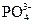
Обычно в условиях эксплуатации правильность выбора дозы ионов 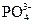
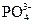
Ca 2+ + Mg. В противном случае доза ионов 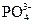
Для уменьшения количества шлама в котловой воде следует стремиться к максимально возможному снижению жесткости питательной воды и обеспечению равномерного и непрерывного ввода раствора фосфата в котловую воду.
В соответствии с расчетными данными ВТК, количество фосфатов, обеспечивающее безнакипный режим котловой воды, увеличивается с ростом солесодержания и уменьшается при понижении рН. Этот регламент позволяет иметь низкое содержание 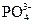
Рекомендуется содержание 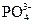
Длительная эксплуатационная проверка режимов фосфатирования на ряде электростанций подтвердила возможность и целесообразность режима уменьшенного фосфатирования для котлов как высокого, так и среднего давления. Принято, что режим уменьшенного фосфатирования, приемлемый для котлов высокого и среднего давления, позволяет снизить скорость образования железофосфатных накипей вследствие незначительной концентрации фосфатов, а также уменьшить интенсивность коррозии труб экранной системы.
Правилами технической эксплуатации разрешено для коррекции питательной воды барабанных котлов применять наряду с фосфатированием и комплексонную обработку. В качестве реагентов комплексообразователей могут быть использованы этилендиаминтетрауксусная кислота (ЭДТД) или ее натриевые соли, например трилон Б. Более предпочтительно применение натриевых солей ЭДТА, так как растворимость их значительно выше.
Данные химического анализа типичного состава отложений с поверхности нагрева экранных труб котлов различных давлений, приведенные в табл. 5.1, свидетельствуют о том, что с увеличением рабочих параметров в составе отложений уменьшается доля соединений катионов Ca 2+ и Mg 2+ и увеличивается доля окислов железа. Следует отметить, что состав отложений (табл. 5.1) отвечает условиям нормативного водно-химического режима котлов – качество питательной воды соответствует регламенту ПТЭ по всем показателям.
Как указывалось ранее, применение фосфата натрия для коррекционной обработки котловой воды не предотвращает образование накипи с участием оксидов железа и меди, поэтому применение фосфатной обработки нельзя рассматривать как оптимальный метод борьбы с накипеобразованием вообще для котлов среднего и тем более высокого давления.
Химический состав отложений в экранных трубах котлов (чистый отсек)
| Показатель | ТП-200 | БКЗ-75 | ПК -14 | БКЗ-320 | ТГМ-96 | |||||
| Экраны | ||||||||||
| зад ний | боко- вой | зад- ний | боко- вой | зад- ний | боко- вой | зад- ний | боко- вой | зад- ний | боко- вой | |
| Обработка кот- ловой воды | Фосфатная | Комплек- сонная | Фосфатная | Фосфатная | Фосфатная | |||||
| Потери при про-каливании, % | 3,0 | 3,5 | 3,5 | 5,3 | — | — | 13,6 | 9,3 | — | — |
| СаО, % | 11,0 | 11,6 | 2,75 | 3,0 | 6,5 | 5,5 | 4,8 | 5,03 | 20,1 | 6,4 |
| MgO, % | 2,8 | 3,86 | 0,57 | 0,8 | 3,25 | 3,32 | 1,9 | 2,53 | 2,1 | 3,9 |
| Р2О5, % | 14,2 | 14,9 | Отсутствует | 19,84 | 21,3 | 7,9 | 8,2 | 14,6 | 12,4 | |
| SiО2, % | 19,1 | 13,6 | 29,6 | 26,6 | 2,21 | 3,5 | 1,4 | 0,9 | 1,4 | 1,76 |
| Аl2О3,.% | 10,3 | 7,8 | 5,7 | 3,8 | 1,9 | 2,9 | 4,7 | 3,18 | 5,4 | 10,6 |
| Fe2O3, % | 27,7 | 27,0 | 24,9 | 43,7 | 37,9 | 46,7 | 29,4 | 54,6 | 43,0 | 46,0 |
| CuO, % | 5,2 | 1,9 | 19,8 | 3,6 | 18,1 | 2,6 | 18,0 | 4,0 | 12,4 | 5,2 |
| ZnO, % | 1,9 | 2,3 | 3,4 | 7,4 | 4,43 | 10,4 | 3,9 | 6,35 | 5,3 | 9,9 |
| SO3, % | 3,09 | 1,8 | 5,5 | 3,8 | 0,45 | 0,54 | 2,1 | 1,4 | 1,14 | 1,1 |
| Nа2O, % | Отсутствует | Отсутствует | 0,6 | 0,65 | 0,91 | 0,78 | 1,8 | 2,0 | ||
| NiO, % | Отсутствует | Отсутствует | Отсутствует | Отсутствует | Отсутствует | |||||
| Сr2О3, % | Отсутствует | Отсутствует | Отсутствует | Отсутствует | Отсутствует | |||||
| MnO, % | Отсутствует | Отсутствует | Отсутствует | Отсутствует | Отсутствует | |||||
| Li, % | Отсутствует | Отсутствует | Отсутствует | Отсутствует | Отсутствует |
В котлах высокого давления вследствие относительно низкой щелочности котловой воды возможно образование фосфорита (Са3РО4)2, который в сочетании с оксидами железа образует твердую железофосфатную накипь. Особенно интенсивное накипеобразование железофосфатной накипи наблюдается в экранных поверхностях котлов, сжигающих жидкое и газообразное топливо, где из-за высоких тепловых напряжений фосфатирование малоэффективно с точки зрения безнакипного режима работы. В таких случаях целесообразно применение комплексонной обработки.
При проведении комплексонной обработки необходимо учитывать следующие обстоятельства:
1) до внедрения комплексонного режима требуется проведение химической очистки экранной системы котла ототложений;
2) при повышении жесткости питательной воды увеличивается доза комплексов на основании стехиометрического соотношения для фактической жесткости;
3) режим комплексонной обработки не исключает коррекции питательной воды в соответствии с нормативами ПТЭ или принятым способом;
4) раствор комплексона и едкого натра вводят в узел сниженного питания котла за регулирующими клапанами;
5) содержание водорода в насыщенном паре при комплексонной обработке выше, чем при фосфатной обработке за счет термолиза ЭДТА.
источник
Владельцы патента RU 2389014:
Изобретение относится к количественному определению содержания фосфатов (обычно, тринатрийфосфата — Na3PO4) в котловой воде барабанных энергетических котлов и может быть использовано на тепловых электростанциях. Способ включает измерение удельной электропроводности котловой воды и расчет концентрации фосфатов, причем измеряют электропроводность охлажденных проб питательной воды и котловой воды солевого отсека барабанного котла, пропущенных через Н-катионитный фильтр, а расчет концентрации фосфатов производят из соотношения:
где СФ — концентрация фосфатов в расчете на РО4 3- , мг/дм 3 ; , , удельные электропроводности Н-катионированных проб котловой воды солевого отсека и питательной воды, приведенные к температуре 25°С, мкСм/см. Достигается повышение информативности анализа. 2 табл., 2 ил.
Изобретение относится к количественному определению содержания фосфатов, вводимых, как правило, в форме тринатрийфосфата Na3PO4, в котловую воду барабанных котлов для обеспечения безнакипного водного режима.
Согласно отраслевым нормам качества котловой воды барабанных энергетических котлов с давлением 13,5 МПа (Правила технической эксплуатации энергетических станций и сетей. РД 34.20.501-95. М., 1996, 200 с.) с 1996 года и по настоящее время концентрация фосфатов нормируется в пределах 0,5-2,0 мг/дм 3 для чистого отсека (чо) и 5-12 мг/дм 3 — для солевого отсека (со) барабана котла. Автоматизация дозирования фосфатов сдерживается отсутствием автоматических анализаторов. Концентрация фосфатов определяется методом ручного химического анализа охлажденных проб котловой воды в лабораторных условиях (Кострикин Ю.М. Инструкция по анализу воды, пара и отложений в теплосиловом хозяйстве. М., Энергоатомиздат, 1967). Попытка автоматизации дозирования фосфатов по расходу питательной воды в котел с периодическим включением насосов-дозаторов ведет к неустойчивому водному режиму котловой воды, как в случае, приведенном на фиг.1 для барабанного котла (р=13,8 МПа) ТЭЦ-23 ОАО «Мосэнерго».
Известен способ расчетного определения рН на электростанциях по дифференциальному измерению электропроводности до (электропроводность прямой пробы, χ) и после Н-катионитного фильтра (электропроводность Н-катионированной пробы, χН) [Анализатор FAM Deltacon рН. Технические данные №23.14. Представительство: Техноприбор. М:]. Сущность способа состоит в пересчете разности электропроводностей (χ-χН) на концентрацию аммиака (гидроксида аммония) и далее — на концентрацию ионов гидроксила, концентрацию ионов водорода и расчете рН=-lgCH + .
Известен способ определения концентрации фосфатов измерением удельной электропроводности котловой воды (Петрова Т.И., Кашинский В.Ч., Верховский А.Е. и др. Исследование влияния концентрации фосфатов в котловой воде на электропроводность и рН // Теплоэнергетика. №7. 2007. С.6-9).
Однако попытки оперативного контроля концентрации фосфатов по измеренной величине удельной электропроводности котловой воды не выдерживают критики, в связи с влиянием на измеренную электропроводность как фосфата, так и хлорида натрия, а также щелочности котловой воды.
Под влиянием названных факторов зависимость концентрации фосфатов в котловой воде от измеренной величины удельной электропроводности носит неоднозначный характер, как показано на фиг.2.
Технический результат предлагаемого изобретения состоит в повышении информативности данных, полученных от автоматических приборов кондуктометрического контроля питательной и котловой воды путем количественного расчетного определения концентрации фосфатов. Технический результат достигается тем, что проводят измерение удельной электропроводности Н-катионированной пробы питательной воды и котловой воды барабанного энергетического котла, и полученные данные используют для расчета концентрации фосфатов в форме 
На фиг.1. показано «Изменение удельной электропроводности (χН25) питательной, котловой воды и пара в период испытаний» (данные автоматической записи ТЭЦ-23 ОАО «Мосэнерго»), где
0 — удельная электропроводность питательной воды перед котлом;
1 — удельная электропроводность в правом чистом отсеке №1;
2 — удельная электропроводность в правом чистом отсеке №2;
3 — удельная электропроводность в левом чистом отсеке;
4 — удельная электропроводность в левом соленом отсеке;
5 — удельная электропроводность перегретого пара за котлом.
На фиг.2 показана «Зависимость концентрации фосфатов от электропроводности котловой воды чистого отсека для ряда ТЭС» по опытным данным, где
1 — ТЭЦ-26 ОАО «Мосэнерго» (1998 г., ВТИ);
2 — ТЭЦ-26 ОАО «Мосэнерго» (2005 г., авторы);
4 — Петрозаводская ТЭЦ (2005 г., МЭИ);
Обоснование расчетного определения концентрации фосфатов состоит в следующем.
Котловая вода современного барабанного энергетического котла с давлением выше 10 МПа содержит следующие примеси: фосфат натрия — Na3PO4, хлорид натрия — NaCl, карбонат натрия — Nа2СО3, гидроксид натрия — NaOH в концентрациях одного порядка значимости. В котловой воде чистого отсека к названным примесям добавляется гидроксид аммония NH4OH, который разлагается на воду Н2О и аммиак NH3, уходящий с паром из котловой воды. В небольших количествах присутствует силикат натрия. Концентрация отдельной примеси котловой воды определяется концентрацией ее (или ее производной) в питательной воде и коэффициентом (степенью) концентрирования примесей питательной воды в котле. Концентрация фосфатов определяется количеством введенного вещества, обычно Na3PO4, качеством и расходом питательной воды и пара.
Для химического контроля проточную пробу котловой воды охлаждают и приводят к атмосферному давлению. После пропуска такой пробы через Н-катионитный фильтр и измерения удельной электропроводности, что является штатной операцией автоматического кондуктометрического химконтроля на ТЭС, в воде остаются следующие диссоциирующие примеси: Н3РО4 и НСl в концентрациях, равных концентрации фосфатов и хлоридов в котловой воде (в мкмоль/дм 3 ). Используя уравнение электропроводности раствора смеси электролитов в виде
для Н-катионированной пробы котловой воды можно выразить концентрацию фосфатов в виде:
где 





Нормирование и химический анализ фосфатов производится в расчете на форму 
Концентрация хлоридов в котловой воде (

Коэффициент концентрирования хлоридов в солевом отсеке современных барабанных котлов (рб=13,8 МПа) составляет от 8 до 12 и может быть, в среднем, принят равным 10. Концентрация хлоридов в питательной воде (
где 




(
Тогда, концентрацию фосфатов из уравнения (3) с учетом уравнения (5) можно привести к виду
где 

Выражение (6) может использоваться для косвенного количественного определения концентрации фосфатов по измерению удельной электропроводности охлажденных Н-катионированных проб питательной и котловой воды.
Предложенный способ проверен в лабораторных и промышленных условиях. В лабораторных условиях измерялась удельная электропроводность Н-катионированной пробы модельного раствора, приготовленного на глубоко обессоленной воде (χобес=0,15 мкСм/см), добавками известных количеств Na3PO4 и NaCl. Результаты приведены в табл.1, откуда видно, что при обычных соотношениях фосфатов и хлоридов в котловой воде, отвечающих опыту №4, отклонение измеренной расчетной концентрации фосфатов находится в пределах 10%, что приемлемо для оперативного контроля качества котловой воды.
| Таблица 1 | ||||||
| Результаты лабораторных опытов на модельных растворах по расчетному определению концентрации фосфатов. | ||||||
| № опыта | Концентрация NaCl | Концентрация фосфата  , мг/л , мг/л | Удельная электропроводность Н-пробы χH, мкСм/см | Концентрация фосфата  , мг/л, расчет по (3) , мг/л, расчет по (3) | Δ, % | |
| мг/дм 3 | мкмоль/дм 3 | |||||
| 1. | 1,50 | 6,0 | 1,48 | 1,3 | ||
| 2. | 5,90 | 24,1 | 5,93 | 0,5 | ||
| 3. | 1,1 | 18,8 | 2,27 | 18,1 | 2,57 | 13,2 |
| 4. | 1,1 | 18,8 | 5,59 | 28,9 | 5,23 | 6,4 |
Промышленные испытания проводились на барабанном энергетическом котле ТГМЕ-96Б ТЭЦ-26 ОАО «Мосэнерго» в условиях ночного отключения насоса-дозатора раствора фосфатов. Результаты испытаний предложенного способа определения концентрации фосфатов приведены в табл.2.
| Таблица 2 | ||||||
| Результаты промышленных испытаний способа определения концентрации фосфатов в котловой воде барабанного котла (рб=13,8 МПа) на ТЭЦ-26 ОАО «Мосэнерго» | ||||||
| № опыта | Время отбора и анализа пробы | Измеренные значения |  , мг/дм 3 , расчет по (6) , мг/дм 3 , расчет по (6) | Δ, % | ||
| χH пв , мкСм/см | χH co , мкСм/см |  , мг/дм 3 , мг/дм 3 | ||||
| 1. | 20 00 | 1,00 | 40,00 | 8,79 | 8,16 | 7,2 |
| 2. | 24 00 | 0,92 | 23,60 | 4,74 | 4,25 | 10,3 |
| 3 | 07 00 | 0,79 | 7,78 | 0,61 | 0,58 | 4,9 |
| 4. | 08 00 | 0,75 | 14,56 | 2,71 | 2,32 | 14,4 |
| 5. | 10 00 | 0,69 | 30,80 | 6,58 | 6,42 | 2,4 |
| Среднее отклонение: 7,76 |
Из табл.2 видно, что среднее отклонение расчетных и измеренных значений концентрации фосфатов находится в пределах 10% также, как и в лабораторных опытах на модельных растворах.
Таким образом, предлагаемый способ позволяет повысить информативность данных, получаемых от автоматических кондуктометров, и количественно определить концентрацию фосфатов в котловой воде современных барабанных энергетических котлов на ТЭС.
Способ определения концентрации фосфатов в котловой воде барабанных энергетических котлов, включающий измерение удельной электропроводности котловой воды и расчет концентрации фосфатов, отличающийся тем, что измеряют электропроводность охлажденных проб питательной воды и котловой воды солевого отсека барабанного котла, пропущенных через Н-катионитный фильтр, а расчет концентрации фосфатов производят из соотношения: 
где Сф — концентрация фосфатов в расчете на РО4 3- , мг/дм 3 ; 

источник
Купить РД 34.37.523.9-88 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО «ЦНТИ Нормоконтроль».
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Распространяется на производственные воды тепловых электростанций и устанавливает методы определения фосфатов в котловых водах.
2 Аппаратура, материалы и реактивы
3 Метод определения фосфатов регулированием кислотности
3.2 Приготовление рабочих растворов
3.3 Приготовление стандартных растворов
3.4 Построение расчетного графика
4 Метод определения фосфатов с применением лимонной кислоты (для устранения помех от силикатов)
4.2 Приготовление рабочих растворов
4.3 Построение расчетного графика
Приложение Ссылочные нормативно-технические документы
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:
ВОДЫ ПРОИЗВОДСТВЕННЫЕ
ТЕПЛОВЫХ ЭЛЕКТРОСТАНЦИЙ.
МЕТОДЫ ОПРЕДЕЛЕНИЯ ФОСФАТОВ
1. РАЗРАБОТАН Всесоюзным дважды ордена Трудового Красного Знамени теплотехническим научно-исследовательским институтом им. Ф.Э. Дзержинского (ВТИ им. Ф.Э. Дзержинского)
2. ИСПОЛНИТЕЛИ Ю.М. Кострикин, докт. техн. наук; Н.М. Калинина; О.М. Штерн; С.Ю. Петрова; Г.К. Корицкий; Л.М. Федешева
3. УТВЕРЖДЕН Главным научно-техническим управлением энергетики и электрификации Минэнерго СССР 15.12.88
Заместитель начальника А.П. Берсенев
4. Срок первой проверка — 1994 г., периодичность проверки — 5 лет
5. ВЗАМЕН Инструкции по эксплуатационному анализу воды и пара на тепловых электростанциях (М.: СПО Союзтехэнерго, 1979) в части определения жесткости (раздел 4)
КЛЮЧЕВЫЕ СЛОВА: энергетика, тепловые электростанции, воды производственные, анализ, фосфаты
ВОДЫ ПРОИЗВОДСТВЕННЫЕ
ТЕПЛОВЫХ ЭЛЕКТРОСТАНЦИЙ.
МЕТОДЫ ОПРЕДЕЛЕНИЯ ФОСФАТОВ
Срок действия с 01.10.89
до 01.10.99
Настоящий стандарт распространяется на производственные воды тепловых электростанций и устанавливает методы определения фосфатов в котловых водах.
Фотоколориметр типа КФК-2 или аналогичного тана с набором кювет толщиной колориметрируемого слоя до 100 мм и набором светофильтров или спектрофотометр;
веса лабораторные общего назначения 2 класса точности с пределом взвешивания 200 г;
ареометры общего назначения — по ГОСТ 18461-81;
колбы мерные первой или второй категории вместимостью 50, 250, 500 и 1000 см 3 по ГОСТ 1770-74;
пипетки градуированные по ГОСТ 29227-91;
колбы конические с пришлифованными пробками и без пробок вместимостью 250 и 500 см 3 по ГОСТ 25336-82;
стаканы химические термостойкие с носиком — по ГОСТ 25336-82;
склянки пришлифованными пробками и без пробок вместимостью 0,5; 1,0; 2,0 и 5,0 дм 3 ;
капельница с клювиком или с колпачком по ГОСТ 25336-82;
кислота соляная 0,1 н, фиксанал — по ТУ 6-09-2540-87;
олово металлическое гранулированное ч.д.а. — по ТУ 6-09-2704-78;
олово двухлористое ч.д.а. — по ТУ 6-09-5384-88;
аммоний молибденово-кислый х.ч„ — по ГОСТ 3765-78;
калий фосфорно-кислый однозамещенный х.ч. — по ГОСТ 4198-75;
фенолфталеин (индикатор) — по ТУ 6-09-5360-87;
индикатор метиловый оранжевый — по ТУ 6-09-4530-77;
натрий сернисто-кислый (сульфит) х.ч. — по ГОСТ 4166-76;
кислота лимонная одноводная — по ГОСТ 3652-69;
натрий фосфорно-кислый однозамещенный ч.д.а. — по ГОСТ 245-76;
натрий фосфорно-кислый двузамещенный ч.д.а. — по ГОСТ 11773-76;
хлороформ — по ТУ 6-09-06-600-76;
вода дистиллированная — по ГОСТ 6709-72;
стандартный образец фосфат иона, содержащего 1 мг/см 3 .
Допускается применение других средств измерений с метрологическими характеристиками и оборудование с техническими характеристиками не хуже, а также реактивов по качеству не ниже, указанных в настоящем нармотивном документе.
3.1. Сущность метода состоит во взаимодействия фосфатов с молибденово-кислым аммонием, при определенной кислотности среды с образованием комплексной фосфорно-молибденовой гетерополикислоты, окрашенной в желтый цвет, которая может быть восстановлена до соединения, имеющего синию окраску, и в измерении оптической плотности полученных растворов.
Минимальное определимое содержание — 0,1 мг/дм 3 PО4.
Продолжительность выполнения анализа 10 — 15 минут.
3.2.1. Раствор хлористого олова. В 100 см 3 глицерина растирают стеклянное палочкой 2,5 г хлористого олова. Смесь подогревают на кипящей водяной бане, растирая оловянную соль до полного растворения.
Полученный глицериновый раствор устойчив против окисления, его хранят в обычной капельнице, из которой осуществляют дозировку.
3.2.2. Раствор для восстановления. Растворяют 20 г метола марки «А» в 100 см 3 дистиллированной воды. Отдельно в 250 — 300 см 3 дистиллированной воды растворяют 100 г сульфита натрия. Смешивают оба раствора. Если получилась мутноватая жидкость, ее фильтрует, фильтрат собирают в мерную колбу вместимостью 1 дм 3 , после чего доливают жидкость до метки дистиллированной водой. Раствор для восстановления чувствителен к действие прямого света; его следует хранить в хорошо закрывающемся полиэтиленовом сосуде.
3.2.3. Раствор серной кислоты. Осторожно приливают 180 см 3 концентрированной серной кислоты к 830 см 3 дистиллированной воды. Перемешивают и дают полностью остыть. Раствор устойчив. Хранят в склянке с плотно закрывающейся пробкой.
3.2.4. Раствор молибденово-кислого аммония. Растворяют 50 г молибденово-кислого аммония в дистиллированной воде, к которому добавлено 10 см 3 с массовой долей 25 % и доливает до 1 дм 3 дистиллированной водой, перемешивают. Хранят в хорошо закрывающемся полиэтиленовом сосуде.
3.2.5. Титрованные растворы кислоты и щелочи. Растворы соляной кислоты концентрации с (HCl) = 0,1 моль/дм 3 и гидроокиси натрия концентрации с (NaOH) = 0,1 моль/дм 3 готовят из фиксаналов. Раствор щелочи можно также готовить, растворяя в дистиллированной воде реактивную химически чистую гидроокись натрия до насыщения. Жидкость при этом разогревается, а при ее остывании часть растворившейся гидроокиси натрия вместе с содой выделяется в твердом виде. Насыщенному раствору NаОН дают осветлиться в течение нескольких суток. Затем ареометром измеряет плотность полученного раствора и определяют его концентрацию по табл. 1.
Содержание NаОН г в 100 г раствора, весовой %
Соответствующим разбавлением, применяя дистиллированную воду, свободную от CO2, готовят раствор гидроокиси натрия концентрации с (NaOH) = 0,1 моль/дм 3 , после чего проверяют его титр по раствору кислоты концентрации с (HCl) = 0,1 моль/дм 3 .
3.3.1. Стандартный раствор, может быть приготовлен из однозамещенного калия фосфорно-кислого (КН2PO4) или при его отсутствии из однозамещенного или двузамещенного фосфатов натрия (NaH2PO4×2Н2O) или (NaH2PO4×12Н2O).
3.3.1.1. Точную навеску 0,1433 г однозамещенного калия фосфорно-кислого, выдержанного сутки в эксикаторе над концентрированной серной кислотой, растворяют в мерной колбе вместимостью 1 дм 3 , после полного растворения соли доливает жидкость до метки дистиллированной водой и тщательно перемешивают. Раствор устойчив, но против биологических образований целесообразно ввести в него 3 — 5 капель хлороформа. Раствор хранят в хорошо закрывающейся склянке.
3.3.1.2. Навеску около 1,8 г (NaH2PO4×2Н2O) или 4,1 г (NaH2PO4×12Н2O) растворяют в 1 дм 3 дистиллированной воды и анализом устанавливают точное содержание в приготовленных растворах. Для этого отбирают пипеткой несколько (3 — 4) проб приготовленного раствора по 50 см 3 , помещая эти количества в конические колбы, вводят по 3 капли индикатора метилового оранжевого и соляной кислоты концентрации с (HCl) = 0,1 моль/дм 3 , создают явно кислую реакцию раствора, доводят раствором щелочи концентрации с (NaOH) = 0,1 моль/дм 3 точно до нейтральной реакции по метиловому оранжевому. Затем кипячением удаляют углекислоту (в реактивах, даже высшей квалификации, иногда присутствуют карбонаты вследствие поглощения солью углекислоты из воздуха) и, охладив жидкость, доводят 0,1 н раствором щелочи точно до нейтральной реакции по метиловому оранжевому. После этого прибавляет насколько капель индикатора фенолфталеина и титруют раствор до неисчезающей слабой розовой окраски фенолфталеина.
Количество раствора щелочи концентрации с (NaOH) = 0,1 моль/дм 3 .
Содержание (PO4) в приготовленных растворах вычисляют в миллиграммах на кубический дециметр по формуле
где a — среднее арифметическое результатов титрования, см 3 ;
0,1 — раствор щелочи концентрации с (NaOH) = 0,1 моль/дм 3 ;
k — поправочный коэффициент этого раствора;
50 и 1000 — пересчет к 1 дм 3 .
3.3.2. Для приготовления стандартного раствора, содержащего 10 мг/дм 3 фосфатов в пересчете на PO4 , отбирают пипеткой 100 см 3 раствора, приготовленного по п. 3.3.1.1, в мерную колбу вместимостью 1 дм 3 , доливают дистиллированной водой до метки и тщательно перемешивают. Для стабилизации к раствору добавляют 2 — 3 капли хлороформа. Раствор устойчив, хранят его в хорошо закрывающейся склянке.
3.3.3. Если для приготовления стандартного раствора пользуются растворами, приготовленными по п. 3.3.1.2, то отмеривают объем 10 : (РО4) см 3 , вносят в мерную колбу вместимостью 1 дм 3 , доливают до метки дистиллированной водой и хорошо перемащивают. Для стабилизации вводят 2 — 3 капли хлороформа.
3.4.1. В несколько мерных колб вместимостью по 50 см 3 вводят различные количества 2, 3, 5, 10 и 20 см 3 стандартного раствора, содержащего 10 мг/дм 3 фосфатов, приготовленного по п. 3.3.2 или п. 3.3.3. Эти количества соответствуют 20, 30, 50, 100 и 200 мкг РО4 в пробе. Дистиллированной водой доливают жидкость в каждой колбе примерно до 40 см 3 , вводят 5 см 3 серной кислоты (п. 3.2.3), 2 см 3 молибденово-кислого аммония (п. 3.2.4) и хорошо перемешивают. Спустя 2 — 3 мин в каждую колбу вводят восстановитель, т.е. по несколько капель (10 — 15) раствора хлористого олова, приготовленного по (п. 3.2.1) или 2 см 3 метол — сульфитного раствора, приготовленного по (п. 3.2.2), перемешивают и доводят до метки дистиллированной водой, после чего еще раз хорошо перемешивают.
Получается серия окрашенных в синий цвет растворов.
Одновременно готовят 3 — 4 контрольных раствора тех же реактивов, но без стандартного раствора фосфата. Через 5 — 7 мин измеряют оптическую плотность (Ак) на фотоколориметре со светофильтрами областью светопропускания 750 нм в соответствующих кюветах, сравнивая с дистиллированной водой. Из полученных результатов вычисляют среднее арифметическое.
Также измеряют оптическую плотность каждого окрашенного стандартного раствора (А) в сравнении с дистиллированной водой.
Значение величины (Ак) зависит от чистоты дистиллированной воды и применяемых реактивов. При их смене значение (Ак) должно проверяться.
3.4.2. По экспериментальным данным, полученным по п. 3.4.1, строят график, которым пользуются при анализе проб.
По оси абсцисс откладывают количества введенных фосфатов (мгк), а по оси ординат — соответствующие им значения оптической плотности (А) минус контрольные значения (Ак), т.е. (А- Ак). По точкам проводят прямую методом наименьших квадратов по приложению А ОСТ 34-70-953.3-88.
Допускается вычисление результатов с помощью множителя, который является средним арифметическим зачением величин, определенных по формуле
где С — количество фосфатов в пробе, мкг;
А — соответствующая этому количеству оптическая плотность;
Ак — среднеарифметическое значение оптической плотности контрольных растворов.
3.5.1. В мерную колбу вместимостью 50 см 3 вводят отмеренное количество анализируемой воды с таким расчетом, чтобы введенное количество PO4 не превышала 200 мкг, затем дистиллированной водой доливают жидкость примерно до 40 см 3 , вводят 5 см 3 серной кислоты (п. 3.2.3), 2 см 3 раствора молибденово-кислого аммония (п. 3.2.4), перемешивают и через 2 мин вводят восстановитель, т.е. 10 — 15 капель раствора хлористого олова (п. 3.2.1) или 2 см 3 метолсульфитного раствора (п. 3.2.2). Перемешивают, доливает до метки дистиллированной водой и снова хорошо перемешивают. Спустя 5 мин измеряют оптическую плотность полученного раствора (Ах) на фотоколориметре со светофильтрами областью светопропускания 750 нм.
Пользуясь расчетным графиком (п. 3.4), получают содержание фосфатов в колориметрируемой проба. Для этого из оптической плотности раствора пробы (Ах) вычитают оптическую плотность контрольной пробы (Ак). Полученную разность (Ах — Ак) находят на оси ординат расчетного графика; далее находят отвечающее этой разности содержание фосфатов (Ср) в пробе по оси абоцисс.
Содержание фосфатов (PO4) в миллиграммах на кубический дециметр вычисляют по формуле
где Ср — содержание фосфатов в пробе, мкг, получаемое по расчетному графику;
V — объем пробы воды, отобранной для анализа, см 3 .
Допустимые погрешности результата определения фосфатов этим методом с доверительной вероятностью Р =0,95 и указаны в табл. 2.
Содержание фосфатов в пробе, мкг
Результаты определения округляют до сотых долей числа.
Форма журнала записи результатов анализа приведена в приложении Б ОСТ 34-70-953.3-88.
4.1. Сущность метода основана на измерении оптической плотности окрашенных растворов, получающихся при взаимодействии фосфатов с аммонием молибденово-кислым и восстановлении образующегося желтоокрашенного соединения метолсульфитным реактивом или хлористым оловом до синего соединения.
Определению фосфатов мешают силикаты, которые взаимодействуют с аммонием молибденово-кислым и с восстановителями с образованием также окрашенных в синий цвеи соединений, влияние которых может быть устранено введением лимонной кислоты. Минимально определимое содержание PO4 — 0,1 мг/дм 3 .
Продолжительность проведения анализа — 10 — 15 минут.
4.2.1. Раствор лимонной кислоты. Растворяет 10 г лимонной кислоты в 100 см 3 дистиллированной воды. Готовить большие объемы этого раствора не следует, так как он быстро плесневеет. Некоторую стабилизацию раствора достигает введением 2 — 3 капель хлороформа. Раствор хранят в полиэтиленовом хорошо закрывающемся сосуде.
4.2.2. Раствор молибденово-кислого аммония. Растворяют 50 г хорошо измельченного аммония молибденово-кислого в 500 см 3 серной кислоты (п. 3.2.3). Добиваются полного растворения соли, после чего доливают жидкость до 1 дм 3 дистиллированной водой. Раствор следует готовить на неделю, так как при более длительном хранении возможно выпадение осадка и реактив становится не пригоден. Раствор хранят в полиэтиленовом хорошо закрывающемся сосуде.
4.3.1. В несколько мерных колб вместимостью по 50 см 3 вводят различные количества (2, 3, 5, 10, 20 см 3 ) стандартного раствора, содержащего 10 мг/дм 3 , фосфатов (п. 3.3.2 или п. 3.3.3). Эти количества соответствуют 20, 30, 50, 100, 200 мкг PO4. Дистиллированной водой доливают жидкость в этик колбах примерно до 40 см 3 , приливают 0,5 см 3 раствора лимонной кислоты (п. 4.2.1), нагревают на водяной бане до 40 — 55 °С, приливают по 2 см 3 метолсульфитного раствора для восстановления (п. 3.2.2) или 10 — 15 капель хлористого олова (п. 3.2.1), перемешивают, добавляют 2 см 3 молибденово-кислого аммония (п. 4.2.2), доливают дистиллированной водой до метки и хорошо перемешивают. Получается серия окрашенных в синий цвет растворов.
Одновременно готовят 3 — 4 контрольных раствора тех же реактивов, но без стандартного раствора фосфата. Через 5 — 7 мин измеряют оптическую плотность (Ак) на фотоколориметре со светофильтрами областью светопропускания 750 нм в соответствующих кюветах, сравнивая с дистиллированной водой. Из полученных результатов вычисляют среднее арифметическое.
Также измеряют оптическую плотность каждого окрашенного стандартного раствора (А) в сравнении с дистиллированной водой.
4.3.2. По экспериментальным данным, полученным по п. 4.3.1. строят расчетный график, как описано в п. 3.4.2.
4.4.1. В мерную колбу вместимостью 50 см 3 вводят отмеренное количество анализируемой воды, но с таким расчетом, чтобы содержание PO4 не превышало 200 мкг. Долив жидкость в колбе дистиллированной водой до 40 — 45 см 3 , приливают 0,5 см 3 лимонной кислоты (п. 4.2.1), нагревают до 40 — 55 °С на водяной бане, приливают 2 см 3 метолсульфитного раствора для восстановления (п. 3.2.2) или 10 — 15 капель хлористого олова (п. 3.2.1) и перемешивают. Приливают 2 см 3 молибденово-кислого аммония (п. 4.2.2), снова аереыешивают, доливает дистиллированной водой до метки и еще раз хорошо перемешивают. Спустя 5 мин измеряют оптическую плотность полученного раствора (Ах) на фотоколориметре со светофильтрами областью светопропускания 750 нм. Сравнение ведут с дистиллированной водой.
Обработка результатов проводится по п. 3.6.
Два результата определений, полученные в одной лаборатории, одним исполнителем на одном оборудовании, на одной пробе признаются достоверными (с доверительной вероятностью Р = 0,95), если расхождение между ними не превышает 0,005 показаний шкалы оптической плотности прибора.
Средние результаты двух испытаний, полученные в разных лабораториях с использованием одних и тех же методов, на одной и той же пробе, признаются достоверными (с доверительной вероятностью Р = 0,95), если расхождение между ними не превышает 0,01 показаний шкалы оптической плотности прибора».
Пункт 5 введен дополнительно. Изм. № 1.
ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
Обозначения НТД, на которые дана ссылка
Номер пункта, подпункта, перечисления, приложения
источник
Лабораторная работа №3
Взятие пробы воды для анализа
Для правильного суждения о качестве воды необходимо соблюдать следующие требования:
1. Брать пробы воды для анализа нужно из точно установленных мест, указанных в водном режиме котельной установи.
2. Если воду берут из трубопровода, то перед взятием пробы следует застоявшуюся воду слить в течение 2-3 минут.
3. Посуда, в которую берут пробу воды, должна быть чистой, ее следует 1-2 раза ополоснуть водой из-под крана, откуда берется проба.
4. Анализы качества котловой воды и теплого ящика проводятся ежесуточно, котельного танка (общая жесткость и содержание хлоридов) 1 раз в 5-7 суток. Полученные результаты фиксируются в журнале.
Проведение испытания
Водородный показатель (pH)
1.1 Метод определения и характеристики
Недородный показатель воды (pH, отрицательный десятичный логарифм концентрации водородных ионов) определяется двумя методами визуально-колориметрическим и потенциометрическим.
При визуально-колориметрическом определении, основанном на реакции ионов водорода с универсальным индикатором (ГД 24.031.120-91, РД 24.032.01-91), pH анализируемой воды определяют визуально сравнением окраски пробы с окраской образцов на контрольной шкале. Диапазон определяемых значений pH составляет 4,5-11,0 при точности анализа ±0,5 ед. pH.
Объём пробы для определения составляет 5 мл, продолжительность выполнения определения — не более 1 мин.
Принадлежности, реактивы и материалы
Определение выполняется с использованием оборудования из состава навесного ящика №1 СЛКВ, секция №2 «pH» или pH-метра типа pH-410 .
Реактивы:раствор индикатора универсального.
Принадлежности, материалы:контрольная шкала образцов окраски растворов для определения pH (pH 4,5; 5,0; 5,5; 6,0; 6,5; 7,0; 7,5; 8,0; 8,5; 9,0; 10,0; 11,0); полимерная пипетка; пробирка колориметрическая с меткой «5 мл».
Отбор и хранение проб
Отбор проб воды и пара должен проводиться в соответствии с п. 9 настоящего руководства.
Для отбора проб используются бутыли из полимерного материала или стекла. Выполнение определений следует проводить как можно скорее и предпочтительнее на месте отбора пробы. Максимальный рекомендуемый срок хранение проб — не более 6 часов.
1.3 Выполнение определения
1) Ополосните колориметрическую пробирку несколько раз анализируемой водой. Налейте в пробирку анализируемую воду до метки «5 мл».
2) Добавьте полимерной пипеткой 3-4 капли раствора индикатора универсального и встряхните пробирку.
3) Проведите визуальное колориметрирование пробы. Для этого пробирку с пробой поместите на белое поле контрольной шкалы и, освещая пробирку рассеянным белым светом достаточной интенсивности, наблюдайте окраску пробы сверху вниз.
4)Определите ближайшее по окраске поле контрольной шкалы и соответствующее ему значение pH. При необходимости повторите определение.
2.1 Метод определения и характеристики
Щелочность воды — показатель, характеризующий содержание в воде соединений, способных реагировать с водородными ионами. К таким соединениям относятся гидроокиси щелочных металлов, карбонаты, гидрокарбонаты и фосфаты щелочных и щелочноземельных металлов, а также соли других слабых кислот.
Метод определения щёлочности является титриметрическим (РД 24.031.120-91, РД 24.032.01-91, РД 34.37.523.7-88). Определение щёлочности воды основано на титровании растворённых в воде щелочных соединений кислотой в присутствии индикаторов, меняющих свою окраску в зависимости от реакции среды. Метод определения щёлочности зависит от вида анализируемой воды и предполагаемого значения щёлочности.
Методом А определяется щёлочность исходной, известкованной, катионированной и питательной вод. Титрование проводят с индикаторами метиловым оранжевым и фенолфталеином при использовании в качестве титранта раствора соляной кислоты 0,1 моль/л. При этом, при титровании с фенолфталеином, определяется свободная щёлочность по фенолфталеину (ЩСВОБ), а при титровании с метиловым оранжевым — общая щелочность (ЩОБЩ). Величина ЩОБЩ условно характеризует суммарное содержание в воде бикарбонатов, карбонатов, гидратов, 2/3 ортофосфатов и гуматов, в то время как ЩСВОБ — гидратов, 1/2 карбонатов, 1/3 ортофосфатов и гуматов.
Методом Вопределяется общая щелочность котловой воды. Титрование проводят со смешанным индикатором для вод, имеющих значительную цветность, а также при титровании при электрическом освещении, при использовании в качестве титранта также раствора соляной кислоты 0,1 моль/л.
Методом С определяется щёлочность воды типа конденсата, т.е. при значении щёлочности менее 0,2 ммоль/кг экв. Титрование проводят со смешанным индикатором или с индикатором метиловым оранжевым, при использовании в качестве титранта раствора соляной кислоты 0,01 моль/л.
Данные по изменению окраски индикаторов в зависимости от pH среды приведены в табл. 3.2.
Отбор и хранение проб
Отбор проб воды и пара проводится в соответствии с требованиями.
Для отбора проб используются бутыли из полимерного материалаили стекла. Выполнение определений рекомендуется пропилить сразу после отбора проб.
Максимальный рекомендуемый срок хранение проб при охлаждении до 2-5°С — не более 24 ч.
Подготовка к определению
Подготовка к определению общей щелочности состоит в приготовлении израсходованного раствора соляной кислоты (0,01 моль/л). Потребитель готовит его самостоятельно, используя раствор соляной кислоты (0,1 моль/л) из состава лаборатории.
Жёсткость общая
3.1 Методы определения и характеристики
Метод определения общей жёсткости как суммарной массовой концентрации эквивалентов катионов кальция и магния — комплексонометрической, основан на реакции образования в щелочной среде (pH = 9) в присутствии индикаторов окрашенных внутрикомплексонных соединений катионов кальция и магния с трилоном Б (двунатриевой солью этилендиаминтетрауксусной кислоты). (РД 24.031.120-91, РД 24.032.01-91, РД 34.37.523.8-88).
В зависимости от предполагаемого значения жёсткости, опредение выполняется тремя методами.
Метод А— титриметрический.Определяется жёсткость природной, известковой и коагулированной воды при величине более 0,1 °Ж. При титровании используется раствор индикатора хром темно-синего и в качестве титранта — раствор трилона Б 0,05 моль/л экв.
Метод Б— титриметрический.Определяется жёсткость любых вод при величине в диапазоне 0,02-0,1 °Ж. При титровании используется раствор индикатора хром тёмно-синего и в качества титранта раствор трилона Б 0,005 моль/л экв.
МетодС — визуально-колориметрический.Определяется жёсткость вод при величине менее 0,02 °Ж. Особенностью данного метода, на первом этапе, является необходимость выбора пары индикатор — буферный раствор, которая для данной исходной (катионированной) воды обеспечивает оптимальный переход окраски от розового к синему, что является индивидуальной особенностью данной исходной воды.
Сравнение окраски анализируемой воды с окраской эталонных растворов позволяет определить фактическое значение жёсткости с чувствительностью 0,001-0,002 °Ж.
Индикаторы кислотный хром тёмно-синий и эриохром чёрный Т образуют с катионами солей жёсткости непрочные окрашенные соединения красного цвета. При добавлении в воду с подобными окрашенными соединениями раствора трилона Б в точке эквивалентности происходит их полное разрушение, при этом раствор становится синим.
В присутствии ионов цинка или меди (неотчётливый переход окраски) определение жёсткости проводят с добавлением раствора сульфида натрия, связывающего эти катионы в нерастворимые сульфидные соединения.
Влияние ионов марганца, приводящее к быстрому обесцвечиванию окраски, устраняют добавлением к пробе раствора солянокислого гидроксиламина.
Объём пробы для анализа составляет, в зависимости от метода, от 10 до 100 мл, продолжительность выполнения анализа — не более 15 мин.
Подготовка к определению
Подготовка к проведению анализа заключается в приготовлении расходных растворов из реактивов, входящих в состав лаборатории.
Буферные растворы следует приготавливать с использованием очищенной катионированной воды либо воды, применение которой не приводит к холостому окрашиванию пробы.
Очищенную воду, необходимую для проведения анализа, приготавливают по ОСТ 34.70.953.2-88, либо используют набор для приготовления очищенной воды.
Отбор и хранение проб
Отбор проб воды и пара должен проводиться в соответствии требованиями.
Пробы анализируемой воды следует отбирать в стеклянные бутыли или полимерные бутыли с пробками. Допускается хранение пробы до 24 ч без консервации.
3.4 Выполнение определения
Метод А. Определение общей жёсткости воды более 0,1 °Ж
1. Налейте анализируемую воду в коническую колбу вместимостью 250 мл до метки «100 мл».
2. Добавьте полимерными пипетками 1 мл аммиачного буферного раствора, 7 капель раствора индикатора кислотного хрома тёмно-синего.
3.Медленно титруйте пробу раствором трилона Б (0,05 моль/л экв.), используя бюретку или стойку-штатив с мерной пипеткой вместимостью 10 мл со шприцем-дозатором, до отчётливого изменения цвета с розового на синий.
Примечание.При нечётком переходе окраски или обесцвечивании пробы определение повторите с добавлением к пробе 0,5 мл раствора сернистого натрия для устранения мешающего действия ионов меди и цинка либо трёх капель раствора солянокислого гидроксиламина для устранения мешающего действия соединений марганца.
4Рассчитайте общую жёсткость (Жобщ) в °Ж по формуле:
ЖОБЩ =V × 0,5
На титрование 100 мл пробы воды израсходовано 3,5 мл раствора трилона Б (0,05 моль/л экв.). Общая жёсткость будет составлять:
ЖОБЩ = V × 0,5 = 3,5× 0,5 = 1,75°Ж
4.1 Метод определения и характеристики
Содержание хлоридов (массовая концентрация хлорид- иона) определяется методом аргентометрического титрования (РД 24.031.120-91, РД 24.032.01-91). Определение основано на титровании хлорид-ионов раствором нитрата серебра при pH 5,0- 8,0, в результате чего образуется суспензия практически нерастворимого хлорида серебра. В качестве индикатора используется хромат калия, который реагирует с избытком нитрата серебра с образованием хорошо заметного оранжево-бурого осадка хромата серебра.
Объём пробы для анализа — см. табл. 12, продолжительность выполнения анализа — не более 5 мин.
Отбор и хранение проб
Отбор проб воды и проводится в соответствии с требованиями.
Для отбора проб используются бутыли из полимерного материала или из стекла. Допускается хранение пробы I мес. без консервации.
В зависимости от предполагаемого содержания хлоридов отбираются пробы для анализа в количествах согласно табл. 12.
На титрование 10 мл пробы котловой воды израсходовано 1,1 мл раствора нитрата серебра (0,05 моль/л экв.). Концентрация хлорид-ионов составит:
мг/л.
На титрование 10 мл пробы воды израсходовано 0,02 мл раствора нитрата серебра (0,05 моль/л экв.). Величина израсходованного на титрование объёма раствора нитрата серебра свидетельствует о том, что концентрация хлорид-ионов меньше предполагаемой.
мг/л.
Так как предполагаемая концентрация хлорид-иона оказалась меньше 4,0 мг/л (см. табл. 3.3), на анализ повторно отбирается проба объёмом 6000 мл, которая упаривается до 150 мл (в 40 раз). На титрование упаренной пробы объёмом 150 мл израсходовано 9,5 мл раствора нитрата серебра (0,05 моль/л экв.). Концентрация хлорид-ионов в этом случае составляет:
мг/л.
На титрование 10 мл пробы воды израсходовано 4,82 мл раствора нитрата серебра (0,05 моль/л экв.). Величина израсходованного на титрование объёма раствора нитрата серебра свидетельствует о том, что концентрация хлорид-ионов больше предполагаемой.
мг/л.
Так как предполагаемая концентрация хлорид-иона оказалась Тоньше 700 мг/л (см. табл. 3.3), отобранная проба разбавляется дистиллятом в 10 раз, на анализ берётся объем 10 мл разбавленной пробы. На титрование отобранной пробы израсходовано 0,48 мл раствора нитрата серебра (0,05 моль/л экв.). Концентрация хлорид-ионов в этом случае составляет:
мг/л.
Вопросы для самоконтроля:
1. Дать определения понятиям: главный конденсат, вспомогательный конденсат, дистиллят испарительной установки, дренажи, добавочная вода, питательная вода, котельная вода, котловая вода, продувочная вода, охлаждающая вода.
2. Охарактеризовать основные показатели: Общее содержание примесей, Растворённые вещества, Взвешенные вещества, Остаток после прокаливания, Потеря при прокаливании, Концентрация водородных ионов, Кислотность, Щёлочность, Щелочное число, Общая жёсткость воды, Карбонатная жёсткость, Некарбонатная жёсткость, Cодержание хлоридов, Фосфатное число, Нитратное число, Содержание окислов меди и железа, Содержание кислорода, Содержание нефтепродуктов.
Лабораторная работа №3
Тема: ОПРЕДЕЛЕНИЕ КАЧЕСТВА КОТЛОВОЙ ВОДЫ
Цель:Определение качества котловой воды, изучение норм качества котловой воды, рекомендации по водному режиму.
В пароконденсатном цикле СЭУ с паротурбинной установкой (ПТУ) вода и пар циркулируют по замкнутому контуру, в котором могут быть различные утечки воды или пара, вызывающие периодическое или непрерывное восполнение контура циркуляции технической водой. Поэтому в СЭУ с ПТУ существуют специальные определения воды в различных точках циркуляционного контура:
• главный конденсат – вода после конденсации отработавшего пара на выходе из главного конденсатора;
• вспомогательный конденсат – вода после конденсации отработавшего пара из вспомогательных конденсаторов (после вспомогательных механизмов и теплообменных аппаратов);
• дистиллят испарительной установки – вода, полученная из морской путем её термической дистилляции;
• дренажи – конденсаты после паровых подогревателей топлива и общесудовых потребителей пара;
• добавочная вода – вода, подаваемая в циркуляционный контур для восполнения его в результате утечек (воды и пара);
• питательная вода – вода, подаваемая в паровой котёл для поддержания его паропроизводительности (так же, как и забортная вода, поступающая в камеру испарения водоопреснительной установки);
• котельная вода – питательная вода определённого химического состава, предназначенная исключительно для парового котла, находящаяся в танке котельной воды;
• котловая вода – вода, находящаяся в циркуляционном контуре котла;
• продувочная вода – котловая вода, удаляемая периодически или непрерывно из котла для уменьшения солесодержания в ней взвешенных частиц шлама;
• охлаждающая вода – вода, с помощью которой отводят теплоту через поверхность теплообмена системы охлаждения теплотехнического объекта.
Питательная вода судовых паровых котлов обычно состоит из конденсата отработавшего пара и добавочной воды. Добавочная вода может быть природной, полученной с берега и прошедшей соответствующую водообработку, или дистиллятом от испарительной установки забортной воды. В целом, добавочная вода составляет 2–5 % от общего количества питательной воды.
Вода является одним из лучших природных растворителей органических и минеральных веществ, а также газов. Поэтому она в результате круговорота в природе приобретает множество примесей в виде газов, взвешенных мелкодисперсных частиц и растворенных минералов различного происхождения. Конденсат отработавшего пара на морских судах чаще всего содержит примеси в виде продуктов коррозии трубопроводов или забортной воды при подсосах в трубных решётках конденсаторов, а также – нефтеостатков СЭУ (частицы жидкого топлива и смазочного масла). Поэтому питательной водой, например, для судовых вспомогательных паровых котлов может быть конденсат отработавшего пара или природная вода, содержащая в себе частицы песка и глины, а также растворенные накипеобразователи щелочно-земельных металлов (Ca2+ и Mg2+), такие как бикарбонаты, сульфаты, хлориды и силикаты, а также коррозионно-активные газы – кислород, хлор и углекислый газ.
Поступление в котловую воду любых вышеперечисленных примесей является нежелательным, т. к. это приводит к появлению накипных отложений и коррозии на поверхности нагрева, что увеличивает расход топлива и снижает надежность котельных установок и эффективность их эксплуатации.
В СДВС с высокотемпературной системой охлаждения вышеуказанное также имеет место. Поэтому на морских транспортных судах системы охлаждения ДВС обычно низкотемпературные и двухконтурные. В первом контуре циркуляции для охлаждения СДВС обычно применяют водные растворы ингибиторов коррозии, а во втором – проточную морскую забортную воду.
Техническая эксплуатация СЭУ невозможна без проведения соответствующего водного режима, предусматривающего контроль основных показателей качества воды (водоконтроля) и определенной технологии водообработки. Качество используемой в СЭУ воды в значительной мере определяет надёжность элементов СЭУ и объём трудозатрат на восстановление работоспособности оборудования. Выбор технологии водоподготовки определяется её эффективностью и экономической целесообразностью.
Основными задачами водоподготовки в СЭУ являются: создание условий для предотвращения процессов накипеобразования и коррозии на поверхности нагрева, а также исключение уноса солей с влажным паром из зоны кипения воды. Поэтому каждый инженер-судомеханик должен уметь определять основные показатели качества питьевой и технической воды, а также корректировать водные режимы и технологии водообработки в соответствии с инструкциями по технической эксплуатации судового оборудования.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ — конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
источник


