Химическое обозначение: Ca
Синонимы: известь, мягкий камень.
Описание: элемент 2 группы 4 периода с атомным номером 20. Мягкий металл серебристого цвета с высокой химической активностью.
Методы определения: потенциометрия, титрование, масс-спектрометрия, атомная абсорбция и эмиссия.
Методики, используемые в Испытательном центре МГУ для определения концентрации кальция в природных средах
| Нормативный документ на методику | Метод определения | Оборудование |
|---|---|---|
| Вода | ||
| ЦВ 3.18.05-2005 (ФР.1.31.2005.01714) | масс-спектрометрия | AGILENT 7500A ICP-MS |
| Почва | ||
| ФР.1.31.2009.06787 | масс-спектрометрия | AGILENT 7500A ICP-MS |
| ЦВ 5.18.19.01-2005 | масс-спектрометрия | AGILENT 7500A ICP-MS |
Распространённость: кальций в свободном виде не встречается в природе, однако распространён в составе соединений: 3,4% массы земной коры приходится на этот элемент. Кальций занимает четвёртое место по количеству образуемых минералов. Существенную часть последних составляют силикаты, алюмосиликаты, граниты, гнейсы, полевые шпаты, кальциты, ангидриты, гипсы, флюориты, апатиты и доломиты. Содержание кальция в воде обуславливает жёсткость воды.
В воде систем централизованного водоснабжения содержание кальция не нормируется напрямую: в водопроводной воде нормируется параметр жёсткости. Кальций, наряду с магнием и стронцием, вносит вклад в показатель жёсткости: если предположить, что вся жёсткость водопроводной воды будет обусловлена только кальцием, максимально допустимая его концентрация будет составлять 140,28 мг/л.
Предельно допустимая концентрация (ПДК) кальция в различных водных объектах
| Нормирование | ПДК, мг/л |
|---|---|
| Бутилированная вода первой категории СанПиН 2.1.4.1116-02 | 0–130 |
| Бутилированная вода высшей категории СанПиН 2.1.4.1116-02 | 25–80 |
| Вода систем централизованного водоснабжения СанПиН 2.1.4.1074-01 | — |
| Водные объекты рыбохозяйственного значения Приказ Минсельхоза РФ № 552 | 0–180 |
| Объекты рекреационного водопользования СанПиН 2.1.5.980-00 | — |
| Вода плавательных бассейнов СанПиН 2.1.2.1188-03 | — |
| Сточные воды в бытовых системах водоотведения Постановление Правительства РФ № 644 | — |
| Сточные воды в ливневых системах водоотведения Постановление Правительства РФ № 644 | — |
В потреблении воды с повышенным содержанием кальция нуждаются грудные дети (норма потребления 1,0–1,2 г в сутки) и беременные женщины (0,4–0,7 г в сутки).
Кальций участвует в:
- сокращении мышечных тканей;
- регулировании способности мембран клеток пропускать вещества и элементы;
- изменении концентрации липидов в кровяной сыворотке;
- передаче нервных импульсов;
- выделении гормонов гипофизом и надпочечниками;
- клеточном иммунитете;
- усвоении микроэлементов;
- ферментативной активности печени.
При недостатке элемента наблюдаются:
- неконтролируемые сокращения тканей мышц;
- судорожные фибрилляции сердечной мышцы;
- нарушение свёртываемости крови;
- нарушение нормального образования и формирования костей.
При избытке кальция наблюдается:
- формирование солевых твёрдых отложений кальция в почках и мочевыводящих путях;
- гиперкальциемия, формирование отложений кальция на костях и стенках сосудов;
- торможение развития скелета.
Ионный обмен. В результате использования ион-обменных смол в воде происходит замена ионов кальция на ионы натрия.
Обратный осмос. Вместе с другими веществами обратный осмос убирает из воды кальций. Нецелесообразно использовать обратный осмос только для умягчения и при жёсткости воды более 7 мг-экв/л без предварительного умягчения.
Кипячение. Во время кипячения воды соли жёсткости, в состав которых входит кальций, осаждаются на стенках сосуда, поэтому вода становится немного мягче (т.е. содержит меньше кальция, чем исходная вода).
Кальций относится к элементам, которые характеризуются как отрицательным, так и положительным влиянием на организм человека. Поэтому необходимо контролировать содержание кальция в питьевой воде и регулировать его содержание таким образом, чтобы концентрация находились в оптимальном диапазоне.
источник
Аналитический центр более 20 лет занимается химическим анализом и разработкой новых методов анализа и диагностики веществ и материалов
В нашем распряжении самый современный приборный парк благодаря научно-техническому взаимодействию с крупнейшими мировыми разработчиками аналитического оборудования
Наши сотудники — это лучшие специалисты страны в области химического анализа, кандидаты и доктора наук
Аккредитация позволяет исследовать питьевую, природную, морскую, технологическую, талую воду и воду бассейнов
Обратившись к нам, Вы получите не только точные данные о присутствующих в воде загрязнителях, но и подробные рекомендации о способах очистки воды.
На основании анализа воды БЕСПЛАТНО подберем несколько вариантов систем водоочистки!
В нашей лаборатории Вы можете проверить качество воды из любого источника: колодца, скважины, водопровода, бассейна, родника, водоема. Для каждого источника есть оптимальный набор показателей, характеризующий возможность использования воды для тех или иных нужд. Чтобы правильно подобрать набор показателей, свяжитесь с нами по номеру +7 (495)149-23-57 или напишите на почту info@ion-lab.ru
Мы рекомендуем выбирать набор параметров в зависимости от того, какой у Вас источник водоснабжения, а также для каких целей планируете использовать воду. Для воды из городского водопровода, а также для воды, используемой в технических целях, подойдут наборы «Минимальный» или «Начальный». Для воды природных источников (скважины, колодцы, родники и т.д.) мы рекомендуем проверить воду на химический состав (наборы «Расширенный» или «Максимальный»), а также сделать анализ на микробиологию.
Да, Вы можете самостоятельно отобрать воду для анализа, следуя инструкции. Или же заказать выезд специалиста, который приедет в назначенное время со всей необходимой тарой, отберет воду и доставит ее в лабораторию.
Да, конечно! Пункт приема проб расположен по адресу: Москва, ул. Добролюбова, 21А, корпус А, пом. 14 (в пешей доступности от метро Фонвизинская, Бутырская, Тимирязевская)
Стоимость выезда специалиста зависит от выбранного Вами набора показателей и удаленности. Более точная информация размещена в разделе Доставка и оплата
© 1997-2019 — Лаборатория ИОН. Все права защищены.
Для химического анализа необходимо заполнить водой чистую пластиковую тару (оптимально 1,5 л). Использовать бутылки из-под сладких, газированных или ароматизированных напитков, а также солёной или минеральной воды недопустимо.
Если выбранный Вами анализ включает определение содержания нефтепродуктов, необходимо заполнить дополнительную стеклянную тару объемом 0,2 л.
Если выбранный Вами анализ включает определение содержания сероводорода, необходимо заполнить дополнительную стеклянную тару объемом 0,5 л (необходимо использовать консервант).
При отборе воды из проточного источника, непосредственно перед отбором необходимо пролить воду сильной струёй в течение 3-5 минут. Перед отбором проб ёмкости и крышки необходимо 3 раза промыть изнутри водой, подлежащей анализу. Использование моющих средств недопустимо. Наполнять тару необходимо тонкой струёй по стенке сосуда «под горлышко». Это снижает насыщение воды кислородом и предотвращает протекание реакций.
Для микробиологического анализа необходимо использовать стерильный контейнер для биоматериалов объемом 150-200 мл.
Перед взятием пробы необходимо протереть водопроводный кран спиртовой салфеткой, уделив особое внимание месту выхода воды.
При отборе воды из водопровода, скважины или колонки необходимо пролить воду сильной струёй в течение 3–5 минут.
При отборе воды из колодца с помощью ведра необходимо обдать ведро кипятком для дезинфекции. Отбор пробы через поливочные шланги и предметы, контактирующие с почвой, не допускается.
Для отбора пробы необходимо надеть перчатки и вскрыть упаковку стерильного контейнера. Не касаясь внутренней поверхности ёмкости, отобрать образец воды (2/3 объема контейнера) и закрыть крышкой.
Рекомендуем доставлять пробу сразу после отбора.
Если сразу после отбора нет возможности доставить пробу в лабораторию, допускается хранение образцов при температуре 2–10 °C в течение 1 суток.
Съезд на ул. Руставели, на первом светофоре поворот налево на ул. Яблочкова.
Через 300 м поворот направо на ул. Гончарова, через 500 м поворот налево (напротив дома №6), через 200 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Поворот на ул. Руставели, на светофоре поворот направо на ул. Добролюбова, через 300м на светофоре поворот налево на ул. Гончарова, напротив дома №6 поворот направо, через 200 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Двигаясь по ул. Милошенкова, поворачиваем на ул. Добролюбова
Через 150 метров поворот направо, за домом 21АкБ поворот налево, через 100-120 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Ближайшее станция метро – Фонвизинская (600 м)
Последний вагон из центра. Выход в сторону улицы Фонвизина. Из стеклянный дверей направо. Перейти через пешеходный переход и идти через дворы в соответствии со схемой. Пункт назначения — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Анализ «Минимальный» содержит минимальный и обязательный перечень загрязнителей, часто встречающихся в питьевой воде, и включает 16 показателей:
- органолептические: мутность, цветность, запах, привкус;
- общехимические: рН, жесткость, окисляемость перманганатная, минерализация, электропроводность, щелочность общая, щелочность свободная;
- катионы: железо, аммоний;
- анионы: нитраты, карбонат, гидрокарбонат.
Данный набор рекомендуется для исследования воды хозяйственно-бытового назначения. Анализ «Минимальный» не обладает достаточной информативностью для подбора системы водоочистки, так как не позволяет получить полную картину о безопасности воды. Если Вы планируете использовать воду в питьевых целях, рекомендуем обратить внимание на наборы, содержащие большее число параметров.
- Точность определения
- Подходит для воды, применяемой в хоз-бытовом назначении
- Срок выполнения — 3-4 рабочих дня
- Не подходит для воды, применяемой в питьевых целях
- Не подходит для корректного подбора фильтров
- Не содержит определения опасных загрязнителей
Анализ «Начальный» предназначен для выявления наиболее часто встречающихся вредных веществ в питьевой воде и включает 23 параметра: мутность, цветность, запах, привкус, рН, жесткость, окисляемость, минерализация, электропроводность, щелочность свободная, щелочность общая, железо, марганец, калий, магний, кальций, фториды, хлориды, нитраты, сульфаты, карбонат, гидрокарбонат, аммоний Данный анализ рекомендуется для оценки качества воды из колодцев, скважин, родников. По протоколу анализа «Начальный» возможен подбор системы водоочистки и типа фильтрующей загрузки. В перечень определяемых параметров входят органолептические показатели, общие химические показатели, а также содержание катионов и анионов
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для колодцев и скважин
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Позволяет корректно и экономично настроить водоочистное оборудование
- Не содержит перечень тяжелых металлов
- Не содержит перечень всех опасных загрязнений
- Срок выполнения исследований 5-6 рабочих дней
Анализ «Расширенный» содержит перечень наиболее часто встречающихся загрязнителей воды, вне зависимости от источника, и включает 31 показатель: мутность, цветность, запах, привкус, рН, жесткость, окисляемость, минерализация, электропроводность, щелочность общая, щелочность свободная, аммоний, алюминий, железо общее, магний, кальций, калий, натрий, марганец, медь, мышьяк, свинец, кадмий, цинк, стронций, фториды, хлориды, нитраты, сульфаты, гидрокарбонат, карбонат. Данный набор рекомендуется, в первую очередь, владельцам колодцев и скважин. Содержит перечень основных тяжелых металлов. Перед покупкой системы водоподготовки рекомендуем провести исследование воды с данным перечнем загрязнителей. Ориентируясь на полученную информацию, Вы сможете подобрать оборудование водоочистки с эффективностью до 98%, а так же корректно его настроить.
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для колодцев и скважин
- Содержит перечень тяжелых металлов
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Позволяет корректно и экономично настроить водоочистное оборудование
Анализ «Максимальный» содержит полный перечень опасных для здоровья человека веществ, встречающихся в воде, поступающих из скважин или колодцев, включая ионы тяжелых металлов и органические вещества, а именно: мутность, цветность, запах, привкус, рН, жесткость, окисляемость, минерализация, электропроводность, щелочность общая, щелочность свободная, аммоний, натрий, калий, магний, кальций, алюминий, железо, марганец, литий, барий, бериллий, бор, ванадий, молибден, кобальт, цинк, никель, хром, стронций, кадмий, мышьяк, медь, свинец, кремний, серебро, титан, ртуть, гиброкарбонат, карбонат, нитрат, хлорид, сульфат, фосфат, фторид, нитрит, сероводород, сульфид, гидросульфид, хлор общий, хлор остаточный, хлор остаточный свободный, АПАВ, нефтепродукты, фенол, формальдегид, бензол, толуол, о-ксилол, п-ксилол, м-ксилол, стирол Данное исследование рекомендуется для клиентов, которые серьезно относятся к выбору питьевой воды. Протокол анализа «Максимальный» позволяет со 100% уверенностью сделать вывод о пригодности воды для питья и приготовления пищи. Результаты исследования позволяют выбрать схему водоочиски, а также оценить эффективность уже установленного оборудования.
Воды, применяемой в хозяйственно-бытовом назначении; оценки работы системы водоочистки.
пластиковая бутылка 1,5 — 2 л.
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для любых источников воды
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Включает полный перечень тяжелых металлов
- Позволяет корректно и экономично настроить водоочистное оборудование
- Содержит полный перечень опасных органических веществ
Помимо хичиеского анализа воды мы настоятельно рекомендуем провести микробиологическое исследование Вашей воды. Микробиологический анализ воды включает определение общего микробного числа (ОМЧ), количества общих колиформных и колиформных термотолерантных бактерий.
источник
JBL Ca Test
Тест предназначен от производителя для точного измерения содержания кальция во всех аквариумах с морской водой с рекомендируемым уровнем Са 400-440 ппм. Точность измерения теста с шагом по 20 ппм (=мг/л).
Инструкция для пользования тестом от производителя:
Способ применения:
ОБРАТИТЕ ВНИМАНИЕ: капельные бутылочки при получении капель всегда держать носиком вертикально вниз!
Носик должен быть сухим снаружи!
Капать, не создавая пузырьков!
1. Мерный сосуд несколько раз прополоскать водой, подлежащей тестированию.
2. Заполнить мерный сосуд тестируемой водой до отметки 5 мл. Для получения точных результатов воспользуйтесь для этого прилагаемым шприцем.
3. Добавить 5 капель реактива 1 и перемешать путем покачивания. Возможно, при этом жидкость помутнеет, но это не влияет на результат теста. Подождать 1 минуту.
4. Добавить 1 малую мерную ложку (узкий конец приложенной двойной ложки) реактива 2 и покачать, пока порошок не растворится.
5. По каплям добавить реактив 3, считая капли и покачивая после каждой капли, пока цвет не изменится с розового через фиолетовый на синий. Перемножив количество использованных капель на 20, получим концентрацию кальция в мг/л. Например: 12 капель реактива 3 = 240 мг/л.
__________
Реагенты
https://www.jbl.de/e.
Kit Components
2540000 JBL Ca Kalzium Test-Set Components:
Product code Description
286 JBL Ca Kalzium Test-Set Reagenz 1
Исходя из листа по безопасности для теста от JBL сайта (Safety data sheet according to 1907/2006/EC, Article 31)
в составе K OH (potassium hydroxide)
(о концентрации можно судить косвенно от сюда — Solvent content: Organic solvents: 0.0 % Water: 75.0 % VOC (EC) 0.00 %)
352 JBL Ca Kalzium Test-Set Reagenz 2
По листу безопасности в составе Na2SO4 (sodium sulphate)
Порошек с пурпуратом аммония
353 JBL Ca Kalzium Test-Set Reagenz 3
По листу безопасности в составе Na OH (sodium hydroxide)
Там видимо ЭДТА содержащий раствор
Как всегда для таких тестов — точный состав и концентрации реагентов не указаны.
В герметично закрытых, не пользованных бутылочках, соответственно информации от производителя, тест сохраняет пригодность 3 года. Для открытых — срок годности не указан. Есть только информация, что после открывания бутылочек, при доступе кислорода, это время укорачивается.
На донышках бутылочек реагентов указан срок годности теста. При покупке стоит на это обратить внимание.
Из сайта JBL — The following is printed on the bottom of the packaging:
CH/B: 2145 (e.g.) = batch number номер серии
BBD: 03/13 (e.g.) = best-before date (month/year)) годен до (месяц/год)
Но это касается только неоткрытых бутылочек реагентов теста
__________
Тест основан на реакцию ионов кальция (с удалением ионов магния гидроксидом калия — реагент 1) и после этого с последующым титрованием с раствором ЭДТА известной концентрации (реагент 3) в присутствие только с кальцием реагирующего индикатора — пурпурата аммония (реагент 2) (murex > Complexometric Titration — titration with ethylencdiamine-tetraacetate ion in the presence of ammonium purpurate)
Все тонкие детали об этом методе, все методики по приготовлению всех реагентов, методику самого тестирования, а также по всем точным расчетам концентрации кальция, можно прочитать здесь:
http://nitttrc.ac.in.
Еще больше о происходящих реакциях, константах устойчивости кальция с ЭДТА и пурпуратом, и разных методов определения кальция, можно почитать в статье James H. Carpenter The Determination of Calcium in Natural Waters, Chesapeake Bay Institute, The Johns Hopkins University, Baltimore, Maryland,
Здесь доступен бесплатный полный текст статьи
http://tubc.aslo.net.
В капельном тесте для аквариумов эта методика конечно упрощена. Основывается только на количество каплей при титровании по визуально хорошо заметному переходу окраски раствора от розовой (пока в растворе еще есть свободные ионы Са и Mg) до голубой (когда уже все связано в комплексон).
__________
Вариации для пользования тестом не по инструкции
Возможности для использования этого теста для определения уровня Са в пресной воде:
В пресноводных аквариумах уровень концентрации Са в среднем до 10 раз ниже, чем в морских аквариумах. Поэтому стандартная градация 1 капли реагента равнозначной 20 ппм получается слишком грубая и не позволяет с необходимой точности определить уровень, который нужно узнать. Но все реагенты этого набора теста корректно срабатывает и в пресной воде. Переходы по окраске аналогичные с измерениями в соленной воде. От розовый через фиолетовый на голубой.
Для использования теста в пресной воде, необходимо уменьшить шаг измерений (уменьшить значение 1 капли реагента 3).
Приспосабливание теста для измерения с меньшим шагом:
Для этого нужно увеличить объем пробы воды взятой для теста. Соответственно 1 капля реагента 3 будет уже не 20 ппм по Са, а концентрация уменьшится. Тогда получится уже более узкая возможная градация (шаг) по измерениям.
Увеличивая объем воды в х-раз, значение 1 капли реагента 3 уменьшится в х-раз.
На пример:
В оригинальной инструкции проба воды 5 мл — 1 капля реагента 3 соответствует 20 ппм
Если проба воды 10 мл — 1 капля реагента 3 соответствует 10 ппм (5*2=10; 20/2=10)
Если проба воды 20 мл — 1 капля реагента 3 соответствует 5 ппм (5*4=20; 20/4=5)
Если проба воды 25 мл — 1 капля реагента 3 соответствует 4 ппм (5*5=25; 20/5=4)
Если проба воды 50 мл — 1 капля реагента 3 соответствует 1 ппм (5*10=50; 20/10=1)
Порядок тестирования Са с морским тестом в пресной воде:
Выбрать увеличенную пробу воды с необходимой точностью шага.
Шприцем отмерить воду и наполнить мерный сосуд. Дальше нужно точно следовать оригинальной инструкции от производителя.
То есть: «добавить 5 капель реагента 1 и перемешать. Наблюдаемое в это время помутнение раствора не влияет на результат тестирования. Подождать 1 минуту. Добавить 1 маленькую мерную ложку (узкий конец прилагаемой двойной ложки) реагента 2 и перемешивать до тех пор, пока порошок полностью не растворится. По каплям добавлять реагент 3, считая капли, перемешивая раствор после каждой капли, до тех пор, пока не произойдет смена цвета с розового через фиолетовый на голубой.»
Полученное число капель реагента 3 при переходе на голубую окраску умножить на новое значение 1 капли, соответственно взятому увеличенному объему воды для теста.
На пример:
Проба воды 10 мл, при переходе на голубой понадобылись 4 капли реагента. Значение 1 капли тогда соответствует 10 ппм.
4*10=40 ппм Са
__________
Возможности для экономии реагентов:
Для самых типичных измерений уровня Са для реминерализации осмоза, или расчетам по удобрениям, проба воды 10 мл уже достаточная. Тогда расход реагента 3 получается наименьшим и тогда из одного комплекта теста возможно сделать максимальное число анализов. В среднем можно сделать в 10 раз больше анализов, чем получается, тестируя соответственно оригинальной инструкции от производителя.
__________
Расчеты, конвертации и всякие другие полезности, исходя из измерений концентрации Са
Определение концентрации Mg, зная Са ппм и общую жесткость
dGH = Ca dGH + Mg dGH
Ca dGH = Ca ppm / 7.144
Mg dGH = Mg ppm / 4.356
Формулы, для расчетов, исходя из ппм по Са. (взяты от Едварда, оригинал можно прочитать в aquaticplantfertilizer/home/test-kits-and-testing при описании методов ППС (Perpetual Preservation SystemTM))
((17.86 x dGH) — (2.5 x Ca ppm)) / 4.1 = Mg ppm
(ppm dGH — (2.5 x Ca ppm)) /4.1 = Mg ppm
Формулы от Эдварда, в которых можно пользоваться числом каплей реагента в зависимости от выбранного объема пробы воды.
Тест на Са здесь упомянут от другой фирмы, но принцип по уменьшению шага для измерений тот же самый. Для JBL Са теста так же по инструкции значение 1 капли реагента 20 ппм и проба воды берется 5 мл.
Hagen Nutrafin, Ca test in 10 ml
((20 x GH drops) — (25 x Ca drops)) /4.1 = Mg ppm
Hagen Nutrafin, Ca test in 5 ml
((20 x GH drops) — (50 x Ca drops)) /4.1 = Mg ppm
Еще полезное (тоже от Едварда)
Пересчет на ппм эквивалент карбоната кальция
Ca ppm = Ca как CaCO3/ 2.5
How do I convert between GH ppm as CaCO3 and dGH?
dGH = GH ppm / 17.86
GH ppm = 17.86 x dGH
How do I convert between KH ppm as CaCO3 and dKH?
dKH = KH ppm / 17.86
KH ppm = 17.86 x dKH
How do I convert CaCO3 ppm equivalent to Ca and Mg ppm?
Example:
GH 80 ppm as CaCO3
Ca 64 ppm as CaCO3
Ca ppm = Ca as CaCO3 / 2.5
Ca ppm = 64 / 2.5
Ca ppm = 25.6
Mg ppm = (ppm GH as CaCO3 – ppm Ca as CaCO3) / 4.1
Mg ppm = (80 – 64) / 4.1
Mg ppm = 3.9
источник
Из всех элементов, кальций, один из самых известных и обсуждаемых. И это неудивительно, ведь его роль в организме трудно переоценить. Известно, что дефицит кальция, а также его переизбыток приводят к разного рода проблемам и заболеваниям.
К альций выполняет в организме человека очень много важных функций: регулирует свертываемость крови, участвует в процессах роста и деятельности клеток всех видов тканей в организме, участвует в процессах ощелачивания организма, обеспечивает прохождение электрических импульсов по нервным волокнам.
Кальций самый распространенный макроэлемент в организме человека, большая его часть содержится в скелете и зубах в виде фосфатов. В организме человека содержится 1,4-2 % Са3(РО4)2 и 13 % СаСО3.
В соответствии с общепринятыми рекомендациями, норма кальция в организме человека для взрослых составляет от 800 до 1200 миллиграмм. Для детей эта норма от 600 до 900 миллиграмм. Кальций вместе с фосфором составляет основу костной ткани, активизирует деятельность ряда важнейших ферментов, участвует в поддержании ионного равновесия в организме, влияет на процессы, происходящие в нервно-мышечной и сердечно-сосудистой системах, влияет на свертываемость крови.
Кальций также является важным элементом для поддержания рН на необходимом для всех систем и среды организма уровне. Например, рН крови — одна из самых жестких постоянных величин человеческого организма. В норме этот показатель составляет в пределах 7,4 (±0,02). Изменение этого показателя на 0,3 приводит к гибели человека.
Наибольшее количество кальция содержится в молоке, молочных продуктах (твороге, твердых сырах), яйцах, рыбе, в зеленых овощах, орехах. Один из источников кальция — это питьевая вода. С водой мы получаем от 10 до 30% суточной нормы кальция (в зависимости от жесткости и химического состава воды).
Одним из общеизвестных показателей качества и свойств воды является её жесткость, которая зависит от содержания в ней растворенных солей кальция и магния. Суммарное содержание этих солей определяет общую жесткость. Общая жесткость воды разделяется на карбонатную, обусловленную концентрацией гидрокарбонатов кальция и магния, и некарбонатную, определяемую концентрацией в воде кальциевых и магниевых солей сильных кислот. Жесткость воды формируется в результате растворения пород, содержащих кальций и магний. Обычно преобладает кальциевая жесткость, обусловленная растворением известняка и мела, однако в местах, где больше доломита, чем известняка, может преобладать и магниевая жесткость. В результате некоторых районах содержание кальция в воде может доходить до 300 мг/литр. Есть питьевые воды, которые продаются в магазинах, с содержанием кальция до 100 мг/литр. И здесь важно отметить, что 80% растворимого кальция мы получаем именно с водой. Таким образом, постоянное употребление воды с высоким содержанием кальция может привести к возникновению мочекаменной болезни и другим проблемам со здоровьем.
Выдержка из «Руководства по контролю качества питьевой воды». Всемирная Организация Здравоохранения (ВОЗ). Женева 1987 год
кальция в воде
с водой(%)
общее кальция поступление с пищей и водой: 1000 мг кальция в сутки
Типичный вклад воды в общее поступление кальция в организм составляет около 10-20 %.
Продолжительный дефицит кальция в ежедневном рационе приводит к судорогам, болям в суставах, остеопорозу, проблемам с ЖКТ, сердечно-сосудистой системой. Симптомами недостатка кальция является повышенная сонливость, раздражительность, ломкость ногтей, проблемы с кожей и зубами.
Как уже было отмечено, 80% растворенного кальция человек получает с питьевой водой. При этом, практически все жидкости в системе человеческого организма являются либо нейтральными, либо слабощелочными, за исключением желудочного сока: рН желудочного сока составляет — 1,0; здоровой крови — 7,43; здоровой лимфы — 7,5; слюны — 7,4. Повышение кислотности водной среды организма является одной из причин многих заболеваний. Появляются нарушения иммунной системы, плохо усваиваются витамины и микроэлементы, возникают заболевания сосудов, сердца, суставов, крови и многие другие патологические состояния организма. При этом организм постоянно ищет резерв щелочи для нейтрализации лишних кислот, т.к. кальций, помещенный в любую жидкость, нейтрализует избыточную кислотность. И резерв этот – костная ткань, зубы, суставы. В результате происходит «вымывание» кальция из костей, развивается остеопороз, появляются наросты, т.к. организм начинает строить кости из стронция.
По оценке специалистов Института Питания РАМН к 40 годам дефицит кальция наблюдается у 50% населения, к 60 годам у 90 %. Следует отметить, что при напряженной физической работе, усиленных тренировках, ограничении движений, чрезмерном употреблении кофе, энергетических напитков и алкоголя, также происходит интенсивное выведение солей кальция из организма.
Дефицит кальция может стать причиной более 100 заболеваний. Но избыток кальция в организме может вызвать гиперкальцемию (избыточное содержание кальция в крови) и вызвать нарушения в функционировании мышечных и нервных тканей, свертываемости крови, усвояемости цинка клетками костной ткани, вызывать появление камней в почках и другие проблемы.
Как говорится в руководстве по качеству питьевой воды ВОЗ «высокие концентрации минеральных веществ в воде увеличивают жидкостную нагрузку на почки, особенно сильно это проявляется у маленьких детей. Комитет по проблемам питания Немецкого Общества Педиатров настаивает, что потребители питьевой воды должны иметь ясное представление о концентрациях кальция и магния в питьевой воде, и ссылок на жесткость воды для этого недостаточно. Дети в конце периода грудного вскармливания, которые получают в основном детское питание на растительной основе и дети раннего возраста, употребляющие вегетарианскую пищу, могут получать значительное количество кальция и/или магния из питьевой воды».
Основными симптомами избытка кальция в организме являются снижение или потеря аппетита, появление тошноты, рвоты, жажды. Человек ощущает слабость, могут появиться ночные судороги. Появляются запоры, боли в низу живота. Если не устранить избыток кальция вовремя, возможны также нарушения функций головного мозга, приводящие к галлюцинациям, спутанности сознания и нарушениям сна.

Известный ученый, академик Одесской региональной академии наук, автор книг «Как родить здорового малыша», «Вода здоровья и долголетия», Н.Г. Друзьяк, долгое время занимался изучением факторов, определяющих долгожительство в определенных районах Евразии. В результате 20-летней работы он определил, что одной из главных причин долгожительства в Якутии, Абхазии, Дагестане, Нагорном Карабахе, а также в некоторых районах Северного Кавказа, в Нахичеване и в Лерикском районе Азербайджана, является местная природная вода с содержанием ионов кальция в пределах от 8 до 20 мг/л. Там, где содержание кальция в воде было меньше или больше указанного интервала, число долгожителей резко снижалось. О полезных свойствах воды с невысоким уровнем содержания кальция пишет также в своей книге «Вода – наместник Бога на Земле» Юрий Андреев. Об этом же говорит д.м.н., профессор и академик РАЕН Иван Павлович Неумывакин в книге «Вода − жизнь и здоровье. Мифы и реальность» и многие другие ученые и исследователи.
Таким образом, излишки, как и недостаток минералов, микро-макроэлементов, в том числе кальция, в воде могут привести к серьезным проблемам со здоровьем. Именно поэтому лучшим выбором является вода, обладающая сбалансированным минерально-солевым составом в пределах 150-350 мг/л с содержанием кальция 8-25 мг/л.
Физиологически полноценная питьевая вода
Физиологически полноценная питьевая вода — это вода, содержащая минеральные вещества, необходимые организму человека в строго определенных количествах. Санитарными нормами и правилами (СанПиН) определены жизненно важные элементы, содержание которых регламентировано (йод, фтор, кальций, магний, калий и др., всего более 100 показателей).
Аквалайн — физиологически полноценная питьевая вода ФППВ (47;78) для жителей Санкт-Петербурга и Ленинградской области – региональный эталон питьевой воды.
Физиологически полноценная питьевая вода «Аквалайн Природная Премиум» добывается в экологически безупречных местах Карельского перешейка на расстоянии 70 км от Санкт-Петербурга из артезианской скважины с глубины 170 метров. На такой глубине отсутствует патогенная бакофлора, вода проходит естественную минерализацию и фильтрацию и не требует дополнительной обработки. При производстве не нарушаются исходный баланс микроэлементов, структура и свойства воды. Розлив воды осуществляется непосредственно на источнике в автоматическом режиме по методу «непрерывной струи». Общий уровень минерализации воды «Аквалайн» — 150-350 мг/литр является оптимальным, в том числе по минерально-солевому составу и органолептическим свойствам для жителей Санкт-Петербурга и Ленинградской области. Такая вода несет пользу на молекулярном уровне, сохраняя естественный водный баланс организма и обеспечивая поступление необходимых ему минеральных веществ, микро и макронутриентов.
- В.А. Тутельян «Научные основы здорового питания»
- И.П. Неумывакин «Вода − жизнь и здоровье. Мифы и реальность»
- Ю. Андреев «Вода – наместник Бога на Земле»
- М. Ахманов «Вода, которую мы пьем»
- Рекомендации ВОЗ
источник
Сколько кальция должно быть в питьевой воде?
Н.Г. Друзьяк долгое время искал факторы, определяющие долгожительство в определенных районах Евразии. В ходе 20-летней работы, ему удалось вывести общую закономерность, а именно то, что главным фактором долгожительства в Якутии, Абхазии, Дагестане, Нагорном Карабахе, а также в некоторых районах Северного Кавказа, в Нахичеванской республике и в Лерикском районе Азербайджана, — во всех этих регионах главным фактором долгожительства является местная природная вода.
Но какие свойства природных вод в этих районах обеспечивают здоровье и долголетие? Первый толчок в поисках Друзьяку дало исследование, проведенное в Московском университете. Молодым мышам давали воду с различной минерализацией — от 50 до 500 мг/л. И оказалось, что лучше других росли мыши на воде с минерализацией 100 мг/л. И хотя интенсивность роста мышей нельзя напрямую связать с состоянием здоровья человека и продолжительностью его жизни, но казалось, что что-то в этом эксперименте все же просматривается.
Однако сама по себе минерализация воды ничего не прояснила. Была вода и с минерализацией около 100 мг/л, но значительно чаще она имела большую минерализацию. Например, сравним по минеральному составу воду на курорте Абастумани в Грузии, которая является общепризнанно целебной и воду из подземного источника «Золотой ключ» под Ашхабадом, у которой не отмечено особых целебных свойств.
Химический состав абастуманской воды из источника «Змеиный» (в мг/л):
Na — 13, Са — 12, НСO3 — 28, Сl — 92, SO4 — 132, а всего 396 мг/л.
Химический состав воды источника «Золотой ключ» (в мг/л):
Nа — 24, Са — 40, Мg — 18, НСО3 — 177, Сl — 24, SО4 — 47, а всего 330 мг/л.
И хотя вторая вода по общей минерализации близка абастуманской воде, и даже менее минерализована, но кальция в ней в три с лишним раза больше (40 мг/л против 12 мг/л), чем в них, а поэтому она и не проявила себя как лечебная. Таким образом, сведя воедино все данные, Н.Г. Друзьяк показал, что в Абхазии, в Дагестане, в Нагорном Карабахе, а в дальнейшем выяснилось, что и в Якутии, и в отдельных районах Северного Кавказа, и в Нахичеванской республике, в общем везде, где было много долгожителей, природная вода обладала одним общим признаком — она была мягкой, содержание ионов кальция в ней укладывалось в очень узкий интервал — от 8 до 20 мг/л. В местах, где кальция было более 20 мг/л, число долгожителей резко снижалось. Это обстоятельство говорит нам о том, что долгожительство — не феномен, а естественное свойство людей жить долго, возможно, до 120 — 150 лет, и только всевозможные неблагоприятные факторы укорачивают людям жизнь. Одним из таких факторов оказался кальций, а точнее, повышенное потребление кальция и с питьевой водой, и с продуктами питания.
Но как же быть с укоренившимся представлением о необходимости максимальной подпитки организма минеральными веществами? Нам всегда казалось, что минеральных веществ и витаминов мы постоянно недобираем. Конечно, при таком отношении к минеральным веществам сложно было заподозрить, что с тем же кальцием у нас уже давно перебор, ведь кальций — это скелетообразующий элемент и, следовательно, он нам очень необходим. Поэтому вопрос мог стоять только о беспрепятственном снабжении им организма в любых доступных количествах. А организму предоставлялось право взять необходимое и выбросить лишнее.
Но кальций оказался с сюрпризом. Если по активности он немного уступает калию и немного превосходит натрий, то по поведению его солей в организме он резко отличается от солей калия и натрия — его соли (большинство из них) труднорастворимы в воде. Например, если К2СO3 (поташ) имеет растворимость 113г в 100 мл воды, a Na2CO3 (кальцинированная сода) имеет растворимость 14,9г в 100 мл воды, то СаСO3 (накипь в чайнике и строительный материал — ракушечник), практически нерастворим в воде. Ионы калия и натрия легко проходят сквозь кожу вместе с потом, а ионы кальция задерживаются в коже, делая её сухой, жесткой и морщинистой. А при выведении кальция через почки в них могут откладываться камни, состоящие, в основном, из кальциевых солей.
То есть, переизбыток кальция в организме, как мы видим, вреден. И, несмотря на то, что кальций является скелетообразующим элементом, здоровье и крепость скелета (у жителей евразийского континента) зависит в первую очередь совсем не от кальция, а от магния. Именно магний определяет кальциевый обмен и усвояемость кальция. Как показал Н.Г. Друзьяк, если в крови не хватает магния, то кальций откладывается там, где ему не следует откладываться. Происходит, например, кальцинация клапанов сердца, крупных сосудов, и они становятся патологически хрупкими. Образуются склеротические бляшки на стенках крупных сосудов, повышается риск тромбообразования.
Как мы видим, переизбыток кальция негативно влияет на сердечно-сосудистую и мочеполовую систему. Неудивительно, что при таком отношении к кальцию: чем больше, тем лучше, — мы имеем такую высокую смертность от заболеваний сердечно-сосудистой системы.
Конечно, нельзя сказать, что подпитка организма кальцием не нужна. Кальций играет очень важную роль в организме. Он является постоянной составной частью крови, клеточных и тканевых соков, он входит в состав клеточного ядра, костного скелета. Многие физиологические процессы (передача нервных импульсов, свертывание крови, образование костной ткани, сокращение мышц и другое) осуществляются только при нормальном обмене кальция в организме. Особенно важное значение имеет кальций для формирования костей. Большая часть кальция организма сосредоточена в костях (99%) и лишь около 1% его находится в тканях и в крови.
Да, роль кальция в организме очень велика, но означает ли это, что чем больше его поступает в организм, тем последнему лучше? И сколько кальция нам необходимо?
Ответ на этот вопрос вроде бы давно известен: 1200 мг в сутки для детей и 800 мг для взрослых (медицинские нормы, которые согласно Н.Г.Друзьяку, завышены). Но взрослые чаще всего перебирают даже эту норму. Например, в Москве в среднем приходится по 300 л молока на человека в год, то есть около 820 мл в сутки. А один литр молока содержит 1200 мг кальция. То есть уже только с молоком человек потребляет более, чем суточную норму кальция.
Но ведь люди получают кальций не только с водой, но и с продуктами питания. На нашем Евроазиатском материке, который был когда-то морским дном, кальций содержится в большом количестве в почве, а значит, как следствие, в растениях, в мясе животных, в молочных продуктах, а также в овощах и фруктах, произрастающих на нашей почве.
Допустим, человек вдобавок пьет еще и жесткую воду, содержащую, например, 70 мг/л кальция. В сутки человек потребляет 2 — 2,5 литра воды, что добавляет ему еще 140 — 180 мг кальция. И, заметьте, эти миллиграммы сразу же попадают в кровь, всасываясь с водой через стенки желудка. И как следствие, кальциевые отложения образуются в сосудах и на сердечных клапанах, о чем уже было сказано несколькими абзацами выше. Далее, если учесть еще и продукты питания, то в итоге суммарное потребление может составить почти двойную норму, из которой, повторимся, часть идет непосредственно в кровь.
Значит, уменьшить содержание кальция в крови можно, перейдя на воду с низким содержанием кальция или вообще бескальциевую воду. К тому же, районы долгожительства убедительно говорят нам о том, что для нашего здоровья и долголетия приемлема питьевая вода только с низким содержанием кальция. И ниже будут приведены дополнительные аргументы в пользу этого взгляда.
К сожалению, ни в одном источнике не говорится о последствиях постоянного превышения нормы потребления кальция, хотя и сама норма, вероятно, тоже значительно завышена. Более того, эта норма определялась не по физиологическим потребностям организма, а как нечто среднестатистическое по фактическому потреблению в определенном регионе. Такая же высокая норма и в Европе, и в Северной Америке, где 70 — 90% кальция население получает с молочными продуктами. А в Италии и в Аргентине нормой считают 650 мг кальция в сутки на взрослого человека. И здесь с молочными продуктами поступает от 50 до 70% кальция. А в Японии, Индии, Чили, ЮАР и Турции нормой считается 300 — 350 мг кальция в сутки, причем молочных продуктов у них почти нет, а весь потребляемый кальций идет со злаками, овощами, плодами и мясом. У народов последних стран очень низкий уровень вывода из организма неиспользованного кальция. Возможно, что уровень потребления кальция у этих народов лишь незначительно ниже необходимой нормы по кальцию, которая согласуется с физиологическими потребностями организма человека (по Н.Г. Друзьяку, физиологические потребности в кальции составляют около 400 мг в сутки). А в тех странах, где уровень потребления кальция очень высок, да еще и постоянно поощряется его высокое потребление, у людей наблюдается высокий уровень кальция в крови и в связи с этим происходит высокий вывод из организма неиспользованного кальция.
Научно подтвержден следующий факт: содержание кальция в сыворотке крови обычного человека достигает 8,5 — 12 мг в 100 г крови, а у людей в районах долгожительства только до 5 мг. Понижение содержания кальция в крови сопровождается понижением возбудимости центральной нервной системы. И наоборот, одной из причин высокой возбудимости и несдержанности некоторых людей может быть высокий уровень кальция у них в крови. Например, жители Санкт-Петербурга пьют воду из Невы, в которой содержится 8 мг/л ионов кальция, а одесситы пьют воду из Днестра, в которой содержится в 8 раз больше ионов кальция. Не потому ли петербуржцы очень спокойны, а одесситы чрезмерно возбудимы?
Исследованиями в Абхазии (Норакидзе, Бахтадзе, 1982) выяснилось, что почти для всех долгожителей характерна ограниченность социальной сферы ценностей и деятельности той микросредой, в которой они живут (семья, соседи). Большая часть долгожителей контактна, их отличает преобладающий интерес к внешним объектам, культ природы и предков. По темпераменту они, скорее, сангвиники (живость и легкая сменяемость эмоций), их переживания носят более поверхностный характер. Это большей частью склонные к удовольствиям, приспособленные к своей микросреде люди.
Теперь мы видим, что одно из условий долголетия, а именно здоровые нервы и хороший характер, на поверку является всего лишь следствием низкого уровня кальция в крови долгожителей, который обеспечивается природной водой в районах их проживания.
По мнению некоторых исследователей, повышенная сексуальность и раннее половое созревание не способствуют продлению жизни. А это связано, как правило, с повышенным уровнем кальция в крови. При пониженном же содержании кальция в крови наблюдается более позднее созревание, нормальная, но не повышенная сексуальность, и длительное сохранение репродуктивной функции.
Как часто приходится читать и слышать, что нам полезны продукты, богатые кальцием. То же самое иногда говорится и о питьевой воде. Можно назвать много книг, авторы которых призывают нас увеличивать потребление кальция. Создается впечатление, что мы постоянно испытываем дефицит в этом элементе. Нет, конечно же, нет — почти повседневно он поступает в избытке в наш организм. Но почему сложилась такая озабоченность — на это трудно ответить. Поводом для этого послужили, по-видимому, некоторые болезни, как, например, рахит, остеопороз, кариес и другие, причину которых видят в недостаточном поступлении кальция в организм, тогда как на самом деле эти болезни возникают в результате дефицита других пищевых веществ. И поэтому главной нашей заботой в дальнейшем должно быть не бесперебойное снабжение организма кальцием, а наоборот, всемерное ограничение его поступления в организм, что сделать намного труднее, чем первое действие, так как мы живем в регионе с повышенным содержанием кальция и в природных водах, и в продуктах питания.
Именно поэтому Николинская вода практически не содержит кальция (1 — 2 мг/л).
источник
Химический анализ природной и питьевой воды. Метод ионообменной хроматографии и титриметрический метод определения ионов кальция и магния. Особенности приготовления растворов. Устранение мешающего влияния катионов железа, марганца, цинка, меди и олова.
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Методика определения ионов кальция и магния в природных водах (определение общей жесткости воды)
2. Приготовление растворов
3.1 Титриметрический метод
3.2 Метод ионообменной хроматографии
Химический анализ природной и питьевой воды показывает, что любая вода представляет собой не чистое вещество с формулой Н2О, а смесь большого количества веществ.
Многочисленные анализы природных вод показали, что среди большого числа компонентов, растворенных в них, 90 % солесодержания составляют карбонаты, гидрокарбонаты, хлориды и сульфаты кальция, магния и натрия. О.А. Алекиным предложена классификация природных вод по результатам их химического анализа. По преобладающему аниону воды делятся на три класса: карбонатные (гидрокарбонатные), хлоридные и сульфатные. По преобладающему катиону воды делятся на три группы: кальциевые, магниевые и натриевые.
В природных водах постоянно находятся ионы кальция и магния, обеспечивающие жесткость воды. Источник их поступления в воду — растворение гипса, известняков и доломитов, входящих в состав горных пород. В санитарно-гигиеническом отношении ионы кальция и магния не представляют большой опасности, но чрезмерная жесткость воды делает ее непригодной для бытовых целей, т.к. образующаяся накипь выводит из строя нагревательные элементы электрических систем нагрева воды. Оптимальная жесткость воды — до 7 мг-экв/л.
Для определения ионов кальция и магния используются два метода:
2. метод ионообменной хроматографии
1. Наиболее точный и распространенный метод определения общей жесткости — комплексометрический, основанный на образовании ионами Са 2+ и Mg 2+ прочных внутрикомплексных соединений с трилоном Б. В качестве индикатора при определении общей жесткости используется эриохром черный. В зависимости от общей жесткости концентрация рабочего раствора трилона Б и объем пробы воды могут быть различными.
Для определения кальция в природных водах преимущественно используются трилонометрический метод с индикатором мурексидом.
Содержание магния проводят расчетным методом, зная общую жесткость и содержание кальция.
2. Приготовление растворов
Раствор трилона Б с концентрацией 0,02 моль/дм 3 эквивалента.
Навеску 3,72г. трилона Б растворяют в 1 дм 3 дистиллированной воды. Точную концентрацию устанавливают по стандартному раствору хлорида цинка. Раствор хранят в полиэтиленовой посуде, проверяют его концентрацию не реже 1 раза в месяц.
Раствор хлорида цинка с концентрацией 0,02 моль/ дм 3 эквивалента.
Отвешивают на технических весах около 0,35 г металлического цинка, смачивают его небольшим количеством концентрированной соляной кислоты и сейчас же промывают дистиллированной водой. Цинк сушат в сушильном шкафу при 105 течение 1ч, затем охлаждают и взвешивают на аналитических весах.
Навеску цинка помещают в мерную колбу вместимостью 500 см 3 , в которую предварительно вносят 10-15 см 3 дистиллированной воды и 1,5 см 3 концентрированной соляной кислоты. Цинк растворяют. После растворения цинка объём раствора доводят до метки на колбе дистиллированной водой. Рассчитывают молярную концентрацию эквивалента раствора хлорида цинка CZn(1/2 ZnCl2), моль/дм 3 , по формуле:
где m — навеска металлического цинка, г; 32,69 — молярная масса эквивалента Zn 2+ , г/моль; V — объём мерной колбы, см 3 .
Буферный раствор NH4Cl +NH4OH.
7,0 г хлорида аммония растворяют в мерной колбе вместимостью 500 см 3 в 100 см 3 дистиллированной воды и добавляют 75 см 3 концентрированного раствора аммиака. Объем раствора доводят до метки дистиллированной водой и тщательно перемешивают. Буферный раствор хранят в стеклянной или полиэтиленовой посуде не более 2 месяцев. Гидроксид натрия, 2 моль/дм 3 .
40 г гидроксида натрия растворяют в мерной колбе вместимостью 500 см 3 и раствор доводят до метки дистиллированной водой.
Индикатор эриохром черный Т.
Растереть в ступке 0,25 г эриохрома черного Т с 50 г хлорида натрия.
0,5 г мурексида растереть с 100 г хлорида натрия. Водный раствор лучше не готовить, т.к. мурексид нестоек в растворе.
Раствор сульфида натрия, 4%.
2 г сульфида натрия растворяют в 50 см 3 дистиллированной воды. Хранят в плотной закрытой полиэтиленовой посуде не более недели.
Раствор гидрохлорида гидроксиламина.
5 г гидрохлорида гидроксиламина растворяют в 100 см 3 дистиллированной воды. Хранят не более 2 месяцев.
Установление точной концентрации раствора трилона Б.
В коническую колбу вместимостью 250 см 3 вносят 10 см 3 раствора хлорида цинка, добавляют дистиллированной воды приблизительно до 100 см 3 , 5 см 3 буферного раствора и 10-15 мг индикатора эриохрома чёрного Т. Содержимое конической колбы тщательно перемешивают и титруют из бюретки раствором трилона Б до перехода окраски красной в голубую. Концентрацию раствора трилона Б рассчитывают по формуле:
3.1 Титриметрический метод
Определение ионов кальция и магния
Устранение мешающих ионов
Для устранения мешающего влияния катионов железа, цинка, меди и олова в пробу добавляют 0,5 мл раствора сульфида натрия.
Для устранения мешающего влияния марганца в пробу добавляют 0,5 мл солянокислого раствора гидроксиламина.
Перед выполнением анализа пробы воды с неизвестной величиной жёсткости проводят оценочное титрование. Для этого берут 10 см 3 воды, добавляют 0,5 см 3 буферного раствора, индикатор (эриохром чёрный Т) и титруют до перехода окраски из красной в голубую. По величине израсходованного трилона Б выбирают из таблицы 1 соответствующий объём пробы воды.
ионообменный хроматография вода магний
Таблица 1. Объём пробы воды, рекомендуемый для определения жёсткости по результатам оценочного титрования
Объём израсходованного раствора трилона Б, см 3
Рекомендуемый объём пробы, см 3
v Определение суммы кальция и магния
К пробе необходимого объёма (см. Оценочное титрование) 100 см 3 добавляют 5 см 3 буфера, индикатор (эриохром чёрный Т) на шпателе. Сразу же титруют при перемешивании до перехода окраски от винно-красной к синей.
К пробе необходимого объёма (см. Оценочное титрование) 100 см 3 добавляют 2 см 3 NaOH (2н) и индикатора (мурексид) на шпателе. Титруют до перехода окраски от красной в фиолетовую. Окраску раствора следует сравнивать с цветом перетитрованного раствора.
Содержание кальция высчитывают по формуле:
где Стр — молярная концентрация эквивалента трилона Б, моль/дм 3 ; V’ тр — объем трилона Б, пошедший на титрование с мурексидом, см 3 (см. Определение кальция); 20,04 — масса эквивалента Ca 2+ ; Vпробы — объем пробы, взятый для анализа, см 3 .
Содержание магния высчитывают по формуле:
где Стр — молярная концентрация эквивалента трилона Б, моль/дм 3 ; V тр — объем трилона Б, пошедший на титрование с эриохромом черным Т, см 3 (см. Определение суммы кальция и магния); V’тр — объем трилона Б, пошедший на титрование с мурексидом, см 3 (см. Определение кальция); 12,15- масса эквивалента Mg 2+ ; Vпробы- объем пробы, взятый для анализа, см 3 .
v Определение общей жесткости воды
Общую жесткость находят по формуле:
где Стр — молярная концентрация эквивалента трилона Б, моль/дм 3 ; Vтр — объем раствора трилона Б, пошедшего на титрование пробы, см 3 ; Vпробы — объем пробы, взятый для анализа, см 3 .
Метод добавок. Для определения данным методом в пробу вводят добавку, равную 50-150% (желательно 100%) жёсткости воды (см. Определение общей жёсткости воды) ГСО 8206-2002.
Затем высчитывают общую жесткость воды с добавкой.
a. Результаты измерений, полученных в условиях воспроизводимости для пробы 1.
Проба 1: оз. Среднее, с. Озёрное, 85 км от берега, дата: 1.10.13, время: 16.55, t = +3.
Установлена точная концентрация трилона Б: Стрилона = 0,002226 (моль/дм 3 ). При выполнении оценочного титрования объем необходимой пробы соответствует 100 (мл).
источник
1.1 Настоящий руководящий документ устанавливает методику выполнения измерений (далее — методика) массовой концентрации кальция в пробах природных и очищенных сточных вод титриметрическим методом в диапазоне от 1,0 до 200,0 мг/дм 3 .
При анализе проб воды с массовой концентрацией кальция, превышающей 200 мг/дм 3 , допускается выполнение измерений после соответствующего разбавления пробы дистиллированной водой.
1.2 Настоящий руководящий документ предназначен для использования в лабораториях, осуществляющих анализ природных и очищенных сточных вод.
В настоящем руководящем документе использованы ссылки на следующие нормативные документы:
ГОСТ 12.1.005-88 ССБТ. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 ССБТ. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 17.1.5.04-81 Охрана природы. Гидросфера. Приборы и устройства для отбора, первичной обработки и хранения проб природных вод. Общие технические условия
ГОСТ 17.1.5.05-85 Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков
ГОСТ Р ИСО 5725-6-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике
ГОСТ Р 51592-2000 Вода. Общие требования к отбору проб
МИ 2881-2004 Рекомендация. ГСИ. Методики количественного химического анализа. Процедуры проверки приемлемости результатов анализа.
Примечание : Ссылки на остальные нормативные документы приведены в разделах 4, В.3 и В.4.
3.1 При соблюдении всех регламентируемых методикой условий проведения измерений характеристики погрешности результата измерения с вероятностью 0,95 не должны превышать значений, приведенных в таблице 1.
Таблица 2 — Диапазон измерений, значения характеристик погрешности и ее составляющих (Р = 0,95)
Показатель повторяемости (среднеквадратическое отклонение повторяемости) s г, мг/дм 3
Показатель воспроизводимости (среднеквадратическое отклонение воспроизводимости) s R, мг/дм 3
Показатель правильности (границы систематической погрешности при вероятности Р = 0,95) ± D с, мг/дм 3
Показатель точности (границы погрешности при вероятности Р = 0,95) ± D , мг/дм 3
При выполнении измерений в пробах с массовой концентрацией кальция свыше 200 мг/дм 3 после соответствующего разбавления погрешность измерения не превышает величины D ×h , где D — погрешность измерения концентрации кальция в разбавленной пробе; h — степень разбавления.
Предел обнаружения кальция 0,6 мг/дм 3 .
Значения показателя точности методики используют при:
— оформлении результатов измерений, выдаваемых лабораторией;
— оценке деятельности лабораторий на качество проведения измерений;
— оценке возможности использования результатов измерений при реализации методики в конкретной лаборатории.
При выполнении измерений применяют следующие средства измерений и другие технические средства:
4.1.1 Весы лабораторные высокого (II ) класса точности по ГОСТ 24104-2001.
4.1.2 Весы лабораторные среднего (III ) класса точности по ГОСТ 24104-2001 с пределом взвешивания 200 г.
4.1.3 Государственный стандартный образец состава водного раствора кальция ГСО 8065-95 (далее — ГСО).
4.1.4 Колбы мерные 2 класса точности исполнения 2, 2а по ГОСТ 1770-74 вместимостью: 250 см 3 — 4 шт.
4.1.5 Пипетки градуированные 2 класса точности исполнения 1, 2 по ГОСТ 29227-91 вместимостью: 1 см 3 — 5 шт.
4.1.6 Пипетки с одной отметкой 2 класса точности исполнения 2 по ГОСТ 29169-91 вместимостью: 10 см 3 — 2 шт.
4.1.7 Бюретки 2 класса точности исполнения 1, 3 по ГОСТ 29251-91 вместимостью:
4.1.8 Цилиндры мерные исполнения 1, 3 по ГОСТ 1770-74 вместимостью:
4.1.9 Пробирки конические исполнения 1 по ГОСТ 1770-74 вместимостью
4.1.10 Колбы конические Кн исполнения 2, ТХС, по ГОСТ 25336-82 вместимостью
4.1.11 Стаканы В-1, ТХС по ГОСТ 25336-82 вместимостью:
4.1.12 Стакан полипропиленовый 250 см 3 — 1 шт.
4.1.13 Воронки лабораторные по ГОСТ 25336-82 диаметром:
4.1.14 Стаканчики для взвешивания (бюксы) по ГОСТ 25336-82:
4.1.15 Ступка № 3 или 4 по ГОСТ 9147-80 — 1 шт.
4.1.16 Колонка хроматографическая диаметром 1,5 — 2,0 см и
4.1.17 Стекло часовое — 1 шт.
4.1.18 Палочки стеклянные — 2 шт.
4.1.19 Склянки для хранения проб и растворов из светлого и темного стекла с завинчивающимися или притертыми пробками вместимостью 100 см 3 , 250 см 3 , 500 см 3 , 1000 см 3 .
4.1.20 Посуда полиэтиленовая (полипропиленовая) для хранения проб и растворов вместимостью 100 см 3 , 250 см 3 , 500 см 3 , 1000 см 3 .
4.1.22 Шкаф сушильный общелабораторного назначения.
4.1.23 Электроплитка с закрытой спиралью по ГОСТ 14919-83.
4.1.24 Устройство для фильтрования проб с использованием мембранных или бумажных фильтров.
Допускается использование других типов средств измерений, посуды и вспомогательного оборудования, в том числе импортных, с характеристиками не хуже, чем у приведенных в 4.1.
При выполнении измерений применяют следующие реактивы и материалы:
4.2.1 Кальций углекислый (карбонат кальция) по ГОСТ 4530-76, х.ч.
4.2.2 Соль динатриевая этилендиамин -N ,N ,N,N-тетрауксусной кислоты 2-водная (трилон Б) по ГОСТ 10652-73, ч.д.а.
4.2.3 Цинк гранулированный по ТУ 6-09-5294-86, ч.д.а.
4.2.4 Аммоний хлористый (хлорид аммония) по ГОСТ 3773-72, ч.д.а.
4.2.5 Аммиак водный по ГОСТ 3760-79, ч.д.а.
4.2.6 Натрий хлористый (хлорид натрия) по ГОСТ 4233-77, ч.д.а.
4.2.7 Натрия гидроокись (гидроксид натрия) по ГОСТ 4328-77, ч.д.а.
4.2.8 Натрий сернистый 9-водный (сульфид натрия) по ГОСТ 2053-77, ч.д.а., или натрия N ,N -диэтилдитиокарбамат 3-водный (диэтилдитиокарбамат натрия) по ГОСТ 8864-71, ч.д.а.
4.2.9 Кислота соляная по ГОСТ 3118-77, ч.д.а.
4.2.10 Пурпурат аммония (мурексид) по ТУ 6-09-1657-72, ч.д.а.
4.2.11 Нафтоловый зеленый Б.
4.2.12 Эриохром черный Т (хромоген черный ЕТ).
4.2.13 Гидроксиламина гидрохлорид по ГОСТ 5456-79, ч.д.а.
4.2.15 Квасцы алюмокалиевые по ГОСТ 4329-77, ч.д.а.
4.2.16 Барий хлорид 2-водный (хлорид бария) по ГОСТ 4108-72, ч.д.а.
4.2.17 Вода дистиллированная по ГОСТ 6709-72.
4.2.17 Универсальная индикаторная бумага (рН 1-10) по ТУ 6-09-1181-76.
4.2.18 Фильтры мембранные «Владипор МФАС-ОС-2», 0,45 мкм, по ТУ 6-55-221-1-29-89 или другого типа, равноценные, по характеристикам или фильтры бумажные обеззоленные «синяя лента» по ТУ 6-09-1678-86.
4.2.19 Фильтры бумажные обеззоленные «белая лента» по ТУ 6-09-1678-86.
Допускается использование реактивов, изготовленных по другой нормативно-технической документации, в том числе импортных, с квалификацией не ниже указанной в 4.2.
Выполнение измерений основано на способности ионов кальция образовывать с трилоном Б малодиссоциированное, устойчивое в щелочной среде соединение. Конечная точка титрования определяется по изменению окраски индикатора (мурексида) из розовой в красно-фиолетовую. Для увеличения четкости перехода окраски предпочтительнее использовать смешанный индикатор (мурексид + нафтоловый зелёный Б). При этом в конечной точке титрования окраска изменяется от грязно-зеленой до синей.
Магний в условиях анализа осаждается в виде гидроксида и не мешает определению.
6.1 При выполнении измерений массовой концентрации кальция в пробах природных и очищенных сточных вод соблюдают требования безопасности, установленные в национальных стандартах и соответствующих нормативных документах.
6.2 По степени воздействия на организм вредные вещества, используемые при выполнении измерений, относятся ко 2, 3 классам опасности по ГОСТ 12.1.007.
6.3 Содержание используемых вредных веществ в воздухе рабочей зоны не должно превышать установленных ПДК в соответствии с ГОСТ 12.1.005.
6.4 Дополнительных требований по экологической безопасности не предъявляется.
К выполнению измерений и обработке их результатов допускаются лица со средним профессиональным образованием или без профессионального образования, но имеющие стаж работы в лаборатории не менее года и освоившие методику.
При выполнении измерений в лаборатории должны быть соблюдены следующие условия:
— температура окружающего воздуха (22 ± 5) °С;
— атмосферное давление от 84,0 до 106,7 кПа (от 630 до 800 мм рт. ст.);
— влажность воздуха не более 80 % при 25 °С;
— напряжение в сети (220 ± 10) В;
— частота переменного тока в сети питания (50 ± 1) Гц.
Отбор проб для выполнения измерений массовой концентрации кальция производится в соответствии с ГОСТ 17.1.5.05 и ГОСТ Р 51592. Оборудование для отбора проб должно соответствовать ГОСТ 17.1.5.04 и ГОСТ Р 51592. Мутные пробы фильтруют через мембранный фильтр 0,45 мкм или бумажный фильтр «синяя лента». Первую порцию фильтрата следует отбросить. Пробы хранят в стеклянной или полиэтиленовой посуде не более 6 мес.
10.1 Приготовление растворов и реактивов
10.1.1 Раствор трилона Б с молярной концентрацией 0,02 моль/дм 3 количества вещества эквивалента (далее — КВЭ).
Растворяют 3,72 г трилона Б в 1 дм 3 дистиллированной воды. Точную концентрацию раствора устанавливают по раствору хлорида цинка в соответствии с 10.2 не реже 1 раза в месяц.
Раствор хранят в плотно закрытой посуде.
Отвешивают около 0,35 г металлического цинка, смачивают его небольшим количеством концентрированной соляной кислоты и сейчас же промывают дистиллированной водой. Цинк сушат в сушильном шкафу при температуре 105 °С в течение 1 ч, затем охлаждают и взвешивают на лабораторных весах с точностью до четвертого знака после запятой.
Навеску цинка количественно переносят в мерную колбу вместимостью 500 см 3 , в которую предварительно вносят 10 — 15 см 3 бидистиллированной воды и 1,5 см 3 концентрированной соляной кислоты. Цинк растворяют. После растворения объем раствора доводят до метки на колбе дистиллированной водой и перемешивают.
Рассчитывают молярную концентрацию хлорида цинка С Zn , моль/дм 3 КВЭ, в полученном растворе по формуле
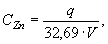
где q — навеска металлического цинка, г;
32,69 — молярная масса эквивалента цинка (1/2 Zn 2+ ), г/моль;
V — вместимость мерной колбы, дм 3 .
При расчете значение С Zn округляют таким образом, чтобы оно содержало 4 значащих цифры.
10.1.3 Аммонийно-аммиачный буферный раствор
В мерной колбе вместимостью 500 см 3 растворяют в 100 см 3 дистиллированной воды 7,0 г хлорида аммония и добавляют 75 см 3 концентрированного раствора аммиака. Объем раствора доводят до метки на колбе дистиллированной водой и тщательно перемешивают. Буферный раствор хранят в полиэтиленовой посуде не более 2 мес.
10.1.4 Индикатор эриохром черный Т
В ступке с 50 г хлорида натрия тщательно растирают 0,5 г эриохрома черного Т. Хранят в склянке из темного стекла не более 6 мес.
В ступке со 100 г хлорида натрия тщательно растирают 0,2 г мурексида. Хранят в склянке из темного стекла не более 6 мес.
В ступке со 100 г хлорида натрия тщательно растирают 0,2 г мурексида и 0,4 г нафтолового зеленого Б. Хранят в склянке из темного стекла не более 6 мес.
10.1.7 Раствор нафтолового зеленого Б, 0,8 %-ный
В 50 см 3 дистиллированной воды растворяют 0,4 г нафтолового зеленого Б. Раствор хранят в темной склянке в течение 3 мес.
К 5 см 3 0,8 %-ного раствора нафтолового зеленого Б добавляют 45 см 3 дистиллированной воды и перемешивают. Раствор хранят не более 3 дней.
10.1.9 Раствор гидроксида натрия, 20 %-ный
Растворяют 20 г гидроксида натрия в 80 см 3 дистиллированной воды.
10.1.10 Раствор гидроксида натрия, 8 %-ный
Растворяют 40 г гидроксида натрия в 460 см 3 дистиллированной воды.
10.1.11 Раствор гидроксида натрия, 0,4 %-ный
Растворяют 2 г гидроксида натрия в 500 см 3 дистиллированной воды.
Растворы гидроксида натрия устойчивы при хранении в плотно закрытой полиэтиленовой посуде.
10.1.12 Раствор сульфида натрия
В 50 см 3 дистиллированной воды растворяют 2 г сульфида натрия. Хранят в плотно закрытой полиэтиленовой посуде в холодильнике не более недели.
10.1.13 Раствор диэтилдитиокарбамата натрия
В 50 см 3 дистиллированной воды растворяют 5 г диэтилдитиокарбамата натрия. Хранят не более 2 недель в холодильнике.
10.1.14 Раствор гидрохлорида гидроксиламина
В 100 см 3 дистиллированной воды растворяют 5 г гидрохлорида гидроксиламина. Хранят в плотно закрытой темной склянке в холодильнике в течение месяца.
10.1.15 Раствор соляной кислоты, 1:3
Смешивают 200 см 3 концентрированной соляной кислоты с 600 см 3 дистиллированной воды.
Подготовка активного угля приведена в приложении А.
10.1.17 Суспензия гидроксида алюминия
Приготовление суспензии гидроксида алюминия приведено в приложении Б.
В коническую колбу вместимостью 250 см 3 с помощью пипетки с одной отметкой вносят 10,0 см 3 раствора хлорида цинка (10.1.2), добавляют 90 см 3 дистиллированной воды, 5 см 3 аммонийно-аммиачного буферного раствора и 70 — 100 мг индикатора эриохрома черного Т. Содержимое колбы тщательно перемешивают и титруют из бюретки вместимостью 25 см 3 раствором трилона Б до перехода окраски из фиолетово-красной в голубую (синюю).
Молярную концентрацию раствора трилона Б СТр, моль/дм 3 КВЭ, рассчитывают по формуле
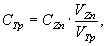
где С Zn — молярная концентрация раствора хлорида цинка, моль/дм 3 КВЭ;
VZn — объем раствора хлорида цинка, см 3 .
VZn — объем раствора трилона Б, пошедший на титрование, см 3 .
11.1 Выбор условий титрования
Объём аликвоты пробы воды для выполнения измерений массовой концентрации кальция выбирают исходя из известной величины жёсткости воды или по результатам оценочного титрования.
Для оценочного титрования отбирают 10 см 3 воды, добавляют 0,2 см 3 8 %-ного раствора гидроксида натрия, 20 — 30 мг индикатора мурексида и титруют раствором трилона Б до перехода окраски из розовой в красно-фиолетовую. По величине израсходованного на титрование объёма раствора трилона Б выбирают из таблицы 2 соответствующий объем аликвоты пробы воды для выполнения измерений массовой концентрации кальция.
Таблица 2 — Объём пробы воды, рекомендуемый для выполнения измерений массовой концентрации кальция
Объем раствора трилона Б, израсходованный при оценочном титровании, см 3
Рекомендуемый объем аликвоты пробы воды, см 3
В зависимости от концентрации кальция титрование следует проводить из бюретки подходящей вместимости. Если по результатам оценочного титрования объем трилона Б менее 0,4 см 3 или величина жесткости менее 1 ммоль/дм 3 КВЭ, используют бюретку вместимостью 5 см 3 ; при объеме трилона менее 0,8 см 3 или величине жесткости от 1 до 2 ммоль/дм 3 КВЭ — бюретку вместимостью 10 см 3 ; при более высокой концентрации кальция или величины жесткости — бюретку вместимостью 25 см 3 . При отсутствии бюретки вместимостью 10 см 3 можно использовать бюретку вместимостью 25 см 3 ; допускается замена бюретки вместимостью 5 см 3 бюреткой вместимостью 10 см 3 , однако замена микробюретки вместимостью 5 см 3 бюреткой вместимостью 25 см 3 недопустима.
11.2.1 В коническую колбу вместимостью 250 см 3 отмеривают пипеткой требуемый объем аликвоты пробы, доводят, если необходимо, до 100 см 3 дистиллированной водой, добавляют 2 см 3 8 %-ного раствора гидроксида натрия, 0,2 — 0,3 г индикатора мурексида (см. 10.1.5 ) или смешанного индикатора (см. 10.1.6 ) и титруют раствором трилона Б до перехода окраски из розовой в красно-фиолетовую при использовании мурексида или из грязно-зелёной в синюю при титровании со смешанным индикатором. Повторяют титрование и, если расхождение объемов трилона Б между параллельными титрованиями не превышает приведенных в таблице 3 , за результат принимают среднее значение объёма трилона Б. В противном случае повторяют титрование до получения допустимого расхождения результатов.
11.2.2 Если в период хранения в пробе выпал осадок карбоната кальция, непосредственно перед выполнением измерений прозрачную часть пробы декантируют (или сливают посредством сифона) в чистую сухую колбу. Оставшийся в склянке осадок растворяют, добавив 0,5 — 1 см 3 концентрированной соляной кислоты. Затем прозрачную часть пробы и жидкость с растворенным осадком соединяют вместе и нейтрализуют 20 %-ным раствором гидроксида натрия, добавляя его по каплям и контролируя рН по индикаторной бумаге. Далее отбирают аликвоту полученного раствора и проводят титрование.
Таблица 3 — Допустимые расхождения между параллельными титрованиями в зависимости от объема раствора трилона Б
Допустимое расхождение объемов трилона Б, см 3
11.2.3 Для получения достаточно четкого перехода окраски при титровании со смешанным индикатором важно соотношение мурексида и нафтолового зеленого в смеси. Для разных партий индикаторов это соотношение может быть разным. Если при использовании сухого смешанного индикатора не удается получить четкий переход окраски в конечной точке титрования, следует использовать нафтоловый зеленый в виде 0,08 %-ного раствора (см. 10.1.8). Титрование проводят следующим образом. Отбирают аликвоту воды в коническую колбу, добавляют 2 см 3 8 %-ного раствора гидроксида натрия, 0,2 — 0,3 г индикатора мурексида (см. 10.1.5), перемешивают и приливают раствор нафтолового зеленого Б до тех пор, пока раствор приобретет грязно-зеленую окраску (всего идет примерно 0,9 — 1,2 см 3 раствора). После этого титруют пробу в соответствии с 11.2.1.
11.3 Устранение мешающих влияний
11.3.1 Выполнению измерений массовой концентрации кальция мешают ионы железа (больше 10 мг/дм 3 ), кобальта, никеля (больше 0,1 мг/дм 3 ), алюминия (больше 10 мг/дм 3 ), меди (> 0,05 мг/дм 3 ), вызывая нечеткое изменение окраски в точке эквивалентности, либо полностью исключая возможность индикации конечной точки титрования.
Другие катионы, например, свинец, кадмий, марганец ( II ), цинк, стронций, барий при высоких концентрациях (как правило не встречающихся в природных водах) могут частично титроваться вместе с кальцием и магнием и повышать расход трилона Б. Для устранения или уменьшения мешающего влияния катионов металлов к пробе перед титрованием прибавляют 0,5 см 3 раствора сульфида или диэтилдитиокарбамата натрия и 0,5 см 3 раствора гидрохлорида гидроксиламина.
11.3.2 Результаты титрования могут быть искажены в присутствии значительных количеств анионов (НСО3 — , СО3 — , РО4 — , SiО3 2- ). Для уменьшения их влияния пробу следует титровать сразу после добавления гидроксида натрия и индикатора.
11.3.3 Мешающее влияние взвешенных веществ устраняется фильтрованием пробы.
11.3.4 Если проба воды заметно окрашена за счёт присутствия веществ природного или антропогенного происхождения, затрудняется фиксация конечной точки титрования. В этом случае пробу перед выполнением измерений следует пропустить со скоростью 3 — 5 см 3 /мин через хроматографическую колонку, заполненную активным углем (высота слоя 15 — 20 см). Первые 25 — 30 см 3 пробы, прошедшей через колонку, отбрасывают.
Как правило, окрашенные соединения антропогенного происхождения сорбируются активным углем практически полностью, в то время как природного (гумусовые вещества) — лишь частично. При неустраняемой активным углем цветности пробы, обусловленной гумусовыми веществами, определение конечной точки титрования значительно облегчается использованием для сравнения слегка перетитрованной пробы этой же воды (пробы-свидетеля).
Осадок в стакане и фильтр промывают 2 — 3 раза небольшими порциями дистиллированной воды, собирая промывные воды в ту же колбу. После этого доводят раствор в колбе до метки, перемешивают, отбирают из колбы необходимую аликвоту и титруют ее в соответствии с 11.2.
11.3.6 При достаточно высокой концентрации кальция устранить мешающие влияния можно разбавлением пробы дистиллированной водой.
12 Вычисление и оформление результатов измерений
12.1 Массовую X, мг/дм 3 , и молярную Хм, ммоль/дм 3 КВЭ, концентрацию кальция в анализируемой пробе воды находят по формулам
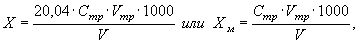
где 20,04 — масса моля КВЭ кальция (1/2 Са 2+ ), г/моль;
С mр — молярная концентрация раствора трилона Б, моль/дм 3 КВЭ;
Vm р — объем раствора трилона Б, пошедшего на титрование пробы, см 3 ;
V — объем пробы воды, взятый для титрования, см 3 .
Если устранение цветности пробы осуществлялось с помощью суспензии гидроксида алюминия (см. 11.3.5), полученный результат умножают на 1,25.
12.2 Результат измерения в документах, предусматривающих его использование, представляют в виде:
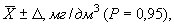
где 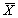
± D — границы характеристики погрешности результатов измерений для данной массовой концентрации кальция (таблица 1).
Численные значения результата измерений должны оканчиваться цифрой того же разряда, что и значения характеристики погрешности; последние не должны содержать более двух значащих цифр.
12.3 Допустимо представлять результат в виде
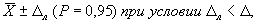
где ± D л — границы характеристик погрешности результатов измерений, установленные при реализации методики в лаборатории и обеспечиваемые контролем стабильности результатов измерений.
Примечание — Допустимо характеристику погрешности результатов измерений при внедрении методики в лаборатории устанавливать на основе выражения D л = 0,84 × D с последующим уточнением по мере накопления информации в процессе контроля стабильности результатов измерений.
12.4 Результаты измерений оформляют протоколом или записью в журнале по формам, приведенным в Руководстве по качеству лаборатории.
13.1.1 Контроль качества результатов измерений при реализации методики в лаборатории предусматривает:
— оперативный контроль исполнителем процедуры выполнения измерений (на основе оценки повторяемости, погрешности при реализации отдельно взятой контрольной процедуры);
— контроль стабильности результатов измерений (на основе контроля стабильности среднеквадратического отклонения повторяемости, среднеквадратического отклонения внутрилабораторной прецизионности, погрешности).
13.1.2 Периодичность оперативного контроля и процедуры контроля стабильности результатов выполнения измерений регламентируют в Руководстве по качеству лаборатории.
13.2 Алгоритм оперативного контроля повторяемости
13.2.1 Контроль повторяемости осуществляют для каждого из результатов измерений, полученных в соответствии с методикой. Для этого отобранную пробу воды делят на две части, и выполняют измерения в соответствии с разделом 11.
13.2.2 Результат контрольной процедуры r к , мг/дм 3 , рассчитывают по формуле
где Х1, Х2 — результаты измерений массовой концентрации кальция в пробе, мг/дм 3 .
13.2.3 Предел повторяемости rn, мг/дм 3 , рассчитывают по формуле
где s r — показатель повторяемости, мг/дм 3 (таблица 1).
13.2.4 Результат контрольной процедуры должен удовлетворять условию
13.2.5 При несоблюдении условия (8) выполняют еще два измерения и сравнивают разницу между максимальным и минимальным результатами с нормативом контроля равным 3,6 ×s r . В случае повторного превышения предела повторяемости, поступают в соответствии с разделом 5 ГОСТ Р ИСО 5725-6.
13.3 Алгоритм оперативного контроля процедуры выполнения измерений с использованием метода добавок совместно с методом разбавления проб
13.3.1 Оперативный контроль процедуры выполнения измерений с использованием метода добавок совместно с методом разбавления пробы проводят, если массовая концентрация кальция в рабочей пробе составляет 10 мг/дм 3 и более. В противном случае оперативный контроль проводят с использованием метода добавок согласно 13.4. Для введения добавок используют ГСО или аттестованный раствор кальция (приложение В).
13.3.2 Оперативный контроль исполнителем процедуры выполнения измерений проводят путем сравнения результатов отдельно взятой контрольной процедуры Кк с нормативом контроля К.
13.3.3 Результат контрольной процедуры Кк, мг/дм 3 , рассчитывают по формуле
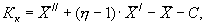
где 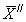
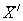
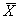
С — концентрация добавки, мг/дм 3 .
13.3.4 Норматив контроля К, мг/дм 3 , рассчитывают по формуле
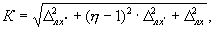
где D лх² ( D лх¢ и D лх ) — значения характеристик погрешности результатов измерений, установленные при реализации методики в лаборатории, соответствующие массовой концентрации кальция в разбавленной пробе с добавкой (разбавленной пробе, рабочей пробе), мг/дм 3 .
Примечание — Допустимо для расчета норматива контроля использовать значения характеристик погрешности, полученные расчетным путем по формулам D лх¢ = 0,84 × D х¢ и D лс = 0,84 × D х.
13.3.5 Если результат контрольной процедуры удовлетворяет условию:
процедуру анализа признают удовлетворительной.
При невыполнении условия (11) контрольную процедуру повторяют. При повторном невыполнении условия (11), выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
13.4.1 Контроль исполнителем процедуры выполнения измерений проводят путем сравнения результатов отдельно взятой контрольной процедуры Кк с нормативом контроля К.
13.4.2 Результат контрольной процедуры Кк, мг/дм 3 , рассчитывают по формуле

где 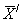
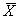
С — концентрация добавки, мг/дм 3 .
13.4.3 Норматив контроля погрешности К, мг/дм 3 , рассчитывают по формуле
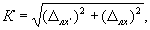
где D лх¢ ( D лх ) — значения характеристики погрешности результатов измерений, установленные при реализации методики в лаборатории, соответствующие массовой концентрации кальция в пробе с добавкой (рабочей пробе), мг/дм 3 .
Примечание — Допустимо для расчета норматива контроля использовать значения характеристик погрешности, полученные расчетным путем по формулам D лх¢ = 0,84 × D х¢ и D лс = 0,84 × D х.
3.4.4 Если результат контрольной процедуры удовлетворяет условию
процедуру признают удовлетворительной.
При невыполнении условия (14) контрольную процедуру повторяют. При повторном невыполнении условия (14), выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
Расхождение между результатами измерений, полученными в двух лабораториях, не должно превышать предела воспроизводимости R . При выполнении этого условия приемлемы оба результата измерений и в качестве окончательного может быть использовано их общее среднее значение. Значение R рассчитывают по формуле
При превышении предела воспроизводимости могут быть использованы методы оценки приемлемости результатов измерений согласно раздела 5 ГОСТ Р ИСО 5725-6 или МИ 2881.
Примечание — Проверка приемлемости проводится при необходимости сравнения результатов измерений, полученных двумя лабораториями.
Порцию активного угля, достаточную для заполнения колонки, помещают в термостойкую коническую колбу, добавляют 100 — 150 см 3 раствора соляной кислоты 4 моль/дм 3 и кипятят 2 — 3 ч, накрыв колбу часовым стеклом. Если раствор кислоты окрашивается, повторяют операцию до тех пор, пока он не останется бесцветным. Уголь отмывают дистиллированной водой до значения рН, соответствующего рН дистиллированной воды по универсальной индикаторной бумаге, добавляют 100 — 150 см 3 раствора гидроксида натрия 1 моль/дм 3 и выдерживают 8 — 10 ч. Если появляется окраска, операцию повторяют.
Очищенный уголь отмывают дистиллированной водой до нейтральной реакции по универсальной индикаторной бумаге. Хранят в склянке с дистиллированной водой.
После пропускания каждой пробы воды уголь в колонке регенерируют промыванием 0,4 %-ным раствором гидроксида натрия до исчезновения окраски последнего, затем дистиллированной до нейтральной реакции.
В стакан вместимостью 1 дм 3 помещают 500 см 3 дистиллированной воды и растворяют в ней 63 г алюмокалиевых квасцов (КА l (SO 4 )2 × 12Н2О). Нагревают раствор примерно до 60 °С и при постоянном перемешивании медленно прибавляют 28 см 3 аммиака водного. Дают смеси отстояться в течение 1 ч, а затем промывают несколько раз дистиллированной водой, декантируя жидкость над осадком. Последняя промывная вода не должна давать положительной реакции на сульфаты (проба с раствором хлорида бария). Для приготовления раствора хлорида бария в 80 см 3 дистиллированной воды растворяют 10 г хлорида бария, прибавляют 10 см 3 концентрированной соляной кислоты и перемешивают. Для проведения пробы на сульфаты к 5 см 3 промывной воды приливают 0,5 см 3 раствора хлорида бария. Помутнение свидетельствует о присутствии сульфатов в промывной воде.
В.1 Назначение и область применения
Настоящая методика регламентирует процедуру приготовления аттестованных растворов кальция, предназначенных для контроля точности результатов измерений массовой концентрации кальция в природных и очищенных сточных водах титриметрическим методом.
В.2 Метрологические характеристики
Метрологические характеристики аттестованных растворов приведены в таблице В.1.
Таблица В.1 — Метрологические характеристики аттестованных растворов кальция
Значение характеристики для аттестованного раствора
Аттестованное значение массовой концентрации кальция, мг/см 3
Границы погрешности установления аттестованного значения массовой концентрации кальция (Р = 0,95), мг/см 3
В.3.1 Весы лабораторные высокого (II ) класса точности по ГОСТ 24104-2001.
В.3.2 Колбы мерные 2 класса точности по ГОСТ 1770-74 вместимостью 250 см 3 — 2 шт.
В.3.3 Пипетка с одной отметкой по ГОСТ 29169-91 вместимостью 25 см 3 .
В.3.4 Цилиндр мерный по ГОСТ 1770-74 вместимостью 100 см 3 .
В.3.5 Стакан химический полипропиленовый вместимостью 250 см 3 .
В.3.6 Стакан В-1, ТХС по ГОСТ 25336-82 вместимостью 250 см 3 .
В.4.1 Кальций углекислый (карбонат кальция) по ГОСТ 4530-76, х.ч. Основной компонент — СаСО3, массовая доля которого не менее 99 %, молекулярная масса — 100,09.
В.4.2 Кислота соляная по ГОСТ 3118-77, х.ч.
В.4.3. Вода дистиллированная, ГОСТ 6709-72.
В.5 Процедура приготовления аттестованных растворов
В.5.1 Приготовление аттестованного раствора кальция АР1-Са
На весах высокого класса точности взвешивают в полипропиленовом стакане вместимостью 250 см 3 31,216 г карбоната кальция с точностью до четвертого знака после запятой. Навеску смачивают дистиллированной водой и добавляют постепенно 120 см 3 соляной кислоты (1:1) при перемешивании. Накрывают стакан чистым часовым стеклом и оставляют стоять до растворения.
После растворения осторожно, по палочке, переносят раствор через воронку в мерную колбу вместимостью 250 см 3 . Три-четыре раза ополаскивают стакан и воронку дистиллированной водой и переносят смывы в ту же колбу. Доводят раствор в колбе дистиллированной водой до метки и перемешивают.
Полученному раствору приписывают массовую концентрацию кальция 50,0 мг/см 3 .
В.5.2 Приготовление аттестованного раствора АР2-Са
В мерную колбу вместимостью 250 см 3 вносят 25,0 см 3 раствора кальция АР1-Са пипеткой с одной отметкой вместимостью 5 см 3 . Объем раствора доводят до метки на колбе дистиллированной водой и перемешивают.
Полученному раствору приписывают массовую концентрацию кальция 5,00 мг/см 3 .
В.6 Расчет метрологических характеристик аттестованных растворов
В.6.1 Расчет метрологических характеристик аттестованного раствора АР1-Са
Аттестованное значение массовой концентрации кальция С1, мг/см 3 , рассчитывают по формуле
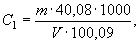
где m — масса навески карбоната кальция, г;
V — вместимость мерной колбы, см 3 ;
40,08 и 100,09 — масса моля кальция и карбоната кальция, соответственно, г/моль.
Расчет предела возможных значений погрешности установления массовой концентрации кальция в растворе АР1-Са D 1 , мг/см 3 , проводится по формуле:

где С1 — приписанное раствору значение массовой концентрации кальция, мг/см 3 ;
D m — предельное значение возможного отклонения массовой доли основного вещества в реактиве от приписанного значения m , %;
m — массовая доля основного вещества в реактиве, приписанная реактиву квалификации х.ч., %;
D m — предельная возможная погрешность взвешивания, г;
m — масса навески карбоната кальция, г;
D V — предельное значение возможного отклонения объема мерной колбы от номинального значения, см 3 ;
V — номинальный объем используемой мерной колбы, см 3 .
Погрешность установления массовой концентрации кальция в растворе АР1-Са равна
В.6.2 Расчет метрологических характеристик аттестованного раствора АР2-Са
Аттестованное значение массовой концентрации кальция С2, мг/см 3 , рассчитывают по формуле
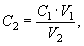
где С1 — приписанное раствору АР1-Са значение массовой концентрации кальция, мг/см 3 ;
V 1 — объем раствора АР1-Са, отбираемый пипеткой, см 3 ;
V 2 — вместимость мерной колбы, см3.
Расчет погрешности установления массовой концентрации кальция в растворе АР2-Са D 2 , мг/см 3 , проводится по формуле:

где С2 — приписанное раствору АР2-Са значение массовой концентрации кальция, мг/см 3 ;
D 1 — погрешность приготовления аттестованного раствора АР1-Са, мг/см 3 ;
С1 — приписанное раствору АР1-Са значение массовой концентрации кальция, мг/дм 3 ;
D V1 — предельное значение возможного отклонения объема V 1 от номинального значения, см 3 ;
V 1 — объем раствора АР1-Са, отбираемый пипеткой, см 3 ;
D V2 — предельное значение возможного отклонения вместимости мерной колбы от номинального значения, см 3 ;
V 2 — вместимость мерной колбы, см 3 .
Погрешность установления массовой концентрации кальция в растворе АР2-Са равна
В.7 Требования безопасности
Необходимо соблюдать общие требования техники безопасности при работе в химических лабораториях.
В.8 Требования к квалификации исполнителей
Аттестованные растворы может готовить инженер или лаборант со средним профессиональным образованием, прошедший специальную подготовку и имеющий стаж работы в химической лаборатории не менее 6 месяцев.
В.9 Требования к маркировке
На склянки с аттестованными растворами должны быть наклеены этикетки с указанием условного обозначения аттестованного раствора, массовой концентрации кальция в растворе, погрешности ее установления и даты приготовления.
Аттестованный раствор АР1-Са хранят в плотно закрытой склянке в течение года.
Аттестованный раствор АР2-Са хранят в плотно закрытой склянке не более 3 мес.
Федеральная служба по гидрометеорологии и мониторингу
окружающей среды
ГОСУДАРСТВЕННОЕ УЧРЕЖДЕНИЕ
«ГИДРОХИМИЧЕСКИЙ ИНСТИТУТ»
СВИДЕТЕЛЬСТВО № 55.24-2006
об аттестации МВИ
Методика выполнения измерений массовой концентрации кальция в воде титриметрическим методом с трилоном Б.
разработанная ГУ «Гидрохимический институт» (ГУ ГХИ)
и регламентированная РД 52.24.403-2007
аттестована в соответствии с ГОСТ Р 8.563-96 с изменениями 2002 г.
Аттестация осуществлена по результатам экспериментальных исследований
В результате аттестации МВИ установлено:
1. МВИ соответствует предъявляемым к ней метрологическим требованиям и обладает следующими основными метрологическими характеристиками:
Диапазон измерений, значения характеристик погрешности и ее составляющих (Р = 0,95)
Диапазон измерений массовой концентрации кальция X, мг/дм 3
Показатель повторяемости (среднеквадратическое отклонение повторяемости) s r, мг/дм 3
Показатель воспроизводимости (среднеквадратическое отклонение воспроизводимости) s R, мг/дм 3
Показатель правильности (границы систематической погрешности при вероятности Р = 0,95) ± D с, мг/дм 3
Показатель точности (границы погрешности при вероятности Р = 0,95) ± D , мг/дм 3
2. Диапазон измерений, значения пределов повторяемости и воспроизводимости при доверительной вероятности Р = 0,95
Диапазон измерений массовой концентрации кальция, X, мг/дм 3
Предел повторяемости (для двух результатов параллельных определений) r, мг/дм 3
Предел воспроизводимости (значение допускаемого расхождения между двумя результатами измерений, полученными в разных лабораториях, при вероятности Р = 0,95), R, мг/дм 3
3. При реализации методики в лаборатории обеспечивают:
— оперативный контроль исполнителем процедуры выполнения измерений (на основе оценки повторяемости и погрешности при реализации отдельно взятой контрольной процедуры);
— контроль стабильности результатов измерений (на основе контроля стабильности среднеквадратического отклонения повторяемости, среднеквадратического отклонения внутрилабораторной прецизионности, погрешности).
Периодичность оперативного контроля и процедуры контроля стабильности результатов выполнения измерений регламентируют в Руководстве по качеству лаборатории.
источник
