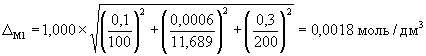Вода, проходя сквозь магматические породы, состоящие из хлорсодержащих минералов и соленосных отложений, растворяет хлориды, то есть соли соляной кислоты, которые чаще всего встречаются в виде солей натрия, магния и кальция. Их большое количество в грунтовых и артезианских водах обусловлено не только вулканическими выбросами, но и в результате круговорота – насыщения атмосферных осадков при прохождении через почву и затем обмен через атмосферу с океаном. Повышенное содержание натрия может наблюдаться вследствие вымывания растворимых соединений с хлором или поваренной соли из слоев имеющих соприкосновение с водой. Поэтому она становится непригодной ни для хозяйственных и технических нужд, ни для орошения в сельском хозяйстве. Следовательно, необходима очистка воды от натрия. Понятно, что соленая вода имеет повышенную предельно допустимую концентрацию солей хлоридной группы, а катионный состав их представлен натрием, образующим с хлором поваренную соль, что и обеспечивает ей соленый вкус. Следовательно, натрий попадает в водопроводную воду следующими путями: проходя сквозь горные породы и растворяя углекислые, сернокислые и хлористые соли натрия, из промышленных и хозяйственных сточных вод, с орошаемых полей. Чаще всего во всех соленых водах больше всего хлористого натрия относительно других солей, в связи с чем специалисты рекомендуют устанавливать системы очистки воды для дома. Если преобладает хлористый магний, то она имеет горько-соленый вкус.
При избыточной концентрации хлоридов и соответственно натрия может наблюдаться:
- раздражение слизистой оболочки глаз, кожных покровов, дыхательных путей;
- ухудшается пищеварение и негативно влияет на секрецию желудка;
- в организме нарушается водно-солевой баланс;
- могут развиться заболевания системы кровообращения;
- возникает вероятность новообразований мочеполовых органов, желудка, пищевода и других органов пищеварения;
- могут возникнуть желче- и мочекаменные заболевания;
- увеличивается частота сердечнососудистых заболеваний.
Очистка воды от натрия необходима, потому что избыточное содержание хлоридов, которое взаимосвязано с избыточным количеством натрия вредно для бытового оборудования:
- значительно увеличивается коррозия металлических поверхностей и деталей бытовых приборов;
- появляется осадок на нагревательных элементах чайников, стиральных и посудомоечных машин, бойлерах, что способствует преждевременному выходу их из строя.
Разные микроэлементы необходимы для каждой клетки и для всего организма. Натрий это микроэлемент, который играет важную роль в образовании желудочного сока, при его участии регулируется выделение почками продуктов жизнедеятельности человека. Он способствует нормальному водно-солевому балансу в клетках, нормализует нервно-мышечную деятельность. Он обеспечивает сохранение в растворимом состоянии минеральных веществ в крови и предотвращает перемещение жидкости из кровеносных сосудов в прилежащие к ним ткани. Известно, что организм человека не приспособлен самостоятельно вырабатывать натрий, поэтому его запас должен пополняться из различных естественных источников, например воды. Сбалансированное содержание натрия обеспечивают почки. Избыточное же его содержание может вызвать такие заболевания как гипертония, сахарный диабет, невроз. При этом наблюдается повышенная возбудимость, гиперактивность, впечатлительность, в некоторых случаях наблюдается чрезмерная жажда, потливость, частое мочеиспускание.
Очистка воды от натрия в бытовых условиях необходима, если наблюдается его переизбыток. В питьевой воде концентрация натрия не должна превышать 200 мг/л. Ведь его переизбыток в организме способствует повышению давления крови и соответственно накоплению жидкости и образованию отеков, а также истощает запасы калия, который необходим для стабильной работы сердечнососудистой системы.
Существуют два основных метода очистки соленой воды – ионообменный метод и обратный осмос воды. Ионообменный метод обладает следующими преимуществами: получение воды высокого качества, возможность работать при резко изменяющемся составе питающей воды, невысокие энергетические и капитальные затраты, невысокий расход на собственные нужды особенно для противоточных фильтров. Недостатки: приличный расход реагентов, и как следствие увеличение эксплуатационных расходов пропорционально содержанию солей, в зависимости от состава исходной воды требуется в некоторых случаях весьма сложная дополнительная подготовка.
Очистка при использовании технологии обессоливания воды имеет множество преимуществ: получение воды высокой степени очистки, небольшое потребление энергии, производительность неограниченна, надежность, невысокие эксплуатационные затраты и расходы на регенерацию мембран. Недостатки: необходимость тщательной дополнительной подготовки воды, обязательна непрерывность работы аппаратуры, но весьма значительные капитальные затраты на оборудование.
источник
Щелочные металлы имеют огромное биологическое значение. Натрий и калий – это элементы, которые постоянно содержатся в организме животных и растений.
Совместно калий и натрий выполняют следующие функции:
§ Создание условий для возникновения мембранного потенциала и мышечных сокращений;
§ Поддержание осмотической концентрации крови;
§ Нормализация водного баланса;
§ Обеспечение мембранного транспорта;
Определение этих металлов важно как в природных и питьевых водах, так и в биологических жидкостях.
Актуальным является определение содержания ионов натрия и калия в природных водах и сравнение его с требованиями предельно допустимых концентраций, а также содержание данных ионов в питьевых водах и сравнение с суточными потребностями организма человека.
Объект исследования: природные и питьевые воды Волгоградской области.
Предмет исследования: содержание ионов натрия и калия в различных водах Волгоградской области.
Цель работы:
· Определить содержание ионов натрия и калия в природных и питьевых водах.
Для осуществления поставленных целей были сформулированы следующие задачи:
· Провести обзор литературы о свойствах щелочных металлов (натрия и калия);
· Освоить потенциометрический метод определения содержания ионов натрия и калия;
· Экспериментально определить содержание ионов натрия и калия в пробах различных источников природных вод;
· Провести сравнительный анализ содержания ионов натрия и калия в питьевых минеральных водах известных марок;
· Сравнить полученные результаты с требованиями ПДК.
муниципальное образовательное учреждение
средняя общеобразовательная школа № 29
Тракторозаводского района г. Волгограда
«Содержание ионов натрия и калия в природных и питьевых водах».
ученик 10 класса МОУ СОШ №29
ГЛАВА1. Обзор литературы_________________________________________5
1.1. Природные соединения и получение натрия и калия_________________5
1.2. Физические и химические свойства натрия и калия, их соединений_________________________________________________8
1.3. Применение натрия и калия_____________________________________12
1.4. Биологическая роль в живых организмах__________________________15
1.5. Суточная норма потребления калия и натрия для организма
ГЛАВА 2. Экспериментальная часть_________________________________19
2.1. Объект исследования__________________________________________19
2.2. Аппаратура и методика проведения анализа_______________________20
2.3. Результаты исследования образцов природных вод_________________21
2.4. Сравнительный анализ минеральных вод на содержание ионов натрия и калия___________________________________________________________22
Щелочные металлы имеют огромное биологическое значение. Натрий и калий – это элементы, которые постоянно содержатся в организме животных и растений.
Совместно калий и натрий выполняют следующие функции:
- Создание условий для возникновения мембранного потенциала и мышечных сокращений;
- Поддержание осмотической концентрации крови;
- Поддержание кислотно-щелочного баланса ;
- Нормализация водного баланса;
- Обеспечение мембранного транспорта;
- Активация многих энзимов .
Определение этих металлов важно как в природных и питьевых водах, так и в биологических жидкостях.
Актуальным является определение содержания ионов натрия и калия в природных водах и сравнение его с требованиями предельно допустимых концентраций, а также содержание данных ионов в питьевых водах и сравнение с суточными потребностями организма человека.
Объект исследования: природные и питьевые воды Волгоградской области.
Предмет исследования: содержание ионов натрия и калия в различных водах Волгоградской области.
- Определить содержание ионов натрия и калия в природных и питьевых водах.
Для осуществления поставленных целей были сформулированы следующие задачи :
- Провести обзор литературы о свойствах щелочных металлов (натрия и калия);
- Освоить потенциометрический метод определения содержания ионов натрия и калия;
- Экспериментально определить содержание ионов натрия и калия в пробах различных источников природных вод;
- Провести сравнительный анализ содержания ионов натрия и калия в питьевых минеральных водах известных марок;
- Сравнить полученные результаты с требованиями ПДК.
1.1. Природные соединения и получение натрия и калия.
Натрий и калий относятся к числу довольно распространенных элементов. Содержание натрия в земной коре составляет 2,64%, калия – 2,6%.
В свободном виде калий и натрий в природе не встречаются. Эти щелочные металлы входят в состав различных соединений. Наиболее важным является соединение натрия с хлором NaCl, которое образует залежи каменной соли (Донбасс, Соликамск, Соль-Илецк и др.). Хлорид натрия содержится также в морской воде и соляных источниках. Обычно верхние слои залежей содержат калийные соли. Они имеются в морской воде, однако в значительно меньших количествах, чем соли натрия. Самые большие в мире запасы калийных солей находятся на Урале в районе Соликамска (минералы сильвинит NaCl * KCl * MgCl * 6H 2 O). Разведаны и эксплуатируются крупные залежи калийных солей в Белоруси (г. Солигорск).
Натрий впервые был получен английским химиком Хемфри Дэви в 1807 году электролизом твердого NaOH .
Кларк натрия в земной коре 25 кг/т. Содержание в морской воде в виде соединений — 10,5 г/л. Металлический натрий встречается как примесь, окрашивающая каменную соль в синий цвет. Данную окраску соль приобретает под действием радиации.
Первым способом получения натрия стала реакция восстановления карбоната натрия углем при нагревании тесной смеси этих веществ в железной ёмкости до 1000 °C:
Na 2 CO 3 + 2C → 2 Na + 3 CO
Затем появился другой способ получения натрия — электролиз расплава едкого натра или хлорида натрия . В настоящее время электролиз — основной способ получения натрия.
Натрий также можно получить циркониетермическим методом, а также термическим разложением азида натрия.
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор ( щёлок ) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K 2 SO 4 , соду и хлорид калия KCl.
В 1807 году английский химик Дэви электролизом расплава едкого кали (KOH) выделил калий и назвал его «потассий». В 1809 году Л. В. Гильберт предложил название «калий». Это название вошло в немецкий язык , оттуда в большинство языков Северной и Восточной Европы и «победило» при выборе символа для этого элемента — K.
В свободном состоянии не встречается. Калий входит в состав сильвина KCl, сильвинита KCl·NaCl, карналлита KCl·MgCl 2 ·6H 2 O, каинита KCl·MgSO 4 ·6H 2 O, а также присутствует в золе некоторых растений в виде карбоната K 2 CO 3 ( поташ ). Калий входит в состав всех клеток . Кларк калия в земной коре составляет 2,4 % (5-й по распространённости металл, 7-й по содержанию в коре элемент). Концентрация в морской воде 380 мг/л.
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C ), то чаще проводят электролиз расплавленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор :
K + + e − → K
2Cl − − 2e − → Cl 2
При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород :
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
1.2. Физические и химические свойства натрия и калия, их соединений.
Натрий — элемент с атомным номером 11 и атомным весом 22,98977. Является элементом главной подгруппы первой группы, третьего периода периодической системы химических элементов Дмитрия Ивановича Менделеева.
Натрий — серебристо-белый металл, в тонких слоях с фиолетовым оттенком, пластичен, даже мягок (легко режется ножом), свежий срез натрия блестит. Величины электропроводности и теплопроводности натрия достаточно высоки, плотность равна 0,96842 г/см³ (при 19,7 °C), температура плавления 97,86 °C, температура кипения 883,15 °C.
Щелочной металл, на воздухе легко окисляется. Для защиты от кислорода воздуха металлический натрий хранят под слоем керосина .
При горении на воздухе или в кислороде образуется пероксид натрия:
С водой натрий реагирует очень бурно, реакция идёт с выделением водорода , который может самовоспламениться или взорваться, куски металла всплывают на поверхность и могут расплавиться:
Как и все щелочные металлы, натрий является сильным восстановителем и энергично взаимодействуют со многими неметаллами (за исключением азота, иода, углерода, благородных газов):
С разбавленными кислотами взаимодействует как обычный металл:
С концентрированными окисляющими кислотами выделяются продукты восстановления:
8Na + 10HNO 3 → 8NaNO 3 + NH 4 NO 3 + 3H 2 O
Растворяется в жидком аммиаке , образуя синий раствор:
С газообразным аммиаком взаимодействует при нагревании:
С ртутью образует амальгаму натрия, которая используется как более мягкий восстановитель вместо чистого металла. При сплавлении с калием даёт жидкий сплав.
Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути , образуя амальгамы. Будучи внесённым в пламя горелки, калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Калий активно взаимодействует с водой. Выделяющийся водород воспламеняется, а ионы калия придают пламени фиолетовый цвет . Раствор фенолфталеина в воде становится малиновым, демонстрируя щелочную реакцию образующегося KOH.
Элементарный калий, как и другие щелочные металлы , проявляет типичные металлические свойства и очень химически активен, является сильным восстановителем. На воздухе свежий срез быстро тускнеет из-за образования плёнок соединений. При длительном контакте с атмосферой способен полностью разрушиться. С водой реагирует со взрывом. Хранить его необходимо под слоем бензина , керосина или силикона , дабы исключить контакт воздуха и воды с его поверхностью.
Калий при комнатной температуре реагирует с кислородом воздуха, галогенами; практически не реагирует с азотом . При умеренном нагревании реагирует с водородом с образованием гидрида (200—350 °C):
При сгорании калия на воздухе образуется надпероксид калия KO 2 (с примесью K 2 O 2 ):
Калий при комнатной температуре активно реагирует с водой, кислотами, растворяется в жидком аммиаке (−50 °C) с образованием тёмно-синего раствора.
Калий глубоко восстанавливает разбавленные серную и азотную кислоты:
8K + 6H 2 SO 4 → 4K 2 SO 4 + SO 2 ↑ + S↓ + 6H 2 O
21K + 26HNO 3 → 21KNO 3 + NO↑ + N 2 O↑ + N 2 ↑ + 13H 2 O
При сплавлении металлического калия со щелочами он восстанавливает водород гидроксогруппы:
При умеренном нагревании реагирует с газообразным аммиаком с образованием амида (65—105 °C):
Металлический калий реагирует со спиртами с образованием алкоголятов :
2K + 2C 2 H 5 OH → 2C 2 H 5 OK + H 2 ↑
При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид :
Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода , или при нагревании смеси супероксида калия с металлическим калием:
Оксиды калия обладают ярко выраженными основными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода :
K 2 O 2 + 2H 2 O→ 2KOH + H 2 O 2
4KO 2 + 2H 2 O → 4KOH + 3O 2 ↑
4KO 2 + 2CO 2 → 2K 2 CO 3 + 3O 2 ↑
Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа .
Также известен озонид калия KO 3 , оранжево-красного цвета. Получить его можно взаимодействием гидроксида калия с озоном при температуре не выше 20 °C:
4KOH + 4O 3 → 4KO 3 + O 2 + 2H 2 O
Озонид калия является очень сильным окислителем, например, окисляет элементарную серу до сульфата и дисульфата уже при 50 °C:
6KO 3 + 5S → 4K 2 SO 4 + 2K 2 S 2 O 7
Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла.
1.3. Применение натрия и калия.
Металлический натрий широко используется в препаративной химии и промышленности как сильный восстановитель, в том числе в металлургии. Натрий используется в производстве весьма энергоёмких натриево-серных аккумуляторов . Его также применяют в выпускных клапанах грузовиков как теплоотвод. Изредка металлический натрий применяется в качестве материала для электрических проводов, предназначенных для очень больших токов.
В сплаве с калием, а также с рубидием и цезием используется в качестве высокоэффективного теплоносителя. В частности, сплав состава натрий 12 %, калий 47 %, цезий 41 % имеет рекордно низкую температуру плавления −78 °C и был предложен в качестве рабочего тела ионных ракетных двигателей и теплоносителя для атомных энергоустановок.
Натрий также используется в газоразрядных лампах высокого и низкого давления. Эти лампы очень широко применяются в уличном освещении. Они дают ярко-жёлтый свет. Срок службы ламп составляет 12-24 тысяч часов. Поэтому газоразрядные лампы незаменимы для городского, архитектурного и промышленного освещения.
Металлический натрий применяется в качественном анализе органического вещества. Сплав натрия и исследуемого вещества нейтрализуют этанолом , добавляют несколько миллилитров дистиллированной воды и делят на 3 части, проба Ж. Лассеня, направлена на определение азота, серы и галогенов ( проба Бейльштейна ).
Хлорид натрия ( поваренная соль ) — древнейшее применяемое вкусовое и консервирующее средство.
Азид натрия (NaN 3 ) применяется в качестве азотирующего средства в металлургии и при получении азида свинца.
Цианид натрия (NaCN) применяется при гидрометаллургическом способе выщелачивания золота из горных пород, а также при нитроцементации стали и в гальванотехнике (серебрение, золочение).
Хлорат натрия (NaClO 3 ) применяется для уничтожения нежелательной растительности на железнодорожном полотне.
Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах, например, в атомных силовых установках на быстрых нейтронах . Кроме того, широко применяются его жидкие сплавы с рубидием и цезием .
Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений .
Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они часто более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока .
Бромид калия применяется в медицине и как успокаивающее средство для нервной системы. Гидроксид калия (едкое кали) применяется в щелочных аккумуляторах и при сушке газов. Карбонат калия ( поташ ) используется как удобрение , при варке стекла. Хлорид калия ( сильвин , «калийная соль») используется как удобрение . Нитрат калия (калийная селитра ) — удобрение , компонент чёрного пороха . Перхлорат и хлорат калия (бертолетова соль) используются в производстве спичек, ракетных порохов, осветительных зарядов, взрывчатых веществ, в гальванотехнике. Дихромат калия (хромпик) — сильный окислитель , используется для приготовления «хромовой смеси» для мытья химической посуды и при обработке кожи ( дубление ). Также используется для очистки ацетилена на ацетиленовых заводах от аммиака , сероводорода и фосфина . Перманганат калия — сильный окислитель , используется как антисептическое средство в медицине и для лабораторного получения кислорода . Дигидрофосфат и дидейтерофосфат калия в виде монокристаллов в лазерной технике. Пероксид калия и супероксид калия используются для регенерации воздуха на подводных лодках и в изолирующих противогазах (поглощает углекислый газ с выделением кислорода). Фтороборат калия — важный флюс для пайки сталей и цветных металлов. Цианид калия применяется в гальванотехнике (серебрение, золочение), при добыче золота и при нитроцементации стали . Калий совместно с перекисью калия применяется при термохимическом разложении воды на водород и кислород (калиевый цикл « Газ де Франс », Франция).
источник
Натрий является одним из главных компонентов химического состава природных вод и по распространённости среди катионов стоит на первом месте, составляя больше половины их общего содержания.
Основными источниками поступления натрия в поверхностные воды суши являются изверженные, осадочные породы и самородные растворимые хлористые (галит, сильвинит) и сернокислые (мирабилит) соли натрия. Кроме того, натрий поступает в природные воды с хозяйственно-бытовыми и промышленными сточными водами и с водами, сбрасываемыми с орошаемых полей. Источником его также могут быть засоленные почвы, из которых он вымывается атмосферными осадками. Большое значение имеют и биологические процессы, протекающие на водосборе, в результате которых образуются растворимые соединения натрия.
Натрий обладает высокой миграционной способностью, что обусловлено хорошей растворимостью его соединений в воде, слабо выраженной способностью к сорбции взвесями и донными отложениями. В поверхностных водах натрий мигрирует преимущественно в растворённом состоянии в виде иона. Концентрация его в речных водах колеблется от первых единиц до сотен миллиграммов в кубическом дециметре в зависимости от физико-географических условий и геологических особенностей бассейнов водных объектов. Обычно в поверхностных водах суши концентрация натрия не превышает 300 мг/дм 3 , но в некоторых случаях может достигать граммов в кубическом дециметре (например, в солёных озерах, небольших реках засушливых регионов с преимущественно подземным питанием).
В подземных водах концентрация натрия колеблется в более широких пределах — от миллиграммов до граммов и десятков граммов в кубическом дециметре. Это определяется составом водовмещающих пород, глубиной залегания подземных вод и другими условиями.
Внутригодовые изменения концентрации хлоридов в поверхностных водах суши связаны, в основном, с гидрологическим режимом водных объектов.
Для водных объектов рыбохозяйственного назначения предельно-допустимая концентрация (ПДК) натрия составляет 120 мг/дм 3 ; для объектов хозяйственно-питьевого и культурно-бытового назначения ПДК равна 200 мг/дм 3 .
МАССОВАЯ КОНЦЕНТРАЦИЯ НАТРИЯ В ВОДАХ.
МЕТОДИКА ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ
ПОТЕНЦИОМЕТРИЧЕСКИМ МЕТОДОМ С
ИОНСЕЛЕКТИВНЫМ ЭЛЕКТРОДОМ
1.1 Настоящий руководящий документ устанавливает методику выполнения измерений (далее — методика) массовой концентрации натрия в природных и очищенных сточных водах в диапазоне от 0,23 до 2300 мг/дм 3 потенциометрическим методом с ионселективным электродом.
При анализе проб воды с массовой концентрацией натрия, превышающей 2300 мг/дм 3 , допускается выполнение измерений после разбавления пробы дистиллированной водой таким образом, чтобы массовая концентрация натрия в разбавленной пробе находилась в пределах указанного выше диапазона измеряемых концентраций.
1.2 Настоящий руководящий документ предназначен для использования в лабораториях, осуществляющих анализ природных и очищенных сточных вод.
В настоящем руководящем документе использованы ссылки на следующие нормативные документы
ГОСТ 12.1.005-88 ССБТ Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 ССБТ Вредные вещества Классификация и общие требования безопасности
ГОСТ 17.15.04-81 Охрана природы Гидросфера Приборы и устройства для отбора, первичной обработки и хранения проб природных вод Общие технические условия
ГОСТ 17.1.5.05-85 Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков
ГОСТ Р ИСО 5725-6-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике
ГОСТ Р 51592-2000 Вода. Общие требования к отбору проб
МИ 2881-2004 Рекомендация. ГСИ. Методики количественного химического анализа. Процедуры проверки приемлемости результатов анализа.
Примечание — Ссылки на остальные нормативные документы приведены в разделах 4, А.3, А.4.
3.1 При соблюдении всех регламентируемых методикой условий проведения измерений характеристики погрешности результата измерения с вероятностью 0,95 не должны превышать значений, приведенных в таблице 1.
Таблица 1 — Диапазон измерений, значения характеристик погрешности и ее составляющих при принятой вероятности Р = 0,95
Показатель повторяемости (среднеквадратическое отклонение повторяемости)
Показатель воспроизводимости (среднеквадратическое отклонение воспроизводимости)
Показатель правильности (границы систематической погрешности)
Показатель точности (границы погрешности)
При выполнении измерений в пробах с массовой концентрацией натрия свыше 2300 мг/дм 3 после соответствующего разбавления погрешность измерений массовой концентрации натрия в исходной пробе ± D находят по формуле
где ± D 1 — показатель точности измерения массовой концентрации натрия в разбавленной пробе, рассчитанный по уравнению таблицы 1;
Предел обнаружения натрия потенциометрическим методом равен 0,2 мг/дм 3 .
3.2 Значения показателя точности методики используют при:
— оформлении результатов измерений, выдаваемых лабораторией;
— оценке деятельности лабораторий на качество проведения измерений;
— оценке возможности использования результатов измерений при реализации методики в конкретной лаборатории.
4.1.1 Мономер любого типа или рН-метр, работающий в режиме милливольтметра, снабжённый магнитной мешалкой (например, И-500, ТУ 4215-002-18294344-02; «Экотест-2000», ТУ 4215-005-41541647-99 и др.).
4.1.2 Электрод измерительный ЭСЛ-51-07, ТУ 25-05.1744-77, ЭС-10-07, ТУ 25-0519.072-86, или другого типа с аналогичными характеристиками.
4.1.3 Электрод вспомогательный хлорсеребрянный ЭВЛ-1МЗ, ТУ 25.05.2181-77 с минимальной скоростью истечения раствора хлорида калия через ключ (не более 1,0 см 3 в сутки) или другого типа с аналогичными характеристиками.
4.1.4 Весы лабораторные высокого (II) класса точности по ГОСТ 24104-2001.
4.1.5 Весы лабораторные среднего (III) класса точности по ГОСТ 24104-2001 с наибольшим пределом взвешивания 500 г.
4.1.6 Термометр с диапазоном измерения температур от 0 °С до 50 °С и ценой деления не более 0,5 °С, по ГОСТ 29224-91.
4.1.7 Колбы мерные 2 класса точности исполнения 2, 2а по ГОСТ 1770-74 вместимостью 100 см 3 — 9 шт., 200 см 3 — 4 шт., 500 см 3 — 1 шт.
4.1.8 Пипетки градуированные 2 класса точности исполнения 1, 2 по ГОСТ 29227-91 вместимостью 1 см 3 — 1 шт., 2 см 3 — 2 шт., 5 см 3 — 3 шт.
4.1.9 Пипетки с одной отметкой 2 класса точности исполнения 2, по ГОСТ 29169-91 вместимостью 5 см 3 — 3 шт., 10 см 3 — 1 шт., 20 см — 3 шт., 25 см — 1 шт.
4.1.10 Цилиндры мерные исполнения 1, 2 по ГОСТ 1770-74 вместимостью 50 см 3 — 2 шт., 100 см 3 — 1 шт., 500 см 3 — 1 шт.
4.1.11 Стаканы В-1, ТХС по ГОСТ 25336-82 вместимостью 50 см 3 — 30 шт., 250 см 3 — 2 шт., 600 см 3 — 1 шт., 1000 см 3 — 1 шт.
4.1.12 Стаканчик для взвешивания (бюкс) СВ-24/10 по ГОСТ 25336-82 — 1 шт.
4.1.13 Воронки лабораторные, тип В по ГОСТ 25336-82 диаметром 56 мм — 2 шт.
4.1.14 Чашка выпарительная № 2 по ГОСТ 9147-80.
4.1.15 Эксикатор исполнения 2 с диаметром корпуса 140 мм или 190 мм по ГОСТ 25336-82.
4.1.16 Посуда полиэтиленовая (полипропиленовая) для хранения проб и растворов вместимостью 0,1; 0,25; 1 дм 3 .
4.1.17 Электроплитка с закрытой спиралью по ГОСТ 14919-83.
4.1.18 Шкаф сушильный общелабораторного назначения с диапазоном температур до 300 °С.
Примечание — Допускается использование других типов средств измерений, посуды и вспомогательного оборудования, в том числе импортных, с характеристиками не хуже, чем у приведенных в 4.1.
4.2.1 Натрий хлористый (хлорид натрия) по ГОСТ 4233-77, х.ч.
4.2.2 Калий хлористый (хлорид калия) по ГОСТ 4234-77, х.ч.
4.2.4 Кислота соляная по ГОСТ 3118-77, х.ч.
4.2.5 Кальций углекислый (кальция карбонат) по ГОСТ 4530-76, х.ч. или кальция хлорид импортный с содержанием натрия не более 0,01 %.
4.2.6 Хлорид кальция обезвоженный, ТУ 6-09-4711-81, ч. (для эксикатора).
4.2.6 Вода дистиллированная по ГОСТ 6709-72.
4.2.7 Фильтры мембранные «Владипор МФАС-ОС-2», 0,45 мкм, ТУ 6-55-221-1-29-89 или другого типа, равноценные по характеристикам или фильтры бумажные обеззоленные «синяя лента», ТУ 6-09-1678-86.
4.2.8 Фильтровальная бумага по ГОСТ 12026-76.
Примечание — Допускается использование реактивов, изготовленных по другой нормативно- технической документации, в том числе импортных, с квалификацией не ниже указанной в 4.2.
Выполнение измерений основано на изменении потенциала ионселективного электрода в зависимости от активности ионов натрия в растворе. Измерения проводят в присутствии аммиака и индифферентного электролита (хлорида кальция), поддерживающих в анализируемом растворе определенное значение рН и ионной силы, что позволяет градуировать прибор в единицах концентрации, а не активности ионов натрия. Концентрацию натрия в пробе находят, исходя из градуировочной зависимости величины электродного потенциала от значения обратного логарифма активности (концентрации) ионов натрия ( pNa ).
6.1 При выполнении измерений массовой концентрации натрия в пробах природных и очищенных сточных вод соблюдают требования безопасности, установленные в национальных стандартах и соответствующих нормативных документах.
6.2 По степени воздействия на организм вредные вещества, используемые при выполнении измерений, относятся к 3, 4 классам опасности по ГОСТ 12.1.007.
6.3 Содержание используемых вредных веществ в воздухе рабочей зоны не должно превышать установленных предельно допустимых концентраций в соответствии с ГОСТ 12.1.005.
6.4 Особых требований по экологической безопасности не предъявляется.
К выполнению измерений допускаются лица со средним профессиональным образованием или без профессионального образования, но имеющие стаж работы в лаборатории не менее года и освоившие методику анализа.
При выполнении измерений в лаборатории должны быть соблюдены следующие условия:
— температура окружающего воздуха (22 ± 5) °С;
— атмосферное давление от 84,0 до 106,7 кПа (от 630 до 800 мм рт. ст.);
— влажность воздуха не более 80 % при 25 °С;
— напряжение в сети (220 ± 10) В;
— частота переменного тока в сети питания (50 ± 1) Гц.
Отбор проб для выполнения измерений массовой концентрации натрия производится в соответствии с ГОСТ 17.1.5.05 и ГОСТ Р 51592. Оборудование для отбора проб должно соответствовать ГОСТ 17.1.5.04 и ГОСТ Р 51592. Пробы помещают в плотно закрывающуюся полиэтиленовую или полипропиленовую посуду. Мутные пробы фильтруют через мембранный фильтр 0,45 мкм, очищенный кипячением в дистиллированной воде, или бумажный фильтр «синяя лента». Первые порции фильтрата отбрасывают. Объем отбираемой пробы не менее 100 см 3 .
10.1.1 Раствор хлорида кальция, 1 моль/дм 3
10.1.1.1 При наличии в лаборатории хлорида кальция необходимой степени чистоты, взвешивают в химическом стакане вместимостью 250 см 3 110 г хлорида кальция 6-водного или 56 г безводного и растворяют в дистиллированной воде. Раствор количественно переносят в мерную колбу вместимостью 500 см 3 . Объем раствора доводят дистиллированной водой до метки на колбе и перемешивают.
10.1.1.2 Для приготовления раствора из карбоната кальция взвешивают в химическом стакане вместимостью 600 см 3 50 г карбоната кальция, смачивают его 60 — 80 см 3 дистиллированной воды и медленно (вначале — по каплям) приливают при перемешивании 90 см 3 соляной кислоты. Выдерживают до растворения карбоната и проверяют рН универсальной индикаторной бумагой. Значение рН должно быть в пределах от 5 до 7. Если в полученном растворе рН оказался ниже 5, следует добавить несколько капель аммиака до получения требуемого значения рН. Раствор количественно переносят в мерную колбу вместимостью 500 см 3 . Объем раствора доводят дистиллированной водой до метки на колбе и перемешивают.
10.1.1.3 Хранят раствор хлорида кальция в плотно закрытой полиэтиленовой или полипропиленовой посуде.
10.1.2 Раствора аммиака 0,1 моль/дм 3
В стакан вместимостью 1000 см 3 помещают 500 см 3 дистиллированной воды, приливают пипеткой 3,8 см аммиака водного и перемешивают. Хранят раствор в плотно закрытой полиэтиленовой или полипропиленовой посуде.
10.1.3 Насыщенный раствор хлорида калия
В 140 см 3 дистиллированной воды при температуре 50 — 60 °С растворяют 60 г хлорида калия. После охлаждения используют раствор над осадком для заполнения вспомогательного электрода.
10.2.1 Градуировочные растворы готовят из аттестованного раствора с массовой концентрацией натрия 22,99 г/дм 3 (молярной концентрацией 1,000 моль/дм 3 ). Методика приготовления аттестованного раствора приведена в приложении А.
10.2.2 Для приготовления градуировочного раствора № 1 с молярной концентрацией натрия 1,00 · 10 -1 моль/дм 3 отбирают пипеткой с одной отметкой 20,0 см 3 аттестованного раствора с молярной концентрацией 1,000 моль/дм 3 , помещают его в мерную колбу вместимостью 200 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 1,00.
10.2.3 Для приготовления градуировочного раствора № 2 с молярной концентрацией натрия 2,50 · 10 -2 моль/дм 3 отбирают пипеткой с одной отметкой 25,0 см 3 градуировочного раствора № 1 с молярной концентрацией натрия 1,00 · 10 -1 моль/дм 3 , помещают его в мерную колбу вместимостью 100 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 1,60.
10.2.4 Для приготовления градуировочного раствора № 3 с молярной концентрацией натрия 1,00 · 10 -2 моль/дм 3 отбирают пипеткой с одной отметкой 20,0 см 3 градуировочного раствора № 1 с молярной концентрацией натрия 1,00 · 10 -1 моль/дм 3 , помещают его в мерную колбу вместимостью 200 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 2,00.
10.2.5 Для приготовления градуировочного раствора № 4 с молярной концентрацией натрия 5,00 · 10 -3 моль/дм 3 отбирают пипеткой с одной отметкой 5,00 см 3 градуировочного раствора № 1 с молярной концентрацией натрия 1,00 · 10 -1 моль/дм 3 , помещают его в мерную колбу вместимостью 100 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 2,30.
10.2.6 Для приготовления градуировочного раствора № 5 с молярной концентрацией натрия 2,00 × 10 -3 моль/дм 3 отбирают пипеткой с одной отметкой 20,0 см 3 градуировочного раствора № 3 с молярной концентрацией натрия 1,00 × 10 -2 моль/дм 3 , помещают его в мерную колбу вместимостью 100 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 2,70.
10.2.7 Для приготовления градуировочного раствора № 6 с молярной концентрацией натрия 1,00 · 10 -3 моль/дм 3 отбирают пипеткой с одной отметкой 20,0 см градуировочного раствора № 3 с молярной концентрацией натрия 1,00 · 10 -2 моль/дм 3 , помещают его в мерную колбу вместимостью 200 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 3,00.
10.2.8 Для приготовления градуировочного раствора № 7 с молярной концентрацией натрия 5,00 · 10 -4 моль/дм 3 отбирают пипеткой с одной отметкой 5,00 см 3 градуировочного раствора № 3 с молярной концентрацией натрия 1,00 · 10 -2 моль/дм 3 , помещают его в мерную колбу вместимостью 100 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 3,30.
10.2.9 Для приготовления градуировочного раствора № 8 с молярной концентрацией натрия 2,00 · 10 -44 моль/дм 3 отбирают пипеткой с одной отметкой 20,00 см 3 градуировочного раствора № 6 с молярной концентрацией натрия 1,00 · 10 -3 моль/дм 3 , помещают его в мерную колбу вместимостью 100 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 3,70.
10.2.10 Для приготовления градуировочного раствора № 9 с молярной концентрацией натрия 1,00 · 10 -4 моль/дм отбирают пипеткой с одной отметкой 10,00 см градуировочного раствора № 6 с молярной концентрацией натрия 1,00 · 10 -3 моль/дм 3 , помещают его в мерную колбу вместимостью 100 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 4,00.
10.2.11 Для приготовления градуировочного раствора № 10 с молярной концентрацией натрия 5,00 · 10 -5 моль/дм отбирают пипеткой с одной отметкой 5,00 см 3 градуировочного раствора № 6 с молярной концентрацией натрия 1,00 · 10 -3 моль/дм 3 , помещают его в мерную колбу вместимостью 100 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 4,30.
10.2.12 Для приготовления градуировочного раствора № 11 с молярной концентрацией натрия 2,00 · 10 -5 моль/дм 3 отбирают градуированной пипеткой 2,00 см градуировочного раствора № 6 с молярной концентрацией натрия 1,00 · 10 -3 моль/дм 3 , помещают его в мерную колбу вместимостью 100 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 4,70.
10.2.13 Для приготовления градуировочного раствора № 12 с молярной концентрацией натрия 1,00 · 10 -5 моль/дм 3 отбирают градуированной пипеткой 1,00 см 3 градуировочного раствора № 6 с молярной концентрацией натрия 1,00 · 10 -3 моль/дм 3 , помещают его в мерную колбу вместимостью 100 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 5,00.
10.2.14 Градуировочные растворы натрия хранят в полиэтиленовой или полипропиленовой посуде с плотно закрывающейся пробкой. Градуировочные растворы № 1 — 3 хранят не более 3 мес, растворы № 4 — 6 — не более мес, № 7 — 12 не более недели.
Подготовку иономера, измерительного и вспомогательного электродов к работе осуществляют в соответствии с руководством по эксплуатации или паспортом.
Вспомогательный электрод хранят в насыщенном растворе хлорида калия.
Измерительный электрод между измерениями следует хранить в растворе с молярной концентрацией натрия 1,00 · 10 -1 моль/дм 3 , не допуская высыхания мембраны электрода. Перед выполнением измерений электрод выдерживают в дистиллированной воде в течение часа.
10.4.1 Для установления градуировочных зависимостей в диапазоне pNa от 2,70 до 5,00 в три стакана вместимостью 50 см 3 мерным цилиндром вместимостью 50 см 3 вносят по 30 см 3 каждого из градуировочных растворов № 5 — 12, добавляют в каждый стакан по 2,0 см раствора хлорида кальция, 1 моль/дм 3 , и 1,0 см раствора аммиака, 0,1 моль/дм 3 .
10.4.2 Для установления градуировочных зависимостей в диапазоне pNa от 1,00 до 2,70 в три стакана вместимостью 50 см 3 мерным цилиндром вместимостью 50 см 3 вносят по 30 см 3 каждого из градуировочных растворов № 1 — 5, добавляют в каждый стакан по 4,0 см раствора хлорида кальция, 1 моль/дм 3 , и 1,0 см 3 раствора аммиака, 0,1 моль/дм 3 .
10.4.3 Один из трех стаканов устанавливают на магнитную мешалку, погружают в раствор перемешивающий элемент, измерительный и вспомогательный электроды, включают мешалку и перемешивают раствор в течение 3 мин. Затем этот стакан убирают (не регистрируя значение потенциала), помещают на мешалку стакан со второй аликвотой этого же градуировочного раствора, погружают в раствор перемешивающий элемент, измерительный и вспомогательный электроды, включают мешалку и после установления постоянного значения потенциала записывают показания иономера. Повторяют измерение с третьей аликвотой этого градуировочного раствора.
10.4.4 Измерения проводят, начиная от меньшей концентрации натрия ( pNa = 5,00) к большей (pNa = 1,00). За результат принимают среднее арифметическое двух измерений. Градуировочные зависимости для диапазонов pNa от 5,00 до 4,00 включительно, от 4,00 до 2,70 включительно и от 2, 70 до 1,00 включительно рассчитывают методом наименьших квадратов в координатах: значения pNa градуировочных растворов (отрицательный логарифм молярной концентрации натрия — lg [Na + ]) — соответствующие им значения потенциала в милливольтах. Одновременно измеряют и записывают температуру градуировочных растворов. Разница в температуре для разных градуировочных растворов не должна составлять более 1 °С.
10.4.5 Градуировочные зависимости устанавливают перед каждой серией измерений массовой концентрации натрия в пробах воды, а также при замене измерительного и (или) вспомогательного электродов.
Допускается устанавливать градуировочные зависимости для одного или двух диапазонов pNa, если в анализируемых пробах воды концентрация натрия не выходит за их пределы.
10.4.6 Если руководством по эксплуатации прибора предусмотрен иной способ установления градуировочной зависимости (градуировки), то допускается устанавливать её в соответствии с руководством по эксплуатации данного прибора для каждого из диапазонов, указанных в 10.4.4. Установление одной градуировочной зависимости для всего диапазона измеряемых концентраций не допускается.
В том случае, когда градуировочные зависимости для конкретного прибора устанавливают по меньшему числу градуировочных растворов, чем предусмотрено в 10.4.1 и 10.4.2, после их установления следует выполнить контроль стабильности градуировочных характеристик в соответствии с 10.5.
10.5.1 Средствами контроля являются градуировочные растворы № 1 — 12 по 10.2 (не менее 2-х растворов для каждого диапазона). Градуировочная характеристика считается стабильной при выполнении условия
где X — результат контрольного измерения массовой концентрации натрия в градуировочном растворе, мг/дм 3 ;
С m — приписанное значение массовой концентрации натрия в градуировочном растворе, мг/дм 3 ;
s R — показатель воспроизводимости для концентрации С, мг/дм 3 (таблица 1).
10.5.2 Если условие стабильности не выполняется для одного градуировочного раствора, необходимо выполнить повторное измерение этого раствора для исключения результата, содержащего грубую погрешность. При повторном невыполнении условия, выясняют причины нестабильности, устраняют их и повторяют измерения. Если градуировочная характеристика вновь не будет удовлетворять условию (1), устанавливают новую градировочную зависимость, либо проводят измерения в режиме милливольтметра и устанавливают градуировочные зависимости согласно 10.4.1 — 10.4.4.
11.1 В три стакана вместимостью 50 см 3 вносят мерным цилиндром вместимостью 50 см 3 по 30 см 3 анализируемой пробы, добавляют в каждый стакан по 2,0 см раствора хлорида кальция, 1 моль/дм 3 , и 1,0 см 3 раствора аммиака, 0,1 моль/дм 3 .
Один из трех стаканов устанавливают на магнитную мешалку, погружают в раствор перемешивающий элемент, измерительный и вспомогательный электроды, включают мешалку и перемешивают пробу в течение 3 мин. Затем этот стакан убирают (не регистрируя значение потенциала), помещают на мешалку стакан со второй аликвотой пробы, погружают в раствор перемешивающий элемент, измерительный и вспомогательный электроды, включают мешалку и после установления постоянного значения потенциала записывают показания иономера. Повторяют измерение с третьей аликвотой пробы. По окончании измерения электроды отмывают дистиллированной водой. Отмывание электродов происходит достаточно быстро при её трехкратной замене. Остатки воды с поверхности электрода удаляют фильтровальной бумагой.
Температура анализируемых проб не должна отличаться от температуры градуировочных растворов более, чем на ± 1 °С.
11.2 Если величина измеренного потенциала ниже, чем потенциал соответствующий значению pNa 2,70 градуировочной зависимости, повторяют измерения, добавляя в пробу 4,0 см 3 раствора хлорида кальция, 1 моль/дм 3 , и 1,0 см 3 раствора аммиака, 0,1 моль/дм 3 .
11.3 Выполнению измерений натрия с ионселективным электродом могут мешать высокие концентрации калия (30-кратный избыток по отношению к натрию), магния (10-кратный избыток), лития (концентрации, превышающие концентрацию натрия), однако для природных и очищенных сточных вод такие мешающие влияния маловероятны.
Наиболее существенное влияние на результаты измерения натрия оказывает концентрация ионов водорода (рН среды). Для получения правильных результатов разность (рН — pNa) должна быть более 3, что достигается подщелачиванием анализируемых проб раствором аммиака.
12.1 Значения pNa в анализируемых пробах воды находят по соответствующей градуировочной зависимости. Массовую концентрацию натрия X, мг/дм 3 , рассчитывают по следующим соотношениям:
pNa = — lg[ Na + ]; [ Na + ] = 10 — pNa , моль/дм 3 ;
X = 10 — pNa · 22,99 · 10 3 мг/дм 3
или находят по таблице Б.1 (см. приложение Б) для значений pNa в диапазоне от 3,00 до 4,00 включ. Массовую концентрацию натрия в мг/дм 3 для значений pNa от 2,00 до 3,00 включ. и от 1,00 до 2,00 включ. получают, увеличивая табличные значения в диапазоне от 3,00 до 4,00 включ., имеющие одинаковые значения дробной части, в 10 и в 100 раз, соответственно, а для значений pNa от 4,00 до 5,00 — уменьшая в 10 раз.
Например, pNa 3,10 соответствует 18,2 мг/дм 3 ионов натрия, pNa 2,10 — 182 мг/дм 3 , pNa 4,10 — 1,82 мг/дм 3 .
При использовании для выполнения измерений иономера, имеющего программу обработки данных, значение массовой концентрации натрия считывают непосредственно с дисплея.
12.2 Результат измерений в документах, предусматривающих его использование, представляют в виде
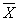
где 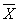
± D — границы характеристики погрешности результатов измерений для данной массовой концентрации натрия (таблица 1).
Численные значения результата измерения должны оканчиваться цифрой того же разряда, что и значения характеристики погрешности, которые не должны содержать более двух значащих цифр.
12.3 Допустимо представлять результат в виде:
X ± D л Р = 0,95, при условии D л D , (5)
где ± D л — границы характеристики погрешности результатов измерений, установленные при реализации методики в лаборатории и обеспечиваемые контролем стабильности результатов измерений.
12.4 Результаты измерений оформляют протоколом или записью в журнале, по формам, приведенным в Руководстве по качеству лаборатории.
13.1.1 Контроль качества результатов измерений при реализации методики в лаборатории предусматривает:
— оперативный контроль исполнителем процедуры выполнения измерений (на основе оценки повторяемости, погрешности при реализации отдельно взятой контрольной процедуры);
— контроль стабильности результатов измерений (на основе контроля стабильности среднеквадратического отклонения повторяемости, внутрилабораторной прецизионности, погрешности).
13.1.2 Периодичность контроля исполнителем процедуры выполнения измерений, а также реализуемые процедуры контроля стабильности результатов выполняемых измерений регламентируются в Руководстве по качеству лаборатории.
13.2.1 Контроль повторяемости осуществляют для каждого из результатов измерений, полученных в соответствии с методикой. Для этого отобранную пробу воды делят на три части, и выполняют измерения в соответствии с разделом 11.
13.2.2 Результат контрольной процедуры r к , мг/дм 3 , рассчитывают по формуле
где X 1 , Х2 — результаты единичных измерений массовой концентрации натрия в пробе, мг/дм 3 .
13.2.3 Предел повторяемости rn, мг/дм 3 , рассчитывают по формуле
где s r — показатель повторяемости, мг/дм 3 (таблица 1).
13.2.4 Результат контрольной процедуры должен удовлетворять условию
13.2.5 При несоблюдении условия (8) выполняют еще два измерения и сравнивают разницу между максимальным и минимальным результатами с нормативом контроля равным 3,6 s r . В случае повторного превышения предела повторяемости, поступают в соответствии с разделом 5 ГОСТ Р ИСО 5725-6.
13.3 Алгоритм оперативного контроля процедуры выполнения измерений с использованием метода добавок совместно с методом разбавления проб
13.3.1 Оперативный контроль процедуры выполнения измерений с использованием метода добавок совместно с методом разбавления пробы проводят, если массовая концентрация натрия в рабочей пробе составляет 1,0 мг/дм 3 и более. В противном случае оперативный контроль проводят с использованием метода добавок согласно 13.4. Для введения добавок используют аттестованный раствор натрия (см. приложение А).
13.3.2 Оперативный контроль исполнителем процедуры выполнения измерений проводят путем сравнения результатов отдельно взятой контрольной процедуры Кк с нормативом контроля К.
13.3.3 Результат контрольной процедуры Кк, мг/дм 3 , рассчитывают по формуле
Кк = 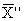
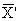
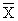
где 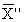

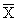
С — концентрация добавки, мг/дм 3 .
13.3.4 Норматив контроля К1, мг/дм 3 , рассчитывают по формуле
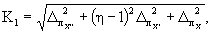
где 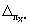
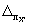
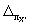
Примечание. Допустимо характеристику погрешности результатов измерений при внедрении методики в лаборатории устанавливать на основе выражения: 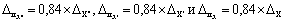
13.3.5 Если результат контрольной процедуры удовлетворяет условию:
процедуру анализа признают удовлетворительной.
При невыполнении условия (11) контрольную процедуру повторяют. При повторном невыполнении условия (11), выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
13.4.1 Контроль исполнителем процедуры выполнения измерений проводят путем сравнения результатов отдельно взятой контрольной процедуры Кк с нормативом контроля К.
13.4.2 Результат контрольной процедуры Кк, мг/дм 3 , рассчитывают по формуле
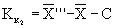
где 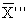
13.4.3 Норматив контроля погрешности К, мг/дм 3 , рассчитывают по формуле
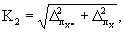
где 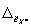
Примечание — Допустимо для расчета норматива контроля использовать значения характеристик погрешности, полученные расчетным путем по формулам 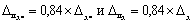
13.4.4 Если результат контрольной процедуры удовлетворяет условию
процедуру признают удовлетворительной.
При невыполнении условия (14) контрольную процедуру повторяют. При повторном невыполнении условия (14), выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
14.1 Расхождение между результатами измерений, полученными в двух лабораториях, не должно превышать предела воспроизводимости R . При выполнении этого условия приемлемы оба результата измерений и в качестве окончательного может быть использовано их общее среднее значение. Значение предела воспроизводимости рассчитывают по формуле
14.2 При превышении предела воспроизводимости могут быть использованы методы оценки приемлемости результатов измерений согласно разделу 5 ГОСТ Р ИСО 5725-6 или МИ 2881.
14.3 Проверку приемлемости проводят при необходимости сравнения результатов измерений, полученных двумя лабораториями.
А.1 Назначение и область применения
Настоящая методика регламентирует процедуру приготовления аттестованного раствора натрия, предназначенного для установления градуировочных характеристик иономера и контроля точности результатов измерений массовой концентрации натрия в природных и очищенных сточных водах потенциометрическим методом.
А.2 Метрологические характеристики
Метрологические характеристики аттестованного раствора приведены в таблице А.1.
Таблица А.1 — Метрологические характеристики аттестованного раствора AP1-Na
Значение характеристики для аттестованного раствора AP1-Na
Аттестованное значение концентрации натрия
Границы погрешности аттестованного значения концентрации натрия (Р = 0,95)
А.3.1 Весы лабораторные высокого (II) класса точности по ГОСТ 24104-2001.
А.3.2 Колбы мерные 2 класса точности исполнения 2 по ГОСТ 1770-74 вместимостью 200 см 3 — 1 шт.
А.3.3 Стаканчик для взвешивания (бюкс) по ГОСТ 25336-82 СВ-24/10 .
А.3.4 Воронка лабораторная по ГОСТ 25336-82 диаметром 56 мм.
А.3.5 Чашка выпарительная № 2 по ГОСТ 9147-80.
А.3.6 Эксикатор исполнения 2, диаметром корпуса 190 мм по ГОСТ 25336-82, заполненный обезвоженным хлоридом кальция.
А.3.7 Шкаф сушильный общелабораторного назначения с диапазоном температур до 300 °С.
А.4.1 Натрий хлористый (хлорид натрия) по ГОСТ 4233-77, х.ч., с содержанием основного вещества не менее 99,9 %.
А.4.2 Вода дистиллированная по ГОСТ 6709-72.
А.5 Процедура приготовления аттестованного раствора натрия AP1-Na
Для приготовления аттестованного раствора AP1- Na взвешивают в бюксе с точностью до четвертого знака после запятой 11,6880 г хлорида натрия, предварительно высушенного в сушильном шкафу при температуре от 250 °С до 270 °С в течение 2 ч. Количественно переносят навеску в мерную колбу вместимостью 200 см 3 , растворяют в дистиллированной воде, доводят объём раствора до метки и перемешивают.
Полученному раствору приписывают молярную концентрацию натрия 1,000 моль/дм 3 и массовую концентрацию 22,99 мг/см 3 (г/дм 3 ).
А.6 Расчет метрологических характеристик аттестованного раствора AP 1-Na
А.6.1 Аттестованное значение молярной концентрации натрия M 1 , моль/дм 3 , и массовой концентрации С1, мг/см 3 (г/дм 3 ), рассчитывают по формулам
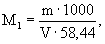
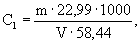
где m — масса навески хлорида натрия, г;
V — вместимость мерной колбы, см 3 .
22,99 и 58,44 — молярная масса иона натрия и хлорида натрия, соответственно, г/моль.
А.6.2 Расчет значений границ погрешности приготовления аттестованного раствора D C1 , г/дм 3 , или D М1 , моль/дм 3 , выполняют по формулам
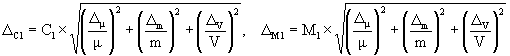
где D m — предельное значение возможного отклонения массовой доли основного вещества ( NaCl ) в реактиве от приписанного значения m , %;
m — массовая доля основного вещества (NaCl) в реактиве, приписанная реактиву квалификации «х.ч.», %;
D m — погрешность взвешивания, г;
D V — предельное значение возможного отклонения вместимости мерной колбы от номинального значения, см 3 .
А.6.3 Погрешности приготовления аттестованного раствора AP 1-Na равны
и
А.7 Требования безопасности
Необходимо соблюдать общие требования техники безопасности при работе в химических лабораториях.
А.8 Требования к квалификации операторов
Аттестованный раствор может готовить инженер или лаборант со средним профессиональным образованием, прошедший специальную подготовку и имеющий стаж работы в химической лаборатории не менее 6 мес.
А.9 Требования к маркировке
На склянку с аттестованным раствором должна быть наклеена этикетка с указанием условного обозначения раствора, величины массовой и молярной концентрации натрия, погрешности ее установления и даты приготовления раствора.
Аттестованный раствор следует хранить в герметично закрытой полиэтиленовой или полипропиленовой посуде при комнатной температуре не более 6 мес.
источник