Микобактерии туберкулеза – МБТ открыты более 30 лет назад, однако до сих пор продолжается их изучение, что связано с высокой скоростью развития туберкулеза в обществе при инфицировании хотя бы одного человека.
Эти микроорганизмы относят к семейству Лучистых грибов (Актиномицеты). Представляют собой различного размера палочки, способные к размножению путем простого деления или почкования. Они неподвижны и не способны к образованию спор. Обладают хорошей устойчивостью к различным факторам окружающей среды. Чаще всего их называют палочками Коха в честь первооткрывателя.
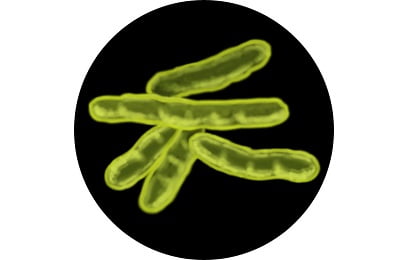
Микобактерий туберкулеза на данный момент известно множество видов. Наибольший интерес представляют микроорганизмы, опасные для человека и способные вызывать инфекционные заболевания.
- Mycobacterii tuberculosis;
- Mycobacterii africanum.
Палочки Коха обладают повышенной жизнеспособностью, поэтому лечение туберкулеза может длиться месяцами с последующим ежегодным контролем больного. Обусловлено это способностью их к персистированию и реверсии.
Важным для диагностики является химический состав возбудителя. Он хорошо изучен. Основу составляет вода и специальные белки (туберкулопротеины), которые являются чужеродными для человеческого организма. На этом построено массовое выявление туберкулеза на ранних этапах для любых возрастных групп – туберкулинодиагностика.
- высокая степень патогенности (способность вызывать развитие заболевания за счет корд-фактора);
- склонность к массовому заражению в коллективах, особенно детских;
- невосприимчивость ко многим дезинфицирующим средствам;
- устойчивость к спиртам, кислотам и щелочи;
- непосредственное токсическое воздействие на клетки, блокирующие воспаление в организме человека – лейкоциты;
- изменчивость и способность к мутации, что обусловливает низкую эффективность определенных противотуберкулезных препаратов.
Крайне важным для недопущения эпидемии является своевременное выявление инфицированных пациентов. Для этого в настоящее время разработаны ежегодные профилактические осмотры во взрослых и детских коллективах. Задачей их считается определение наличия МБТ или уже развившегося тубзаболевания у конкретного человека.
К этой группе можно отнести туберкулинодиагностику и экспресс-тесты.
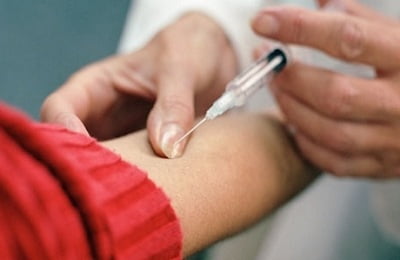
Методы туберкулинодиагностики основаны на введении в кровоток специального лекарства, содержащего туберкулин (белок бактерии), или его аналогов. Препарат вводится внутрикожно. Через 72 часа оценивают результат.
Если пациент инфицирован либо переболел туберкулезом, то при инъекции чужеродных антигенов, организм отреагирует местной аллергической реакцией в виде папулы (красное пятно с пузырьком) на месте укола.
Существует 2 метода туберкулинодиагностики:
Диаскинтест является хорошим современным препаратом, однако он не может заменить пробу Манту. Часто их назначают одновременно, особенно при положительных первых исследованиях. Однако эти методы лишь позволяют врачам заподозрить инфицированность микобактерией человека, но не могут дать 100% гарантию.
Минусами туберкулинодиагностики являются:
- частые ложноположительные результаты;
- невозможность представить полную оценку клинической картины;
- невозможность выявления конкретного возбудителя заболевания.
Однако туберкулинодиагностика является важным этапом для выявления МБТ при туберкулезе. Лишь после ее положительных результатов фтизиатр назначает последующее углубленное обследование.
В связи с необходимостью быстрой и более точной диагностики туберкулеза современная фтизиатрия предлагает к использованию так называемые экспресс-методы диагностики.
Они являются удобными, быстрыми, в большинстве случаев достоверными, однако их стоимость и необходимость соответствующего оснащения учреждения делают их невостребованными. Из экспресс-методов применяют:
Использование специальной индикаторной пробирки с флуоресцентными веществами. После посева рост МБТ наблюдается в течение 4-10 суток. По наличию или отсутствию свечения определяют положительный или отрицательный результат.
4 и 5 методы позволяют выявить МБТ в исходном материале на 2-4 сутки. Это высокоэффективные способы, позволяющие выявить вид и форму возбудителя в самые ранние сроки.
С учетом развития современной науки и медицинской техники, фтизиатрия предлагает много способов для выявления МБТ.

- Бактериоскопия: прямая, люминесцентная, фазово-контрастная, флотационная.
- Бактериология.
- Биологические методы.
Сущность этих методов состоит в проведении лабораторных исследований, при которых из различных материалов выделяют МБТ. Для этого при легочном туберкулезе чаще всего используют мокроту. При внелегочном туберкулезе исследуют:
- мочу;
- плевральный выпот;
- спинномозговую жидкость;
- каловые массы;
- выделения свищей; пунктаты;
- промывные воды желудка.
Промывание желудка и последующий сбор промывных вод часто назначают детям, не умеющим хорошо откашливать мокроту (особенно младшие возрастные группы). Это более щадящий метод, чем бронхоскопия.
Анализ мочи на микобактерии туберкулеза проводят при подозрении на инфицирование ими почек. Показанием для этого является обнаружение в осадке большого количества лейкоцитов (более 15 в каждом поле зрения).
Выявление МБТ в цереброспинальной жидкости важно для диагностики туберкулезного менингита, однако эффективность данной процедуры невелика.
Любой полученный от больного материал подлежит специальной подготовке мазков из него для дальнейшего исследования в зависимости от метода, назначенного фтизиатром. Анализы проводятся только в противотуберкулезных учреждениях специально обученным медицинским персоналом.
Суть состоит в окрашивании специальными красителями препаратов, полученных из материала больного, с последующим рассмотрением их под микроскопом.

Делают бактериоскопию несколько дней подряд. Результаты записывают на определенные бланки. Указывается при этом вид (грамположительная палочка) и приблизительное количество.
Наиболее эффективными являются люминесцентная и фазово-контрастная микроскопия. В первом случае флуоресцентно окрашенный препарат изучают при облучении ультрафиолетовыми лучами.
Это позволяет в более короткие сроки рассмотреть большое количество препарата и точнее установить диагноз.
При проведении фазово-контрастной бактериоскопии врач может наблюдать МБТ и их различные формы в живом состоянии. Такой вид исследования является единственным способом выявления возбудителя, позволяющим его зафиксировать «вживую». Это достигается путем использования специального фазово-контрастного оборудования. Такой метод исследования позволяет поставить правильный диагноз в большинстве случаев. Минусом является высокая стоимость медицинских устройств.

- найденные формы МБТ;
- вид;
- среднее количество МБТ.
Второй показатель имеет наибольшее значение для оценки динамики проводимой терапии.
Важное клиническое значение при выявлении МБТ имеет посев на специальные среды. При наличии палочки Коха в исходном материале будет происходить рост их колоний. Плюсом этого является возможность выявления возбудителя при малой его концентрации в начальной жидкости, из которой делаются посевы.
Главный недостаток бактериологического метода – большое время ожидания результата, которое составляет от 3 недель и дольше. Обусловлено это крайне медленным ростом колоний МБТ после посева на питательной среде.
Неотъемлемой частью при проведении бактериологического метода, когда получены возбудители заболевания, является определение их чувствительности к противотуберкулезным препаратам.

- Скудное, когда обнаруживается до 20 КОЕ.
- Умеренное, если их количество доходит до 100.
- Обильное, когда выявляется свыше 100 КОЕ.
При 1 варианте необходимо обязательное повторное исследование, потому что такое количество КОЕ не является достоверным для постановки диагноза.
При выявлении чувствительности к противотуберкулезным средствам в заключении указывается наиболее распространенный список лекарств, используемых фтизиатрами для лечения заболевания. Около названия каждого препарата латинскими буквами ставится – S или R. S обозначает чувствительность МБТ к данному лекарству, R – резистентность (устойчивость).
Один возбудитель может быть восприимчив как к одному, так и к нескольким препаратам, исходя из этого, фтизиатр назначает рациональную терапию.
При туберкулезе выявление МБТ происходит различными методами. Чаще всего в клинической практике используют несколько способов для обнаружения возбудителя, обязательно включающих посев на специальные среды. Такие методы являются абсолютно безопасными и широко применяются при диагностике туберкулеза у детей и взрослых.
источник
Большое значение в правильности выполнения лабораторных поисков МБТ имеет забор патологического материала.Посуда, в которую собирают патологический материал,должна быть стерильной. Наиболее часто исследуется мокрота. Собранные образцы должны быть немедленно отосланы в соответствующую лабораторию. Если такой возможности нет, материал сохраняют в холодильнике при температуре воздуха 4-10 о С. Если лаборатория расположена в отдалении от учреждения здравоохранения, доставку материала для исследований осуществляют 1 или 2 раза в неделю. Для этого должны использоваться специальные контейнеры. Контейнеры должны быть прочными, устойчивыми к разрушению, иметь широкую горловину с герметически завинчивающейся пробкой, чтобы предотвратить случайное вытекание из нее содержимого.
При сборе образцов риск инфекции очень большой, особенно когда больной выкашливает мокроту, в связи с этим процедуру необходимо проводить как можно дальше от посторонних лиц и в специальном помещении/кабине.
Мокроту на МБТ в амбулаторных условиях собирают трижды, после соответствующего туалета полости рта:
1. Первая проба – в поликлинике или стационаре, в присутствии медицинского работника, через 1-2 часа после сна.
2. Вторая проба – в тот же день через несколько часов (3-4 часа).
3. Третья проба – на следующий день пациент приносит мокроту сам.
У нетранспортабельных пациентов забор мокроты производит участковая медсестра поликлиники на дому в стерильную посуду и доставляет в бактериологическую лабораторию.
Методы этиологической диагностики туберкулеза
– с окраской по Циль-Нельсену;
– посевы на плотные питательные среды (Левен-
– посевы на жидкие питательные среды с автома-
тизированным учетом роста типа BACTEC MGIT 960/320 TB
Биочиповая, стриповая, картриджная технологии,
ПЦР в режиме реального времени
Рис. 2. Алгоритм этиологической диагностики туберкулеза
Цель этиологической диагностики туберкулеза:
• выявление эпидемиологически опасных больных туберкулезом – бактериовыделителей (с МБТ+);
• верификация диагноза туберкулеза;
• определение лечебной тактики;
• оценка эффективности лечения и прогноза;
• для эпидемического контроля за туберкулезом.
Бактериоскопический метод выявления МБТ наиболее простой, дешевый, специфический, доступный по сравнению со всеми другими методами диагностики туберкулеза. Бактериоскопический метод имеет свои разновидности: простая бактериоскопия иLEDили люминесцентной микроскопии (рис. 3).
При простой бактериоскопии мазок красят по Цилю-Нильсону: стеклянной палочкой гнойные комочки мокроты наносят равномерно на предметное стекло, и фиксируют в пламени горелки. Далее красят карболовым фуксином, который после нанесения подогревают в пламени, чтобы краситель лучше проник в МБТ, после промывания мазка обесцвечивают в 25 % растворе сернойкислоты или в 3 % соляно-кислом спирте. Обесцвеченные элементы мазка докрашивают 0,3 % раствором метиленового синего. Микобактерии не воспринимают обычные анилиновые красители, в результате чего кислотоустойчивые микобактерии окрашиваются в малиново-красный цвет, а другие микробы и клеточные элементы – в голубой цвет. МБТ под микроскопом имеют вид продолговатых палочек, розового цвета на синем фоне. На окрашивание затрачивается 20-30 минут. Метод простой и дешевый, но мало информативный, чтобы обнаружить МБТ в 1 см 3 мокроты должно быть около 50-100 тыс. МБТ, если же будет меньше, то МБТ не будут найдены.
В основу метода люминесцентной микроскопии включена окраска МБТ флюорохромами (аурамин, родамин и др.), которые также связываются с воскоподобными структурами микробной клетки и светятся в ультрафиолетовых лучах. LED (light emitted diode – светоизлучающие диоды) технологии позволяют конвертировать обычный световой микроскоп во флюоресцентный, увеличивая и улучшая технические возможности люминесцентной микроскопии.
При бактериологическом исследовании патологический материал культивируют на питательных средах, и выделяют культуру МБТ в чистом виде. Наиболее часто используют следующие питательные среды: Левенштейна-Йенсена, Финн-2. Перед посевом на питательные среды проводят обработку патологического материала для уничтожения сопутствующей флоры, разжижения, деконтаминации. В зависимости от материала, степени его гомогенности и загрязнённости для предпосевной обработки используют различные деконтаминанты. Для мокроты в основном используют 10 % раствор трёхзамещённого фосфорно-кислого натрия. После предварительной обработки материал центрифугируют, за счёт этого осаждают микобактерии, и повышают их содержание в осадке («обогащение осадка»). Полученный осадок подвергают нейтрализации, и засевают им (инокулируют) поверхность плотных питательных сред или пробирки с жидкими (полужидкими) средами. Из оставшейся части осадка готовят мазки для микроскопического исследования, так как микроскопическое и культуральное исследования нужно производить параллельно из одной и той же пробы диагностического материала (рис. 2). При использовании плотных сред инокулированные пробирки помещают в термостат при температуре 37 С на 2 суток в горизонтальном положении. Это обеспечивает более равномерное всасывание материала в питательную среду. Через 2 суток пробирки переводят в вертикальное положение, и герметично закрывают резиновыми или силиконовыми пробками во избежание подсыхания засеянных сред. Посевы выдерживают в термостате при 37 о С в течение 10-12 недель при регулярном еженедельном просмотре.
на среде Левенштейна-Йенсена
Рис. 3 Вид МБТ под микроскопом и в культуре
Длительность получения результатов исследований на основе классических метод выявления/культивирования микобактерий туберкулеза (в течение 1-3 месяцев) неблагоприятно сказывается на эффективности химиотерапии, особенно в связи с вероятностью неправильного выбора схемы химиотерапии при наличии ЛУ у возбудителя и риском расширения спектра устойчивости МБТ.
Культивирование на жидкой питательной среде в автоматизированной системе учета роста микроорганизмов – ускоренный культуральный диагностический метод (10- 14 дней)
Культивирование на жидкой среде повышает выявление МБТ примерно на 10% по сравнению с твердыми средами. В настоящее время широко используются системы с автоматической детекцией учета роста МБТ, которые позволяют значительно ускорить получение результат. В бактериологических лабораториях медицинских организаций фтизиатрического профиля РФ преобладающей является автоматизированная система BACTEC MGIT 960/320.
Рис. 3. Автоматизированная система культивирования микобактерий: MGIT-BACTEC-960
Преимущества автоматизированной системы культивирования BACTEC MGIT 960/320 перед культуральными исследованиями на плотных питательных средах обеспечиваются высокой эффективностью стандартизованных и сертифицированных по ISO9001 производств реагентов и сред, а также поддержанием стандартных протоколов исследований.
В основе методики лежит изобретение индикаторной пробирки MGIT (mycobacteria growth indicating tube). Содержимое пробирки MGIT – это питательный бульон, благодаря которому достигается более эффективное выделение микобактерий и их ускоренный рост. Пробирка содержит 7 мл стерильного питательного бульона Мидлбрук 7Н9, в которую перед использованием вносится обогатительная добавка для стимуляции роста МБТ. На дне пробирки содержится кислородзависимый флюорохромный краситель. Во время бактериального роста внутри пробирки происходит поглощение свободного кислорода и его замещение углекислым газом. По мере расходования свободного кислорода возникает флюоресценция. Флюоресценция становится видимой при облучении пробирки ультрафиолетовым светом и автоматически регистрируется фотодатчиками, встроенными в прибор BACTEC MGIT 960/320 (рис. 4). Один раз в час флуоресцентный сенсор считывает результаты тестирования. Интенсивность свечения прямо пропорциональна уровню расходования кислорода и регистрируется в единицах роста (GU –growth units). В среднем появление роста МБТ сокращается до 11 дней. Прибор оценивает пробу как отрицательную при отсутствии роста в течение шести недель (42 дня).
Результат
незначительное или полное отсутствие свечения
Результат
на дне пробирки и оранжевое отражение в колене пробирки
Рис. 4. Результаты индикаторной пробирки MGIT на выделения культуры МБТ
Основное преимущество исследований на основе молекулярно-генетических методов в том, что они являются «быстрыми» методами, позволяющими получить результаты в относительно короткий временной период. Заключение о наличии МБТ в диагностическом материале делается на основании выявления видоспецифичного генетического маркера (ДНК) МБТ или видоспецифичных белков-антигенов, а вывод о ЛУ — на основании выявления мутаций в целевых участках генов МБТ, ассоциированных с ЛУ.
Из всех молекулярно-генетических подходов базовым методом, применяемым для выявления M.tuberculosis complex является полимеразная цепная реакция (ПЦР).
Проведение ПЦР-анализа происходит в три этапа:
Детекция ДНК-продуктов амплификации
Выделение ДНК — это первоначальный этап проведения ПЦР-диагностики, суть которого заключается в следующем: врач забирает у пациента материал для исследования и подвергает его специальной обработке. В процессе обработки происходит расщепление двойной спирали ДНК на отдельные нити. В материал пациента добавляется специальная жидкость, растворяющая органические вещества, мешающие «чистоте» проведения реакции (табл. 3).
Варианты проведения амплификации и визуализации результатов ПЦР
Визуализации результатов ПЦР
ПЦР с последующим электрофоретическим анализом продуктов амплификации
ПЦР с последующей гибридизацией продуктов амплификации на стрипах
ПЦР с последующей гибридизацией продуктов амплификации на биологических микрочипах
ПЦР с определением специфического продукта по значению флуоресценции специфического зонда в конечной точке
ПЦР в режиме реального времени (получение результатов непосредственно во время прохождения реакции)
Выделение ДНК из диагностического материала, полученного от больных туберкулезом – сложный многоэтапный процесс, который может производится вручную или с использованием автоматов для выделения.
Амплификация ДНК. Для осуществления амплификации ДНК используются так называемые ДНК-матрицы — молекулы ДНК МБТ, на которые впоследствии будет происходить «клонирование» ДНК. Для проведения этого этапа достаточно небольшого кусочка молекулы ДНК, который присущ только МБТ. В большинстве тест-систем избран фрагмент ДНК IS6110, который в многочисленных штаммах МБТ имеет в геноме значительное число (10-20) повторов, что обеспечивает, наряду со специфичностью, высокую чувствительность анализа.
Все многочисленно повторяющиеся этапы амплификации происходят при различных температурах. Для проведения ПЦР-анализа используется специально программируемое оборудование – ПЦР–термостат или амплификатор, которое автоматически осуществляет смену температур. Амплификация проводится по заданной программе и составляет 2 часа.
В процессе детекции продуктов амплификации проходит разделение полученной смеси продуктов амплификации. К смеси добавляется специальные растворы, которые наделяют фрагменты ДНК способностью флюоресцировать — отражаться оранжево-красными светящимися полосами. Образующееся свечение выдает присутствие ДНК МБТв забранном у пациента на ПЦР-анализ материале.
Одной из инновационных технологий, основанных на ПЦРв режиме реального времени, является использование анализатора Xpert MTB/RIF (Cepheid, США). Этим оборудованием оснащены многие противотуберкулезные учреждения РФ. Она упрощает молекулярное тестирование, обеспечивая полную интеграцию и автоматизацию трех процессов (подготовка образца, амплификация и детекция), необходимых для молекулярного тестирования. Тест Xpert MTB/RIF имеет аналитическую чувствительность пяти геномных копий очищенных ДНКM. tuberculosis. Молекулярные маяки, которые нацелены на ген «rpoB», охватывают все мутации, обнаруженные в >99,5 % штаммов, устойчивых к рифампицину. Перекрестная реактивность с нетуберкулезными микобактериями отсутствует. ДНК МБТ, устойчивая к рифампицину выявляется в присутствии, как нетуберкулезных ДНК, так и в смешанных чувствительных и устойчивых штаммах. Образцы материала человека в основном могут быть взяты из мокроты, промывных вод бронхов, мочи, плеврального экссудата, ликвора. Итоговые результаты тестов предоставляются в графическом и табличном форматах (рис. 5). Xpert MTB/RIF позволяет сразу при подозрении у пациента туберкулеза взять у него мокроту и в течение двух часов определить есть ли у него МБТ и устойчивые ли они к самому эффективному противотуберкулезному препарату (рифампицин). Данная методика позволяет с первых дней назначить адекватную химиотерапию, и распределить потки поступающих больных в противотуберкулезный диспансер и направить в специализированные отделения (с лекарственно-устойчивым туберкулезом).
Рис. 5 Анализатора Xpert MTB/RIF . Подготовка образцов к проведению теста
При работе системы GeneXpert необходимы минимальное число ручных операций и специализированных знаний. Пользователь просто добавляет биологический образец для тестирования в картридж, ставит его на борт прибора, и система GeneXpert автоматически запускает цикл реакций (рис. 5). Прибор GeneXpert компактен и удобен, может быть установлен вне лаборатории. Малые размеры прибора и незначительные потребности в энергии позволяют системе работать практически в любом помещении. Настольный ПК или ноутбук используется для выполнения программного обеспечения и хранения базы данных, содержащей результаты работы системы GeneXpert. Программное обеспечение позволяет выбирать описания тестов, контролировать процесс тестирования, просматривать результаты теста и экспортировать данные для анализа в приложениях сторонних разработчиков. Программное обеспечение также используется для архивирования результатов, извлечения данных из архива и управления базой данных. Сканер штрих-кодов ускоряет ввод данных, а также снижает вероятность возникновения ошибки при вводе данных.
Дифференциация (типирование) микобактерий туберкулеза
Необходимо отличать микобактерии туберкулеза от сапрофитных микобактерий, которые определяются в 0,3-3% культур.
Кислотоустойчивые сапрофитные микобактерии можно выделить как из внешней среды, так и из материала здорового человека, а также и из патологического материала. Присутствие сапрофитных микобактерий в мокроте, слюне, промывных водах желудка и бронхов, моче, кале и т. д. может быть не связано с наличием заболевания и служить источником серьезных диагностических ошибок. Обнаружение кислотоустойчивых сапрофитов в мокроте больных может привести к ошибочному диагнозу туберкулеза.
Идентификация микобактерий по культуральным свойствам.При посеве на плотные питательные среды на основании скорости роста бактерий, морфологии и окраски колоний (пигментообразование) можно сделать предварительное заключение о принадлежности культуры либо к комплексу МБТ, либо к нетуберкулезных микобактерий (НТМБ). При культивировании МБТ на жидких питательных средах проводится тестирование на контаминацию (микроскопия культуры с окраской по Цилю-Нильсену и посев на кровяной агар) и затем молекулярно-генетическими методами подтверждается принадлежность к микобактериям туберкулезного комплекса;
Идентификация микобактерий с помощью биохимических тестов
Дифференциация микобактерий туберкулезного комплекса и нетуберкулезными видами микобактерий основана на их культуральных свойствах и способности к росту на дифференциально-диагностических средах. Наиболее часто применяемыми и общепринятыми тестами являются способность к росту на среде, содержащей 1000 мкг/мл натрия салициловокислого; к росту на среде, содержащей 500 мкг/мл паранитробензойной кислоты; к росту на среде, содержащей 5% хлорида натрия. Виды микобактерий туберкулезного комплекса не способны к росту на указанных питательных средах. Для дифференциации вида M.bovisот других видов туберкулезных микобактерий используют культуральный тест на способность к росту на среде, содержащей 2 мкг/мл гидразида тиофен-2 карбоксиловой кислоты. Среди всех представителей этой группы только указанный вид не дает роста на этой питательной среде.
Для контроля контаминации при культивировании на жидкой/плотной питательной среде проводят посев культур на чашки Петри с кровяным агаром. Наличие роста микроорганизмов через 24-72 часа инкубации при +37°С свидетельствует о контаминации материала посторонней микрофлорой.
Эти исследования являются достаточно длительными, трудоемкими и требуют дополнительных капиталовложений, материально-технической базы, надлежащих условий, обеспечивающих биологическую безопасность.
Идентификация микобактерий с помощью молекулярно-биологических методов
Методы видовой идентификации, основанные на выявлении генетических маркеров МБТ с помощью ПЦР, имеют преимущество в специфичности и быстроте анализа по сравнению с культуральными и биохимическими методами.
Молекулярные методы дифференциации МБТ от нетуберкулезных микобактерий основаны на выявлении видоспецифических структур в геноме или белковом спектре возбудителя. Одни методы направлены только на дифференцировку микобактерий туберкулезного комплекса от нетуберкулезных микобактерий, другие — пригодны для точной видовой идентификации возбудителя.
К методам, дифференцирующим микобактерий туберкулезного комплекса от нетуберкулезных микобактерий, относится ПЦР, выявляющая вставочную последовательность ДНКIS6110, присутствующую только у микобактерий туберкулезного комплекса.
Иммунохроматографический методидентификации выросших культур микроорганизмов (метод поддержан ВОЗ), основанный на определении наличияспецифического антигена МБТ МРТ64, отличается простотой выполнения и позволяет получить результат идентификации МБТ за 15 минут. Данный метод может быть рекомендован в качестве основного при проведении идентификации культур, выросших на жидких и/или плотных питательных средах, а также в контаминированных культуральных образцах.
Методики, обеспечивающие точную видовую идентификацию нетуберкулезных микобактрий, более трудоемки и требуют больших материальных затрат. К ним относится гибридизационные технологии на нейлоновых мембранах (ДНК-стрипы), позволяющие идентифицировать следующие виды нетуберкулезных микобактерий: M.avium ssp., M.chelonae, M.abscessus, M.fortuitum, M.gordonae, M.intracellular e, M.scrofulaceum, M.interjection, M.kansasii, M.malmoense, M.peregrinum, M.marinum, M.ulcerans, M.xenopi и M.simiae, M.mucogenicum, M.goodii, M.celatum, M.smegmatis, M.genavense, M.lentiflavum, M.heckeshornense, M.szulgai, M.intermedium, M.phlei, M.haemophilum, M.kansasii, M.ulcerans, M.gastri, M.asiaticumvL M.shimoidei. Этим методом можно исследовать культуры с плотной и жидкой питательных сред и получить результат в течение 1 -2 дней.
Идентификация МБ до вида может проводиться также с помощью секвенирования, MALDI-ToF масс-спектрометрии, высокоэффективной жидкостной хроматографии (ВЭЖХ), тонкослойной хроматографии, результаты которых основаны на выявлении уникальных для каждого видаМБ структур.
Определения лекарственной чувствительности МБТ к ПТП
Цель микробиологических методов исследования лекарственной чувствительности МБТ к ПТП состоит в том, чтобы определить отличается ли клинический изолят от «дикого» штамма МБТ по степени чувствительности к соответствующему антимикробному агенту. При оценке результата микробиологического исследования культура МБТ признаётся устойчивой, если микобактерии дают рост на питательной среде в присутствии критической концентрации заключённого в неё противотуберкулёзного препарата.
Методы определения лекарственной чувствительности МБТ к ПТП
Метод абсолютных концентраций на плотной
среде Левенштейна-Йенсена. Регистрация МБТ:
– по нитратредуктазной активности МБТ.
Метод пропорций на жидких питательных средах
с автоматизированным учетом роста типа
ПЦР в режиме реального времени,
бБиочиповая, стриповая, картриджная технологии
Метод абсолютных концентраций на плотной питательной среде Левенштейна-Йенсена, основанный на добавлении в культуральную среду определенных стандартных концентраций противотуберкулезных препаратов, которые принято называть критическими при расчете на мкг/мл. Критическая концентрация – это самая низкая концентрация, которая подавляет рост 95% «диких» штаммов МБТ. Для каждой среды или системы культивирования подобраны соответствующие критические концентрации препаратов. Культура МБТ считается чувствительной к той или иной концентрации противотуберкулезного препарата, которая содержится в среде, если число колоний МБТ, выросших в одной пробирке с тем или иным ПТП, не превышает 20, а посевная доза соответствует 10 7 микробных тел.
Модифицированный метод пропорций в жидкой питательной среде в системе с автоматизированным учетом роста микроорганизмов типа BACTEC MGIT 960. В процессе определения происходит сравнение скорости роста МБТ — в контрольной пробирке и в пробирках с лекарственными препаратами. В первую пробирку не вносится лекарственный препарат — контрольную, в остальные пробирки добавляются известные концентрации тестируемых лекарственных препаратов, рост в которых сравнивается с ростом в контрольной пробирке.
Если тестируемый лекарственный препарат активен по отношению к выделенным МБТ, он будет ингибировать рост и подавлять флюоресценцию, при этом в контрольной пробирке рост не ингибируется и, соответственно, уровень флюоресцентности в данной пробирке будет выраженный. Мониторинг роста осуществляется при помощи прибора BACTEC MGIT 960/320, который автоматический интерпретирует результаты на наличие чувствительности или резистентности МБТ к препарату.
На плотной питательной среде Левенштейна-Йенсена проводят определение ЛЧ МБТ методом абсолютных концентраций к ПТП первого ряда (стрептомицин, изониазид, рифампицин, этамбутол) и к ПТП второго ряда (канамицин, капреомицин, циклосерин, офлоксацин, этионамид, аминосалициловая кислота, амикацин).
На жидких питательных средах проводят определение ЛЧ МБТ к ПТП первого ряда (изониазид, рифампицин, этамбутол, стрептомицин, пиразинамид) и к ПТП второго ряда (амикацин, канамицин, офлоксацин, левофлоксацин, моксифлоксацин, этионамид, протионамид, капреомицин, аминосалициловая кислота, линезолид).
Молекулярно-генетические методы определения лекарственной чувствительности/устойчивости МБТ
Генотипические методы определения лекарственной чувствительности/устойчивости МБТ основаны на изучении специфических участков генома МБТ и выявлении наличия или отсутствия определенных мутаций в генах, связанных с резистентностью к конкретным ПТП. При этом исследованию могут подвергаться как диагностический материал, так и выросшие культуры микроорганизмов.
Основным достоинством молекулярно-генетических является быстрое и достоверное выявление больных МЛУ ТБ, так как они позволяют выявить ЛУ МБТ к рифампицину и изониазиду, а также к важнейшим препаратам второго ряда, позволяя использовать разделение потоков больных и включать в режим лечения наиболее эффективные препараты.
Молекулярно-генетические тест-системы определения лекарственной устойчивости микобактерий туберкулеза представлены тремя основными технологиями:
Гибридизационные технологии, основанные на гибридизации продуктов ПЦР со специфическими олигонуклеотидами, иммобилизированными на матрице, которая может представлять собой биологический микрочип, или ДНК-стрип. Гибридизационные технологии позволяют в культуре с плотной или жидкой среды или непосредственно в мокроте, положительной по результатам микроскопического исследования, в течение 1-2 дней выявлять наиболее распространенные мутации в генах МБТ, связанных с устойчивостью к основным ПТП первого ряда — изониазиду и рифампицину и некоторым ПТП второго ряда (в зависимости от тест-системы). Данная группа методов основана на том, что амплифицированные в результате ПЦР целевые последовательности гибридизуются с зондами, нанесенными на соответствующую матрицу. По результатам гибридизации делается вывод о наличии мутаций, влекущих устойчивость к ПТП.
Мультиплексная ПЦР в режиме реального времени. Метод ПЦР в режиме реального времени позволяет определять мутации, ассоциированные с ЛУ к рифампицину, изониазиду. Преимуществом данного метода перед описанными выше является отсутствие этапа гибридизации и оценка результатов в режиме реального времени, что позволяет снизить возможность кросс-контаминации образцов. Однако, для получения информации, сравнимой с гибридизационными технологиями, необходимо проведение большего числа циклов анализа. Использование зарегистрированных наборов позволяет с высокой чувствительностью и специфичностью (94 % и 99 %, соответственно) выявлять мутации в генах rpoB, katG и inhA, ассоциирующиеся с устойчивостью к рифампицину и изониазиду.
«Картриджная» технология (выделение ДНК и амплификация идут автоматически в специальном картридже в системе GeneXpert).
Использование этой системы позволяет непосредственно из нативной мокроты в очень короткие сроки (в течение 2,5 часов) одновременно проводить выявление ДНК МБТ и с высокой достоверностью определять устойчивость к рифампицину.
Классификация лекарственной устойчивости МБТ
Первичная лекарственная резистентность – это устойчивость МБТ к ПТП, которая обнаружена у впервые выявленных больных, которые никогда не принимали противотуберкулезную терапию.
Вторичная лекарственная устойчивость (приобретенная) – резистентность МБТ, которая обнаружена у больных, которые принимали ПТП больше 4 недель. Лекарственная устойчивость классифицируется как:
Монорезистентность – устойчивость только к одному ПТП.
Полирезистентность – устойчивость к двум и ПТП, но не к сочетанию изониазида и рифампицина.
Устойчивость к рифампицину – лекарственная устойчивость МБТ к рифампицину независимо от лекарственной устойчивости к другим противотуберкулезным препаратам, определенная любым методом тестирования лекарственной чувствительности.
Множественная лекарственная устойчивость (МЛУ) – устойчивость к сочетанию изониазида и рифампицина независимо от наличия устойчивости к другим противотуберкулезным препаратам.
Широкая лекарственная устойчивость (ШЛУ) – сочетанная устойчивость к изониазиду, рифампицину, фторхинолону и канамицину и/или амикацину и/или капреомицину независимо от наличия устойчивости к другим противотуберкулезным препаратам.
Причины лекарственной устойчивости:
1) биологические – недостаточная концентрация препарата в очаге туберкулезной инфекции, индивидуальные особенности организма пациента (быстрая скорость инактивации препаратов);
2) причины, обусловленные пациентом – контакт с больными резистентным туберкулезом, отсутствие приверженности лечению (нерегулярный прием препаратов, неосознания важности лечения, преждевременное прекращение приема ПТП), неудовлетворительная переносимость препаратов, в том числе и сопутствующая патология, требующая приостановления (коррекция) противотуберкулезной терапии;
3) факторы, обусловленные течением заболевания – распространенный, быстропрогрессирующий деструктивный процесс;
4) факторы, обусловленные назначенным лечением – неадекватная схема лечения, лечение одним препаратом (монотерапия), недостаточная доза или длительность лечения, использования препаратов с перекрестной стойкостью, использование ПТП низкого качества, где доза препарата не соответствует заявленной.
источник
Забор мокроты проводится после провоцирующей отделение мокроты ингаляции. Для ингаляции рекомендуется использовать раствор, в 1 литре стерильной дистиллированной воды которого содержится 150 гр. NaCl и 10 гр Na2CO3 (двууглекислый натрий). Больной вдыхает за процедуру 30-60 мл данной смеси в течение 10-15 минут. После ингаляции усиливается отделение слюны еще до появления кашля, поэтому первую порцию слюны предлагается больному сплюнуть в специальный лоток с хлорамином, а затем собирать мокроту.
Забор промывных вод бронхов.
Промывные воды бронхов забираются у пациентов при отсутствии мокроты, невозможности проведения аэрозольной ингаляции или при безуспешности их.
Забор промывных вод бронхов осуществляет врач-отоларинголог или они забираются при проведении бронхоскопии. При этом во время вдоха вводят в трахею 5-7 мл стерильного изотонического раствора, в результате вызывается кашлевой рефлекс, и промывные воды бронхов собираются в стерильный флакон. У лиц с выраженным глоточным рефлексом при проведении процедуры рекомендуется предварительная анестезия надгортанника, гортани, задней стенки глотки.
Забор промывных вод желудка:
— промывные воды желудка забираются у детей младшего возраста, так как они плохо откашливают мокроту и проглатывают ее;
— мокрота забирается натощак, последний прием пищи должен быть не меньше, чем за 12 часов до взятия промывных вод желудка;
— больному дают выпить 100-150 мл раствора питьевой соды для нейтрализации желудочного содержимого. Для приготовления раствора питьевой соды берут 1 чайную ложку соды на 1 стакан стерильной дистиллированной, а не водопроводной воды, для исключения попадания в желудок кислотоустойчивых сапрофитов;
— больному вводят в желудок желудочный зонд и собирают содержимое желудка в специальный стерильный флакон, который быстро доставляют в лабораторию.
Имеются данные, что наиболее результативен в выявлении МБТ метод, включающий сочетание аэрозольных ингаляций с промывными водами желудка, которые должны забираться через 30 минут после ингаляции. В этом случае повышается процент положительных результатов выявления МБТ.
Забор операционного материала осуществляется в стерильные флаконы без консервантов с немедленной доставкой в лабораторию. Возможно хранение в холодильнике при температуре 4-10°С с небольшим количеством стерильного физиологического раствора или сухим льдом при невозможности быстрой доставки.
Забор анализа мочи на МБТ:
— забирается средняя утренняя порция мочи или вся утренняя порция с последующей доставкой в бактериологическую лабораторию;
— при невозможности быстрой доставки материал не должен храниться в холодильнике больше 48-72 часов, если больше, то добавляются консерванты: 2-3% раствор борной кислоты (срок хранения до 3 суток при комнатной температуре), 0,05-0,1% раствор хлоргексидина биглюконата (срок хранения 3-5 суток).
К микробиологическим методам диагностики туберкулеза относят:
4) молекулярно-биологический метод.
Из перечисленных выше, самым чувствительным методом выявления МБТ является биологический метод, его чувствительность составляет 1-5 микробных тел в 1мл исследуемого материала; на 2 месте — бактериологический метод (чувствительность — 20-100 микробных тел в 1 мл); на 3 месте – бактериоскопический метод (чувствительность более 100 тыс. и более микробных тел в 1 мл). Золотым стандартом выявления больных туберкулезом является сочетание бактериоскопического и бактериологического методов. Биологический метод более дорогой и используется в трудных диагностических случаях.
Разновидностями бактериоскопического метода являются:
— простая бактериоскопия с окраской по Цилю-Нильсену: вначале препарат обрабатывают карболовым раствором фуксина, затем обесцвечивают 5% раствором серной кислоты или 3% раствором солянокислого спирта и докрашивают 0,25% раствором метиленового синего. МБТ выглядят под микроскопом в виде красных палочек на синем фоне (приложение 2, рис. 2);
— люминесцентная микроскопия с применением флюорохромов: аурамин 00, родамин С и другие. Под люминесцентным микроскопом МБТ выглядят в виде желто-зеленых светящихся палочек на черном фоне. При использовании люминесцентной микроскопии информативность метода повышается на 30% (приложение 2, рис.3).
— метод седиментации, метод флотации повышают информативность микроскопического метода на 10%.
Бактериологический (культуральный) метод заключается в посеве мокроты на питательные среды. Стандартной питательной средой для выращивания МБТ служит твердая яичная среда Левенштейна- Йенсена. Существуют так же жидкие питательные среды (система ВАСТЕТ 460 ТВ и др.). Посевы длительно выдерживают в термостате при температуре 37-38°С. Рост колоний на твердых питательных средах происходит за 14-90 дней, на жидких -3-14 дней. Для МБТ человеческого и бычьего видов характерно образование плотных морщинистых колоний кремового цвета (приложение 2, рис. 4).
Преимущества данного метода:
— данным методом можно определить жизнеспособность культуры (способность размножаться, способность к образованию и росту колоний). Если микобактерии туберкулеза выявляются при простой микроскопии, но при посеве роста колоний не наблюдается, то это нежизнеспособные МБТ (образно говоря «микобактерии туберкулеза-трупы»);
— можно определить степень вирулентности МБТ. Быстрорастущие колонии МБТ, это, как правило, более вирулентная культура;
— можно дать количественную характеристику бактериовыделения. Если у больного выявляется при посеве от 1-20 колоний, то это свидетельствует о скудном бактериовыделении; от 21 до 100 колоний — умеренное бактериовыделение; более 100 колоний – обильное бактериовыделение.
Пациенты с обильным бактериовыделением более опасны для окружающих в плане заражения;
— можно определить чувствительность МБТ к противотуберкулезным препаратам и выявить лекарственную устойчивость. Основными методами определения лекарственной чувствительности МБТ являются методы абсолютных концентраций (применяется в России) и пропорций (применяется за рубежом). По своей информативности они равноценны. У больных туберкулезом можно выявить следующие виды лекарственной устойчивости МБТ к применяемым противотуберкулезным препаратам:
1) первичная лекарственная устойчивость – если больной вообще не принимал противотуберкулезные препараты или принимал их менее 3 недель, то есть он заразился изначально лекарственно-устойчивыми штаммами МБТ. Первичная лекарственная устойчивость характеризует состояние микобактериальной популяции на данной территории и важна для эпидемической характеристики заболеваемости;
2) вторичная лекарственная устойчивость – если больной принимал противотуберкулезные препараты более 3 недель и лекарственная устойчивость у него сформировалась в результате неэффективной и неадекватной химиотерапии;
3) множественная лекарственная устойчивость – если выявляется устойчивость как минимум к сочетанию изониазида и рифампицина, независимо от наличия или отсутствия лекарственной устойчивости к другим препаратам;
4) поливалентная лекарственная устойчивость- выявление лекарственной устойчивости к препаратам основной группы и резервным;
5) монорезистентность — выявление устойчивости к одному препарату;
6) перекрестная лекарственная устойчивость – выявление лекарственной устойчивости к препаратам одной группы по происхождению (например, группа аминогликозиды: стрептомицин, канамицин).
Важно отметить, что в последние годы отмечается рост лекарственноустойчивых форм туберкулеза среди взрослого населения.
В настоящее время за рубежом и в последние годы в России для выявления живых МБТ применяется радиометрическая система ВАСТЕТ. МБТ культивируют в жидкой питательной среде, где в качестве источника углерода используется меченая 14С пальмитиновая кислота. Преимуществом новой микробиологической методики является возможность быстрого получения результата исследования – через 12-24 дня. К недостаткам этого метода, ограничивающим возможность его широкого применения, относятся:
— высокая себестоимость исследования;
— необходимость применения радиоактивных изотопов и специального радиометрического оборудования, сложность работы с изотопной технологией;
— необходимость дополнительного посева на плотную питательную среду при возникновении проблем с идентификацией возбудителя или интерпретации результатов. Данная методика не дает качественной характеристики возбудителя и не позволяет определить лекарственную чувствительность возбудителя.
Биологический метод заключается в заражении морских свинок мокротой или другим патологическим материалом, предварительно обработанным серной кислотой для уничтожения неспецифической микрофлоры. Исследуемый материал вводится подкожно в паховую область, яичко, внутрибрюшинно. Ежедневно животному вводится кортизон для снижения иммунитета. При положительном результате через 1 месяц у животного формируется генерализованный туберкулез, животное забивают и выделенные органы исследуют макроскопически, гистологически и бактериологически. Биологический метод применяется для выявления не только типичных, но и биологически измененных форм возбудителя, в частности L- трансформированных и фильтрующихся форм.
Иммуноферментный анализ. Впервые его применил для выявления противотуберкулезных антител Е. Nassau в 1976 году. Он использовал в качестве антигена фильтрат M. tuberculosis H37Rv. Преимуществами данного метода являются:
— высокая производительность метода;
— простота в проведении анализа и регистрации результатов;
-возможность использования микроколичества диагностического
— более безопасен и экономичен по сравнению с радиоиммунологическим
— специфичность метода (частота отсутствия реакции на препарат у здоро
вых лиц) колеблется от 86-97%, чувствительность метода (частота положи
тельных ответных реакций у лиц с активной туберкулезной инфекцией) —
Молекулярно-генетические методы обнаружения М. tuberculosis основаны на полимеразной цепной реакции (ПЦР). Метод известен с 1985 года и сущность его состоит в выявлении в составе биологического материала фрагментов цепи ДНК или РНК, специфических для данного возбудителя. Для поиска возбудителя используют различный патологический материал (мокроту, промывные воды трахеи, бронхов, плевральную, спинномозговую жидкость и другие объекты). Принцип метода состоит в циклическом повторении трех стадий реакции:
1) денатурации ДНК при нагревании;
2) гибридизации искусственно синтезированных олигонуклеотидов с фланговыми участками цепей амплифицируемого фрагмента ДНК (так называемых «праймеров» или «затравочных» фрагментов);
3) синтеза (достройки) цепи фрагмента ДНК с помощью термостабильной ДНК-полимеразы. Многократное удвоение цепей ДНК (30-40 циклов) позволяет в течение нескольких часов умножить (амплифицировать) специальный участок ДНК в геометрической прогрессии, а затем идентифицировать его (при электрофорезе в агарозном геле в присутствии красителя этидия бромида синтезированный фрагмент ДНК выявляется в виде светящейся под действием ультрафиолета полосы).
— метод обладает высокой чувствительностью (теоретически можно определять единичные М. tuberculosis в образце). По сравнению с культуральными методами, при обследовании больных туберкулезом методом ПЦР число положительных результатов увеличивается на 50-70%.
— быстрота проведения анализа (1-2 дня), что чрезвычайно ценно для клинической практики.
— данный метод позволяет значительно улучшить распознавание этиологии патологического процесса у пациентов без выделения микобактерий.
— информативен при дифференциальной диагностике туберкулезного плеврита, менингита, мочеполового туберкулеза.
— эффективен в отношении возбудителей с высокой антигенной изменчивостью (в том числе L-форм), определение которых требует длительного культивирования и сложных питательных сред.
— перспективен при дифференциации М. tuberculosis и нетуберкулезных микобактерий (в том числе и после культивирования микобактерий, особенно на жидких питательных средах с использованием систем типа BACTEC).
— перспективен для быстрого определения лекарственной устойчивости и, следовательно, необходим для своевременной коррекции лечения (Gene Xpert MTB/RIF (R ) – получение результата через 90 мин, ТБ –Биочип ( HR Fq) — 24 ч, ДНК – стриповый Hain Lifescience ( HRE Fq Am/Сm)- 5ч).
— имеется возможность штаммовой идентификации, что позволяет определять внутривидовые различия возбудителя туберкулеза и представляет интерес для эпидемиологических исследований и определения роли суперинфекции при рецидивах туберкулеза.
— проблема специфичности ПЦР в диагностике туберкулеза обусловлена высоким риском ложноположительных результатов, поскольку продукты амплификации (фрагменты ДНК) легко могут попасть в исследуемые образцы и служить матрицей для новых реакций. Это определяет очень жесткие требования к технологии проведения анализов, в том числе раздельные помещения для каждой из трех стадий анализа. Проблема может быть решена за счет инактивации загрязняющих молекул специальными реагентами и совершенствования технологии подготовки клинических образцов (выделение ДНК на микропористых частицах стекла, иммуномагнитная сепарация микобактериий и пр.
— метод не позволяет определять степень жизнеспособности выявляемых микобактерий.
В связи с этим, использование методов, основанных на амплификации фрагментов генома микобактерий (ПЦР), допускается в России как дополнительный метод ускоренной дифференциальной диагностики туберкулеза для получения ориентировочных результатов при обязательном параллельном применении классических микробиологических методов.
Молекулярно-биологические методы могут проводиться в лабораториях краевых, областных и крупных городских противотуберкулезных учреждений, использующих учрежденные Минздравом России наборы реагентов (тест-системы) и имеющих лицензию на работу с микроорганизмами III-IV групп патогенности. Технология проведения ПЦР приводится в описаниях и инструкциях соответствующих наборов (тест-систем).
источник
Особенности проведения промывания желудка у пациента в бессознательном состоянии.
1. Толстый стерильный желудочный зонд диаметром 10-15 мм, длиной – 100-120 см с метками на расстоянии 45, 55, 65 см от слепого конца – 1 шт.
2. Резиновая трубка длиной 70 см (для удлинения зонда) и стеклянная соединительная трубка диаметром не менее 8 мм – по 1 шт.
3. Воронка емкостью 1 л – 1 шт.
7. Антисептик – 1 разовая доза для обработки рук.
10. Фартук клеенчатый для пациента и медицинского работника – 2 шт.
11. Марлевая салфетка, смоченная дезсредством – 1 шт.
12. Перчатки нестерильные – 1 пара.
13. Емкость для промывных вод – 1 шт.
14. Емкость для отправки промывных вод в лабораторию – 2 шт.
15. Ведро с чистой водой комнатной температуры объёмом 10 л – 1 шт.
17. Жидкое мыло – при отсутствии антисептика для обработки рук.
18. Диспенсер с одноразовым полотенцем.
Алгоритм действий
Подготовка к процедуре:
1. Измерить артериальное давление, подсчитать пульс.
2. Снять зубные протезы у пациента (если они есть).
3. Медицинскому работнику надеть перчатки, фартук.
4. Поставить таз к головному концу кушетки.
5. Измерить шёлковой нитью расстояние от резцов до пупка плюс ширина ладони пациента.
6. Перенести метку на зонд, начиная от закруглённого конца.
7. Взять зонд в правую руку как «писчее перо» на расстоянии 10 см от закруглённого конца.
Выполнение процедуры:
7. Встать сбоку от пациента
8. Уложить пациента на левый бок, подстелив клеенку.
9. Раскрыть рот и зафиксировать его роторасширителем.
10. Захватить и зафиксировать язык языкодержателем.
11. Ввести пациенту зонд, проталкивая его по задней стенке глотки в пищевод и желудок.
12. Убедиться, что зонд не попал в дыхательные пути: к наружному концу зонда поднести несколько волокон ваты или тонкое перышко. Их колебание означает, что зонд находится в дыхательных путях.
13. Присоединить к зонду воронку, заполнить ее водой, держа на уровне кровати.
14. Поднять воронку выше головы пациента.
15. Как только вода достигнет устья воронки, быстро опустить воронку ниже уровня желудка, чтобы содержимое желудка наполнило воронку полностью.
16. Осторожно вылить содержимое воронки в таз для промывных вод.
17. Повторить промывание несколько раз до чистых промывных вод.
Окончание процедуры:
18. Воронку снять, конец зонда опустить в таз на 15-20 минут.
19. Зонд извлечь через салфетку, смоченную дезинфицирующим средством, предварительно пережав его непосредственно перед ртом пациента.
20. Поместить зонд, воронку в контейнер с дезинфицирующим средством, салфетку в контейнер с отходами класса Б.
21. Обработать полость рта пациента, обтереть полотенцем вокруг.
22. Пациента тепло укрыть, наблюдать за состоянием.
23. Снять перчатки, положить в ёмкость с дезинфицирующим раствором.
24. Вымыть руки, обработать антисептиком или мылом.
25. Написать направление и отправить емкости с промывными водами в лабораторию.
26. Сделать запись о проведении процедуры и реакции на нее пациента.
Техника получения промывных вод желудка.
1. При помощи шприца Жанэ ввести в желудок 0,5 л воды.
2. Потянуть поршень шприца на себя, аспирируя введенную воду.
3. Вновь ввести эту же порцию жидкости в желудок.
4. Вновь потянуть поршень шприца на себя, аспирируя введенную воду.
5. Вылить промывные воды в количестве 20 – 50 мл в стерильную емкость для промывных вод.
6. Повторить забор промывных вод в конце процедуры промывания желудка.
8. Обе стерильные ёмкости отправляют в лабораторию с соответствующим направлением.
Примечание.При подозрении на отравление прижигающими ядами сразу же берут первую порцию промывных вод (п.3 и п.4 не выполняются).
5. Помощь пациенту при рвоте.
1. Предотвратить развитие асфиксии от попадания рвотных масс в дыхательные пути.
2.Облегчить страдания пациента.
Показания: тошнота, начавшаяся рвота.
2. Клеенчатый фартук – 1 шт.
4. Марлевая салфетка – 4 — 6 шт.
5. Раствор для полоскания полости рта ( стакан кипячёной воды, или 2 раствор натрия гидрокарбоната, или 3 раствор перекиси водорода – 1 столовая ложка на стакан воды, иди слабо солёный раствор) ,
6. Электроотсос или грушевидный баллончик – 1 шт.
7. При необходимости – ёмкость для отправления рвотных масс в лабораторию – 1 шт.
9. Шпатель, обёрнутый бинтом – 1 шт.
Помощь пациенту при рвоте, находящемуся на полупостельном режиме:
Алгоритм действий
Подготовка к процедуре:
3. Если у пациента есть зубные протезы, их следует снять.
4. Усадить пациента на стул со спинкой, встать справа от него.
5. Быстро надеть на него клеенчатый фартук.
6. Слегка наклонить вперед туловище и голову пациента, развести его колени и поставить к ногам таз, в который опустить свободный конец фартука.
Выполнение процедуры:
7. Придерживать голову пациента во время акта рвоты, положив на лоб свою правую ладонь, а левой рукой держать левое плечо пациента.
8. Полоскать полость рта после каждого акта рвоты.
Окончание процедуры:
9. Вытереть лицо пациента салфеткой.
10. Уложить в постель и создать покой.
11. Необходимо установить наблюдение за пациентами: контроль артериального давления, пульса, частоты дыхательных движений, частоты сердечных сокращений, внешнего вида.
12. Оставить рвотные массы до прихода врача; собрав по его назначению в сухую стеклянную банку с плотно закрывающейся крышкой в количестве 50-60 мл, отправить в лабораторию.
13. К краю кровати поставить чистый таз, матрац прикрыть клеенкой на случай повторной рвоты.
Помощь при рвоте пациенту, находящемуся на постельном режиме в активном положении:
Алгоритм действий
Подготовка к процедуре:
3. Если у пациента есть зубные протезы, их следует снять.
4. Убрать подушки, прикрыть матрац клеенкой, а сверху пеленкой.
5. Поставить таз к краю кровати, повернуть пациента на бок, помочь наклониться над тазом.
Выполнение процедуры:
6. Поддерживать голову пациента при рвотных движениях.
Окончание процедуры:
7. После рвоты дать прополоскать рот, обтереть лицо пациента.
8. Уложить в постель и создать покой.
9. Необходимо установить наблюдение за пациентом: контроль артериального давления, пульса, частоты дыхательных движений, частоты сердечных сокращений, внешнего вида.
10. Оставить рвотные массы до прихода врача; собрав по его назначению в сухую стеклянную банку с плотно закрывающейся крышкой в количестве 50-60 мл, отправить в лабораторию.
11. К краю кровати поставить чистый таз, при необходимости сменить постельное и нательное бельё.
Помощь при рвоте пациенту, находящемуся на постельном режиме в пассивном положении или без сознания:
Алгоритм действий
Подготовка к процедуре:
3. Если у пациента есть зубные протезы, их следует снять.
4. Убрать подушки, повернуть голову пациента на бок.
5. Матрац прикрыть клеёнкой так, чтобы она подходила и под голову пациента
6. Прикрыть клеёнку пелёнкой так, чтобы она обязательно заходила под ухо пациента во избежание затекания рвотных масс в слуховой проход.
7. Поставить ко рту почкообразный лоток.
8. При необходимости разомкнуть челюсти пациента шпателем, обернутым бинтом, вводя его в горизонтальном положении между малыми коренными зубами.
9. С помощью роторасширителя зафиксировать челюсти в разведенном состоянии.
Выполнение процедуры:
10. Поддерживать голову пациента во время рвотных движений.
Окончание процедуры:
11.После рвоты освободить полость рта от остатков рвотных масс, подсасывая их баллончиком, или очищая рот пальцем, обёрнутым марлей, или шпателем, обёрнутым марлей.
11. Провести орошение полости рта одним из антисептиков из резинового баллончика.
12. Обтереть лицо пациента влажной салфеткой, при необходимости сменить бельё.
13. Уложить в постель и создать покой.
14. Необходимо установить наблюдение за пациентом: контроль артериального давления, пульса, частоты дыхательных движений, частоты сердечных сокращений, внешнего вида.
15. Оставить рвотные массы до прихода врача; собрав по его назначению в сухую стеклянную банку с плотно закрывающейся крышкой в количестве 50-60 мл, отправить в лабораторию.
Тема: 5.9. Медикаментозное лечение в сестринской практике.
Дата добавления: 2014-12-17 ; Просмотров: 7935 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник

