Сухой остаток является одним из основных критериев определения качества воды, который выявляет степень ее минерализации. Для определения типа воды используется ионно-солевой остаток.
В качестве основных ионов, благодаря которым можно определить сухой остаток, выступают: сульфаты, хлориды, карбонаты, нитраты, бикарбонаты. Существует их подразделение на органические и минеральные остатки, которые отличаются температурами кипения. Сухой остаток подразумевает наличие в воде растворенных нелетучих твердых веществ. Существует специальная методика его вычисления.
С его помощью осуществляется определение сухого остатка в исследуемой пробе. Для проведения подобного исследования необходимо провести фильтрование пробы, отделить ее от органических примесей.
Воду используют почти во всех отраслях современного производства. Например, в косметической промышленности ее используют в качестве питьевой воды, как сырье для создания полуфабрикатов, как вещество для мытья промышленной тары.
Именно с водой связаны органолептические показатели продукции, выпускаемые на предприятии: стабильность, запах, вкус, цвет. К примеру, внешний вид и вкус сиропов напрямую связаны с минеральными веществами, содержащимися в воде. Если сухой остаток содержит хлорид натрия, в таком случае вода приобретает некоторый соленый вкус.
Существуют определенные нормативы, которым должна соответствовать вода. Если содержание сухого остатка им не удовлетворяет, в таком случае ее нельзя использовать. Существуют специальные физико-химические лаборатории, которые оснащены специальными измерительными приборами.
В них массовая доля сухого остатка определяется по ГОСТу «Вода питьевая» 18164-72. Используют воду в производстве лишь после того, как будет проведен полный контроль ее на соответствие всем показателям качества.
Если в ходе исследований будут выявлены несоответствия по каким-либо показателям, необходимо составить протокол о несоответствии, выполняют необходимые корректирующие мероприятия.
Существует несколько методик, позволяющих определять сухой остаток. ГОСТ допускает процедуру с добавлением соды либо с использованием соли. Рассмотрим оба варианта более подробно.
В первом случае происходит выпаривание пробы с использованием водяной бани. Сначала емкость, которую будут использовать для выпаривания, высушивают до получения постоянной массы. Далее в фарфоровую емкость наливают отфильтрованную воду. После завершения выпаривания последней пробы, чашка высушивается в термостате до постоянной массы при температуре.
Для определения сухого остатка используется специальная формула. Она связывает между собой массу пустой емкости, с сухим остатком, а также количество воды, которая взята для исследования.
Применение этого метода приводит к получению завышенных результатов. Подобная ситуация объясняется повышенной гигроскопичностью, а также протеканием гидролиза хлорида кальция и магния, сложностью передачи воды сульфатами кальция и магния.
Для устранения подобного недостатка осуществляется добавление к испытуемому образцу чистого карбоната натрия. В процессе добавления хлоридов кальция и магния происходит их переход в безводные карбонаты. Для полного удаления кристаллизационной воды, выполняют сушку полученного сухого остатка при повышенной температуре до тех пор, пока не будет получена постоянная масса в термостате.
Данный вариант предполагает предварительное фильтрование воды с применением бумажного фильтра. После высушивания пробы до получения постоянной массы, чашку нужно поставить на водяную баню. Здесь проводится выпаривание проб воды, отобранных для анализа. Как только будет внесена последняя порция воды, вносят пипеткой раствор углекислого газа. Учитывая, что вес взятой соды относится к массе сухого остатка как 2 к 1, проводят математические расчеты.
Чтобы проводить дальнейшее выпаривание, необходимо перемешивать пробу, разрушая при этом образующуюся корку. Для перемешивания применяют стеклянную палочку. Далее обмывают дистиллированной водой палочку. Потом образующийся сухой остаток с содой в чашке размещают в термостате, сушат его при температуре порядка 150 градусов по Цельсию до получения постоянной массы.
Средняя продолжительность выпаривания составляет от двух до пяти часов. Определяют разность по весу между емкостью образованного осадка и начальным весом чашки и соды. Данная разность определяет количество сухого остатка в определяемом количестве воды. Определяют сухой остаток по формуле, связывающей массу пустой емкости, добавленной соды, а также объем воды, выбранный для анализа.
Данный анализ с гигиенической точки зрения заключается в том, что можно провести технически корректировку анализируемой воды, воспользовавшись системами фильтрации, понижая при этом степень минерализации.
Вкус считается сбалансированным, если в воде общее содержание соли составляет 600 мг на один литр. Если в ней содержится больше 1 г/л, она считается непригодной для питья, поскольку обладает горько-соленым вкусом.
Если постоянно употреблять такую воду, в организме могут возникнуть серьезные физиологические проблемы. В первую очередь происходит усиление моторной и секретной функции кишечника и желудка, при повышенной температуре организм перегревается.
источник
Анализ проб сточных вод сухой остаток.
Сухой остаток —это масса остатка, получаемого выпариванием профильтрованной пробы сточной воды и высушиванием при 103—105 °С или 178—182 °С. Величина эта должна выражать суммарное количество растворенных в пробе веществ, неорганических и органических. Получаемые результаты, однако, удовлетворяют этому требованию лишь приближенно, при какой бы из указанных двух температур ни проводилось высушивание остатка.
Если остаток высушивали при 103—105 °С, то в нем сохранится вся или почти вся кристаллизационная вода солей, образующих кристаллогидраты, а также частично и окклюдированная вода. С другой стороны, при выпаривании и высушивании удаляются все летучие с водяным паром органические вещества, растворенные газы, а также СОг из гидрокарбонатов, которые при этом превратятся в карбонаты.
Если остаток высушивали при 178—182 °С, то окклюдированная вода будет удалена полностью. Кристаллизационная вода также удалится, но некоторое количество может остаться, особенно, когда в пробе присутствуют преимущественно сульфаты. Гидрокарбонаты превратятся в карбонаты, но последние могут частично разложиться . Может произойти незначительная потеря нитратов. Органические вещества теряются в большей мере, чем в первом случае.
Высушивание при 178—182 °С следует предпочесть при анализе вод, содержащих преимущественно неорганические соли, так как тогда получаемый результат приближается в большей мере к сумме результатов отдельных определений катионов и анионов в пробе.
Ход определения. В прокаленную, охлажденную и взвешенную фарфоровую или кварцевую чашку помещают 50—250 мл анализируемой сточной воды, предварительно профильтрованной. Воду выпаривают на водяной бане досуха. Затем переносят чашку с остатком в сушильный шкаф и высушивают при 103—105 °С или 178—182 °С до постоянной массы.
Расчет. Содержание сухого остатка (х) в мг/л вычисляют по формуле
где а — масса чашки с сухим остатком, мг; b — масса пустой чашки, мг; V — объем анализируемой сточной воды, мл.
Анализ проб сточных вод прокаленный остаток.
Проводя анализ проб сточных вод иногда требуется определить их прокаленный остаток. Цель этого определения -получить приближенное представление о содержании органических и неорганических веществ в пробе: при прокаливании органические вещества удаляются, неорганические остаются. Анализ проб сточных вод на прокаленный остаток выполняют следующим образом: чашку с сухим остатком помещают в муфельную печь, предварительно разогретую, и прокаливают при 500С 15-20 минут. После полного охлаждения чашку взвешивают. Прокаливание повторяют до достижения постоянной массы. Рассчитывают результат по той же формуле, что и при определении сухого остатка.
Расчет. Содержание прокаленного остатка(х) в мг/л вычисляют по формуле
где а-масса чашки с прокаленным остатком, мг; b-масса пустой чашки, мг;
V-объем анализируемой сточной воды, мл.
Анализ проб сточных вод пенистость.
Пенистость-это способность сохранять искусственно созданную пену на поверхности исследуемой пробы, можно использовать для качественной оценки присутствия таких веществ, как сапонины и сапонаты натурального и искусственного происхождения. Анализ проб сточных вод на пенистость проводят следующим образом: пробу воды 500мл вливают в колбу вместимостью 1 л с притертой пробкой, затем колбу закрывают и интенсивно взбалтывают 30с. Результат определения расценивают как положительный в том случае, если пена, образовавшаяся при взбалтывании пробы, сохраняется на поверхности в колбе больше 1 минуты. Значение pH пробы при определении должно быть в пределах 6,5-8,5.
Химический анализ сточных вод на щелочность.
Щелочностью называют содержание в воде веществ, вступающих в реакцию с сильными кислотами. К этим веществам относят: сильные основания, полностью диссоциирующие в разбавленных растворах с образованием гидроксид- ионов (едкий натр, едкое кали),слабые основания(аммиак, анилин, пиридин),анионы слабых кислот, анионы гуминовых кислот.
Химический анализ сточных вод на щелочность проводят используя различные индикаторы, наиболее подходящим индикатором является метиловый желтый, цвет которого изменяется от желтого к красному в границах pH=4.0-2.9 довольно резко, или бромфеноловый синий, если титрование с ним проводить до чисто желтого цвета.
источник
О том, какого качества жидкость, можно судить, определив сухой остаток в воде, показывающий насколько она минерализована. Тип воды определяется посредством ионно-солевого остатка. Остановимся на этом более подробно.
Из этой статьи вы узнаете:
Что показывает сухой остаток в воде
Какое влияние на организм оказывает сухой остаток в воде
Какие методы определения сухого остатка в воде существуют
Какое количество сухого остатка в воде допустимо
Сухой остаток в воде говорит о том, что в воде имеются растворенные органические и минеральные соединения, которые закипают по достижении водой температуры более +105… +110 °С. Для выявления наличия и характера сухого остатка используются гравиметрические расчетные способы. Для установления его типа образец воды отфильтровывается либо отстаивается, пока сухая смесь не отделится в качестве взвешенных частиц.
Сухой остаток в основном выявляют, подвергнув природную воду нагреву до +103… +105 °С. Для более детального и скрупулезного изучения свойств природной и сточной воды ее высушивают, нагревая до температуры +178… +182 °С.
Особенно широко в природной воде распространены анионы НСО3, СО3 и катионы Na + , K + , Ca 2+ , Mg 2+ , H + . В зависимости от того, какие анионы или группы анионов преобладают в воде, ее можно разделить на три основных класса:
карбонатная и гидрокарбонатная;
Вкусовые качества воды напрямую зависят от ее химического и минерального состава. От него зависит также частота инфекционных заболеваний в районе. На сегодняшний день вопрос о том, каким образом минерализованная вода влияет на человеческий организм, стал очень актуален, что явилось основанием для увеличения объема исследований в этой сфере. Эта тенденция связана с тем, что многие страны сталкиваются с дефицитом пресной воды.
В связи с появлением и развитием технологий, позволяющих изменять электролитный состав питьевой воды, его изучению в настоящее время уделяется значительное внимание. На данный момент недостаточно изучено, каким образом минерализованная вода влияет на организм человека, какое значение при этом имеет ее электролитный состав.
Высокоминерализованная вода не способствует утолению жажды, поскольку при попадании в организм значительного количества минералов, непосредственно количество воды в организме, в том числе в плазме крови, уменьшается. Потеря организмом воды даже в самой малой степени может увеличить давление плазмы крови, а также привести к раздражению рецепторов сосудов, что вызовет возбуждение определенных зон головного мозга – центров жажды.
Для утоления потребности в воде достаточно прекратить раздражение осморецепторов, а, следовательно, привести в норму осмотическое давление в плазме крови. С этой целью следует употреблять воду с низким уровнем содержания минералов, являющейся гипотонической по отношению к клеткам крови и межтканевой жидкости.
В процессе изучения ионно-солевого состава сухого остатка воды, ученые выяснили, что различные степени остатка оказывают разное влияние на человеческий организм.
Исследования, проводимые как в отношении лабораторных животных, так и в отношении добровольцев показали, что высокоминерализованная вода способна оказать отрицательное воздействие на человека. Употребление такой воды может вызывать расстройство метаболических и биохимических процессов, кроме того, приводит к нарушениям как на морфологическом, так и на функциональном уровне.
То есть, если употреблять воду, содержание сухого остатка в которой превышает 1000 мг/л, велика вероятность нарушения гидрофильности тканей организма, задержки в организме воды, значительного сокращения мочеиспускания. В результате этих процессов повышается нагрузка на сердце и сосуды, обостряются хронические заболевания, такие как ишемическая болезнь, миокардиодистрофия, стенокардия, гипертоническая болезнь, что увеличивает риск развития инфаркта и прочих неблагоприятных последствий.
Употребляя сильно минерализованную воду, человек может испытать диспепсическое расстройство. Особенно остро ощущают смену воды люди, изменившие регион проживания. Это связано с высоким содержанием в жидкости солей магния, которые, раздражая слизистые оболочки кишечника, стимулируют перистальтические процессы.
Употребление такой воды способно изменять секрецию и моторную функцию желудка. А если пить ее в течение длительного времени и в больших количествах – может вызвать мочекаменную или желчекаменную болезни.
Статьи, рекомендуемые к прочтению:
Однако стоит иметь в виду, что и вода с очень низким содержанием минералов (величина сухого остатка менее 100 мг/л) имеет неприятный вкус и может представлять опасность для здоровья при длительном употреблении. В такой воде содержится очень мало кальция и магния, что влечет риск возникновения сердечно-сосудистых заболеваний, а также негативно сказывается на состоянии и развитии опорно-двигательного аппарата.
Употребляемая вода должна соответствовать определенным нормативам. В случае, если содержание сухого остатка выше или ниже, вода непригодна для использования. Измерение количества сухого остатка в воде производится при помощи специальных измерительных приборов в физико-химических лабораториях.
Для того чтобы вода была пригодна для использования, содержащийся в ней сухой остаток должен соответствовать требованиям ГОСТа «Вода питьевая» 18164-72. Применение воды в производстве возможно после проведения ее полного анализа. Если исследование покажет, что какие-либо показатели воды не отвечают требованиям, в этом случае составляется протокол несоответствия, выполняются необходимые мероприятия по коррекции показателей.
Вода, в которой содержание сухого остатка не превышает 1000 мг/л, называется пресной, в большинстве рек, пресных озер и водохранилищ содержится именно такая вода. При минерализации от 1000 до 3000 мг/л вода имеет солоноватый вкус. В случае, когда сухой остаток в воде превышает 3000 мг/л, вода будет сильносоленой на вкус, она свойственна океанам и морям.
Оптимальная степень минерализации воды составляет 300–500 мг/л. Вода, сухой остаток которой составляет 100–300 мг/л, расценивается как удовлетворительная, показатели 500–1000 мг/л считаются завышенными, но вода пригодна для употребления. Следует иметь в виду, что при использовании воды со степенью минерализации 1000 мг/л и выше можно серьезно ухудшить состояние здоровья. По этой причине питьевой считается та, сухой остаток в которой не превышает 1000 мг/л.
В то же время сухой остаток воды в водоемах, предназначенных для хозяйственно-питьевых и культурно-бытовых нужд, не должен превышать 1000–1500 мг/л.
Для оценки состава и свойств сточной воды проводят санитарно-химический анализ, включающий, помимо стандартных химических тестов, ряд параметров, определяющих физические, физико-химические и санитарно-бактериологические показатели.
Состав сточной воды достаточно сложен, проводимые исследования не позволяют определить каждое из загрязняющих веществ, в связи с этим возникла необходимость выбирать показатели, с помощью которых можно было бы охарактеризовать те или иные свойства воды, не идентифицируя отдельные вещества. Название этих данных – групповые или суммарные. Так, определив органолептические показатели (запах, цвет), нет дальнейшей необходимости определять количественные степени веществ, способных придавать воде цвет и запах.
При помощи полного санитарно-химического анализа можно определить следующие данные: температуру, окраску, наличие запаха, степень прозрачности, величину рН, количество сухого остатка, его плотность и потерю в процессе накаливания, количество взвеси, объем и массу оседающих веществ, степень перманганатной окисляемости, химическую и биохимическую потребности в кислороде (ХПК и БПК соответственно), уровень азота (общего, аммонийного, нитритного, нитратного), фосфатов, хлоридов, сульфатов, тяжелых металлов и других токсичных элементов, количество поверхностно-активных веществ, нефтепродуктов, растворенного кислорода, микробов, бактерий группы кишечной палочки (БГКП), яиц гельминтов.
Помимо указанных показателей, к обязательным тестам для определения полного санитарно-химического исследования на городских очистных станциях могут быть отнесены тесты, определяющие специфические примеси, которые поступают в канализационные сети населенных пунктов с производственных предприятий.
Анализ сухого остатка позволяет установить степень общей загрязненности сточной воды органическими и минеральными веществами, находящимися в различных агрегативных состояниях (в мг/л). Выпаривание и дальнейшее высушивание образца сточных вод при температуре +105 °С поможет установить необходимые показатели. Далее остаток прокаливается при температуре +600 °C, в результате чего можно определить его зольность. Эти показатели позволяют выявить соотношение органической и минеральной частей загрязнений в сухом остатке.
Способ состоит в том, что образец выпаривается посредством водяной бани.
Чаша, предназначенная для выпаривания образца, высушивается до достижения постоянной массы. В фарфоровую чашу заливают фильтрованную воду объемом около 200–500 см 3 . После того как последняя проба воды выпарена, чаша с содержащимся в ней остатком высушивается при +110 °С в термостате постоянной массы.
Для вычисления количественного показателя сухого остатка (Х), мг/дм 3 используется следующая формула:
где m – масса емкости с сухим остатком, мг;
m1 – масса пустой емкости, мг;
V – объем воды, взятой для испытания, см 3 .
Однако, в связи с высокой способностью поглощения водяных паров и гидролизом хлоридов магния и кальция, трудностей при передаче воды сульфатами магния и кальция, велика вероятность при проведении данного анализа получить завышенные результаты. Для исправления ситуации в испытуемый образец добавляют чистый карбонат натрия. В этом случае хлориды магния и кальция преобразуются в безводные карбонаты. С целью полного выпаривания кристаллизационной воды образовавшийся остаток подвергается высушиванию при +160… +180 °С до достижения постоянной массы в термостате.
Воду необходимо заранее отфильтровать, используя бумажные фильтры. В емкости, высушенной до постоянной массы, на водяной бане выпарить отобранные для анализа 200–500 см 3 воды. После того как внесли заключительную порцию воды, при помощи пипетки добавляют 1%-ный раствор кальцинированной соды из расчета, чтобы вес соды в 2 раза превышал вес сухого остатка, предполагаемого к получению.
В случае если возникает необходимость последующего выпаривания, содержимое чаши время от времени перемешивают при помощи стеклянной палочки для разрушения образовывающейся корочки. Палочка промывается в дистиллированной воде. После этого образовавшийся сухой остаток с натрием углекислым в чаше необходимо поместить в емкость термостата и высушить при +150 °С до получения постоянной массы. Образец воды сушится в течение 2–5 часов.
Объем сухого остатка в пробе воды составляет разницу в весе между чашей с образовавшимся сухим остатком и первоначальным весом соды и емкости (в 1 см 3 содового раствора содержится 10 мг Na2CO3).
Сухой остаток (Х), мг/дм 3 , вычисляют по формуле:
где m – масса емкости с сухим остатком, мг;
m1 – масса пустой емкости, мг;
m2 – масса добавленной соды, мг;
V – объем воды, необходимой для испытания, см 3 .
Практическое использование полученных показателей состоит в технической возможности корректировать используемую воду (при помощи системы фильтров), понижая степень ее минерализации.
На российском рынке присутствует немало компаний, которые занимаются разработкой систем водоочистки. Самостоятельно, без помощи профессионала, выбрать тот или иной вид фильтра воды довольно сложно. И уж тем более не стоит пытаться смонтировать систему водоочистки самостоятельно, даже если вы прочитали несколько статей в Интернете и вам кажется, что вы во всем разобрались.
Надежнее обратиться в компанию по установке фильтров, которая предоставляет полный спектр услуг – консультацию специалиста, анализ воды из скважины или колодца, подбор подходящего оборудования, доставку и подключение системы. Кроме того, важно, чтобы компания предоставляла и сервисное обслуживание фильтров.
Наша компания Biokit предлагает широкий выбор систем обратного осмоса, фильтры для воды и другое оборудование, способное вернуть воде из-под крана ее естественные характеристики.
Специалисты нашей компании готовы помочь вам:
подключить систему фильтрации самостоятельно;
разобраться с процессом выбора фильтров для воды;
подобрать сменные материалы;
устранить неполадки или решить проблемы с привлечением специалистов-монтажников;
найти ответы на интересующие вопросы в телефонном режиме.
Доверьте очистку воды системам от Biokit – пусть ваша семья будет здоровой!
источник
Сухой остаток — масса высушенного вещества, остающегося после выпаривания 1 дм 3 воды. Сухой остаток характеризует общее содержание примесей воды как растворенных, так и взвешенных, без газов и летучих веществ.
Проведение анализа. В предварительно взвешенную фарфоровую чашку диаметром около 10 см и помещенную на водяную баню постепенно приливают 500 см 3 исследуемой воды и выпаривают. Водяную баню лучше наполнять дистиллированной водой во избежание попадания в чашку осадка с брызгами кипящей воды.
После выпаривания чашку с осадком высушивают в сушильном шкафу при 105 – 110 о С до постоянной массы и после охлаждения в эксикаторе взвешивают. Для вычисления сухого остатка в 1 дм 3 воды найденную массу осадка умножают на 2.
Пример. Масса высушенного осадка в чашке после выпаривания 500 см 3 воды равна 0,2120 г, или 212 мг. Следовательно, содержание сухого остатка равно 424 мг/ дм 3 .
Окисляемость – величина, характеризующая содержание в воде органических и минеральных веществ, окисляемых (при определенных условиях) одним из сильных химических окислителей. Выражается этот параметр в миллиграммах кислорода, пошедшего на окисление этих веществ, содержащихся в 1 дм 3 воды.
Различают несколько видов окисляемости воды: перманганатную, бихроматную, иодатную, цериевую. Наиболее высокая степень окисления достигается бихроматным и иодатным методами. В практике водоочистки для природных малозагрязненных вод определяют перманганатную окисляемость, а в более загрязненных водах – как правило, бихроматную окисляемость (называемую также ХПК – «химическое потребление кислорода»).
Окисляемость является очень удобным комплексным параметром, позволяющим оценить общее загрязнение воды органическими веществами.
Величина окисляемости природных вод может варьироваться в широких пределах от долей миллиграммов до десятков миллиграммов О2 на литр воды. Поверхностные воды имеют более высокую окисляемость (а значит и более высокое содержание органических веществ) по сравнению с подземными. Так, горные реки и озера характеризуются окисляемостью 2…3 мг О2/дм 3 , реки равнинные – 5…12 мг О2 /дм 3 , реки с болотным питанием – десятки миллиграммов О2 /дм 3 . Подземные же воды имеют в среднем окисляемость на уровне от сотых до десятых долей мг О2 /дм 3 (исключения составляют воды в районах нефтегазовых месторождений, торфянников, в сильно заболоченных местностях).
В водоемах и водотоках, подверженных сильному воздействию хозяйственной деятельности человека, бихроматная окисляемость (ХПК) используется в качестве меры содержания органического вещества в пробе воды.
В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого водопользования величина ХПК не должна превышать 15 мг О2/дм 3 .
При анализе питьевой воды обычно определяют перманганатную окисляемость. В основе метода перманганатной окисляемости лежат следующие реакции.
Перманганат калия (КМпО4), будучи сильным окислителем, реагирует в кислой среде с восстановителями. В анализируемую воду перманганат калия вводят в виде 0,01 моль/дм 3 . раствора с некоторым избытком. Для учета его количества, пошедшего на окисление примесей воды, в реакционную смесь вводят такой же объем 0,01 моль/дм 3 раствора щавелевой кислоты. Не вступившую в реакцию щавелевую кислоту оттитровывают перманганатом калия и по результату титрования вычисляют окисляемость воды. Окисляемость выражают либо в миллиграммах перманганата калия, либо в миллиграммах кислорода, расходуемых на окисление примесей в 1 дм 3 воды.
Проведение анализа. В коническую колбу вместимостью 250 см 3 наливают 100 см 3 анализируемой воды, 5 см 3 серной кислоты, разбавленной водой в соотношении 1 : 3, 10 см 3 0,01 моль/дм 3 раствора перманганата и вносят несколько стеклянных шариков или капилляров. Закрыв колбу часовым стеклом, ее содержимое за 5 мин подогревают до кипения и кипятят 10 мин. К горячему раствору добавляют 6 см 3 0,01 моль/дм 3 раствора щавелевой кислоты и размешивают его вращением колбы. Обесцветившийся горячий раствор титруют 0,01 моль/дм 3 раствором перманганата калия до появления слабо-розового окрашивания. Температура раствора не должна падать ниже 80 о С. Израсходованное на титрование количество перманганата равно количеству его, пошедшему на окисление примесей воды. Если раствор при кипячении обесцветится или побуреет, определение повторяют с разбавленной пробой воды и одновременно ставят холостой опыт с водой, взятой для разбавления. Для холостого опыта в коническую колбу отмеривают 100 см 3 дистиллированной воды и ведут определение окисляемости так же, как и в исследуемой воде. Определение окисляемости с предварительным разбавлением анализируемой воды повторяют также и тогда, когда расход перманганата на титрование составляет более 6 см 3 .
В конце определения окисляемости рекомендуется проверить молярную концентрацию раствора перманганата по щавелевой кислоте. Для этого в горячий раствор после титрования вносят 10 см 3 0,01 моль/дм 3 щавелевой кислоты и титруют перманганатом калия до появления розового окрашивания. Коэффициент нормальности перманганата вычисляют из уравнения:
где V — объем перманганата, пошедшего на титрование, см 3 .
Окисляемость воды Ок, мг кислорода на 1 дм 3 воды,
Ок = 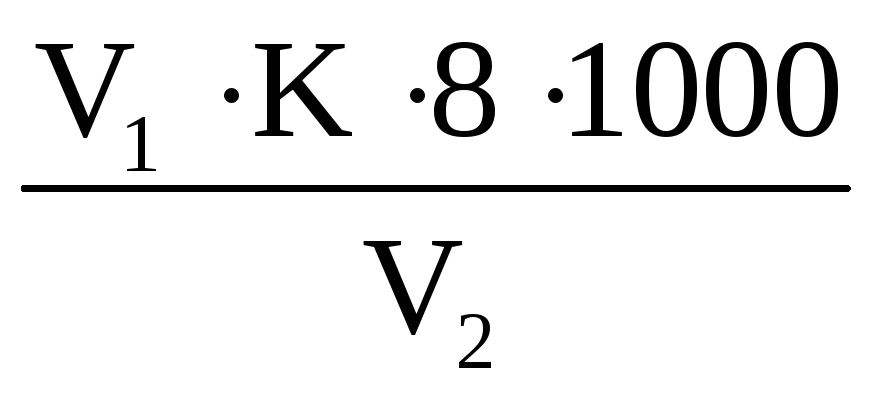
где V1 – объем раствора перманганата, пошедшего на титрование пробы с исследуемой водой, см 3 ; V2 – объем пробы исследуемой воды, см 3 ; 8 – объем кислорода, эквивалентный 1 см 3 нормального раствора перманганата, см 3 ; К – коэффициент молярной концентрации перманганата.
При разбавлении пробы исследуемой воды из величины V1 вычитают объем перманганата, расходуемого на окисление пробы воды, взятой для разбавления.
О степени загрязненности воды органическими примесями по ее окисляемости можно судить только в том случае, если учесть влияние на окисляемость неорганических восстановителей. Для этого при наличии в воде железа, сероводорода, нитритов их определяют отдельно, а результат, пересчитанный на окисляемость, вычитают из величины окисляемости воды. Пересчет производят, руководствуясь тем, что 1 мг H2S соответствует 0,47 мг, 1 мг NO2 — 0,35 мг, а 1 мг Fe 2+ — 0,14 мг кислорода. Влияние хлоридов на окисляемость обычно устраняют добавлением к анализируемой пробе воды 0,4 г сульфата ртути.
Пример. Вода для определения окисляемости разбавлена дистиллированной водой вдвое. На титрование пробы исследуемой воды пошло 2 см 3 перманганата. На титрование холостой пробы израсходовано 0,2 см 3 перманганата. Так как в пробе разбавленной воды содержится 50 см 3 дистиллированной, то для окисления содержащихся в ней примесей потребуется 0,1 см 3 перманганата. При проверке нормальности рабочего раствора израсходовано 10,2 см 3 перманганата. Следовательно, коэффициент его молярной концентрации равен:
К =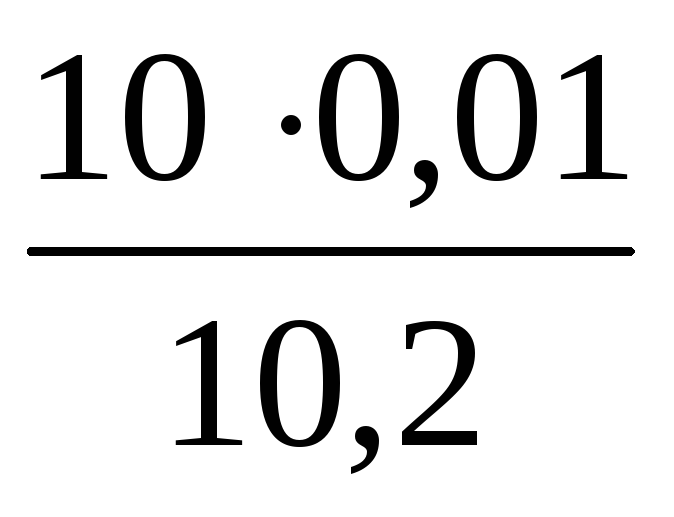
Ок = 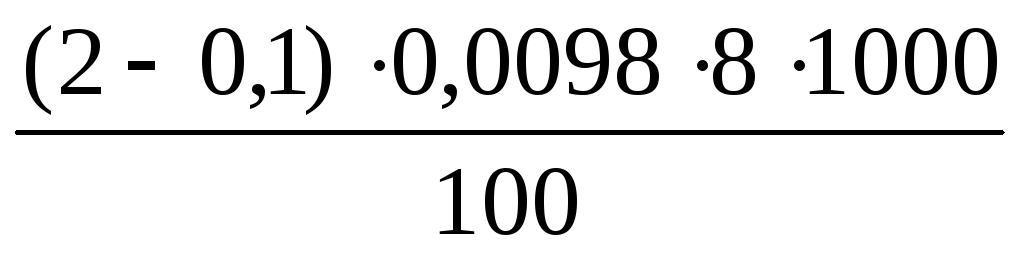
источник
Сухой остаток характеризует содержание в воде нелетучих растворенных веществ (главным образом минеральных) и органических веществ, температура кипения которых превышает 105–110°С. Сухой остаток определяют гравиметрическим и расчетным методами. Перед определением сухого остатка пробу необходимо фильтровать либо отстаивать для отделения от взвешенных веществ.
Гравиметрический (весовой) метод основан на определении веса высушенного остатка, полученного после выпаривания пробы. При гравиметрическом определении сухого остатка сначала проводят выпаривание основной массы пробы, которая может составлять 250–500 мл. Далее оставшуюся часть пробы высушивают во взвешенной, доведенной до постоянной массы чашке (стакане, тигле) в сушильном шкафу в стандартных условиях в два этапа. На первом этапе высушивание проводят при температуре 103–105°С в течение 1–2 часов. При этом удаляются влага и все летучие органические вещества, однако сохраняется почти вся кристаллизационная вода солей – кристаллогидратов. На втором этапе высушивание проводят при температуре 178–182°С также в течение 1–2 часов. В этих условиях разлагаются кристаллогидраты, более полно испаряются и разлагаются органические вещества, разлагаются также некоторые соли – например, гидрокарбонаты до карбонатов и далее до оксидов (частично или полностью). Величину сухого остатка определяют по разности масс остатка пробы до и после высушивания, причем иногда выполняют промежуточное взвешивание – после высушивания при температуре 103–105°С. Взвешивание выполняют на аналитических весах с погрешностью не более ±1 мг (лучше ±0,1 мг). Перед взвешиванием тигель необходимо охладить до комнатной температуры.
Для определения сухого остатка поверхностных природных вод обычно достаточно высушивания при температуре 103–105°С. Высушивание при температуре 178–182°С применяется специалистами при детальном исследовании природных или сточных вод.
Величину сухого остатка можно также оценить расчетным методом. При этом надо суммировать полученные в результате анализов концентрации растворенных в воде минеральных солей, а также органических веществ (гидрокарбонат суммируется в количестве 50%*). Для питьевой и природной воды величина сухого остатка практически равна сумме массовых концентраций анионов (карбоната, гидрокарбоната, хлорида, сульфата) и катионов (кальция и магния, а также определяемых расчетным методом натрия и калия).
Величина сухого остатка для поверхностных вод водоемов хозяйственно-питьевого и культурно-бытового водопользования не должна превышать 1000 мг/л (в отдельных случаях допускается до 1500 мг/л).
А. Определение сухого остатка гравиметрическим методом
Весы аналитические с комплектом разновесов, мерный стакан, сушильный шкаф с термометром (103–105°С), фарфоровая чашечка (стакан) на 300 мл, щипцы.
1. Подготовьте предварительно (можно это сделать накануне эксперимента) чистую фарфоровую чашечку или стакан:
— высушите ее в сушильном шкафу при температуре 103–105°С не менее часа;
— с помощью щипцов достаньте чашечку из сушильного шкафа, дайте ей остыть до комнатной температуры (2–3 часа).
2. Определите массу пустой чашечки (М1) в г, взвесив ее на аналитических весах с точностью до ± 0,0001 г.
3. Мерным стаканом поместите в чашечку 100 мл анализируемой воды.
4. Поместите чашечку в сушильный шкаф при температуре 103–105°С на ночь для выпаривания.
5. С помощью щипцов достаньте чашечку из сушильного шкафа, дайте ей остыть до комнатной температуры в течение 2–3 часов.
6. Определите массу чашечки с остатком (М2) в г, взвесив ее на аналитических весах с точностью до ± 0,0001 г.
7. Рассчитайте величину сухого остатка (МСО) в мг/л по уравнению:
где: М2 и М1 – вес чашки с остатком после высушивания и пустой чашки соответственно, г;
V – объем воды, взятой для анализа, мл;
10 6 – коэффициент пересчета единиц измерения из г/мл в мг/л.
В. Определение сухого остатка расчетным методом
Величину сухого остатка в мг/л можно определить также расчетным методом, суммируя результаты определения массовых концентраций главных ионов, выраженные в мг/л (гидрокарбонат суммируют в количестве 50%).
Полученный результат округлите до целых чисел.
О расчете величины сухого остатка (общего солесодержания) в ммоль-эквивалентной форме см. п. 6.3.7.
* При «классическом» гравиметрическом определении сухого остатка при нагревании выпариваемой пробы протекает химическая реакция разложения гидрокарбонат-аниона:
в результате этой реакции теряется около 50% массы содержащегося в пробе гидрокарбонат—аниона.
источник
Определение сухого остатка в химическом анализе имеет большое практическое значение. Эта величина позволяет не только характеризовать общую минерализацию воды, но и контролировать качество выполненного анализа, так как при правильно выполненном анализе общее содержание найденных веществ должно быть близко к величине сухого остатка.
В водах, а также рассолах сухой остаток получают выпариванием воды с содой. В кислых водах сухой остаток получают выпариванием с серной кислотой. Наиболее удобно объем воды на определение брать с таким расчетом, чтобы вес сухого остатка составлял 50 — 500 мг. Для определения сухого остатка в рассолах берут навеску от 1 до 10 г в зависимости от концентрации рассола.
Определение сухого остатка простым выпариванием воды и последующим высушиванием при температуре 105 — 110 °С дает для вод и рассолов неудовлетворительные результаты вследствие гидролиза и гигроскопичности хлоридов магния и кальция и трудной отдачи кристаллизационной воды сульфатами кальция и магния. Эти недостатки устраняются прибавлением к выпариваемой воде навески химически чистого карбоната натрия. При этом хлориды и сульфаты кальция и магния переходят в безводные карбонаты, а из натриевых солей лишь сульфат натрия обладает кристаллизационной водой, но она полностью удаляется высушиванием сухого остатка при температуре 150 — 180° С.
Определение выпариванием с содой
Высушивают фарфоровую или лучше кварцевую чашку до постоянного веса при температуре 105 — 110° С. В чашку вносят безводный Na2CО3 в количестве, в 2 — 3 раза превышающем предполагаемое содержание растворенных солей в анализируемом объеме пробы (последнее может быть ориентировочно подсчитано после определения хлор-, сульфат- и гидрокарбонат-ионов).
Чашку с карбонатом натрия взвешивают, затем в нее наливают соответствующее количество прозрачной воды или рассола (при анализе рассола соду предварительно растворяют в небольшом объеме дистиллированной воды) и выпаривают досуха под инфракрасной лампой, на водяной или не слишком горячей песчаной бане. В случае использования песчаной бани следят, чтобы не было кипения воды и разбрызгивания в конце выпаривания. Обтирают чашку с полученным сухим остатком сначала фильтровальной бумагой, смоченной разбавленной соляной кислотой (для удаления возможной накипи или загрязнений из песка), а затем сухой бумагой. После этого чашку накрывают часовым стеклом и сушат в термостате при температуре 150 — 180 °С в течение 2 — 3 ч.
После охлаждения в эксикаторе чашку взвешивают. Затем чашку помещают снова в термостат на 1 ч. При вторичном взвешивании ввиду некоторой гигроскопичности осадка рекомендуется сначала поставить на весы разновес, отвечающий первому взвешиванию, а потом уже чашку с осадком. Если разность между двумя взвешиваниями не будет превышать ±0,001 г, определение сухого остатка можно считать законченным; в противном случае операцию высушивания следует повторить.
Содержание сухого остатка (в мг/л) вычисляют по формуле:
где а — вес чашки с сухим остатком, мг;
v — объем исследуемой воды, мл.
Определение выпариванием с серной кислотой
Определение сухого остатка в природных водах выпариванием с серной кислотой основано на переводе всех солей, растворенных в воде, в сульфаты. При последующем удалении избытка серной кислоты и прокаливании сухого остатка до постоянного веса железо и алюминий будут взвешены в виде окислов Fe2О3 и А12О3.
Однако определение сухого остатка этим методом в кислых водах не дает удовлетворительных результатов, так как превращение значительных количеств сульфатов железа и алюминия в окислы требует продолжительного прокаливания и высокой температуры; при этих условиях возможно разложение других солей. Е. П. Муликовская этот метод выделения сухого остатка видоизменила. Для удаления избытка серной кислоты высушивание ведется при температуре 360 — 380° С. В таком сульфатном сухом остатке железо и алюминий взвешивают в виде сульфатов. При этом железо необходимо предварительно окислить до трехвалентного.
Во взвешенную платиновую или фарфоровую чашку отмеривают такой объем воды, в котором содержалось бы не более 1 г солей, после чего прибавляют 1 — 2 мл 5%-ного раствора перекиси водорода и закрывают чашку часовым стеклом. Когда прекратится бурное выделение кислорода, обмывают стекло дистиллированной водой, прибавляют 1 — 2 мл H2SО4 (1:2) и выпаривают раствор на водяной бане до маслообразной консистенции.
Затем чашку переносят на асбестовую сетку и осторожно нагревают до полного прекращения выделения паров серной кислоты, после чего, снова смочив сухой остаток концентрированной серной кислотой, вторично нагревают на асбестовой сетке до прекращения выделения паров серной кислоты. Последняя операция необходима для перевода основного сульфата окисного железа в среднюю соль. После вторичной обработки серной кислотой сухой остаток нагревают в термостате при температуре 360 — 380 °С в течение 1,5 — 2 ч. Полученный сухой остаток содержит все металлы, находящиеся в воде в виде сульфатов, причем железо — в виде Fe2(SО4)3.
источник
Оборудование, реактивы, материалы
Колба коническая на 250 см 3 ;
В СВ сухой остаток характеризует загрязненность воды примесями, находящимися во всех агрегатных состояниях. Его определяют выпариванием пробы СВ с последующим высушиванием при температуре 105°С. В него входят как растворенная, так и взвешенные вещества.
Ход определения. Отмеренную цилиндром пробу СВ в количестве 100 см 3 выпаривают на водяной бане в предварительно высушенной и взвешенной фарфоровой чашке. Содержимое чашки дополняют по мере выпаривания. После полного выпаривания пробы чашку ставят в сушильный шкаф и сушат при температуре 103-105°С в течение 1 ч. После охлаждения в эксикаторе чашку быстро взвешивают, так как осадок гигроскопичен.
Сухой остаток (в мг/дм 3 ) определяют по формуле 1.
, (1)
где а – масса чашки вместе с сухим остатком,
— объем выпаренной пробы, см 3
2. Прокаленный сухой остаток
Его получают путем прокаливания сухого остатка при температуре 600°С. Он дает представление о соотношении органической и неорганической частей в общей массе примесей.
Ход определения. Высушенную и взвешенную фарфоровую чашку с сухим остатком (х1) ставят в муфельную печь, предварительно нагретую до температуры 500-600°С, и прокаливают в течение 1 ч. Чашку сначала немного охлаждают на открытом воздухе, затем в эксикаторе и после полного охлаждения взвешивают.
Прокаленный остаток (мг/дм 3 ) определяют по формуле 2.
, (2)
где с – масса фарфоровой чашки вместе с прокаленным остатком, мг;
— объем выпаренной пробы.
В прокаленном остатке остаются минеральные вещества, тогда содержание органических веществ (х3), мг/дм 3 может быть определено по формуле 3.
Этот показатель характеризует количество осадка, образующегося в процессе очистки СВ при отстаивании и используется при расчете отстойников. Он указывает на количество примесей, остающихся на фильтре после фильтрования СВ и последующего высушивания фильтра до постоянной массы.
Во взвешенных веществах содержатся частицы загрязнений различной степени дисперсности. Количественное определение грубодисперсных примесей следует, по возможности, проводить сразу после отбора проб для анализа.
Для определения таких примесей их отделяют, фильтруя СВ через различные пористые материалы: мембранные фильтры, стеклянные, кварцевые или фарфоровые фильтры.
В данной работе определение взвешенных веществ осуществляют путем фильтрования через бумажный фильтр, укрепленный тканью из муслина.
Ход определения. Складчатый беззольный бумажный фильтр помещают в бюкс, высушивают в сушильном шкафу при температуре 105°С до постоянной массы, охлаждают в эксикаторе в закрытом бюксе и взвешивают на аналитических весах с точностью до четвертого знака после запятой. Высушенный фильтр достают из бюкса расправляют и укладывают в стеклянную воронку для фильтрования на тканевую подложку. Бюкс вместе с крышкой сохраняют. Сточную воду в количестве 100 см 3 профильтровывают через бумажный фильтр. Бумажный фильтр вместе с муслиновой подложкой подсушивают в сушильном шкафу при 105°С. Подсушенный фильтр отделяют от подложки, помещают в прежний бюкс и досушивают до постоянной массы при той же температуре.
Содержание взвешенных веществ (мг/дм 3 ) определяют по формуле 4.
, (4)
где e – масса бюкса вместе с фильтром со взвешенными веществами после высушивания, мг;
f – масса бюкса с высушенным фильтром, мг;
— объем сточной воды, взятой для анализа, см 3 .
4. Прокаленный остаток взвешенных веществ
Он позволяет дать приближенное представление о доли неорганических и органических веществ во взвешенных веществах, так как при прокаливании разрушаются карбонаты, аммиачные соли и др.
Ход определения. Сухой бумажный фильтр со взвешенными веществами сминают в комочек, поджигают и помещают в предварительно прокаленный и взвешенный тигель. Бумажный фильтр в бюксе дожигают на электроплитке до полного обугливания, затем тигель помещают в муфель предварительно нагретый до 500-600°С и выдерживают в течение 1 ч. Тигель некоторое время охлаждают на воздухе, а затем в эксикаторе и после полного охлаждения взвешивают.
Прокаленный остаток взвешенных веществ (мг/дм 3 ) определяют по формуле 5.
, (5)
где g – масса тигля с прокаленным остатком взвешенных веществ, мг;
h – масса пустого прокаленного тигля, мг;
— объем СВ, взятый для анализа взвешенных веществ, см 3 .
В прокаленном остатке от взвешенных веществ содержатся только минеральные вещества, тогда содержание органических веществ (мг/дм 3 ) можно определить по формуле 6:
Он характеризует суммарное количество растворенных органических и неорганических веществ. Его определяют аналогично показателю «сухой остаток», для чего используют фильтрат, полученный при определении взвешенных веществ (п.3).
Ход определения. Весь объем фильтрата, оставшегося от определения взвешенных веществ, выпаривают на водяной бане в предварительно прокаленной в муфеле и взвешенной фарфоровой чашке. После полного выпаривания и подсушивания в сушильном шкафу при температуре 105°С в течение часа, чашку охлаждают в эксикаторе и быстро взвешивают.
Плотный остаток (в мг/дм 3 ) определяют по формуле 7:
Х7 = , (7)
где k – масса чашки вместе с плотным остатком, мг;
— объем сточных вод, взятых для определения взвешенных веществ, см 3 .
6. Прокаленный остаток от плотных веществ.
Этот показатель дает приближенное представление о доли неорганических и органических веществ, находящихся в сточной воде в растворенном состоянии.
Ход определения. Высушенные и взвешенные плотные вещества, находящиеся в фарфоровой чашке (х7) ставят в муфельную печь, предварительно нагретую до температуры 500-600°С, прокаливают в течение 1 ч. Чашку вынимают из муфельной печи и вначале охлаждают на воздухе, затем в эксикаторе. После полного охлаждения взвешивают.
Прокаленный остаток от плотных веществ (мг/дм 3 ) определяют по формуле 8:
Х8 = , (8)
где m – масса фарфоровой чашки с прокаленным остатком, мг;
n – масса пустой фарфоровой чашки, мг;
— объем сточных вод, взятый для определения взвешенных веществ, см 3 .
В прокаленном остатке содержатся минеральные вещества, растворенные в сточной воде. Органические растворенные вещества (мг/дм 3 ) определяют по разности, по формуле 9:
1. Что характеризует в сточной воде показатель «сухой остаток»?
2. Как в сточной воде определяют показатель «сухой остаток»?
3. Как определяют в сточной воде показатель «прокаленный сухой остаток» и для чего это делают?
4. Что характеризует в сточной воде показатель «взвешенные вещества»?
5. Для чего определяют в сточной воде показатель «взвешенные вещества»?
6. Как в сточной воде определяют показатель «взвешенные вещества»?
7. Зачем определяют показатель «прокаленный остаток взвешенных веществ»?
8. Что означает показатель «плотный остаток» в сточной воде, как его определяют?
9. С какой целью, выделенный из сточных вод плотный остаток дополнительно прокаливают в муфельной печи?
10. Как консервируют сточную воду для определения взвешенных, плотных веществ?
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Только сон приблежает студента к концу лекции. А чужой храп его отдаляет. 8484 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Одним из важных показателей качества питьвой воды является сухой остаток (минерализация) воды. По ионно-солевому составу сухого остатка природных вод можно определить к какому типу относится вода, например, к хлоридно-натриевому типу. Минеральная или столовая питьевая это вода.
Сухой остаток характеризует содержание в воде нелетучих растворенных веществ (главным образом минеральных) и органических веществ, температура кипения которых превышает 105–110°С. Сухой остаток определяют гравиметрическим и расчетным методами. Перед определением сухого остатка пробу необходимо фильтровать либо отстаивать для отделения от взвешенных веществ.
Для определения сухого остатка поверхностных природных вод обычно достаточно высушивания при температуре 103–105°С. Высушивание при температуре 178–182°С применяется специалистами при детальном исследовании природных или сточных вод.
Величина сухого остатка для поверхностных вод водоемов хозяйственно-питьевого и культурно-бытового водопользования не должна превышать 1000 мг/л (в отдельных случаях допускается до 1500 мг/л).
Воду с сухим остатком до 1000 мг/л называют пресной. Именно такая минерализация свойственна воде рек, большинства пресных озер и водохранилищ. Воду называют солоноватой, если ее минерализация составляет 1000-3000 мг/л, и соленой при минерализации свыше 3000 мг/л, что характерно для воды морей и океанов.
Наиболее распространенными в природной воде являются: анионы СГ, НСО3, СО3 и катионы Na+, K+, Ca2+, Mg2+, H+. В зависимости от того, какой анион или группа анионов преобладает, природные воды разделяют на три класса:
1) гидрокарбонатные и карбонатные
2) сульфатные
С химическим (минеральным) составом воды связывали ее вкусовые качества и возможность развития у населения массовых заболеваний. В современных условиях интерес к вопросу влияния минерализации воды на организм человека возрос, а объем исследований расширился. Этому способствовало и то, что ныне проблема дефицита пресной воды во многих странах мира является очень острой. Особое значение приобрела гигиеническая оценка электролитного состава питьевой воды с появлением технических возможностей его изменения. Сегодня можно считать, что влияние общей минерализации воды или ее электролитного состава на организм человека достаточно изучено.
К тому же вода с повышенной минерализацией хуже утоляет жажду. Ощущение жажды возникает рефлекторно вследствие уменьшения количества воды в организме, главным образом в плазме крови. Даже незначительное обезвоживание приводит к повышению осмотического давления плазмы крови и к раздражению осморецепторов сосудов, что вызывает возбуждение определенных зон коры головного мозга — так называемого центра жажды. Чтобы утолить жажду, нужно прекратить раздражение осморецепторов, то есть нормализовать осмотическое давление плазмы крови. Этого легче достичь, употребляя воду с низкой минерализацией, которая является гипотонической в отношении крови и межтканевой жидкости.
Чтобы вода не имела горького и соленого вкуса интенсивностью свыше 2 баллов, ее сухой остаток не должен превышать 1000 мг/л. Именно такую воду называют пресной. То есть верхний предел минерализации (сухого остатка) питьевой воды — 1000 мг/л — установлен на основании влияния на органолептические свойства воды.
Кроме того, опыты на лабораторных животных и результаты исследований, проведенных с участием волонтеров, свидетельствуют, что употребление высокоминерализованной воды небезразлично для организма: оно может приводить к расстройству многих метаболических и биохимических процессов и развитию различных нарушений как на функциональном, так и на морфологическом уровне. Так, употребление воды с сухим остатком, превышающим 1000 мг/л, сопровождается повышением гидрофильности тканей, задержкой воды в организме, уменьшением на 30-60% диуреза. Вследствие этого повышается нагрузка на сердечно-сосудистую систему и тяжесть течения хронических болезней: ишемической болезни сердца, стенокардии, миокардиодистрофии, гипертонической болезни. Повышается риск их обострения, что может привести к инфаркту миокарда и т. п.
Употребление воды с повышенной минерализацией может вызвать диспепсические расстройства у лиц, которые изменили место проживания. Это обусловлено содержанием в воде солей магния и прежде всего сульфатов, которые раздражают слизистую оболочку тонкой и толстой кишок, усиливая их перистальтику. Кроме того, под влиянием такой воды изменяется секреторная и моторная функции желудка. Установлено, что длительное употребление высокоминерализованной воды приводит к развитию и прогрессированию мочекаменной и желчнокаменной болезней.
Таким образом, оптимальной считают минерализацию воды на уровне 300-500 мг/л. Вода с сухим остатком 100-300 мг/л считается удовлетворительной минерализации, 500-1000 мг/л — повышенной, но допустимой минерализации. Солоноватая и соленая вода (с минерализацией выше 1000 мг/л) неприятна на вкус, ее употребление приводит к нарушениям в состоянии здоровья. Поэтому качественной следует считать питьевую воду, имеющую сухой остаток до 1000 мг/л.
Статьи: Все о воде и системах очистки воды Интернет-магазин «ЮВК», Киев.
источник
Аналитический центр более 20 лет занимается химическим анализом и разработкой новых методов анализа и диагностики веществ и материалов
В нашем распряжении самый современный приборный парк благодаря научно-техническому взаимодействию с крупнейшими мировыми разработчиками аналитического оборудования
Наши сотудники — это лучшие специалисты страны в области химического анализа, кандидаты и доктора наук
Аккредитация позволяет исследовать питьевую, природную, морскую, технологическую, талую воду и воду бассейнов
Обратившись к нам, Вы получите не только точные данные о присутствующих в воде загрязнителях, но и подробные рекомендации о способах очистки воды.
На основании анализа воды БЕСПЛАТНО подберем несколько вариантов систем водоочистки!
В нашей лаборатории Вы можете проверить качество воды из любого источника: колодца, скважины, водопровода, бассейна, родника, водоема. Для каждого источника есть оптимальный набор показателей, характеризующий возможность использования воды для тех или иных нужд. Чтобы правильно подобрать набор показателей, свяжитесь с нами по номеру +7 (495)149-23-57 или напишите на почту info@ion-lab.ru
Мы рекомендуем выбирать набор параметров в зависимости от того, какой у Вас источник водоснабжения, а также для каких целей планируете использовать воду. Для воды из городского водопровода, а также для воды, используемой в технических целях, подойдут наборы «Минимальный» или «Начальный». Для воды природных источников (скважины, колодцы, родники и т.д.) мы рекомендуем проверить воду на химический состав (наборы «Расширенный» или «Максимальный»), а также сделать анализ на микробиологию.
Да, Вы можете самостоятельно отобрать воду для анализа, следуя инструкции. Или же заказать выезд специалиста, который приедет в назначенное время со всей необходимой тарой, отберет воду и доставит ее в лабораторию.
Да, конечно! Пункт приема проб расположен по адресу: Москва, ул. Добролюбова, 21А, корпус А, пом. 14 (в пешей доступности от метро Фонвизинская, Бутырская, Тимирязевская)
Стоимость выезда специалиста зависит от выбранного Вами набора показателей и удаленности. Более точная информация размещена в разделе Доставка и оплата
© 1997-2019 — Лаборатория ИОН. Все права защищены.
Для химического анализа необходимо заполнить водой чистую пластиковую тару (оптимально 1,5 л). Использовать бутылки из-под сладких, газированных или ароматизированных напитков, а также солёной или минеральной воды недопустимо.
Если выбранный Вами анализ включает определение содержания нефтепродуктов, необходимо заполнить дополнительную стеклянную тару объемом 0,2 л.
Если выбранный Вами анализ включает определение содержания сероводорода, необходимо заполнить дополнительную стеклянную тару объемом 0,5 л (необходимо использовать консервант).
При отборе воды из проточного источника, непосредственно перед отбором необходимо пролить воду сильной струёй в течение 3-5 минут. Перед отбором проб ёмкости и крышки необходимо 3 раза промыть изнутри водой, подлежащей анализу. Использование моющих средств недопустимо. Наполнять тару необходимо тонкой струёй по стенке сосуда «под горлышко». Это снижает насыщение воды кислородом и предотвращает протекание реакций.
Для микробиологического анализа необходимо использовать стерильный контейнер для биоматериалов объемом 150-200 мл.
Перед взятием пробы необходимо протереть водопроводный кран спиртовой салфеткой, уделив особое внимание месту выхода воды.
При отборе воды из водопровода, скважины или колонки необходимо пролить воду сильной струёй в течение 3–5 минут.
При отборе воды из колодца с помощью ведра необходимо обдать ведро кипятком для дезинфекции. Отбор пробы через поливочные шланги и предметы, контактирующие с почвой, не допускается.
Для отбора пробы необходимо надеть перчатки и вскрыть упаковку стерильного контейнера. Не касаясь внутренней поверхности ёмкости, отобрать образец воды (2/3 объема контейнера) и закрыть крышкой.
Рекомендуем доставлять пробу сразу после отбора.
Если сразу после отбора нет возможности доставить пробу в лабораторию, допускается хранение образцов при температуре 2–10 °C в течение 1 суток.
Съезд на ул. Руставели, на первом светофоре поворот налево на ул. Яблочкова.
Через 300 м поворот направо на ул. Гончарова, через 500 м поворот налево (напротив дома №6), через 200 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Поворот на ул. Руставели, на светофоре поворот направо на ул. Добролюбова, через 300м на светофоре поворот налево на ул. Гончарова, напротив дома №6 поворот направо, через 200 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Двигаясь по ул. Милошенкова, поворачиваем на ул. Добролюбова
Через 150 метров поворот направо, за домом 21АкБ поворот налево, через 100-120 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Ближайшее станция метро – Фонвизинская (600 м)
Последний вагон из центра. Выход в сторону улицы Фонвизина. Из стеклянный дверей направо. Перейти через пешеходный переход и идти через дворы в соответствии со схемой. Пункт назначения — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Анализ «Минимальный» содержит минимальный и обязательный перечень загрязнителей, часто встречающихся в питьевой воде, и включает 16 показателей:
- органолептические: мутность, цветность, запах, привкус;
- общехимические: рН, жесткость, окисляемость перманганатная, минерализация, электропроводность, щелочность общая, щелочность свободная;
- катионы: железо, аммоний;
- анионы: нитраты, карбонат, гидрокарбонат.
Данный набор рекомендуется для исследования воды хозяйственно-бытового назначения. Анализ «Минимальный» не обладает достаточной информативностью для подбора системы водоочистки, так как не позволяет получить полную картину о безопасности воды. Если Вы планируете использовать воду в питьевых целях, рекомендуем обратить внимание на наборы, содержащие большее число параметров.
- Точность определения
- Подходит для воды, применяемой в хоз-бытовом назначении
- Срок выполнения — 3-4 рабочих дня
- Не подходит для воды, применяемой в питьевых целях
- Не подходит для корректного подбора фильтров
- Не содержит определения опасных загрязнителей
Анализ «Начальный» предназначен для выявления наиболее часто встречающихся вредных веществ в питьевой воде и включает 23 параметра: мутность, цветность, запах, привкус, рН, жесткость, окисляемость, минерализация, электропроводность, щелочность свободная, щелочность общая, железо, марганец, калий, магний, кальций, фториды, хлориды, нитраты, сульфаты, карбонат, гидрокарбонат, аммоний Данный анализ рекомендуется для оценки качества воды из колодцев, скважин, родников. По протоколу анализа «Начальный» возможен подбор системы водоочистки и типа фильтрующей загрузки. В перечень определяемых параметров входят органолептические показатели, общие химические показатели, а также содержание катионов и анионов
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для колодцев и скважин
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Позволяет корректно и экономично настроить водоочистное оборудование
- Не содержит перечень тяжелых металлов
- Не содержит перечень всех опасных загрязнений
- Срок выполнения исследований 5-6 рабочих дней
Анализ «Расширенный» содержит перечень наиболее часто встречающихся загрязнителей воды, вне зависимости от источника, и включает 31 показатель: мутность, цветность, запах, привкус, рН, жесткость, окисляемость, минерализация, электропроводность, щелочность общая, щелочность свободная, аммоний, алюминий, железо общее, магний, кальций, калий, натрий, марганец, медь, мышьяк, свинец, кадмий, цинк, стронций, фториды, хлориды, нитраты, сульфаты, гидрокарбонат, карбонат. Данный набор рекомендуется, в первую очередь, владельцам колодцев и скважин. Содержит перечень основных тяжелых металлов. Перед покупкой системы водоподготовки рекомендуем провести исследование воды с данным перечнем загрязнителей. Ориентируясь на полученную информацию, Вы сможете подобрать оборудование водоочистки с эффективностью до 98%, а так же корректно его настроить.
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для колодцев и скважин
- Содержит перечень тяжелых металлов
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Позволяет корректно и экономично настроить водоочистное оборудование
Анализ «Максимальный» содержит полный перечень опасных для здоровья человека веществ, встречающихся в воде, поступающих из скважин или колодцев, включая ионы тяжелых металлов и органические вещества, а именно: мутность, цветность, запах, привкус, рН, жесткость, окисляемость, минерализация, электропроводность, щелочность общая, щелочность свободная, аммоний, натрий, калий, магний, кальций, алюминий, железо, марганец, литий, барий, бериллий, бор, ванадий, молибден, кобальт, цинк, никель, хром, стронций, кадмий, мышьяк, медь, свинец, кремний, серебро, титан, ртуть, гиброкарбонат, карбонат, нитрат, хлорид, сульфат, фосфат, фторид, нитрит, сероводород, сульфид, гидросульфид, хлор общий, хлор остаточный, хлор остаточный свободный, АПАВ, нефтепродукты, фенол, формальдегид, бензол, толуол, о-ксилол, п-ксилол, м-ксилол, стирол Данное исследование рекомендуется для клиентов, которые серьезно относятся к выбору питьевой воды. Протокол анализа «Максимальный» позволяет со 100% уверенностью сделать вывод о пригодности воды для питья и приготовления пищи. Результаты исследования позволяют выбрать схему водоочиски, а также оценить эффективность уже установленного оборудования.
Воды, применяемой в хозяйственно-бытовом назначении; оценки работы системы водоочистки.
пластиковая бутылка 1,5 — 2 л.
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для любых источников воды
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Включает полный перечень тяжелых металлов
- Позволяет корректно и экономично настроить водоочистное оборудование
- Содержит полный перечень опасных органических веществ
Помимо хичиеского анализа воды мы настоятельно рекомендуем провести микробиологическое исследование Вашей воды. Микробиологический анализ воды включает определение общего микробного числа (ОМЧ), количества общих колиформных и колиформных термотолерантных бактерий.
источник
