Присутствие в воде хлоридов натрия, магния, кальция и др. ухудшают свойства воды в случае ее использования для технических нужд, а также для питьевых целей. Хлорид-ион может присутствовать в воде природных источников и образовываться в процессе хлорирования перед доставкой воды в водопроводную сеть по реакции:
Анализ воды на хлорид-ион осуществляется методом аргентометрии при содержании ионов Сl — более 0,25 мг/л.
Цель работы: использование метода осаждения и методики титрования для определения нормальной концентрации ионов хлора в воде по закону эквивалентов.
Необходимое оборудование: установка для титрования: штатив, бюретка на 25 или 50 мл, пипетка вместимостью 10 мл с резиновой «грушей», мерная колба на 100 или 250 мл, химический стакан, конические колбы на 100 мл, воронка.
Необходимые реактивы: рабочий раствор нитрата серебра (концентрация может быть разной в зависимости от содержания в воде хлорид-ионов), раствор хромата калия в качестве индикатора, дистиллированная вода.
Сущность метода и методика выполнения работы.
Определение концентрации Сl — основано на образовании нерастворимой соли хлорида серебра по реакции:
Зная объем и концентрацию рабочего раствора нитрата серебра, идущего на титрование пробы воды, и, пользуясь законом эквивалентов, можно рассчитать содержание ионов хлора. Индикатором в этой реакции является К2CrO4— хромат калия, который реагирует с рабочим раствором по реакции:
Осадок Аg2CrO4 имеет кирпично-красную окраску. Выпадение осадков происходит последовательно: сначала выпадает белый нерастворимый хлорид серебра (ПР = 1,610 -12 ) – менее растворимый, чем хромат серебра ( ПР = 10 -10 ). Когда все ионы хлора будут связаны в осадок, т.е. основная реакция пройдет до конца, начнется выпадение Аg2CrO4. Раствор от одной капли титранта (нитрата серебра) приобретает кирпично-красный оттенок, и титрование прекращают.
Содержание ионов хлора в [мг/л] рассчитывают по формуле:
[Сl — ]= С(AgNO3)V(AgNO3)1000Э(Сl — )/V(пробы) [мг/л], где
С(AgNO3) – нормальная концентрация рабочего раствора в моль/л;
V(AgNO3) –объем рабочего раствора, израсходованного на титрование
Э(Сl — ) –эквивалентная масса хлорид-ионов, Э(Сl — ) = 35.5 г/моль.
5. ФИЗИКО-ХИМИЧЕСКИЙ АНАЛИЗ
К физико-химическим методам исследования относятся все электрохимические методы (кондуктометрия, потенциометрия, полярография, амперометрия и др.), калориметрические (методы определения теплоемкости и тепловых эффектов фазовых и химических превращений), оптические (фотометрическое титрование, колориметрия и нефелометрия и др.), хроматографические, основанные на избирательной адсорбции различных веществ и пр. Перечисление и рассмотрение всех методов не входит в задачу данного пособия. В отдельный раздел физико-химических исследований выделен физико-химический анализ, методики которого применяются практически во всех методах.
Проведение качественного и количественного анализа позволяет точно установить химический состав вещества. В течение длительного периода развития химических наук основным объектом исследования было изолированное индивидуальное вещество с постоянным составом. Вещества, которые невозможно было выделить чистом виде (фазы переменного состава – шлаки, керамические материалы, сплавы, растворы и пр.), долгое время исключались как объект исследования, ввиду невозможности с помощью известных методов анализа точно установить их состав. В конце XIX и в начале XX века формируется новый раздел – физико-химический анализ. Физико-химический анализ изучает зависимость между составом и свойствами макроскопических равновесных систем, составленных из нескольких веществ (компонентов). Для физико-химического анализа характерно представление этих зависимостей графически, в виде диаграммы состав – свойство. Основоположниками нового направления были Д. Гиббс, Я. Ван-дер-Ваальс, Х. Розебом, Г. Тамман, Д.И. Менделеев, Д.П. Коновалов. Особая заслуга в развитии физико-химического анализа и выделении его в самостоятельную дисциплину принадлежит Н.С. Курнакову, который разработал основы геометрического анализа диаграмм состояния и создал крупнейшую в мире школу физико-химического анализа.
Основная задача этого раздела химии состоит в измерении физического свойства системы, находящейся в состоянии равновесия, при последовательном изменении ее состава. Результатом такого исследования является диаграмма состав–свойство, представляющая собой геометрическое отражение процессов, которые протекают в системе. Зависимость между составом системы и ее свойствами в принципе может быть выражена аналитическим уравнением состояния. Однако явный вид функции обычно неизвестен. Геометрический анализ диаграмм состав-свойство, сочетая в себе наглядность и универсальность, позволяет определить количество образующихся в системе фаз, их природу, области их существования и особенности взаимодействия между ними. Это дает возможность наблюдения за изменениями в системе в процессе химического взаимодействия, не выделяя образующиеся фазы для исследования.
Физико-химический анализ позволяет количественно исследовать ход изменения какого-либо физического свойства (давления пара, температуры плавления, плотности, вязкости, твердости, электрической проводимости и т.п.) системы, образованной двумя компонентами при непрерывно меняющемся ее составе. Если функцией состава служит, например, температура фазовых превращений, то получающийся геометрический образ называется диаграммой состояния или фазовой диаграммой, поскольку измеряемое свойство является термодинамическим. В качестве примера фазовой диаграммы представлена диаграмма состояния однокомпонентной системой — воды (рис.1). Однокомпонентной системой является любое простое вещество или химическое соединение, обладающее строго определенным составом в газообразном, жидком и твердом состояниях. Фазовые диаграммы обычно строят на плоскости в координатах температура-давление. Фазовые поля (области существования) пара V, жидкости L и твердой фазы S дивариантны, т.е. допускают одновременное изменение двух параметров состояния – температуры и давления.
Рис. 1. Диаграмма состояния однокомпонентной системы. S, L и V — области существования твердой, жидкой и паровой фаз; 1, 2 и 3 кривые кипения (испарения), плавления и возгонки (сублимации); К – критическая точка; в которой исчезает различие между жидкостью и насыщенным паром; А — тройная точка, соответствующая равновесному сосуществованию твердой, жидкой и газообразной фазы.
Диаграммы, отражающие зависимость физических свойств (электрических, магнитных и пр.) от состава, которые не могут быть представлены в виде функции только давления, температуры и концентраций, называются диаграммами состав-свойство. Пример такой диаграммы для металлической системы представлен на рис. 2. Результаты исследования наносят на диаграмму состав-свойство, причем состав всегда откладывают по вертикальной оси и выражают в процентах (или долях) одного из компонентов системы, а свойство, выраженное числовым значением соответствующей физической величины (в данном случае электрической проводимости и твердости, измеренных при постоянной температуре) — по вертикальной оси. Такие диаграммы позволяют по виду полученных кривых обнаружить происходящие в системе превращения и дают указания относительно характера этих превращений, состава получающихся продуктов, свидетельствуя об образования твердых растворов, химических соединений или других фаз переменного состава.
Рис. 2. Изотермы (при постоянной температуре) электрической проводимости s твердости Ндля непрерывного ряда твердых растворов.
Например, вид кривых рисунка 2 — это типичные диаграммы состав–свойство для непрерывного ряда твердых растворов. Максимум на кривой изотермы твердости обусловлен напряжениями, возникающими вследствие упругой деформации кристаллической решетки при образовании твердых растворов. Искажения решетки приводят к увеличению рассеяния носителей тока, снижению их подвижности и, следовательно, понижению электрической проводимости вблизи того же состава (около 50%).
Термический анализ
Из всех видов физико-химического анализа при изучении сплавов чаще всего применяется термический анализ, начало которому было положено в шестидесятых годах XIX века русским металлургом Д.К. Черновым. Термический анализ – совокупность методов определения температур, при которых происходят процессы, сопровождающиеся выделением тепла (например, кристаллизация из жидкости), либо его поглощением (например, плавление, термическая диссоциация). С помощью термического анализа решается задача получения количественных характеристик (например, фазовый состав, теплота реакций) при нагревании или охлаждении исследуемых объектов. Термический анализ широко применяется при изучении сплавов металлов, минералов и других геологических пород. Результатом термического анализа металлических систем является построение и изучение диаграмм плавкости, которые выражают зависимость температуры плавления сплава от процентного содержания металлов, входящих в его состав. Многочисленные работы Н.С. Курнакова по выяснению природы металлических сплавов внесли ясность в понимание процессов, происходящих при затвердевании сплавов. Им были открыты химические соединения, состав которых может меняться в довольно широких пределах. Эти соединения переменного состава Курнаков назвал бертоллидами, по имени французского ученого Бертолле (1748-1822), допускавшего их существование, предложив для обычных соединений постоянного состава со стехиометрическим соотношением компонентов название дальтониды. Стехиометрическое соотношение компонентов, образующих соединение, соблюдается только в парообразном состоянии, в молекулярных кристаллах и жидкостях. При образовании твердых фаз с координационной решеткой (кристаллических веществах) эти соотношения не соблюдаются, к ним неприменим закон постоянства состава и, следовательно, их следует отнести к бертоллидам.
Диаграммы плавкости обычно строят, исходя из кривых охлаждения сплавов, используя метод термического анализа. Для получения этих кривых берут два чистых металла и готовят из них ряд смесей (сплавов) различного состава (двухкомпонентные системы). Каждую из приготовленных смесей расплавляют и медленно охлаждают, отмечая через точно определенные промежутки времени температуру остывающего сплава. По данным наблюдений строят кривые охлаждения, откладывая по оси абсцисс — время, а по оси ординат – температуру (рис. 3, кривые а). При отсутствии превращений кривая нагревания (охлаждения) идёт плавно; превращения отражаются появлением на кривой изломов или горизонтальных участков («остановок»). В точке излома (кривая 1 – кривая охлаждения чистого металла) начинается образование твердой фазы, сопровождающееся выделением тепла, вследствие чего температура остается некоторое время постоянной (кривая идет параллельно оси абсцисс). Когда вся масса расплавленного металла затвердеет, опять начинается равномерное понижение температуры.
Расплав чистого компонента (металла) можно рассматривать как растворитель. Согласно закону Рауля, добавление второго компонента (растворенного вещества) вызывает понижение температуры кристаллизации системы (раствора). При охлаждении расплава, пока в охлаждаемой системе не происходит фазовых превращений, температура расплава падает с определенной скоростью. Появление кристаллов сопровождается выделением теплоты кристаллизации и замедляет или приостанавливает падение температуры, вызывая излом или площадку на кривой охлаждения (рис.3а — кривые 2,3,5,6). При этом состав остающегося в жидком состоянии сплава изменяется, и температура его затвердевания непрерывно понижается во время кристаллизации. Выпадение кристаллов и равномерное понижение температуры происходят до тех пор, пока состав сплава не достигнет эвтектического состава. Эвтектика или эвтектическая смесь — это сплав, имеющий самую низкую температуру плавления. Температура, отвечающая точке (Е) на рисунке 3б представляет собой самую низкую температуру плавления, которую может иметь сплав данных двух металлов. Когда сплав достигнет эвтектического состава, падение температуры приостанавливается, так как эвтектика выделяется при постоянной температуре. После выделения эвтектики температура снова начинает падать (кривые 2-6). Кривые 1 и 7 характеризуют затвердевание чистых металлов. Все остальные кривые отражают процесс остывания сплавов с постепенно уменьшающимся содержанием металла А. Кривая 4 отвечает процессу затвердевания сплава эвтектического состава (примерно 60% металла Б и 40% металла А).
Из анализа кривых охлаждения (рис. 3а) следует, что смесь двух металлов при охлаждении претерпевает два фазовых превращения. Изломы на кривых характеризуют начало выделения из расплава кристаллов вещества A (кривая 2, 3) или вещества B (кривая 5,6), а площадки в нижней части кривых – выделение эвтектической смеси, насыщенной в отношении обоих компонентов. Таким образом, кристаллизация жидкой смеси двух металлов (кривые 2-6), в отличие от кристаллизации чистых металлов (кривые 1,7), сопровождается изменением состава жидкой фазы и лежит в некотором температурном интервале. Смесь эвтектического состава (кривая 4) кристаллизуется подобно чистым компонентам при постоянной температуре, поэтому дает монотонную кривую охлаждения с горизонтальным участком при эвтектической, наименьшей для данной системы температуре. После окончания кристаллизации идет охлаждение отвердевшей системы до температуры окружающей среды.
Определив с помощью кривых охлаждения температуры кристаллизации для смесей различных составов, строят диаграмму состояния (плавкости), схематичное построение которой показано на рисунке 3б.
| ; 1 |
| Рис. 3. Построение диаграммы плавкости для двух металлов А и В, полностью растворяющихся в жидком и нерастворяющихся в твердом состояниях и образующие сплав эвтектического состава: а) кривые охлаждения; б) диаграмма плавкости. |
I – гомофазная жидкая область
II, III – гетерофазные области (расплав + твердая фаза)
IV – гетерофазная область (Aтв + Втв)
E – эвтектика (состав с наименьшей tпл)
tАE – линия ликвидуса (liquid – жидкий) – геометрическое место точек, отвечающих температурам начала кристаллизации компонента A
tВE – линия ликвидуса – геометрическое место точек, отвечающих температурам начала кристаллизации компонента B
tAtEEtB – линия солидуса (solid – твердый), ниже которой существуют твердые фазы.
Диаграммы плавкости можно получить с помощью более точного дифференциально-термического метода анализа, по которому нагревание (охлаждение) исследуемого объекта ведут вместе и в одних и тех же условиях с веществом-эталоном, которое в условиях опыта не имеет превращений. В этом случае на одном и том же графике записывают и кривую «время — температура», и кривую «время — разность температур» объекта и эталона. Эта разность появляется при любом превращении исследуемого объекта, протекающем с поглощением (выделением) тепла. О характере превращений судят не по виду простой кривой нагревания (охлаждения), а по дифференциальной кривой, имеющей резко выраженные максимумы и минимумы в точках фазовых переходов, поэтому более точно определяется температуру превращений. Для записи кривых нагревания и охлаждения используют самопишущие приборы (например, пирометр Н.С.Курнакова), электронные потенциометры, оптические пирометры. Рассмотрим основные типы диаграмм плавкости.
5.2. Диаграмма плавкости двух металлов с неограниченной растворимостью в жидком и полной нерастворимостью в твердом состоянии
Пример построения такого вида диаграммы по кривым охлаждения рассмотрен на рисунке 3 и соответствует случаю, когда два компонента образуют одну жидкую фазу (расплав), при охлаждении которой выделяются (кристаллизуются) индивидуальные вещества и образуется сплав эвтектического состава, при этом сплавляемые металлы не образуют ни химических соединений, ни твердого раствора. Примером подобных сплавов могут служить сплавы: висмут-кадмий (эвтектика содержит 60% висмута и 40% кадмия), свинца с сурьмой (эвтектика содержит 13% сурьмы и 87% свинца), меди с серебром (эвтектика содержит 28% меди и 72% серебра) и др.
На рисунке 4 изображена диаграмма плавкости системы двух металлов Аи В. По горизонтальной оси указан состав сплава (стрелка указывает на увеличение содержания металла В); по вертикальной – температуры плавления.
Точка ТА соответствует температуре плавления чистого металла А. По мере прибавления к нему металла В, температура плавления понижается, вплоть до некоторой точки Е, соответствующей самой низкой температуре плавления сплава состава эвтектической смеси. В этой точке оба металла начинают кристаллизоваться одновременно, образуя эвтектику. При исследовании эвтектики под микроскопом она оказывается состоящей из мельчайших кристалликов двух металлов, тесно перемешанных друг с другом. Затем по мере увеличения содержания в сплаве металла В температура плавления снова начинает расти по кривой ЕТВ, пока не достигнет точки ТВ, показывающей температуру плавления чистого металла В.
Рис. 4. Диаграмма плавкости двойной системы, компоненты которой А и В не образуют твердых растворов и химических соединений. L — область существования жидкости (расплава); (L + SA) и (L + SB) — области сосуществования жидкой фазы и твердых металлов А и В соответственно; (SA + SB) — область существования механической смеси твердых А, В и эвтектики; ТАETВ – линия ликвидуса; MEN — линия солидуса; E-эвтектическая точка; С, D, F, G, О и Q примеры фигуративных точек.
Если исходить из металла В, постепенно прибавляя к смеси все больше металл А, то сначала температура плавления будет понижаться до точки Е, а затем возрастать до точки ТА. Всоответствии с вышесказанным на диаграмме можно выделить пять областей: L– жидкий сплав металлов А и В (гомофазная жидкая область); (L + SA) – смесь жидкого сплава и кристаллов А; (L + SB) – смесь жидкого сплава и кристаллов (гетерофазные области — расплав + твердая фаза); (SA + Е) – смесь эвтектики и кристаллов А; (Е + SB) – смесь эвтектики и кристаллов В — гетерофазные области (смесь двух твердых фаз).
Точка на диаграмме состояния, отвечающая составу образца при определенной температуре, называется фигуративной. Например, если фигуративная точка С, находится в гомогенной области L, никакие фазовые превращения не происходят. Если охлаждать жидкий сплав состава, который соответствует точке G на оси абсцисс, от фигуративной точки С (область расплава L), то из него сначала будут выделяться кристаллы металла В(от кривой ЕОТВ до точки D и ниже). По мере их выделения температура будет снижаться, и когда упадет до температуры, которая соответствует точке N, вся оставшаяся еще жидкой часть сплава в точке F начнет при постоянной температуре затвердевать, образуя эвтектическую смесь с мельчайшими кристалликами металла В.
источник
Обзор характеристик воды с повышенным содержанием хлоридов (натрия, кальция), их норм примесей, а также раскрытие вопроса вредного воздействия на живые организмы, бытовую технику и коммуникации.
Хлориды – это соли соляной кислоты. Магматические породы с хлорсодержащими минералами (хлорапатит, содалит и др.), а также соленосные отложения (галит) являются первичными источниками данного элемента.
Все природные воды содержат в своем составе хлориды, чаще всего встречающиеся в виде натриевых, магниевых и кальциевых солей. Их естественное содержание в грунтовых и артезианских водах обусловлено вулканическими выбросами, а также результатами кругового взаимодействия атмосферных осадков с почвами и обмена через атмосферу с океаном.
Хлориды, содержащиеся в значительном количестве в воде, могут быть следствием вымывания хлористых соединений или поваренной соли из пластов, соприкасающихся с водой.
Воды подземных источников, некоторых озер и морей в большом количестве содержат хлорид натрия (NaCl), присутствующий в воде хлорид кальция (CaCb) придает ей некарбонатную жесткость.
При оценке санитарного состояния водоема учитывают показатель содержания хлоридов в воде. Так, к примеру, незначительное содержание отмечается в водах северной части России, обычно, не выше 10 мг/л, тогда как соответствующий показатель, характерный для южных регионов, доходит до 10-100 мг/л.
Прослеживается тенденция заметных сезонных колебаний концентрации хлорид-ионов в поверхностных водах, что связано с коррелирующим изменением общей минерализации. Это обусловлено критерием загрязнения водоема из-за попадания в него хозяйственно-бытовых стоков.
Высокое содержание хлоридов заметно ухудшает вкусовые качества воды, делает ее соленой на вкус, а также практически непригодной для хозяйственных и технических нужд, в том числе для оросительных работ на сельскохозяйственных угодьях.
ПДК (предельно допустимая концентрация) хлоридов в воде не должна превышать 350 мг/л, в противном случае вода будет неприятной по вкусу – чрезмерно соленой.
Соленые (хлоридные) воды содержат соли хлоридной группы. Чаще всего катионный состав таких вод представляет натрий, образующий в сочетании с хлором поваренную соль, чем и обеспечен их соленый вкус. Причем, хлористый натрий заметно доминирует относительно других солей практически во всех хлоридных водах.
Хлористый магний преобладает в горько-соленых водах, где его все равно намного меньше, чем поваренной соли. Превышает количество растворенной поваренной соли в некоторых случаях содержащийся хлористый кальций в водах хлоридно-кальциевого типа.
Отличием от карбонатных и сульфатных ионов является их не предрасположенность к созданию ионных ассоциированных пар. Слабо выраженная сорбция с взвешенными веществами, легкая растворимость и потребление водными организмами объясняется хорошей миграционной способностью хлоридных анионов.
При попадании в организм человека, а также домашних животных воды, содержащей избыточное количество хлоридов:
- раздражаются слизистые оболочки, глаза, кожные покровы, дыхательные пути;
- проявляется негативное воздействие на секреторную деятельность желудка;
- ухудшается пищеварение;
- нарушается водно-солевой баланс;
- возникает вероятность развития заболеваний системы кровообращения;
- появляется склонность к возникновению новообразований мочеполовых органов, органов пищеварения, желудка, пищевода;
- избыточное поступление в организм хлористого натрия увеличивает частоту сердечно сосудистых заболеваний;
- появляется склонность к гипертензивным состояниям, повышенной реактивности сосудов;
- возникает вероятность желче- и мочекаменных заболеваний.
источник
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
Методы определения содержания хлоридов
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
Методы определения содержания хлоридов
Drinking water.
Method for determination
of chloride content
Настоящий стандарт распространяется на питьевую воду и устанавливает методы определения содержания хлоридов (хлор-иона).
Определение содержания хлор-иона в питьевой воде производят:
при содержании хлор-иона от 10 мг/дм 3 и выше титрованием азотнокислым серебром в присутствии хромовокислого калия в качестве индикатора;
при содержании хлор-иона до 10 мг/дм 3 титрованием азотнокислой ртутью в присутствии индикатора дифенилкарбазона.
1.1. Отбор проб производят по ГОСТ 2874 и ГОСТ 4979.
1.2. Объем пробы воды для определения содержания хлоридов должен быть не менее 250 см 3 .
1.3. Пробы воды, предназначенные для определения хлоридов, не консервируют.
Метод основан на осаждении хлор-иона в нейтральной или слабощелочной среде азотнокислым серебром в присутствии хромовокислого калия в качестве индикатора. После осаждения хлорида серебра в точке эквивалентности образуется хромовокислое серебро, при этом желтая окраска раствора переходит в оранжево-желтую. Точность метода 1-3 мг/дм 3 .
2.2 Аппаратура, материалы и реактивы
Посуда мерная стеклянная лабораторная по ГОСТ 1770, ГОСТ 29227, ГОСТ 29251, вместимостью: пипетки 100, 50 и 10 см 3 без делений; пипетка 1 см 3 с делением через 0,01 см 3 ; цилиндр мерный 100 см 3 ; бюретка 25 см 3 со стеклянным краном.
Колбы конические по ГОСТ 25336, вместимостью 250 см 3 .
Пробирки колориметрические с отметкой на 5 см 3 .
Воронки стеклянные по ГОСТ 25336.
Фильтры беззольные «белая лента».
Серебро азотнокислое по ГОСТ 1277.
Натрий хлористый по ГОСТ 4233.
Квасцы алюмокалиевые (алюминий-калий сернокислый) по ГОСТ 4329.
Калий хромовокислый по ГОСТ 4459.
Аммиак водный по ГОСТ 3760, 25 %-ный раствор.
Вода дистиллированная по ГОСТ 6709.
Все реактивы, используемые для анализа, должны быть квалификации чистые для анализа (ч. д. а.).
2.3.1. Приготовление титрованного раствора азотнокислого серебра.
2,40 г химически чистого AgNO 3 растворяют в дистиллированной воде и доводят объем раствора дистиллированной водой до 1 дм 3 .
1 см 3 раствора эквивалентен 0,5 мг С l — .
Раствор хранят в склянке из темного стекла.
2.3.2. Приготовление 10%-ного раствора (подкисленного азотной кислотой) азотнокислого серебра
10 г AgNO 3 растворяют в 90 см 3 дистиллированной воды и добавляют 1-2 капли HNO 3 .
2.3.3. Приготовление титрованного раствора хлористого натрия
0,8245 г химически чистого NaCl , высушенного при 105 °С, растворяют в дистиллированной воде и доводят объем раствора дистиллированной водой до 1 дм 3 .
1 см 3 раствора содержит 0,5 мг С l — .
2.3.4. Приготовление гидроокиси алюминия
125 г алюмокалиевых квасцов [ AlK ( SO 4 )2 × 12H2O] растворяют в 1 дм 3 дистиллированной воды, нагревают до 60 °С и постепенно прибавляют 55 см 3 концентрированного раствора аммиака при постоянном перемешивании. После отстаивания в течение 1 ч осадок переносят в большой стакан и промывают декантацией дистиллированной водой до исчезновения реакции на хлориды.
2.3.5. Приготовление 5 %-ного раствора хромовокислого калия
50 г К2С r О4 растворяют в небольшом объеме дистиллированной воды и доводят объем раствора дистиллированной водой до 1 дм 3 .
2.3.6. Установка поправочного коэффициента к раствору азотнокислого серебра.
В коническую колбу вносят пипеткой 10 см 3 раствора хлористого натрия и 90 см 3 дистиллированной воды, добавляют 1 см 3 раствора хромовокислого калия и титруют раствором азотнокислого серебра до перехода лимонно-желтой окраски мутного раствора в оранжево-желтую, не исчезающую в течение 15-20 с. Полученный результат считают ориентировочным. К оттитрованной пробе прибавляют 1-2 капли раствора хлористого натрия до получения желтой окраски. Эта проба является контрольной при повторном, более точном определении. Для этого отбирают новую порцию раствора хлористого натрия и титруют азотнокислым серебром до получения незначительной разницы оттенков слабо-оранжевого в титруемом растворе и желтого в контрольной пробе. Поправочный коэффициент ( К) вычисляют по формуле
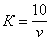
где v — количество азотнокислого серебра, израсходованное на титрование, см 3 .
2.4.1. Качественное определение
В колориметрическую пробирку наливают 5 см 3 воды и добавляют три капли 10 %-ного раствора азотнокислого серебра. Примерное содержание хлор-иона определяют по осадку или мути в соответствии с требованиями таблицы.
Характеристика осадка или мути
1. Опалесценция или слабая муть
3. Образуются хлопья, осаждаются не сразу
2.4.2. Количественное определение
В зависимости от результатов качественного определения отбирают 100 см 3 испытуемой воды или меньший ее объем (10-50 см 3 ) и доводят до 100 см 3 дистиллированной водой. Без разбавления определяются хлориды в концентрации до 100 мг/дм 3 . p Н титруемой пробы должен быть в пределах 6-10. Если вода мутная, ее фильтруют через беззольный фильтр, промытый горячей водой. Если вода имеет цветность выше 30°, пробу обесцвечивают добавлением гидроокиси алюминия. Для этого к 200 см 3 пробы добавляют 6 см 3 суспензии гидроокиси алюминия, а смесь встряхивают до обесцвечивания жидкости. Затем пробу фильтруют через беззольный фильтр. Первые порции фильтрата отбрасывают. Отмеренный объем воды вносят в две конические колбы и прибавляют по 1 см 3 раствора хромовокислого калия. Одну пробу титруют раствором азотнокислого серебра до появления слабого оранжевого оттенка, вторую пробу используют в качестве контрольной пробы. При значительном содержании хлоридов образуется осадок AgCl , мешающий определению. В этом случае к оттитрованной первой пробе приливают 2-3 капли титрованного раствора NaCl до исчезновения оранжевого оттенка, затем титруют вторую пробу, пользуясь первой, как контрольной пробой.
Определению мешают: ортофосфаты в концентрации, превышающей 25 мг/дм 3 ; железо в концентрации более 10 мг/дм 3 . Бромиды и йодиды определяются в концентрациях, эквивалентных С l — . При обычном содержании в водопроводной воде они не мешают определению.
Содержание хлор-иона ( X), мг/дм 3 , вычисляют по формуле
где v — количество азотнокислого серебра, израсходованное на титрование, см 3 ;
К — поправочный коэффициент к титру раствора нитрата серебра;
g — количество хлор-иона, соответствующее 1 см 3 раствора азотнокислого серебра, мг;
V — объем пробы, взятый для определения, см 3 .
Расхождения между результатами повторных определений при содержании С l — от 20 до 200 мг/дм 3 — 2 мг/дм 3 ; при более высоком содержании — 2 отн. %.
3. ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ХЛОР-ИОНА В ВОДЕ ТИТРОВАНИЕМ АЗОТНОКИСЛОЙ РТУТЬЮ В ПРИСУТСТВИИ ИНДИКАТОРА ДИФЕНИЛКАРВАЗОНА
Хлориды титруют в кислой среде раствором азотнокислой ртути в присутствии дифенилкарбазона, при этом образуется растворимая, почти диссоциирующая хлорная ртуть. В конце титрования избыточные ионы ртути с дифенилкарбазоном образуют окрашенное в фиолетовый цвет комплексное соединение. Изменение окраски в эквивалентной точке выражено четко, в связи с этим конец титрования определяется с большой точностью.
Точность метода 0,5 мг/дм 3 .
3.2. Аппаратура, материалы и реактивы.
Посуда мерная стеклянная лабораторная по ГОСТ 1770, ГОСТ 29227, ГОСТ 29251, вместимостью: пипетки 100 и 50 см 3 без делений, цилиндр мерный 100 см 3 микробюретка 2 см 3 .
Колбы конические по ГОСТ 25336, вместимостью 250 см 3 .
Ртуть азотнокислая окисная по ГОСТ 4520.
Натрий хлористый по ГОСТ 4233.
Кислота азотная по ГОСТ 4461.
Спирт этиловый ректификованный по ГОСТ 5962.
Бромфеноловый синий (индикатор).
Все реактивы, используемые для анализа, должны быть квалификации чистые для анализа (ч. д. а.).
3.3.1. Приготовление 0,0141 н. раствора азотнокислой ртути
2,42 г Hg ( N О3)2 × 1 /2Н2 O растворяют в 20 см 3 дистиллированной воды к которой прибавлено 0,25 см 3 концентрированной азотной кислоты, затем объем раствора доводят дистиллированной водой до 1 дм 3 .
1 см 3 этого раствора эквивалентен 0,5 мг С l — .
Раствор устойчив в течение четырех месяцев.
Поправочный коэффициент к титру раствора азотнокислой ртути определяют титрованием 5 см 3 хлористого натрия (1 см 3 — 0,5 мг С l — ), разбавленного до 100 см 3 дистиллированной водой, в тех же условиях, как при анализе пробы воды.
3.3.2. Приготовление дифенилкарбазона, спиртового раствора смешанного индикатора
0,5 г дифенилкарбазона и 0,05 г бромфенолового синего растворяют в 100 см 3 95 %-ного этилового спирта. Хранят в склянке из темного стекла.
3.3.3. Приготовление 0,2 н. раствора азотной кислоты
12.8 мл концентрированной азотной кислоты разводят дистиллированной водой до 1 дм 3
Все растворы готовят на дважды перегнанной дистиллированной воде.
Отбирают 100 см 3 испытуемой воды, прибавляют 10 капель смешанного индикатора и по каплям 0,2 н. раствор HNO 3 до появления желтой окраски (рН 3,6), после чего прибавляют еще пять капель 0,2 н. раствора HNO 3 и титруют из микробюретки раствором азотнокислой ртути. К концу титрования окраска раствора приобретает оранжевый оттенок. Титрование продолжают медленно, по каплям добавляя раствор азотнокислой ртути, сильно взбалтывая пробу до появления слабо-фиолетового оттенка.
Для определения более четкого конца титрования используют контрольную пробу, в которой к 100 см 3 дистиллированной воды прибавляют индикатор, 0,2 н. раствор азотной кислоты и одну каплю раствора азотнокислой ртути.
Метод может быть использован для определения и более высоких концентраций хлоридов в воде (более 10 мг/дм 3 ). В этом случае отбирают меньший объем воды (содержание С l — в отобранном объеме должно быть не менее 10 мг) и разбавляют дистиллированной водой до 100 см 3 прибавляют те же реактивы и в том же количестве и титруют из бюретки раствором азотнокислой ртути, как описано выше.
Определению не мешают цветность воды выше 30° и железо в концентрации, превышающей 10 мг/дм 3 . Йодиды и бромиды определяют в концентрациях, эквивалентных С l — .
Содержание хлор-иона ( X) в мг/дм 3 вычисляют по формуле
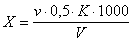
где v — количество азотнокислой ртути, израсходованное на титрование, см 3 ;
К — поправочный коэффициент к титру раствора азотнокислой ртути;
V — объем воды, взятый для определения, см 3 .
Расхождения между результатами повторных определений при содержании С l — в воде до 10 мг/дм 3 — 0,5 мг/дм 3 .
1. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета стандартов Совета Министров СССР
3. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
источник
Защите окружающей среды от возрастающей антропогенной нагрузки в настоящее время уделяется все большее внимание во всем мире. Развитие промышленности, в том числе и химической, увеличение добычи ископаемого сырья, расширение использования транспорта сопровождается поступлением в окружающую среду больших количеств различных загрязняющих веществ.
Сильное загрязнение окружающей среды (воды, воздуха, почвы) приводят к возникновению неблагоприятных последствий: нарушению нормальной жизнедеятельности биосферы, изменению климата, исчезновению многих видов растений и животных, ухудшению здоровья населения.
Для предотвращения или снижения загрязнения издаются природоохранительные законы и проводятся различные мероприятия – технологические, санитарно-технические, технические, правовые, медицинские и т.п. В основе всех мероприятий лежит контроль за содержанием вредных веществ, который регламентируется санитарно-гигиеническими нормативами – ПДК. Контроль необходим для получения информации об уровне загрязнения, а также об источниках выбросов, причинах и факторах, определяющих загрязнение. Полученные данные позволяют выбирать или проводить защитные, оздоровительные мероприятия и следить за их выполнением.
К качеству контроля предъявляются требования надежности и точности, применяемые методы должны быть достаточно чувствительны и избирательны. Независимо от техники выполнения надежность результатов анализа зависит от учета возможных химических, фотохимических и биохимических превращений загрязняющих веществ в разных средах, а также возможности миграции их из одной среды в другую. Данные о загрязнении одной среды должны увязываться с данными о загрязнении другой среды.
1 . Распространение хлорид-иона
Хлорид-ион образуется в результате растворения и сольватации ионных солей, содержащих анион хлора (хлориды). Следовательно, существование хлорид-иона возможно только в водных растворах. В почвах хлорид ион может также содержатся в составе кристаллических солей. В природе хлор представленный хлорид ионом имеет значительное распространение: 0,02% от массы земной коры. Для сравнения это столько же, сколько и углерода или в 10 раз больше чем свинца. Самые распространенные минералы, содержащие хлорид ион: галит NaCl, сильвинит NaCl*KCl, карналлит KCl*MgCl2 . Хлориды тяжелых металлов нерастворимы, хлориды щелочных и щёлочноземельных металлов растворимы все. Значительная растворимость хлоридов обусловила их распространение на планете. Основным местонахождением хлоридов является Мировой океан. По содержанию солей воды мирового океана являются хлоридно-натриевыми. Средняя концентрация хлорид-иона составляет 546 ммоль/л (19 г./л). Значительное содержание хлоридов во внутренних водоёмах явление редкое. Оно колеблется в пределах 5–80 мг/л. Повышенное содержание хлоридов объясняется загрязнением водоема сточными водами некоторых производств. Однако тому причиной может быть и выщелачивание материнской породы содержащей хлоридные соли.
Содержание хлорид иона в поверхностных слоях почвах, также не может достигать значительных величин вследствие интенсивного вымывания хлоридов под воздействием атмосферных осадков. Однако возможно присутствие значительных концентраций хлоридов в следующих случаях:
– вследствие засоления почв в результате подъёма высокоминерализованных подземных вод;
– в результате постоянного притока вод с последующим испарением жидкости.
Отсюда два различных местанахождения хлоридов. В первом случае это жидкость влажной почвы, а во втором растворённые хлориды образуют включения кристаллических солей в грунте.
2. Методы определения хлорид-иона
Необходимость определения хлорид-ионов возникает при анализе различных веществ, природных, питьевых и сточных вод. Контроль содержания хлорид-ионов требует различных уровней – от макроконцентраций до 10 -7 % в особо чистой воде. Существующие государственные стандарты (ГОСТы), регламентируют, какое веществом каким методом и с помощью какого оборудования нужно определять. Современные нормативные документы, регламентирующие процедуру контроля содержания загрязнителей в водах различного происхождения, разрешают использование химических, физико-химических и физических методов анализа. Основная масса лабораторий, проводящих мониторинг вод, не всегда располагает современным оборудованием для реализации физических методов анализа, позволяющих быстро, правильно и точно определять концентрацию загрязнителей. Наиболее массово по-прежнему представлены химические методы. Возможности разработанных на основе этих методов методик определения содержания в воде неорганических загрязнителей не всегда удовлетворяют требованиям ГОСТ, особенно при анализе вод природного происхождения. Многие загрязнители в воде можно обнаруживать разными способами, на разном оборудовании, но разные методы анализа дают различную погрешность, некоторые могут не учитывать какие-либо мешающие факторы. Определение хлоридов в этом отношении имеет ряд преимуществ. Их содержание редко пускается до микроконцентраций, и поэтому основные методики определения хлоридов всё ещё остаются методами «мокрой» химии. Однако в последнее время инструментальные методы применяются все чаще. Инструментальные методы позволяют автоматизировать анализ, сделать его экспрессным, значительно уменьшают расход вспомогательных реактивов. Определение хлоридов можно проводить такими методами:
Титриметрическое определение хлоридов может выполняться как химическими так и инструментальными методами анализа.
2.2 Химические методы определения хлорид иона
2.2.1 Требования к титриметрическим методам определения
Титриметрические определения хлоридов, основаны на реакциях образования осадков малорастворимых соединений. Не все реакции сопровождающиеся выпадением осадков применимы в объемном анализе. В этих реакциях пригодны только некоторые реакции, удовлетворяющие определенным условиям. Реакция должна протекать строго по уравнению и без побочных процессов. Образующийся осадок должен быть практически нерастворимым и выпадать достаточно быстро, без образования пересыщенных растворов. К тому же необходимо иметь возможность определять конечную точку титрования с помощью индикатора. Наконец, явления адсорбции (соосаждения) должны быть выражены при титровании настолько слабо, чтобы результат определения не искажался.Наименования отдельных методов осаждения происходят от названий применяемых растворов. Метод, использующий раствор нитрата серебра, называют аргентометрией. Тиоцианатометрия основана на применении раствора тиоцианата аммония NH4 SCN (или калия KSCN) и служит для определения следов С1 — в сильнощелочных и кислых растворах. Дорогостоящий аргентометрический метод определения галогенидов по возможности стараются заменять меркурометрическим. В последнем используют раствор нитрата ртути (I) Hg2 (NO3 )2 .2.2.2 Аргентометрия Объемный аналитический метод, основанный на реакциях осаждения ионов галогенов катионами серебра с образованием малорастворимых галогенидов: Cl — +Ag + = AgCl↓ При этом используют раствор нитрата серебра. Если же анализируют вещество на содержание серебра, то пользуются раствором хлорида натрия (или калия).Для понимания метода аргентометрии большое значение имеют кривые титрования. В качестве примера рассмотрим случай титрования 10,00 мл 0,1 н. раствора хлорида натрия 0,1 н. раствором нитрита серебра (без учета изменения объема раствора).
| Прибавлено раствора AgNO3 , мл | [С1 — ] | [Ag + ] | рСl | pAg |
| 10 -1 | 1 | — | ||
| 9.00 | 10 -2 | 10 -8 | 2 | 8 |
| 9.90 | 10 -3 | 10 -7 | 3 | 7 |
| 9.99 | 10 -4 | 10 -6 | 4 | 6 |
| 10.00 (точка эквивалентности) | 10 -5 | 10 -5 | 5 | 5 |
| 10,01 | 10 -6 | 10 -4 | 6 | 4 |
| 10,10 | 10 -7 | 10 -3 | 7 | 3 |
| 11,00 | 10 -8 | 10 -2 | 8 | 2 |
| 20,00 | 10 -9 | 10 -1 | 9 | 1 |
В качестве стандартных растворов для определения галогенидов, цианидов и роданидов применяют нитрат или перхлорат ртути(II), а для определения ионов хорошо диссоциирующих солей ртути – роданид аммония.
источник
Определение хлорид-ионов в питьевой воде
Важнейшей среди водоохранных проблем является разработка эффективных с эколого-гигиенических позиций методов подготовки поверхностных вод для питьевых целей.
Загрязнение природных источников питьевого водоснабжения при недостаточной эффективности работы водоочистных сооружений влечёт за собой ухудшение качества подаваемой потребителям питьевой воды и создаёт опасность для здоровья населения во многих регионах России, обусловливает высокий уровень заболеваемости кишечными инфекциями, гепатитом, увеличивает степень риска воздействия на организм человека канцерогенных и мутагенных факторов.
Каждый второй житель нашей страны вынужден использовать для питьевых целей воду, не соответствующую по ряду показателей гигиеническим требованиям; почти треть населения страны пользуется децентрализованными источниками водоснабжения; население ряда регионов страдает от недостатка питьевой воды и отсутствия связанных с этим санитарно-бытовых условий. Отставание России от развитых стран по средней продолжительности жизни и повышенная смертность в значительной мере связаны с потреблением недоброкачественной воды.
Более 100 лет наиболее распространенным способом борьбы с загрязнением в России является метод обеззараживания воды хлором. Хлор, используемый для дезинфекции, больше всего нам портит жизнь. В последние годы было установлено, что хлорирование воды представляет серьёзную угрозу для здоровья людей, поскольку попутно образуются крайне вредные хлорорганические соединения и диоксины. Хотя вначале хлор спасает от инфекций, однако потом его производные начинают медленно отравлять организм, т. к. обладают канцерогенным, мутагенным эффектом, влияют на наследственность. По данным американских исследователей, у людей, постоянно употребляющих хлорированную воду, вероятность рака мочевого пузыря на 21% и рака прямой кишки на 38% выше, чем у тех, кто пьёт очищенную, но не хлорированную воду.
Перед употреблением водопроводную воду надо очищать. Для освобождения от хлора воду целесообразно отстаивать (от нескольких часов до нескольких суток). Для освобождения от микробов и хлора воду необходимо кипятить не более 1-3 минут. Сырую воду можно пить только в крайних случаях. Нежелательно использовать для приготовления пищи горячую водопроводную воду, т. к. горячая вода химически более агрессивная, и это может приводить к выщелачиванию из водопроводных труб тяжёлых металлов, которые накапливаются в жизненно важных органах человека, вызывая со временем их заболевания.
В последнее время для доочистки воды стали использовать различные бытовые фильтры. Фильтр должен удалять микробы, хлор и его производные, тяжёлые металлы, нефтепродукты, нитраты и нитриты, пестициды. Однако опасно и вторичное загрязнение воды микроорганизмами, осевшими на самом фильтре. Японцы и американцы переходят сейчас на электрохимические фильтры. Принцип их действия основан на химической реакции, проходящей под воздействием сильного электрического поля в присутствии катализатора. В результате вода полностью очищается от микроорганизмов, органических соединений и ионов тяжёлых металлов. Эти фильтры – вечные, в них нет расходуемых материалов, однако нужна электроэнергия.
Добиться снижения концентрации вредных веществ в питьевой воде можно путём замены хлорирования на озонирование или обработку УФ-лучами. Эти прогрессивные методы широко внедряются на станциях водоподготовки многих стран Западной Европы и США. В нашей стране, к сожалению, из-за экономических трудностей применение экологически эффективных технологий осуществляется крайне медленно.
На ряде отечественных станций водоподготовки на заключительной стадии используют сорбционные процессы с применением активированных углей (адсорбентов), которые эффективно извлекают из воды нефтепродукты, СПАВ, пестициды, хлорорганические и другие соединения, в том числе и обладающих канцерогенными свойствами.
При неуклонном возрастании техногенного загрязнения поверхностных вод в мировой практике питьевого водоснабжения наметилась тенденция к переходу на использование артезианских (подземных) вод. Уровень их минерализации, органического, бактериального и биологического загрязнения намного ниже. В ряде случаев такие воды вполне отвечают гигиеническим требованиям и могут подаваться потребителям, минуя традиционную подготовку.
Предельно допустимая концентрация (ПДК) хлорид-ионов в питьевых водах 250 – 350 мг/л.
Хлориды определяются путём титрования анализируемой воды азотнокислым серебром в присутствии хромовокислого калия как индикатора, показывающего окончание реакции. Азотнокислое серебро с ионом хлора дает белый осадок хлорида серебра, а с хромовокислым калием красный осадок хромата серебра. Из образовавшихся осадков меньшей растворимостью обладает хлорид серебра. Поэтому, после того как весь хлор будет связан, образуется хромовокислое серебро. Появление красной окраски свидетельствует о конце реакций. Ход реакций выразится следующими уравнениями:
Титрование может проводиться в нейтральной или слабощелочной среде. Кислую анализируемую воду нейтрализуют бикарбонатом.
При концентрации хлоридов меньше 7 мг/лопределение не дает точного результата. В этом случае исследуемую воду упаривают в три раза и снова титрованием определяют в ней количество хлора, учитывая при дальнейшем расчете количество выпаренной воды.
Целью лабораторной работы является овладение знаниями, умениями и навыками, связанными с определением содержания хлоридов в питьевой воде.
Дата добавления: 2014-12-08 ; Просмотров: 894 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Аналитический центр более 20 лет занимается химическим анализом и разработкой новых методов анализа и диагностики веществ и материалов
В нашем распряжении самый современный приборный парк благодаря научно-техническому взаимодействию с крупнейшими мировыми разработчиками аналитического оборудования
Наши сотудники — это лучшие специалисты страны в области химического анализа, кандидаты и доктора наук
Аккредитация позволяет исследовать питьевую, природную, морскую, технологическую, талую воду и воду бассейнов
Обратившись к нам, Вы получите не только точные данные о присутствующих в воде загрязнителях, но и подробные рекомендации о способах очистки воды.
На основании анализа воды БЕСПЛАТНО подберем несколько вариантов систем водоочистки!
В нашей лаборатории Вы можете проверить качество воды из любого источника: колодца, скважины, водопровода, бассейна, родника, водоема. Для каждого источника есть оптимальный набор показателей, характеризующий возможность использования воды для тех или иных нужд. Чтобы правильно подобрать набор показателей, свяжитесь с нами по номеру +7 (495)149-23-57 или напишите на почту info@ion-lab.ru
Мы рекомендуем выбирать набор параметров в зависимости от того, какой у Вас источник водоснабжения, а также для каких целей планируете использовать воду. Для воды из городского водопровода, а также для воды, используемой в технических целях, подойдут наборы «Минимальный» или «Начальный». Для воды природных источников (скважины, колодцы, родники и т.д.) мы рекомендуем проверить воду на химический состав (наборы «Расширенный» или «Максимальный»), а также сделать анализ на микробиологию.
Да, Вы можете самостоятельно отобрать воду для анализа, следуя инструкции. Или же заказать выезд специалиста, который приедет в назначенное время со всей необходимой тарой, отберет воду и доставит ее в лабораторию.
Да, конечно! Пункт приема проб расположен по адресу: Москва, ул. Добролюбова, 21А, корпус А, пом. 14 (в пешей доступности от метро Фонвизинская, Бутырская, Тимирязевская)
Стоимость выезда специалиста зависит от выбранного Вами набора показателей и удаленности. Более точная информация размещена в разделе Доставка и оплата
© 1997-2019 — Лаборатория ИОН. Все права защищены.
Для химического анализа необходимо заполнить водой чистую пластиковую тару (оптимально 1,5 л). Использовать бутылки из-под сладких, газированных или ароматизированных напитков, а также солёной или минеральной воды недопустимо.
Если выбранный Вами анализ включает определение содержания нефтепродуктов, необходимо заполнить дополнительную стеклянную тару объемом 0,2 л.
Если выбранный Вами анализ включает определение содержания сероводорода, необходимо заполнить дополнительную стеклянную тару объемом 0,5 л (необходимо использовать консервант).
При отборе воды из проточного источника, непосредственно перед отбором необходимо пролить воду сильной струёй в течение 3-5 минут. Перед отбором проб ёмкости и крышки необходимо 3 раза промыть изнутри водой, подлежащей анализу. Использование моющих средств недопустимо. Наполнять тару необходимо тонкой струёй по стенке сосуда «под горлышко». Это снижает насыщение воды кислородом и предотвращает протекание реакций.
Для микробиологического анализа необходимо использовать стерильный контейнер для биоматериалов объемом 150-200 мл.
Перед взятием пробы необходимо протереть водопроводный кран спиртовой салфеткой, уделив особое внимание месту выхода воды.
При отборе воды из водопровода, скважины или колонки необходимо пролить воду сильной струёй в течение 3–5 минут.
При отборе воды из колодца с помощью ведра необходимо обдать ведро кипятком для дезинфекции. Отбор пробы через поливочные шланги и предметы, контактирующие с почвой, не допускается.
Для отбора пробы необходимо надеть перчатки и вскрыть упаковку стерильного контейнера. Не касаясь внутренней поверхности ёмкости, отобрать образец воды (2/3 объема контейнера) и закрыть крышкой.
Рекомендуем доставлять пробу сразу после отбора.
Если сразу после отбора нет возможности доставить пробу в лабораторию, допускается хранение образцов при температуре 2–10 °C в течение 1 суток.
Съезд на ул. Руставели, на первом светофоре поворот налево на ул. Яблочкова.
Через 300 м поворот направо на ул. Гончарова, через 500 м поворот налево (напротив дома №6), через 200 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Поворот на ул. Руставели, на светофоре поворот направо на ул. Добролюбова, через 300м на светофоре поворот налево на ул. Гончарова, напротив дома №6 поворот направо, через 200 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Двигаясь по ул. Милошенкова, поворачиваем на ул. Добролюбова
Через 150 метров поворот направо, за домом 21АкБ поворот налево, через 100-120 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Ближайшее станция метро – Фонвизинская (600 м)
Последний вагон из центра. Выход в сторону улицы Фонвизина. Из стеклянный дверей направо. Перейти через пешеходный переход и идти через дворы в соответствии со схемой. Пункт назначения — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Анализ «Минимальный» содержит минимальный и обязательный перечень загрязнителей, часто встречающихся в питьевой воде, и включает 16 показателей:
- органолептические: мутность, цветность, запах, привкус;
- общехимические: рН, жесткость, окисляемость перманганатная, минерализация, электропроводность, щелочность общая, щелочность свободная;
- катионы: железо, аммоний;
- анионы: нитраты, карбонат, гидрокарбонат.
Данный набор рекомендуется для исследования воды хозяйственно-бытового назначения. Анализ «Минимальный» не обладает достаточной информативностью для подбора системы водоочистки, так как не позволяет получить полную картину о безопасности воды. Если Вы планируете использовать воду в питьевых целях, рекомендуем обратить внимание на наборы, содержащие большее число параметров.
- Точность определения
- Подходит для воды, применяемой в хоз-бытовом назначении
- Срок выполнения — 3-4 рабочих дня
- Не подходит для воды, применяемой в питьевых целях
- Не подходит для корректного подбора фильтров
- Не содержит определения опасных загрязнителей
Анализ «Начальный» предназначен для выявления наиболее часто встречающихся вредных веществ в питьевой воде и включает 23 параметра: мутность, цветность, запах, привкус, рН, жесткость, окисляемость, минерализация, электропроводность, щелочность свободная, щелочность общая, железо, марганец, калий, магний, кальций, фториды, хлориды, нитраты, сульфаты, карбонат, гидрокарбонат, аммоний Данный анализ рекомендуется для оценки качества воды из колодцев, скважин, родников. По протоколу анализа «Начальный» возможен подбор системы водоочистки и типа фильтрующей загрузки. В перечень определяемых параметров входят органолептические показатели, общие химические показатели, а также содержание катионов и анионов
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для колодцев и скважин
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Позволяет корректно и экономично настроить водоочистное оборудование
- Не содержит перечень тяжелых металлов
- Не содержит перечень всех опасных загрязнений
- Срок выполнения исследований 5-6 рабочих дней
Анализ «Расширенный» содержит перечень наиболее часто встречающихся загрязнителей воды, вне зависимости от источника, и включает 31 показатель: мутность, цветность, запах, привкус, рН, жесткость, окисляемость, минерализация, электропроводность, щелочность общая, щелочность свободная, аммоний, алюминий, железо общее, магний, кальций, калий, натрий, марганец, медь, мышьяк, свинец, кадмий, цинк, стронций, фториды, хлориды, нитраты, сульфаты, гидрокарбонат, карбонат. Данный набор рекомендуется, в первую очередь, владельцам колодцев и скважин. Содержит перечень основных тяжелых металлов. Перед покупкой системы водоподготовки рекомендуем провести исследование воды с данным перечнем загрязнителей. Ориентируясь на полученную информацию, Вы сможете подобрать оборудование водоочистки с эффективностью до 98%, а так же корректно его настроить.
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для колодцев и скважин
- Содержит перечень тяжелых металлов
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Позволяет корректно и экономично настроить водоочистное оборудование
Анализ «Максимальный» содержит полный перечень опасных для здоровья человека веществ, встречающихся в воде, поступающих из скважин или колодцев, включая ионы тяжелых металлов и органические вещества, а именно: мутность, цветность, запах, привкус, рН, жесткость, окисляемость, минерализация, электропроводность, щелочность общая, щелочность свободная, аммоний, натрий, калий, магний, кальций, алюминий, железо, марганец, литий, барий, бериллий, бор, ванадий, молибден, кобальт, цинк, никель, хром, стронций, кадмий, мышьяк, медь, свинец, кремний, серебро, титан, ртуть, гиброкарбонат, карбонат, нитрат, хлорид, сульфат, фосфат, фторид, нитрит, сероводород, сульфид, гидросульфид, хлор общий, хлор остаточный, хлор остаточный свободный, АПАВ, нефтепродукты, фенол, формальдегид, бензол, толуол, о-ксилол, п-ксилол, м-ксилол, стирол Данное исследование рекомендуется для клиентов, которые серьезно относятся к выбору питьевой воды. Протокол анализа «Максимальный» позволяет со 100% уверенностью сделать вывод о пригодности воды для питья и приготовления пищи. Результаты исследования позволяют выбрать схему водоочиски, а также оценить эффективность уже установленного оборудования.
Воды, применяемой в хозяйственно-бытовом назначении; оценки работы системы водоочистки.
пластиковая бутылка 1,5 — 2 л.
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для любых источников воды
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Включает полный перечень тяжелых металлов
- Позволяет корректно и экономично настроить водоочистное оборудование
- Содержит полный перечень опасных органических веществ
Помимо хичиеского анализа воды мы настоятельно рекомендуем провести микробиологическое исследование Вашей воды. Микробиологический анализ воды включает определение общего микробного числа (ОМЧ), количества общих колиформных и колиформных термотолерантных бактерий.
источник