Жёсткость – технологическая характеристика качества воды любого происхождения, связанная с содержанием растворимых в ней соединений кальция и магния. Она определят, в основном, потребительские качества воды и потому анализ воды на жесткость имеет важное хозяйственное значение. Общая жесткость определяется как суммарное содержание всех солей кальция и магния в растворе.
В разных странах существуют свои нормы жесткости для воды. У нас в стране вода классифицируется по жесткости таким образом: вода считается мягкой, если её жёсткость (Q) меньше 4 ммоль/л, средняя – 4-8, жёсткая – 8-12, очень жёсткая – свыше 12ммоль/л.
Рекомендованная единица СИ для измерения концентрации — моль на кубический метр (моль/м³), однако, на практике для измерения жёсткости используются градусы жёсткости и миллиграммы эквивалента на литр (мг-экв/л).
— Мягкая вода с жесткостью менее 3,0 мг-экв/л,
— Средней жесткости – 3,0-6,0 мг-экв/л
— Жесткая – более 6,0 мг-экв/мл.
В разных странах использовались (иногда используются до сих пор) различные внесистемные единицы — градусы жёсткости. По величине общей жёсткости различают воду мягкую (до 2 °Ж), средней жёсткости (2-10 °Ж) и жёсткую (более 10 °Ж).
Жёсткость воды поверхностных источников существенно колеблется в течение года; она максимальна в конце зимы, минимальна — в период паводка
Химический анализ воды показал, что существует два типа жесткости: временная и постоянная. Временная (карбонатная) жёсткость обусловлена наличием гидрокарбонатов кальция и магния (Ca(HCO3)2 , Mg(HCO3)2). Устраняется кипячением.Если в воде присутствуют ионы железа, то образуется FeCO3 — неустойчивое в воде вещество. В присутствии кислорода конечным продуктом цепочки реакций оказывается Fe(OH)3, представляющий собой темно-рыжий осадок. Поэтому, чем больше в воде железа, тем сильнее окраска у накипи, которая осаждается на стенках и дне сосуда при кипячении
Постоянная (некарбонатная) жёсткость обусловлена наличием хлоридов, сульфатов, нитратов и других анионов. Кипячением не устраняется. Для её устранения используют химические и физические способы.
Химический способ основан на переводе растворимых соединений кальция и магния в нерастворимые и удалением их при фильтровании.
. Физические способы основаны на применении ионообменных смол. Наиболее широко используется катионообменный способ, основанный на применении специальных реагентов – катионитов, которые загружаются в фильтры и при пропускании через них воды, заменяют катионы кальция и магния на катион натрия.
Лучшим реагентом для устранения общей жесткости воды является ортофосфат натрия Na3PO4, входящий в состав большинства препаратов бытового и промышленного назначения
Полностью очистить воду от солей жёсткости можно дистилляцией.
Анализ воды на жесткость в лаборатории производится комплексонометрическийм методом и методом нейтрализации.
Комплексонометрический метод основан на образовании устойчивых комплексонатов при взаимодействии ионов металлов с комплексоном III (метод комплексонометрии). В основе этого метода лежит титрование воды в присутствии аммонийного буферного раствора (pH=10,0) и индикатора хромогена чёрного раствором комплексона III до перехода винно-красной окраски в синюю.
Анализ проб воды на временную жесткость проводят, используя метод нейтрализации в основе, которого лежит титрование воды в присутствии индикатора метилового оранжевого раствором соляной кислоты до перехода жёлтой окраски индикатора в оранжевую. При добавлении кипячении карбонатная жесткость воды уменьшается на 57-70%.
Таким образом, можно определить общую и временную жесткость воды и частично снизить ее негативное воздействие на организм.
источник
Химическое обозначение: Mg
Синонимы: магнезия, магнезиум, австрий.
Описание: элемент 2 группы 3 периода с атомным номером 12. Лёгкий мягкий металл серебристого цвета с высокой химической активностью, ковкий.
Методы определения: потенциометрия, титрование, масс-спектрометрия, атомная абсорбция и эмиссия.
Методики, используемые в Испытательном центре МГУ для определения концентрации магния в природных средах
| Нормативный документ на методику | Метод определения | Оборудование |
|---|---|---|
| Вода | ||
| масс-спектрометрия | AGILENT 7500A ICP-MS | |
| Почва | ||
| ФР.1.31.2009.06787 | масс-спектрометрия | AGILENT 7500A ICP-MS |
| ЦВ 5.18.19.01-2005 | масс-спектрометрия | AGILENT 7500A ICP-MS |
Распространённость: магний встречается в составе соединений: брусит, каинит, бишофит, карналлит. На этот элемент приходится 1,95 % массы земной коры, т.е. его концентрация достигает 19,5 кг на тонну. Магний относится к биогенным элементам и наряду с кальцием широко распространён. Содержание магния в воде обуславливает жёсткость воды.
В воде систем централизованного водоснабжения содержание магния не нормируется напрямую: в водопроводной воде нормируется параметр жёсткости. Магний, наряду с кальцием и стронцием, вносит вклад в показатель жёсткости: если предположить, что вся жёсткость водопроводной воды будет обусловлена только магнием, его максимально допустимая концентрация будет составлять 85,02 мг/л.
Предельно допустимая концентрация (ПДК) магния в различных водных объектах
Бутилированная вода первой категории
Бутилированная вода высшей категории
Вода систем централизованного водоснабжения
Водные объекты рыбохозяйственного значения
Приказ Минсельхоза РФ № 552
Объекты рекреационного водопользования
Вода плавательных бассейнов
Постановление Правительства РФ № 644
Постановление Правительства РФ № 644
Суточная норма потребления магния находится в диапазоне 0,2–0,7 г и зависит от возраста и гендерной принадлежности. Большая потребность в элементе возникает у беременных и кормящих грудью женщин. В сочетании с сульфатами приобретает сильный слабительный эффект.
Магний участвует в:
- метаболизме углеводов;
- образовании сложных эфиров;
- продукции аминокислот;
- передаче нервных импульсов;
- усвоении и разрушении витаминов в крови;
- клеточном и обычном иммунитете.
При недостатке элемента наблюдаются:
- замедление проводимости нервных тканей;
- внезапная смерть младенцев;
- нарушение работы сердца;
- общий дефицит магния (гипомагниемия).
При избытке магния наблюдается:
- развитие дыхательной дисфункции (паралича);
- развитие симптома сердечной блокады;
- в присутствии сульфатов – раздражение желудочно-кишечного тракта.
Ионный обмен. При использовании ионообменных смол в воде происходит замена ионов магния на ионы натрия. Поскольку магний, как и кальций, играет выраженную физиологическую роль, убирать магний из воды полностью не нужно. Оптимальное значение жёсткости (именно по этому параметру часто настраивают ионообменные фильтры) составляет 1,5–2,5 мг-экв/л.
Обратный осмос. Вместе с другими веществами обратный осмос убирает из воды магний. Нецелесообразно использовать обратный осмос только для умягчения и при жёсткости воды более 7 мг-экв/л без предварительного умягчения.
Кипячение. Во время кипячения воды соли жёсткости, в состав которых входит магний, осаждаются на стенках сосуда, поэтому вода становится немного мягче, то есть содержит меньше магния, чем исходная вода.
Магний относится к элементам, которые обладают как отрицательным, так и положительным влиянием на организм человека. Поэтому необходимо контролировать содержание магния в питьевой воде и регулировать его содержание таким образом, чтобы концентрация находились в оптимальном диапазоне.
источник
Из всех элементов, кальций, один из самых известных и обсуждаемых. И это неудивительно, ведь его роль в организме трудно переоценить. Известно, что дефицит кальция, а также его переизбыток приводят к разного рода проблемам и заболеваниям.
К альций выполняет в организме человека очень много важных функций: регулирует свертываемость крови, участвует в процессах роста и деятельности клеток всех видов тканей в организме, участвует в процессах ощелачивания организма, обеспечивает прохождение электрических импульсов по нервным волокнам.
Кальций самый распространенный макроэлемент в организме человека, большая его часть содержится в скелете и зубах в виде фосфатов. В организме человека содержится 1,4-2 % Са3(РО4)2 и 13 % СаСО3.
В соответствии с общепринятыми рекомендациями, норма кальция в организме человека для взрослых составляет от 800 до 1200 миллиграмм. Для детей эта норма от 600 до 900 миллиграмм. Кальций вместе с фосфором составляет основу костной ткани, активизирует деятельность ряда важнейших ферментов, участвует в поддержании ионного равновесия в организме, влияет на процессы, происходящие в нервно-мышечной и сердечно-сосудистой системах, влияет на свертываемость крови.
Кальций также является важным элементом для поддержания рН на необходимом для всех систем и среды организма уровне. Например, рН крови — одна из самых жестких постоянных величин человеческого организма. В норме этот показатель составляет в пределах 7,4 (±0,02). Изменение этого показателя на 0,3 приводит к гибели человека.
Наибольшее количество кальция содержится в молоке, молочных продуктах (твороге, твердых сырах), яйцах, рыбе, в зеленых овощах, орехах. Один из источников кальция — это питьевая вода. С водой мы получаем от 10 до 30% суточной нормы кальция (в зависимости от жесткости и химического состава воды).
Одним из общеизвестных показателей качества и свойств воды является её жесткость, которая зависит от содержания в ней растворенных солей кальция и магния. Суммарное содержание этих солей определяет общую жесткость. Общая жесткость воды разделяется на карбонатную, обусловленную концентрацией гидрокарбонатов кальция и магния, и некарбонатную, определяемую концентрацией в воде кальциевых и магниевых солей сильных кислот. Жесткость воды формируется в результате растворения пород, содержащих кальций и магний. Обычно преобладает кальциевая жесткость, обусловленная растворением известняка и мела, однако в местах, где больше доломита, чем известняка, может преобладать и магниевая жесткость. В результате некоторых районах содержание кальция в воде может доходить до 300 мг/литр. Есть питьевые воды, которые продаются в магазинах, с содержанием кальция до 100 мг/литр. И здесь важно отметить, что 80% растворимого кальция мы получаем именно с водой. Таким образом, постоянное употребление воды с высоким содержанием кальция может привести к возникновению мочекаменной болезни и другим проблемам со здоровьем.
Выдержка из «Руководства по контролю качества питьевой воды». Всемирная Организация Здравоохранения (ВОЗ). Женева 1987 год
кальция в воде
с водой(%)
общее кальция поступление с пищей и водой: 1000 мг кальция в сутки
Типичный вклад воды в общее поступление кальция в организм составляет около 10-20 %.
Продолжительный дефицит кальция в ежедневном рационе приводит к судорогам, болям в суставах, остеопорозу, проблемам с ЖКТ, сердечно-сосудистой системой. Симптомами недостатка кальция является повышенная сонливость, раздражительность, ломкость ногтей, проблемы с кожей и зубами.
Как уже было отмечено, 80% растворенного кальция человек получает с питьевой водой. При этом, практически все жидкости в системе человеческого организма являются либо нейтральными, либо слабощелочными, за исключением желудочного сока: рН желудочного сока составляет — 1,0; здоровой крови — 7,43; здоровой лимфы — 7,5; слюны — 7,4. Повышение кислотности водной среды организма является одной из причин многих заболеваний. Появляются нарушения иммунной системы, плохо усваиваются витамины и микроэлементы, возникают заболевания сосудов, сердца, суставов, крови и многие другие патологические состояния организма. При этом организм постоянно ищет резерв щелочи для нейтрализации лишних кислот, т.к. кальций, помещенный в любую жидкость, нейтрализует избыточную кислотность. И резерв этот – костная ткань, зубы, суставы. В результате происходит «вымывание» кальция из костей, развивается остеопороз, появляются наросты, т.к. организм начинает строить кости из стронция.
По оценке специалистов Института Питания РАМН к 40 годам дефицит кальция наблюдается у 50% населения, к 60 годам у 90 %. Следует отметить, что при напряженной физической работе, усиленных тренировках, ограничении движений, чрезмерном употреблении кофе, энергетических напитков и алкоголя, также происходит интенсивное выведение солей кальция из организма.
Дефицит кальция может стать причиной более 100 заболеваний. Но избыток кальция в организме может вызвать гиперкальцемию (избыточное содержание кальция в крови) и вызвать нарушения в функционировании мышечных и нервных тканей, свертываемости крови, усвояемости цинка клетками костной ткани, вызывать появление камней в почках и другие проблемы.
Как говорится в руководстве по качеству питьевой воды ВОЗ «высокие концентрации минеральных веществ в воде увеличивают жидкостную нагрузку на почки, особенно сильно это проявляется у маленьких детей. Комитет по проблемам питания Немецкого Общества Педиатров настаивает, что потребители питьевой воды должны иметь ясное представление о концентрациях кальция и магния в питьевой воде, и ссылок на жесткость воды для этого недостаточно. Дети в конце периода грудного вскармливания, которые получают в основном детское питание на растительной основе и дети раннего возраста, употребляющие вегетарианскую пищу, могут получать значительное количество кальция и/или магния из питьевой воды».
Основными симптомами избытка кальция в организме являются снижение или потеря аппетита, появление тошноты, рвоты, жажды. Человек ощущает слабость, могут появиться ночные судороги. Появляются запоры, боли в низу живота. Если не устранить избыток кальция вовремя, возможны также нарушения функций головного мозга, приводящие к галлюцинациям, спутанности сознания и нарушениям сна.

Известный ученый, академик Одесской региональной академии наук, автор книг «Как родить здорового малыша», «Вода здоровья и долголетия», Н.Г. Друзьяк, долгое время занимался изучением факторов, определяющих долгожительство в определенных районах Евразии. В результате 20-летней работы он определил, что одной из главных причин долгожительства в Якутии, Абхазии, Дагестане, Нагорном Карабахе, а также в некоторых районах Северного Кавказа, в Нахичеване и в Лерикском районе Азербайджана, является местная природная вода с содержанием ионов кальция в пределах от 8 до 20 мг/л. Там, где содержание кальция в воде было меньше или больше указанного интервала, число долгожителей резко снижалось. О полезных свойствах воды с невысоким уровнем содержания кальция пишет также в своей книге «Вода – наместник Бога на Земле» Юрий Андреев. Об этом же говорит д.м.н., профессор и академик РАЕН Иван Павлович Неумывакин в книге «Вода − жизнь и здоровье. Мифы и реальность» и многие другие ученые и исследователи.
Таким образом, излишки, как и недостаток минералов, микро-макроэлементов, в том числе кальция, в воде могут привести к серьезным проблемам со здоровьем. Именно поэтому лучшим выбором является вода, обладающая сбалансированным минерально-солевым составом в пределах 150-350 мг/л с содержанием кальция 8-25 мг/л.
Физиологически полноценная питьевая вода
Физиологически полноценная питьевая вода — это вода, содержащая минеральные вещества, необходимые организму человека в строго определенных количествах. Санитарными нормами и правилами (СанПиН) определены жизненно важные элементы, содержание которых регламентировано (йод, фтор, кальций, магний, калий и др., всего более 100 показателей).
Аквалайн — физиологически полноценная питьевая вода ФППВ (47;78) для жителей Санкт-Петербурга и Ленинградской области – региональный эталон питьевой воды.
Физиологически полноценная питьевая вода «Аквалайн Природная Премиум» добывается в экологически безупречных местах Карельского перешейка на расстоянии 70 км от Санкт-Петербурга из артезианской скважины с глубины 170 метров. На такой глубине отсутствует патогенная бакофлора, вода проходит естественную минерализацию и фильтрацию и не требует дополнительной обработки. При производстве не нарушаются исходный баланс микроэлементов, структура и свойства воды. Розлив воды осуществляется непосредственно на источнике в автоматическом режиме по методу «непрерывной струи». Общий уровень минерализации воды «Аквалайн» — 150-350 мг/литр является оптимальным, в том числе по минерально-солевому составу и органолептическим свойствам для жителей Санкт-Петербурга и Ленинградской области. Такая вода несет пользу на молекулярном уровне, сохраняя естественный водный баланс организма и обеспечивая поступление необходимых ему минеральных веществ, микро и макронутриентов.
- В.А. Тутельян «Научные основы здорового питания»
- И.П. Неумывакин «Вода − жизнь и здоровье. Мифы и реальность»
- Ю. Андреев «Вода – наместник Бога на Земле»
- М. Ахманов «Вода, которую мы пьем»
- Рекомендации ВОЗ
источник
Федеральное агентство по образованию
Государственное образовательное учреждение
Новгородский государственный университет им. Ярослава Мудрого
Факультет естественных наук и природных ресурсов
Массовая концентрация кальция и магния в воде.
Жесткость воды. Массовая концентрация кальция в водах: Методические указания/ Составитель — НовГУ, Великий Новгород, 2008. – 12 с.
Понятие жесткости, источники кальция в воде, влияние на живые организмы.
Методические указания предназначены для студентов специальности 020801.65 — «Экология» и всех студентов, изучающих «Общую экологию».
Жесткость — свойство воды, обусловленное присутствием в ней растворенных солей щелочно-земельных металлов (преимущественно кальция и магния). Различают жесткость кальциевую и магниевую, связанную с присутствием в воде соответственно ионов кальция и магния. Суммарное содержание ионов этих металлов в воде называется общей жесткостью.
Общая жёсткость подразделяется на карбонатную, обусловленную присутствием в воде гидрокарбонатов и карбонатов кальция и магния, и некарбонатную, обусловленную наличием кальциевых и магниевых солей сильных кислот.
Карбонатную жесткость также называют временной (устранимой), а некарбонатную — постоянной. Гидрокарбонаты кальция и магния при длительном кипячении воды разлагаются с выделением диоксида углерода и выпадающих в осадок карбонатов кальция и магния (при дальнейшем кипячении карбонат магния гидролизуется с образованием гидроксида); жесткость воды при этом уменьшается:
Жесткость, оставшаяся после кипячения воды в течение определенного времени, достаточного для полного разложения гидрокарбонатов и удаления диоксида углерода (обычно 1-1,5 ч), называется постоянной жесткостью. Постоянная жесткость является важной характеристикой качества воды, используемой для технических целей. Она преимущественно зависит от содержания ионов кальция и магния, которые после кипячения уравновешиваются сульфатами и хлоридами. Эту часть постоянной жесткости, называемую также остаточной жесткостью, можно найти по разности между общей жесткостью и концентрацией гидрокарбонатов, выраженной в миллимолях на кубический дециметр. Однако кроме остаточной жесткости в воде после кипячения остается небольшое количество ионов кальция и магния, обусловленное растворимостью карбоната кальция и гидроксида магния. Эта часть постоянной жесткости называется неустранимой жесткостью. Поскольку растворимость карбоната кальция и гидроксида магния в присутствии ионов кальция и магния в растворе весьма незначительна, обычно некарбонатную (остаточную) жесткость отождествляют с постоянной жесткостью.
Жесткость воды в настоящее время выражают в миллимолях количества вещества эквивалентов (КВЭ) Са2+ и Mg2+, содержащихся в 1 дм3 воды — ммоль/дм3 КВЭ (ранее эту единицу обозначали мг·экв/л или мг·экв/дм3). Миллимоль КВЭ Са2+ и Mg2+ равны соответственно 20,04 мг/моль и 12,15 мг/ммоль.
В естественных условиях ионы кальция и магния поступают в воду в результате взаимодействия растворенного диоксида углерода с карбонатными минералами и при других процессах растворения и химического выветривания горных пород. Источником этих ионов являются также микробиальные процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий: силикатной, металлургической, стекольной, химической промышленности, стоки с сельскохозяйственных угодий.
Общая жесткость поверхностных вод колеблется в основном от единиц до десятков миллимолей КВЭ в кубическом дециметре, причем карбонатная жесткость часто составляет 70-80 % от общей жесткости. Она подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период паводка. Жесткость подземных вод более постоянна.
Вода с жесткостью менее 4 ммоль/дм3 КВЭ характеризуется как мягкая; от 4 до 8 ммоль/дм3 КВЭ — средней жесткости; от 8 до 12 ммоль/дм3 КВЭ — жесткая; более 12 ммоль/дм3 КВЭ — очень жесткая.
Обычно преобладает (иногда в несколько раз) жесткость, обусловленная ионами кальция, однако в отдельных случаях, магниевая жесткость может достигать 50-60 % общей жесткости и более (часто магниевая жесткость превосходит кальциевую в морских и океанических водах, либо в поверхностных водах суши с высоким содержанием сульфат-ионов).
Высокая жесткость оказывает отрицательное влияние на свойства воды используемой в промышленности и для хозяйственно-бытовых целей. Жесткие требования в отношении величины жесткости предъявляются к воде, питающей паросиловые установки, поскольку в присутствии сульфатов и карбонатов кальций и магний образуют прочную накипь, уменьшающую теплопроводность металла и приводящую к перерасходу топлива и перегреву котлов. Для устранения жесткости применяют различные способы — осаждение труднорастворимых солей кальция и магния химическим или термическим путем, умягчение с помощью ионитов.
Высокая жесткость, особенно, обусловленная превышением солей магния, ухудшает органолептические свойства воды, придавая ей горьковатый вкус и оказывая отрицательное воздействие на органы пищеварения. Предельно допустимая величина жесткости в питьевых водах 7 ммоль/дм3 КВЭ, но в некоторых случаях допускается использовать для питьевых целей воду с жесткостью 10 ммоль/дм КВЭ.
1.1 Метод измерения жесткости
Выполнение измерений жесткости основано на способности ионов кальция и магния в среде аммонийно-аммиачного буферного раствора (рН 9-10) образовывать с трилоном Б малодиссоциированные комплексные соединения. При титровании вначале связывается кальций, образующий более прочный комплекс с трилоном Б, а затем магний. Конечная точка титрования определяется по изменению окраски индикатора эриохрома черного Т от вишнёво-красной (окраска соединения магния с индикатором) до голубой (окраска свободного индикатора).
Границы погрешности при вероятности Р=0,95 (±Δ):
от 0,060 до 2,000 ммоль/дм3 – 0,037+0,040Х
св.2,000 до 13,00 включ. – -0,05+0,073Х
Объём аликвоты пробы воды для выполнения измерений величины жесткости выбирают исходя из предполагаемой величины жёсткости или по результатам оценочного титрования.
Для оценочного титрования отбирают 10 см3 воды, добавляют 0,5 см3 буферного раствора, 7-10 мг индикатора эриохрома черного Т и титруют раствором трилона Б с до перехода окраски из вишнево-красной в голубую. По величине израсходованного на титрование объёма раствора трилона Б выбирают из таблицы 1 соответствующий объем аликвоты пробы воды для выполнения измерений величины жесткости.
Таблица 1 — Объём пробы воды, рекомендуемый для выполнения измерений жесткости
Предполагаемая жесткость воды, моль/дм3
Объем раствора трилона Б, израсходованный при оценочном титровании, см3
Рекомендуемый объем аликвоты пробы воды, см3
источник
Цель работы: определить комплексонометрическим методом:
– проба А – общую жесткость воды, ммоль экв/л;
– проба Б – массу кальция и магния в пробе, г.
Сущность работы. Ионы Са 2+ и Mg 2+ образуют комплексонаты, которые устойчивы в щелочной среде, поэтому их титруют стандартным раствором ЭДТА в присутствии аммиачного буфера. Если использовать индикатор эриохром черный Т, то в к. т. т. наблюдается переход окраски раствора от сиреневой (комплексы индикатора с Са 2+ и Mg 2+ ) к синей (свободная форма индикатора в этих условиях).
Жесткость воды – это суммарный показатель качества воды. Она обусловлена наличием ионов Са 2+ и Mg 2+ . Общая жесткость воды показывает, сколько миллимоль эквивалентов Са 2+ и Mg 2+ в сумме содержится в 1 л воды.
Суммарное содержание Са 2+ и Mg 2+ определяют прямым титрованием пробы воды в аммонийном буфере стандартным раствором
ЭДТА в присутствии индикатора эриохрома черного Т:
Me 2+ + H2Y 2– = MeY 2– + 2H + Þ fэкв(Me 2+ ) = 
Поскольку концентрация Са 2+ и Mg 2+ в воде незначительна, для титрования берут большие аликвоты анализируемой воды (50,00 или 100,00 мл) с помощью специальных пипеток большой вместимости.
Раздельное определениеСа 2+ и Mg 2+ при совместном присутствии в растворе основано на титровании пробы с разными индикаторами в разных условиях.
Сначала определяют суммарное содержание кальция и магния в пробе. С этой целью титруют аликвоту анализируемого раствора комплексоном III с индикатором эриохромом черным Т в среде аммиачного буфера. При этом протекают следующие реакции:
Mg 2+ + H2Y 2– = MgY 2– + 2H + Þ
Þ fэкв(Ca 2+ ) = 


Затем определяют содержание кальция, титруя такую же аликвоту раствором ЭДТА с индикатором мурексидом в сильнощелочной среде. При добавлении щелочи ионы магния маскируются за счет осаждения в виде Mg(OH)2¯ и не реагируют с ЭДТА. Следовательно, титруются только ионы кальция:
Свободная форма индикатора мурексида в этих условиях имеет сиренево-фиолетовую окраску, а комплекс его с кальцием – кирпично-красную. Содержание магния в пробе находят по разности.
Оборудование и реактивы: бюретка, мерный цилиндр (25 мл), стандартный раствор ЭДТА, аммиачный буфер с рН 9, индикатор эриохром черный Т в смеси с NaCl (1 : 100). Для анализа пробы А дополнительно: пипетка Мора большой вместимости (50,00 или 100,00 мл), конические колбы большой вместимости (250 мл). Для анализа пробы Б дополнительно: мерная колба, пипетка Мора, конические колбы, гранулированный NaOH, мурексид в смеси с NaCl (1 : 100).
Выполнение работы
Проба А. Определение общей жесткости воды. Получают у лаборантов анализируемый раствор в коническую колбу. Отбирают пипеткой аликвоту 50,00 или 100,00 мл и переносят в другую коническую колбу. Прибавляют 20–25 мл аммонийного буфера, индикатор на кончике шпателя и титруют раствором комплексона III до перехода окраски раствора от сиреневой к синей.
По результатам титрования рассчитывают общую жесткость воды (ммоль-экв/л):
Делают вывод о характеристике воды, используя справочные данные (см. &).
Проба Б. Раздельное определение кальция и магния. Получают у лаборантов анализируемый раствор в мерную колбу, доводят до метки и перемешивают.
Для определения суммарной концентрации кальция и магния отбирают пипеткой аликвоту анализируемого раствора в колбу для титрования, добавляют 20–25 мл аммиачного буфера и индикатор эриохром черный Т на кончике шпателя. Титруют раствором ЭДТА до перехода сиреневой окраски раствора в синюю. Усредняют полученные близкие объемы ЭДТА и получают среднее значение объема титранта V1(Na2H2Y), который затрачен на титрование Ca 2+ и Mg 2+ в сумме.
Для определения кальция отбирают пипеткой такую же аликвоту анализируемого раствора, вносят в него 2–3 гранулы NaOH (для создания сильнощелочной среды, проверить с помощью универсальной индикаторной бумаги!), мурексид на кончике шпателя и титруют раствором ЭДТА до перехода кирпично-красной окраски в сиренево-фиолетовую. Усредняют полученные близкие объемы ЭДТА и получают среднее значение объема титранта V2(Na2H2Y), который затрачен на титрование Ca 2+ . По разности находят объем титранта, пошедший на титрование Mg 2+ :
Исходя из полученных значений объемов V2(Na2H2Y) и V3(Na2H2Y), рассчитывают массу кальция и магния в пробе (г).
| & | М(Ca 2+ ) = 40,078 г/моль | М(Mg 2+ ) = 24,3050 г/моль | ||
| Ж(Н2О), ммоль-экв/л | 12 | |||
| Характеристика воды | Мягкая | Средней жесткости | Жесткая | Очень жесткая |
В Западной Европе жесткость воды выражают в немецких градусах жесткости ( ° d). 1 ° d соответствует 10 мг CaO в 1 л воды. Переход к моль-экв/л: 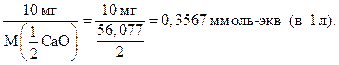 1 ° d = 0,3567 ммоль-экв/л. 1 ° d = 0,3567 ммоль-экв/л. | ||||
| : | С использованием ПО «Практикум по АХ и ФХМА»: – оценить неопределенность измерений; – провести Q-тест и статистическую обработку результатов анализа, если имеется 4 и более результатов параллельных измерений. |
Лабораторная работа № 20
Комплексонометрическое определение ионов поливалентных
металлов
Цель работы: определить по указанию преподавателя массу определяемого иона металла в растворе (г) или массовую долю (%) соли металла в образце (табл. 15).
Задания для выполнения лабораторной работы
| Проба | Определяемое вещество | Способ титрования | Индикатор, условия проведения анализа | |
| Ион | Соль | |||
| А | Co 2+ | CoSO4 · 7H2O | Прямое титрование | Мурексид; в аммиачном буфере |
| Ni 2+ | NiSO4 · 7H2O | |||
| Cu 2+ | CuSO4 · 5H2O | |||
| Б | Fe 3+ | FeCl3 · 6H2O Fe2(SO4)3 · 9H2O NH4Fe(SO4)2 · 12H2O | Прямое титрование | Сульфосалициловая кислота; в ацетатном буфере при 60 о С |
| В | Al 3+ | AlCl3 · 6H2O Al(NO3)3 · 9H2O NH4Al(SO4)2 · 12H2O KAl(SO4)2 · 12H2O | Обратное титрование солью Zn 2+ | Ксиленоловый оранжевый; образование AlY – – в кислом кипящем растворе; титрование – в ацетатном буфере |
Сущность работы. Важнейшим достоинством комплексонометрии является возможность определения практически всех катионов поливалентных металлов. В зависимости от устойчивости комплексонатов металлов и их комплексов с индикатором, а также других особенностей титруемой системы применяют методы прямого, обратного титрования или титрования по замещению. Прямым титрованием определяют Mg 2+ , Ca 2+ , Zn 2+ , Cd 2+ , Pb 2+ , Co 2+ , Ni 2+ , Cu 2+ , Mn 2+ , Fe 3+ и др. Если реакция с ЭДТА протекает слишком медленно (Al 3+ , Cr 3+ ), отсутствует подходящий индикатор для условий существования иона в растворе (Hg 2+ ), то применяют обратное титрование.
Определение Co 2+ , Ni 2+ , Cu 2+ основано на прямом комплексонометрическом титровании в присутствии мурексида при значении рH 7–8, которое поддерживается с помощью аммиачного буфера. При более высоких значениях pH происходит образование аммиачных комплексов
Me 2+ + 6NH3 =
и разрушение комплекса металла с индикатором, что снижает точность титрования.
Определение Fe 3+ проводится прямым титрованием в присутствии сульфосалициловой кислоты при pH о С.
Определение Al 3+ проводится обратным титрованием солью цинка (II) в присутствии ксиленолового оранжевого или солью меди(II) в присутствии индикатора ПАН.
Оборудование и реактивы: технические и аналитические весы, мерные колбы, бюретка, пипетка Мора, мерный цилиндр, конические колбы, стандартный раствор ЭДТА.
Для анализа пробы А: аммиачный буферный раствор, мурексид.
Для анализа пробы Б: ацетатный буферный раствор pH 2,5,
25 %-ный раствор сульфосалициловой кислоты, кислота для растворения сухой соли, водяная баня.
Для анализа пробы В: кристаллический ZnSO4 · 7H2O, 0,25 М раствор ацетата натрия, 1 М раствор HCl, ксиленоловый оранжевый, водяная баня.
Выполнение работы. Если проводят анализ раствора, то получают его в мерную колбу, доводят до метки дистиллированной водой и перемешивают. Затем отбирают отдельные аликвоты анализируемого раствора в колбы для титрования, создают необходимые условия и проводят титрование в соответствии с описанными ниже методиками. По результатам титрования рассчитывают массу определяемого иона в пробе (г).
Если для анализа предложена сухая смесь соли с индифферентными примесями, то рассчитывают навеску соли, необходимую для приготовления раствора заданной концентрации в имеющейся мерной колбе. Затем берут навеску, переносят в мерную колбу, растворяют в дистиллированной воде (в случае солей Fe 3+ – с добавлением кислоты), доводят до метки и перемешивают. Затем отбирают отдельные аликвоты полученного раствора в колбы для титрования, создают необходимые условия и проводят титрование в соответствии с описанными ниже методиками. По результатам титрования рассчитывают массовую долю кристаллогидрата в образце (%).
Проба А. Определение Co 2+ , Ni 2+ , Cu 2+ . К аликвоте раствора медленно, по каплям, при перемешивании добавляют аммиачный буферный раствор. При этом вначале протекает образование осадка гидроксида металла, а затем его растворение с образованием аммиачного комплекса. Как только осадок растворится, добавление буферного раствора прекращают. К раствору добавляют мурексид на кончике шпателя и титруют раствором ЭДТА до перехода окраски к яркой фиолетово-сиреневой.
Проба Б. Определение Fe 3+ . К аликвоте раствора добавляют 5 мл ацетатного буферного раствора, нагревают до 60 о С, добавляют 1 мл раствора сульфосалициловой кислоты и титруют раствором ЭДТА до перехода окраски от красно-фиолетовой к бледно-желтой.
Проба В. Определение Al 3+ . Готовят 0,05 н. стандартный раствор сульфата цинка по точной навеске, как описано в лабораторной работе № 18.
К аликвоте раствора, содержащего Al 3+ , добавляют 20,00 мл стандартного раствора ЭДТА и 2 мл 1 М HCl. Нагревают до кипения и оставляют на кипящей водяной бане на 10 минут. После охлаждения добавляют в колбу 10 мл раствора ацетата натрия, ксиленоловый оранжевый на кончике шпателя и титруют раствором сульфата цинка до перехода окраски от желтой к красной.
| & | М(Co 2+ ) = 58,9332 г/моль М(Ni 2+ ) = 58,69 г/моль М(Cu 2+ ) = 63,546 г/моль М(Fe 3+ ) = 55,847 г/моль М(Al 3+ ) = 26,9815 г/моль М(CoSO4 · 7H2O) = 281,11 г/моль М(NiSO4 · 7H2O) = 280,86 г/моль М(CuSO4 · 5H2O) = 249,69 г/моль | М(FeCl3 · 6H2O) = 270,298 г/моль М(Fe2(SO4)3 · 9H2O) = 562,02 г/моль М(NH4Fe(SO4)2 · 12H2O) = 482,20 г/моль М(AlCl3 · 6H2O) = 241,432 г/моль М(Al(NO3)3 · 9H2O) = 375,134 г/моль М(NH4Al(SO4)2 · 12H2O) = 453,33 г/моль М(KAl(SO4)2 · 12H2O) = 474,39 г/моль |
| : | С использованием ПО «Практикум по АХ и ФХМА»: – оценить неопределенность измерений; – провести Q-тест и статистическую обработку результатов анализа, если имеется 4 и более результатов параллельных измерений. |
Программа курса
Предмет аналитической химии. Значение аналитической химии. Аналитический контроль технологических процессов. Классификация методов аналитической химии: методы разделения, методы обнаружения и методы определения. Цели и задачи методов.
Общая схема аналитического определения. Выбор метода анализа. Отбор пробы и пробоподготовка. Метрологические основы аналитической химии. Статистическая обработка результатов анализа.
Последнее изменение этой страницы: 2017-01-25; Нарушение авторского права страницы
источник
Химический анализ природной и питьевой воды. Метод ионообменной хроматографии и титриметрический метод определения ионов кальция и магния. Особенности приготовления растворов. Устранение мешающего влияния катионов железа, марганца, цинка, меди и олова.
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Методика определения ионов кальция и магния в природных водах (определение общей жесткости воды)
2. Приготовление растворов
3.1 Титриметрический метод
3.2 Метод ионообменной хроматографии
Химический анализ природной и питьевой воды показывает, что любая вода представляет собой не чистое вещество с формулой Н2О, а смесь большого количества веществ.
Многочисленные анализы природных вод показали, что среди большого числа компонентов, растворенных в них, 90 % солесодержания составляют карбонаты, гидрокарбонаты, хлориды и сульфаты кальция, магния и натрия. О.А. Алекиным предложена классификация природных вод по результатам их химического анализа. По преобладающему аниону воды делятся на три класса: карбонатные (гидрокарбонатные), хлоридные и сульфатные. По преобладающему катиону воды делятся на три группы: кальциевые, магниевые и натриевые.
В природных водах постоянно находятся ионы кальция и магния, обеспечивающие жесткость воды. Источник их поступления в воду — растворение гипса, известняков и доломитов, входящих в состав горных пород. В санитарно-гигиеническом отношении ионы кальция и магния не представляют большой опасности, но чрезмерная жесткость воды делает ее непригодной для бытовых целей, т.к. образующаяся накипь выводит из строя нагревательные элементы электрических систем нагрева воды. Оптимальная жесткость воды — до 7 мг-экв/л.
Для определения ионов кальция и магния используются два метода:
2. метод ионообменной хроматографии
1. Наиболее точный и распространенный метод определения общей жесткости — комплексометрический, основанный на образовании ионами Са 2+ и Mg 2+ прочных внутрикомплексных соединений с трилоном Б. В качестве индикатора при определении общей жесткости используется эриохром черный. В зависимости от общей жесткости концентрация рабочего раствора трилона Б и объем пробы воды могут быть различными.
Для определения кальция в природных водах преимущественно используются трилонометрический метод с индикатором мурексидом.
Содержание магния проводят расчетным методом, зная общую жесткость и содержание кальция.
2. Приготовление растворов
Раствор трилона Б с концентрацией 0,02 моль/дм 3 эквивалента.
Навеску 3,72г. трилона Б растворяют в 1 дм 3 дистиллированной воды. Точную концентрацию устанавливают по стандартному раствору хлорида цинка. Раствор хранят в полиэтиленовой посуде, проверяют его концентрацию не реже 1 раза в месяц.
Раствор хлорида цинка с концентрацией 0,02 моль/ дм 3 эквивалента.
Отвешивают на технических весах около 0,35 г металлического цинка, смачивают его небольшим количеством концентрированной соляной кислоты и сейчас же промывают дистиллированной водой. Цинк сушат в сушильном шкафу при 105 течение 1ч, затем охлаждают и взвешивают на аналитических весах.
Навеску цинка помещают в мерную колбу вместимостью 500 см 3 , в которую предварительно вносят 10-15 см 3 дистиллированной воды и 1,5 см 3 концентрированной соляной кислоты. Цинк растворяют. После растворения цинка объём раствора доводят до метки на колбе дистиллированной водой. Рассчитывают молярную концентрацию эквивалента раствора хлорида цинка CZn(1/2 ZnCl2), моль/дм 3 , по формуле:
где m — навеска металлического цинка, г; 32,69 — молярная масса эквивалента Zn 2+ , г/моль; V — объём мерной колбы, см 3 .
Буферный раствор NH4Cl +NH4OH.
7,0 г хлорида аммония растворяют в мерной колбе вместимостью 500 см 3 в 100 см 3 дистиллированной воды и добавляют 75 см 3 концентрированного раствора аммиака. Объем раствора доводят до метки дистиллированной водой и тщательно перемешивают. Буферный раствор хранят в стеклянной или полиэтиленовой посуде не более 2 месяцев. Гидроксид натрия, 2 моль/дм 3 .
40 г гидроксида натрия растворяют в мерной колбе вместимостью 500 см 3 и раствор доводят до метки дистиллированной водой.
Индикатор эриохром черный Т.
Растереть в ступке 0,25 г эриохрома черного Т с 50 г хлорида натрия.
0,5 г мурексида растереть с 100 г хлорида натрия. Водный раствор лучше не готовить, т.к. мурексид нестоек в растворе.
Раствор сульфида натрия, 4%.
2 г сульфида натрия растворяют в 50 см 3 дистиллированной воды. Хранят в плотной закрытой полиэтиленовой посуде не более недели.
Раствор гидрохлорида гидроксиламина.
5 г гидрохлорида гидроксиламина растворяют в 100 см 3 дистиллированной воды. Хранят не более 2 месяцев.
Установление точной концентрации раствора трилона Б.
В коническую колбу вместимостью 250 см 3 вносят 10 см 3 раствора хлорида цинка, добавляют дистиллированной воды приблизительно до 100 см 3 , 5 см 3 буферного раствора и 10-15 мг индикатора эриохрома чёрного Т. Содержимое конической колбы тщательно перемешивают и титруют из бюретки раствором трилона Б до перехода окраски красной в голубую. Концентрацию раствора трилона Б рассчитывают по формуле:
3.1 Титриметрический метод
Определение ионов кальция и магния
Устранение мешающих ионов
Для устранения мешающего влияния катионов железа, цинка, меди и олова в пробу добавляют 0,5 мл раствора сульфида натрия.
Для устранения мешающего влияния марганца в пробу добавляют 0,5 мл солянокислого раствора гидроксиламина.
Перед выполнением анализа пробы воды с неизвестной величиной жёсткости проводят оценочное титрование. Для этого берут 10 см 3 воды, добавляют 0,5 см 3 буферного раствора, индикатор (эриохром чёрный Т) и титруют до перехода окраски из красной в голубую. По величине израсходованного трилона Б выбирают из таблицы 1 соответствующий объём пробы воды.
ионообменный хроматография вода магний
Таблица 1. Объём пробы воды, рекомендуемый для определения жёсткости по результатам оценочного титрования
Объём израсходованного раствора трилона Б, см 3
Рекомендуемый объём пробы, см 3
v Определение суммы кальция и магния
К пробе необходимого объёма (см. Оценочное титрование) 100 см 3 добавляют 5 см 3 буфера, индикатор (эриохром чёрный Т) на шпателе. Сразу же титруют при перемешивании до перехода окраски от винно-красной к синей.
К пробе необходимого объёма (см. Оценочное титрование) 100 см 3 добавляют 2 см 3 NaOH (2н) и индикатора (мурексид) на шпателе. Титруют до перехода окраски от красной в фиолетовую. Окраску раствора следует сравнивать с цветом перетитрованного раствора.
Содержание кальция высчитывают по формуле:
где Стр — молярная концентрация эквивалента трилона Б, моль/дм 3 ; V’ тр — объем трилона Б, пошедший на титрование с мурексидом, см 3 (см. Определение кальция); 20,04 — масса эквивалента Ca 2+ ; Vпробы — объем пробы, взятый для анализа, см 3 .
Содержание магния высчитывают по формуле:
где Стр — молярная концентрация эквивалента трилона Б, моль/дм 3 ; V тр — объем трилона Б, пошедший на титрование с эриохромом черным Т, см 3 (см. Определение суммы кальция и магния); V’тр — объем трилона Б, пошедший на титрование с мурексидом, см 3 (см. Определение кальция); 12,15- масса эквивалента Mg 2+ ; Vпробы- объем пробы, взятый для анализа, см 3 .
v Определение общей жесткости воды
Общую жесткость находят по формуле:
где Стр — молярная концентрация эквивалента трилона Б, моль/дм 3 ; Vтр — объем раствора трилона Б, пошедшего на титрование пробы, см 3 ; Vпробы — объем пробы, взятый для анализа, см 3 .
Метод добавок. Для определения данным методом в пробу вводят добавку, равную 50-150% (желательно 100%) жёсткости воды (см. Определение общей жёсткости воды) ГСО 8206-2002.
Затем высчитывают общую жесткость воды с добавкой.
a. Результаты измерений, полученных в условиях воспроизводимости для пробы 1.
Проба 1: оз. Среднее, с. Озёрное, 85 км от берега, дата: 1.10.13, время: 16.55, t = +3.
Установлена точная концентрация трилона Б: Стрилона = 0,002226 (моль/дм 3 ). При выполнении оценочного титрования объем необходимой пробы соответствует 100 (мл).
источник
Ответов в этой теме: 20
Страница: 1 2
«« назад || далее »»
| Автор | Тема: Определение кальция и магния в воде | |
| Провитамин Пользователь Ранг: 92 | 01.07.2009 // 14:29:11 Добрый день! Подскажите пожалуйста официальный документ на определение отдельно кальция и магния в воде (и чтобы там были указаны ПДК). | |
| Реклама на ANCHEM.RU Администрация Ранг: 246 Размещение рекламы | ||
| химик по случаю Пользователь Ранг: 95 | 20.07.2009 // 15:02:38 Все зависит от того, о каком виде воды (питьевая, сточная, котловая и др.) идет речь. Понятно, что вода бывает разная. Если вода питьевая, то найдите в библиотеке толстенную книгу-справочник «Государственный контроль качества воды» 2003 г. и там обнаружите гостовские методики определения названных вами показателей (иногда в нескольких вариациях, для ваших компонентов – обычно комплексонометрия). Кроме того, в этом же талмуде обычно указаны ПДК, которые диктуются СанПиН 2.1.4.1074-01 «Питьевая вода….» (с 1.09.09 у него будет новый номер СанПиН 2.1.4.2496-09 и другое название). Если вода бутилированная (и не минеральная), смотри требования по Са и Мg в СанПиН 2.1.4.1116-02. В поиске указанных официальных документов помогут разнообразные электронные справочные правовые системы и Интернет. Если вода котловая, то обратитесь за помощью к лаборантам (лично или через данный форум), которые проводят подобные анализы ежедневно по многу раз на котельных. Они подскажут свои нормативные документы, которыми руководствуются в работе. Если вода сточная, то требуется предварительная пробоподготовка (минерализация пробы). Тонкости пробоподготовки описаны в книге «Унифицированные методы анализа вод» под редакцией Ю.Ю. Лурье. | |
| Апраксин VIP Member Ранг: 3255 | 20.07.2009 // 16:24:06 Редактировано 1 раз(а) Пользователь удалил свое сообщение | |
| Imhoff Пользователь Ранг: 535 | 25.08.2013 // 21:49:41 Редактировано 1 раз(а) Извиняюсь за некропостинг, но вот возник такой вопрос. ГОСТ Р 52407-2005 «ВОДА ПИТЬЕВАЯ Методы определения жесткости», часть Б, которая предлагает рассчитывать жесткость как сумму ионов кальция и магния, найденных пламенной ААС. Вопрос собственно в следующем: имеет ли лаборатория право при реализации части Б данного ГОСТА в протоколе КХА помимо значения общей жесткости указывать содержание кальция и магния отдельно? Т.е. что бы не приобретать отдельно МВИ на кальций и магний. Еще был бы очень признателен, если кто-нибудь поделится ссылками на действующие аттестованные МВИ для определения кальция и магния в питьевой и природной воде титриметрическим или потенциометрическими методами.. | |
| OS Пользователь Ранг: 55 | 26.08.2013 // 6:39:13 Редактировано 1 раз(а)
В п. 1 Область применения написано: — комплексонометрический метод (метод А); — методы атомной спектрометрии (методы Б и В). Метод Б по 5.1 применяют для определения массовой концентрации ионов кальция и магния. | |
| Imhoff Пользователь Ранг: 535 | 26.08.2013 // 15:01:42
Спасибо за развернутый ответ. С областью применения ЭТОГО ГОСТа как раз все понятно. С определением с помощью него кальция и магния — теперь тоже. Мне бы теперь еще подыскать какую-нибудь простенькую титремитрическую аттестованную МВИ для той же области применения, но для другой лаборатории, где нет ААС. | |
| Реклама на ANCHEM.RU Администрация Ранг: 246 Размещение рекламы |
| |
| smihаilоv Пользователь Ранг: 3174 | 26.08.2013 // 15:53:13
Титреметрическую в этой жизни не найдёте. Попробуйте титриметрическую найти. | |
| Imhoff Пользователь Ранг: 535 | 26.08.2013 // 19:47:32 Редактировано 2 раз(а)
Титреметрическую в этой жизни не найдёте. Попробуйте титриметрическую найти. ТитрИметрическую. ну опечатался. Граммар-наци кругом! | |
| Апраксин VIP Member Ранг: 3255 | 26.08.2013 // 22:03:32
Экий Вы привередливый. | |
| smihаilоv Пользователь Ранг: 3174 | 27.08.2013 // 10:06:01 Без обид. Больше не буду. | |
| klepanka Пользователь Ранг: 175 | 30.08.2013 // 11:23:16 РД 52.24.403-2007. Массовая концентрация кальция в водах. Методика выполнения измерений титрометрическим методом с трилоном Б |

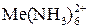
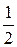 , fэкв(H2Y 2– ) =
, fэкв(H2Y 2– ) =