Приходько А.Е. (ЗАО «НПК Медиана — Фильтр»)
Вода в фармацевтическом производстве относится к ключевым элементам, обеспечивающим безопасность изготавливаемых лекарственных средств. Без применения воды самого разного качества не обходится практически ни одно фармацевтическое предприятие. Она может использоваться как сырье, вспомогательный материал, а так же как энергоноситель.
В технологическом процессе изготовления лекарственных средств, особенно для парентерального применения, вода занимает одно из первых мест среди основных источников пирогенных веществ, химического, микробиологического загрязнения, поэтому важной задачей является обеспечение высокого качества воды для фармацевтических целей, что достигается оптимальным выбором системы водоподготовки.
При производстве лекарственных средств для парентерального применения необходимо использовать воду для инъекций, к которой предъявляются достаточно жесткие требования. Одно из них — отсутствие пирогенных веществ.
Получить апирогенный продукт, а это — одно из основных требований, предъявляемым к инъекционным препаратам, можно лишь при правильной организации всего технологического процесса получения лекарства, в частности, контроля на содержание пирогенов. Наиболее рациональные точки контроля при изготовлении парентеральных лекарственных средств следующие: контроль сырья, контроль воды для инъекций , проверка элементов фильтра на вымывание из них пирогенов, контроль растворов перед стерилизующим фильтрованием, контроль чистоты ампул, флаконов. Основными источниками пирогенных веществ в воде для инъекций являются системы умягчения воды, деионизации и угольный фильтр, которые требуют наиболее пристального внимания, частой регенерации, очистке и т.п.
Требование апирогенности воды для инъекций связано с возможностью возникновения пирогенной реакции, которая выражается повышеним температуры тела, ознобом и другими симптомами. Причиной такой реакции часто являются эндотоксины граммотрицательных бактерий, которые при внутривенном введении обладают значительно большей активностью, чем при подкожном или внутримышечном введении. В связи с этим особенно опасны инфузионные растворы, загрязненные бактериальными эндотоксинами, т.к. они вводятся человеку в больших объемах.
Согласно ГФ XI тест на пирогенность проводится биологическим методом на кроликах, основанным на измерение температуры тела животных после внутривенного введения испытуемого препарата. Использование млекопитающих, вида, близкого к человеку, позволяет установить влияние испытуемого препарата на целый организм. С помощью испытания на животных возможно определять действие обоих классов пирогенов – «экзо» и «эндо»-токсинов, а также пирогенов небактериальной природы.
Однако этот метод достаточно длителен (4-5 часов), дает значительную вариабельность результатов, связанную с индивидуальной чувствительностью (чувствительность животных в 3-4 раза ниже, чем у человека), сезонностью. Используемые в эксперименте животные, должны содержаться в строго определенных условиях. Кроме того, многие лекарственные вещества в дозах, близких к терапевтическим, могут вызвать токсические реакции и даже гибель животных.
Наряду с фармакопейным методом возможно использование люминесцентного метода, основанного на способности бактериальных эндотоксинов усиливать флуоресценцию родамина 6Ж и 1-анилина-нафталин-8-сульфоната; флуориметрического метода, основанного на измерении собственной интегральной флуоресценции бактериальных пирогенов в пределах длин волн эмиссии от 310 до 400 нм.
В настоящее время доминирующее значение для контроля за содержанием пирогенных примесей, а именно, бактериальных эндотоксинов (БЭ), получил LAL -тест, позволяющий проводить испытания in vitro . Этот метод основан на способности лизата амебоцитов (клеток крови) мечехвоста специфически реагировать с эндотоксинами граммотрицательных бактерий. В результате реакции происходит помутнение прозрачной реакционной смеси или образование твердого геля, что и служит индикатором присутствия эндотоксина. Этот метод широко используется за рубежом и в настоящее время внедряется в России. Основными преимуществами LAL- теста являются:
- Возможность оценить уровень БЭ в тех препаратах, которые невозможно проверить на животных (антипиретиков, радиофармацевтических, противоопухолевых, седативных, короткоживущих изотопов и др.);
- Чувствительность LAL -теста в 100 раз выше, нежели чем испытание пирогенности традиционным методом;
- С помощью LAL- теста можно количественно определить концентрацию БЭ до 0,03 ЕДэ /мл (с помощью опытов на животных удается выявить наличие пирогенов, содержание которых превышает 5-10 ЕДэ / мл);
- Быстрота выполнения LAL -теста – 1- 1,5 часа.
Этот метод введен в Американскую, Британскую, Европейскую и др. Фармакопеи. В 1997 году Фармакопейный Государственный Комитет РФ утвердил общую фармакопейную статью 42-2960-97 «Определение содержания бактериальных эндотоксинов («ЛАЛ-тест»)».
Быстрота выполнения и высокая чувствительность LAL -теста в первую очередь необходимы для анализов воды, которую получают на асептических участках фармацевтических предприятий и применяют в качестве растворителя для приготовления парентеральных лекарственных средств. В настоящее время контроль безопасности, качества воды осуществляется в опытах на кроликах. Замена этого трудоемкого и малочувствительного метода даст не только экономический эффект, но и значительно улучшит качество лекарственных препаратов, и соответственно, безопасность их применения.
Для оценки безопасности и качества воды для инъекций , получаемой на фармацевтических предприятиях и в аптеках, в частных статьях Фармакопей США, Европы установлен показатель «содержание бактериальных эндотоксинов», который не должен превышать 0,25 ЕДэ/мл . В данный момент в нашей стране утверждается изменение к частной фармакопейной статье 42-2620-97 «Вода для инъекций». Для оценки пирогенности, как альтернативный биологическому, предлагается LAL -тест для определения содержания БЭ (не более 0,25 ЕДэ/мл).
На многих предприятиях в США, Европе, Японии и др., занятых выпуском парентеральных препаратов, существуют собственные стандарты, регламентирующие содержание БЭ в воде для инъекций. Они значительно строже, чем требуемый предел 0,25 ЕДэ/мл (табл.1):
Пределы содержания БЭ в воде для инъекций
источник
Содержимое (Table of Contents)
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Пирогенность ОФС.1.2.4.0005.15
Взамен ГФ XII, ч.1, ОФС42-0061-07
Настоящая общая фармакопейная статья распространяется на испытание пирогенности инъекционных растворов и фармацевтических субстанций, из которых они изготавливаются. Испытание основано на измерении температуры тела у кроликов до и после инъекции.
Каждого кролика содержат в отдельной клетке на полноценном пищевом рационе, ограждая от раздражающих воздействий (акустических, оптических и других). В помещениях, где находятся животные и проводятся испытания, поддерживают постоянную температуру воздуха 20 ± 3 ºС. Перед испытанием проводят осмотр животных и отбирают здоровых кроликов одного пола, не альбиносов, с массой тела от 2,0 до 3,5 кг, которые не теряли в массе в течение предыдущей недели.
За 18 часов до испытания кроликов лишают корма без ограничения воды. Во время опыта животные не получают ни корма, ни воды. Кроликов, впервые предназначенных для опыта или не участвовавших в опыте более четырех недель, предварительно готовят к процедуре испытания, осуществляя все рабочие операции (осмотр, взвешивание, измерение температуры тела) за исключением инъекции.
Кролики, ранее бывшие в опыте, могут быть использованы повторно через трое суток, если введенное им лекарственное средство было апирогенным. При повышении температуры тела у животного на 0,6 ºС и более, кролик может быть использован для дальнейших опытов не ранее, чем через две недели.
Если испытуемое лекарственное средство обладает антигенными свойствами, то порядок повторного использования животных для испытаний указывают в фармакопейной статье.
Посуда для разведения, шприцы и иглы для инъекций должны быть стерильными и апирогенными, что обеспечивается нагреванием при температуре 250ºС в течение 30 минут или 200ºС в течение 60 минут.
Для разведения испытуемых лекарственных средств используют 0,9 % раствор натрия хлорида для инъекций, если в фармакопейной статье не указан другой растворитель. Все растворители должны быть стерильными и апирогенными.
Ректальную температуру у кроликов измеряют с точностью до 0,1ºС медицинским максимальным ртутным или электронным термометром с термочувствительным датчиком. Термометр или датчик вводят в прямую кишку кролика на глубину от 5 до 7,5 см в зависимости от массы тела животного.
Испытуемое лекарственное средство вводят в ушную вену кролика, если в фармакопейной статье не указан другой путь введения. Объем инъецируемого раствора должен составлять не менее 0,2 мл и не более 10 мл на 1,0 кг массы тела животного. Перед введением раствор подогревают до температуры 37,0 ± 2ºС.
Тест-дозу испытуемого лекарственного средства, объём вводимого раствора и, если необходимо, скорость введения указывают в фармакопейной статье.
Испытание лекарственного средства проводят на группе из трех кроликов с исходной температурой 38,5-39,5 ºС.
Перед опытом, с интервалом не менее 30 минут, у каждого кролика дважды измеряют температуру тела. Различия в показаниях температуры у одного и того же животного не должны превышать 0,2ºС. В противном случае кролика исключают из испытания. За исходную температуру принимают величину последнего результата измерения.
Раствор испытуемого лекарственного средства вводят животным сразу после второго измерения температуры.
Измерения температуры после внутривенного введения испытуемого лекарственного средства проводят с интервалом не более 30 минут на протяжении трех часов. При других путях парентерального введения – на протяжении пяти часов.
Испытание лекарственного средства можно проводить поэтапно. На каждом этапе используют трех кроликов. Максимальное число этапов не должно превышать четырех.
По окончании каждого из этапов испытания определяют максимальное изменение температуры (Dt) тела каждого кролика по сравнению с исходным значением. Изменение температуры тела животного ниже исходной величины принимают за нулевое и не учитывают.
Для трех кроликов определяют сумму индивидуальных максимальных повышений температур (S Dt). Значения S Dt, полученные на разных этапах испытания, последовательно суммируют, а результаты сравнивают с уровнями, указанными в Таблице 1.
После первого этапа испытания лекарственное средство признают апирогенным, если полученный результат меньше или равен 1,2 ºС (Таблица 1, колонка 3), а индивидуальное повышение температуры ни у одного из трех кроликов не превышает 0,5 ºС (колонка 4).
Если результат, полученный на первом этапе, превышает 1,2 ºС (колонка 5) или зарегистрировано индивидуальное повышение температуры более чем на 0,5 ºС хотя бы у одного из трех кроликов (колонка 6), то необходимо перейти к проведению следующего этапа испытания.
После второго этапа испытания лекарственное средство признают апирогенным, если полученный результат меньше или равен 2,8ºС (колонка 3), а индивидуальное повышение температуры свыше 0,5ºС отмечено не более, чем у одного из шести кроликов (колонка 4).
Если результат, полученный на втором этапе испытания, больше 2,8ºС, но меньше 4,3ºС (колонка 5), или более, чем у одного животного зарегистрировано индивидуальное повышение температуры свыше 0,5ºС (колонка 6), то необходимо перейти к проведению следующего этапа испытания.
После третьего этапа испытания лекарственное средство признают апирогенным, если полученный результат меньше или равен 4,5ºС (колонка 3), а индивидуальное повышение температуры свыше 0,5ºС отмечено не более, чем у двух из девяти кроликов (колонка 4).
Если результат, полученный на третьем этапе испытания, больше 4,5ºС, но меньше 6,0ºС (колонка 5), или зарегистрировано индивидуальное повышение температуры свыше 0,5 ºС более, чем у двух животных (колонка 6), то необходимо перейти к проведению следующего этапа испытания.
После четвертого этапа испытания лекарственное средство признают апирогенным, если полученный результат меньше или равен 6,6 ºС (колонка 3), а индивидуальное повышение температуры свыше 0,5 ºС отмечено не более, чем у трех из двенадцати кроликов (колонка 4).
Лекарственное средство признают пирогенным, если результат на втором или последующих этапах испытания выше, чем величины, указанные в колонке 7. Лекарственное средство признают пирогенным и в том случае, если в результате четырех этапов испытания зарегистрировано индивидуальное повышение температуры свыше 0,5ºС более, чем у трех кроликов из двенадцати.
* При индивидуальном повышении температуры свыше 0,5 о С более, чем у трех кроликов из двенадцати, лекарственное средство признают пирогенным.
источник
ПИРОГЕННЫЕ ВЕЩЕСТВА. МЕТОДЫ ДЕПИРОГЕНИЗАЦИИ
Пирогенные вещества (от слов «пир» — огонь, «генан» — производить) впервые были выделены из загнивающего мяса Бердон-Сандерсеном в 1875 г. Пирогенные вещества образуют грамотрицательные бактерии. Установлено, что пирогенную реакцию вызывают живые и мертвые микробные клетки, а также продукты их жизнедеятельности. При попадании в кровь пирогенные вещества вызывают у человека и животных лихорадку, озноб, повышение температуры тела, падение артериального давления, цианоз, рвоту, понос, нейропению, лейкоцитоз.
Пирогенная активность грамположительных микроорганизмов в 10000 – 100000 раз слабее.
По химическому составу пирогенные вещества — это высокомолекулярные соединения липополисахаридной природы с молекулярной массой до 8000000 и размером частиц от 50 нм до 1 мкм. Молекула пирогена состоит из 3 частей:
1) общий полисахарид, он одинаков для многих грамотрицательных бактерий;
2) иммуноспецифическая полисахаридная цепь, характерная для каждого вида микробов;
3) липид А (токсичная часть) — именно он вызывает пирогенную реакцию организма. Представляет собой дисахарид глюкозамин, к которому амидными и эфирными связями присоединяются жирные кислоты.
Пирогены являются термостабильными веществами. Они не разрушаются при температуре стерилизации 120 о С и 132°С. Поэтому при приготовлении лекарственных форм для инъекций очень важно строгое соблюдение асептики. Кроме того, применяют следующие методы депирогенизации:
1) химические — обработка материалов 0,5-1% раствором калия перманганата, подкисленном серной кислотой; или нагревание в течение 1 часа при t=100°С в растворе пероксида водорода;
2) адсорбционные — поглощение пирогенов активированным углем, целлюлозой;
3) термический — прокаливание при t 180°С и выше;
4) механические — отделение пирогенов мембранным фильтрованием.
Испытания на пирогенность воды и растворов для инъекций проводят в соответствии с ГФ РБ Т 1, С.268. Ежеквартально испытание на пирогенность инъекционных растворов и воды для инъекций осуществляют в бактериологических лабораториях биологическим методом. Метод основан на измерении температуры тела кроликов после введения растворов испытуемых веществ.
Испытание проводят на здоровых взрослых кроликах обоего пола массой не менее 1,5 кг., желательно от 2,0 до 3,5 кг. Каждый кролик должен содержаться индивидуально в спокойном помещении при однородной подходящей температуре. В течение недели, предшествующей опыту, кролики не должны терять в массе. Температура тела кроликов должна быть в пределах 38,5-39,5 0 С (измеряется ректально, используют термометр или электрическое устройство). При уборке клеток и взвешивании животных оберегают от возбуждения (шум и резкие движения). Испытуемые лекарственные средства, вода для инъекций, шприцы и иглы должны быть стерильными и апирогенными. Предварительное испытание на животных проводят в соответствии с ГФ РБ. При испытании на пирогенность воды для инъекций из нее готовят изотонический раствор натрия хлорида. Растворы подогревают до температуры 37 0 С и медленно вводят в крайнюю вену уха каждого из кроликов в течение не более 2 минут, если иное не предписано в частной статье. Определение исходной и максимальной температуры проводят в соответствии с ГФ РБ. При определении исходной температуры кролики, у которых два последовательных значения температуры варьируются в пределах, превышающих 0,2 о С, изымаются из испытания.
Воду для инъекций или раствор лекарственного средства считают непирогенными, если сумма повышений температуры у трех кроликов меньше или равна 1,4 о С. Если эта сумма превышает 2,2 о С, то воду для инъекций или раствор лекарственного средства считают пирогенными. В случае, когда сумма повышения температуры у 3 кроликов находится в пределах от 1,5 до 2,2 о С, испытание повторяют дополнительно на 5 кроликах. В этом случае воду для инъекций или раствор лекарственного средства считают непирогенными, если сумма повышений температуры у всех 8 кроликов не превышает 3,7 0 С. Если же эта сумма равна 3,8 0 С или больше, воду для инъекций или раствор лекарственного средства считают пирогенными.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Сдача сессии и защита диплома — страшная бессонница, которая потом кажется страшным сном. 8443 — 

источник
Вода очищенная должна подвергаться химическому и бактериологическому контролю. Ежедневно (из каждого баллона, а при подаче воды по трубопроводу — на каждом рабочем месте ) — анализу на отсутствие хлоридов, сульфатов, солей кальция и др. Ежеквартально — полному химическому анализу. Два раза в квартал направляется в местную санитарно — бактериологическую лабораторию для бактериологического исследования.
Воду очищенную сохраняют в асептических условиях не более 3 суток в закрытых емкостях, изготовленных из материалов, которые не меняют свойств воды и защищают ее от механических включений и микробиологических загрязнений.
Большое значение для качества воды имеет способ ее сбора и хранения. Получаемая вода для инъекций собирается в чистые простерилизованные или обработанные паром сборники промышленного производства . Необходимые санитарно — гигиенические условия хранения воды для инъекций обеспечивают отечественные сборники.
Выбор сборника типа СИ для аптек зависит от объема работы и затраты очищенной воды. Сборники должны иметь четкую надпись: «Вода для инъекций». Если используется одновременно несколько сборников, они нумеруются.
В порядке исключения вода для инъекций может хранится в стерильных сборниках, которые плотно закрываются пробками с двумя отверстиями: одно — для трубки, по которой поступает вода, другой — для стеклянной трубки, в которую вставляется тампон из стерильной ваты для фильтрования воздуха. Приемник с меток защиты от пыли должен быть обязан закрыт в герметичный стеклянный бокс. Необходимо тщательно следить за чистотой баллонов и соединительных трубок, по которым поступает вода в сборник.
Обычные стеклянные бутылки с корковыми или притертыми пробками непригодны для хранения воды для инъекций.
Воду для инъекций используют свежеприготовленной или хранят при температуре от 5 до 10 С. При подготовке запаса воды для инъекций ее необходимо стерилизовать сразу же после пергонки в плотно закрытых сосудах 120 С в течении 20 минут или при 100 С в течение 30 минут, или подогревать в сборнике до температуры 80-95 С в процессе перегонки, сбора и затем хранить в септических условиях не более 24 часов.
Проверка качества воды для инъекций. В аптеках качество воды для инъекций проверяется химическими методами ежедневно с каждого баллона согласно требованиям ДФ на отсутствие хлоридов, сульфатов, солей кальция, возобновляемых веществ, аммиака и угольного ангидрида. Ежеквартально вода направляется в контрольно — аналитическую лабораторию для полного химического анализа. В этом случае, помимо вышеупомянутых анализов, в воде определяют рН, кислотность или щелочность, наличие сухого остаткаЮ нитратов, нитритов, тяжелых металлов.
Бактериологический контроль проводиться не реже 2 раз в квартал. В 1 мл очищенной воды, используемой для перегонки, предельно допустимое содержание микроорганизмов не должно превышать 10 -15 колоний.
Ежеквартально вода для инъекций контролируется на пирогенность, так как исследования на восстанавливающие вещества с калия перманганатом не может указывать на отсутствие пирогенных веществ.
Вода проверяется на отсутствие видимых механических включений.
Методы получения воды очищенной и воды для инъекций. Стадии технологического процесса получения воды.
Вода очищенная может быть получена дистилляцией, ионным обменом , электролизом, обратным осмосом. Вода — бесцветная , прлзрачная, без запаха и вкуса; рН может колебаться в пределах 5,0 — 7,0 ; не должна содержать восстанавливающих веществ, нитратов, нитритов, хлоридов, сульфатов, следов аммиака и других примесей.
Из методов получения воды очищенной распространенным является метод дистилляции (перегонки).
Перегонка воды должна проводиться в специально оборудованном для этого помещении. Стены помещения должны быть окрашены маслянной краской или выложены облицовочной плиткой и содержаться в абсолютной чистоте. В этих помещениях запрещается делать другие посторонние работы — мыть грязную посуду, стирать белье, хранить посторонние предметы. В порядке исключения может быть разрешена только стерилизация растворов лекарственных веществ.
Механические примеси обычно отделяют отстаиванием с последующим сливом воды из осадка или фильтрованием. Для этого используют фильтры, выполненные в виде емкости цилиндрической формы, заполненные антрацитом или кварцевым песком. Емкости имеют крышку и дно, Оснащенное устройством для ввода, вывода и распределения воды внутри фильтра. Фильтры могут быть однослойные или двухслойные. Высота загрузки колеблется в зависимости от количества взвешенных частиц и желаемого промывочного эффекта.
Нежелательно присутствие в воде солей кальция и магния, которые придают ей временную и постоянную жесткость, вследствие чего при дистилляции воды на стенках испарителя образуется накипь. Кроме того, при перегонке жесткой воды быстро выходят из строя нагревательные элементы дистиллятора. Временную жесткость обусловливает наличие кальция и магния гидрокарбонатов. От них можно избавиться кипячением воды. При этом гидрокарбонаты переходят в карбонаты и выпадают в осадок, который отфильтровывают. Но в этом случае вода насыщается углерода оксидом, медленно удаляется при кипячении, тем самым снижается рН воды очищенной. Поэтому для устранения временной жесткости целесообразно применять кальция гидроксил.
Постоянная жесткость воды обусловлена присутствием кальция и магния хлоридов, сульфатов и других солей. ее устраняют обработкой воды натрия карбонатом.
Доступен для каждой аптеки известково-содовый способ смягчения воды. Суть его в том, что в воду добавляют одновременно раствор кальция гидроксила и раствор натрия карбоната. Под действием кальция гидроксила устраняется временная (карбонатная) жесткость, поскольку кальция и магния гидрокарбонаты переходят в карбонаты и выпадают в осадок.
Под действием натрия карбоната выпадают соли постоянной (некарбонатных) твердости: сульфаты, хлориды и другие соли кальция и магния. Кальция гидроксил связывает также углерода диоксид, находящегося в воде.
Коагуляция коллоидных примесей. Коллоидную муть можно удалить только после предварительного укрупнения взвешенных частиц. Для разрушения коллоидной системы необходимо нейтрализовать электрический заряд частиц. Лишенные заряда частицы под действием сил взаимного притяжения соединяются-коагулируют. Укрупненные частицы имеют такую массу, при которой они теряют свою кинетическую устойчивость и выпадают в осадок. Нейтрализация заряда коллоидных частиц достигается добавлением в воду другого вещества также коллоидного характера, но частицы которой несут противоположный заряд.
Соединения кремниевой кислоты, находящиеся в воде, в коллоидно-дисперсном состоянии несут отрицательные заряды, поэтому для их коагуляции пригодны только вещества, заряженные в воде положительно. Как такое вещество чаще всего применяют алюминия сульфат или алюмокалиевые галуны. Обработку воды перед дистилляцией стоит делать в отдельных емкостях, чтобы избежать загрязнения аквадистилляторов.
Водопроводная вода, подготовленная таким образом, все же содержит достаточное количество солей, которые при дистилляции оседают на стенках испарителя и электронагревательных элементов, что значительно снижает производительность дистиллятора и нередко выводит из строя электронагреватели.
Метод магнитной обработки воды заключается в пропускании ее через зазоры, образованные в корпусе специального устройства между подвижными и неподвижными магнитами. В результате воздействия на воду магнитного поля изменяются условия кристаллизации солей при дистилляции. Вместо плотного осадка на стенках дистилляторов образуются рыхлые шламы, а в толще воды — суспендированных. При использовании устройства обязательное ежедневное сброса воды из аппарата для удаления шлама. Предложен электрохимический диализный аппарат с применением полупроницаемых мембран, а также ионообменная установка для получения обессоленной воды с использованием гранулированных ионитов и ионообменного целлюлозного волокна.
Общий принцип получения воды дистиллированной заключается в том, что питьевую воду, которая прошла водоподготовку, помещают в аквадистиллятор, состоящий из следующих основных частей: испарителя, пароотводной части (шлема и соединительных трубок), конденсатора (холодильника) и сборника. Для контроля уровня воды в камере испарения оборудовано водомерное стекло. Испаритель с водой нагревают до кипения. Пары воды поступают в конденсатор, где они скраплливаются и в виде дистиллята поступают в сборник. Все нелетучие примеси, находящиеся в исходной воде, остаются в аквадистилляторы.
источник
При парентеральном, особенно при внутрисосудистом введении препаратов, иногда наблюдается быстрое повышение температуры тела до 40°С, что сопровождается учащением пульса, ознобом, потовыделением, тошнотой и головной болью. В особо тяжелых случаях возможен смертельный исход, вызванный присутствием в растворе пирогенов — веществ бактериального происхождения. Пирогенностью обладают живые микроорганизмы и продукты их жизнедеятельности, тела мертвых бактерий, которые могут находиться в растворах после стерилизации. Пирогенные вещества принято разделять на экзогенные (в основном бактериальные) и эндогенные (клеточно-тканевые). Источником эндогенных пирогенов могут быть лейкоциты и белки крови, которые в определенных условиях образуют и выделяют биологически активные вещества с пирогенными свойствами (лейкопирогены).
С химической точки зрения пирогены — это сложные вещества с высокой молекулярной массой и размером частиц от 50 до 1 мкм, состоящие в основном из липополисахаридов, адсорбированных на белковом носителе. Например, химический состав пирогенного вещества, выделенного из Proteus Vulgaris, состоит из углерода (25,83%), водорода (6,06%), азота (6%), фосфора (0,29%) и золы (8,33%).
Пирогены растворимы в воде, нерастворимы в спирте и ацетоне, устойчивы к воздействию повышенной температуры. Нагревание в автоклаве при 120°С в течение 20 мин приводит к гибели бактерий, но не уничтожает пирогены. Чувствительность пирогенов к высокой температуре различна. Изменение pH водного раствора практически не влияет на термолабильность пирогенов. В сухом виде их полное разложение происходит только при температуре 200°С в течение 30 мин; стерилизация сухим воздухом при 160°С в течение 2 ч не гарантирует полной апирогенности. Повышение температуры позволяет сократить время, необходимое для уничтожения пирогенов. При температуре 600°С достаточно минутного нагревания, при 450°С — двухминутного, следовательно, освободить от них воду и инъекционные растворы термической стерилизацией практически невозможно.
Пирогенные вещества чувствительны к действию окислителей, например, перекиси водорода или перманганата калия.
Пирогены обладают очень малыми размерами и пррходят через самые плотные фильтры с размерами пор от 0,005 до 0,001 мкм.
Существуют различные методы обнаружения и удаления пирогенов из растворов.
Для практических целей, наряду с методами удаления пирогенных компонентов, большое значение имеют методы их обнаружения:
Химические методы основаны на проведении определенных цветных реакций.
Физические методы основаны на измерении электропроводности и полярографических максимумов.
Из-за ряда недостатков первых двух методов чаще всего применяют методы биопроб, которые введены в Фармакопеи различных стран мира.
Биологические методы. До настоящего времени основным и официально принятым во всех странах методом испытания лекарственных средств на наличие пирогенных примесей считается метод, основанный на троекратном измерении температуры тела кролика после внутривенного введения исследуемого препарата. Повышение температуры на 0,6°С или более, согласно требованию фармакопей, считается доказательством наличия пирогенов.
Специальные статьи Фармакопей оговаривают условия . проведения этого испытания, поскольку факторы — химический (корм), физический (изменение температуры окружающей среды), физиологический (возбуждение животных при анальном измерении температуры) — могут повлиять на результат испытания. И даже при самом строгом соблюдении требований к проведению испытаний невозможно избежать случайных ошибок, связанных с индивидуальной чувствительностью животных к пирогену и препарату, различными климатическими условиями, времени постановки опыта и т. п. Все это может отразиться на показателях температуры, измеренной с точностью до ±0,1°С.
Согласно данным различных Фармакопей доза одного и того же препарата в ряде случаев колеблется в широких пределах. Очень часто при равных или весьма близких дозах препаратов объемы вводимых растворов различаются в 5 раз. Отмечено, что наблюдается большой разрыв между дозами для кроликов и человека. Нередко эти дозы различаются в 100—6000 раз. По мнению ученых, изучавших этот вопрос, тест-доза препарата при испытании пирогенности должна подбираться индивидуально, учитывая его фармакологию, переносимость кроликом, и ориентировочно должна составлять 1/10 максимальной суточной дозы для человека.
Существует вариант условий признания препарата пирогенным либо алирогенным: воду или раствор лекарственного средства считают апирогенным, если сумма максимальных повышений температур у 3 кроликов не превышает 1,2°С, и пирогенным, если она равна или больше 2,2°С. Если сумма повышений температуры у 3 кроликов больше 1,2°С, но меньше 2,2°С, то испытание повторяют на 5 кроликах. Воду или раствор лекарственного средства считают пирогенным, если сумма повышений температуры у 8 кроликов равна или больше 3,8°С, в противном случае — апирогенным.
В последнее время заметное распространение получает метод испытания лекарственных средств на пирогенность in vitro с использованием лизата амебоцитов краба Лимулюс. Этот метод имеет ряд преимуществ перед фармакопейным: он чувствительнее в 5—10 раз, результат получается быстрее, возможно количественное определение пирогена. Кроме того, с его помощью возможен контроль препаратов, которые нельзя испытать на кроликах. Одним из недостатков этого метода является его специфичность в отношении эндотоксина грамотрицательных бактерий, т. е. опасность не выявить наличие в лекарственных средствах пирогенов другого происхождения.
источник
| Информация о документе | |
| Дата добавления: | |
| Размер: | |
| Доступные форматы для скачивания: |
ТЕСТОВЫЕ ЗАДАНИЯ С ОТВЕТАМИ
к программе по фармацевтической технологии
1. Для протирания ручных весочков используют:
Б. 3% раствор перекиси водорода
2. Метрологическая проверка весов и гирь, применяемых в аптечных учреждениях производится:
Наркотические, ядовитые и сильнодействующие лекарственные средства отвешивает:
4. Наука, занимающаяся изучением влияния фармацевтических факторов на терапевтическую эффективность лекарственных препоратов, это:
Б. технология лекарственных форм
5. Высокой гигроскопичностью, которую учитывают при изготовлении любых лекарственных форм, обладает:
6. Свойством летучести, которое учитывают при обеспечении условий хранения и изготовлении лекарственных препаратов, обладают:
7. Какие вещества при изготовлении сложных порошков измельчаются со спиртом:
3. Кислота аскорбиновая В. 5, 6
8. Назовите красящие вещества, которые в сложных порошках вводят между слоями не красящих веществ:
5. Этакридина лактат Д. 1, 2, 4
11. Первым при изготовлении массы порошков измельчают лекарственные вещества:
А. выписанные в малой массе
12. После затирания пор ступки вещества смешивают в порядке:
А. в первую очередь вещества списка А
Б. от большего количества к меньшему
Г. от меньшего количества к большему
Д. в первую очередь наркотические вещества.
Предельно допустимое соотношение при смешивании порошков:
14. Тритурации используют, если количество лекарственных средств списка А Б на все порошки:
15. При изготовлении тритурации в качестве индифферентного вещества используют:
А. любое вспомогательное вещество
16. Порошки с фенилсалицилатом следует отпустить в капсулах:
18. Порошки упаковывают в пергаментные капсулы, если в их составе присутствуют вещества:
19. Массо-объемная концентрация – это количество вещества в граммах в:
А. общем объеме раствора в мл
Б. общей массе раствора в граммах
В. объеме воды очищенной в мл
20. При изготовлении простых растворов изменение общего объема не учитывают, если концентрация раствора меньше:
21. При изготовлении сложных растворов изменение общего объема учитывают, если суммарное содержание твердых веществ:
22. Если в рецепте не указан растворитель, то готовят:
Г. на любом, разрешенном к применению
А. масло подсолнечное, сироп сахарный, эфир
Б. вода очищенная, скипидар, настойки, глицерин
В. эфир, глицерин, пергидроль, хлороформ, ихтиол
Г. димексид, глицерин, жидкость Бурова
Д. глицерин, сироп сахарный, димексид.
3. воду очищенную В. 2, 5, 7, 9
4. эфир медицинский Г. 1, 3, 7, 8
5. масло подсолнечное Д. 3, 7, 8, 9
25. Не используют процессы нагревания и тщательного перемешивания при изготовлении растворов:
26. Концентрация йода в растворе Люголя для внутреннего применения составляет:
27. Какое из веществ в жидких лекарственных формах берут с учетом процента влажности:
28. В горячей воде следует растворять вещества:
А. этакридина лактат, кальция глюконат, кислоту борную
Б. натрия гидрокарбонат, серебра нитрат, кислоту борную
В. фенол, натрия хлорид, анальгин
Г. калия бромид, кальция хлорид, новокаин
Д. глюкоза, кофеин-бензоат натрия, кислоту аскорбиновую.
29. При отсутствии в рецепте или другой НД указаний о концентрации спирта этилового применяют этанол:
30.Общими технологическими правилами при изготовлении водных и этанольных растворов является:
1. массо – объемный метод изготовления А. 1,2,4
2. нежелательность нагревания и фильтрования Б. 2,4,5
3. добавление растворителя после отвешивания
лекарственных веществ В. 3,4
4. дозирование растворителя по объему Г. 2,5
5. растворение ведут в подставке Д. 1,4.
31. Последовательность смешивания ингредиентов при изготовлении микстуры с пепсином:
А. пепсин+вода + кислота хлористоводородная
В. хлористоводородная кислота +вода+пепсин
Г. вода+хлористоводородная кислота+пепсин
Д. хлористоводородная кислота+пепсин+вода.
32. Технологические приемы, используемые для изготовления раствора протаргола:
А. растворяют в концентрированном растворе своих солей
Б. растворяют при нагревании
В. растворяют во флаконе для отпуска в слабокислом растворе
Г. растворяют в ступке в части воды, часть оставляют для споласкивания
Д. растворяют в широкогорлой посуде, вещество насыпают на поверхность воды тонким слоем.
33. Концентрированные растворы лекарственных веществ (концентраты) добавляют:
А. в подставку к раствору других лекарственных веществ
Б. в отпускной флакон в первую очередь
В. в отпускной флакон к профильтрованному раствору лекарственных веществ или к рассчитанному количеству воды
Д. в подставку к жидкостям, содержащим эфирные масла в чистом виде.
34. При введении в состав микстуры 5,0 кальция хлорида отмеривают 10 мл концентрированного раствора концентрации:
35. Общий объем микстуры, изготовленной по прописи:
Sirupi simplicis ana 5 ml
36. Число приемов микстуры с общим объемом 180 мл, дозируемой столовыми ложками, равно:
37. Вода ароматная, выписанная в прописи рецепта в качестве дисперсионной среды, при изготовлении микстур добавляется:
Б. после концентрированных растворов,
В. до добавления жидкостей, содержащих этанол,
Г. в последнюю очередь, т.к. содержит эфирное масло.
38. Жидкости, содержащие этанол, добавляют к микстуре:
Б. после растворения лекарственных средств списков А и Б (до концентратов),
В. последними в порядке возрастания концентрации этанола,
Г. последними в порядке уменьшения концентрации этанола.
39. Дисперсионной средой является вода, суспензию образует:
40. В каких случаях образуются суспензии?
1. в результате химических реакций А. 1,2,4,5
2. если прописаны вещества, растворимые в
3.если превышен предел растворимости В. 3,4,5,6
4. при смене растворителя Г. 1,3,4,6
5. если прописаны вещества списка Б Д. 1,3,4,5
6.если вещество нерастворимо в данном растворителе
41. При изготовлении суспензий для диспергирования веществ в ступку помещают жидкость в количестве:
А. 30% от массы сухих веществ
В. в половинном количестве от массы веществ
42. При приготовлении суспензий используют желатозу для:
А. Камфоры, ментола, фенилсалицилат
Б. Цинка оксид, тальк, висмута субнитрат
В. Оксид магния, белая глина, сера
Г. Магния карбонат основной, крахмал, кислота борная
43. Эмульсии – это лекарственная форма, состоящая из:
А. диспергированной фазы в жидкой дисперсионной среде,
Б. тонко диспергированных, несмешивающихся жидкостей,
В. макромолекул и макроионов, распределенных в жидкости,
Г. мицелл в жидкой дисперсионной среде.
44. При отсутствии указаний о концентрации в соответствии с ГФ XI для изготовления 100,0 эмульсии берут масла:
45. При отсутствии указания о том. какое масло следует взять для изготовления эмульсии, могут быть использованы масла:
46. Режим экстракции при изготовлении настоев:
А настаивание 30 мин., охлаждение 10 мин.
Б. настаивание 15 мин., охлаждение 45 мин.
В. настаивание 45 мин., охлаждение 15 мин.
Г. настаивание 10 мин., охлаждение 30 мин.
Д. настаивание 30 мин., без охлаждения.
47. Режим экстракции при изготовлении отваров:
А настаивание 30 мин., охлаждение 10 мин.
Б. настаивание 15 мин., охлаждение 45 мин.
В. настаивание 10 мин., охлаждение 30 мин.
Г. настаивание 45 мин., охлаждение 15 мин.
Д. настаивание 25 мин., охлаждение искусственное.
48.Настои и отвары из лекарственного растительного сырья списка Б готовят из экстрактов в соотношении:
49. При отсутствии указания о количестве лекарственного растительного сырья извлечение из травы горицвета готовится в соотношении:
50. Режим экстракции при изготовлении водных извлечений из сырья, содержащего дубильные вещества:
А настаивание 30 мин., охлаждение 10 мин.
Б. настаивание 15 мин., охлаждение 45 мин.
В. настаивание 30 мин., без охлаждения
Г. настаивание 25 минут, охлаждение искусственное
Д. настаивание 30 минут, до полного охлаждения.
51. Режим экстракции при изготовлении водных извлечений с пометкой «Cito»:
А настаивание 25 мин., охлаждение искусственное
Б. настаивание 15 мин., охлаждение 30 мин.
В. настаивание 25 мин., без охлаждения
Г. настаивание 30 мин., охлаждение 10 мин.
Д. настаивание 30 мин., без охлаждения.
52. Отвары из листьев сенны процеживают:
Б. после полного охлаждения
В. после охлаждения в течение 45 мин.
Г. после искусственного охлаждения
Д. после охлаждения в течение 10 мин.
53. Особенность приготовления водной вытяжки из сырья, содержащего эфирные масла:
Б. инфундирку не открывают
В. добавляют натрия гидрокарбонат
Г. добавляют кислоту хлористоводородную
Д. охлаждают с открытой инфундиркой.
54. В одном инфундирном стакане изготавливать водные извлечения из сырья с различной гистологической структурой:
В. можно, если физико – химические свойства действующих веществ требуют одинакового режима экстракции.
55. При изготовлении водных извлечений с применением жидких экстрактов – концентратов их добавляют в микстуру с учетом концентрации и свойств использованного экстрагента:
В. до жидкостей с большей концентрацией этанола,
Г. после жидкостей с большей концентрацией этанола.
56. Если в рецепте не указана концентрация мази, то из веществ общего списка готовят в концентрации:
57. Если в рецепте выписана официнальная мазь, но нестандартной концентрации, в качестве основы используют:
Б. сплав вазелина с ланолином,
В. консистентную эмульсию «вода — ланолин»,
Г. официнальную основу с пересчетом компонентов.
58. К мазям-суспензиям относится:
59. Нижеперечисленные лекарственные вещества образуют мазь типа раствора:
1. кислота салициловая А. верно все
60. Ланолин водный содержит воду в количестве:
61. В мазях-суспензиях лекарственные вещества растирают с жидкостью, родственной мазевой основе, если концентрация мази:
62. В мазях-суспензиях вещества растворяют в части расплавленной основы, если концентрация мази:
63. Мази-эмульсии образуют лекарственные вещества:
Г. не растворимые в воде и в основе
64.Обязательно вводят в мазь в растворенном виде (растворяют в воде):
1. протаргол А. верно 1, 2, 3
2. кислота салициловая Б. верно все
3. калия иодид В. верно 1, 3, 5
4. сера очищенная Г. верно 1, 3
5. ксероформ Д. верно 1, 2, 4
65. Пастами называют мази с концентрацией:
67. Мази – суспензии образуют:
1. кислота борная А. верно 1,2,4,5
2. цинка оксид Б. верно все
3. раствор адреналина гидрохлорида В. верно 1,3,5
68. По концентрации входящих лекарственных веществ мазь серная относится:
В. к мазям-суспензиям с концентрацией сухих веществ менее 5%
69. Мази-сплавы готовят, сплавляя компоненты:
А. в порядке повышения температуры плавления
В. в порядке понижения температуры плавления.
70. Если в рецепте не указано количество основы, то ректальные суппозитории согласно ГФ готовят массой:
71. Если в рецепте не указано количество основы, то вагинальные суппозитории готовят массой:
73. Какое из требований не предъявляется к суппозиториям:
74. Новокаин вводят в суппозиторную основу по типу:
75. По типу суспензии вводят в суппозиторную основу:
76. К преимуществам инъекционного способа введения лекарственных веществ относятся все, кроме:
А. опасность внесения инфекции
Б. возможность оказания экстренной помощи
В. высокая степень биологической доступности лекарственных веществ
Г. точность дозирования лекарственных веществ
Д. быстрота наступления терапевтического действия.
77 . Анализ воды для инъекций на пирогенность осуществляется:
78. К инфузионным растворам относят растворы для парентерального введения объемом:
79. К термическому методу стерилизации относится:
А. стерилизация ультрафиолетовым облучением
Б. паровой метод стерилизации
В. стерилизация фильтрованием
Д. стерилизация растворами.
80. Водные растворы для инъекций стерилизуют:
81. Срок хранения воды для инъекций
82. Интервал времени от начала изготовления раствора для инъекций до стерилизации не должен превышать:
83. Термостойкие порошки в аптечных условиях стерилизуют:
Б. ультрафиолетовым облучением
84. Флаконы для отпуска инъекционных растворов стерилизуют паровым методом при температуре:
85. В качестве стабилизатора для инъекционного раствора глюкозы используют:
А. 1 М раствор кислоты хлороводородной
Б. 0,1 М раствор натрия гидроксида
86. Для стабилизации растворов новокаина для инъекций используют:
А. 0,1 М раствор натрия гидроксида
В. 0,1 М раствор кислоты хлороводородной
Д. 1 М раствор натрия гидроксида
87. Для стабилизации растворов кислоты аскорбиновой используют следующий стабилизатор:
А. натрия гидрокарбонат с натрия сульфитом
Б. раствор натрия гидроксида 0,1 М
В. раствор кислоты хлороводородной 0,1 М
88. Какие требования предъявляет ГФ-Х1 к растворам для инъекций?
А. стерильность, апирогенность, стойкость, изотоничность
Б. стерильность, апирогенность, стойкость, изоионичность
В. чистота, стерильность, апирогенность, точная концентрация лекарственных веществ
Г. стерильность, апирогенность, стойкость, чистота
Д. стерильность, изотоничность, чистота, апирогенность.
89. Натрия хлорид в глазные капли добавляют для:
А. предотвращения окисления
Б. перевода вещества в устойчивую форму
В. предотвращения гидролиза
Г. достижения изотоничности
90. В качестве изотонирующего компонента для изготовления глазных капель ГФ XI разрешает использовать:
1. натрия хлорид А. верно все
2. натрия тиосульфат Б. 1,2,3
4. натрия метабисульфат Г. 1,3,5
92. Растворы внутреннего и наружного применения для новорожденных детей изготавливают на:
Б. воде очищенной, проверенной на отсутствие восстанавливающих веществ,
солей аммония, углерода диоксида
93. При отсутствии указаний для мазей с антибиотиками (не глазных) применяют основу, состоящую из:
Б. 10 частей безводного ланолина и 90 частей вазелина
В. 40 частей безводного ланолина и 60 частей вазелина
Г. 1 часть ланолина безводного и 5 частей вазелина
Д. 30 частей ланолина безводного и 60 частей вазелина.
96. Какие лекарственные средства применяются только в гомеопатии?
А. химические элементы и неорганические соединения
Б. органические соединения
В. продукты животного происхождения
Г. продукты патологических секретов и выделений (назоды)
Д. растения и вытяжки из них
97. К лекарственным формам только промышленного производства относятся:
3. растворы для инъекций В. верно 1,3,4,5
98. Продление лечебного эффекта в пролонгированных лекарственных формах – это:
А. увеличение дозировки лекарственного вещества
Б. улучшение лечебного эффекта
В. создание в организме терапевтической концентрации лекарственного
вещества и равномерное поддержание ее в течение длительного времени
Г. увеличение числа приемов лекарства.
99. Таблетки по определению ГФ, это:
1. лекарственная форма для внутреннего применения
2. лекарственная форма, состоящая из лекарственного средства, заключенного в оболочку
3. дозированная лекарственная форма
лекарственная форма, получаемая прессованием лекарственных и вспомогательных веществ
лекарственная форма, предназначенная для внутреннего, наружного,
сублингвального, имплантационного или парентерального применения.
100. Настойки по определению ГФ это:
окрашенные жидкие спиртовые или водно – спиртовые извлечения из лекарственного растительного сырья
2. концентрированные извлечения из лекарственного растительного сырья
3. водные извлечения из лекарственного растительного сырья
4. получаемые без нагревания и удаления экстрагента
5. получаемые с применением нагревания или удаления экстрагента
источник
1. В контрольно-аналитическую лабораторию из аптеки поступила на анализ вода очищенная и вода для инъекций.
Студенту выпускного курса, проходящему производственную практику, было поручено провести анализ поступившей воды. Провизор-аналитик перед проведением анализа задал студенту несколько вопросов:
Где и в какие сроки проводится полный фармакопейный анализ воды очищенной и воды для инъекций?
Дайте обоснование способам определения показателей примесных соединений и ионов, которые включены в фармакопейные статьи на эти препараты. Какие из этих ионов и соединений должны отсутствовать, а содержание каких в фармакопейных статьях нормируется? Обоснуйте различие в методиках определения.
Можно ли считать воду отвечающей требованиям качества только на основании химического контроля?
Какие дополнительные испытания регламентируются при оценке качества воды для инъекций? Охарактеризуйте современные способы определения ее пирогенности. Какую опасность представляет вода, не выдерживающая испытаний по этому показателю?
Какие факторы, влияющие на качество воды для фармацевтических целей, провизор должен учитывать при организации и контроле процессов ее получения, хранения и использования; каким нормативным документом он при этом руководствуется?
Проводится ли в аптеке полный фармакопейный анализ воды очищенной и воды для инъекций? Если нет, то перечислите показатели, примесные соединения и ионы, на которые провизор-аналитик проводит испытания в аптеке при анализе воды очищенной и воды для инъекций.
Вода очищенная. Aqua purificata
Вода очищенная получается методом дистилляции, обратным осмосом, ионным обменом и другими методами. Это наиболее часто используемый растворитель для лекарственных веществ. На воде очищенной готовят микстуры, жидкости для наружного применения. На воде для инъекций готовят инъекционные растворы, глазные капли. Вода очищенная должна соответствовать определенным требованиям в отношении чистоты. Это должна быть бесцветная, прозрачная жидкость без запаха и вкуса, с рН в пределах 5—7. Определение, в соответствии с требованиями ГФ, должно проводиться потенциометрическим методом. В воде очищенной определяют 0 сухой остаток после выпаривания 100 мл. После высушивания при 100-105 °С до постоянного веса остаток не должен превышать 0,001% (1 мг в 100 г воды) В воде очищенной не должно быть восстанавливающих вещест; (остатки микроорганизмов). Это определение проводят путем кипячения 100 мл воды, 1 мл 0,01 н. раствора КМп04и 2 мл разведен ной H2S4в течение 10 мин. Розовая окраска раствора должна со храниться, а в случае присутствия восстанавливающих веществ, он; исчезнет:
Вода легко поглощает С02. В воде очищенной этого примесного вещества не должно быть. Обнаруживают его по помутнению в присутствии известковой воды [Са(ОН)2]. Определение ведут в течение 1 ч в закрытом сосуде, заполненном доверху равными объёмами испытуемой воды и воды известковой. Помутнение указывает на наличие СО, в воде очищенной:
В воде очищенной должны отсутствовать нитраты и нитриты, которые определяют по посинению раствора дифениламина (химизм — см. стр. 14,15). Раствор дифениламина готовят на концентрированной H2S4. В воде очищенной допускается содержание примесного иона аммония в пределах не более 0,00002%. Для оценки регламентированного количества аммиака в воде необходимо использовать эталонный раствор, содержащий 0,00002% аммиака. В испытуемой воде и в эталонном растворе проводят реакцию с реактивом Несслера (раствор K2HgI4 в КОН). Окраска в испытуемой воде не должна быть интенсивнее, чем в эталонном растворе:
В воде очищенной должны отсутствовать хлориды, сульфаты, ионы кальция и тяжелых металлов. Хлорид-ионы открывают по реакции с раствором AgN03 в присутствии HNO3, (химизм — см. с. 18). Не должно быть помутнения или опалесценции. Азотная кислота делает реакцию специфичной, т.к. осадки AgN03 с другими ионами (за исключением В г — и 1
-ионов) в HN03 растворяются. Сульфаты обнаруживают по реакции с раствором ВаС12 в присутствии НС1, в которой растворяются осадки иона бария с другими ионами, например S03 2
(химизм — см. с. 14, 18). Не должно быть помутнения. Ионы кальция обнаруживают по реакции с раствором оксалата аммония в присутствии аммиачного буфера, создающего оптимальные условия для реакции, рН 6,0 — 7,5 (химизм — см. с. 18). Не должно быть помутнения. Ионы тяжелых металлов обнаруживают по реакции с раствором натрия сульфида в среде кислоты уксусной. Данная реакция позволяет выявить ионы тяжелых металлов, дающие с 5 2
-ионами темные осадки. Поскольку концентрация ионов крайне мала, наличие примесей ионов тяжелых металлов характеризуется появлением бурого окрашивания:
Микробиологическая 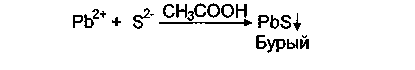
Вода для инъекций — Aqua pro injectionibus. Вода для инъекций должна отвечать требованиям, предъявляемым к воде очищенной. Кроме того, она должна быть апирогенной, не содержать антимикробных веществ и других добавок. Определение пирогенности проводят в соответствии с ФС «Испытание на пирогенность». Для определения пирогенности инъекционных препаратов (и в том числе воды для инъекций) в настоящее время наряду с испытаниями на кроликах используют ЛАЛ-реактив. В ФС «Бактериальные эндотоксины» описаны требования к ЛАЛ-реактиву, процедура анализа, расчет предельного содержания бактериальных эндотоксинов.ЛАЛ-тест основан на способности лизата амебоцитов (клеток крови) мечехвоста Limulus polyphemus (Лизат Амебоцитов Лимулюс — ЛАЛ-реактив) специфически реагировать с эндотоксинами бактерий (липополисахаридами). Этот тест может быть использован в медицине для ранней диагностики заболеваний, вызванных грамотрицательными бактериями. Реакция между эндотоксинами и лизатом дает помутнение реакционной смеси и увеличение ее вязкости вплоть до образования плотного геля. Такой результат является доказательством присутствия эндотоксинов. Анализ называется гель-тромб-тестом и используется для определения соответствия реального содержания бактериальных эндотоксинов предельному их содержанию, указанному в частной статье ГФ (качественный анализ), а также для определения содержания бактериальных эндотоксинов в испытуемом препарате (количественный анализ). Основным методом проведения анализа на соответствие показателю «Бактериальные эндотоксины» является качественный анализ (при отсутствии других указаний). Этот метод является также арбитражным. ЛАЛ-реактив представляет собой лиофилизированный препарат. Вода для ЛАЛ-теста должна соответствовать требованиям, предъявляемым к воде для инъекций и не содержать бактериальные эндотоксины в количествах, определяемых используемым ЛАЛ-реакти-вом в данном тесте. Используют воду для инъекций свежеприготовленную или хранящуюся не более 24 ч при температуре 5—10 °С или 80—95 °С в закрытых ёмкостях, изготовленных из материалов, не изменяющих свойства воды, защищающих воду от попадания механических включений и микробиологического загрязнения.
Преимущество данного теста перед испытанием на кроликах заключается в его высокой чувствительности. Кроме того, определение не требует много времени — результат может быть получен через 30—60 мин.
2. Аптека изготавливает большое количество растворов антисептиков (водорода пероксида, хлорамина Б, серебра нитрата, йода, калия перманганата). Какую воду необходимо использовать при этом? Требуется ли дополнительная ее подготовка?
После изготовления 5% раствора калия перманганата для новорожденного ребенка было отмечено выпадение осадка. В чем причина этого явления и как его предотвратить? Может ли быть отпущен такой препарат?
В растворе эуфиллина, изготовленном в аптеке, также наблюдалось появление осадка. Какое соединение выпало в осадок и почему?
Можно ли использовать для изготовления лекарственных препаратов воду очищенную независимо от даты ее получения?
Указанная группа веществ по фармакологическим свойствам относится к антисептикам. Но физико-химические свойства этих веществ требует индивидуального подхода. Все растворы указанных веществ готовятся на воде очищенной:
Растворы примесей водорода _ это стандартный фармакопейный раствор представленный в нормативной документации двумя концентратами:
Solutio Hydrogenii peroxydi dilutum (3%) 2,7 %-3,3%
Solutio Hydrogenii peroxydi concentratum seu Perhydrolum 30 % (27,5 %-30,l%) Как антисептическое средство используется 3% раствор перекиси водорода.
Трубопроводы неполимерных материалов стерилизуются 0,5% раствором водорода пероксида 6 часов с последующим промыванием водой очищенной. 3 % раствор используется для обработки ручных весочков перед отвешиванием субстанции.
Раствор перекиси водорода для наружного применения новорождённым готовят в асептических условиях на стерильной очищенной воде, разливают в стерильные флаконы Приготовленный раствор в аптеках имеет срок годности 15 суток. Хранить следует в прохладном месте, защищенном от света закрытыми полиэтиленовой пробкой и завинчивающейся крышкой.
Раствор йода, раствор Люголя, раствор серебра нитрата, калия перманганата готовят на воде очищенной, которая должна отвечать требованиям ФС-42-2619-97, а именно: не должна содержать хлоридов, нитратов, восстанавливающих веществ, кальция, диоксида углерода, тяжёлых металлов. Нормируется содержание аммиака, рН от 5,0 до 7,0.
Очищенную воду ежедневно проверяют на отсутствие хлоридов, сульфатов, ионов кальция, значения рН. Растворы окислителей (калий перманганата, серебра нитрата, йода, водород пероксида, хлорамина) должны готовится на воде дополнительно проверенной на отсутствие восстанавливающих веществ:
5% раствор перманганата калия для новорожденного ребёнка готовить следует на стерильной очищенной воде в асептических условиях, без последующей стерилизации. Причины появления осадка стало то, что кроме обычного контроля предварительно вода очищенная не была проверена на наличие восстанавливающих веществ, в результате в растворе калия перманганата произошла реакция окислительно-восстановительная, с образованием осадка двуокиси марганца. Препарат с осадком и изменённым цветом раствора отпущен быть не может.
Растворы эуфиллина готовятся на воде инъекционной для внутривенного и внутримышечного введения, которая должна быть проверена, кроме ежедневного контроля (хлоридов, сульфатов, ионов кальция, значение рН) дополнительно на отсутствие диоксида углерода. При наличии содержания углекислоты в воде для инъекций образуется осадок нерастворимых карбонатов в этилендиамине и теофиллине. Раствор отпуску не подлежит.
Вода очищенная имеет сроки годности при правильном хранении 3 суток (72 часа), вода для инъекций должна быть свежее полученная и используется в течении 1 суток. Более 3 суток вода использоваться не должна, так как является питательной средой для развития микроорганизмов.
источник
