Сущность метода заключается в титровании пробы стандартным раствором кислоты в присутствии индикаторов фенолфталеина или метилового оранжевого.
Чувствительность метода 50 мкг-экв./дм 3 .
Диапазон определяемых значений — от 0,5 до 20 мг-экв./л.
Комплектация рассчитана на проведение 1000 определений.
Необходимые для проведения анализа приборы и материалы:
Колбы мерные 2-1000-2 по ГОСТ 1770.
Колбы Кн-250 ТХС по ГОСТ 25336Е.
Цилиндры мерные вместимостью 100 см 3 по ГОСТ 1770
Воронка коническая стеклянная по ГОСТ 23932.
Бюретка 1-2-25-0,1 по ГОСТ 29251.
Вода дистиллированная по ГОСТ 6709 (вода обессоленная, конденсат).
Состав набора:
Кислота соляная, стандарт-титр для приготовления раствора с концентрацией 0,1 г-экв./дм 3 .
Метиловый оранжевый, индикатор, 0,1% водный раствор по ГОСТ 4919.1.
Фенолфталеин, индикатор, сухая смесь, по ГОСТ 4919.1.
Реактивы, входящие в состав набора, проверяются на соответствие требованиям действующих стандартов и технических условий.
Поправочные коэффициенты на нормальность стандартных растворов находятся в пределах 1±0,003.
Приготовление рабочих растворов.
Перед проведением анализа необходимо приготовить раствор соляной кислоты.
Для приготовления раствора соляной кислоты необходимо количественно перенести содержимое ампулы в мерную колбу, растворить примерно в 800-900 мл дистиллированной воды, хорошо перемешать и довести объем раствора до метки дистиллированной водой.
Время, затрачиваемое на проведение операции — около 20 минут.
Поправочный коэффициент для растворов, приготовленных из стандарт-титров, равен единице.
Готовый раствор перелить в емкости для хранения.
Проведение анализа.
1. В чистую коническую колбу Кн 2-250 мерным цилиндром отмеряют 100 см 3 анализируемой воды и прибавляют индикатор фенолфталеин.
Если проба имеет розовую окраску, ее титруют стандартным раствором соляной кислоты до обесцвечивания раствора. Результат титрования заносят в журнал. После чего к пробе прибавляют 3-4 капли раствора индикатора метилового оранжевого. Проба окрасится в желтый цвет.
Если после прибавления к пробе фенолфталеина окрашивание не проявляется. К пробе следует сразу прибавить 3-4 капли раствора индикатора метилового оранжевого. Проба окрасится в желтый цвет.
2. Окрашенную в желтый цвет пробу титруют стандартным раствором соляной кислоты до перехода окраски в апельсиновую.
3. Величина щелочности определяется по формулам:
Щфф — щелочность пробы по фенолфталеину, мг-экв./дм 3 ;
афф — расход кислоты на титрование с индикатором фенолфталеином, см 3
С — концентрация применяемого для титрования раствора соляной кислоты, г-экв./дм 3 (С=0,1 или 0,01);
V — объем взятой на титрование пробы, см 3 .
Щмо — щелочность пробы по метиловому оранжевому (общая щелочность), мг-экв./дм 3 ;
амо — расход кислоты на титрование с индикатором метиловым оранжевым (в случае последовательного титрования за объем кислоты, пошедший на титрования с метиловым оранжевым берется суммарный расход кислоты с начала титрования), см 3 ;
С — концентрация применяемого для титрования раствора соляной кислоты, г-экв./дм 3 (С=0,1 или 0,01);
V — объем взятой на титрование пробы, см 3 .
источник
Объемный (количественный) анализ.Объемный метод количественного анализа основан на точном измерении реагирующих веществ, концентрация одного из которых известна. Растворы с точно установленной концентрацией называются титрованными, т.к. они используются для определения концентрации исследуемых растворов, то их называют рабочими или стандартными. Процесс прибавления стандартного титрованного раствора к раствору исследуемого вещества называется титрованием. Титрование ведется до достижения точки эквивалентности, т.е. до того момента, когда количество прибавленного стандартного раствора будет эквивалентно количеству определяемого вещества согласно уравнению реакции. Необходимое условие объемного анализа – точная фиксация точки эквивалентности, поэтому используют реакции, конец которых характеризуется определенным внешним признаком (изменение окраски, выпадение осадка). Часто для фиксации точки эквивалентности употребляют специальные вещества, изменяющие цвет или другие свойства с изменением концентрации исследуемого иона. Такие вещества называются индикаторами.
Требования к реакциям, применяемым в объемном анализе:
— возможность тем или иным способом фиксировать точку эквивалентности;
— количественное течение реакции до равновесия, характеризующегося соответствующей величиной константы равновесия реакции;
— можно применять только те реакции, которые протекают с достаточной скоростью;
— при титровании не должны протекать побочные реакции, делающие точное вычисление результатов анализа невозможным.
В зависимости от типа реакции, которая протекает при титровании, выделяют методы объемного анализа:
1 Нейтрализация. В основе метода лежит реакция нейтрализации:
Этим методом определяют кислотность, щелочность, карбонатную жесткость воды.
2 Окислительно-восстановительные методы, в основе которых применяют окислительно-восстановительные реакции, в ходе которых исследуемое вещество количественно переводят в окисленную или восстановленную форму.
3 Осаждение. Объемные определения метода основаны на осаждении определенного иона в виде труднорастворимого соединения.
4 Комплексометрия. В методе исследуемый ион связывается водным реактивом в малодиссоциированный комплекс. Метод применяется при определении жесткости воды Mg 2+ , Ca 2+ , иона Fe 3+ .
Измерение объемов. Для точного измерения в объемном анализе используют бюретки, пипетки, мерные колбы.
1 Бюретки служат для титрования и представляют собой цилиндрические трубки с суженным концом, отсчет ведется сверху вниз.
2 Пипетки служат для точного отмеривания каких-либо определенных объемов исследуемого раствора.
3 Мерные колбы служат для разбавления исследуемого раствора до определенного объема.
Щелочность обусловлена присутствием в воде веществ, содержащих гидроксоанион, а также веществ, реагирующих с сильными кислотами (соляной, серной). К таким соединениям относятся:
1 сильные щелочи (KOH, NaOH) и летучие основания (например, NH3×H2O), а также анионы, обуславливающие высокую щелочность в результате гидролиза в водном растворе при рН > 8,4 (СО3 2– , S 2– , PO4 3– , SiO3 2– и др.);
2 слабые основания и анионы летучих и нелетучих слабых кислот (HCO3 – , H2PO4 – , HPO4 2– , CH3COO – , HS – , анионы гуминовых кислот и др.).
Щелочность пробы воды измеряется в моль-экв/л или моль-экв/л и определяется количеством сильной кислоты (обычно используют соляную кислоту с концентрацией 0,05 или 0,1 ммоль-экв/л), израсходованной на нейтрализацию раствора.
При нейтрализации до значений рН = 8,0 – 8,2 в качестве индикатора используют фенолфталеин. Определяемая таким образом величина называется свободной щелочностью. При нейтрализации до значений
рН = 4,2 – 4,5 в качестве индикатора используют метиловый оранжевый. Определяемая данным образом величина называется общей щелочностью. При рН = 4,5 проба воды имеет нулевую щелочность.
Соединения первой группы из приведенных выше определяются по фенолфталеину, второй – по метилоранжу.
Щелочность природных вод в силу их контакта с атмосферным воздухом и известняками обусловлена, главным образом, содержанием в них гидрокарбонатов и карбонатов, которые вносят значительный вклад в минерализацию воды. Соединения первой группы могут содержаться также в сточных и загрязненных поверхностных водах.
Экспериментальная часть
Определение свободной щелочности. В коническую колбу наливают 100 мл исследуемой воды, прибавляют 2 – 3 капли индикатора фенолфталеина и титруют раствором HCl до обесцвечивания раствора. Расчет производят по формуле:
где х – свободная щелочность воды, мг-экв/л;
СH(HCl) – молярная концентрация эквивалента раствора HCl, моль/л;
Определение общей щелочности. В ту же колбу, где проводили титрование, добавляют 2 – 3 капли индикатора метилового оранжевого и продолжают титрование до тех пор, пока окраска индикатора из желтой не перейдет в оранжевую.
Эксперимент повторяют три раза, результаты эксперимента записывают в таблицу 1. Из полученных результатов находят среднее арифметическое значение объема рабочего раствора.
Таблица 1 – Результаты титрования
| № | V (H2О), мл | V (HСl), мл | V (HCl) средн., мл |
| 100,0 |
Перед каждым титрованием заполняют бюретку раствором до нулевого деления шкалы.
Расчет производят по формуле:
где х – общая щелочность воды, мг-экв/л;
СH(HCl) – молярная концентрация эквивалента раствора HCl, моль/л;
V (H2О) – взятый объем воды, мл.
Аналогично щелочности при анализе сточных и технологических вод определяют кислотность воды.
Кислотность воды обусловлена содержанием в воде веществ, реагирующих с гидроксоанионами. К таким соединениям относятся:
1) сильные кислоты: соляная HCl, азотная HNO3, серная H2SO4;
2) слабые кислоты: уксусная CH3COOH; сернистая H2SO3; угольная H2CO3; сероводородная H2S и т.п.;
3) катионы слабых оснований: аммоний NH4 + ; катионы органических аммонийных соединений.
Кислотность пробы воды измеряется в моль-экв/л или моль-экв/л и определяется количеством сильной щелочи (обычно используют растворы КОН или NaOH с концентрацией 0,05 или 0,1 моль/л), израсходованной на нейтрализацию раствора.
Различают свободную и общую кислотность. Свободная кислотность определяется при титровании до значений рН = 4,3 – 4,5 в присутствии в качестве индикатора метилового оранжевого. В этом диапазоне оттитровываются HCl, HNO3, H2SO4, H3PO4.
Общая кислотность определяется при титровании до значений рН = 8,2 – 8,4 в присутствии фенолфталеина в качестве индикатора. В этом диапазоне оттитровываются слабые кислоты – органические, угольная, сероводородная, катионы слабых оснований.
Естественная кислотность обусловлена содержанием слабых органических кислот природного происхождения (например, гуминовых кислот). Загрязнения, придающие воде повышенную кислотность, возникают при кислотных дождях, при попадании в водоемы не прошедших нейтрализацию сточных вод промышленных предприятий и др.
Экспериментальная часть
Определение свободной кислотности. В коническую колбу наливают 100 мл исследуемой воды, прибавляют 2 – 3 капли индикатора метилового оранжевого и титруют раствором щелочи до перехода оранжевой окраски раствора в желтую.
Эксперимент повторяют три раза, результаты эксперимента записывают в таблицу 2. Из полученных результатов находят среднее арифметическое значение объема рабочего раствора.
Таблица 2 – Результаты титрования
| № | V (H2О), мл | V (NaOH), мл | V (NaOH) средн., мл |
| 100,0 |
Расчет проводят по формуле:
где х – свободная кислотность воды, мг-экв/л;
V (NaOH) – объем раствра щелочи, мл;
СH(NaOH) – молярная концентрация эквивалента раствора щелочи, моль/л;
Определение общей кислотности. В коническую колбу наливают 100мл исследуемой воды, прибавляют 2 – 3 капли индикатора фенолфталеина и титруют раствором щелочи появления малиновой окраски индикатора.
Эксперимент повторяют три раза, результаты эксперимента записывают в таблицу 3. Из полученных результатов находят среднее арифметическое значение объема рабочего раствора.
Таблица 3 – Результаты титрования
| № | V (H2О), мл | V (NaOH), мл | V (NaOH) средн., мл |
| 100,0 |
Расчет проводят по формуле:
где х – свободная кислотность воды, мг-экв/л;
V (NaOH) – объем раствора щелочи, мл;
СH(NaOHl) – молярная концентрация эквивалента раствора щелочи, моль/л;
Вопросы для самоконтроля
1 На титрование 100 мл исследуемой воды пошло 20 мл 0,1 н раствора соляной кислоты по метиловому оранжевому. Определите щелочность воды.
2 Вода содержит (мг/л): CaSO4 – 50, Ca(HCO3)2 – 100, Mg(HCO3)2 – 25. Какова величина щелочности.
3 Какова общая щелочность воды, содержащей СО3 2- – 50 мг/л, НСО3 — – 122 мг/л.
4 При определении щелочности воды было израсходовано 0,1 н кислоты на титрование 100 мл пробы с индикатором фенолфталеином 3 мл и дополнительно с индикатором метиловым оранжевым 5 мл. Рассчитайте общую и отдельные виды щелочности воды.
5 Вода имеет жесткость равную 9 мг-экв/л. Постоянная жесткость составляет 60 % от общей жесткости (соли натрия отсутствуют). Какова величина щелочности воды.
6 В 1 л воды содержится 210 мг NaHCO3 и 5,3 мг Na2CO3. Определите общую щелочность воды.
ЛАБОРАТОРНАЯ РАБОТА
Дата добавления: 2016-11-20 ; просмотров: 6215 | Нарушение авторских прав
источник
Сущность метода. В основе метода определения общей щелочности воды лежит принцип образования нейтральных солей при взаимодействии кислоты с гидратами, гидрокарбонатами и карбонатами щелочных и щелочнозечельных металлов, а также свойство различных индикаторов изменять свой цвет в зависимости от величины рН.
Учитывая эти свойства, исследуемую пробу воды подвергают титрованию раствором соляной или серной кислоты требуемой концентрации в присутствии индикаторов фенолфталеина и метилоранжа.
Применяемые реактивы:
децинормальный (0,1 н.) раствор соляной или серной кислоты;
1%-ный спиртовый раствор фенолфталеина для определения гидратной и карбонатной щелочности;
0,1%-ный раствор метилоранжа, служащий индикатором при определении карбонатной и гидрокарбонатной щелочности.
Подготовка_пробы воды. При титровании воды кислота вступает во взаимодействие как со щелочами, так и с веществами, которые могут находиться в воде во взвешенном состоянии и которые не обусловливают щелочность воды. Чтобы уменьшить расход кислоты на ненужные реакции и обеспечить правильность определения щелочности, анализируемую пробу охлаждают до 20°С, если она была горячей, и пропускают через бумажный фильтр.
Порядок анализа. К 100 мл соответственно подготовленной для титрования пробы воды добавляют 2-3 капли фенолфталеина.
При окрашивании пробу титруют раствором соляной или серной кислоты соответствующей нормальности (0,1 н. или 0,01 н.) до исчезновения окраски. Титрование проводят медленно, тщательно перемешивая пробу воды.
Количество 0,1 н. или 0,01 н. раствора соляной или серной кислоты, пошедшее на титрование с фенолфталеином, записывают с пометкой «фф». Если в процессе прибавления фенолфталеина окрашивания не наступает, значит, в воде отсутствуют гидратная и карбонатная щелочности. В этом случае титровать пробы воды раствором кислоты не нужно, так как щелочность по фенолфталеину отсутствует.
После этого в эту же пробу добавляют 2-3 капли метилоранжа и титруют 0,1 н. или 0,01 н. раствором кислоты до перехода окраски пробы из желтой в оранжевую. Количество раствора кислоты, пошедшее на титрование с метилоранжем, записывают с пометкой «МО».
Для расчета общей щелочности воды берут суммарный расход кислоты, пошедшей на титрование с фенолфталеином и метилоранжем.
Расчет результатов анализа. Расчет результатов анализа основан на том, что каждый 1 мл нормального раствора соляной или серной кислоты оттитровывают 1 мг×экв щелочности. Соответственно этому 1 мл децинорнального (0,1 н.) раствора соляной кислоты оттитровывает 0,1 мг×экв. щелочности, а 1 мл сантинормального (0,01 н.) раствора оттитровывает 0,01 мг×экв щелочности.
Следовательно, общая щелочность воды
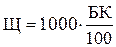
где Щ — общая щелочность воды, мг×экв/кг;
1000 — перерасчет результатов анализа на 1 л воды;
К — коэффициент нормальности раствора кислоты;
Б — суммарный расход кислоты на титрование, мл;
100 -объем пробы воды, взятой для анализа, мл.
При титровании 100 мл пробы воды децинормальным раствором кислоты (0,1 н.) формула упрощается:
При использовании саитинормального раствора кислоты (0,01 н.):
Для воды типа конденсата щелочность принято выражать в микро-грамм эквивалентах на литр (мкг×экв/кг). В этом случае
Щ =Б 0.01 × 1000 × 1000/100
СОСТАВЛЕНИЕ ОТЧЕТА
Для оформления отчета необходимо заполнить табл. 3.
Результаты расчетов
| № | Наименование параметра | По какой формуле определяется | Значение | Размерность |
| Карбонатная жесткость Некарбонатная жесткость Общая жесткость метод титрования метод комплексометрический Окисляемость Общая щелочность Сухой остаток Класс жесткости | табл.2 |
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Чем обусловлена и в каких единицах измеряется карбонатная жесткость?
2. Чем обусловлена и в каких единицах измеряется некарбонатная жесткость?
3. Что такое общая жесткость?
4. Как определить класс жесткости воды?
5. Почему карбонатная жесткость устраняется при кипячении? Напишите, какие при этом протекают реакции.
6. Как устраняют жесткость воды в промышленных условиях?
7. Как определяют карбонатную жесткость?
8. Как определяют некарбонатную жесткость?
9. Как определяют общую жесткость?
10. Что такое окисляемоеть воды и чем она обусловлена, в каких единицах измеряется?
11. Как определяют окисляемоеть воды?
12. Что такое общая щелочность воды, в каких единицах измеряется?
13. Как определяют щелочность воды?
14. Что такое сухой остаток, в каких единицах измеряется и как определяется?
источник
Настоящий документ устанавливает методику измерений свободной и общей щелочности в питьевых, поверхностных, подземных пресных и сточных водах титриметрическим методом.
Диапазон измерений от 0,005 до 10 ммоль/дм 3 (мг × экв./дм 3 ).
При титровании определению мешает интенсивная окраска пробы, мутность, свободный хлор, высокое содержание диоксида углерода.
Избавление от мешающих влияний приведено в п. 9.1.
Значения показателей точности измерений 1 — расширенной неопределенности измерений по настоящей методике при коэффициенте охвата 2 приведены в таблице 1. Бюджет неопределенности измерений приведен в Приложении А.
1 В соответствии с ГОСТ Р 8.563-2009 (п. 3.4) в качестве показателя точности измерений использованы показатели неопределенности измерений).
Таблица 1 — Диапазон измерений, показатели неопределенности измерений
Суммарная стандартная относительная неопределенность, u, %
Расширенная относительная неопределенность 2 , U при коэффициенте охвата k = 2, %
2 Соответствует характеристике погрешности при доверительной вероятности Р = 0,95.
Значения показателя точности методики используют при:
— оформлении результатов анализа, выдаваемых лабораторией;
— оценке качества проведения испытаний в лаборатории;
— оценке возможности использования настоящей методики в конкретной лаборатории.
При выполнении измерений применяют следующие средства измерений, вспомогательные устройства, реактивы и материалы.
— Весы лабораторные специального или высокого класса точности с ценой деления не более 0,1 мг, наибольшим пределом взвешивания не более 210 г по ГОСТ Р 53228-2008
— Термометр с ценой деления 0,2 °С по ГОСТ 29224-91
— Колбы мерные вместимостью 100, 250, 1000 см 3 по ГОСТ 1770-74
— Пипетки градуированные вместимостью 1, 5, 10 см 3 по ГОСТ 29227-91
— Бюретки с ценой деления 0,1 см 3 по ГОСТ 29251-91
— Цилиндры мерные или мензурки по ГОСТ 1770-74
3.2 Вспомогательные устройства
— Плитка электрическая с закрытой спиралью и регулируемой мощностью нагрева по ГОСТ 14919-83
— Шкаф сушильный лабораторный любого типа
— Стаканчики для взвешивания (бюксы) по ГОСТ 25336-82
— Воронка стеклянная диаметром (13 — 15) см по ГОСТ 25336-82
— Воронка фильтрующая с пористой пластинкой по ГОСТ 25336-82
— Трубки хлоркальциевые ТХ-П-1-17(25) по ГОСТ 25336-82
— Бутыли из полимерного материала или стекла для отбора проб.
— Устройство для продувания воздуха (или микрокомпрессор МК)
— Фильтры обеззоленные по ТУ 6-09-1678-86
1 Допускается применение иных средств измерений утвержденных типов, вспомогательных устройств и материалов, технические и метрологические характеристики которых не уступают указанным выше.
2 Средства измерений должны быть поверены в установленные сроки.
3.3 Реактивы, материалы и стандартные образцы
— ГСО общей (карбонатной) щелочности воды. Относительная погрешность аттестованного значения не более 1 % при Р = 0,95
— Кислота соляная, стандарт-титр по ТУ 6-09-2540-87
— Кислота соляная, раствор 0,1 моль/дм 3
— Натрий углекислый (карбонат) по ГОСТ 83-79
— Натрия серноватистокислый (тиосульфат), 5-водный по ГОСТ 27068-86
— Метиленовый красный водорастворимый по ТУ 6-09-4070-75
— Активированный уголь АГ-3 по ГОСТ 20464-75
— Спирт этиловый ректификованный по ГОСТ 18300-87
— Вата медицинская гигроскопическая по ГОСТ 5556-81
— Натронная известь — смесь NaOH и Са(ОН)2
1 Все реактивы, используемые для анализа, должны быть квалификации ч.д.а. или х.ч.
2 Допускается использование реактивов, изготовленных по другой нормативно-технической документации, в том числе импортных.
Определение щелочности основано на титровании пробы раствором сильной кислоты.
Под щелочностью понимают способность некоторых компонентов, содержащихся в воде, связывать эквивалентное количество сильной кислоты. Щелочность создают все катионы, которые в воде были уравновешены гидроксильными ионами, анионами слабых кислот (карбонаты, бикарбонаты и т.п.). Щелочность определяется количеством сильной кислоты, необходимым для замещения этих анионов. Расход кислоты пропорционален их общему содержанию в воде и выражает общую щелочность воды (М). В обычных природных водах величина щелочности зависит, как правило, только от содержания гидрокарбонатов щелочных металлов. В этом случае значение рН
Наличие растворимых карбонатов и гидроокисей повышает значение рН > 8,3. Та часть общей щелочности, которая соответствует количеству кислоты, необходимой для понижения рН до 8,3, называется свободной щелочностью (Р). Количество титранта, израсходованного для достижения рН = 8,3, эквивалентно свободной щелочности; количество, необходимое для достижения рН = 4,5, эквивалентно общей щелочности. Если рН
При работе в лаборатории необходимо соблюдать следующие требования техники безопасности.
5.1 При выполнении анализов необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007-76.
5.2 Электробезопасность при работе с электроустановками соблюдается по ГОСТ Р 12.1.019-2009.
5.3 Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004-91 и иметь средства пожаротушения по ГОСТ 12.4.009-83.
5.4 Организация обучения работающих безопасности труда производится по ГОСТ 12.0.004-90.
5.5 Содержание вредных веществ в воздухе не должно превышать установленных предельно допустимых концентраций в соответствии с ГОСТ 12.1.005-88.
Выполнение измерений может производить химик-аналитик, владеющий техникой титриметрического анализа и получивший удовлетворительные результаты при выполнении контроля процедуры измерений.
При выполнении измерений в лаборатории должны быть соблюдены следующие условия:
— Температура окружающего воздуха (22 ± 5) °С.
— Атмосферное давление (84 — 106) кПа.
— Относительная влажность не более 80 % при t = 25 °C .
— Частота переменного тока (50 ± 1) Гц.
— Напряжение в сети (220 ± 22) В.
При подготовке к выполнению измерений проводят следующие работы: отбор проб, приготовление растворов и реактивов, определение поправочного коэффициента для раствора соляной кислоты.
8 .1.1 Отбор проб производят в соответствии с требованиями ГОСТ Р 51593-2000 «Вода питьевая. Отбор проб», ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб», ПНД Ф 12.15.1-08 «Методические указания по отбору проб для анализа сточных вод».
8 .1.2 Посуду, предназначенную для отбора и хранения проб, промывают раствором соляной кислоты 1:1, а затем несколько раз дистиллированной водой.
8 .1.3 Пробы воды отбирают в бутыли из полимерного материала или стекла. При фильтровании через любой фильтр первые порции фильтрата отбрасывают.
Объем отбираемой пробы должен быть не менее 300 см 3 .
8 .1.4 Щелочность, особенно свободную, следует определять сразу после отбора пробы. Если это невозможно, отбирают полную бутыль и определяют щелочность не позднее, чем через 24 ч.
8 .1.5 При отборе проб составляется сопроводительный документ по утвержденной форме, в котором указывается:
— цель анализа, предполагаемые загрязнители;
— должность, фамилия отбирающего пробу, дата.
8.2 Приготовление растворов и реактивов
Дистиллированную воду кипятят 15 мин и охлаждают до комнатной температуры в колбе, закрытой пробкой, в которую вставлена хлоркальциевая трубка с натронной известью.
При приготовлении из стандарт-титра раствор готовят согласно инструкции.
При отсутствии стандарт-титра раствор готовят из концентрированной соляной кислоты. Пипеткой вместимостью 10 см 3 помещают 8,5 см 3 концентрированной соляной кислоты плотностью 1,188 г/см 3 в мерную колбу вместимостью 1 дм 3 с предварительно налитой дистиллированной водой в объеме (200 — 300) см 3 и доводят объем раствора дистиллированной водой до метки.
Срок хранения 6 месяцев в стеклянной посуде в местах, защищенных от попадания прямых солнечных лучей.
Коэффициент поправки к концентрации соляной кислоты устанавливают по ГОСТ 25794.1-83 по раствору натрия углекислого с концентрацией 0,1 н и проверяют 1 раз в месяц (п. 8.3).
Предварительно карбонат натрия прокаливают при температуре 270 — 300 °С до постоянной массы в день установки титра. Охлаждают в эксикаторе. Затем берут навеску 5,3000 г и переносят в мерную колбу вместимостью 1 дм 3 , растворяют в небольшом количестве свежепрокипяченной и охлажденной дистиллированной воды и доводят до метки такой же водой.
Для предотвращения поглощения СО2 из воздуха раствор хранят в герметично закрытой склянке. Раствор хранят не более 3 месяцев.
8 .2.4 Приготовление спиртового раствора смешанного индикатора (метиловый красный + бромкрезоловый зеленый)
1. Растворяют 0,015 г метилового красного в 50 см 3 96 % этилового спирта
2. Растворяют 0,200 г бромкрезолового зеленого в 100 см 3 96 % этилового спирта.
Смешанный индикатор хранят в склянке из темного стекла до помутнения или изменения окраски.
Растворяют 0,05 г натриевой соли метилового оранжевого в 100 см 3 горячей дистиллированной воды. Охлаждают и фильтруют через бумажный фильтр.
Хранят в склянке из темного стекла до помутнения или изменения окраски.
Растворяют 0,5 г фенолфталеина в 50 см 3 96 % этилового спирта и добавляют 50 см 3 дистиллированной воды.
Хранят в склянке из темного стекла до помутнения или изменения окраски.
Отбирают 20 см 3 раствора карбоната натрия, разбавляют до 100 см 3 свободной от СО2 дистиллированной водой и титруют раствором соляной кислоты с концентрацией 0,1 н, строго соблюдая те же условия, что и при определении общей щелочности (п. 9.3). Особенно следует соблюдать рекомендованные условия продувания воздухом. Титрование повторяют дважды и, если расхождение в объемах раствора соляной кислоты не превышает 0,02 см 3 , за результат титрования принимают среднее арифметическое.
Коэффициент поправки для раствора соляной кислоты находят по формуле:
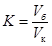
где К — коэффициент поправки раствора соляной кислоты;
V б — объём раствора карбоната натрия, взятый для титрования, см 3 ;
V к — объём раствора соляной кислоты, израсходованный на титрование, см 3 .
Если при предварительном определении было установлено, что вода имеет свободную щелочность (рН ³ 8,3, реакция по фенолфталеину), то наряду с общей щелочностью определяют также и свободную щелочность.
Окраску пробы устраняют прибавлением активированного угля и фильтрованием пробы перед анализом.
Влияние мутности устраняют фильтрованием пробы через бумажные или стеклянные фильтры.
Свободный хлор удаляют добавлением к пробе эквивалентного количества 0,1 н раствора тиосульфата натрия.
Высокие концентрации СО2 мешают правильному определению перехода окраски при титровании, поэтому для более точного определения щелочности предварительно вытесняют СО2, продувая воздух через воду.
Дистиллированную воду для приготовления растворов готовят по п. 8.2.1.
9.2 Определение свободной щелочности (Р)
В коническую колбу вместимостью 250 см 3 вносят 100 см 3 анализируемой воды. Воду с высокой щелочностью берут в меньшем количестве и доводят объем приблизительно до 100 см 3 прокипяченной и охлажденной дистиллированной водой. Добавляют 2 капли раствора фенолфталеина и титруют из бюретки на белом фоне раствором соляной кислоты с концентрацией 0,1 н до полного обесцвечивания.
Отмеряет 100 см 3 пробы или используют раствор после определения свободной щелочи, прибавляют три капли смешанного индикатора или две капли метилового оранжевого. Затем продувают воздух и одновременно титруют на белом фоне 0,1 н раствором соляной кислоты до момента, когда зеленая окраска смешанного индикатора перейдет в грязно-серую, или до начала перехода окраски метилового оранжевого из желтой в оранжевую. Воздух продолжают продувать и спустя 5 мин, в случае необходимости дотитровывают.
Для титрования сточных вод используют бюретку с ценой деления 0,1 см 3 . При анализе природных вод, имеющих низкую общую щелочность, титруют из микробюретки и отсчитывают с точность до 0,005 см 3 .
10.1 Расчет свободной (Р) и общей (М) щелочности, ммоль/дм 3 , проводят по формулам
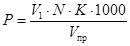
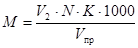
где V1 — объем раствора соляной кислоты, пошедший на титрование по фенолфталеину, см 3 ;
V 2 — объем раствора соляной кислоты, пошедший на титрование по смешанному индикатору, см 3 ;
N — концентрация раствора соляной кислоты, 0,1 ммоль/дм 3 ;
К — коэффициент поправки к концентрации раствора соляной кислоты;
V пр — объем пробы, взятый для анализа, см 3 .
10.2 За результат измерений Рср (свободной щелочности) и Мср (общей щелочности) принимают среднее арифметическое значение двух параллельных определений P 1 и Р2; M 1 и М2
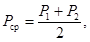
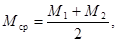
для которых выполняется следующее условие:
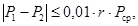
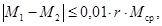
где r — предел повторяемости, значения которого приведены в таблице 2.
Таблица 2 — Значения пределов повторяемости и воспроизводимости при вероятности Р = 0,95
Предел повторяемости (относительное значение допускаемого расхождения между двумя результатами параллельных определений), r, %
Предел воспроизводимости (относительное значение допускаемого расхождения между двумя результатами измерений, полученными в разных лабораториях), R, %
источник
ИССЛЕДОВАНИЯ КАЧЕСТВА ИСХОДНОЙ (СЫРОЙ) КОТЛОВОЙ ВОДЫ ПАРОВОЙ КОТЕЛЬНОЙ И СЕТЕВОЙ ВОДЫ ВОДОГРЕЙНОЙ КОТЕЛЬНОЙ И ТЕПЛОВЫХ СЕТЕЙ
Цель работы: Практическое освоение методики аналитического контроля общей щелочности воды и отдельных форм щелочности; приобретение навыков анализа воды, используемой в теплоэнергетических установках.
Щелочность воды, реактивы, применяемые при ее определении
Щелочность воды – это общее содержание в воде веществ, обуславливающих при диссоциации или в результате гидролиза повышенную концентрацию ионов ОН —.
В исходной воде щелочность обычно связана с присутствием ионов 


Большая щелочность воды определяется количеством соляной кислоты, затраченной на титрование анализируемой пробы воды (100 мл пробы) в присутствии индикатора фенолфталеина (I этап) и метилоранжа (II этап) 0,1 н. Количество кислоты (мл), израсходованной при титровании, равно щелочности испытуемой воды при рН = 3. 4 .
Малая щелочность воды определяется путем титрования 100 мл пробы в присутствии фенолфталеина (I этап) и метилрота или смешанного индикатора (II этап) 0,01 н. раствором серной или соляной кислоты. Величина щелочности при этом определяется по формуле:

где п – количество израсходованного 0,01 н. раствора кислоты, мл.
Анализы по определению отдельных форм щелочности основаны на том, что при титровании пробы воды сильной кислотой, реакции, протекающие между кислотой и различными анионами, обусловливающими форму щелочности, заканчиваются при различных значениях рН раствора. Титрование проводится в присутствии двух индикаторов, каждый из которых рассчитан на определенный диапазон значений рН. Одним индикатором является метилоранж, окраска которого изменяется на желтую в кислой среде при рН=3. 4, вторым — фенолфталеин, окраска которого изменяется на розовую в щелочной среде при рН > 8,4. Следует особо отметить, что значение рН=8,4 имеют растворы чистых гидрокарбонатов (НСО3), постоянно присутствующих в водах. При анализе пробы воды на первом этапе используется фенолфталеин, а на втором — метилоранж.
Оценка отдельных форм щелочности производится в соответствии с полученными при титровании данными. При этом возможны следующие случаи:
1) фенолфталеин не дает розового окрашивания, т.е. Ф = 0, где Ф — расход соляной кислоты, пошедшей на титрование пробы, окрашенной фенолфталеином, мл. Метилоранж дает желтое окрашивание пробы, которая затем титруется соляной кислотой до изменения окраски. В этом случае в воде присутствуют только бикарбонаты (бикарбонатная щелочность) Щб, которая подсчитывается по формуле (1), где А = М, а М — расход кислоты на титрование пробы воды, окрашенной метилоранжем, мг-экв/л;
2) фенолфталеин дает розовое окрашивание, причем при титровании пробы оказалось, что 2Ф М. В этом случае в воде присутствуют карбонаты и гидраты. Для расчета Щк в формулу (1) следует подставить А=2(М-Ф), а для расчета Щг — А = (2Ф — М);
5) фенолфталеин дает розовое окрашивание, причем М = 0 (т.е. после обесцвечивания фенолфталеина дальнейшее увеличение объема метилоранжа сразу вызывает оранжевую окраску пробы воды). В этом случае присутствуют только гидраты; для расчета Щг в формулу (1) следует подставить А = Ф. При Кн = 0,1 мг-экв/л и V = 100 мл для определения формы и численного значения щелочности удобно пользоваться таблицей.
Оценка точности значений щелочности, вычисленных по формуле (1), производится в случае однократного измерения с учетом погрешностей измерения объемов анализируемой пробы Av, мл, и кислоты АА, мл, пошедшей на титрование, мг-экв/л
Сухой остаток – это суммарное количество нелетучих веществ в воде, выраженное в мг/кг. Он получается путем осторожного выпаривания профильтрованной пробы с последующим высушиванием при температуре 110-120°С. Количество этих веществ, определенное взвешиванием и пересчитанное на 1 кг воды, составляет сухой остаток.
При оперативном обслуживании теплового оборудования, ХВО, тепловых сетей метод определения солесодержания воды путем выделения каждый раз сухого остатка не применяется из-за большого количества времени, затрачиваемого на него. Так как практически в каждой воде находятся ионы 

где K – коэффициент пропорциональности, Cl – концентрация хлоридов, мг/кг.
3. Концентрация хлоридов, реактивы, применяемые для ее определения.
Для определения концентрации хлоридов проба титруется раствором азотнокислой окисной ртути 
Расчет концентрации хлоридов ведется по формуле

где a – расход раствора азотнокислой окисной ртути, мг; Т – титр раствора азотнокислой ртути по хлор-иону, мг/л; V – объем пробы воды на анализ, мл.
Относительная щелочность котловой воды паровых котлов.
Для правильного ведения режимов непрерывной и периодической продувок паровых котлов очень важно оптимальное соотношение щелочности и солесодержания котловой воды. Правилами Госгортехнадзора относительная щелочность нормируется:

где 40 – эквивалент NaOH, мг/кг*экв;
Щ – общая щелочность котловой воды, мг*экв/кг; S — сухой остаток, мг/кг.
Величина относительной щелочности более 50% вызывает межкристаллитную коррозию металла барабана котла.
5. Описание лабораторной установки
Установка состоит (рис. 2) из колбы-1, бюретки-3 со сливным устройством-2, емкости-4 с 0,1 н раствором HCI, мерной колбы-5 и пипеток с индикаторами (на рис. 2 не показаны).
Порядок выполнения лабораторной работы
Ознакомиться с лабораторной установкой, назначением и порядком включения двухходового крана-6, конструкцией и порядком работы со сливным устройством-2 бюретки-3. Записать технические и метрологические характеристики средств измерений, используемых в работе.
Определить общую щелочность анализируемой пробы воды; для этого:
а) мерной колбой — 5 отмерить 100 мл воды и перелить ее в колбу-1, добавить туда же 2-3 капли фенолфталеина до появления розовой окраски (при отсутствии реакции на фенолфталеин выполнить п.»б» и переходить сразу к п.»г»);
б) открыть двухходовой кран-6 и заполнять бюретку-3 до тех пор, пока середина мениска кислоты в бюретке не совпадет с любой оцифрованной отметкой в диапазоне 15. 20 мл; перекрыть кран, записать значение начального объема Ан в таблицу по форме 1; в эту же таблицу занести результаты последующих опытов и расчетов;
в) поставить колбу-1 под сливное устройство бюретки-3, сжимая пальцами шарик сливного устройства-2, титровать пробу соляной кислотой до обесцвечивания пробы; прекратить титрование, занести в таблицу значение объема кислоты, затраченной на титрование Аф;
г) добавить в анализируемую пробу воды 2-3 капли метилоранжа. Если проба воды окрасилась в оранжевый цвет, эксперимент считается законченным, следует занести в таблицу значение объема кислоты затраченной на титрование Ам=0, и перейти к расчетам, как это указано в п.»д»; при появлении желтой окраски следует титровать пробу, как это указано в п.»в», до появления оранжевой окраски; прекратить титрование, занести в таблицу значение объема кислоты, затраченной на титрование Ам!
д) вычислить расход кислоты Ф, затраченной на титрование пробы воды, окрашенной фенолфталеином; расход кислоты М, затраченной на титрование пробы воды, окрашеннойметилоранжем; суммарный расход кислоты А; общую щелочность Що;
е) повторить еще два раза опыты и расчеты, как это указано в пп. «а. д», вычислить среднеарифметическое значение щелочности Що, доверительные границы и записать окончательный результат;
4. Определить отдельные формы щелочности и вычислить, пользуясь таблицей по форме 1, их численные значения.
1. Краткое описание лабораторной установки, технические и метрологические характеристики средств измерений, краткие пояснения проводимых опытов.
2. Результаты опытов и расчетов, таблицы.
3. Выводы по работе и анализ результатов (см. «Общие указания»).
1. Белан Ф.И, Водоподготовка. М.: Госэнергоиздат 1958.
2. Фрог Б.Н., Левченко А.П. Водоподготовка: Учебное пособие для вузов.
М. Издательство МГУ, 1996 г. 680 с; 178 ил.
3. Руководящие указания по водоподготовке и водно–химическому режиму тепловых сетей. / СЦНТИ Энергоатомиздат. М., 1973. С. 3 — 50
источник
Когда заходит речь о качестве питьевой воды, мы, прежде всего, обращаем внимание на отсутствие вредных примесей, цвет, запах и т.п. А вот о важности такого показателя как щёлочность воды знают далеко не все. В этой статье мы попробуем разобраться, почему норма щёлочности воды так важна для нашего с вами здоровья, как она определяется и как достичь оптимальных показателей щёлочности воды.
Для начала попробуем разобраться, что же собственно такое «щёлочность воды». Справочная литература предлагает такое определение щёлочности: это общее число содержащихся в воде гидроксильных ионов, а также анионов слабых кислот. Щёлочность воды может быть гидратная, карбонатная, бикарбонатная, в зависимости от наличия в ней определённых веществ. Также следует разграничить понятие «щёлочность воды» и её водородный показатель (pH). Он показывает концентрацию в воде свободных ионов водорода. Если pH низкий ( 7) – о щелочной. Взаимосвязь pH и щёлочности прямопропорциональна: чем больше щёлочность воды, тем выше показатель pH. Щёлочность измеряется в ммоль/дм3, а рН – просто число единиц.
Согласно Государственным санитарным нормам, оптимальный показатель pH для питьевой воды от 6,5 до 8,5 единиц. Это совпадает с требованиями, применяющимися для контроля качества питьевой воды в США. Нормативы ЕС в этом вопросе отличаются несущественно (от 6,5 до 9,5). Показатель дистиллированной воды – 7 единиц. Это условно нейтральная вода. Показатели pH питьевой воды строго контролируются во всех странах.
А вот нормы щёлочности воды украинскими Государственными санитарными нормами не регулируются. Хотя и учитываются на предприятиях водоснабжения для правильного расчета реагентов, которые используют для обработки воды.
Относительно расчёта щёлочности воды стоит отметить, что оптимальные нормы немного отличаются в зависимости от того, для каких нужд используется вода.
Давайте попробуем разобраться, почему такое большое значение придаётся нормам щёлочности воды? Оказывается, от щёлочности воды напрямую зависит состояние нашего организма. Оптимальная норма щёлочности воды поможет наладить такие функции организма:
- обменные процессы
- восстановление микрофлоры кишечника
- активизация мозговой деятельности за счёт обогащения мозга кислородом
- укрепление иммунитета
Это неудивительно, поскольку в самом организме человека преобладают нейтральные или слабощелочные жидкости. Интересно, что pH человеческой крови составляет 7,43 (т.е. практически нейтрален).
Поэтому очень важным является определение щёлочности питьевой воды и контроль этих показателей.
Японские учёные установили, что если человек постоянно употребляет воду щёлочностью 6,5 – 7, то продолжительность жизни увеличивается на 20 – 30%. Дело в том, что кислая среда (низкая щёлочность воды) создаёт идеальные условия для развития различных болезней.
Для поддержания нормального кислотно-щелочного баланса и хорошего самочувствия важно «не закислять» организм. Но проблема в том, что большинство продуктов имеют кислую среду. А значит, для поддержания баланса важно пить воду, именно она способствует тому, что кровь может переносить больше кислорода. Но полезна не всякая вода. В первую очередь нужно обращать внимание на её щёлочность. Лучше, если она близка к нейтральной. Государственные санитарные нормы регламентируют щёлочность питьевой бутилированной воды и воды из бюветов на уровне 6,5 ммоль/дм3. Норма щёлочности воды, поступающей в централизованные водопроводные системы, регулируется ещё на этапе водоподготовки. Повышенная кислотность может наблюдаться в сильно загрязнённых природных водах (например, после сброса отходов промышленных предприятий, когда в воду попадает большое количество сильных кислот и их солей).
Кстати, вода повышенной щёлочности также не слишком полезна. Так, после водных процедур в такой воде может появляться:
- зуд на коже
- высыпания
- раздражения на слизистых
В разных регионах уровень pH водопроводной воды колеблется от 5,5 до 10 единиц. При необходимости этот показатель можно и нужно регулировать. Для измерения рН в домашних условиях можно использовать специальные тестеры. А вот для определения щёлочности воды понадобиться сдать образцы на анализ в специализированную лабораторию. После того, как вы получите результаты исследования, специалисты «УкрХимАнализ» дадут необходимые рекомендации. Если вода имеет повышенную щёлочность, то эффективным способом её снижения может стать фильтр. Хорошо справляются с данной проблемой, в частности, системы обратного осмоса. Они помогают не только снизить щёлочность воды, но и нормализовать её состав в целом, уменьшить минерализацию и жёсткость.
источник
ПНД Ф 14.1:2:3:4.245-2007
Количественный химический анализ вод. Методика измерений свободной и общей щелочности в питьевых, поверхностных, подземных пресных и сточных водах титриметрическим методом
Купить ПНД Ф 14.1:2:3:4.245-2007 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО «ЦНТИ Нормоконтроль».
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Документ устанавливает методику измерений свободной и общей щелочности в питьевых, поверхностных, подземных пресных и сточных водах титриметрическим методом.
2 Приписанные характеристики показателей точности измерений
3 Средства измерений, вспомогательное оборудование, реактивы и материалы
3.2 Вспомогательные устройства
3.3 Реактивы, материалы и стандартные образцы
5 Требования безопасности, охраны окружающей среды
6 Требования к квалификации операторов
7 Требования к условиям измерений
8 Подготовка к выполнению измерений
8.2 Приготовление растворов и реактивов
8.3 Определение поправочного коэффициента для раствора соляной кислоты
9.1 Устранение мешающих влияний
9.2 Определение свободной щелочности (Р)
9.3 Определение общей щелочности (М)
10 Обработка результатов измерений
11 Оформление результатов измерений
12 Контроль точности результатов измерений
12.2 Оперативный контроль процедуры измерений с использованием метода добавок
12.3 Оперативный контроль процедуры измерений с использованием образцов для контроля
Приложение А (информационное). Таблица А.1 — Бюджет неопределенности измерений
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:
ФЕДЕРАЛЬНАЯ СЛУЖБА ПО НАДЗОРУ
В СФЕРЕ ПРИРОДОПОЛЬЗОВАНИЯ
Директор ФБУ «Федеральный центр
анализа и оценки техногенного
КОЛИЧЕСТВЕННЫЙ ХИМИЧЕСКИЙ АНАЛИЗ ВОД
МЕТОДИКА ИЗМЕРЕНИЙ
СВОБОДНОЙ И ОБЩЕЙ ЩЕЛОЧНОСТИ
В ПИТЬЕВЫХ, ПОВЕРХНОСТНЫХ, ПОДЗЕМНЫХ
ПРЕСНЫХ И СТОЧНЫХ ВОДАХ
ТИТРИМЕТРИЧЕСКИМ МЕТОДОМ
ПНД Ф 14.1:2:3:4.245-2007
(ФР.1.31.2008.05185)
Методика допущена для целей государственного
экологического контроля
Методика рассмотрена и одобрена федеральным бюджетным учреждением «Федеральный центр анализа и оценки техногенного воздействия (ФБУ «ФЦАО»).
Настоящий документ устанавливает методику измерений свободной и общей щелочности в питьевых, поверхностных, подземных пресных и сточных водах титриметрическим методом.
Диапазон измерений от 0,005 до 10 ммоль/дм 3 (мг×экв./дм 3 ).
При титровании определению мешает интенсивная окраска пробы, мутность, свободный хлор, высокое содержание диоксида углерода.
Избавление от мешающих влияний приведено в п. 9.1.
Значения показателей точности измерений 1 — расширенной неопределенности измерений по настоящей методике при коэффициенте охвата 2 приведены в таблице 1. Бюджет неопределенности измерений приведен в Приложении А.
1 В соответствии с ГОСТ Р 8.563-2009 (п. 3.4) в качестве показателя точности измерений использованы показатели неопределенности измерений).
Таблица 1 — Диапазон измерений, показатели неопределенности измерений
Диапазон измерений, ммоль/дм 3
Суммарная стандартная относительная неопределенность, u, %
Расширенная относительная неопределенность 2 , U при коэффициенте охвата k = 2, %
2 Соответствует характеристике погрешности при доверительной вероятности Р = 0,95.
Значения показателя точности методики используют при:
— оформлении результатов анализа, выдаваемых лабораторией;
— оценке качества проведения испытаний в лаборатории;
— оценке возможности использования настоящей методики в конкретной лаборатории.
При выполнении измерений применяют следующие средства измерений, вспомогательные устройства, реактивы и материалы.
— Весы лабораторные специального или высокого класса точности с ценой деления не более 0,1 мг, наибольшим пределом взвешивания не более 210 г по ГОСТ Р 53228-2008
— Термометр с ценой деления 0,2 °С по ГОСТ 29224-91
— Колбы мерные вместимостью 100, 250, 1000 см 3 по ГОСТ 1770-74
— Пипетки градуированные вместимостью 1, 5, 10 см 3 по ГОСТ 29227-91
— Бюретки с ценой деления 0,1 см 3 по ГОСТ 29251-91
— Цилиндры мерные или мензурки по ГОСТ 1770-74
3.2 Вспомогательные устройства
— Плитка электрическая с закрытой спиралью и регулируемой мощностью нагрева по ГОСТ 14919-83
— Шкаф сушильный лабораторный любого типа
— Стаканчики для взвешивания (бюксы) по ГОСТ 25336-82
— Воронка стеклянная диаметром (13 — 15) см по ГОСТ 25336-82
— Воронка фильтрующая с пористой пластинкой по ГОСТ 25336-82
— Трубки хлоркальциевые ТХ-П-1-17(25) по ГОСТ 25336-82
— Бутыли из полимерного материала или стекла для отбора проб.
— Устройство для продувания воздуха (или микрокомпрессор МК)
— Фильтры обеззоленные по ТУ 6-09-1678-86
1 Допускается применение иных средств измерений утвержденных типов, вспомогательных устройств и материалов, технические и метрологические характеристики которых не уступают указанным выше.
2 Средства измерений должны быть поверены в установленные сроки.
3.3 Реактивы, материалы и стандартные образцы
— ГСО общей (карбонатной) щелочности воды. Относительная погрешность аттестованного значения не более 1 % при Р = 0,95
— Кислота соляная, стандарт-титр по ТУ 6-09-2540-87
— Кислота соляная, раствор 0,1 моль/дм 3
— Натрий углекислый (карбонат) по ГОСТ 83-79
— Натрия серноватистокислый (тиосульфат), 5-водный по ГОСТ 27068-86
— Метиленовый красный водорастворимый по ТУ 6-09-4070-75
— Активированный уголь АГ-3 по ГОСТ 20464-75
— Спирт этиловый ректификованный по ГОСТ 18300-87
— Вата медицинская гигроскопическая по ГОСТ 5556-81
— Натронная известь — смесь NaOH и Са(ОН)2
1 Все реактивы, используемые для анализа, должны быть квалификации ч.д.а. или х.ч.
2 Допускается использование реактивов, изготовленных по другой нормативно-технической документации, в том числе импортных.
Определение щелочности основано на титровании пробы раствором сильной кислоты.
Под щелочностью понимают способность некоторых компонентов, содержащихся в воде, связывать эквивалентное количество сильной кислоты. Щелочность создают все катионы, которые в воде были уравновешены гидроксильными ионами, анионами слабых кислот (карбонаты, бикарбонаты и т.п.). Щелочность определяется количеством сильной кислоты, необходимым для замещения этих анионов. Расход кислоты пропорционален их общему содержанию в воде и выражает общую щелочность воды (М). В обычных природных водах величина щелочности зависит, как правило, только от содержания гидрокарбонатов щелочных металлов. В этом случае значение рН 8,3. Та часть общей щелочности, которая соответствует количеству кислоты, необходимой для понижения рН до 8,3, называется свободной щелочностью (Р). Количество титранта, израсходованного для достижения рН = 8,3, эквивалентно свободной щелочности; количество, необходимое для достижения рН = 4,5, эквивалентно общей щелочности. Если рН 3 .
8.1.4 Щелочность, особенно свободную, следует определять сразу после отбора пробы. Если это невозможно, отбирают полную бутыль и определяют щелочность не позднее, чем через 24 ч.
8.1.5 При отборе проб составляется сопроводительный документ по утвержденной форме, в котором указывается:
— цель анализа, предполагаемые загрязнители;
— должность, фамилия отбирающего пробу, дата.
8.2 Приготовление растворов и реактивов
Дистиллированную воду кипятят 15 мин и охлаждают до комнатной температуры в колбе, закрытой пробкой, в которую вставлена хлоркальциевая трубка с натронной известью.
При приготовлении из стандарт-титра раствор готовят согласно инструкции.
При отсутствии стандарт-титра раствор готовят из концентрированной соляной кислоты. Пипеткой вместимостью 10 см 3 помещают 8,5 см 3 концентрированной соляной кислоты плотностью 1,188 г/см 3 в мерную колбу вместимостью 1 дм 3 с предварительно налитой дистиллированной водой в объеме (200 — 300) см 3 и доводят объем раствора дистиллированной водой до метки.
Срок хранения 6 месяцев в стеклянной посуде в местах, защищенных от попадания прямых солнечных лучей.
Коэффициент поправки к концентрации соляной кислоты устанавливают по ГОСТ 25794.1-83 по раствору натрия углекислого с концентрацией 0,1 н и проверяют 1 раз в месяц (п. 8.3).
Предварительно карбонат натрия прокаливают при температуре 270 — 300 °С до постоянной массы в день установки титра. Охлаждают в эксикаторе. Затем берут навеску 5,3000 г и переносят в мерную колбу вместимостью 1 дм 3 , растворяют в небольшом количестве свежепрокипяченной и охлажденной дистиллированной воды и доводят до метки такой же водой.
Для предотвращения поглощения СО2 из воздуха раствор хранят в герметично закрытой склянке. Раствор хранят не более 3 месяцев.
8.2.4 Приготовление спиртового раствора смешанного индикатора (метиловый красный + бромкрезоловый зеленый)
1. Растворяют 0,015 г метилового красного в 50 см 3 96 % этилового спирта
2. Растворяют 0,200 г бромкрезолового зеленого в 100 см 3 96 % этилового спирта.
Смешанный индикатор хранят в склянке из темного стекла до помутнения или изменения окраски.
Растворяют 0,05 г натриевой соли метилового оранжевого в 100 см 3 горячей дистиллированной воды. Охлаждают и фильтруют через бумажный фильтр.
Хранят в склянке из темного стекла до помутнения или изменения окраски.
Растворяют 0,5 г фенолфталеина в 50 см 3 96 % этилового спирта и добавляют 50 см 3 дистиллированной воды.
Хранят в склянке из темного стекла до помутнения или изменения окраски.
8.3 Определение поправочного коэффициента для раствора соляной кислоты
Отбирают 20 см 3 раствора карбоната натрия, разбавляют до 100 см 3 свободной от СО2 дистиллированной водой и титруют раствором соляной кислоты с концентрацией 0,1 н, строго соблюдая те же условия, что и при определении общей щелочности (п. 9.3). Особенно следует соблюдать рекомендованные условия продувания воздухом. Титрование повторяют дважды и, если расхождение в объемах раствора соляной кислоты не превышает 0,02 см 3 , за результат титрования принимают среднее арифметическое.
Коэффициент поправки для раствора соляной кислоты находят по формуле:
где К — коэффициент поправки раствора соляной кислоты;
Vб — объём раствора карбоната натрия, взятый для титрования, см 3 ;
Vк — объём раствора соляной кислоты, израсходованный на титрование, см 3 .
Если при предварительном определении было установлено, что вода имеет свободную щелочность (рН ³ 8,3, реакция по фенолфталеину), то наряду с общей щелочностью определяют также и свободную щелочность.
9.1 Устранение мешающих влияний
Окраску пробы устраняют прибавлением активированного угля и фильтрованием пробы перед анализом.
Влияние мутности устраняют фильтрованием пробы через бумажные или стеклянные фильтры.
Свободный хлор удаляют добавлением к пробе эквивалентного количества 0,1 н раствора тиосульфата натрия.
Высокие концентрации СО2 мешают правильному определению перехода окраски при титровании, поэтому для более точного определения щелочности предварительно вытесняют СО2, продувая воздух через воду.
Дистиллированную воду для приготовления растворов готовят по п. 8.2.1.
9.2 Определение свободной щелочности (Р)
В коническую колбу вместимостью 250 см 3 вносят 100 см 3 анализируемой воды. Воду с высокой щелочностью берут в меньшем количестве и доводят объем приблизительно до 100 см 3 прокипяченной и охлажденной дистиллированной водой. Добавляют 2 капли раствора фенолфталеина и титруют из бюретки на белом фоне раствором соляной кислоты с концентрацией 0,1 н до полного обесцвечивания.
9.3 Определение общей щелочности (М)
Отмеряет 100 см 3 пробы или используют раствор после определения свободной щелочи, прибавляют три капли смешанного индикатора или две капли метилового оранжевого. Затем продувают воздух и одновременно титруют на белом фоне 0,1 н раствором соляной кислоты до момента, когда зеленая окраска смешанного индикатора перейдет в грязно-серую, или до начала перехода окраски метилового оранжевого из желтой в оранжевую. Воздух продолжают продувать и спустя 5 мин, в случае необходимости дотитровывают.
Для титрования сточных вод используют бюретку с ценой деления 0,1 см 3 . При анализе природных вод, имеющих низкую общую щелочность, титруют из микробюретки и отсчитывают с точность до 0,005 см 3 .
10.1 Расчет свободной (Р) и общей (М) щелочности, ммоль/дм 3 , проводят по формулам
где V1 — объем раствора соляной кислоты, пошедший на титрование по фенолфталеину, см 3 ;
V2 — объем раствора соляной кислоты, пошедший на титрование по смешанному индикатору, см 3 ;
N — концентрация раствора соляной кислоты, 0,1 ммоль/дм 3 ;
К — коэффициент поправки к концентрации раствора соляной кислоты;
Vпр — объем пробы, взятый для анализа, см 3 .
10.2 За результат измерений Рср (свободной щелочности) и Мср (общей щелочности) принимают среднее арифметическое значение двух параллельных определений P1 и Р2; M1 и М2
для которых выполняется следующее условие:
где r — предел повторяемости, значения которого приведены в таблице 2.
Таблица 2 — Значения пределов повторяемости и воспроизводимости при вероятности Р = 0,95
Диапазон измерений, ммоль/дм 3
Предел повторяемости (относительное значение допускаемого расхождения между двумя результатами параллельных определений), r, %
Предел воспроизводимости (относительное значение допускаемого расхождения между двумя результатами измерений, полученными в разных лабораториях), R, %
источник