Содержан ие ио нов аммония в природных водах варьирует в интервале от 10 до 200 мкг/дм 3 в пересчете на азот. Присутствие в незагрязненных поверхностных водах ионов аммония связано главным образом с процессами биохимической деградации белковых веществ, дезаминирования аминокислот, разложения мочевины под действием уреазы . Основными источниками поступлен ия ио нов аммония в водные объекты являются животноводческие фермы, хозяйственно-бытовые сточные воды, поверхностный сток с сельхозугодий в случае использования аммонийных удобрений, а также сточные воды предприятий пищевой, коксохимической, лесохимической и химической промышленности.
В стоках промышленных предприятий содержится до 1 мг/дм 3 аммония, в бытовых стоках – 2-7 мг/дм 3 ; с хозяйственно-бытовыми сточными водами в канализационные системы ежесуточно поступает до 10 г аммонийного азота (на одного жителя).
При переходе от олиготрофных к мез о- и эвтрофным водоемам возрастают как абсолютная концентрация ионов аммония, так и их доля в общем балансе связанного азота.
Концентрация аммония в питьевой воде не должна превышать
2 мг/дм 3 по азоту. ПДКвр солевого аммония составляет 0,5 мг/дм 3 по азоту (лимитирующий показатель вредности – токсикологический).
Присутствие аммония в концентрациях порядка 1 мг/дм 3 снижает способность гемоглобина рыб связывать кислород. Признаки интоксикации – возбуждение, судороги, рыба мечется по воде и выпрыгивает на поверхность. Механизм токсического действия – возбуждение центральной нервной системы, поражение жаберного эпителия, гемолиз (разрыв) эритроцитов. Токсичность аммония возрастает с повышением pH среды. Содержание аммония в водоемах с различной степенью загрязненности приведено в таблице ниже.
Таблица. Содержание аммония в водоемах с различной степенью загрязненности
Степень загрязнения (классы водоемов)
Повышенная концентрац ия ио нов аммония может быть использована в качестве индикаторного показателя, отражающего ухудшение санитарного состояния водного объекта, процесса загрязнения поверхностных и подземных вод, в первую очередь, бытовыми и сельскохозяйственными стоками.
Соединения аммония содержат атом азота в минимальной степени окисления «-3». Катионы аммония являются продуктом микробиологичес кого разложения белков животного и растительного происхожде ния. Образовавшийся таким образом аммоний вновь вовлекается в процесс синтеза белков, участвуя тем самым в биологическом круговороте веществ (цикле азота). По этой причине аммоний и его соединения в небольших концентрациях обычно присутству ют в природных водах.
Существуют два основных источника загрязнения окружающей среды аммонийными соединениями. Аммонийные соедине ния в больших количествах входят в состав минеральных и орга нических удобрений, избыточное и неправильное применение которых приводит к загрязнению водоемов. Кроме того, аммонийные соединения в значительных количествах присутствуют в нечистотах (фекалиях). Не утилизированные дол жным образом нечистоты могут проникать в грунтовые воды или смываться поверхностными стоками в водоемы. Стоки с пастбищ и мест скопления скота, сточные воды от животноводческих ком плексов, а также бытовые и хозяйственно-фекальные стоки все гда содержат большие количества аммонийных соединений. Опас ное загрязнение грунтовых вод хозяйственно-фекальными и бытовыми сточными водами происходит при разгерметизации си стемы канализации. По этим причинам повышенное содержание аммонийного азота в поверхностных водах обычно является при знаком хозяйственно-фекальных загрязнений.
ПДК аммиака и ионов аммония в воде водоемов составля ет 2,6 мг/л (или 2,0 мг/л по аммонийному азоту). Лимитирующий показатель вредности – общесанитарный .
источник
ПНД Ф 14.1:2:4.276-2013
Количественный химический анализ вод. Методика измерений массовой концентрации аммиака и аммоний-ионов в питьевых. природных и сточных водах фотометрическим методом с реактивом Несслера
Купить ПНД Ф 14.1:2:4.276-2013 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО «ЦНТИ Нормоконтроль».
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Нормативный документ устанавливает методику количественного химического анализа различных типов вод с целью определения суммарного содержания аммиака и аммоний-ионов фотометрическим методом с реактивом Несслера. Методика распространяется на следующие объекты анализа: воды питьевых, в том числе расфасованные в емкости; воды природные пресные подземных источников водоснабжения; воды сточные производственные, хозяйственно-бытовые, ливневые и очищенные. Методика может быть использована для анализа талых, технических вод и проб снежного покрова. Методику не рекомендуется использовать для анализа проб воды поверхностных водоемов, т.к. природные гуминовые вещества мешают определению аммония. Процедура осаждения гуминовых веществ в щелочной среде не позволяет устранить мешающее влияние полностью, что приводит к завышению результатов определения аммония в диапазоне массовых концентраций от 0,1 до 1 мг/дм3. Для анализа природных вод поверхностных водоемов рекомендуется использовать другой метод анализа. Диапазон измерений массовых концентраций аммония составляет от 0,1 до 100 мг/дм3.
1. Общие положения и область применения
3. Приписанные характеристики показателей точности измерений
5. Средства измерений, вспомогательные устройства, материалы, реактивы
5.1 Средства измерений, вспомогательное оборудование, лабораторная посуда
6. Условия безопасного проведения работ
7. Требования к квалификации операторов
8. Условия выполнения измерений
10. Подготовка к выполнению измерений
10.2 Приготовление растворов
10.3 Установление градуировочной характеристики
10.4 Контроль стабильности градуировочной характеристики
12. Обработка результатов измерений
13. Оформление результатов измерений
14. Оценка приемлемости результатов измерений
15. Контроль точности результатов измерений
Приложение 1. Блок-схема проведения анализа
Приложение 2 (рекомендуемое). Приготовление реактива Несслера из набора реактивов
Приложение 3 (рекомендуемое). Устранение мешающих влияний органических веществ перегонкой из щелочного раствора
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:
ФЕДЕРАЛЬНАЯ СЛУЖБА ПО НАДЗОРУ
В СФЕРЕ ПРИРОДОПОЛЬЗОВАНИЯ
И. о. директора ФБУ «Федеральный
центр анализа и оценки техногенного
КОЛИЧЕСТВЕННЫЙ ХИМИЧЕСКИЙ АНАЛИЗ ВОД
МЕТОДИКА ИЗМЕРЕНИЙ
МАССОВОЙ КОНЦЕНТРАЦИИ АММИАКА И АММОНИЙ-ИОНОВ
В ПИТЬЕВЫХ, ПРИРОДНЫХ И СТОЧНЫХ ВОДАХ
ФОТОМЕТРИЧЕСКИМ МЕТОДОМ
С РЕАКТИВОМ НЕССЛЕРА
Методика допущена для целей государственного
экологического контроля
Методика рассмотрена и одобрена федеральным бюджетным учреждением «Федеральный центр анализа и оценки техногенного воздействия» (ФБУ «ФЦАО»).
Настоящее издание методики действует до выхода нового издания.
Аналитический центр ЗАО «РОСА»
Адрес: 119297, г. Москва, ул. Родниковая, д. 7
Электронный адрес: quality@rossalab.ru
Адрес сайта: www.rossalab.ru
Настоящий нормативный документ устанавливает методику количественного химического анализа различных типов вод с целью определения суммарного содержания аммиака и аммоний-ионов (далее — аммония) фотометрическим методом с реактивом Несслера. Методика распространяется на следующие объекты анализа: воды питьевые, в том числе расфасованные в емкости; воды природные пресные подземных источников водоснабжения; воды сточные производственные, хозяйственно-бытовые, ливневые и очищенные. Методика может быть использована для анализа талых, технических вод и проб снежного покрова.
Методику не рекомендуется использовать для анализа проб воды поверхностных водоемов, т.к. природные гуминовые вещества мешают определению аммония. Процедура осаждения гуминовых веществ в щелочной среде не позволяет устранить мешающее влияние полностью, что приводит к завышению результатов определения аммония в диапазоне массовых концентраций от 0,1 до 1 мг/дм 3 . Для анализа природных вод поверхностных водоемов рекомендуется использовать другой метод анализа.
Диапазон измерений массовых концентраций аммония составляет от 0,1 до 100 мг/дм 3 .
Примечание — Если массовая концентрация аммония в пробе превышает верхнюю границу указанного диапазона, то допускается разбавление пробы таким образом, чтобы массовая концентрация аммония в разбавленной пробе соответствовала диапазону.
При массовой концентрации аммония в анализируемой пробе свыше 3,0 мг/дм 3 анализ выполняют с разбавлением пробы.
Мешающее влияние мутности и цветности проб устраняют путем проведения процедуры осаждения раствором сульфата меди в щелочной среде.
Мешающее влияние фенолов, сероводорода и сульфидов и некоторых органических веществ, например, аминов, ацетона, альдегидов и спиртов, устраняется путем отгонки аммиака из щелочного раствора.
Мешающее влияние солей кальция и магния устраняют добавлением раствора калия-натрия виннокислого.
При взаимодействии активного остаточного хлора с аммоний-ионами образуются хлорамины, которые мешают определению аммония. Мешающее влияние активного хлора устраняют добавлением эквивалентного количества раствора серноватистокислого натрия.
При невозможности устранения мешающих влияний с помощью процедур пробоподготовки, предусмотренных настоящим нормативным документом, рекомендуется выполнять анализ с использованием другого метода анализа.
Блок-схема проведения анализа приведена в приложении 1.
ГОСТ 12.0.004-90 Система стандартов безопасности труда. Организация обучения безопасности труда. Общие положения
ГОСТ 12.1.004-91 Система стандартов безопасности труда. Пожарная безопасность. Общие требования
ГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 12.4.009-83 Система стандартов безопасности труда. Пожарная техника для защиты объектов. Основные виды. Размещение и обслуживание
ГОСТ 17.1.5.05-85 Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков
ГОСТ 1770-74 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 4165-78 Реактивы. Медь (II) сернокислая 5-водная. Технические условия
ГОСТ 4232-74 Реактивы. Калий йодистый. Технические условия
ГОСТ 4328-77 Реактивы. Натрия гидроокись. Технические условия
ГОСТ 5845-79 Реактивы. Калий-натрий виннокислый 4-водный. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 9656-75 Реактивы. Кислота борная. Технические условия
ГОСТ 14262-78 Кислота серная особой чистоты. Технические условия
ГОСТ 14919-83 Электроплиты, электроплитки и жарочные электрошкафы бытовые. Общие технические условия
ГОСТ 18190-72 Вода питьевая. Методы определения содержания остаточного активного хлора
ГОСТ 24363-80 Реактивы. Калия гидроокись. Технические условия
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 27384-2002 Вода. Нормы погрешностей измерений показателей состава и свойств
ГОСТ 28311-89 Дозаторы медицинские лабораторные. Общие технические требования и методы испытаний
ГОСТ 29169-91 Посуда лабораторная стеклянная. Пипетки с одной отметкой
ГОСТ 29227-91 Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
ГОСТ Р 12.1.019-2009 Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты
ГОСТ Р ИСО 5725-6-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности
ГОСТ Р 51592-2000 Вода. Общие требования к отбору проб
ГОСТ Р 52501-2005 Вода для лабораторного анализа. Технические условия
ГОСТ Р 53228-2008 Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
Примечание — Если ссылочный стандарт заменен (изменен), то следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
Настоящая методика обеспечивает получение результатов анализа с погрешностями, не превышающими значений, приведенных в таблице 1. Приписанные погрешности измерений не превышают нормы погрешностей, установленные ГОСТ 27384.
Таблица 1 — Диапазон измерения, значение показателей повторяемости, воспроизводимости и точности
Диапазон измерений, мг/дм 3
Показатель повторяемости (стандартное отклонение повторяемости), sr, %
Показатель воспроизводимости (стандартное отклонение воспроизводимости) sR, %
Показатель точности (границы относительной погрешности при Р = 0,95), ± δ, %
источник
Метод применим для определения концентрации аммонийного азота в пересчете на ионы аммония МН4 в природной воде, питательной воде и ее составляющих, конденсатах пара, котловых и теплофикационных водах. Данный метод применим для вод, содержащих и не содержащих гидразин.
Сущность метода [61] состоит во взаимодействии аммонийного азота в щелочной среде с реактивом Несслера и измерении оптической плотности образующейся при этом желто-оранжевой суспензии. Нес- слер предложил использовать данное соединение для определения концентрации ионов аммония еще в 1856 г. Реактив Несслера представляет собой щелочной раствор двойной соли иодида двухвалентной ртути и иодида калия Н§12 * 2К.1.
Для анализа отбирают такой объем пробы, чтобы концентрация
аммония не превышала 1 мг/дм 3 . Ход анализа зависит от присутствия в воде веществ, мешающих определению, таких как гидразин, окрашенные органические соединения и некоторые ионы металлов.
Если анализируемая вода свободна от каких-либо мешающих компонентов, к отобранной пробе добавляют реактив Несслера, при этом аммиак и соли аммония реагируют с реактивом Несслера следующим образом:
Концентрации азота, ртути и йода в осадке находятся в соотношении 1 : 2 : 3. Однако в состав образующегося продукта могут входить и другие соединения. Таким образом, окончательное строение образующегося вещества не установлено. При большом избытке йода осадок заметно растворяется. Это учитывают при приготовлении реактива Несслера. При очень большом избытке щелочи осадок разлагается с образованием оксида ртути, который тоже окрашен, но менее интенсивно, чем соединение МН7Н§-,13.
В результате данных реакций образуется взвесь мелких нераство- ренных частиц осадка определенного размера в растворе. В зависимости от условий проведения реакции образуется либо суспензия, либо коллоидный раствор.
Соединение, образующееся по указанной выше реакции, склонно к образованию коллоидных частиц с отрицательным зарядом. Через 3 мин после образования коллоидного раствора устанавливается максимальная окраска, после чего измеряют оптическую плотность раствора. Однако еще через небольшой промежуток времени после достижения максимальной окраски начинается осаждение частиц, и раствор становится непригодным для анализа. Если концентрация
ионов аммония ниже 5 мг/дм , то после добавления реактива Несслера образующийся коллоидный раствор остается устойчивым в течение достаточно длительного времени. Оптическая плотность исследуемого раствора зависит не только от общего количества продукта реакции, но и от размера коллоидных частиц. Размер частиц, в свою очередь, зависит от порядка сливания анализируемого раствора и реакти bob, от концентрации электролитов, от продолжительности отстаивания коллоидного раствора и ряда других причин.
Определению концентрации аммиака мешают различные соединения, например амины, ацетон, альдегиды и т.п.
Мешающее влияние гидразина устраняют введением в реакционную среду йода. На начальном этапе гидразин разрушается до азота по реакции
Окрашенное соединение при этом не образуется. В тот момент, когда весь гидразин разрушится, раствор приобретет желтоватую окраску, обусловленную избытком йода, который затем окисляют добавлением небольшого избытка раствора сульфита натрия
В результате данной реакции происходит обесцвечивание раствора.
Если анализируемая вода содержит органические вещества, от них освобождаются коагуляцией. Для этого к анализируемой воде добавляют раствор сульфата железа и доводят pH раствора до значения pH = 5—7, при этом образуется малорастворимый пористый осадок — гидроксид железа, который сорбирует органические вещества, удаляя их из раствора:
Далее выпавший осадок отделяют фильтрованием раствора через бумажный фильтр.
Многие ионы (в частности, ионы магния) мешают анализу, поскольку способствуют осаждению определяемого компонента NH-,Hg-,I34. Иногда их влияния можно избежать, вводя в раствор тарт- рат-ионы, образующие с некоторыми мешающими ионами прочные комплексы, т.е. маскирующие их. Однако не все ионы металлов образуют с тартрат-ионами прочные комплексы, поэтому часто приходится предварительно отделять аммиак отгонкой.
Мешающее влияние солей жесткости устраняют добавлением раствора виннокислого калия-натрия, влияние большого количества железа, цветности и мутности — осветлением раствора гидроксидом алюминия.
Определение концентрации аммиака и ионов аммония рекомендовано проводить сразу же после отбора пробы. Если нет возможности
провести анализ сразу, то пробу консервируют прибавлением 1 см 3
концентрированной серной кислоты или 2—4 см -5 хлороформа на 1 дм 3 пробы.
Если концентрация гидразина в анализируемой воде превышает 100 мг/кг, то его предварительно окисляют раствором йода концентрацией 0,1 и. Для этого в мерную колбу вместимостью 50 см 3 переносят отмеренный объем анализируемой воды и доводят объем в колбе примерно до 40 см 3 обессоленной водой, после чего перемешивают раствор. Далее к раствору по каплям добавляют раствор йода концентрацией 0,1 и до появления желтой окраски жидкости и через 2 мин в нее вводят также по каплям 0,1 н раствор тиосульфата натрия до полного связывания избытка йода (исчезновения окраски). Раствор перемешивают, доводят объем в колбе до метки обессоленной водой, прибав-
ляют 1 см реактива Несслера и еще раз все перемешивают. Если кон-
центрация гидразина меньше 100 мг/дм , используют растворы йода и тиосульфата натрия концентрацией 0,01 н.
Влияние солей жесткости устраняют добавлением в пробу 1 см 3 раствора сегнетовой соли па 50 см’’ анализируемой пробы.
Приготовление рабочих растворов
- 1. Безаммиачная обессоленная вода. Обессоленная вода проверяется на содержание аммиака (к 5 см 3 воды прибавляют 0,1 см 3 реактива Несслера). При обнаружении аммиака (появление желтоватой окраски) обессоленную воду фильтруют через активированный уголь марки БАУ или через катионит в Н-форме либо кипятят в колбе до уменьшения объема на 1/3, после чего проверяют воду на содержание аммиака и ионов аммония. На этой воде готовят реактивы и ее используют в анализе для разбавления пробы.
- 2. Реактив Несслера. Применяют готовый реактив или готовят его по методикам, описанным ниже.
Методика 1. Навески 100 г иодида ртути ^12 и 70 г иодида калия К.1 растворяют в небольшом количестве безаммиачной обессоленной воды и смешивают с раствором гидроксида натрия, полученного растворением 160 г гидроксида натрия в 500 см 3 безаммиачной обессо-
ленной воды. Обессоленной водой объем смеси доводят до 1000 см и дают отстояться в течение не менее 4 ч. Используют прозрачный раствор. Реактив Несслера — щелочной раствор, поэтому необходимо обращаться с ним с осторожностью, не допуская попадания на кожу и слизистую оболочку глаз. При попадании реактива на кожу или в глаза необходимо быстро промыть пораженный участок водой.
Методика 2. Растворяют навеску 32 г иодида ртути (II) и навеску 20 г иодида калия в 50 см 3 безаммиачной обессоленной воды и разбавляют раствор водой до 200 см 3 . При этом выпадает небольшое количество избытка иодида ртути. Отбирают 20 см 3 прозрачного раствора
и смешивают с 30 см 3 концентрированного раствора гидроксида калия. Дают жидкости отстояться, сливают прозрачный раствор сифоном в темную склянку с притертой пробкой и хранят в темном месте.
Методика 3. Навеску 6 г хлорида ртути (II) растворяют в 50 см 3 горячей (80 °С) обессоленной воды в фарфоровой чашке, добавляют
раствор 7,4 г иодида калия в 50 см 3 воды. Раствор охлаждают до комнатной температуры и дают отстояться, после чего жидкость сливают, а осадок иодида ртути для удаления образовавшегося хлорида калия
трижды промывают холодной водой порциями по 20 см 3 . Промывную жидкость декантируют. К промытому осадку прибавляют 5 г иодида калия и немного воды, затем концентрированный раствор 20 г гидроксида калия и после охлаждения разбавляют обессоленной водой до
- 100 см 3 . После отстаивания раствора сливают прозрачную жидкость в темную склянку с притертой пробкой и хранят ее в темном месте. Раствор реактива Несслера устойчив длительное время, если его защищать от воздействия оксида углерода воздуха с помощью хлоркальци- евой трубки.
- 3. Раствор сегнетовой соли. Для получения раствора сегнетовой соли с массовой долей 50 % навеску 67,1429 г тартрата натрия и калия
К№С4Н46 • 4Н-,0 разбавляют до 100 см обессоленной водой и прибавляют 0,2—0,5 см 3 реактива Несслера. Раствор применяют после осветления.
- 4. Раствор йода. Раствор йода концентрацией 0,1 н готовят из фик- санала по инструкции, приложенной к набору фиксаналов. Раствор устойчив в течение одного года, хранят его в склянке темного стекла. Раствор йода концентрацией 0,01 н готовят разбавлением в 10 раз раствора концентрацией 0,1 н. Приготовленный раствор хранят в течение 10 дней в склянке темного стекла в темном месте без доступа света.
- 5. Раствор тиосульфата натрия. Раствор тиосульфата натрия концентрацией 0,1 н готовят из фиксанала по инструкции, приложенной к набору фиксаналов. Раствор устойчив в течение одного года, если он защищен от доступа угольной кислоты и приготовлен на све- жепрокипяченной и охлажденной воде.
Раствор тиосульфата натрия концентрацией 0,01 и готовят разбавлением в 10 раз раствора концентрацией 0,1 п. Приготовленный раствор хранят в течение 10 дней.
6. Основной раствор аммиака. Основной раствор, содержащий в пересчете на N Н4 1000 мг/дм 3 , готовят из хлорида аммония квалификации «х.ч.», предварительно высушенного в сушильном шкафу при
температуре 105—ПО °С. В мерную колбу вместимостью 1000см переносят навеску 2,9722 г реактива и растворяют его в безаммиачной обессоленной воде. После растворения доводят объем в колбе до метки обессоленной водой и хорошо перемешивают раствор. Раствор устойчив, хранят его в склянке с притертой пробкой.
7. Стандартный раствор аммиака. Стандартный раствор концентрацией 10 мг/дм 3 готовят разбавлением основного стандартного раствора в 100 раз. Для этого отбирают пипеткой 10 см 3 основного раствора в мерную колбу вместимостью 1000 см 3 и доводят объем в колбе безаммиачной обессоленной водой до метки. Раствор хорошо перемешивают. Раствор неустойчив, пригоден в день приготовления.
Построение калибровочного графика
В несколько мерных колб вместимостью 50 см 3 вводят 0,5; 1,0; 2,0;
3,0; 4,0; 5,0 см стандартного раствора, что соответствует концентрациям МН4 0,1; 0,2; 0,4; 0,6; 0,8; 1,0 мг/дм 3 . Затем объем в каждой колбе доводят до метки безаммиачной обессоленной водой. Раствор
перемешивают, добавляют точно по 1 см 3 реактива Несслера и еще раз хорошо перемешивают. Спустя 10 мин измеряют оптическую плотность окрашенных растворов О при длине волны Хтах = 400 нм в кюветах с рабочей длиной 50 мм. В качестве раствора сравнения применяют холостую пробу (безаммиачную обессоленную воду с реактивом Несслера). Зависимость оптической плотности от концентрации
ионов ]4Н4 представлена в табл. 6.2. Пример калибровочного графика показан на рис. 6.2.
Рис. 6.2. Калибровочный график для определения концентрации ионов аммония с применением реактива Несслера (стандартный раствор с концентрацией 10 мг/дм 3 )
Зависимость оптической плотности от концентрации ионов аммония в растворе (стандартный раствор с концентрацией 10 мг/дм 3 , кювета с рабочей длиной 30 мм, колба вместимостью 50 см 3 )
Оптическая плотность, рассчитанная по методу наименьших квадратов ?>р
источник
Фотометрический метод определения массовой концентрации ионов аммония основан на взаимодействии ионов аммония с тетрамеркуратом калия в щелочной среде (реактив Несслера) с образованием коричневой, нерастворимой в воде соли основания Милона), переходящей в коллоидную форму желтого цвета при малых содержаниях ионов аммония.
Оптическую плотность раствора измеряют при λ = 425 нм в кюветах с длиной поглощающего слоя 10 или 50 мм. Интенсивность окраски прямо пропорциональна концентрации ионов аммония.
Настоящая методика обеспечивает получение результатов анализа с погрешностью, не превышающей значений, приведённых в таблице 1.
Значения показателя точности методики используют при:
— оформлении результатов анализа, выдаваемых лабораторией;
— оценке деятельности лабораторий на качество проведения испытаний;
— оценке возможности использования результатов анализа при реализации методики в конкретной лаборатории.
Таблица 1 — Диапазон изм ерений, значения показателей точности, правильности, воспроизводимости и повторяемости
Показатель повторяемости (относительное среднеквадратическое отклонение повторяемости),
Показатель воспроизводимости (относительное среднеквадратическое отклонение воспроизводимости)
Показатель точности 1 (границы, в которых находится погрешность методики при Р = 0,95), ±δ, %
Поверхностные пресные и сточные воды
Поверхностные морские воды
1 Соответствует расширенной относительной неопределенности с коэффициентом охвата k = 2.
3. СРЕДСТВА ИЗМЕРЕНИЙ, ВСПОМОГАТЕЛЬНОЕ ОБОРУДОВАНИЕ, МАТЕРИАЛЫ, РЕАКТИВЫ
Фотоэлектроколориметр или спектрофотометр любого типа, позволяющий измерять оптическую плотность при λ = 425 нм.
Кюветы с длиной поглощающего слоя 10 и 50 мм.
Весы лабораторные с наибольшим пределом взвешивания 200 г, по ГОСТ 24104-2001.
Весы технические лабораторные по ГОСТ 24104-2001.
Шкаф сушильный общелабораторного назначения.
ГСО с аттестованным содержанием ионов аммония 1 мг/см 3 с погрешностью не более 1 % при доверительной вероятности р = 0,95, № 7015-93.
Колбы мерные, наливные вместимостью 50, 100, 250, 500 см 3 по ГОСТ 1770-74.
Пипетки градуированные вместимостью 1; 2; 5; 10 см 3 2-го класса точности по ГОСТ 29227-91.
Цилиндры вместимостью 25; 100; 500; 1000 см 3 2-го класса точности по ГОСТ 1770-74.
Колбы конические типа Кн-2-100 ХС; Кн-2-250 ХС; Кн-2-500 ТС по ГОСТ 25336-82.
Стаканы химические Н-1-250 ТХС; В-1-500 ТХС по ГОСТ 25336-82.
Воронки лабораторные В-75-110 ХС по ГОСТ 25336-82.
Аппарат для перегонки с водяным паром.
Фильтры обеззоленные ТУ 6-09-1678.
Бумага индикаторная, универсальная ТУ-6-09-1181.
Бутыли из стекла или полиэтилена с притертыми или винтовыми пробками вместимостью 500 — 1000 см 3 для отбора и хранения проб и реактивов.
1 Допускается использование других средств измерений, вспомогательного оборудования, посуды и материалов с метрологическими и техническими характеристиками не хуже указанных.
2 Средства измерений должны быть поверены в установленные сроки.
Реактив Несслера по ТУ 6-09-2089.
Калий фосфорнокислый однозамещенный по ГОСТ 4198-75.
Калий фосфорнокислый двузамещенный по ГОСТ 2493-75.
Калия гидроокись по ТУ 6-09-50-2322.
Натрий мышьяковистокислый (метаарсенит) по ТУ 6-09-2791.
Натрий серноватистокислый (тиосульфат) по ГОСТ 27068-86.
Цинк сернокислый 7-водный по ГОСТ 4174.
Калий-натрий виннокислый 4-х водный (сегнетова соль) по ГОСТ 5845-79.
Этилендиамин-N,N, N ‘N'»-тетрауксусной кислоты динатриевая соль (Трилон Б) по ГОСТ 10652-73.
Калий марганцевокислый по ГОСТ 20490-75.
Натрий тетраборнокислый по ГОСТ 4199-76.
Калий двухромовокислый по ГОСТ 4220-75.
Фильтры обеззоленные по ТУ 6-09-1678.
Бумага индикаторная, универсальная по ТУ-6-09-1181.
Фильтры бумажные обеззоленные «белая лента» и «синяя лента» по ТУ 6-09-1678-86.
1 Все реактивы, используемые для анализа, должны быть квалификации ч.д.а. или х.ч.
2 Допускается использование реактивов, изготовленных по другой нормативно-технической документации, в том числе импортных, с квалификацией не ниже ч.д.а.
4.1 При выполнении анализов необходимо соблюдать требования техники безопасности при работе с химическими реактивами ГОСТ 12.1.007-76 и ПОТ Р М-004-97.
4.2 Электробезопасность при работе с электроустановками по ГОСТ 12.1.019-79.
4.3 Организация обучения работающих безопасности труда по ГОСТ 12.0.004-90.
4.4 Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004-91 и иметь средства пожаротушения по ГОСТ 12.4.009-83.
4.5 Содержание вредных веществ в воздухе не должно превышать установленных предельно допустимых концентраций в соответствии с ГОСТ 12.1.005-88.
Выполнение измерений может производить химик-аналитик, владеющий техникой фотометрического анализа, изучивший инструкцию по эксплуатации спектрофотометра или фотоколориметра и уложившегося в нормативы контроля при выполнении процедур контроля погрешности.
Измерения проводятся в следующих условиях:
Температура окружающего воздуха (20 ± 5) ° С.
Относительная влажность не более 80 % при температуре 25 °С.
Атмосферное давление (84 — 106) кПа.
Частота переменного тока (50 ± 1) Гц.
Напряжение в сети (220 ± 22) В.
7.1 Отбор проб производится в соответствии с требованиями ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб», ГОСТ Р 51593-2000 «Вода питьевая. Отбор проб», ПНД Ф 12.15.1-08 «Методические указания по отбору проб для анализа сточных вод».
7.2 Бутыли для отбора и хранения проб воды обезжиривают раствором CMC, промывают водопроводной водой, хромовой смесью, водопроводной водой, а затем 3 — 4 раза дистиллированной водой.
Пробы воды (объем не менее 500 см 3 ) отбирают в полиэтиленовые или стеклянные бутыли, предварительно ополоснутые отбираемой водой.
7.3 Пробы морской воды анализируют в день отбора. Если проба не будет проанализирована в день отбора, то её хранят при температуре 3 — 4 °С с не более 24 часов.
7.4 Если определение ионов аммония в питьевых, природных и сточных водах проводят в день отбора пробы, то консервирование не производится. Если проба не будет проанализирована в день отбора, то ее консервируют добавлением 1 см 3 концентрированной серной кислоты на 1 дм 3 . Консервированная проба может храниться не более 2 суток при температуре 3 — 4 °С.
Проба воды не должна подвергаться воздействию прямого солнечного света. Для доставки в лабораторию сосуды с пробами упаковываются в тару, обеспечивающую сохранение и предохраняющую от резких перепадов температуры.
7.5 При отборе проб составляют сопроводительный документ по форме, в котором указывают:
цель анализа, предполагаемые загрязнители;
должность, фамилия отбирающего пробу, дата.
Подготовку спектрофотометра и фотоэлектроколориметра к работе проводят в соответствии с рабочей инструкцией по эксплуатации прибора.
Бидистиллированную воду готовят одним из следующих способов:
— дважды перегнанную воду пропускают через колонку с катеонитом КУ-2 или СБС
— вторично перегоняют дистиллированную воду, предварительно подкислив серной кислотой и добавив марганцовокислый калий до четкой малиновой окраски.
Упаривают дистиллированную воду до 1/4 объема, после добавления двууглекислого натрия (0,1 — 0,5 г на 1 дм 3 ). Полученную воду проверяют на наличие аммиака реактивом Несслера и используют для приготовления реактивов и разбавления проб.
Безаммиачную воду хранят в бутыли с тубусом. В пробку бутыли вставляют хлоркальциевую трубку, заполненную кристаллами NaHSO 4 .
Морскую воду наливают в колбу, доливают равный объем дистиллята, слабо подщелачивают и кипятят до первоначального объема. После охлаждения воды и отстоя образовавшейся мути осторожно сливают прозрачную воду в другой сосуд. Безаммиачную морскую воду следует хранить в сосуде, соединенном со склянкой Тищенко.
Помещают в стакан 15 г калия натрия виннокислого четырехводного (KNaC 4 H 4 O 6 ∙ 4H 2 O), растворяют в 75 см 3 безаммиачной дистиллированной воды. Раствор можно применять после осветления. Необходимо проверить приготовленный раствор на содержание иона аммония. В случае его присутствия прибавляют немного гидроксида калия и гидроксида натрия (до щелочной реакции) и после этого раствор кипятят до начала образования корки солей на стенках стакана. Раствор разбавляют безаммиачной водой до прежнего объема и повторяют испытание на аммоний. Для связывания следов аммиака в раствор сегнетовой соли приливают 5 см 3 реактива Несслера. Хранят в склянке из темного стекла в защищенном от света месте. Реактив устойчив.
15 %-ный раствор сегнетовой соли упаривают до половины объема, остужают в сосуде, соединенном со склянкой Тищенко. Хранят в склянке из темного стекла в защищенном от света месте. Реактив устойчив.
Помещают в стакан 40,0 г гидроокиси натрия, растворяют в небольшом количестве безаммиачной воды, переносят в мерную колбу вместимостью 1 дм 3 и доводят до метки безаммиачной водой».
Хранят под защитой от контакта с воздухом в посуде из полиэтилена в течение 2-х месяцев.
Помещают в стакан 10 г гидроокиси натрия, растворяют в 90 см 3 безаммиачной воды. Раствор хранят в посуде из полиэтилена.
10 %-ный раствор гидроокиси натрия упаривают до половины объема, остужают в сосуде, соединенном со склянкой Тищенко. Раствор хранят в посуде из полиэтилена. Срок хранения 2 месяца.
К 500 см 3 раствора 0,025 М тетрабората натрия приливают 88 см 3 0,1 М раствора гидроокиси натрия и разбавляют до 1 дм 3 безаммиачной водой. Хранят в течение 3 месяцев.
Помещают в стакан 9,5 г тетрабората натрия десятиводного (Na 2 B 4 O ∙ 10H 2 O ), растворяют в небольшом количестве безаммиачной воды, переносят в колбу на 1000 см 3 , а затем доводят до метки. Хранят в течение 3 месяцев.
Помещают в стакан 14,3 г безводного однозамещенного фосфорнокислого калия и 68,8 г безводного двузамещенного фосфорнокислого калия, растворяют в небольшом количестве безаммиачной воды, не содержащей аммиака и аммонийных солей, переносят в мерную колбу вместимостью 1 дм 3 , и доводят до метки этой же водой.
Срок хранения до внешних изменений, но более 2-х месяцев.
100 г сульфата цинка помещают в стакан, растворяют в небольшом количестве безаммиачной воды, переносят в мерную колбу вместимостью 1 дм 3 и доводят до метки безаммиачной водой. Реактив устойчив.
Помещают в стакан 10 г гидроксида натрия, растворяют в 60 см 3 безаммиачной воды. К полученному раствору добавляют 50 г трилона Б, переносят в мерную колбу на 100 см 3 и доводят до метки безаммиачной водой. Реактив устойчив.
Помещают в стакан 50 г KNaС4Н4O 6 ∙ 4Н 2 O, растворяют в небольшом количестве безаммиачной воды, переносят в мерную колбу на 100 см 3 , доводят до метки бидистиллированной водой, прибавляют 0,2 — 0,5 см 3 реактива Несслера. Раствор можно применять после осветления. Хранят в склянке из темного стекла в защищенном от света месте. Реактив устойчив.
Помещают в стакан 1 г мышьяковистокислого натрия, переносят в мерную колбу вместимостью 1 дм 3 и доводят до метки безаммиачной водой. Реактив устойчив.
Помещают в стакан 3,5 г серноватистокислого натрия, растворяют в небольшом количестве безаммиачной воды, переносят в мерную колбу вместимостью 1 дм 3 и доводят до метки безаммиачной водой. Раствор хранят в склянке из темного стекла не более 3-х месяцев.
Помещают в стакан 40 г борной кислоты, растворяют в небольшом количестве безаммиачной воды, переносят в мерную колбу вместимостью 1 дм 3 и доводят до метки безаммиачной водой. Раствор хранят в емкости из полиэтилена. Реактив устойчив.
125 г алюмокалиевых квасцов AIK(SO 4 )2 ∙ 12Н2O помещают в стакан, растворяют в небольшом количестве дистиллированной воды, переносят в мерную колбу вместимостью 1 дм 3 , доводят до метки дистиллированной водой, нагревают до 60 °С и постепенно прибавляют 55 см 3 концентрированного раствора аммиака при постоянном перемешивании. Дают смеси постоять около 1 часа, промывают осадок гидроокиси алюминия многократной декантацией дистиллированной водой до удаления хлоридов, нитритов, нитратов и аммиака. Реактив устойчив.
27,3 см 3 серной кислоты (ρ = 1,84 г/см 3 ) вносят небольшими порциями при перемешивании в 150 — 200 см 3 дистиллированной воды, переносят в мерную колбу вместимостью 1 дм 3 и доводят до метки дистиллированной водой. Срок хранения 6 месяцев.
Помещают в стакан 40 г гидроокиси натрия, растворяют в 60 см 3 безаммиачной воды. Хранят под защитой от контакта с воздухом в посуде из полиэтилена в течение 2-х месяцев.
Помещают в стакан 15 г гидроокиси натрия, растворяют в 85 см 3 безаммиачной воды. Хранят под защитой от контакта с воздухом в посуде из полиэтилена в течение 2-х месяцев.
Помещают в стакан 4,0 г гидроокиси натрия, растворяют в небольшом количестве безаммиачной воды, переносят в мерную колбу вместимостью 1 дм 3 и доводят до метки безаммиачной водой.
Хранят под защитой от контакта с воздухом в посуде из полиэтилена в течение 2-х месяцев.
Раствор готовят из ГСО в соответствии с прилагаемой к образцу инструкцией. В 1 см 3 раствора должно содержаться 0,1 мг ионов аммония.
2,9650 г аммония хлористого, подготовленного по ГОСТ 4212-76, помещают в стакан, растворяют в небольшом количестве дистиллированной воды, переносят в мерную колбу на 1000 см 3 , а затем доводят до метки 1 см 3 раствора содержит 0,1 мг ионов аммония.
Приготовленный раствор хранят в банке из темного стекла в течение 3-х месяцев.
Раствор готовят в день проведения анализа, разбавлением основного стандартного раствора безаммиачной дистиллированной водой. 1 см 3 раствора содержит 0,005 мг ионов аммония.
При наличии СO 2 раствор готовят в соответствии с прилагаемой к образцу инструкцией. 1 см 3 раствора должен содержать 0,005 мг ионов аммония.
Раствор используют свежеприготовленным.
Для построения градуировочного графика необходимо приготовить образцы для градуировки с массовой концентрацией ионов аммония от 0,05 до 4,0 мг/дм 3 (для морской воды от 0,05 до 1,0 мг/дм 3 ).
Условия анализа должны соответствовать п. 6.
Состав и количество образцов для градуировки приведены в таблице 2. Погрешность, обусловленная процедурой приготовления образцов для градуировки, не превышает 2,5 %.
Таблица 2 — Состав и количество образцов для градуировки
Массовая концентрация ионов аммония в градуировочных растворах, мг/дм 3
Аликвотная часть рабочего градуировочного раствора с концентрацией 0,005 мг/см 3 , помещаемая в емкость вместимостью 50 см 3 , см 3
Растворы для градуировки готовят в цилиндрах Несслера вместимостью 50 см 3 , для чего в каждый цилиндр вносят рабочий градуировочный раствор согласно таблице 2 и доводят до метки безаммиачной морской водой. Растворы в цилиндрах перемешивают и добавляют по 1,0 см 3 раствора сегнетовой соли. В другие цилиндры вместимостью 50 см 3 наливают по 1,5 см 3 30 % раствора сегнетовой соли, смачивают стенки цилиндра этим раствором, затем приливают 5 см 3 20 % раствора едкого натра и хорошо перемешивают. Растворы стандартов с сегнетовой солью быстро приливают к смеси сегнетовой соли и едкого натра, перемешивают, добавляют 2 см 3 реактива Несслера и аккуратно перемешивают. Через 15 мин измеряют оптическую плотность полученных растворов на фотоэлектроколориметре или спектрофотометре при длине волны λ = 425 нм, в кюветах с длиной поглощающего слоя 50 мм по отношению к безаммиачной морской воде, проведенной через процедуру анализа.
Растворы готовят в мерных колбах вместимостью 50 см 3 , для чего в каждую колбу вносят рабочий градуировочный раствор согласно таблице 2 и доводят до метки безаммиачной водой. Обрабатывают способом описанным в п. 10.2.2.
Анализ образцов для градуировки проводят в порядке возрастания их концентрации. Для построения градуировочного графика каждую искусственную смесь необходимо фотометрировать 3 раза с целью исключения случайных результатов и усреднения данных.
При построении градуировочного графика по оси ординат откладывают значения оптической плотности, а по оси абсцисс — содержание аммония в мг/дм 3 .
Для растворов с содержанием 0,0 — 0,6 мг/дм 3 ионов аммония строят график, используя кюветы толщиной слоя 50 мм; для растворов, содержащих 0,6 — 4,0 мг/дм 3 — график с использованием кюветы с толщиной слоя 10 мм.
Контроль стабильности градуировочной характеристики проводят не реже одного раза в квартал, а также после ремонта или поверки прибора, при использовании новой партии реактивов. Средствами контроля являются вновь приготовленные образцы для градуировки (не менее 3 образцов из приведенных в таблице 2).
Градуировочную характеристику считают стабильной при выполнении для каждого образца для градуировки следующего условия:
где X — результат контрольного измерения массовой концентрации ионов аммония в образце для градуировки, мг/дм 3 ;
С — аттестованное значение массовой концентрации ионов аммония в образце для градуировки, мг/дм 3 ;
σ Rл — среднеквадратическое отклонение внутрилабораторной прецизионности, установленное при реализации методики в лаборатории.
Примечание . Допустимо среднеквадратическое отклонение внутрилабораторной прецизионности при внедрении методики в лаборатории устанавливать на основе выражения: σRл = 0,84σR, с последующим уточнением по мере накопления информации в процессе контроля стабильности результатов анализа.
Значения σ R приведены в таблице 1.
Если условие стабильности градуировочной характеристики не выполняется только для одного образца для градуировки, необходимо выполнить повторное измерение этого образца с целью исключения результата, содержащего грубую погрешность.
Если градуировочная характеристика нестабильна, выясняют причины нестабильности градуировочной характеристики и повторяют контроль ее стабильности с использованием других образцов для градуировки, предусмотренных методикой. При повторном обнаружении нестабильности градуировочной характеристики строят новый градуировочный график.
9.1 Избавление от мешающих влияний при определении ионов аммония в поверхностных пресных и сточных водах
9 .1.1 Непосредственному применению метода без предварительной отгонки аммиака мешает такое большое количество веществ, что рекомендовать этот метод без отгонки можно для анализа лишь очень немногих вод.
Определению мешают амины, хлорамины, ацетон, альдегиды, спирты и некоторые другие органические соединения, реагирующие с реактивом Несслера. В их присутствии проводят определение аммиака с отгонкой.
Определению мешают также компоненты, обуславливающие жесткость воды, железо, сульфиды, хлор, а также мутность.
9 .1.2 Мешающее влияние жесткости воды устраняют прибавлением раствора сегнетовой соли или комплексона (III). Мутные растворы центрифугируют или фильтруют с помощью стеклянной ваты, стеклянного или бумажного фильтра «белая лента», предварительно промытого безаммиачной водой до отсутствия аммиака в фильтре.
Большое количество железа, сульфидов и мутность удаляют с помощью раствора сульфата цинка (см. п. 8.2.11). К 100 см 3 пробы прибавляют 1 см 3 раствора и смесь тщательно перемешивают. Затем рН смеси доводят до 10,5 добавлением 25 %-ного раствора едкого калия или натрия. Проверяют значение рН на рН-метре. После взбалтывания и образования хлопьев осадок отделяют центрифугированием или фильтрованием через стеклянный фильтр (допускается использование бумажного фильтра «белая лента»), предварительно освобожденного от аммиака. Увеличение объема жидкости необходимо учитывать при расчете.
9 .1.3 Мешающее влияние хлора устраняют добавлением раствора тиосульфата или арсенита натрия. Для удаления 0,5 мг хлора достаточно прибавить 1 см 3 одного из указанных растворов (по п.п. 8.2.15, 8.2.17).
9 .1.4 В присутствии нелетучих органических соединений, например, гуминовых веществ, определение ионов аммония проводят после дистилляции.
9 .1.5 Кальций в концентрациях, превышающих 250 мг/дм 3 , оказывает влияние на установление рН. В этом случае раствор подщелачивают буферным фосфатным раствором и смесь обрабатывают кислотой или щелочью до рН — 7,4 (см. п. 10 «Выполнение измерений»).
9 .1.6 Летучие органические соединения, которые мешают определению аммиака в дистилляте, устраняют кипячением слабо подкисленной пробы (см. п. 10 «Выполнение измерений»).
9 .1.7 Мутная или цветная вода (при цветности выше 20°) подвергается коагуляции гидроокисью алюминия: к 300 см 3 исследуемой воды прибавляют 2 — 5 см 3 суспензии или 0,5 г сухой окиси алюминия, встряхивают. После 2-часового отстаивания отбирают для анализа прозрачный бесцветный слой.
Если проба воды не осветляется с помощью гидроксида алюминия, ее анализируют после предварительной отгонки (см. п. 10.2.3 «Выполнение измерений. Определение с перегонкой»).
Морские воды определяют без отгонки.
Определению мешает тонкая взвесь, образующаяся при взаимодействии реактива Несслера с катионами кальция и магния, присутствующими в морской воде в большом количестве. Для удержания магния и кальция в воде применяют сегнетову соль. Ее избыток не влияет на ход анализа. В случае появления взвеси при внесении рекомендуемых количеств раствора сегнетовой соли в пробу следует увеличить ее концентрацию или добавить цитрат натрия (лимоннокислый натрий).
10.1.1 Качественное определение
К 10 см 3 пробы прибавляют несколько кристалликов сегнетовой соли и 0,5 см 3 реактива Несслера. Желтое окрашивание раствора, помутнение или выпадение желто-коричневого осадка указывает на присутствие ионов аммония. При повышенном содержании органических веществ, особенно гуминовых кислот, вызывающих усиление коричневой окраски после подщелачивания, проводят параллельный опыт, добавив к пробе сегнетову соль, а вместо реактива Несслера — 0,5 см 3 15 %-ного раствора гидроксида натрия.
К 50 см 3 первоначальной или осветленной пробы, или к меньшему ее объему, доведенному до 50 см 3 безаммиачной водой, прибавляют 1 — 2 капли раствора сегнетовой соли или комплексона III и смесь тщательно перемешивают. При анализе очень жестких вод количество добавляемого раствора Сегнетовой соли или комплексона III увеличивается до 0,5 — 1,0 см 3 . Затем добавляют 1 см 3 реактива Несслера и снова перемешивают. Через 10 мин измеряют оптическую плотность. Окраска смеси устойчива в течение 30 мин. Из величины оптической плотности вычитают оптическую плотность холостого опыта. Если необходимо, вычитают и оптическую плотность пробы, к которой вместо реактива Несслера добавляют 1 см 3 15 %-ого раствора едкого натра и по графику находят содержание ионов аммония.
10.1.3 Определение с перегонкой
При анализе окрашенных проб, а также в присутствии мешающих органических соединений производят предварительную отгонку аммиака из исследуемой воды.
Отгонку аммиака из проб природных и сточных вод, содержащих легко гидролизуемые органические соединения, проводят при рН ÷ 7,4, добавляя к пробе фосфатный буферный раствор; в присутствии цианидов и большинства азотсодержащих органических соединений следует использовать боратный буферный раствор (рН ÷ 9,5). При анализе сточных вод, содержащих большие количества фенолов (воды коксохимических, газогенераторных предприятий) к пробе воды, добавляют 40 %-ный раствор гидроксида натрия. Если наряду с фенолами присутствуют вещества, гидролизующиеся в щелочной среде, то отгонку надо провести дважды: сначала при рН ÷ 7,4, собирая отгон в разбавленный раствор серной кислоты, затем подщелочить этот отгон до сильнощелочной реакции.
Для поглощения аммиака применяют растворы борной или серной кислот или безаммиачную воду.
Перегонку исследуемых проб проводят в комнате, воздух которой не содержит аммиака.
В колбу для отгона помещают 400 см 3 анализируемой пробы воды (или меньший объем, доведенный до 400 см 3 безаммиачной водой). Если проба воды содержит большое количество взвешенных веществ или нефтепродуктов, ее предварительно фильтруют через фильтр «белая лента». При необходимости пробу воды дехлорируют одним из реагентов, рекомендованных в п. 9.2.2. Если надо, нейтрализуют пробу (до рН ÷ 7) 1 М раствором серной кислоты или гидроксида натрия. Затем приливают 25 см 3 буферного раствора (рН ÷ 7,4 или 9,5 в зависимости от предполагаемых загрязнений) или 20 см 3 40 %-ного раствора гидроокиси натрия при анализе фенольных вод. В приемник наливают 50 см 3 поглощающего раствора и устанавливают объем жидкости так, чтобы конец холодильника был погружен в нее, добавляя при необходимости безаммиачную воду. Отгоняют примерно 300 см 3 жидкости, отгон количественно переносят в мерную колбу вместимостью 500 см 3 , замеряют рН полученного отгона (по рН-метру) и при необходимости доводят рН раствора до 6,0, затем разбавляют до метки безаммиачной водой.
В 50 см 3 аликвотной части определяют содержание ионов аммония, как указано в п. 10.1.2. При измерении оптической плотности используют кюветы толщиной слоя 1 — 5 см в зависимости от содержания ионов аммония в растворе.
В цилиндр Несслера на 50 см 3 вливают 1,5 см 3 30 % раствора сегнетовой соли и тщательно смачивают стенки цилиндра. Затем к этому раствору приливают 5 см 3 20 % раствора едкого натра и оба раствора хорошо перемешивают. Отдельно в цилиндр Несслера наливают 50 см 3 испытуемой морской воды, добавляют 1,0 см 3 сегнетовой соли и тщательно перемешивают. Затем морскую воду с сегнетовой солью быстро приливают к содержимому первого цилиндра, т.е. к смеси сегнетовой соли с раствором едкого натра, и полученную смесь хорошо перемешивают.
Обязательно проводится «холостой опыт».
Внимание ! Изменение порядка при ливания реактивов ведет к появлению мутности. Необходимо строго соблюдать порядок работы.
В пробы добавляют 2 см 3 реактива Несслера, перемешивают и через 15 мин колориметрируют на спектрофотометре при длине волны 425 нм в кювете с толщиной поглощающего слоя 50 мм на фоне безаммиачной морской воды. Перед нахождением концентрации ионов аммония, из оптической плотности пробы вычитается оптическая плотность «холостого опыта».
11.1 Содержание ионов аммония в питьевой, поверхностной пресной и сточной воде (мг/дм 3 ) вычисляют по формуле:
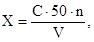
где С — содержание ионов аммония, найденное по калибровочному графику, мг;
V — объем пробы, взятой для анализа, см 3 ;
n = 1 при прямом определении ионов аммония;
n = 10 при определении с предварительной отгонкой аммиака (т.к. для анализа используется 1/10 отгона).
11.2 Содержание ионов аммония в морской воде (мг/дм 3 ) рассчитывают по формуле:
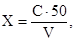
X — содержание ионов аммония, мг/дм 3 ;
С — концентрация ионов аммония, найденная по градуировочному графику, мг/дм 3 ;
V — объем пробы, взятый для анализа, см 3 .
11.3 За результат анализа принимают среднее арифметическое значение (Хср) двух параллельных определений X 1 и Х 2
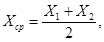
для которых выполняется следующее условие:
где r — предел повторяемости, значения которого приведены в таблице 3.
При невыполнении условия (5) могут быть использованы методы проверки приемлемости результатов параллельных определений и установления окончательного результата согласно раздела 5 ГОСТ Р ИСО 5725-6.
11.4 Расхождение между результатами анализа, полученными в двух лабораториях, не должно превышать предела воспроизводимости. При выполнении этого условия приемлемы оба результата анализа, и в качестве окончательного может быть использовано их среднее арифметическое значение. Значения предела воспроизводимости приведены в таблице 3.
Таблица 3 — Значения предела повторяемости и воспроизводимости при вероятности Р = 0,95
Предел повторяемости (относительное значение допускаемого расхождения между двумя результатами параллельных определений), r, %
Предел воспроизводимости (относительное значение допускаемого расхождения между двумя единичными результатами измерений, полученными в разных лабораториях), R, %
источник
Фотометрический метод определения массовой концентрации ионов аммония основан на взаимодействии NH 4 + — иoнов с тетраиодомеркуратом калия в щелочной среде K 2 HgI 4 + КОН (реактив Несслера) с образованием коричневой, нерастворимой в воде соли основания Миллона [ Hg 2 N] ∙ H 2 O , переходящей в коллоидную форму при малых содержаниях NH 4 + — иoнов . Светопоглощение раствора измеряют при λ = 425 нм в кюветах с длиной поглощающего слоя 1 или 5 см. Интенсивность окраски прямо пропорциональна концентрации NH 4 + — ионов в растворе пробы.
Настоящая методика обеспечивает получение результатов анализа с погрешностью, не превышающей значений, приведенных в таблице 1.
Диапазон измерений, значения показателей точности, повторяемости и воспроизводимости
Показатель точности (границы относительной погрешности при вероятности Р = 0,95), ± δ, %
Показатель повторяемости (относительное среднеквадратическое отклонение повторяемости) s r, %
Показатель воспроизводимости (относительное среднеквадратическое отклонение воспроизводимости) s R , %
Значения показателя точности методики используют при:
— оформлении результатов анализа, выдаваемых лабораторией;
— оценке деятельности лабораторий на качество проведения испытаний;
— оценке возможности использования результатов анализа при реализации методики в конкретной лаборатории.
Спектрофотометр или фотоэлектроколориметр, измеряющий светопоглощение при λ= 425 нм.
Кюветы с длиной поглощающего слоя 10 и 50 мм.
Весы лабораторные 2 класса точности ГОСТ 24104.
Колбы мерные, наливные 2-50-2
Колбы плоскодонные Кн-2-500-18 ТСХ ГОСТ 25336.
Стаканчики для взвешивания СВ ГОСТ 25336.
Аппарат для обыкновенной перегонки или с водяным паром (аппарат Парнаса-Вагнера).
Сушильный шкаф электрический ОСТ 16.0.801.397.
Фильтры обеззоленные ТУ 6-09-1678.
Бумага индикаторная, универсальная ТУ-6-09-1181.
Воронки стеклянные для фильтрования ГОСТ 25336.
Бутыли из стекла или полиэтилена с притертыми или винтовыми пробками вместимостью 500 — 1000 см 3 для отбора и хранения проб и реактивов.
Стандартный образец с аттестованным содержанием ионов аммония или аммоний хлористый, ГОСТ 3773.
Реактив Несслера, ТУ 6-09-2089.
Калий фосфорнокислый однозамещенный, ГОСТ 4198.
Калий фосфорнокислый двузамещенный, ГОСТ 2493.
Калия гидроокись, ТУ 6-09-50-2322.
Натрий мышьяковистокислый (метаарсенит), ТУ 6-09-2791.
Натрий серноватистокислый (тиосульфат), СТ СЭВ 223.
Калий-натрий виннокислый 4-х водный (сегнетова соль), ГОСТ 5845.
Этилендиамин-N,N,N’N’-тетрауксусной кислоты динатриевая соль (Трилон Б) ГОСТ 10652.
Ртуть йодная, Hgl ТУ 6-09-02-374.
Все реактивы должны быть квалификации х.ч. или ч.д.а.
4.1 . При выполнении анализов необходимо соблюдать требования техники безопасности при работе с химическими реактивами ГОСТ 12.1.007 .
4.2 . Электробезопасность при работе с электроустановками по ГОСТ 12.1.019 .
4.3 . Организация обучения работающих безопасности труда по ГОСТ 12.0.004 .
4.4 . Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004 и иметь средства пожаротушения по ГОСТ 12.4.009 .
Выполнение измерений может производить химик-аналитик, владеющий техникой фотометрического и спектрофотометрического анализов, изучивший инструкцию по работе с соответствующими приборами.
Измерения проводятся в следующих условиях:
температура окружающего воздуха (20 ± 5) °С;
атмосферное давление (84,0 — 106,7) кПа (630 — 800 мм. рт. ст);
относительная влажность (80 ± 5) %;
напряжение сети (220 ± 10) В;
частота переменного тока (50 ± 1) Гц.
Отбор проб производится в соответствии с требованиями ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб» G )
Бутыли для отбора и хранения проб воды обезжиривают раствором CMC , промывают водопроводной водой, хромовой смесью, водопроводной водой, а затем 3 — 4 раза дистиллированной водой.
Пробы воды (объем не менее 500 см 3 ) отбирают в стеклянные или полиэтиленовые бутыли, предварительно ополоснув отбираемой водой.
Если определение ионов аммония производят в день отбора пробы, то консервирование не производится. Если проба не будет проанализирована в день отбора, то ее консервируют добавлением 1 см 3 концентрированной серной кислоты на 1 дм 3 . Консервированная проба может храниться не более 2 суток при температуре (3 — 4) ° С. Проба воды не должна подвергаться воздействию прямого солнечного света. Для доставки в лабораторию сосуды с пробами упаковываются в тару, обеспечивающую сохранение и предохраняющую от резких перепадов температуры. При отборе проб составляют сопроводительный документ по форме, в котором указывают:
цель анализа, предполагаемые загрязнители;
должность, фамилия отбирающего пробу, дата.
Подготовку прибора к работе и оптимизацию условий измерения производят в соответствии с рабочей инструкцией по эксплуатации прибора. Прибор должен быть поверен.
Непосредственному применению метода без предварительной отгонки аммиака мешает такое большое количество веществ, что рекомендовать этот метод без отгонки можно для анализа лишь очень немногих вод.
7.4.1 . Определению мешают амины, хлорамины, ацетон, альдегиды, спирты и некоторые другие органические соединения, реагирующие с реактивом Несслера. В их присутствии проводят определение аммиака с отгонкой.
7.4.2 . Определению мешают также компоненты, обуславливающие жесткость воды, железо, сульфиды, хлор, а также мутность.
Мешающее влияние жесткости воды устраняют прибавлением раствора Сегнетовой соли или комплексом (III). Мутные растворы центрифугируют или фильтруют с помощью стеклянной ваты, стеклянного или бумажного фильтра «белая лента», предварительно промытого безаммиачной водой до отсутствия аммиака в фильтре.
Большое количество железа, сульфидов и мутность удаляют с помощью раствора сульфата цинка (см. п. 7.5.8). К 100 см 3 пробы прибавляют 1 см 3 раствора и смесь тщательно перемешивают. Затем рН смеси доводят до 10,5 добавлением 25 %-ного раствора едкого калия или натрия. Проверяют значение рН на рН-метре. После взбалтывания и образования хлопьев осадок отделяют центрифугированием или фильтрованием через стеклянный фильтр (допускается использование бумажного фильтра «белая лента»), предварительно освобожденного от аммиака. Увеличение объема жидкости необходимо учитывать при расчете.
7.4.3 . Мешающее влияние хлора устраняют добавлением раствора тиосульфата или арсенита натрия. Для удаления 0,5 мг хлора достаточно прибавить 1 см 3 одного из указанных растворов (см. п.п. 7.5.11 , 7.5.13 ).
7.4.4 . В присутствии нелетучих органических соединений, например, гуминовых веществ, определение ионов аммония проводят после дистилляции.
7.4.5 . Кальций в концентрациях, превышающих 250 мг/дм 3 , оказывает влияние на установление рН. В этом случае раствор подщелачивают буферным фосфатным раствором и смесь обрабатывают кислотой или щелочью до рН — 7,4 (см. п. 8.2 «Выполнение измерений»).
7.4.6 . Летучие органические соединения, которые мешают определению аммиака в дистилляте, устраняют кипячением слабо подкисленной пробы (см. п. 8.3 «Выполнение измерений»).
7.4.7 . Мутная или цветная вода (при цветности выше 20 ° ) подвергается коагуляции гидроокисью алюминия: к 300 см 3 исследуемой воды прибавляют 2 — 5 см 3 суспензии или 0,5 г сухой окиси алюминия, встряхивают. После 2-часового отстаивания отбирают для анализа прозрачный бесцветный слой.
Если проба воды не осветляется с помощью гидроксида алюминия, ее анализируют после предварительной отгонки (см. п. 8.3 «Выполнение измерений. Определение с перегонкой»).
7.5.1 . Приготовление бидистиллята, не содержащего аммиака
Дважды перегнанную воду пропускают через колонку с катионитом КУ-2 или СБС или: вторично перегоняют дистиллированную воду предварительно подкислив серной кислотой и добавив марганцовокислый калий до четкой малиновой окраски или: упаривают дистиллированную воду до 1/4 объема, после добавления двууглекислого натрия (0,1 — 0,5 г на 1 дм 3 ). Полученную воду проверяют на наличие аммиака реактивом Несслера и используют для приготовления реактивов и разбавления проб.
7.5.2 . Приготовление основного раствора хлористого аммония
2 ,9650 г аммония хлористого, подготовленного по ГОСТ 4212 , помещают в стакан, растворяют в небольшом количестве дистиллированной воды, переносят в мерную колбу на 1000 см 3 , а затем доводят до метки.
1 см 3 раствора содержит 1 мг NH 4 + . Приготовленный раствор хранят в банке из темного стекла в течение года.
7.5.3 . Приготовление рабочего раствора хлористого аммония
Раствор готовят в день проведения анализа, разбавлением основного стандартного раствора безаммиачной водой.
1 см 3 раствора содержит 0,005 мг NН4 + .
При наличии ГСО: раствор готовят в соответствии с прилагаемой к образцу инструкцией.
1 см 3 раствора должен содержать 0,005 мг N Н4 + .
7.5.4 . Приготовление боратного буферного раствора, рН = 9,5
К 500 см раствора 0,025 М тетрабората натрия приливают 88 см 3 0,1 М раствора гидроокиси натрия и разбавляют до 1 дм 3 безаммиачной водой. Хранят в течение 3 мес.
7.5.5 . Приготовление тетрабората натрия, 0,025 М водный раствор
9 ,5 г тетрабората натрия ( Na 2 B 4 О ∙ 10Н2О) помещают в стакан, растворяют в небольшом количестве безаммиачной воды, переносят в колбу на 1000 см 3 , а затем доводят до метки. Хранят в течение 3 мес.
7.5.6 . Приготовление фосфатного буферного раствора рН = 7,4
14 ,3 г безводного однозамещенного фосфорнокислого калия и 68,8 г безводного двузамещенного фосфорнокислого калия помещают в стакан, растворяют в небольшом количестве безаммиачной воды, не содержащей аммиака и аммонийных солей, переносят в мерную колбу на 1 дм 3 , и доводят до метки этой же водой.
Используют выпускаемый реактив по ТУ 6-09-2089.
В случае отсутствия готовят в лабораторных условиях из окиси ртути (II) одним из указанных методов.
Исходный материал: ртуть хлорная, ртуть йодная.
HgCl 2 (ртуть хлорная): готовят растворением окиси ртути в разбавленной соляной кислоте: HgO + 2HCl = HgCl 2 + Н2O
HgI 2 (ртуть йодная): получают при взаимодействии хлорной ртути с йодистым калием: HgCl 2 + 2KI = HgI 2 + 2KCl (Карякин Ю.В., Ангелов И.И. «Чистые химические вещества». М., Химия, 1974, с. 309 — 310, 314).
50 г иодида калия помещают в стакан, растворяют в 50 см 3 безаммиачной воды. Отдельно 30 г хлорида ртути ( II ) помещают в стакан, растворяют в 150 см 3 нагретой до кипения безаммиачной воды. Горячий раствор хлорида ртути приливают к раствору иодида калия до появления не исчезающего при перемешивании красного осадка. Затем фильтруют через стеклянный фильтр или слой прокаленного асбеста и к фильтрату прибавляют раствор 150 г едкого кали в 300 см 3 безаммиачной воды.
Разбавив полученный раствор до 1 дм 3 , вводят в него еще 5 см 3 насыщенного раствора хлорида ртути (II ) и оставляют в темном месте до полного осветления. Хранят в темном месте, в склянке, закрытой корковой пробкой. При употреблении отбирают пипеткой прозрачную жидкость не взмучивая осадка со дна склянки.
Или: 100 г безводного иодида ртути ( II ) и 70 г безводного иодида калия помещают в стакан, растворяют в небольшом количестве безаммиачной воды, полученную смесь медленно, при непрерывном перемешивании переносят в охлажденный раствор, полученный при растворении 160 г едкого натра в 500 см 3 безаммиачной воды. Полученную смесь разбавляют безаммиачной водой до 1 дм 3 .
7.5.8 . Приготовление водного раствора сульфата цинка
100 г сульфата цинка помещают в стакан, растворяют в небольшом количестве безаммиачной воды, переносят в мерную колбу на 1 дм 3 и доводят до метки безаммиачной водой.
10 г гидроксида натрия помещают в стакан, растворяют в 60 см 3 безаммиачной воды. К полученному раствору добавляют 50 г трилона Б, переносят в мерную колбу на 100 см 3 и доводят до метки безаммиачной водой.
7.5.10 . Приготовление раствора калия натрия виннокислого (сегнетова соль)
50 г KNaC 4 H 4 O 6 ∙ 4Н2О помещают в стакан, растворяют в небольшом количестве безаммиачной воды, переносят в мерную колбу на 100 см 3 , доводят до метки бидистиллированной водой, прибавляют 0,2 — 0,5 см 3 реактива Несслера. Раствор можно применять после осветления.
7.5.11 . Приготовление водного раствора арсенита натрия
1 г мышьяковистого натрия помещают в стакан, переносят в мерную колбу на 1 дм 3 и доводят до метки безаммиачной водой.
7.5.12 . Приготовление водного раствора сульфата натрия
0 ,9 г сернистокислого натрия помещают в стакан, растворяют в небольшом количестве безаммиачной воды, переносят в мерную колбу на 1 дм 3 и доводят до метки безаммиачной водой.
7.5.13 . Приготовление водного раствора тиосульфата натрия
3 ,5 г серноватистокислого натрия помещают в стакан, растворяют в небольшом количестве безаммиачной воды, переносят в мерную колбу на 1 дм 3 и доводят до метки безаммиачной водой.
40 г борной кислоты помещают в стакан, растворяют в небольшом количестве безаммиачной воды, переносят в мерную колбу на 1 дм 3 и доводят до метки безаммиачной водой.
7.5.15 . Приготовление гидроокиси алюминия, суспензии для коагуляции
125 г алюмокалиевых квасцов AIK (SО4)2 ∙ 12Н2О помещают в стакан, растворяют в небольшом количестве дистиллированной воды, переносят в мерную колбу на 1 дм 3 , доводят до метки дистиллированной водой, нагревают до 60 °С и постепенно прибавляют 55 см 3 концентрированного раствора аммиака при постоянном перемешивании. Дают смеси постоять около 1 часа, промывают осадок гидроксида алюминия многократной декантацией дистиллированной водой до удаления хлоридов, нитритов, нитратов и аммиака.
7.5.16 . Приготовление 1 М водного раствора серной кислоты
27 ,3 см 3 серной кислоты пл. 1,84 г/см 3 вносят небольшими порциями при перемешивании в 150 — 200 см 3 дистиллированной воды, переносят в мерную колбу вместимостью 1 дм 3 и доводят до метки дистиллированной водой.
7.5.17 . Приготовление 40 %-ного раствора гидроокиси натрия
40 г гидроокиси натрия помещают в стакан, растворяют в 60 см 3 безаммиачной воды.
7.5.18 . Приготовление 15 %-ного раствора гидроокиси натрия
15 г гидроокиси натрия помещают в стакан, растворяют в 85 см 3 безаммиачной воды.
7.5.19 . Приготовление 1 М раствора гидроокиси натрия
40 г гидроокиси натрия помещают в стакан, растворяют в небольшом количестве безаммиачной воды, переносят в мерную колбу на 1 дм 3 и доводят до метки безаммиачной водой. Хранят под защитой от контакта с воздухом.
К 10 см 3 пробы прибавляют несколько кристалликов сегнетовой соли и 0,5 см 3 реактива Несслера. Желтое окрашивание раствора, помутнение или выпадение желто-коричневого осадка указывает на присутствие ионов аммония. При повышенном содержании органических веществ, особенно гуминовых кислот, вызывающих усиление коричневой окраски после подщелачивания, проводят параллельный опыт, добавив к пробе сегнетову соль, а вместо реактива Несслера — 0,5 см 3 15 %-ного раствора гидроксида натрия.
К 50 см 3 первоначальной или осветленной пробы, или к меньшему ее объему, доведенному до 50 см 3 безаммиачной водой, прибавляют 1 — 2 капли раствора сегнетовой соли или комплексона III и смесь тщательно перемешивают. При анализе очень жестких вод количество добавляемого раствора сегнетовой соли или комплексона III увеличивается до 0,5 — 1,0 см 3 . Затем добавляют 1 см 3 реактива Несслера и снова перемешивают. Через 10 минут измеряют оптическую плотность. Окраска смеси устойчива в течение 30 мин. Из величины оптической плотности вычитают оптическую плотность холостого опыта. Если необходимо, вычитают и оптическую плотность пробы, к которой вместо реактива Несслера добавляют 1 см 3 15 %-ного раствора едкого натра и по графику находят содержание ионов аммония.
При анализе окрашенных проб, а также в присутствии мешающих органических соединений производят предварительную отгонку аммиака из исследуемой воды.
Отгонку аммиака из проб природных и сточных вод, содержащих легко гидролизуемые органические соединения, проводят при рН ÷ 7,4 добавляя к пробе фосфатный буферный раствор; в присутствии цианидов и большинства азотсодержащих органических соединений следует использовать боратный буферный раствор (рН ÷ 9,5). При анализе сточных вод, содержащих большие количества фенолов (воды коксохимических, газогенераторных предприятий) к пробе воды добавляют 40 %-ный раствор гидроксида натрия. Если наряду с фенолами присутствуют вещества, гидролизующиеся в щелочной среде, то отгонку надо провести дважды: сначала при рН ÷ 7,4 собирая отгон в разбавленный раствор серной кислоты, затем подщелочить этот отгон до сильнощелочной реакции.
Для поглощения аммиака применяют растворы борной или серной кислот или безаммиачную воду.
Перегонку исследуемых проб проводят в комнате, воздух которой не содержит аммиака.
В колбу для отгона помещают 400 см 3 анализируемой пробы воды (или меньший объем, доведенный до 400 см 3 безаммиачной водой). Если проба воды содержит большое количество взвешенных веществ или нефтепродуктов, ее предварительно фильтруют через фильтр «белая лента». При необходимости пробу воды дехлорируют одним из реагентов, рекомендованных в п. 7.4.3. Если надо, нейтрализуют пробу (до рН ÷ 7) 1 М раствором серной кислоты или гидроксида натрия. Затем приливают 25 см 3 буферного раствора (рН ÷ 7,4 или 9,5 в зависимости от предполагаемых загрязнений) или 20 см 3 40 %-ного раствора гидроокиси натрия при анализе фенольных вод. В приемник наливают 50 см 3 поглощающего раствора и устанавливают объем жидкости так, чтобы конец холодильника был погружен в нее, добавляя при необходимости безаммиачную воду. Отгоняют примерно 300 см 3 жидкости, отгон количественно переносят в мерную колбу на 500 см 3 , измеряют рН полученного отгона (по рН-метру) и при необходимости доводят рН раствора до 6,0, затем разбавляют до метки безаммиачной водой.
В 50 см 3 аликвотной части определяют содержание ионов аммония, как указано в п. 8.2. При измерении оптической плотности используют кюветы толщиной слоя 1 — 5 см в зависимости от содержания ионов аммония в растворе.
В мерные колбы вместимостью 50 см 3 вносят 0,0; 0,5; 1,0; 2,0; 4,0; 6,0; 8,0; 10,0; . 40,0 см 3 рабочего стандартного раствора аммония (п. 7.5.3), доводят до метки безаммиачной водой. Полученную шкалу растворов с содержанием 0,0; 0,0025; 0,005; 0,01; 0,02; 0,03; 0,04; 0,05; . 0,2 мг NH 4 + обрабатывают описанным выше (п. 8.2) способом.
График строят методом наименьших квадратов в координатах оптическая плотность — содержание ионов аммония (мг); вводят поправку на холостой опыт.
Для растворов с содержанием 0,0 — 0,03 мг ионов аммония строят график, используя кюветы толщиной слоя 5 см; для растворов, содержащих 0,03 — 0,20 мг NH 4 + — график с использованием кюветы с толщиной слоя 1 см.
Контроль стабильности градуировочной характеристики проводят не реже одного раза в квартал или при смене партий реактивов. Средствами контроля являются вновь приготовленные образцы для градуировки (не менее 3 образцов из приведенных в п. 8.4).
Градуировочную характеристику считают стабильной при выполнении для каждого образца для градуировки следующего условия:
где X — результат контрольного измерений массовой концентрации ионов аммония в образце для градуировки;
С — аттестованное значение массовой концентрации ионов аммония в образце для градуировки;
s Rл _ среднеквадратическое отклонение внутрилабораторной прецизионности, установленное при реализации методики в лаборатории.
Примечание. Допустимо среднеквадратическое отклонение внутрилабораторной прецизионности при внедрении методики в лаборатории устанавливать на основе выражения: s Rл = 0,84 s r , с последующим уточнением по мере накопления информации в процессе контроля стабильности результатов анализа.
Значения s r приведены в таблице 1.
Если условие стабильности градуировочной характеристики не выполняется только для одного образца для градуировки, необходимо выполнить повторное измерение этого образца с целью исключения результата содержащего грубую погрешность.
Если градуировочная характеристика нестабильна, выясняют причины и повторяют контроль с использованием других образцов для градуировки, предусмотренных методикой. При повторном обнаружении нестабильности градуировочной характеристики строят новый градуировочный график.
Содержание ионов аммония NH 4 + в мг/дм 3 вычисляют по формуле:
где С — содержание ионов аммония, найденное по калибровочному графику, мг,
V — объем пробы, взятой для анализа, см 3 ;
n = 1 при прямом определении ионов аммония;
n = 10 при определении с предварительной отгонкой аммиака (т.к. для анализа используется 1/10 отгона).
За результат анализа Хср принимают среднее арифметическое значение двух параллельных определений Х1 и Х2.
для которых выполняется следующее условие:
где r — предел повторяемости, значения которого приведены в таблице 2.
Значения предела повторяемости при вероятности Р = 0,95
Предел повторяемости (относительное значение допускаемого расхождения между двумя результатами параллельных определений), r, %
При невыполнении условия (1) могут быть использованы методы проверки приемлемости результатов параллельных определений и установления окончательного результата согласно раздела 5 ГОСТ Р ИСО 5725-6.
Расхождение между результатами анализа, полученными в двух лабораториях, не должно превышать предела воспроизводимости. При выполнении этого условия приемлемы оба результата анализа, и в качестве окончательного может быть использовано их среднее арифметическое значение. Значения предела воспроизводимости приведены в таблице 3.
Значения предела воспроизводимости при вероятности Р = 0,95
Предел воспроизводимости (относительное значение допускаемого расхождения между двумя результатами измерений, полученными в разных лабораториях), R, %
При превышении предела воспроизводимости могут быть использованы методы оценки приемлемости результатов анализа согласно раздела 5 ГОСТ Р ИСО 5725-6.
10.1 . Результат анализа Хср в документах, предусматривающих его использование, может быть представлен в виде: Хср ± D , Р = 0,95
где D — показатель точности методики.
Значение D рассчитывают по формуле: D = 0,01 ∙ δ ∙ X ср . Значение δ приведено в таблице 1 .
Допустимо результат анализа в документах, выдаваемых лабораторией, представлять в виде: Хср ± D л , Р = 0,95, при условии D л D ,
где Хср— результат анализа, полученный в соответствии с прописью методики;
± D л — значение характеристики погрешности результатов анализа, установленное при реализации методики в лаборатории, и обеспечиваемое контролем стабильности результатов анализа.
Примечание. При представлении результата анализа в документах, выдаваемых лабораторией, указывают:
— количество результатов параллельных определений, использованных для расчета результата анализа;
— способ определения результата анализа (среднее арифметическое значение или медиана результатов параллельных определений).
10.2 . В том случае, если массовая концентрация ионов аммония в анализируемой пробе превышает верхнюю границу диапазона, то допускается разбавление пробы таким образом, чтобы массовая концентрация ионов аммония соответствовала регламентированному диапазону.
Результат анализа Хср в документах, предусматривающих его использование, может быть представлен в виде: Хср± D ‘, Р = 0,95 , где ± D ‘ — значение характеристики погрешности результатов анализа, откорректированное на величину погрешности взятия аликвоты.
Контроль качества результатов анализа при реализации методики в лаборатории предусматривает:
— оперативный контроль процедуры анализа (на основе оценки погрешности при реализации отдельно взятой контрольной процедуры);
— контроль стабильности результатов анализа (на основе контроля стабильности среднеквадратического отклонения повторяемости, среднеквадратического отклонения внутрилабораторной прецизионности, погрешности).
Оперативный контроль процедуры анализа проводят путем сравнения результата отдельно взятой контрольной процедуры Кк с нормативом контроля К.
Результат контрольной процедуры Кк рассчитывают по формуле:
где х ‘ ср — результат анализа массовой концентрации ионов аммония в пробе с известной добавкой — среднее арифметическое двух результатов параллельных определений, расхождение между которыми удовлетворяет условию (1) раздела 9.
X ср — результат анализа массовой концентрации ионов аммония в исходной пробе — среднее арифметическое двух результатов параллельных определений, расхождение между которыми удовлетворяет условию (1) раздела 9 .
Норматив контроля К рассчитывают по формуле
где — значения характеристики погрешности результатов анализа, установленные в лаборатории при реализации методики, соответствующие массовой концентрации ионов аммония в пробе с известной добавкой и в исходной пробе соответственно.
Примечание. Допустимо характеристику погрешности результатов анализа при внедрении методики в лаборатории устанавливать на основе выражения: D л = 0,84 D , с последующим уточнением по мере накопления информации в процессе контроля стабильности результатов анализа.
Процедуру анализа признают удовлетворительной, при выполнении условия:
При невыполнении условия (2) контрольную процедуру повторяют. При повторном невыполнении условия (2) выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
Оперативный контроль процедуры анализа проводят путем сравнения результата отдельно взятой контрольной процедуры Кк с нормативом контроля К.
Результат контрольной процедуры Кк рассчитывают по формуле:
где Сср — результат анализа массовой концентрации ионов аммония в образце для контроля — среднее арифметическое двух результатов параллельных определений, расхождение между которыми удовлетворяет условию (1) раздела 9;
С — аттестованное значение образца для контроля.
Норматив контроля К рассчитывают по формуле:
где ± D л — характеристика погрешности результатов анализа, соответствующая аттестованному значению образца для контроля.
Примечание. Допустимо характеристику погрешности результатов анализа при внедрении методики в лаборатории устанавливать на основе выражения: D л = 0,84 D , с последующим уточнением по мере накопления информации в процессе контроля стабильности результатов анализа.
Процедуру анализа признают удовлетворительной, при выполнении условия:
При невыполнении условия (3) контрольную процедуру повторяют. При повторном невыполнении условия (3) выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
Периодичность оперативного контроля процедуры анализа, а также реализуемые процедуры контроля стабильности результатов анализа регламентируют в Руководстве по качеству лаборатории.
источник