За период с 27.03.2015г по 02.04.2015г специалисты отдела ветеринарно-санитарной экспертизы ФГБУ «Центральная научно-производственная ветеринарная радиологическая лаборатория» обнаружили общие колиформные бактерии и термотолерантные колиформные бактерии в двух пробах воды артезианской разливаемой через сеть автоматов по розливу воды в тару потребителей.
ОКБ — содержание в воде общих колиформных бактерий индикатор качества питьевой воды. Они легко поддаются обнаружению и количественному подсчету, поэтому на протяжении многих лет их используют как своеобразный показатель качества воды.
ОКБ — это международная квалификация, и они входят в большую группу БГКП (бактерии группы кишечных палочек). Содержание в воде ОКБ можно определять двумя методами: методом мембранных фильтров и титрационным (бродильным) методом.
Исследование воды методом мембранных фильтров. Метод основан на фильтрации установленного объема воды через мембранные фильтры, выращивании посевов на дифференциально-диагностической среде и последующей идентификации колоний по культуральным и биохимическим признакам.
Титрационный метод исследования воды. Метод основан на накоплении бактерий после посева установленного объема воды в жидкую питательную среду, с последующим пересевом на дифференциально-диагностическую среду и идентификации колоний по культуральным и биохимическим тестам.
«Колиформные организмы» принадлежат к классу граммоотрицательных бактерий, в форме палочек, которые живут и размножаются в нижнем отделе пищеварительного тракта человека и множества животных имеющих теплую кровь таких как — домашний скот и водоплавающие птицы, способных ферментировать лактозу при 35-37 0С с образованием кислоты, газа и альдегида. Попадая в воду с фекальными стоками они способны выживать в течении нескольких недель, хотя в подавляющем своем большинстве они лишены способности размножаться.
По данным исследований последних лет наряду с обыкновенно относимыми к этому классу бактериями Escherichia (E.Coli), Citrobacter, Enterobacter и Klebsiela к нему относится и способные ферментировать лактозу бактерии Enterobacter cloasae и Citrobadter freundii. Эти бактерии возможно обнаружить не только в фекалиях, но также в окружающей среде, и даже в питьевой воде с относительно большой концентрацией питательных веществ. Помимо этого сюда можно отнести виды, которые редко или совсем не обнаруживаются в фекалиях и способные размножаться в воде достаточно хорошего качества.
ТКБ — термотолерантные колиформные бактерии. Число ТКБ характеризует степень фекального загрязнения воды водных объектов и косвенно определяет эпидемическую опасность в отношении возбудителей кишечных инфекций. ТКБ определяют теми же методами, как и БГКП (ОКБ).
Отбор проб для санитарно-микробиологических исследований должен проводиться с соблюдением правил стерильности и всех не-обходимых условий, регламентированных для каждого исследуемого объекта соответствующими нормативными документами.
Ошибки, допущенные при взятии проб, приводят к получению неправильных результатов. При упаковке и транспортировке проб необходимо создавать условия, исключающие гибель или размножение исходной микробиоты в исследуе-мом объекте. Поэтому отобранные пробы должны быть как можно быстрее доставлены в лабораторию для исследования.
Содержание в воде ОКБ, ТКБ может явиться причиной инфекционного заболевания, вызываемого диареегенными кишечными палочками, характеризующиеся преимущественным по¬ражением желудочно-кишечного тракта с развитием интоксикации и диарейного синдрома, реже — генерализацией патологического процесса.
источник
Анализ водопроводной, бутилированной воды, а также воды из скважин, колодцев и т.д.
Анализ воды – исследование качества и свойств воды, определение количественного содержания веществ и примесей.
Существуют разные методы исследований в зависимости от вида объекта испытаний. Для каждого законодательными актами определен перечень показателей, по которым производится исследование проб.
Чтобы сдать воду на анализ и провести ее лабораторное исследование, следует обращаться в аккредитованные лаборатории. Экспертиза воды должна производиться с соблюдением требований нормативных документов, использованием аттестованного оборудования. В этом случае есть гарантия успешности и достоверности результатов, признания полученных результатов Роспотребнадзором, Мосводоканалом и другими органами.
Испытательная лаборатория «Веста» имеет бессрочный аттестат аккредитации и проводит экспертизу питьевой воды, санитарный, химический анализ, исследования воды из бассейнов, образцов сточных и технических вод. Мы оказываем услуги частным лицам и организациям.
Стоимость анализа воды от 250 руб за показатель.
Лабораторная экспертиза воды является частью экологических изысканий. Они необходимы для составления проектной документации, а также в следующих случаях:
- для оценки качества питьевой воды городских водопроводов;
- экспертизы качества воды из колодцев и скважин;
- определения эффективности очистки, контроля ресурса сменных фильтров;
- подтверждения пригодности бутилированной воды;
- оценки состояния воды в бассейнах;
- оценки качества дистиллированной воды;
- для предприятий, которые сбрасывают стоки в систему канализации или (после прохождения через очистные сооружения) в природный водоем.
Мы готовы оказать услуги всем, кому требуется оперативное и достоверное проведение анализа воды в Москве по доступной стоимости.
Химический анализ воды предполагает установление химического состава образцов:
- на 12 показателей (для проверки работы фильтров);
- на 24 показателя (подходит для оценки загрязненности);
- На 31 показатель для Мосводоканала.
В процессе химического анализа исследуются следующие показатели:
Бактериологическая экспертиза воды производится с целью выявления присутствия в ней опасных микроорганизмов.
В нашей лаборатории анализа воды можно также заказать по выгодным ценам:
- санитарно-микробиологическую экспертизу, которая производится при выборе и проверке питьевых и хозяйственных источников;
- исследование радиологических показателей (альфа-, бета-активность, радон и проч.).
После проведения исследований любого типа (химический, санитарный анализ и другие) выдается протокол исследования, содержащий сведения об объекте испытаний, результаты исследований, ссылки на методы исследований и требования НД к исследуемым показателям.
Преимущества проведения анализа воды в лаборатории «Веста»:
- Наша компания имеет десятилетний опыт работы.
- В штате лаборатории – кандидаты медицинских наук, химики и микробиологи, санитарные врачи с большим теоретическим багажом и огромным практическим опытом.
- В распоряжении персонала – уникальное высокочувствительное оборудование, референтные образцы и современные методы пробоподготовки.
- Внедренная в лаборатории система менеджмента качества проводимых исследований, постоянный контроль со стороны вышестоящих организаций, участие лаборатории в межлабораторных сравнительных испытаниях позволяет получать результаты с гарантированной точностью и достоверностью.
Наши многочисленные клиенты, отечественные и зарубежные компании, уже убедились в достоверности, высочайшем качестве и оптимальной стоимости проведения экспертизы воды.
| № | Наименование компонента | Нормативы СанПиН 2.1.4.1074-01, не более |
| 1 | Реакция среды, рН | 6,0-9,0 |
| 2 | Цветность, град | 20 |
| 3 | Мутность, ЕМФ | 2,6 |
| 4 | Жёсткость | 7,0 (10,0) мг-экв/л |
| 5 | Железо общее | 0,3 мг/л |
| 6 | Щелочность | Не нормируется |
| 7 | Перманганатная окисляемость | 5 мг/л |
| 8 | Аммоний, ионы по азоту | 2 (N) |
| 9 | Сульфаты, ионы | 500,0 мг/л |
| 10 | Сульфиды | 0,003 мг/л |
| 11 | Марганец | 0,1 мг/л |
| 12 | Сероводород | 0,003 мг/л |
| 13 | Нитриты | 3 мг/л |
| 14 | Нитраты | 45 мг/л |
| 15 | Электропроводность среды | Не нормируется |
Лаборатория экспертизы воды предлагает:
- сжатые сроки проведения исследований воды (от 3 до 10 дней);
- выгодные в Москве цены на услуги;
- идеальную точность результатов, их понятную интерпретацию;
- широкую область аккредитации: любой анализ или комплексную услугу;
- дальнейшие рекомендации по результатам исследований, направленные на улучшение качества воды.
Собственный автопарк, укомплектованный шестью автомобилями, – это возможность выезжать на объекты заказчиков, выполнять профессиональный забор проб, доставлять образцы для лабораторного анализа.
Внедренные стандарты ГОСТ ИСО/МЭК 17025-2009 – это ваша уверенность в чистой воде, юридическая гарантия точных и достоверных результатов!
источник
Несоответствие воды микробиологическим нормам, так же как и химическим, делает ее непригодной для питья. Если Ваш источник водоснабжения не защищен от прямого воздействия окружающей среды или коммунальные системы устарели или давно не чистились, то сделать микробиологический анализ воды просто необходимо. От этого зависит Ваше здоровье и безопасность! Особенно это важно для тех, кто пользуется колодцем. Колодезная вода – грунтовая, она на прямую контактирует с почвами, а значит, грозит «напоить» Вас и нитратами, и тяжелыми металлами, и аммиаком, и, конечно, вредными органическими веществами, которые попадают в почву в результате деятельности сельскохозяйственных ферм или угодий.
В таблице 1 представлены микробиологические показатели действующего норматива СанПиН 2.1.4.1074-01 для питьевой воды:
Таблица 1. Микробиологические нормативы для питьевой воды
| Показатель | Норматив СанПиН 2.1.4.1074-01 |
|---|---|
| Общая микробная численность | Не более 50 КОЕ в 1 мл |
| Общие колиформные бактерии | Отсутствие в 100 мл |
| Термотолерантные колиформные бактерии | Отсутствие в 100 мл |
| Колифаги | Отсутствие в 100 мл |
| Споры сульфитредуцирующих бактерий | Отсутствие в 20 мл |
Стандартный микробиологический анализ питьевой воды в МГУ включает определение трех показателей: общего микробного числа, количества общих колиформных и термотолерантных колиформных бактерий.
Расширенный микробиологический анализ воды включает анализ пяти показателей: общего микробного числа, количества общих колиформных бактерий, количества термотолерантных колиформных бактерий, титр колифагов и содержание спор сульфитредуцирующих бактерий.
Часто на наших участках или поблизости имеются водоемы, где мы и наши дети с удовольствием любим провести время. Конечно, вода в данных водоемах не является питьевой, но ее безопасность для человека также, как и питьевая, регламентируется. В таблице 2 представлены микробиологические показатели действующего норматива по гигиеническим требованиям к охране поверхностных вод (СанПиН 2.1.5.980-00)
Таблица 2. Микробиологические нормативы для рекреационного водопользования, а также в черте населенных мест
| Показатель | Норматив СанПиН 2.1.5.980-00 |
|---|---|
| Общие колиформные бактерии | Не более 500 КОЕ в 100 мл |
| Термотолерантные колиформные бактерии | Не более 100 КОЕ в 100 мл |
| Колифаги | Не более 100 БОЕ в 100 мл |
| Возбудители кишечных инфекций (анализ бактерий из сем. Enterobacteriaceae рода Salmonella) | Вода не должна содержать возбудителей кишечных инфекций (полное отсутствие в 1000 мл) |
Микробиологический анализ воды, предназначенной не для питья, включает определение количества двух показателей: общих колиформных и колиформных термотолерантных бактерий.
Помимо двух основных показателей мы предлагаем провести дополнительный анализ на содержание: колифагов, условно-патогенных дрожжей и микромицетов (частых спутников опортунистических заболеваний) и индекса самоочищения водоёма.
При значительном превышении нормативов СанПиН 2.1.5.980-00, а также возможном фекальном загрязнении водоёма, мы предлагаем провести анализ на наличие возбудителей кишечных инфекций (род Salmonella и Enterococcus).
Метод определяет в питьевой воде общее число мезофильных аэробных и факультативно анаэробных микроорганизмов (ОМЧ), способных образовывать колонии на питательном агаре при температуре 37 °С в течение 24 часов, видимые с увеличением в 2 раза. Данный индикатор выявляет потенциальных бактерий, способных причинить вред здоровью человека.
Общие колиформные бактерии (ОКБ) – грамотрицательные, оксидазоотрицательные, не образующие спор палочки, способные расти на дифференциальных лактозных средах, ферментирующие лактозу до кислоты, альдегида и газа при температуре (37+1) °С в течение (24-48) часов. Многие представители данной группы являются микроорганизмами нормальной микрофлоры желудка, поэтому превышение данной группы микроорганизмов может говорить о возможно антропогенном (в том числе и фекальном) загрязнении воды.
Термотолерантные колиформные бактерии (ТКБ) входят в число общих колиформных бактерий, обладают всеми их признаками и, кроме того, способны ферментировать лактозу до кислоты, альдегида и газа при температуре (44±0,5) °С в течение 24 часов. Также, как и ОКБ являются индикаторной группой, однако более устойчивые в окружающей среде: вот почему обнаружение данной группы микроорганизмов в воде может говорить об однозначном загрязнении ее продуктами жизнедеятельности человека.
Колифаги, определяемые стандартным методом (МУК 4.2.1018-01), являются вирусами кишечной палочки (Escherichia coli) и рассматриваются эпидемиологами как дополнительный, а порой и более чувствительный, метод в определении загрязнения воды микроорганизмами группы кишечной палочки. Вирусные частицы, и в частности колифаги, более устойчивы к окружающей среде, чем их бактерии-хозяева. В связи с этим, наличие колифагов может служить достоверной меткой о более давнем фекальном загрязнении источника воды. Показана прямая корреляция между содержанием колифагов в воде и опасных для человека энтеровирусов, поэтому наличие колифагов в воде может говорить о вирусном заражении источника. Действующий нормативный документ (СанПиН 2.1.4.1074-01) подразумевает отсутствие колифагов в 100 мл воды.
Сульфитредуцирующие клостридии – спорообразующие анаэробные палочковидные микроорганизмы, являющиеся дополнительным микробиологическим показателем фекального загрязнения водоема. В отличие от относительно неустойчивых колиформных и термотолерантных колиформных бактерий, споры клостридий могут сохраняться в водоемах долгое время. Клостридии встречаются в кишечнике человека и домашних животных, однако, при попадании с водой в большом количестве могут вызвать пищевые отравления. К сульфитредуцирующим клостридиям относятся в том числе и опасные для человека клостридии (Clostridiumbotulinum, Clostridium perfringens, Clostridium tetani), вызывающие тяжелейшие заболевания. Согласно действующему нормативу (СанПиН 2.1.4.1074-01) споры клостридий должны отсутствовать в 20 мл воды.
К условно-патогенным дрожжам и микромицетам (плесени) относят большую неоднородную группу грибных организмов, способных сапротрофно расти при 37 °С. В нее входят такие представители, как Candida albicans и Cryptococcus neoformans, которые являются частым фактором оппортунистических заболеваний человека, вызывая кандидозы (грибковые заболевания кожи), молочницы и проч. Другие организмы микромицеты (Cladosporium cladosporioides, Aspergillusniger) могут являться активными сенсебилизаторами аллергических реакций, а иногда и самими аллергенами. В РФ не нормируется вода по плесеням и дрожжевым организмам в воде.
Общее число микроорганизмов не нормируется в воде водоемов в зонах рекреаций, поскольку уровень этой группы микроорганизмов в большей мере зависит от природных особенностей каждого объекта, времени года и т.п.
Однако при выборе нового источника водоснабжения или места рекреации в воде водоёмов дополнительно следует определять общую микробную численность, вырастающую:
- при температуре 37 °С в течение 24 часов;
- при температуре 22 °С в течение 72 часов.
- ОМЧ при 37 °С представлена большей частью алохтонной микрофлорой (внесенную в водоем в результате антропогенного загрязнения, в том числе фекального);
- ОМЧ при 20-22 °С представлена, помимо алохтонной, аборигенной микрофлорой (естественной, свойственной для данного водоёма).
Соотношение численности этих групп микроорганизмов позволяет судить об интенсивности процесса самоочищения. При завершении процесса самоочищения коэффициент ОМЧ 22 °С/ ОМЧ 37 °С. В местах загрязнения хозяйственно-бытовыми сточными водами численные значения обеих групп близки.
Показатель позволяет получить дополнительную информацию о санитарном состоянии водоемов, источниках загрязнения, процессах самоочищения.
источник
Запах природной воды вызывают летучие пахнущие вещества, попадающие в воду естественным путем или со сточными водами. В родниках, содержащих только неорганические вещества, может быть запах сероводорода. Интенсивность запаха оценивается в баллах по пятибальной шкале, определяемой при температуре воды в 20°С. По ГОСТу питьевая вода может иметь запах до 2 баллов.
Основной запах в исследуемых родниках — сероводород. Источник сероводорода в природных водах — восстановительные процессы, протекающие при бактериальном разложении и биохимическом окислении органических веществ естественного происхождения и веществ, поступающих в водные объекты со сточными водами. Сероводород находится в водах родников в виде недессоциированных молекул Н2S и ионов гидросульфата НS. Наличие в воде сероводорода служит показателем ее сильного загрязнения и анаэробных условий. Является причиной невозможности её потребление, так как сероводород обладает высокой токсичностью, дурным запахом, который резко ухудшает органолептические свойства воды, делая её непригодной для питьевого водоснабжение, технических и хозяйственных целей.
Цветность обусловлена содержанием в воде окрашенных органических соединений, присутствием гуминовых соединений, содержанием трехвалентного железа, вымыванием из почвогрунтов различных веществ, поступлением загрязненных сточных вод. Гуминовые вещества – итог процесса разложения остатков растений – окрашивают воду, в зависимости от концентрации, в желтый или коричневый цвет. Степень цветности выражается в градусах платино–кобальтовой шкалы. Высокая или повышенная цветность отрицательно влияет на развитие живых организмов, ухудшает условия окисления растворенного в воде железа.
Норма цветности по СанПиН составляет 30 градусов.
Мутность по нормам СанПиН не должна превышать 1,5 мг/л. Мутность воды в родниках чаще всего зависит от наличия взвешенных частиц ила, тонкодисперсной глины, высокого содержания общего железа и ряда других веществ, нередко связана с не обустроенностью или плохой обустроенностью места выхода родников и емкостей накопления воды, низким дебитом родников.
Водородный показатель (рН) – величина, характеризующая активность концентрации ионов водорода в растворах и численно равная отрицательному десятичному логарифму этой активности или концентрации, выраженной в моль/дм3:
Если в воде при 22°С содержится 10-7,2 моль/дм3 ионов водорода (Н+), то она будет обладать нейтральной реакцией; при меньшем содержании Н+ реакция будет щелочной, при большей – кислотной. Таким образом, при рН =7,2 реакция воды нейтральна, при рН 7,2 – щелочная.
Водородный показатель играет важную роль в определении качества воды. В речных и родниковых водах его значение колеблется от 6 до 8,5. Концентрация подвержена сезонным колебаниям – зимой она обычно равна 6,8 – 7,4, летом – 7,4 — 8,2.
Концентрация ионов водорода имеет большое значение для химических и биологических процессов, протекающих в природных водах. От него зависит развитие и жизнедеятельность водных растений, устойчивость различных форм миграции элементов, степень агрессивности воды по отношению к металлам, бетону и др.
Для человека слабокислые воды (рН – 6,7 – 6,8) кажутся более вкусными, чем щелочные, поэтому зимние холодные воды «вкуснее» теплых летних вод.
Жесткость – свойство природной воды, определяемое присутствием в ней растворенных солей щелочно-земельных металлов – кальция, магния и некоторых других. Основными характеристиками, определяющими жесткость воды, является наличие в воде ионов кальция и магния. Верхний предел жесткости питьевой воды в системах водоснабжения по действующим санитарным нормам не должен превышать 7-10 мг*экв/л. Один миллиэквивалент жесткости отвечает содержанию 20,04 мг/л Ca2+ или 12,16 мг/л Mg2+. При длительном кипячении воды из нее выделяется диоксид углерода и выпадает осадок, состоящий из карбоната кальция, при этом жесткость воды уменьшается. Поэтому применяют термин «временная или устранимая жесткость воды», понимая при этом присутствие в воде гидрокарбонатных солей, которые могут быть удалены из воды кипячением в течение одного часа. Оставшаяся после кипячения жесткость воды называется постоянной.
Жесткость природной воды колеблется в широких пределах. В одном и том же водном объекте значения ее изменяются в зависимости от времени.
Классифицируются природные воды по общей жесткости следующим образом:
Очень мягкая – до 1,5 ммоль/дм3
умеренно жесткая -3,0 – 6,0 ммоль/дм3
очень жесткая > 9,0 ммоль/дм3.
По действующему стандарту жесткость питьевой воды не должна превышать 7 ммоль/дм3. Для питья допускается использование относительно жестких вод, так как наличие солей кальция и магния невредно для здоровья и не ухудшает вкусовых качеств воды.
Последние исследования установили, что жесткая вода, в которой много солей кальция и магния, создает дополнительную нагрузку на почки и может стать причиной образования в них камней. Наиболее благоприятна для организма человека вода с жесткостью 3 – 4,5 ммоль/дм3. Вода с низкой жесткостью вымывает из организма соли и тогда возникает угроза остеопороза. С другой стороны, имеются исследования, выявляющие снижение риска сердечно-сосудистых заболеваний при постоянном потреблении воды с высокой жесткостью.
Сухой остаток – это сумма всех примесей воды, определяемая путем выпаривания пробы. Сухой остаток характеризует общую минерализацию воды. Пригодные для водоснабжения воды не должны иметь минерализацию выше 1000 мг/дм3. По степени минерализации воды принято подразделять на четыре группы: ультрапресные с содержанием солей до 200 мг/дм3, пресные – от 200 до 500, повышенной минерализации – от 500 до 1000 и высокой минерализации – выше 1000 мг/дм3.
С увеличением общего содержания солей повышается электропроводность воды и это приводит к ускорению коррозионных процессов. Повышенная концентрация солей может привести к уменьшению растительности и кислорода.
Нитриты (NO2-) в природных водах встречаются в связи с разложением органических веществ и их нитрификацией. Нитриты – неустойчивые компоненты природных вод. Наибольшая их концентрация (до 10 – 20 мг/дм3 азота) наблюдается во время летней стагнации. При достаточной концентрации кислорода процесс окисления идет дальше под действием бактерий, и нитриты окисляются до нитратов.
Повышенное содержание нитритов указывает на наличие процессов разложения органических веществ в условиях медленного окисления NO2- в NO3- , что указывает на загрязнение водного объекта органическими веществами, т.е. является важным санитарным показателем.
ПДК нитритов в питьевой воде 3,0 мг/дм3.
Нитраты (NO3-) – соединения азотной кислоты. Присутствие нитратных ионов в природных водах связано с внутриводоемными процессами нитрификации аммонийных ионов в присутствии кислорода под действием нитрифицирующих бактерий.. Содержание нитратов увеличивается к осени и достигает максимума зимой. Повышенное содержание нитратов указывает на ухудшение санитарного состояния водного объекта. При этом нитраты являются наименее токсичной формой из всех соединений азота (нитритов, аммония) и могут нанести вред здоровью только при очень высоких концентрациях.
ПДК нитратов в питьевой воде 45 мг/дм3.
Хлориды — хлоридные ионы относятся к главным ионам химического состава природных вод. Концентрация хлоридов в родниках колеблется от долей миллиграмма до сотен и тысяч в 1 дм3.
Первичным источником хлоридов в природных водах являются магматические породы, в состав которых входят хлорсодержащие минералы (содалит, хлорапатит и др.). Значительное количество хлоридов поступают в природные воды из океана через атмосферу. Хлориды обладают большой миграционной способностью, слабовыраженной способностью к сорбции на взвешенных веществах и к потреблению водными организмами.
Повышенное содержание хлоридов ухудшает вкусовые качества воды и делает её малопригодной для питьевого водоснабжения. Концентрация хлоридов в поверхностных водах подвержена заметным сезонным колебаниям, коррелирующим с изменениями минерализации воды. ПДК хлоридов составляет 350 мг/дм3.
Сульфаты — естественное содержание сульфатов в грунтовых водах обусловлено выветриванием пород и биохимическими процессами, происходящими в водоносных слоях. Часть их поступает в процессе отмирания организмов и окисления веществ растительного и животного происхождения. Повышенное содержание сульфатов ухудшает органолептические свойства воды и оказывает неблагоприятные физиологические воздействия на организм человека.
В аэробных условиях сульфаты не изменяются, а в анаэробных сульфаты восстанавливаются облигатными сульфатредуцирующими бактериями до сульфидов, которые выпадают затем в осадок преимущественно в виде сульфида железа. Этот процесс наблюдается в емкостях накопления родниковых вод и колодцев, если они мало используются, и в них застаивается вода.
ПДК в питьевых водах до 500 мг/дм3.
Соединения железа почти всегда присутствуют в природных водах. Формы присутствия железа в воде многообразны. В двухвалентном состоянии железо может присутствовать в воде лишь при низких значениях рН и Еh. Следует отметить, что усваиваться организмом может только двухвалентное железо, а не наиболее его распространенная его трехвалентная форма.
Соединения железа присутствуют в воде в растворенной, коллоидной и нерастворенной форме.
Повышенное содержание в питьевой воде более 1 мг/дм3 железа ухудшает качество воды и возможность ее использования для пищевых целей. Слишком высокое содержание железа в пищевом рационе может вызывать многочисленные неблагоприятные последствия для организма.
Анализ воды обычно проводится по следующим параметрам:
ОКБ — содержание в воде общих колиформных бактерий индикатор качества питьевой воды. Они легко поддаются обнаружению и количественному подсчету, поэтому на протяжении многих лет их используют как своеобразный показатель качества воды.
ОКБ — это международная квалификация, и они входят в большую группу БГКП (бактерии группы кишечных палочек). Содержание в воде ОКБ можно определять двумя методами: методом мембранных фильтров и титрационным (бродильным) методом.
Исследование воды методом мембранных фильтров. Метод основан на фильтрации установленного объема воды через мембранные фильтры, выращивании посевов на дифференциально-диагностической среде и последующей идентификации колоний по культуральным и биохимическим признакам.
Титрационный метод исследования воды. Метод основан на накоплении бактерий после посева установленного объема воды в жидкую питательную среду, с последующим пересевом на дифференциально-диагностическую среду и идентификации колоний по культуральным и биохимическим тестам.
«Колиформные организмы» принадлежат к классу граммоотрицательных бактерий, в форме палочек, которые живут и размножаются в нижнем отделе пищеварительного тракта человека и множества животных имеющих теплую кровь таких как — домашний скот и водоплавающие птицы, способных ферментировать лактозу при 35-37 С с образованием кислоты, газа и альдегида. Попадая в воду с фекальными стоками они способны выживать в течении нескольких недель, хотя в подавляющем своем большинстве они лишены способности размножаться.
По данным исследований последних лет наряду с обыкновенно относимыми к этому классу бактериями Escherichia (E.Coli), Citrobacter, Enterobacter и Klebsiela к нему относится и способные ферментировать лактозу бактерии Enterobacter cloasae и Citrobadter freundii. Эти бактерии возможно обнаружить не только в фекалиях, но также в окружающей среде, и даже в питьевой воде с относительно большой концентрацией питательных веществ. Помимо этого сюда можно отнести виды, которые редко или совсем не обнаруживаются в фекалиях и способные размножаться в воде достаточно хорошего качества.
ТКБ — термотолерантные колиформные бактерии. Число ТКБ характеризует степень фекального загрязнения воды водных объектов и косвенно определяет эпидемическую опасность в отношении возбудителей кишечных инфекций. ТКБ определяют теми же методами, как и БГКП (ОКБ).
ОМЧ 37 — общее микробное число. Определение количества патогенных бактерий при биологическом анализе воды представляет собой непростую и трудоемкую задачу, в качестве критерия бактериологической загрязненности используют подсчет общего числа образующих колонии бактерий (Colony forming Units — CFU) в 1 мл воды.
источник
1.1. Настоящие методические указания устанавливают методы санитарно-микробиологического контроля качества питьевой воды в отношении ее эпидемической безопасности по показателям СанПиН 2.1.4.559-96 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества».
1.2. Методические указания предназначены для лабораторий организаций, предприятий и иных хозяйственных субъектов, осуществляющих производственный контроль, а также органов санитарно-эпидемиологической службы, обеспечивающих государственный и ведомственный санитарно-эпидемиологический надзор за качеством питьевой воды централизованных систем питьевого водоснабжения.
2.1. Санитарные правила и нормы. «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества». СанПиН 2.1.4.559-96.
2.3. ГОСТ 18963-73. Вода питьевая. Методы санитарно-бактериологического анализа.
3.1.1. Отбор проб производит специалист после прохождения инструктажа по технике выполнения отбора проб для микробиологического анализа.
3.1.2. Для отбора проб воды используют специально предназначенную для этих целей одноразовую посуду или емкости многократного применения, изготовленные из материалов, не влияющих на жизнедеятельность микроорганизмов.
3.1.3. Емкости должны быть оснащены плотно закрывающимися пробками (силиконовыми, резиновыми или из других материалов) и защитным колпачком (из алюминиевой фольги, плотной бумаги). Многоразовая посуда, в т.ч. пробки, должна выдерживать стерилизацию сухим жаром или автоклавированием.
3.1.4. При отборе проб в одной и той же точке для различных целей первыми отбирают пробы для бактериологических исследований. Если отбирают воду после обеззараживания химическими реагентами, то для нейтрализации остаточного количества дезинфектанта в емкость, предназначенную для отбора проб, вносят до стерилизации натрий серноватисто-кислый в виде кристаллов из расчета 10 мг на 500 мл воды.
3.1.5. Пробу отбирают в стерильные емкости. Емкость открывают непосредственно перед отбором, удаляя пробку вместе со стерильным колпачком. Во время отбора пробка и края емкости не должны чего-либо касаться. Ополаскивать посуду запрещается.
При заполнении емкостей должно оставаться пространство между пробкой и поверхностью воды, чтобы пробка не смачивалась при транспортировании.
После наполнения емкость закрывают стерильной пробкой и колпачком.
3.1.7. Отобранную пробу маркируют и сопровождают документом отбора проб воды с указанием места, даты, времени забора, фамилии специалиста, отбиравшего пробу, и другой информации.
3.2.1. Доставку проб питьевой воды осуществляют в контейнерах-холодильниках при температуре (4 — 10) °С. В холодный период года контейнеры должны быть снабжены термоизолирующими прокладками, обеспечивающими предохранение проб от промерзания. При соблюдении указанных условий срок начала исследований от момента отбора проб не должен превышать 6 ч.
Если пробы нельзя охладить, их анализ следует провести в течение 2 ч после забора.
Если не может быть соблюдено время доставки пробы и температура хранения, анализ пробы проводить не следует.
Пробы питьевой воды должны доставляться в отдельных продезинфицированных контейнерах.
Термостат для температурного режима (37 ± 1) °С
Термостат для температурного режима (44 ± 1) °С
Термостат или водяная баня для температурного режима (44 ± 0,5) °С
Водяная баня для температурного режима (75 ± 5) °С
Водяная баня или термостат для температурного режима (45 — 49) °С (для питательных сред)
Прибор для мембранной фильтрации под вакуумом с диаметром фильтрующей поверхности 35 или 47 мм и устройство для создания разрежения (0,5 — 1,0) атм
Весы лабораторные общего назначения 4 кл. точности, с пределом взвешивания до 1000 г
Максимальный термометр ртутный с диапазоном измерения от 20 до 200 °С с ценой деления шкалы 1 °С
Термометр ртутный с диапазоном измерения от 0 до 100 °С с ценой деления шкалы 0,5 °С
рН-метр, обеспечивающий измерение с погрешностью до 0,01
Дистиллятор, обеспечивающий качество дистиллированной воды не ниже
Стерилизатор суховоздушный для температурного режима (180 ± 5) °С
Холодильник бытовой электрический
Вытяжной шкаф для работы с хлороформом при проведении анализа на колифаги
Нагревательный прибор для варки питательных сред либо магнитные мешалки с подогревом до 300 °С
Прибор для счета колоний бактерий
Лупа с двукратным увеличением
Дозаторы для разлива питательных сред
Оптический стандарт мутности на 10 ед.
Горелки газовые или спиртовки
Пинцеты для работы с мембранными фильтрами
Мембранные фильтры для микробиологических целей с диаметром пор не более 0,45 мкм и размером диска 35 или 47 мм и другие фильтрующие мембраны с аналогичной способностью фильтрации, имеющие сертификат качества
Индикаторы бумажные для определения рН в диапазоне 6 — 8 с интервалом определения 0,2 — 0,3
Фольга алюминиевая, колпачки силиконовые, металлические
Пипетки, вместимостью 1,5, 10 мл с ценой деления 0,1 мл многоразового или одноразового использования)
Пробирки (многоразового или одноразового использования)
Цилиндры, вместимостью 100, 250, 500 мл или мензурки, вместимостью 250, 500, 1000 мл
Чашки бактериологические (Петри)
Пробки (силиконовые, резиновые и другие, выдерживающие стерилизацию сухим жаром или автоклавированием)
Бумага фильтровальная лабораторная
Вата хлопковая медицинская гигроскопическая
Карандаши или фломастеры по стеклу
Все химические реактивы должны соответствовать квалификации не ниже ч. д. а.
Железо серно-кислое закисное (7-водное)
Натрий серноватисто-кислый (тиосульфат натрия) 5-водный
Спирт этиловый ректификованный медицинский
Спирт этиловый технический
Натрий сернисто-кислый (сульфит натрия)
Фенилендиаминовые соединения* (тетраметил-п-фенилендиамин гидрохлорид, диметил-п-фенилендиамин соляно-кислый)
Генциан фиолетовый кристаллический
* Вещества обладают канцерогенным и мутагенным действием, работа с ними требует соблюдения мер предосторожности.
Сухой препарат с индикатором ВР и лактозой или среда Гисса с лактозой
Пептон сухой ферментативный для бактериологических целей
Системы индикаторные бумажные (СИБ)
Допускаются к использованию коммерческие питательные среды, диагностические препараты и системы идентификации производства зарубежных фирм, предназначенные для целей описываемых методов. Питательные среды и биологические препараты зарубежного производства должны иметь международный сертификат качества ISO 9000 или EN 29 000.
При использовании следует руководствоваться рекомендациями фирмы-производителя.
Все обезвоженные коммерческие питательные среды и препараты отечественного производства должны иметь сертификат соответствия.
4.5.1. Контрольный колифаг М82, штамм ВКПМ-3254 Е. coli К12 F + Str r получают в ГНИИ Генетика — Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ — Россия, 113545, г. Москва, 1-ый Дорожный проезд, д. 1).
4.5.2. Штамм Е. coli М17-02 и один из штаммов: Pseudomonas aeruginosa или Pseudomonas fluorescens получают в Государственном Национальном Органе контроля медицинских и биологических препаратов им. Л. А. Тарасовича Минздрава России (Россия, 121002, г. Москва, ул. Сивцев-Вражек, д. 41).
В производственных лабораториях, расположенных на территории водопроводных станции, следует использовать штамм Pseudomonas fluorescens .
Предпочтительно использование стандартизованных сухих питательных сред промышленного производства.
При использовании промышленных сухих питательных сред их приготавливают в соответствии с указаниями изготовителя на этикетке.
В этом случае следует соблюдать способ применения и срок хранения питательных сред, указанные на упаковках.
Сухие питательные среды хранят в сухих помещениях, в темноте, при комнатной температуре. Открытые упаковки тщательно закупоривают. Среды с измененным внешним видом (уплотненные, с комками), а также с истекшим сроком годности не используют.
Для приготовления растворов, реактивов и питательных сред применяют воду дистиллированную по ГОСТу 6709-72.
Питательные среды готовят в посуде из инертного материала.
Учитывая возможное изменение рН питательных сред после кипячения и стерилизации, окончательный контроль рН проводят в готовой среде при температуре 25 °С с использованием индикаторной бумаги.
После стерилизации питательные среды оставляют для охлаждения при комнатной температуре. При необходимости розлива в чашки Петри среды охлаждают до температуры (50 — 60) °С.
Температура сред, хранящихся в холодильнике, перед посевом должна быть доведена до комнатной.
5.3.3. Питательный агар запрещается выдерживать в расплавленном состоянии более 8 ч. Оставшийся неиспользованным агар повторному расплавлению не подлежит.
Готовят из сухого препарата по способу, указанному на этикетке. Если на поверхности среды заметны следы влаги, чашки перед посевом необходимо подсушить. Срок хранения чашек со средой не более 2 — 3 суток в темноте, если производителем не оговорены другие сроки.
5.4.2. Повышение дифференцирующих свойств среды
Для повышения дифференцирующих свойств среды в готовую и охлажденную до (60 — 70) °С среду перед разливкой в чашки допускается прибавлять на 100 мл среды 0,2 мл 5 %-ного спиртового раствора основного фуксина. Срок хранения раствора фуксина — не более 1 мес.
5.4.3. Модификация среды с добавлением розоловой кислоты
В случаях, когда мембранные фильтры зарастают микрофлорой, не относящейся к бактериям кишечной группы, помимо фуксина, допускается добавление на 100 мл среды Эндо 0,2 мл 5 %-ного спиртового раствора розоловой кислоты. Срок хранения раствора розоловой кислоты — не более 1 мес.
Модификацию среды Эндо с добавлением розоловой кислоты используют только при работе методом мембранной фильтрации.
10 г пептона, 5 г натрия хлористого, 5 г лактозы растворяют при нагревании в 1 л дистиллированной воды. После растворения ингредиентов устанавливают рН 7,4 — 7,6, разливают по 10 мл в пробирки, стерилизуют при (112 ± 2) °С 12 мин.
Для приготовления концентрированной лактозо-пептонной среды все ингредиенты, кроме воды, увеличивают в 10 раз, разливают по 1 мл в пробирки и по 10 мл во флаконы.
5.6.1. Полужидкая среда с лактозой из сухого препарата
Готовят по способу, указанному на этикетке.
Срок хранения — не более 2 недель при комнатной температуре.
Посев производят уколом до дна пробирки. При образовании кислоты цвет питательной среды изменяется в соответствии с использованным индикатором. При газообразовании газ скапливается или по уколу, или на поверхности, или в толще среды появляются разрывы. При инкубации посевов более 5 ч газ может улетучиться. В таких случаях на присутствие газа указывают оставшиеся в толще среды «карманы» — потемнения среды на месте бывшего пузырька газа.
5.6.2. Полужидкая среда с лактозой
Готовят при отсутствии сухого препарата.
В 1 л дистиллированной воды растворяют 10 г пептона, 5 г натрия хлористого, (4 — 5) г агар-агара, доводят до кипения, устанавливают рН 7,2 — 7,4, добавляют 1 мл 1,6 %-ного спиртового раствора бромтимолового синего. Стерилизуют при (120 ± 2) °С 20 мин. В расплавленную среду вносят 5 г лактозы, нагревают до кипения, разливают в стерильные пробирки на высоту (3 — 5) см и стерилизуют при (112 ± 2) °С 12 мин. Срок хранения — не более 2 недель при комнатной температуре.
Правильно приготовленная среда зеленого цвета с синеватым оттенком (цвет бутылочного стекла). При Образовании кислоты цвет среды изменяется на желтый.
5.6.3. Лактозо-пептонная среда
Готовят по п. 5.5 с добавлением 1 мл 1,6 %-ного спиртового раствора бромтимолового синего на 1 л и разливают по (3 — 5) мл в пробирки с поплавком.
Готовят по прописи завода-изготовителя.
1 %-ный водный раствор тетраметил-п-фенилендиамина гидрохлорид. Готовят перед употреблением.
Реактив № 1. 1 %-ный спиртовой раствор α-нафтола.
Реактив № 2. 1 %-ный водный раствор фенкпендиаминового соединения.
Растворы сохраняют в темных флаконах с притертыми пробками:
1 — до одного месяца, 2 — до одной недели. Перед употреблением к трем частям первого раствора добавляют семь частей второго раствора.
Могут быть использованы коммерческие тест-системы для постановки оксидазного теста (СИБ-оксидаза или аналоги).
Перед работой с каждой серией проб реактивы или тест-системы на оксидазу следует испытывать с тест-культурами микроорганизмов, дающих положительную ( Ps . aeruginosa , Ps . fluorescens ) и отрицательную оксидазную реакцию (E. coli).
В 1000 мл стерильного расплавленного питательного агара (по п. 5.4 ) добавляют 10 г глюкозы, нагревают до растворения, разливают мерно во флаконы, автоклавируют при (112 ± 2) °С 12 мин (основная среда).
20 %-ный раствор сульфита натрия ( Na 2 SO 3 ) и 8 %-ный раствор железа серно-кислого закисного ( FeSO 4 ) или железа хлористого ( FeCl 2 ) готовят непосредственно перед употреблением в стерильной посуде на стерильной дистиллированной воде. Раствор сульфита натрия нагревают до полного растворения. Перед выполнением анализа в 100 мл расплавленной основной среды вносят 5 мл 20 %-ного раствора сульфита натрия, перемешивают, затем вносят 1 мл 8 %-ного раствора сернокислого железа, перемешивают и стерильно разливают в пробирки высоким столбиком (12 — 15) см для работы методом мембранной фильтрации или во флаконы для работы методом прямого посева.
5.9.1. Карболовый раствор генциана фиолетового готовят следующим образом: 1 г генциана фиолетового, 10 мл ректификованного этилового спирта, 5 г фенола растирают в ступке, добавляя 100 мл дистиллированной воды.
5.9.2. Раствор Люголя готовят следующим образом: 1 г йода, 2 г йодистого калия растворяют в 300 мл дистиллированной воды. Хранить во флаконе из темного стекла.
5.9.3. Фуксин Циля готовят следующим образом: 1 г основного фуксина, 10 мл спирта этилового ректификованного, 54 г фенола растирают в ступке, добавляя 100 мл дистиллированной воды.
Лабораторную посуду моют, ополаскивают сначала водопроводной, затем дистиллированной водой и высушивают.
Пробирки, колбы, бутылки, флаконы закрывают силиконовыми или ватно-марлевыми пробками и колпачками (силиконовые, металлические, из фольги или плотной бумаги).
Пипетки со вставленными тампонами из ваты укладывают в металлические пеналы или заворачивают в бумагу.
Чашки Петри укладывают в металлические пеналы или заворачивают в бумагу. Бумага, используемая для обертывания лабораторной посуды, не должна разрушаться при стерилизации.
Подготовленную посуду стерилизуют в сушильном шкафу при температуре 160 °С в течение 2 ч или 180 °С 1 ч, считая с момента достижения указанной температуры. Стерильную посуду вынимают из стерилизационного шкафа после его охлаждения ниже 60 °С. Срок хранения стерильной посуды — не более 10 дней.
Материалы и лабораторную посуду, разрушающиеся при температуре (160 — 180) °С (резина и т.п.), следует стерилизовать в паровом стерилизаторе при температуре (121 ± 2) °С 20 мин.
Новые резиновые пробки кипятят в 2 %-ном растворе натрия двууглекислого 30 мин и 5 раз промывают водопроводной водой (кипячение и промывание повторяют дважды). Затем пробки кипятят в дистиллированной воде 30 мин, высушивают, заворачивают в бумагу или фольгу и стерилизуют в паровом стерилизаторе. Резиновые пробки, использованные ранее, обеззараживают, кипятят 30 мин в водопроводной воде с нейтральным моющим средством, промывают в водопроводной воде, высушивают, монтируют и стерилизуют.
После выполнения анализа все использованные чашки, пробирки и пипетки обеззараживают в автоклаве при (126 ± 2) °С в течение 60 мин, в исключительных случаях допускается обеззараживание кипячением в 2 %-ном растворе пищевой соды или 0,5 %-ном моющего средства в течение 60 мин с момента закипания (в закрытой емкости с полным погружением в раствор).
Перед посевом пробу тщательно перемешивают и фламбируют горящим тампоном край емкости. Используемые пробирки и чашки маркируют.
Перед каждым отбором новой порции воды для анализа пробу перемешивают стерильной пипеткой.
Мембранные фильтры должны быть подготовлены к анализу в соответствии с указаниями изготовителя.
Воронку и столик фильтровального аппарата обтирают марлевым (ватным) тампоном, смоченным спиртом ректификованным, и фламбируют. После охлаждения на столик фильтровального аппарата кладут фламбированным пинцетом стерильный мембранный фильтр, прижимают его воронкой.
В воронку прибора для фильтрования наливают отмеренный объем воды, затем создают вакуум.
При посеве нескольких объемов одной пробы следует фильтровать через один фильтровальный аппарат без обеззараживания сначала меньшие, а затем большие объемы воды, меняя каждый раз фильтры. Перед фильтрованием каждой новой пробы прибор обеззараживают.
Следует начинать с фильтрования проб обеззараженной воды или тех проб, которые предположительно не загрязнены, а затем фильтровать загрязненные пробы.
При фильтровании 1 мл исследуемой воды следует в воронку налить предварительно не менее 10 мл стерильной воды, а затем внести анализируемую воду.
После окончания фильтрования и осушения фильтра отключают вакуум, воронку снимают, фильтр осторожно поднимают за край фламбированным пинцетом и переносят его, не переворачивая, на питательную среду, разлитую в чашки Петри, избегая пузырьков воздуха между средой и фильтром. Поверхность фильтра с осевшими на ней бактериями должна быть обращена вверх.
Под каждым фильтром на дне чашки делают надпись с указанием объема профильтрованной воды, номера пробы и даты посева. На одну чашку можно поместить 3 — 4 фильтра с условием, чтобы фильтры не соприкасались.
8.1.1. Определение понятия показателя
Метод определяет в питьевой воде общее число мезофильных аэробных и факультативно анаэробных микроорганизмов (ОМЧ), способных образовывать колонии на питательном агаре при температуре 37 °С в течение 24 ч, видимые с увеличением в 2 раза.
Из каждой пробы делают посев не менее двух объемов по 1 мл.
После тщательного перемешивания пробы воды вносят по 1 мл в стерильные чашки Петри, слегка приоткрывая крышки. После внесения воды в каждую чашку вливают (8 — 12) мл (на чашку диаметром 90 — 100 мм) расплавленного и остуженного до (45 — 49) °С питательного агара после фламбирования края посуды, в которой он содержится. Затем быстро смешивают содержимое чашек, равномерно распределяя по всему дну, избегая образования пузырьков воздуха, попадания агара на края и крышку чашки. Эту процедуру производят на горизонтальной поверхности, где чашки оставляют до застывания агара.
Расплавленный агар на период проведения анализа помещают в водяную баню или термостат, поддерживающие температуру (45 — 49) °С.
После застывания агара чашки с посевами помещают в термостат вверх дном и инкубируют при температуре (37 ± 1) °С в течение (24 ± 2) ч.
Подсчитывают все выросшие на чашке колонии, наблюдаемые при увеличении в 2 раза. Учитывают только те чашки, на которых выросло не более 300 изолированных колоний.
Количество колоний на обеих чашках суммируют и делят на два. Результат выражают числом колониеобразующих единиц (КОЕ) в 1 мл исследуемой пробы воды.
Если на одной из 2 чашек подсчет невозможен, результат выдают на основании учета колоний на одной чашке. Если на двух чашках имеет место рост расплывчатых колоний, не распространяющийся на всю поверхность чашки, или выросло более 300 колоний и анализ нельзя повторить, подсчитывают сектор чашки с последующим пересчетом на всю поверхность. В этих случаях в протоколе отмечают «число КОЕ/мл — ориентировочно».
Если подсчет колоний на чашках невозможен, то в протоколе отмечают «сплошной рост».
8.2. Определение общих и термотолерантных колиформных бактерий методом мембранной фильтрации (основной метод)
Общие колиформные бактерии (ОКБ) — грамотрицательные, оксидазоотрицательные, не образующие спор палочки, способные расти на дифференциальных лактозных средах, ферментирующие лактозу до кислоты, альдегида и газа при температуре (37 + 1) °С в течение (24 — 48) ч.
Термотолерантные колиформные бактерии (ТКБ) входят в число общих колиформных бактерий, обладают всеми их признаками и, кроме того, способны ферментировать лактозу до кислоты, альдегида и газа при температуре (44 ± 0,5) °С в течение 24 ч.
Метод основан на фильтрации установленного объема воды через мембранные фильтры, выращивании посевов на дифференциальной питательной среде с лактозой и последующей идентификации колоний по культуральным и биохимическим свойствам.
8.2.3.1. Порядок исследования
При исследовании питьевой воды анализируют 3 объема по 100 мл.
При получении стабильных отрицательных результатов допустима фильтрация 300 мл воды через один фильтр.
При фильтрации воды неизвестного качества целесообразно увеличение количества фильтруемых объемов для получения изолированных колоний на фильтре (например, 10, 40, 100, 150 мл воды).
Отмеренный объем воды фильтруют через мембранные фильтры с соблюдением требований, изложенных в п. 7 .
Фильтры помещают на среду Эндо, приготовленную по п. 5.4 . Чашки с фильтрами ставят в термостат дном вверх и инкубируют посевы при температуре (37 ± 1) °С в течение (24 ± 2) ч.
Если на фильтрах нет роста или выросли колонии пленчатые, губчатые, плесневые, прозрачные, расплывчатые, выдают отрицательный ответ: отсутствие ОКБ и ТКБ в 100 мл исследуемой воды. Анализ заканчивают через 24 ч.
Если на фильтрах обнаружен рост изолированных типичных лактозоположительных колоний: темно-красных, красных с металлическим блеском или без него или других подобного типа колоний с отпечатком на обратной стороне фильтра, подсчитывают число колоний каждого типа отдельно и приступают к подтверждению их принадлежности к ОКБ и ТКБ.
Для подтверждения наличия ОКБ исследуют:
· все колонии, если на фильтрах выросло менее 5 колоний;
· не менее 3 — 4 колоний каждого типа.
Для подтверждения наличия ТКБ исследуют все типичные колонии, но не более 10.
Каждую выбранную изолированную колонию исследуют на:
· наличие оксидазной активности;
· принадлежность к Граму (микроскопия окрашенного по Граму препарата или постановка теста Грегерсена);
· ферментацию лактозы до кислоты и газа.
Полоску фильтровальной бумаги помещают в чистую чашку Петри и смачивают 2 — 3 каплями реактива для оксидазного теста по п. 5.7 . Готовые бумажные системы смачивают дистиллированной водой. Часть изолированной колонии стеклянной палочкой или платиновой петлей (металлическая петля из нихрома может дать ложноположительную реакцию) наносят штрихом на подготовленную фильтровальную бумагу. Реакция считается положительной, если в течение 1 мин появляется фиолетово-коричневое ( п. 5.7.1 вариант 1) или синее ( п. 5.7.2 вариант 2 и СИБ-оксидаза) окрашивание штриха. При отрицательной реакции цвет в месте нанесения культуры не меняется. При положительном результате эту колонию из дальнейшего исследования исключают.
Если при исследовании колоний, окрашенных в темно-красный цвет, получают недостаточно четкий результат, необходимо пересеять культуру со среды Эндо на питательный агар. После инкубации тест повторяют.
Из оксидазоотрицательной колонии делается мазок, окрашивается по Граму и микроскопируется.
На обезжиренное спиртом предметное стекло наносят петлей 1 каплю дистиллированной воды, вносят небольшое количество культуры из анализируемой колонии и распределяют по поверхности стекла. Мазок высушивают при комнатной температуре и фиксируют трехкратным проведением через пламя горелки. На препарат накладывают полоску фильтровальной бумаги и на нее наливают карболовый раствор генциана фиолетового на (0,5 — 1) мин, снимают бумагу, наливают раствор Люголя на (0,5 — 1) мин, сливают раствор Люголя и стекло промывают в этиловом спирте в течение (0,5 — 1) мин, пока не перестанет отходить краситель. Затем стекло тщательно промывают водой и докрашивают в течение (1 — 2) мин фуксином Циля, разведенным 1:10 дистиллированной водой. После промывания и просушивания препарата мазок микроскопируют.
Приготовление реактивов для окраски по Граму изложено в п. 5.9 .
Грамотрицательные микроорганизмы имеют розовую окраску, грамположительные окрашиваются в синий цвет. Колиформные бактерии являются грамотрицательными палочками.
Окраска по Граму может быть заменена тестом Грегерсена, не требующим использования оптики.
Тест Грегерсена: в капле 3 %-ного водного раствора КОН на предметном стекле эмульгируют бактерийную массу, взятую с плотной среды. После нескольких секунд перемешивания петлей взвесь ослизняется и за петлей тянутся слизистые нити, что указывает на принадлежность испытуемой культуры или колонии к грамотрицательному виду. У грамположительных бактерий слизистые нити не образуются — реакция отрицательная.
8.2.3.4. Определение ферментации лактозы
Оставшуюся часть оксидазоотрицательной грамотрицательной изолированной колонии засевают параллельно в две пробирки с лактозной средой ( п. 5.6 ):
· для подтверждения наличия ОКБ посев инкубируют при температуре (37 ± 1) °С в течение 48 ч;
· для подтверждения наличия ТКБ посев осуществляют в среду, предварительно прогретую до температуры (43 — 44) °С, и инкубируют при температуре (44 ± 0,5) °С в течение 24 ч.
Первичный учет образования кислоты и газа на подтверждающих полужидких средах и СИБ ( п. 5.6 ) возможен через (4 — 6) ч. При обнаружении кислоты и газа дают положительный ответ. При отсутствии кислоты и газа или при наличии только кислоты пробирки с посевами для окончательного учета ТКБ оставляют до 24 ч. Пробирки с посевами для подтверждения наличия ОКБ после просмотра через 24 ч и получения отрицательного результата оставляют для окончательного учета до 48 ч.
Если колония, подлежащая исследованию, незначительных размеров, ее пересевают на скошенный питательный агар и после инкубации в течение (18 — 24) ч выполняют все необходимые подтверждающие тесты.
Если на части или на всей поверхности фильтра наблюдается наложение колоний или сплошной рост, выполняют оксидазный тест путем помещения мембранного фильтра на кружок фильтровальной бумаги большего диаметра, чем фильтр, обильно смоченный реактивом, или на диск СИБ-оксидаза, смоченный дистиллированной водой. При появлении первых признаков реакции, но не более чем через 5 мин, мембранный фильтр переносят обратно на среду Эндо. После четкого проявления реакции определяют результат. При появлении фиолетово-коричневого или синего окрашивания (в зависимости от примененного реактива) оксидазный тест считают положительным.
Если на фильтрах все колонии оксидазоположительные, они не учитываются и выдают ответ об отсутствии ОКБ и ТКБ и завершают анализ.
При отрицательной оксидазной реакции проводят рассев до получения изолированных колоний и подтверждают их принадлежность к ОКБ и ТКБ по п. п. 8.2.3.3 — 8.2.3.4 (анализ качественный).
8.2.4.1. Грамотрицательные колонии учитываются как ОКБ при отрицательном оксидазном тесте и ферментации лактозы при температуре 37 °С с образованием кислоты и газа.
Грамотрицательные колонии учитываются как ТКБ при отрицательном оксидазном тесте и ферментации лактозы при температуре 44 °С с образованием кислоты и газа.
8.2.4.2. При отсутствии общих и термотолерантных колиформных бактерий на всех фильтрах результат записывают «не обнаружено КОЕ ОКБ в 100 мл» и «не обнаружено КОЕ ТКБ в 100 мл».
Вычисление проводят по формуле:
Х — число колоний в 100 мл;
V — профильтрованный объем воды через фильтры, на которых велся учет;
а — число подсчитанных на этих фильтрах колоний в сумме.
1. При посеве 3 фильтров по 100 мл выросло две колонии в 100 мл, на остальных двух фильтрах нет роста. Число общих или термотолерантных колиформных бактерий будет:
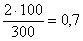
2. При посеве 10, 40, 100 и 150 мл на фильтрах с профильтрованным объемом 40 мл выросло 4 изолированные колонии, с профильтрованным объемом 100 — 3 ОКБ. Фильтры с объемами 10 мл и 150 мл заросли и учету не подлежат. Суммируют общее число колоний ОКБ (ТКБ) на тех фильтрах, где получены изолированные колонии, и пересчитывают на объем 100 мл.
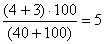
8.2.4.4. Если при выборочной проверке колоний одного типа получены неодинаковые результаты, то вычисляют числа ОКБ или ТКБ среди колоний этого типа по формуле:
Х — число подтвержденных бактерий одного типа;
а — общее число колоний этого типа;
b — число проверенных из них;
с — число колоний с положительным результатом.
Полученные результаты учета по каждому типу колоний суммируют и далее подсчитывают по п. 8.2.4.3 — 8.2.4.4 .
8.2.4.5. Окончательный результат выдают: количество КОЕ ОКБ в 100 мл, из них количество КОЕ ТКБ в 100 мл.
Ориентировочный результат может быть выдан при обнаружении типичных колиформных колоний на среде Эндо, образованных грамотрицательными оксидазоотрицательными бактериями. Окончательный ответ подтверждается по результатам ферментации лактозы.
8.2.4.6. При наложении колоний или сплошном росте на всех фильтрах ( п. 8.2.3.5 ) в случае подтверждения принадлежности к ОКБ и ТКБ выдается качественный результат «обнаружено ОКБ в 100 мл».
Если все колонии на фильтре оксидазоположительные или не подтвердилась их принадлежность к ОКБ и ТКБ, анализ завершается, в протоколе отмечают «зарост фильтров».
В обоих случаях анализ повторяют.
8.3.1. Определение понятия показателя
Определение понятия показателей ОКБ и ТКБ по п. 8.2.1 .
Титрационный метод может быть использован:
· при отсутствии материалов и оборудования, необходимых для выполнения анализа методом мембранной фильтрации;
· при анализе воды с большим содержанием взвешенных веществ;
· в случае преобладания в воде посторонней микрофлоры, препятствующей получению на фильтрах изолированных колоний общих колиформных бактерий.
Метод основан на накоплении бактерий после посева установленного объема воды в жидкую питательную среду, с последующим пересевом на дифференциальную плотную питательную среду с лактозой и идентификации колоний по культуральным и биохимическим тестам.
При исследовании питьевой воды качественным методом (текущий санэпиднадзор, производственный контроль) засевают 3 объема по 100 мл.
При исследованиях воды с целью количественного определения ОКБ и ТКБ при повторном анализе производят посев: 3 объемов по 100 мл, 3 объемов по 10 мл, 3 объемов по 1 мл.
Каждый объем исследуемой воды засевают в лактозо-пептонную среду, приготовленную по п. 5.5 . Посев 100 мл и 10 мл воды производят в 10 и 1 мл концентрированной лактозо-пептонной среды, посев 1 мл пробы проводят в 10 мл среды обычной концентрации.
Посевы инкубируют при (37 ± 1) °С в течение 48 ч. Не ранее 24 час инкубации проводят предварительную оценку посевов. Из емкостей, где отмечено наличие роста (помутнение) и образование газа, производят высев бактериологической петлей на сектора среды Эндо ( п. 5.4.1 ) для получения изолированных колоний.
Емкости без наличия роста и образования газа оставляют в термостате и окончательно просматривают через 48 ч. Посевы без признаков роста считают отрицательными и дальнейшему исследованию они не подлежат. Из емкостей, где отмечено помутнение и образование газа или только помутнение, делают высев на сектора среды Эндо.
Посевы на среде Эндо инкубируют при температуре (37 ± 1) °С в течение (18 — 20) ч.
При образовании помутнения и газа в среде накопления и росте на среде Эндо колоний, типичных для лактозоположительных бактерий: темно-красных или красных, с металлическим блеском или без него, выпуклых с красным центром и отпечатком на питательной среде, дают положительный ответ на присутствие общих колиформных бактерий в данном объеме пробы.
Наличие ОКБ требуется подтвердить:
· если в среде накопления отмечено только помутнение;
· если принадлежность к лактозоположительным колониям вызывает сомнение у исследователя.
· проверяют наличие отпечатка на среде Эндо после снятия петлей подозрительной колонии;
· выполняют оксидазный тест по п. 8.2.3.2 ;
· подтверждают принадлежность к Граму по п. 8.2.3.3 ;
· подтверждают способность к газообразованию при посеве изолированных 1 — 2 колоний каждого типа с каждого сектора на среду с лактозой по п. 5.6 с последующей инкубацией посевов при температуре (37 ± 1) °С в течение (24 — 48) ч.
При отсутствии изолированных колоний проводят рассев на среду Эндо общепринятыми бактериологическими методами.
Отрицательный ответ дают, если:
· в среде накопления нет признаков роста;
· на секторах среды Эндо нет роста;
· на секторах среды Эндо выросли не характерные для колиформных бактерий колонии (прозрачные с неровными краями, расплывчатые и т.п.);
· все колонии оказались оксидазоположительными;
· все колонии оказались грамположительными;
· если в подтверждающем тесте на среде с углеводом не отмечено газообразования.
Для определения термотолерантных колиформных бактерий работают с секторами среды Эндо, где выросли типичные лактозоположительные колонии. Делают посев 2 — 3 изолированных колоний каждого типа с каждого сектора в пробирки с любой из лактозных сред, приготовленных по п. 5.6 .
Среду перед посевом нагревают на водяной бане или в термостате до 44 °С. Немедленно после посева пробирки помещают в термостат и инкубируют при температуре (44 ± 0,5) °С в течение 24 ч. Допускается просмотр посевов через (4 — 6) ч.
При образовании газа в среде накопления, росте на среде Эндо лактозоположительных бактерий и выявлении способности этих бактерий ферментировать лактозу до кислоты и газа в течение 24 ч при температуре 44 °С дают положительный ответ на наличие в этом объеме пробы воды ТКБ. Во всех остальных случаях дают отрицательный ответ.
Допустимо для ускорения выдачи ответа на присутствие ТКБ производить высев 1 мл из объемов среды накопления, где отмечено помутнение и газообразование в пробирке с лактозо-пептонной средой с поплавком по п. 5.6 и прогретой предварительно до температуры 44 °С. Посевы выдерживают в термостате при температуре (44 ± 0,5) °С в течение 24 ч. При обнаружении кислоты и газа дают положительный ответ.
При исследовании 3 объемов по 100 мл результаты оцениваются качественно и при обнаружении ОКБ и ТКБ хотя бы в одном из 3 объемов, делается запись в протоколе «обнаружены в 100 мл».
При исследовании количественным методом определяют наиболее вероятное число (НВЧ) ОКБ и ТКБ по табл. 1.1 приложения 1 .
Результат сообщают без доверительного интервала.
При отрицательном ответе на наличие ОКБ и ТКБ во всех исследованных объемах выдают заключение в протоколе «не обнаружены в 100 мл».
8.4.1. Определение понятия показателя
Сулъфитредуцирующие клостридии — спорообразующие анаэробные палочковидные микроорганизмы, редуцирующие сульфит натрия на железо-сульфитном агаре при температуре (44 ± 1) °С в течение (16 — 18) ч.
Метод основан на выращивании посевов в железо-сульфитном агаре в условиях, приближенных к анаэробным, и подсчете числа черных колоний.
При исследовании хлорированной воды прогревание пробы можно не производить.
Из каждой пробы питьевой воды делают посев или фильтруют 20 мл. При необходимости подбирают объемы с таким расчетом, чтобы в посевах (на фильтрах) выросло не более 10 — 15 колоний. При этом ориентируются на результаты предыдущих исследований.
Фильтрование воды производят в соответствии с требованиями, изложенными в п. 7 .
8.4.3.2. Определение методом фильтрования в пробирках
Перед посевом пробирки с железо-сульфитным агаром, приготовленным по п. 5.8 , расплавляют на водяной бане (не кипятить!). В течение посева поддерживают среду нагретой до (70 — 80) °С в водяной бане.
После фильтрования установленного объема воды мембранный фильтр фламбированным пинцетом берут за два противоположных края и согнутый в виде трубочки помещают в пробирку с горячим агаром. Сторона фильтра с осевшими бактериями обращена внутрь. При этом фильтр распрямляется и располагается по стенке пробирки.
Сразу же после посева пробирку с агаром и фильтром для создания анаэробных условий быстро охлаждают, помещая в емкость с холодной водой. Культивируют посевы при (44 ± 1) °С в течение (16 — 18) ч.
8.4.3.3. Определение методом фильтрования в чашках Петри
Чашки Петри диаметром (55 — 60) мм заливают тонким слоем железо-сульфитного агара. После фильтрации фильтр поместить фильтрующей поверхностью вниз на застывшую питательную среду так, чтобы под фильтром не было пузырьков воздуха. Затем заливают расплавленным железо-сульфитным агаром до верхнего края чашки, чтобы крышка плотно прилегала к среде для создания анаэробных условий. Культивируют посевы при (44 ± 1) °С в течение (16 — 18) ч.
8.4.3.4. Определение прямым посевом
Железо-сульфитный агар во флаконах и пробу воды готовят, как это описано в п. 8.4.3.1 .
В стерильные пробирки вносят:
· по 10 мл в 2 пробирки (объемом не менее 30 мл) или
· по 5 мл в 4 пробирки (объемом по 15 мл).
Посевы заливают горячим железо-сульфитным агаром в количестве, превышающем объем воды в 2 раза. Среду заливать по стенке пробирки, избегая образования пузырьков воздуха. После этого пробирку быстро охлаждают, помещая ее в емкость с холодной водой для создания анаэробных условий. Посевы инкубируют при (44 ± 1) °С в течение (16 — 18) ч.
Количественному учету подлежат только те посевы, где получены изолированные колонии. Подсчитывают черные колонии, выросшие как на фильтрах, так и в толще питательной среды.
Результат анализа выражают числом колониеобразующих единиц (КОЕ) спор сульфитредуцирующих клостридий в 20 мл воды.
При отсутствии роста черных колоний на всех фильтрах дают ответ «не обнаружено в 20 мл воды».
При невозможности учета колоний из-за сливного роста результат оценивается как качественный, в протоколе отмечают «обнаружено в 20 мл». При необходимости получения количественного результата анализ повторяют.
8.5.1. Определение понятия показателя
Колифаги — бактериальные вирусы, способные лизировать E. coli и формировать при температуре (37 ± 1) °С через (18 ± 2) ч зоны лизиса бактериального газона (бляшки) на питательном агаре.
8.5.2. Титрационный метод определения колифагов
Определение колифагов в питьевой воде заключается в предварительном накоплении колифагов в среде обогащения на культуре E. coli и последующем выявлении зон лизиса (просветления) газона E. coli на питательном агаре.
Метод предназначен для проведения текущего контроля качества питьевой воды.
На всех этапах исследования используют бактериальную взвесь, приготовленную следующим образом: культуру E. coli засевают в пробирку со скошенным питательным агаром со стрептомицином ( п. 5.3.5 ). Через (18 ± 2) ч инкубации при температуре (37 ± 1) °С произвести смыв бактерий с косяка 5 мл стерильного физиологического раствора (0,85 %-ный раствор NaCl ) и по стандарту мутности готовят взвесь E. coli в концентрации 10 9 бактериальных клеток в 1 мл.
Допускается использование 4-часовой бульонной культуры E. coli, полученной путем подращивания в термостате при температуре 37 °С. Концентрация 10 9 бактериальных клеток E. coli содержится в 2 мл.
8.5.2.4. Проведение качественного анализа
В исследуемую пробу воды объемом 100 мл вносят 10 мл 10-кратного питательного бульона (приготовленного по п. 5.2.2 ) и 1 мл подготовленного смыва тест-культуры или 2 мл 4-часовой бульонной культуры ( п. 8.5.2.3 ).
Для контроля культуры 0,1 мл смыва бактерий Е. c oli (или 0,2 мл 4-часовой бульонной культуры) помещают в чашку Петри и заливают питательным агаром.
Исследуемую пробу воды (100 мл) и чашку Петри с контролем E. coli помещают в термостат и инкубируют при температуре (37 ± 1) °С в течение (18 ± 2) ч.
После инкубации из исследуемой пробы воды отливают в пробирку 10 мл и добавляют 1 мл хлороформа.
Пробирку закрывают стерильной резиновой или силиконовой пробкой, энергично встряхивают для равномерного распределения хлороформа по объему пробы и оставляют при комнатной температуре не менее 15 мин до полного осаждения хлороформа.
В предварительно расплавленный и остуженный до (45 — 49) °С питательный агар добавляют приготовленный смыв бактерий E. coli ( п. 8.5.2.3 ) из расчета 1,0 мл смыва (или 2 мл 4-часовой бульонной культуры) на 100 мл агара.
В стерильную чашку Петри пипеткой из пробирки переносят 1 мл обработанной хлороформом пробы (не касаясь хлороформа) и заливают смесью расплавленного и остуженного до (45 — 49) °С питательного агара объемом (12 — 15) мл, а также одну дополнительную чашку Петри для контроля культуры E. coli и осторожно покачивают для равномерного перемешивания пробы воды и агара. Для полного застывания чашки оставляют на столе при комнатной температуре на 10 мин. После застывания чашки переворачивают и помещают в термостат на (18 ± 2) ч при 37 °С.
При выполнении серии проб ставится общий контроль для всей серии.
Просмотр посевов осуществляют в проходящем свете.
Проба считается положительной при наличии полного лизиса, просветления нескольких бляшек, одной бляшки на чашке с пробой воды при отсутствии зон лизиса на контрольной чашке.
В протоколе анализа отмечается: колифаги обнаружены или не обнаружены в 100 мл воды (результат качественный).
При наличии зон лизиса в контроле культуры результат считается недействительным.
Исследуемую пробу воды в количестве 100 мл разлить на 6 объемов: 1 флакон 50 мл и 5 пробирок по 10 мл. В 50 мл пробы добавить 5 мл десятикратного питательного бульона (по п. 5.2.2 ) и 0,5 мл смыва (или 1 мл 4-часовой бульонной культуры) бактерий E. coli ( п. 8.5.2.3 ). В каждые 10 мл пробы внести по 1 мл десятикратного питательного бульона и 0,1 мл смыва (или 0,2 мл 4-часовой бульонной культуры) бактерий E. coli.
Для контроля культуры 0,1 мл смыва бактерий (или 0,2 мл 4-часовой бульонной культуры) E. coli помещают в чашку Петри и заливают питательным агаром.
Посевы инкубируют при температуре (37 ± 1) °С в течение 18 ± 2 ч.
После инкубации из объема 50 мл отлить в пробирку 10 мл. Во все исследуемые 6 объемов добавить по 1 мл хлороформа. Пробирки закрыть стерильными резиновыми или силиконовыми пробками, энергично встряхнуть для равномерного распределения хлороформа по объему пробы и оставить при комнатной температуре не менее 15 мин для осаждения хлороформа.
В предварительно расплавленный и остуженный до (45 — 49) °С питательный агар добавить приготовленный смыв бактерий E. coli ( п. 8.5.2.3 ) из расчета 1,0 мл смыва (или 2 мл 4-часовой бульонной культуры) на 100 мл агара. Приготовленную смесь разлить в чашки Петри: 1 чашку для контроля культуры E. coli на лизогенность и по одной чашке на каждую исследуемую пробу воды. При одновременном анализе нескольких проб воды ставится один контроль культуры E. coli.
После застывания агара чашки, предназначенные для посева проб, разделить на 6 секторов, промаркировать их в соответствии с исследуемыми объемами. На каждый сектор из соответствующей пробирки нанести пастеровской пипеткой (микропипеткой или бактериологической петлей продольным штрихом) по 1 капле надосадочной жидкости (без хлороформа).
После подсыхания капель чашки с исследуемыми пробами и контрольную чашку поместить в термостат при (37 ± 1) °С на (18 ± 2) ч.
Просмотр результатов осуществляется в проходящем свете.
Учет проводится по наличию зон просветления (лизиса) на секторах газона E. coli.
При применении капельного способа посева пипеткой образуется зона лизиса в виде округлого пятна или отдельных бляшек. При посеве продольным штрихом бактериологической петлей отмечается лизис по ходу штриха.
Проба считается положительной при наличии зоны лизиса хотя бы на одном секторе при отсутствии зон лизиса на контрольной чашке.
Оценка проводится по таблице наиболее вероятного числа (НВЧ) бляшкообразующих единиц (БОЕ) (табл. 1.2). В протоколе анализа указывается наиболее вероятное количество колифагов в 100 мл воды и диапазон возможных колебаний: НВЧ БОЕ (нижний предел — верхний предел) колифагов в 100 мл. Результат полуколичественный.
При наличии зон лизиса в контрольной чашке результат считать недействительным.
8.5.3. Прямой метод определения колифагов
Определение колифагов в питьевой воде заключается в исследовании нормируемого объема воды (100 мл) путем его прямого посева и последующего учета зон лизиса (бляшек) на газоне E. coli в чашках Петри с питательным агаром.
Прямой метод выделения колифагов из воды проводят параллельно с титрационным при исследованиях по эпидемическим показаниям.
В питательный агар двойной концентрации ( п. 5.3.2 ), расплавленный и остуженный до (45 — 49) °С, добавить смыв E. coli ( п. 8.5.2.3 ) из расчета 2,0 мл смыва (или 4 мл 4-часовой бульонной культуры) на каждые 100 мл агара, перемешать. Исследуемые 100 мл воды разлить по 20 мл в большие пробирки, нагреть до (35 — 44) °С и немедленно (не более чем через 5 мин по достижении требуемой температуры) разлить в 5 чашек Петри и сразу же внести в каждую чашку по 20 мл смеси агара с культурой E. coli.
Для контроля культуры E. coli в одну чашку Петри внести 20 мл стерильной водопроводной воды, предварительно прогретой до (35 — 44) °С, залить 20 мл приготовленного агара с E. coli и осторожно перемешать.
Содержимое чашек осторожно перемешать и оставить при комнатной температуре до застывания. Чашки с застывшим агаром поместить дном вверх в термостат и инкубировать при температуре (37 ± 1) °С в течение (18 ± 2) ч.
Просмотр посевов осуществляется в проходящем свете.
Учет результатов проводят путем подсчета и суммирования бляшек, выросших на 5 чашках Петри. Результаты выражают в бляшкообразующих единицах (БОЕ) на 100 мл пробы воды. В контрольной чашке бляшки должны отсутствовать.
Наиболее часто зоны лизиса выглядят прозрачными пятнами на фоне газона тест-культуры питательного агара в виде круглых изолированных бляшек (от 1 до 5 — 7) мм в диаметре с четко выраженными либо стертыми границами.
При высоких концентрациях фага наблюдается разная картина лизиса.
Слияние негативных колоний дает «ажурный» газон E. coli, рост единичных колоний E. coli на фоне сплошного лизиса, либо полное отсутствие роста на чашке.
При прямом посеве возможен лизис, маскируемый негомогенно застывшим агаром, а также закрытый сопутствующей микрофлорой. Капли конденсата и негомогенно застывший при прямом посеве агар могут приводить к образованию артефактов на газоне E. coli, визуально напоминающих лизис.
Предварительный учет результатов можно проводить через (5 — 6) ч инкубации. На этом этапе при наличии четких зон лизиса может быть выдан предварительный ответ о присутствии колифагов в воде.
Окончательный количественный учет прямого посева проводится через (18 ± 2) ч. Результаты выражают количеством бляшкообразующих единиц (БОЕ) на 100 мл пробы воды.
Если отмечен сливной рост бляшек и счет затруднителен, то по данным прямого посева может быть выдан качественный результат: «обнаружено в 100 мл воды».
При получении отрицательного результата при работе прямым методом окончательный ответ выдается по результатам титрационного метода.
При наличии зон лизиса в контрольной чашке результат исследования считается недействительным.
8.5.4.1. Отрицательный контроль
Отрицательный контроль подтверждает отсутствие контаминации фагом питательных сред, лабораторной посуды, оборудования на этапах подготовки и проведения анализа, а также позволяет оценить способность тест-культуры E. coli давать равномерный газон.
Отрицательным контролем служит исследование стерильной водопроводной воды, проводимое аналогично анализируемой пробе воды. Так, при анализе воды титрационным методом 10 мл стерильной водопроводной воды вносят в дополнительную пробирку. При анализе воды прямым посевом в дополнительную шестую чашку Петри вносят 20 мл стерильной водопроводной воды.
Дополнительные посевы исследуются на колифаги аналогично основным пробам.
При анализе серии проб отрицательный контроль может быть один на каждый вид анализа: титрационный и прямой. В этом случае постановка отрицательного контроля поэтапно осуществляется после обработки всех проб данной серии.
В случае обнаружения бляшек колифагов в чашках с отрицательным контролем результаты исследования всей серии проб воды недействительны.
Следует проверить стерильность лабораторного оборудования, посуды, питательных сред, а также повторить контрольный посев на чистоту тест-штамма E. coli К12 F + Str R .
Кратность проведения отрицательного контроля — 1 раз в день.
8.5.4.2. Методика подтверждения фаговой природы лизиса
В сомнительных случаях при работе как титрационным, так и прямым методами необходимо провести контрольный посев на подтверждение фаговой природы лизиса.
С этой целью бактериологической петлей извлекают участок агара, подозрительный на колифаги, помещают его в 5 мл питательного бульона, куда добавляют каплю тест-культуры E. coli и инкубируют при 37 °С в течение (16 — 18) ч. Полученную культуру обрабатывают хлороформом и исследуют на наличие фага. Высев осуществляют петлей или пипеткой на сектора питательного агара аналогично способу, описанному в п. 8.5.2.5 . Лизис на любом из секторов расценивается как подтверждение наличия фага.
Таблицы расчета наиболее вероятного числа микроорганизмов
Расчет наиболее вероятного числа бактерий в 100 мл питьевой воды
источник