Обзор характеристик воды с повышенным содержанием хлоридов (натрия, кальция), их норм примесей, а также раскрытие вопроса вредного воздействия на живые организмы, бытовую технику и коммуникации.
Хлориды – это соли соляной кислоты. Магматические породы с хлорсодержащими минералами (хлорапатит, содалит и др.), а также соленосные отложения (галит) являются первичными источниками данного элемента.
Все природные воды содержат в своем составе хлориды, чаще всего встречающиеся в виде натриевых, магниевых и кальциевых солей. Их естественное содержание в грунтовых и артезианских водах обусловлено вулканическими выбросами, а также результатами кругового взаимодействия атмосферных осадков с почвами и обмена через атмосферу с океаном.
Хлориды, содержащиеся в значительном количестве в воде, могут быть следствием вымывания хлористых соединений или поваренной соли из пластов, соприкасающихся с водой.
Воды подземных источников, некоторых озер и морей в большом количестве содержат хлорид натрия (NaCl), присутствующий в воде хлорид кальция (CaCb) придает ей некарбонатную жесткость.
При оценке санитарного состояния водоема учитывают показатель содержания хлоридов в воде. Так, к примеру, незначительное содержание отмечается в водах северной части России, обычно, не выше 10 мг/л, тогда как соответствующий показатель, характерный для южных регионов, доходит до 10-100 мг/л.
Прослеживается тенденция заметных сезонных колебаний концентрации хлорид-ионов в поверхностных водах, что связано с коррелирующим изменением общей минерализации. Это обусловлено критерием загрязнения водоема из-за попадания в него хозяйственно-бытовых стоков.
Высокое содержание хлоридов заметно ухудшает вкусовые качества воды, делает ее соленой на вкус, а также практически непригодной для хозяйственных и технических нужд, в том числе для оросительных работ на сельскохозяйственных угодьях.
ПДК (предельно допустимая концентрация) хлоридов в воде не должна превышать 350 мг/л, в противном случае вода будет неприятной по вкусу – чрезмерно соленой.
Соленые (хлоридные) воды содержат соли хлоридной группы. Чаще всего катионный состав таких вод представляет натрий, образующий в сочетании с хлором поваренную соль, чем и обеспечен их соленый вкус. Причем, хлористый натрий заметно доминирует относительно других солей практически во всех хлоридных водах.
Хлористый магний преобладает в горько-соленых водах, где его все равно намного меньше, чем поваренной соли. Превышает количество растворенной поваренной соли в некоторых случаях содержащийся хлористый кальций в водах хлоридно-кальциевого типа.
Отличием от карбонатных и сульфатных ионов является их не предрасположенность к созданию ионных ассоциированных пар. Слабо выраженная сорбция с взвешенными веществами, легкая растворимость и потребление водными организмами объясняется хорошей миграционной способностью хлоридных анионов.
При попадании в организм человека, а также домашних животных воды, содержащей избыточное количество хлоридов:
- раздражаются слизистые оболочки, глаза, кожные покровы, дыхательные пути;
- проявляется негативное воздействие на секреторную деятельность желудка;
- ухудшается пищеварение;
- нарушается водно-солевой баланс;
- возникает вероятность развития заболеваний системы кровообращения;
- появляется склонность к возникновению новообразований мочеполовых органов, органов пищеварения, желудка, пищевода;
- избыточное поступление в организм хлористого натрия увеличивает частоту сердечно сосудистых заболеваний;
- появляется склонность к гипертензивным состояниям, повышенной реактивности сосудов;
- возникает вероятность желче- и мочекаменных заболеваний.
источник
Цель работы.Научиться определять содержание хлоридов в воде и осуществлять первичную обработку результатов.
Реактивы и растворы.
1. Раствор нитрата серебра (АgNОз), 1 млкоторого осаждает 1 мгСl ¯ . Берут навеску 4,791 г кристаллического нитрата серебра и растворяют в мерной колбе на 1 л дистиллированной воды.
2.10%-ный раствор хромата калия, не содержащий хлоридов. Берут 100 г К2СrO4 и растворяют в небольшом количестве дистиллированной воды, затем добавляют несколько капель АgNO3, до появления красновато-бурого осадка. Дают раствору отстояться, затем фильтруют и доводят объем его до 1000 мл дистиллированной водой.
3. Раствор хлорида натрия, 1 мл которого содержит точно 1 мг Сl — .Берут навеску 1,6486 г химически чистого NаСl и растворяют дистиллированной водой в мерной колбе на 1 л.
1. Конические колбы объемом 300 мл — по числу проб плюс одна.
2. Пипетки: на 10 мл для раствора NаСl; на 1 мл градуированная для раствора К2СгO4.
3. Мерный цилиндр на 100 мл.
Общие сведения.Хлориды являются главной составной частью солевого состава морской воды. В водоемах суши их содержание незначительно, за исключением некоторых озер, расположенных на засолоненных почвах или преимущественно питающихся высокоминерализованными грунтовыми водами. Такие водоемы встречаются в некоторых местах на южных территориях Украины и России и в Средней Азии. Содержание хлоридов в этих водоемах достигает сотен и даже тысяч миллиграммов в 1 л, хотя обычно их количество в водах суши не превышает 100 мг/л. Если гидрометеорологическими условиями повышенное содержание хлоридов объяснено быть не может, оно служит показателем постороннего загрязнения. В водоемах суши хлориды определяют для получения величины минерализации и загрязнения, в морях и океанах по количеству хлоридов рассчитывают соленость воды.
Принцип определения.Определение хлоридов в пресной воде аргентометрическим методом основано на осаждении анионов хлора раствором нитрата серебра при титровании. В качестве индикатора применяют раствор хромата калия. Химическую сущность происходящего можно представить уравнением реакции:
Как только все анионы хлора окажутся связанными, начнется реакция:
На образование соли Аg2СгO4 укажет переход цвета раствора от лимонно-желтого к красноватому, не исчезающему при взбалтывании.
Принцип определения хлорности и солености морской воды аналогичен принципу определения хлоридов в пресной воде. Однако в технике определения хлорности морской воды много существенных отличий от техники определения хлоридов в пресных водоемах.
Для определения хлорности готовят раствор нитрата серебра такой концентрации, чтобы отсчет по бюретке при титровании морской воды примерно соответствовал величине хлорности. Например, для воды с нормальной (35%) соленостью, хлорность которой равна 19,38% (уд.вес 1,02674), концентрация нитрата серебра составит:
где 4,791 — количество АgNО3, осаждающее 1 г хлора, при условии, что на титрование берется 15 мл морской воды.
Для приготовления 1 л раствора берут навеску АgNO3 в количестве 3,71 г, учитывая наличие примесей в соли АgNO3, которая выпускается промышленностью.
При определении хлорности морской воды применяют особые бюретки и пипетки. Эти бюретки отличаются от обычных наличием приспособлений для автоматического заполнения и установления раствора на нулевом делении. На каждое деление бюретки приходится объем 2 мл, целое деление в свою очередь подразделяется на 20 дробных делений. Это позволяет вести отсчет при титровании с точностью до 0,01 мл. Бюретки выпускают нескольких типов для определения различной хлорности.
Пипетки применяют автоматические, одинаковой вместимости ―15 мл. Пробу объемом 15 мл помещают в специальную титровальную с толстым овальным дном рюмку вместимостью около 300 мл. При титровании пробу тщательно перемешивают стеклянной палочкой.
Для проверки титра раствора нитрата серебра и определения хлорности в испытуемой воде необходимо в одинаковых с пробой условиях оттитровывать пробу морской воды с точно известной величиной хлорности (так называемой «нормальной» воды). Нормальная вода — это океаническая вода, хлорность которой точно определена и соответствует средней солености океана (35%). Нормальную морскую воду выпускают в стеклянных запаянных баллончиках вместимостью 250 мл, на этикетке которых указана точная величина хлорности.
Ход определения.В коническую колбу берут 100 мл испытуемой воды (если вода с большей мутностью, ее фильтруют), добавляют 1 мл 10%-ного раствора К2СгО4 и титруют раствором АgNОз при постоянном перемешивании до появления устойчивого красноватого оттенка. Желательно вести титрование с двумя «свидетелями» (в одной колбе проба только с К2СгО4, в другой — немного перетитрованная проба).
Определение поправки к титру раствора АgNO3.Поправку к титру АgNОз определяют по точному раствору NаСl, 1 мл которого содержит 1 мг Сl¯.
В коническую колбу помещают 10 мл раствора МаСl, доводят объем до50 мл дистиллированной водой, прибавляют 0,5 мл 10%-ногораствора К2CrO4 и титруют раствором нитрата серебра до изменения окраски раствора. Поправку определяют по формуле (*), где n — количество мл раствора АgNО3, пошедшее на титрование 10 мл раствора NаСl.
Вычисление результатов.Все записи при выполнении работы делаются в таблице по образцу табл.1 (прилож.).
Содержание анионов хлора в пресной воде определяют по формуле:
С(Сl¯) = (А×1×К×1000)/Vмг/л (31)
где А — количество раствора АgNО3, пошедшее на титрование пробы, мл;
1 — количество Сl¯, которое осаждает 1 мл раствора АgNО3 при титровании;
К— поправка к титру раствора АgNO3; V— объем пробы, взятый для анализа.
Содержание Сl¯, кроме того, выражают в ммоль(экв)/л, для чего результат, полученный в мг/л, делят на 35,445 мг. Результаты расчета следует округлить до 0,001 ммоль(экв)/л и 0,1 мг/л.
Результаты титрования при определении хлорности морской воды вычисляют по формуле:
Сl % = а + К (32)
где а — исправленный отсчет бюретки (отсчет с учетом поправки бюретки после титрования пробы), К- поправка титрования, которую находят по «Океанографическим таблицам» [8]. Зная хлорность, в «Океанографических таблицах» находят соленость воды; величину, которой (г/кг) выражают в промилле (%).
Отчет.Отчет по данной лабораторной работе состоит в устном собеседовании с преподавателем. Результаты измерений представляются по установленной форме.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. От чего зависит содержание в воде хлоридов?
2. Каков принцип определения хлоридов в пресной воде?
3. Какая существует зависимость между количеством АgNO3, пошедшим на титрование пробы, и содержанием в воде Сl¯?
4. Что такое соленость морской воды и как ее определяют?
5. В каких единицах выражают количество хлоридов, содержащихся в воде, а также величину солености?
источник
Аналитический центр более 20 лет занимается химическим анализом и разработкой новых методов анализа и диагностики веществ и материалов
В нашем распряжении самый современный приборный парк благодаря научно-техническому взаимодействию с крупнейшими мировыми разработчиками аналитического оборудования
Наши сотудники — это лучшие специалисты страны в области химического анализа, кандидаты и доктора наук
Аккредитация позволяет исследовать питьевую, природную, морскую, технологическую, талую воду и воду бассейнов
Обратившись к нам, Вы получите не только точные данные о присутствующих в воде загрязнителях, но и подробные рекомендации о способах очистки воды.
На основании анализа воды БЕСПЛАТНО подберем несколько вариантов систем водоочистки!
В нашей лаборатории Вы можете проверить качество воды из любого источника: колодца, скважины, водопровода, бассейна, родника, водоема. Для каждого источника есть оптимальный набор показателей, характеризующий возможность использования воды для тех или иных нужд. Чтобы правильно подобрать набор показателей, свяжитесь с нами по номеру +7 (495)149-23-57 или напишите на почту info@ion-lab.ru
Мы рекомендуем выбирать набор параметров в зависимости от того, какой у Вас источник водоснабжения, а также для каких целей планируете использовать воду. Для воды из городского водопровода, а также для воды, используемой в технических целях, подойдут наборы «Минимальный» или «Начальный». Для воды природных источников (скважины, колодцы, родники и т.д.) мы рекомендуем проверить воду на химический состав (наборы «Расширенный» или «Максимальный»), а также сделать анализ на микробиологию.
Да, Вы можете самостоятельно отобрать воду для анализа, следуя инструкции. Или же заказать выезд специалиста, который приедет в назначенное время со всей необходимой тарой, отберет воду и доставит ее в лабораторию.
Да, конечно! Пункт приема проб расположен по адресу: Москва, ул. Добролюбова, 21А, корпус А, пом. 14 (в пешей доступности от метро Фонвизинская, Бутырская, Тимирязевская)
Стоимость выезда специалиста зависит от выбранного Вами набора показателей и удаленности. Более точная информация размещена в разделе Доставка и оплата
© 1997-2019 — Лаборатория ИОН. Все права защищены.
Для химического анализа необходимо заполнить водой чистую пластиковую тару (оптимально 1,5 л). Использовать бутылки из-под сладких, газированных или ароматизированных напитков, а также солёной или минеральной воды недопустимо.
Если выбранный Вами анализ включает определение содержания нефтепродуктов, необходимо заполнить дополнительную стеклянную тару объемом 0,2 л.
Если выбранный Вами анализ включает определение содержания сероводорода, необходимо заполнить дополнительную стеклянную тару объемом 0,5 л (необходимо использовать консервант).
При отборе воды из проточного источника, непосредственно перед отбором необходимо пролить воду сильной струёй в течение 3-5 минут. Перед отбором проб ёмкости и крышки необходимо 3 раза промыть изнутри водой, подлежащей анализу. Использование моющих средств недопустимо. Наполнять тару необходимо тонкой струёй по стенке сосуда «под горлышко». Это снижает насыщение воды кислородом и предотвращает протекание реакций.
Для микробиологического анализа необходимо использовать стерильный контейнер для биоматериалов объемом 150-200 мл.
Перед взятием пробы необходимо протереть водопроводный кран спиртовой салфеткой, уделив особое внимание месту выхода воды.
При отборе воды из водопровода, скважины или колонки необходимо пролить воду сильной струёй в течение 3–5 минут.
При отборе воды из колодца с помощью ведра необходимо обдать ведро кипятком для дезинфекции. Отбор пробы через поливочные шланги и предметы, контактирующие с почвой, не допускается.
Для отбора пробы необходимо надеть перчатки и вскрыть упаковку стерильного контейнера. Не касаясь внутренней поверхности ёмкости, отобрать образец воды (2/3 объема контейнера) и закрыть крышкой.
Рекомендуем доставлять пробу сразу после отбора.
Если сразу после отбора нет возможности доставить пробу в лабораторию, допускается хранение образцов при температуре 2–10 °C в течение 1 суток.
Съезд на ул. Руставели, на первом светофоре поворот налево на ул. Яблочкова.
Через 300 м поворот направо на ул. Гончарова, через 500 м поворот налево (напротив дома №6), через 200 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Поворот на ул. Руставели, на светофоре поворот направо на ул. Добролюбова, через 300м на светофоре поворот налево на ул. Гончарова, напротив дома №6 поворот направо, через 200 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Двигаясь по ул. Милошенкова, поворачиваем на ул. Добролюбова
Через 150 метров поворот направо, за домом 21АкБ поворот налево, через 100-120 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Ближайшее станция метро – Фонвизинская (600 м)
Последний вагон из центра. Выход в сторону улицы Фонвизина. Из стеклянный дверей направо. Перейти через пешеходный переход и идти через дворы в соответствии со схемой. Пункт назначения — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Анализ «Минимальный» содержит минимальный и обязательный перечень загрязнителей, часто встречающихся в питьевой воде, и включает 16 показателей:
- органолептические: мутность, цветность, запах, привкус;
- общехимические: рН, жесткость, окисляемость перманганатная, минерализация, электропроводность, щелочность общая, щелочность свободная;
- катионы: железо, аммоний;
- анионы: нитраты, карбонат, гидрокарбонат.
Данный набор рекомендуется для исследования воды хозяйственно-бытового назначения. Анализ «Минимальный» не обладает достаточной информативностью для подбора системы водоочистки, так как не позволяет получить полную картину о безопасности воды. Если Вы планируете использовать воду в питьевых целях, рекомендуем обратить внимание на наборы, содержащие большее число параметров.
- Точность определения
- Подходит для воды, применяемой в хоз-бытовом назначении
- Срок выполнения — 3-4 рабочих дня
- Не подходит для воды, применяемой в питьевых целях
- Не подходит для корректного подбора фильтров
- Не содержит определения опасных загрязнителей
Анализ «Начальный» предназначен для выявления наиболее часто встречающихся вредных веществ в питьевой воде и включает 23 параметра: мутность, цветность, запах, привкус, рН, жесткость, окисляемость, минерализация, электропроводность, щелочность свободная, щелочность общая, железо, марганец, калий, магний, кальций, фториды, хлориды, нитраты, сульфаты, карбонат, гидрокарбонат, аммоний Данный анализ рекомендуется для оценки качества воды из колодцев, скважин, родников. По протоколу анализа «Начальный» возможен подбор системы водоочистки и типа фильтрующей загрузки. В перечень определяемых параметров входят органолептические показатели, общие химические показатели, а также содержание катионов и анионов
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для колодцев и скважин
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Позволяет корректно и экономично настроить водоочистное оборудование
- Не содержит перечень тяжелых металлов
- Не содержит перечень всех опасных загрязнений
- Срок выполнения исследований 5-6 рабочих дней
Анализ «Расширенный» содержит перечень наиболее часто встречающихся загрязнителей воды, вне зависимости от источника, и включает 31 показатель: мутность, цветность, запах, привкус, рН, жесткость, окисляемость, минерализация, электропроводность, щелочность общая, щелочность свободная, аммоний, алюминий, железо общее, магний, кальций, калий, натрий, марганец, медь, мышьяк, свинец, кадмий, цинк, стронций, фториды, хлориды, нитраты, сульфаты, гидрокарбонат, карбонат. Данный набор рекомендуется, в первую очередь, владельцам колодцев и скважин. Содержит перечень основных тяжелых металлов. Перед покупкой системы водоподготовки рекомендуем провести исследование воды с данным перечнем загрязнителей. Ориентируясь на полученную информацию, Вы сможете подобрать оборудование водоочистки с эффективностью до 98%, а так же корректно его настроить.
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для колодцев и скважин
- Содержит перечень тяжелых металлов
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Позволяет корректно и экономично настроить водоочистное оборудование
Анализ «Максимальный» содержит полный перечень опасных для здоровья человека веществ, встречающихся в воде, поступающих из скважин или колодцев, включая ионы тяжелых металлов и органические вещества, а именно: мутность, цветность, запах, привкус, рН, жесткость, окисляемость, минерализация, электропроводность, щелочность общая, щелочность свободная, аммоний, натрий, калий, магний, кальций, алюминий, железо, марганец, литий, барий, бериллий, бор, ванадий, молибден, кобальт, цинк, никель, хром, стронций, кадмий, мышьяк, медь, свинец, кремний, серебро, титан, ртуть, гиброкарбонат, карбонат, нитрат, хлорид, сульфат, фосфат, фторид, нитрит, сероводород, сульфид, гидросульфид, хлор общий, хлор остаточный, хлор остаточный свободный, АПАВ, нефтепродукты, фенол, формальдегид, бензол, толуол, о-ксилол, п-ксилол, м-ксилол, стирол Данное исследование рекомендуется для клиентов, которые серьезно относятся к выбору питьевой воды. Протокол анализа «Максимальный» позволяет со 100% уверенностью сделать вывод о пригодности воды для питья и приготовления пищи. Результаты исследования позволяют выбрать схему водоочиски, а также оценить эффективность уже установленного оборудования.
Воды, применяемой в хозяйственно-бытовом назначении; оценки работы системы водоочистки.
пластиковая бутылка 1,5 — 2 л.
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для любых источников воды
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Включает полный перечень тяжелых металлов
- Позволяет корректно и экономично настроить водоочистное оборудование
- Содержит полный перечень опасных органических веществ
Помимо хичиеского анализа воды мы настоятельно рекомендуем провести микробиологическое исследование Вашей воды. Микробиологический анализ воды включает определение общего микробного числа (ОМЧ), количества общих колиформных и колиформных термотолерантных бактерий.
источник
Во многих областях Украины водопроводная вода обрабатывается хлором. Хлорирование воды – распространённая практика в коммунальном хозяйстве, так как позволяет дезинфицировать воду и избежать размножения инфекций. Многие считают, что единственный недостаток хлорированной воды – неприятный запах. Но превышение хлоридов в воде может негативно отразиться на здоровье. Именно поэтому в спорных случаях необходим анализ воды на хлор. Почему норма хлоридов в питьевой воде может быть превышена и насколько это опасно – узнаете из нашей статьи.
Хлор – один из элементов необходимых для нормальной жизнедеятельности человеческого организма. Дефицит хлора может спровоцировать общую слабость, снижение давления, ухудшение аппетита и т.п. В основном суточная потребность в хлоридах восполняется организмом за счёт обыкновенной поваренной соли. Содержится хлор и в ряде продуктов нашего повседневного рациона (хлеб, масло, сыр, яйца и т.п.). Также хлор может попадать в организм и с питьевой водой. Предельно допустимая концентрация хлоридов в воде устанавливается по органолептическому показателю – вкусовым качествам. При концентрации хлорида натрия больше 250 мг/л вода уже имеет солоноватый вкус. А вот хлоридов кальция или магния для такого же эффекта нужно не менее 1000 мг/л. Усреднённая норма хлоридов в питьевой воде составляет не более 250 мг/л. (В отдельных случаях, связанных с природными условиями и технологией подготовки воды в Украине до 2020 года допускается концентрация до 350 мг/л).
Если же анализ воды на хлор показывает превышение нормы, употребление её может негативно отразиться на здоровье.
Вообще, хлориды в воде в природе содержатся как в поверхностных, так и в грунтовых водах. В коммунальном хозяйстве хлор широко применяется для дезинфекции воды и уничтожения бактерий, но вместе с тем это достаточно опасное токсичное вещество. Среди наиболее распространённых хлоридов: хлорид натрия (обычная поваренная соль), хлорид водорода, хлорид магния, диоксид хлора и т.д. Анализ воды на хлориды и хлор обязательно входит в перечень показателей химического анализа, помогающего определить качество воды. С одной стороны, хлор эффективно борется с бактериями и решает проблему чистоты воды. Но, в то же время, в воде после добавления хлора могут возникать так называемые тригалометаны. Это токсины, которые образуются при реакции хлора с природными элементами в воде. Вот эти-то вещества, попадая в наш организм с водопроводной водой, могут привести к серьёзным проблемам со здоровьем. Например, таким как:
- астма
- кожные заболевания
- заболевания сердечнососудистой системы
Но самое опасное, что эти вещества являются канцерогенами и провоцируют развитие онкологических заболеваний. Украинские учёные пришли к выводу, что для оценки концентрации тригалометанов, которые образуются в процессе водоподготовки, можно использовать такой показатель как общий органический углерод. Он также, как и хлориды, определяется при химическом анализе воды.
Если анализ воды на хлориды и хлор показал превышение нормы, то опасно не только пить такую воду, но и купаться в ней. Поскольку хлор легко проникает в организм и через кожу.
Повышенное содержание хлора и хлоридов в воде не только делает её неприятной на вкус, при этом она становится практически непригодной для многих хозяйственных нужд (в частности, для полива).
Существенное превышение хлоридов в воде говорит о том, что, скорее всего, где-то была нарушена технология водоподготовки. Поскольку постоянное использование воды с превышенным уровнем хора может негативно отразиться на здоровье, не лишним будет перестраховаться и при малейшем подозрении сдать воду на анализ. Заподозрить неладное можно, например, если вы почувствовали, что характерный запах хлора усилился.
При заборе пробы для анализа воды на хлор обратите внимание, что для получения объективных результатов образец должен оказаться в лаборатории максимум через два часа.
Что же делать, если лабораторные исследования подтвердили превышение хлоридов в воде? Сразу отметим, что кипячение никоим образом не помогает снизить уровень хлора. Более того, при нагревании хлор реагирует с солями находящимися в воде и образует ещё более опасные вещества. Поэтому к способам, которые «реально работают» стоит отнести два:
- отстаивание (хлор очень летучий и на воздухе его содержание в воде резко снижается)
- фильтрация
Это может показаться парадоксальным, но даже установка недешёвого фильтра окупится достаточно быстро. Не говоря уже об удобстве. Ведь отстаивать воду для того, чтобы принять ванну – занятие хлопотное, а покупка бутилированной воды для питья и готовки влетит «в копеечку». При этом с проблемой избыточного хлора справляются даже недорогие угольные фильтры.
Заботьтесь о здоровье и следите за качеством питьевой воды!
источник
Хлориды в крови: возможные причины, симптомы, проведение диагностических исследований, консультация врача и лечение
Для обнаружения и предупреждения болезней на ранних стадиях делается анализ крови. Нахождение хлора в тканях является значимым маркером медицинской диагностики. Биохимия крови очень важна для определения общего состояния пациента. Часто назначают анализ на уровень хлоридов в крови. Что означают его результаты? Что делать, если обнаружена гирепхлоремия или гипохлоремия?
Хлор – это компонент, который входит в состав не только желудочного сока, но и межклеточной жидкости. Данный элемент представляется в виде самостоятельных ионов, заряженных отрицательно (анионов). Их функции разные, но основной является поддержание гидростатического воздействия и кислотного баланса в норме. Хлор поступает в организм вместе с пищей. Главным органом сбережения выступает кожа, в клеточках которой сохраняется более 50 % прибывающего хлора. При нормальном функционировании человеческого организма изменение концентрации хлоридов обусловлено поддержанием нейтральной среды.
Нормальная насыщенность хлорида в крови взрослых людей 98-107 ммоль на литр. Неизменное сохранение водно-солевого баланса — это основное условие для нормальной работы организма, поэтому состав крови должен быть стабильным. Непрерывное повышение либо снижение доли хлора указывает на присутствие патологии.
Объект биохимии — это 5-10 миллилитров крови (образец, взятый на голодный желудок из вены).
Анализ предписывается для таких целей:
- Оценить кислотный и электролитный баланс.
- Диагностировать болезни почек и печени, сопровождаемых патологией обмена веществ, судорожных состояний и патологий сознания.
- Контролировать водно-солевой баланс у больных, проходящих длительную инфузионную терапию.
- Выяснить показатели при болезнях инфекционного и неинфекционного характера, сопровождаемых долгой диареей и тошнотой.
Число хлоридов оценивают в комбинации с присутствием катионов натрия и калия. Разница между числом содержащегося натрия (в качестве главного катиона крови) и числом содержащегося хлора и бикарбоната называется анионовым разрывом. Данный показатель, как правило, составляет 8-16 ммоль/л, а его превышение нормы указывает о жестком несоблюдении кислотно-щелочного баланса.
Повышенные хлориды в крови (гиперхлоремия) — это отклонение, при котором прослеживается излишек хлора.
Для человека могут быть серьезные последствия, если он за один раз употребил 15 гр хлора. Это серьезный показатель, так как компонент токсичен. Он уничтожает здоровые клетки организма, в результате начинаются нарушения здоровья. Если не принимать меры, у человека диагностируется обезвоживание. На повышение хлора в крови могут указывать такие симптомы:
- Задержка жидкости.
- Высокое АД.
- Сбои в сердечном ритме.
- Слабость мышц.
- Покалывания в мышцах, онемение.
- Судороги.
Такое явление наблюдается у тех, кто употребляет продукты питания или медикаменты, в которых содержится повышенное количество этого вещества. Медики обосновали, что прием 15 г хлора за один раз способен стать причиной кишечных инфекций, так как этот компонент токсичен.
Существует два фактора, по которым можно определить, повышены хлориды в крови или нет:
Причины возникновения патологии обуславливаются дисфункцией мочевыделительной и пищеварительной систем. Если пациент страдает нефритом или нефрозом, то эти патологии приводят к задержке в тканях жидкости и солей, вследствие чего они со временем начинают накапливаться.
Концентрация хлора при этом растет. Другие причины:
- Повышенное содержание в крови натрия.
- Недоедание, диеты, основанные на голодании.
- Повышенное употребление соленой пищи.
- Обезвоживание организма.
- Сахарный диабет.
- Болезни сердца.
- Почечная недостаточность.
- Лечение некоторыми медикаментами.
Нормальным уровнем хлорида натрия в крови является примерно 98-107 ммоль на литр. Обезвоживание организма опасно образованием тромбов внутри сосудов. Пониженные хлориды в крови (гипохлоремия) прослеживаются при осмотическом давлении при наличии нарушения щелочно-кислотного баланса у человека. Недостаточное количество хлоридов в крови часто появляется при заболеваниях ЖКТ (гастрит, язва и другие).
Нехватка макроэлемента вызывает такие симптомы:
- Рвота.
- Чрезмерное потоотделение.
- Ломкие волосы, ногти и зубы.
- Запоры.
- Отеки
- Нарушения обмена веществ.
- Высокое АД.
Также при нехватке хлора прослеживается слабость мышц с конвульсивными движениями, бывает нарушение дыхания, появляются проблемы с пищеварением. Поэтому организм непосредственно ориентирует хлориды в крови в необходимом направлении для нормализации самочувствия.
Достоверных данных о признаках недостатка хлора у человека не существует, потому как лабораторные исследования проводились только лишь на крысах.
О недостатке хлора могут свидетельствовать следующие признаки:
- Безусловное исчерпание до развития анорексии.
- Редкостное желание испражняться.
- Выпадение волос, а порой даже зубов.
- Возникновение отека.
- Серьезный скачок кровяного давления вплоть до скептически высочайших уровней (хоть все зависит от особенностей организма и его взаимодействия на недостаток хлора).
- Формирование алкалоза.
Если человек начал очень стремительно сбрасывать вес без явных причин либо волосы стали ломкими, не лишним будет посетить клинику, чтобы сделать анализ крови и уточнить количественный показатель этого микроэлемента в организме.
Определение хлоридов в крови производится путем анализа крови. Его берут из вены натощак. Норма хлоридов в крови колеблется в пределах от 98 до 107 ммоль/литр.
Часто требуется проведение дополнительных обследования состояние почек и печени.
Если больной принимает медицинские препараты, содержащие соли хлора, перед анализом нужно прервать такую терапию. Время, за сколько нужно это сделать, определяется периодом выведения из организма составляющих препарата, что указывается в инструкции к ним. Также за сутки до сдачи анализа крови на хлориды нужно исключить из рациона продукты с повышенным содержанием этих элементов.
Ниже приведена таблица, в которой указано, сколько в сутки допускается поступление хлоридов в организм:
Отклонения в том либо другом направлении от отмеченных пределов отразятся на состоянии здоровья.
Чтобы не допустить превышения нормы хлоридов, следует соблюдать баланс потребления воды. Взрослым следует пить около 2,5 литров чистой воды в день. Для деток до 5 лет этот показатель составляет 500 мл, а для подростков — 1 литр. Разумеется, это средний показатель. В летний период и для людей, работающих в горячих цехах (пекарни, сталевары, кузнецы и т. д.) норма должна быть выше.
При повышенном содержании хлоридов больному назначают:
- Лекарства против тошноты, рвоты, поноса.
- Повышенное потребление воды (до 3 литров в день).
- Запрет на употребление алкоголя и кофеина.
- Лечение основных заболеваний (при сахарном диабете контроль глюкозы в крови).
- Если больной в тяжелом состоянии, ему назначают внутривенное ведение жидкости.
- Диету.
При гипохлоремии назначают препараты, включающие хлорид натрия. При тяжелом состоянии больного их вводят внутривенно (с помощью капельницы). В обязательном порядке назначается диета, в состав которой должны входить продукты с повышенным содержанием хлоридов.
Чтобы избежать повышенного или пониженного содержания хлоридов в крови, нужно отказаться от потребления соли в повышенных количествах, пить не менее 2,5 литров чистой негазированной воды ежедневно, вовремя осуществлять лечение заболеваний внутренних органов и сахарного диабета, вовремя проходить обследование. Предлагаем список продуктов, в которых содержится много хлоридов:
- Оливки.
- Сельдерей.
- Помидоры.
- Салаты разных сортов.
- Колбасные изделия, ветчина.
- Рожь.
- Еда фаст-фудов.
- Сыры.
- Горох.
- Гречка.
- Яйца куриные.
- Рис.
- Некоторые виды рыбы (скумбрия, камбала, хек, мойва, тунец, карась.
Ориентируясь на этот список, можно составлять для себя правильное ежедневное меню.
источник
Цель работы.Научиться определять содержание хлоридов в воде и осуществлять первичную обработку результатов.
Реактивы и растворы.
1. Раствор нитрата серебра (АgNОз), 1 млкоторого осаждает 1 мгСl ¯ . Берут навеску 4,791 г кристаллического нитрата серебра и растворяют в мерной колбе на 1 л дистиллированной воды.
2.10%-ный раствор хромата калия, не содержащий хлоридов. Берут 100 г К2СrO4 и растворяют в небольшом количестве дистиллированной воды, затем добавляют несколько капель АgNO3, до появления красновато-бурого осадка. Дают раствору отстояться, затем фильтруют и доводят объем его до 1000 мл дистиллированной водой.
3. Раствор хлорида натрия, 1 мл которого содержит точно 1 мг Сl — .Берут навеску 1,6486 г химически чистого NаСl и растворяют дистиллированной водой в мерной колбе на 1 л.
1. Конические колбы объемом 300 мл — по числу проб плюс одна.
2. Пипетки: на 10 мл для раствора NаСl; на 1 мл градуированная для раствора К2СгO4.
3. Мерный цилиндр на 100 мл.
Общие сведения.Хлориды являются главной составной частью солевого состава морской воды. В водоемах суши их содержание незначительно, за исключением некоторых озер, расположенных на засолоненных почвах или преимущественно питающихся высокоминерализованными грунтовыми водами. Такие водоемы встречаются в некоторых местах на южных территориях Украины и России и в Средней Азии. Содержание хлоридов в этих водоемах достигает сотен и даже тысяч миллиграммов в 1 л, хотя обычно их количество в водах суши не превышает 100 мг/л. Если гидрометеорологическими условиями повышенное содержание хлоридов объяснено быть не может, оно служит показателем постороннего загрязнения. В водоемах суши хлориды определяют для получения величины минерализации и загрязнения, в морях и океанах по количеству хлоридов рассчитывают соленость воды.
Принцип определения.Определение хлоридов в пресной воде аргентометрическим методом основано на осаждении анионов хлора раствором нитрата серебра при титровании. В качестве индикатора применяют раствор хромата калия. Химическую сущность происходящего можно представить уравнением реакции:
Как только все анионы хлора окажутся связанными, начнется реакция:
На образование соли Аg2СгO4 укажет переход цвета раствора от лимонно-желтого к красноватому, не исчезающему при взбалтывании.
Принцип определения хлорности и солености морской воды аналогичен принципу определения хлоридов в пресной воде. Однако в технике определения хлорности морской воды много существенных отличий от техники определения хлоридов в пресных водоемах.
Для определения хлорности готовят раствор нитрата серебра такой концентрации, чтобы отсчет по бюретке при титровании морской воды примерно соответствовал величине хлорности. Например, для воды с нормальной (35%) соленостью, хлорность которой равна 19,38% (уд.вес 1,02674), концентрация нитрата серебра составит:
где 4,791 — количество АgNО3, осаждающее 1 г хлора, при условии, что на титрование берется 15 мл морской воды.
Для приготовления 1 л раствора берут навеску АgNO3 в количестве 3,71 г, учитывая наличие примесей в соли АgNO3, которая выпускается промышленностью.
При определении хлорности морской воды применяют особые бюретки и пипетки. Эти бюретки отличаются от обычных наличием приспособлений для автоматического заполнения и установления раствора на нулевом делении. На каждое деление бюретки приходится объем 2 мл, целое деление в свою очередь подразделяется на 20 дробных делений. Это позволяет вести отсчет при титровании с точностью до 0,01 мл. Бюретки выпускают нескольких типов для определения различной хлорности.
Пипетки применяют автоматические, одинаковой вместимости ―15 мл. Пробу объемом 15 мл помещают в специальную титровальную с толстым овальным дном рюмку вместимостью около 300 мл. При титровании пробу тщательно перемешивают стеклянной палочкой.
Для проверки титра раствора нитрата серебра и определения хлорности в испытуемой воде необходимо в одинаковых с пробой условиях оттитровывать пробу морской воды с точно известной величиной хлорности (так называемой «нормальной» воды). Нормальная вода — это океаническая вода, хлорность которой точно определена и соответствует средней солености океана (35%). Нормальную морскую воду выпускают в стеклянных запаянных баллончиках вместимостью 250 мл, на этикетке которых указана точная величина хлорности.
Ход определения.В коническую колбу берут 100 мл испытуемой воды (если вода с большей мутностью, ее фильтруют), добавляют 1 мл 10%-ного раствора К2СгО4 и титруют раствором АgNОз при постоянном перемешивании до появления устойчивого красноватого оттенка. Желательно вести титрование с двумя «свидетелями» (в одной колбе проба только с К2СгО4, в другой — немного перетитрованная проба).
Определение поправки к титру раствора АgNO3.Поправку к титру АgNОз определяют по точному раствору NаСl, 1 мл которого содержит 1 мг Сl¯.
В коническую колбу помещают 10 мл раствора МаСl, доводят объем до50 мл дистиллированной водой, прибавляют 0,5 мл 10%-ногораствора К2CrO4 и титруют раствором нитрата серебра до изменения окраски раствора. Поправку определяют по формуле (*), где n — количество мл раствора АgNО3, пошедшее на титрование 10 мл раствора NаСl.
Вычисление результатов.Все записи при выполнении работы делаются в таблице по образцу табл.1 (прилож.).
Содержание анионов хлора в пресной воде определяют по формуле:
С(Сl¯) = (А×1×К×1000)/Vмг/л (31)
где А — количество раствора АgNО3, пошедшее на титрование пробы, мл;
1 — количество Сl¯, которое осаждает 1 мл раствора АgNО3 при титровании;
К— поправка к титру раствора АgNO3; V— объем пробы, взятый для анализа.
Содержание Сl¯, кроме того, выражают в ммоль(экв)/л, для чего результат, полученный в мг/л, делят на 35,445 мг. Результаты расчета следует округлить до 0,001 ммоль(экв)/л и 0,1 мг/л.
Результаты титрования при определении хлорности морской воды вычисляют по формуле:
Сl % = а + К (32)
где а — исправленный отсчет бюретки (отсчет с учетом поправки бюретки после титрования пробы), К- поправка титрования, которую находят по «Океанографическим таблицам» [8]. Зная хлорность, в «Океанографических таблицах» находят соленость воды; величину, которой (г/кг) выражают в промилле (%).
Отчет.Отчет по данной лабораторной работе состоит в устном собеседовании с преподавателем. Результаты измерений представляются по установленной форме.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. От чего зависит содержание в воде хлоридов?
2. Каков принцип определения хлоридов в пресной воде?
3. Какая существует зависимость между количеством АgNO3, пошедшим на титрование пробы, и содержанием в воде Сl¯?
4. Что такое соленость морской воды и как ее определяют?
5. В каких единицах выражают количество хлоридов, содержащихся в воде, а также величину солености?
источник
Окисляемость показывает количество кислорода в миллиграммах, необходимого для окисления органических веществ, содержащихся в 1 дм³ воды.
Воды поверхностных и подземных источников имеют разную окисляемость — у подземных вод величина окисляемости незначительна, за исключением болотных вод и вод нефтяных месторождений. Окисляемость горных рек ниже, чем равнинных. Наибольшая величина окисляемости (до десятков мг/дм³) — у рек с питанием болотными водами.
Величина окисляемости закономерно изменяется в течение года. Окисляемость характеризуется несколькими величинами — перманганатной, бихроматной, йодатной окисляемостью (в зависимости от того, какой окислитель используется).
ПДК окисляемости воды имеют следующие значения: химическое потребление кислорода или бихроматная окисляемость (ХПК) водоемов питьевого назначения не должна превышать 15 мг О₂ /дм³. Для водоемов в зонах рекреации величина ХПК не должна превышать 30 мг О₂ /дм³.
Водородный показатель (pH) природной воды показывает количественное содержание в ней угольной кислоты и ее ионов.
Санитарно-гигиенические нормативы для водоемов разного типа водопользования (питьевого, рыбохозяйственного, рекреационных зон) устанавливают ПДК pH в интервале 6,5-8,5.
Концентрация ионов водорода, выраженная величиной pH — один из важнейших показателей качества воды. Величина pH имеет решающее значение при протекании многочисленных химических и биологических процессов в природной воде. Именно от величины pH зависит, какие растения и организмы будут развиваться в данной воде, каким образом будет происходить миграция элементов, от этой величины также зависит степень коррозионной активности воды на металлические и бетонные конструкции.
От величины pH зависят пути превращения биогенных элементов и степени токсичности загрязняющих веществ.
Жесткость природной воды проявляется вследствие содержания в ней растворенных солей кальция и магния. Суммарное содержание ионов кальция и магния является общей жесткостью. Жесткость можно выражать несколькими единицами измерения, на практике чаще используют величину мг-экв/дм³.
Высокая жесткость ухудшает бытовые характеристики и вкусовые свойства воды, оказывает неблагоприятное воздействие на здоровье человека.
ПДК по жесткости питьевой воды нормируется величиной 10,0 мг-экв/дм³.
К технической воде отопительных систем предъявляют более строгие требования по жесткости их-за вероятности образования накипи в трубопроводах.
Присутствие аммиака в природной воде обусловлено разложением азотсодержащих органических веществ. Если аммиак в воде образуется при разложении органических остатков (фекальное загрязнение), то такая вода непригодна для питьевых нужд. Аммиак определяется в воде по содержанию ионов аммония NH₄⁺.
ПДК аммиака в воде составляет 2,0 мг/дм³.
Нитриты NO₂⁻ являются промежуточным продуктом биологического окисления аммиака до нитратов. Процессы нитрификации возможны только в аэробных условиях, в противном случае природные процессы идут по пути денитрификации — восстановления нитратов до азота и аммиака.
Нитриты в поверхностных водах находятся в виде нитрит-ионов, в кислых водах частично могут быть в форме недиссоциированной азотистой кислоты (HN0₂).
Содержание нитритов в поверхностных водах существенно ниже, чем в водах подземного происхождения. Подземные воды верхних водоносных горизонтов могут содержать нитритов до десятых долей миллиграмма на литр.
ПДК нитритов в воде составляет 3,3 мг/дм³ (по нитрит-иону), или 1 мг/дм³ в пересчете на азот аммонийный. Для водоемов рыбохозяйственного назначения нормы составляют 0,08 мг/дм³ по нитрит-иону или 0,02 мг/дм³ в пересчете на азот.
Нитраты по сравнению с другими азотными соединениями наименее токсичны, однако в значительных концентрациях вызывают вредные последствия для организмов. Основная опасность нитратов — в их способности накапливаться в организме и окисляться там до нитритов и нитрозаминов, которые значительно более токсичны и способны вызывать так называемое вторичное и третичное нитратное отравление.
Накопление больших количеств нитратов в организме способствует развитию метгемоглобинемии. Нитраты вступают в реакцию с гемоглобином крови и образуют метгемоглобин, которые не переносит кислород и, таким образом, вызывает кислородное голодание тканей и органов.
Подпороговая концентрация нитрата аммония, не оказывающая вредных последствий на санитарный режим водоема составляет 10мг/дм³.
Для водоемов рыбохозяйственного назначения повреждающие концентрации нитратов аммония для различных видов рыб начинаются с величин порядка сотен миллиграммов на литр.
ПДК нитратов для питьевой воды составляет 45 мг/дм³ , для рыбохозяйственных водоемов —40 мг/дм³ по нитратам или 9,1 мг/дм³ по азоту.
Хлориды в повышенной концентрации ухудшают вкусовые качества воды, а при высокой концентрации делают воду непригодной для питьевых целей. Для технических и хозяйственных целей содержание хлоридов также строго нормируется. Вода, в которой много хлоридов непригодна для орошения сельскохозяйственных насаждений.
ПДК хлоридов в питьевой воде не должно превышать 350 мг/дм³, в воде рыбохозяйственных водоемов — 300мг/дм³.
Сульфаты в питьевой воде ухудшают ее органолептические показатели, при высоких концентрациях оказывают физиологическое воздействие на организм человека. Сульфаты в медицине используются как слабительное средство, поэтому их содержание в питьевой воде строго нормируется.
Содержание сульфатов в технической воде также подлежит контролю. В присутствии кальция сульфаты образуют накипь, что важно учитывать при подготовке вод, питающих паросиловые установки.
Содержание сульфатов в промышленной и питьевой воде может быть благоприятным или нежелательным фактором.
Сульфат магния определяется в воде на вкус при содержании от 400 до 600 мг/дм³, сульфат кальция — от 250 до 800 мг/дм³.
ПДК сульфатов для питьевой воды — 500 мг/дм³, для вод рыбохозяйственных водоемов —100 мг/дм³.
О влиянии сульфатов на процессы коррозии нет достоверных данных, но отмечается, что при содержании сульфатов в воде свыше 200 мг/дм³ из свинцовых труб вымывается свинец.
Соединения железа поступают в природную воду из природных и антропогенных источников. Значительные количества железа поступают в водоемы вместе со сточными водами металлургических, химических, текстильных и сельскохозяйственных предприятий.
При концентрации железа свыше 2 мг/дм³ ухудшаются органолептические показатели воды— в частности, появляется вяжущий привкус.
Высокое содержание железа делает воду непригодной для питьевых и технических целей.
ПДК железа в питьевой воде 0,3 мг/дм³,при лимитирующем показатели вредности – органолептическом. Для вод рыбохозяйственных водоемов — 0,1 мг/дм³, лимитирующий показатель вредности — токсикологический.
Высокие концентрации фтора наблюдаются в сточных водах стекольных, металлургических и химических производств (при производстве удобрений, стали, алюминия и др.), а также на горнорудных предприятиях.
Содержание фтора в питьевой воде нормируется. Повышенное содержание фтора в питьевой воде вызывает заболевание костной ткани — флюороз. Недостаток фтора тоже опасен. В местностях, где в питьевой воде содержание фторидов понижено – менее 0,01 мг/дм³, у людей чаще развивается кариес зубов.
ПДК по фтору в питьевой воде составляет 1,5 мг/дм³, при лимитирующем показателе вредности санитарно-токсикологическом.
Щелочность — показатель, логически противоположный кислотности. Щелочность природных и технических вод – способность содержащихся в них ионов нейтрализовать эквивалентное количество сильных кислот.
Показатели щелочности воды необходимо учитывать при реагентной подготовке воды, в процессах водоснабжения, при дозировании химических реагентов.
Если концентрация щелочноземельных металлов повышена, знание щелочности воды необходимо при определении пригодности воды для систем орошения.
Щелочность воды и показатель pH используются в расчете баланса угольной кислоты и определении концентрации карбонат-ионов.
Поступление кальция в природные воды идет из естественных и антропогенных источников. Большое количество кальция поступает в природные водоемы со стоками металлургических, химических, стекольных и силикатных производств, а также при стоке с поверхности сельхозугодий, где применялись минеральные удобрения.
ПДК кальция в воде рыбохозяйственных водоемов составляет 180 мг/дм³.
Ионы кальция относятся к ионам жесткости, которые образуют прочную накипь в присутствии сульфатов, карбонатов и некоторых других ионов. Поэтому содержание кальция в технических водах, питающих паросиловые установки, строго контролируется.
Количественное содержание в воде ионов кальция необходимо учитывать при исследовании карбонатно-кальциевого равновесия, а также при анализе происхождения и химсостава природных вод.
Алюминий известен как легкий серебристый металл. В природных водах он присутствует в остаточных количествах в виде ионов или нерастворимых солей. Источники попадания алюминия в природные воды — сточные воды металлургических производств, переработки бокситов. В процессах водоподготовки соединения алюминия применяют в качестве коагулянтов.
Растворенные соединения алюминия отличаются высокой токсичностью, способны накапливаться в организме и приводить к тяжелым поражениям нервной системы.
ПДК алюминия в питьевой воде не должна превышать 0,5 мг/дм³.
Магний — один из важнейших биогенных элементов, играющий большую роль в жизнедеятельности живых организмов.
Антропогенные источники поступления магния в природные воды— сточные воды металлургии, текстильной, силикатной промышленности.
ПДК магния в питьевой воде — 40 мг/дм³.
Натрий — щелочной металл и биогенный элемент. В небольших количествах ионы натрия выполняют важные физиологические функции в живом организме, в высоких концентрациях натрий вызывает нарушение работы почек.
В сточных водах натрий поступает в природные воды преимущественно с орошаемых сельхозугодий.
ПДК натрия в питьевой воде составляет 200 мг/дм³.
Элемент марганец содержится в природе в виде минеральных соединений, а для живых организмов является микроэлементом, то есть в малых количествах необходим для их жизнедеятельности.
Значительное поступление марганца в природные водоемы происходит со стоками металлургических и химических предприятий, горно-обогатительных фабрик и шахтных производств.
ПДК ионов марганца в питьевой воде —0,1 мг/дм³, при лимитирующем показателе вредности органолептическом.
Избыточное поступление марганца в организм человека нарушает метаболизм железа, при тяжелых отравлениях возможны серьезные психические расстройства. Марганец способен постепенно накапливаться в тканях организма, вызывая специфические заболевания.
Используемый для обеззараживания воды гипохлорит натрия присутствует в воде в виде хлорноватистой кислоты или иона гипохлорита. Использование хлора для дезинфекции питьевых и сточных вод, несмотря на критику метода, до сих пор широко используется.
Хлорирование также применяется в процессах изготовления бумаги, ваты, для дезинсекции холодильных установок.
В природных водоемах активный хлор присутствовать не должен.
ПДК свободного хлора в питьевой воде 0.3 — 0.5 мг/дм³.
Нефтепродукты — одни из наиболее опасных загрязнителей природных водоемов. Нефтепродукты попадают в природные воды несколькими путями: в результате разливов нефти при авариях нефтеналивных судов; со сточными водами нефтегазовой промышленности; со сточными водами химических, металлургических и других тяжелых производств; с хозяйственно-бытовыми стоками.
Небольшие количества углеводородов образуются в результате биологического разложения живых организмов.
Для санитарно-гигиенического контроля определяются показатели содержания растворенной, эмульгированной и сорбированной нефти, поскольку каждый перечисленный вид по-разному влияет на живые организмы.
Растворенные и эмульгированные нефтепродукты оказывают многообразное неблагоприятное воздействие на растительный и животный мир водоемов, на здоровье человека, на общее физико-химическое состояние биогеоценоза.
ПДК нефтепродуктов для питьевой воды —0,3 мг/дм³, при лимитирующем показатели вредности органолептическом. Для водоемов рыбохозяйственного назначения ПДК нефтепродуктов 0,05 мг/дм³.
Полифосфатные соли используются в процессах водоподготовки для умягчения технической воды, в качестве компонента средств бытовой химии, как катализатор или ингибитор химических реакций, как пищевая добавка.
ПДК полифосфатов для воды хозяйственно-питьевого назначения — 3,5 мг/дм³, при лимитирующем показатели вредности органолептическом.
Кремний – распространенный в земной коре элемент, входит в состав многих минералов. Для организма человека является микроэлементом.
Значительное содержание кремния наблюдается в сточных водах керамических, цементных, стекольных и силикатных производств, при производстве вяжущих материалов.
ПДК кремния в питьевой воде — 10 мг/дм³.
Сульфиды — серосодержащие соединения, соли сероводородной кислоты H₂S. В природных водах содержание сероводорода позволяет судить об органическом загрязнении, поскольку сероводород образуется при гниении белка.
Антропогенные источники сероводорода и сульфидов — хозяйственно-бытовые сточные воды, стоки металлургических, химических и целлюлозных производств.
Высокая концентрация сероводорода придает воде характерный неприятный запах (тухлых яиц) и токсичные свойства, вода становится непригодной для технических и хозяйственно-питьевых целей.
ПДК по сульфидам — в водоемах рыбохозяйственного назначения содержание сероводорода и сульфидов недопустимо.
Химически активный металл, в естественной форме является микроэлементом растительных и животных организмов.
Повышенные поступления стронция в организм изменяют метаболизм кальция в организме. Возможно развитие стронциевого рахита или «уровской болезни», при которой наблюдается задержка роста и искривление суставов.
Радиоактивные изотопы стронция вызывают у человека канцерогенный эффект или лучевую болезнь.
ПДК природного стронция в питьевой воде составляет 7 мг/дм³, при лимитирующем показателе вредности санитарно-токсикологическом.
источник
Содержание хлоридов в исследуемом растворе (рС1—) устанавливают по градуировочному графику.[ . ]
Содержание хлорид-ионов в воде природных водоемов варьирует в широких пределах. В речной и озерных водах, особенно в северных районах нашей страны (см. рис. 3.8), концентрация их невелика. Однако с увеличением минерализации воды абсолютное и относительное количество С1 возрастает;, в морях и большей части соляных озер он является главным анионом; в морской воде хлорид-ионы составляют 87% массы всех анионов. Объясняется это хорошей растворимостью хлоридов кальция, магния, натрия (см. п. 2.4.2.2) и малой растворимостью Са504 и СаС03. Поэтому с увеличением солесодержания в воде такие широко распространенные ионы, как БО и С03 (НСО ), достигая величин произведения растворимости в присутствии ионов Са2+ (см. п. 2.4.4), начинают выделяться в осадок, уступая» место иону С1 .[ . ]
Содержание хлорид-иона можно определять титрованием 0,05 н. раствором А§1 03, но лучше всего потенциометрически относительно серебряного электрода, покрытого хлоридом серебра. Предел обнаружения в зависимости от чувствительности титрования составляет 1—5 млн-1 в 60 л воздуха.[ . ]
Определение хлоридов служит контролем постоянства солевого фона сточной воды, изменяющейся во время очистки в органической части, и для суждения о «согласованности» анализируемых проб. Содержание хлоридов колеблется от 180 до 300 мг/л.[ . ]
Содержание хлоридов — ниже допустимой нормы, поэтому применение сточных вод в сельском хозяйстве при наличии достаточных площадей вполне возможно. Однако предварительно необходимо проверить, нужны ли и в какой степени мероприятия по уменьшению, а в некоторых случаях и уничтожению неприятного запаха.[ . ]
Содержание хлоридов в воде определяет и ее пригодность для питья. Для питьевой воды предельное значение составляет 200 мг/л. Вода с ббльшим содержанием либо солона, либо горька на вкус. Содержание хлоридов в воде также определяет возможность ее использования в сельском хозяйстве, в том числе для парников и оранжерей. В зависимости от вида растений предельная концентрация хлоридов составляет 50—300 мг/л.[ . ]
Хлориды являются составной частью большинства природных вод. Как и сульфаты, они определяют некарбонатную жесткость воды. Содержание хлоридов естественного происхождения имеет большой диапазон колебаний. Однако в воде рек концентрация хлоридов невелика — она не превышает обычно 10 мг/л, поэтому повышенное количество хлор-ионов указывает на загрязнение .источника сточными водами. В воде источников централизованного водоснабжения концентрация хлоридов не должна превышать 350 мг/л.[ . ]
Хлориды являются составной частью большинства природных вод. Большое содержание хлоридов геологического происхождения в поверхностных водах — явление редкое. Поэтому обнаружение большого количества хлоридов является показателем загрязнения воды бытовыми или некоторыми промышленными сточными водами. В промышленных сточных водах содержание хлоридов зависит от характера производства. Постепенное повышение содержания хлоридов в поверхностных водах может служить мерилом загрязнения водоемов сточными водами.[ . ]
Хлориды — главные ионы природных вод, обладают большой миграционной способностью, что объясняется их хорошей растворимостью, слабо выраженной способностью к сорбции на взвешенных веществах и к потреблению водными организмами. Хлориды ухудшают вкусовые качества воды и делают ее малопригодной для питьевого водоснабжения, поэтому контроль содержания хлоридов в воде водоемов имеет важное значение для оценки качества воды. Для рыбохозяйственных водных объектов ПДК хлоридов составляет 300 мг/л.[ . ]
Содержание хлоридов также более или менее постоянно. Изменение массы хлоридов указывает на примесь производственных сточных вод.[ . ]
Хлориды являются преобладающим анионом в высокоминерализованных водах. Концентрация хлоридов в поверхностных водах подвержена сезонным колебаниям, коррелирующим с изменением общей минерализации воды. В незагрязненных речных водах и водах пресных озер содержание хлоридов колеблется от долей миллиграмма до десятков и сотен, в подземных и морских водах — значительно выше.[ . ]
При содержании хлоридов менее 250 мг/л берут 100 мл фильтрованной испытуемой воды. При большем содержании хлоридов берут 10-50 мл. Испытуемую воду наливают в две конические колбы, доводят до 100 мл дистиллированной водой, прибавляют 5 капель раствора К2Сг04. Раствор в одной колбе титруют AgN03, а вторая колба используется для контроля.[ . ]
Помимо хлоридов кальция и магния в составе солей, растворенных в воде, присутствующей в сырье, находится хлорид натрия, который, как известно, гидролизу не подвергается, но существенно повышает проводимость коррозионной среды и за счет этого повышает ее агрессивность. С другой стороны, он способствует развитию питтинговой коррозии и коррозионному растрескиванию аустенит-ных сталей, так как, так же как хлориды магния и кальция, является поставщиком ионов хлора. Именно этим и объясняются, на наш взгляд, аномально высокие скорости коррозии верхних тарелок колонны, выполненных из стали 12Х18Н10Т в 1997 г., когда участились вынужденные остановки установки, а на завод поступала нефть с высоким содержанием хлоридов и воды. Как показано в отчетах главного технолога завода, всего после нескольких дней эксплуатации колонны в условиях образования аномально высокого содержания НС1 глубина поражения этих элементов достигла 0,5 мм. Таким образом, применявшиеся методы защиты (ингибирование, нейтрализация и использование тарелок из стали 12Х18Н10Т) не смогли привести к должному уровню надежности эксплуатации аппарата. Применение защитного колпака из стали 08Х17Н13М2Т можно считать лишь временной мерой, так как эта сталь, хоть и в меньшей мере, чем 12Х18Н10Т, все-таки подвержена питтинговой коррозии под действием хлоридов, особенно в кислой среде.[ . ]
Рио.35. Влияние содержания А1СЦ на величину pH и выход активного хлора в растворах с содержанием хлоридов 0.427 г-ион/л: I — выход активного хлора. 2 — напряжение, 3 — pH исходного электролита, 4 — pH электролита после электролиза.[ . ]
В питьевой воде содержание хлоридов не должно превышать 30—50 мг/л, а содержание сульфатов — 60 мг/л. Однако это не всегда достижимо в некоторых южных маловодных районах нашей страны (Туркмения, Казахстан и др.), где местные водоисточники сильно минерализованы.[ . ]
| Изменение . содержания хлоридов в растворах дихлоруксусной | 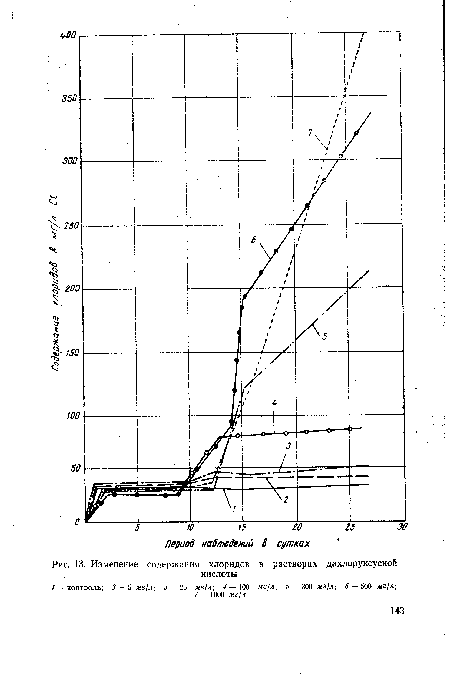 |
По ГОСТу предельное содержание сульфат-ионов в воде источников централизованного водоснабжения не должно превышать 500 мг/л, но, как правило, в речной воде концентрация сульфатов составляет 100—150 мг/л. Повышенная концентрация сульфатов может свидетельствовать о загрязнении источника сточными водами, в основном производственными. Хлориды являются составной частью большинства природных вод. Содержание хлоридов естественного происхождения имеет большой диапазон колебаний: Однако в воде рек концентрация хлоридов невелика — она превышает обычно 10—30 мг/л, поэтому повышенное количество хлор-ионов указывает на загрязнение источника сточными водами. В воде источников централизованного водоснабжения концентрация хлоридов не должна превышать 350 мг/л. Лимитирование верхнего предела концентраций сульфатов и хлоридов обусловлено тем, что более высокие концентрации этих ионов придают воде солоноватый привкус и могут вызывать нарушение в работе желудочно-кишечного тракта у людей. При некоторых соотношениях сульфатов и хлоридов вода становится агрессивной по отношению к различным типам бетона. Силикаты в растворе определяют лишь в тех природных водах, где их содержание зависит от геологическихусловий и присутствия некоторых организмов. Все эти кислоты при обычных для природных вод значениях pH малорастворимы и образуют в воде коллоидные растворы. Силикаты — нежелательная примесь в воде, питающей котлы, так как дает силикатную накипь на стенках котлов.[ . ]
Ход определения. Вносят в колбу несколько стеклянных бусинок, соединяют ее с обратным холодильником, нагревают содержимое колбы до кипения и кипятят 2 ч. Одновременно проводят холостое определение, взяв для него 25 мл дважды перегнанной (с добавлением перманганата в колбу для кипячения) воды. По охлаждении анализируемый раствор переносят в мерную колбу вместимостью 200 мл, стенки колбы при-, бора обмывают дважды перегнанной водой. Промывную — воду сливают в колбу и доводят той же водой анализируемый раствор до метки. Отобрав аликвотную порцию в 100 мл полученного раствора, переносят ее в стакан вместимостью 400—450 мл, разбавляют дистиллированной водой примерно до 300 мл и нейтрализуют 45%-ным раствором едкого натра: сначала приливают 30 мл этого раствора, потом после перемешивания прибавляют его по каплям до pH = 5—7. Нейтрализованный раствор нагревают до кипения, вносят 0,1 г прокаленной окиси магния и на-; гревают 20 мин при слабом кипении. Дают осадку собраться на дне стакана и фильтруют раствор через плотный фильтр, перенося осадок на фильтр к концу фильтрования. Осадок на фильтре промывают горячей водой до получения бесцветного фильтрата. Воронку с фильтром помещают на маленькую коническую колбу, в фильтре делают отверстие и через него смывают осадок горячей водой в колбу. Затем фильтр обрабатывают 3 мл 2 н. серной кислоты, обмывая ею предварительно стенки стакана. Фильтр и стакан хорошо промывают горячей водой, собирая промывные воды в ту же колбу и кипятят, содержимое колбы до полного растворения осадка. Полученный раствор переносят в мерную колбу вместимостью 100 мл, фильтруя его, если надо, через плотный фильтр. Приливают затем 5 мл 2 н. уксусной кислоты и смесь кипятят 5 мин. Охлаждают полученный ■ окрашенный раствор, разбавляют его дистиллированной водой до метки, перемешивают и измеряют его оптическую плотность при X = 536 нм в кювете с толщиной поглощающего слоя 5 см по отношению к раствору холостого опыта.[ . ]
Образцы для анализа на содержание органических веществ собирали в отмытые гексаном стеклянные бутылки вместимостью около 4 л, снабженные тефлоновыми пробками. Образцы для определения содержания хлоридов и взвешенных веществ отбирали в чистые полиэтиленовые литровые сосуды. Все образцы до анализа или экстрагирования хранили при 4 °С. Анализы и экстракцию взвешенных веществ проводили спустя 36 ч после отбора проб.[ . ]
Высокая растворимость хлоридов объясняет широкое распространение их во всех природных водах. В проточных водоемах содержание хлоридов обычно невелико (20-30мг/л). Незагрязненные грунтовые воды в местах с несолончаковой почвой обычно содержат до 30-50 мг/л хлор-иона. В водах, фильтрующихся через солончаковую почву, в 1 л могут содержаться сотни и даже тысячи миллиграммов хлоридов. Вода, содержащая хлориды в концентрации более 350 мг/л, имеет солоноватый привкус, а при концентрации хлоридов 500-1000 мг/л неблагоприятно влияет на желудочную секрецию. Содержание хлоридов является показателем загрязнения подземных и поверхностных водоисточников и сточных вод. Определение хлоридов ведется по методу Мора.[ . ]
Известно, что при растущем содержании хлоридов и сульфатов в бумаге, при уменьшающемся значении pH увеличивается корродирующее действие бумаги.[ . ]
Предварительные указания. Если содержание хлоридов во взятом объеме воды превышает 25 мг С1, то необходимо добавлять сульфат ртути. При наличии в воде других неорганических восстановителей следует внести поправку на потребление ими кислорода, которую устанавливают в 20 мл исследуемой воды путем ее титрования 0,0Ш раствором перманганата в слабокислой среде на холоде (см. «Определение перманганатной окисляемости»).[ . ]
Метод применяется для определения хлоридов при содержании их, превышающем 2 мг/л без разбавления можно титровать пробы с содержанием хлоридов до 400 мг/л. Точность определения +1—■ 3 мг/л. Для точного определения хлоридов при концентрациях меньше 10 мг/л пробы надо предварительно упаривать. В зависимости от концентрации хлоридов в пробе титруют 0,1 н., 0,05 н. или 0,02 н. раствором нитрата серебра.[ . ]
Наличие в сточных водах большого количества хлоридов отрицательно сказывается на процессе ионитовой очистки сточных вод. Следствием высокой концентрации хлор-ионов ¡в сточных водах являются низкая концентрация некаля в регенерате и большие расходы энергетических средств на его переработку. Содержание хлоридов в сточных водах ведет к снижению емкости поглощения ионита.[ . ]
При анализе целлюлоз, содержащих значительное количество хлоридов, может образоваться в колбе белый налет. В этом случае высушенный экстракт растворяют в 15 мл горячего спирта, добавляют 30 мл дистиллированной воды и определяют содержание хлоридов путем титрования 0,1 н. раствором AgNOз, используя в качестве индикатора К2СЮ4.[ . ]
При производстве калиевой селитры отходом является рассол с содержанием хлорида натрия 220—250 г/л. С вводом на заводе цеха утилизации хлорида натрия (рис. 1.12) содержание последнего в общем стоке снизилось с 4800 до 1200 мг/л. При этом ежегодно утилизируется свыше 3500 т хлорида натрия, 40 % которого выпускается в виде химической продукции реактивной чистоты.[ . ]
Между тем, расчетами по изменению солесодержания, в частности содержания хлоридов и солей жесткости, подтверждено уменьшение накипеобразования в 8—9 раз, т. е. примерно во столько же раз, как и при стендовых испытаниях.[ . ]
В работе [19] изучено также влияние низкомолекулярного электролита (хлорида натрия) на £-потенциал. При увеличении содержания хлорида натрия до 1,5 г/л и добавлении флокулянта отрицательный £■-потенциал резко уменьшался. При дальнейшем росте содержания хлорида натрия в сточной воде снижение £-потенциала замедлялось, оптимальная доза флокулянта увеличивалась, эффективность очистки ухудшалась. Это обусловлено уменьшением степени диссоциации ионогенных групп флокулянта, свертыванием макромолекул и снижением их суммарного положительного заряда.[ . ]
В ряде производств образуются жидкие и твердые отходы с высокой концентрацией хлорида натрия, а также органических и хлорорганических соединений. При огневой переработке этих отходов может быть получен продукт с высоким содержанием хлорида натрия, пригодный для дальнейшего использования.[ . ]
Биохимическое окисление 2,4-Д происходит с образованием хлор-ионов, причем повышение содержания хлоридов в пробах соответствует тому количеству хлор-ионов- которое содержится в 2,4-Д и высвобождается в процессе окисления.[ . ]
Настоящий стандарт распространяется на питьевую воду и устанавливает методы определения содержания хлоридов (хлор-иона).[ . ]
Основными показателями для характеристики состава очищенных сточных вод являются: остаток нефти или нефтепродуктов в воде (в мг/л), содержание взвешенных веществ по весу, высушенных при температуре 105°С (в мг/л). количество растворенного кислорода (в мг/л), прозрачность (в см), цветность (в град), окраска, содержание хлоридов и сероводорода (в мг/л), окисляемость (в мг02/л), активная реакция pH, биохимическая (ВПК) или химическая (ХПК) потребность в кислороде (в мг02/л). В особых случаях могут представлять интерес определение содержания сульфатов и сульфидов (в мг/л). Дополнительными показателями служат влажность и зольность осадка (в %). Определение влажности осадка должно производиться не реже одного раза в месяц.[ . ]
К настоящему времени качество подземных вод характеризуется следующим образом. В четвертичном горизонте в промышленных зонах увеличилось содержание хлоридов, сульфатов, сухого остатка и нитратов, концентрация последних превышает 50 мг/дм3.[ . ]
Основными проблемами угольных бассейнов являются очистка кислых и минерализованных сточных вод уральских месторождений и сточных вод с повышенным содержанием хлоридов и сульфатов Подмосковного бассейна, ликвидация мелких котельных и рекультивация земель для месторождений Восточной Сибири — очистка шахтных вод и хозяйственно-бытовых вод, рекультивация земель, для месторождений Дальнего Востока — строительство очистных сооружений для шахтных и карьерных вод, содержащих трудноосаждаемую дисперсную взвесь, повышение эффективности действующих сооружений и рекультивация земель.[ . ]
По данным табл.21, необходимую точность дозирования + 10% можно получить при учете двух вариантов работы ионатора: при работе на водах, не требующих добавления сульфата натрия (о содержанием хлоридов менее 10 к оумые анионов), режим приготовления 20 л концентрата — 6 мин электролиза при 3 А;, при работе с добавлением сульфата натрия режим приготовления — 7 мин электролиза при силе тока 3,2-3,4 А.[ . ]
В зависимости от результатов качественного определения отбирают 100 см3 испытуемой воды или меньший ее объем (10—50 см3) и доводят до 100 см3 дистиллированной водой. Без разбавления определяются хлориды в концентрации до 100 мг/дм3. pH титруемой пробы должен быть в пределах 6—10. Если вода имеет цветность выше 30°, пробу обесцвечивают добавлением гидроокиси алюминия. Для этого к 200 см3 пробы добавляют 6 см3 суспензии гидроокиси алюминия, а смесь встряхивают до обесцвечивания жидкости. Затем пробу фильтруют через беззольный фильтр. Первые порции фильтрата отбрасывают. Отмеренный объем воды вносят в две конические колбы и прибавляют по 1 см3 раствора хромовокислого калия. Одну пробу титруют раствором азотнокислого серебра до появления слабого оранжевого оттенка, вторую пробу используют в качестве контрольной пробы. При значительном содержании хлоридов образуется осадок А СЛ, мешающий определению. В этом случае к оттитрованной первой пробе приливают 2—3 капли титрованного раствора ЫаС1 до исчезновения оранжевого оттенка, затем титруют вторую пробу, пользуясь первой, как контрольной пробой.[ . ]
Контроль качества вода в емкости сезонного регулированйя постоянно показывает повышенный уровень минерализации этих вод, который зачастую превышает нормативы на 20-40 % и обусловливается. избыточным содержанием хлорида натрия. Основным источником его в сточных водах является регенерационный раствор, который используется для промывки ионообменных фильтров котельной.[ . ]
Отмеченное незначительное снижение количества гемоглобина у подопытных животных на 4-м месяце опыта по сравнению с контролем является статистически недостоверным. Содержание хлоридов и резервной щелочности в крови, а также хлоридов в моче во все сроки исследования не изменялось.[ . ]
Многие представители самого обширного в семействе рода парнолистник, насчитывающего около 100 видов, являются галофитами. Они населяют солончаки главным образом Азии, Африки и Австралии. Этот кустарник обладает небольшими мясистыми листьями и развивает мощный стержневой корень, который проникает до влажных горизонтов почвы.[ . ]
Известно, что чрезмерная соленость почвы характерна для многих горнорудных районов всего мира. В Германской Демократической Республике это является главным образом результатом добычи меди, сланца, поташа, бурого угля, а также производства соды. Большие количества хлоридов и солей, повышающих жесткость воды, попадают в реки с небольшим или средним расходом, вода которых используется для промышленных целей многими крупными коммерческими предприятиями. Даже после поглощения этих солей рекой (в Эльбе, например, в районе Магдебурга, в течение последних 20 лет среднегодовое содержание хлоридов составляло 77—423 мг/л и 9,9—20,5° общей жесткости) вредные последствия все же остаются значительными, что может быть продемонстрировано на следующих примерах.[ . ]
Количественный ионометрический экспресс-метод определения нитратов состоит в извлечении нитратов из материала раствором алюмокалиевых квасцов и последующим измерением нитрат-иона в вытяжке ионоселективным электродом. Метод непригоден для исследования продуктов, в которых содержание хлоридов превышает содержание нитратов более чем в 50 раз. Этот метод может быть использован только для анализа сырья.[ . ]
Имеются сообщения о возникновении гастроэнтеритов небактериального происхождения в Эссене (ФРГ) в 1959 г., которыми страдало около 7% населения (К. Im-hoff, 1970). Причиной было то, что засушливое лето 1959 г. обусловило значительное снижение расхода воды в реке Руре. Это снизило способность реки к разбавлению сточных вод. Содержание хлоридов в воде возросло со 100 до 507 мг/л, нитратов — до 24 мг/л, детергентов — до 1,2 мг/л. Частота повторного использования воды реки составила 0,9, что превышает допустимый предел (Н. Koenig et al„ 1970).[ . ]
Известен и нашел частичное применение в зарубежной практике [68] и метод разбрызгивания ОБР на пахотные земли после предварительной его нейтрализации. Однако использование указанного метода ограничивается типом и системой обработки бурового раствора. Этот метод не приемлем для минерализованных буровых растворов, т е , растворов с высоким содержанием хлоридов и других токсичных солевых компонентов. Но отсутствие в литературе сведений о нейтрализующих агентах не позволяет дать объективную оценку возможностей метода, а также практической и экономической целесообразности его применения.[ . ]
Известны отравляющие вещества самого различного действия, однако, попадая в воду, они ведут себя в основном как общеядовитые. На зараженность воды отравляющими веществами могут указывать некоторые внешние признаки и данные обычных методов контроля, так как наличие ОВ вызывает изменение многих показателей воды, например pH, окисляемости, хлоро-поглощаемости, содержания хлоридов и растворенного кислорода, а также данные биологических и бактериологических исследований. Поэтому все эти показатели в условиях возможного отравления воды ОВ должны определяться и фиксироваться систематически.[ . ]
При солянокислотном травлении стали взаимодействие 20%-ной кислоты с оксидами железа приводит к образованию хлористого и хлорного железа. Выводимый на регенерацию ОТР содержит, %: 5-10 HG1, 17-25 FeCl2, 0,4-0,8 FeClj. В многоступенчатых установках с противотоком обрабатываемого металла и травильного раствора в последнем могут быть получены очень низкая концентрация кислоты и весьма высокое содержание хлоридов железа (до 340 г/л). Продуктами регенерации являются соляная кислота, возвращаемая в травильную ванну, и оксид железа.[ . ]
Основным видом загрязнений является рудная и известняковая пыль. При контакте воды со шламом происходит выщелачивание извести и других компонентов, в результате чего солевой состав сточных вод претерпевает значительные изменения. Исследования показали, что pH воды возрастает с 7,5 до 12-13, щелочность с 1,3-3,6 до 21-22 мг-экв/дм3 в том числе гидратная от нуля до 17 мг-экв/дм3. Возрастает также содержание хлоридов и сульфидов.[ . ]
Загрязнение подземных вод в значительных объемах происходит за счет фильтрата —токсичной жидкости, выделяющейся со свалок твердых бытовых отходов. Только в черте города в Москве по официальным данным насчитывается более 100 свалок, а «полуночных»—вообще никогда не подсчитывалось. Состав фильтрата примерно может быть следующим и почти близким для всех свалок: повышенная до 10— 20 г/л минерализация, высокие содержания хлоридов и сульфатов, множество органических кислот (гуминовая, молочная, уксусная, пи-ровиноградная и др.), так называемые «ураганные» концентрации тяжелых металлов (в том числе и наиболее токсичных, таких, как ртуть), медикаментозные, санитарно-больничные, бактериологические и гель-минтозные загрязнения. Известно, что в теле свалок идут активные процессы брожения и гниения, т. е. разложения органики, конечным продуктом которых являются вода, тёпло, биогаз (диокси!д углерода и метан). Нередки случаи самовозгорания биогаза с негативными экологическими последствиями, так как многие свалки насыщены синтетическими пластмассами, горение которых в низкотемпературном режиме приводит к образованию диоксинов, попадающих в атмосферу, в гидросферу, а далее в трофические сети экосистем.[ . ]
Процесс реализуется в противоточном режиме в реакторе скруб-берного типа при 400°С. Его продуктами являются газ (около 7% HCl, 40 — водяных паров, 0,8-1,0% 02) и оксид железа. Основная масса последнего оседает в растворе, выделяется из него и отгружается потребителю: Газ очищается от остатков Fe203, охлаждается и отправляется в абсорбционную колонну, орошаемую водой из промывочных ванн. Из нижней ее части выводится 16-20%-ная соляная кислота с небольшим, около 2%, содержанием хлоридов железа. Газ после абсорбционной колонны освобождается от остатков хлористого водорода и других примесей в скруббере, орошаемом раствором каустической соды (NaOH), и выбрасывается в дымовую трубу.[ . ]
Воду с сухим остатком до 1000 мг/л называют пресной, свыше 1000 мг/л — минерализованной. Вода, содержащая избыточное количество минеральных солей, непригодна для питья, т.к. имеет соленый или горько-соленый вкус, а ее употребление (в зависимости от состава солей) приводит к различным неблагополучным физиологическим отклонениям в организме. С другой стороны, слабоминерализованная вода с сухим остатком ниже 50-100 мг/л неприятна на вкус, длительное ее употребление может привести также к некоторым неблагоприятным физиологическим сдвигам в организме (уменьшение содержания хлоридов в тканях и др.). Такая вода, как правило, содержит мало фтора и других микроэлементов.[ . ]
Данные, касающиеся окислительно-воостановительного потенциала проб, получены только для весны 1976 г. Исследовали воды скважины 12В; значения окислительно-восстановительного потенциала там изменялись от +100 до +150 мВ (максимум + 170 мВ). Неожиданно наиболее низкие значения ( + 55 и + 65 мВ) были зарегистрированы в скважинах 10 и 4 -соответственно. Вода скважины 7 имела окислительно-восстановительный потенциал +105 мВ. В ручье наблюдалось увеличениеокис-лительно-востановительного потенциала от +90 мВ (измерено выше по течению) до +107 мВ (измерено ниже по течению). За исключением летних и осенних данных анализа рроб из скважины 6А, наблюдается общая тенденция к уменьшению содержания хлоридов с увеличением расстояния от очистной станции [6]. Воды скважины 3 и высачиваний ниже дороги характеризуются высоким содержанием хлоридов, отражая поступления солей с дороги, как отмечалось ранее. Во всех случаях происходило небольшое увеличение содержания хлоридов в ручье Вест Брук из-за высачиваний.[ . ]
источник