Полевой химический анализ воды имеет большое научное и практическое значение. Он помогает:
• целесообразно направлять и корректировать гидрогеологические работы в процессе их выполнения;
• отбирать наиболее важные пробы для полного анализа;
• на месте определять летучие и быстроизменяющиеся компоненты.
В полевой анализ воды входит определение не только летучих (СО2, Н2S, О2), быстроизменяющихся (t, pH, Fe 2+ , NO2 — ) компонентов, но и определение ионов, характеризующих другие ее важнейшие свойства (Са 2+ , Mg 2+ , NH + , Na + , Сl — , SO4 2- , NO3 — , НСО3 — , СО3 2- ). Учитывая скорость изменения физических свойств и химического состава, при выполнении полевого анализа воды, соблюдают следующую последовательность определений:
1. температура, рН, запах, прозрачность, цвет;
2. свободная углекислота, сероводород, кислород;
3. нитрат и нитрит ионы, аммоний, железо закисное и окисное;
4. карбонат — и гидрокарбонат-ионы, жесткость, ионы кальция, магния, сульфаты, хлориды и вкус.
Во время учебной практики с помощью полевой лаборатории за 20-30 минут можно выполнить анализ воды, состоящий из определений: рН, Fe 3+ , Fe 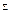
рН определяют колориметрическим методом с универсальным индикатором Алямовского.
Ионы Fe 3+ , Fe^ (в виде трехвалентного) определяют колориметрическим методом с роданидом калия или аммония.
Ион Fe 2+ определяют расчетным путем.
Ион NH4 + определяют колориметрическим методом с реактивом Несслера.
Ион NO2 — определяют колориметрическим методом с реактивом Грисса.
Ионы НСО3 — и СОз 2- определяют объемным методом, если рН раствора меньше 8.2, то такая вода не содержит карбонатов.
Общую жесткость и Са 2+ определяют объемным трилонометрическим методом.
Ион Mg 2+ рассчитывают по разности.
Ион Сl — определяют аргентометрическим капельным методом.
Ион SO4 2 » определяют турбидиметрическим методом.
Лабораторная работа № 1
ВИЗУАЛЬНАЯ КОЛОРИМЕТРИЯ
Цель работы
Определение микрокомпонентов (NH4 + , NO2 — , Fe 3+ ) и концентрации водородных ионов (рН) в природных водах.
Общие сведения
В визуальных колориметрических методах интенсивность потока излучения оценивается на глаз. Ряд визуальных методов применяется на практике для определения микрокомпонентов (NH4 + , NO2 — , Fe 3+ ) и концентрации водородных ионов (рН) в природных водах. Используемые в визуальных методах для сравнения интенсивности окраски калиброванные пробирки должны быть одинакового диаметра, высоты и с одинаковой прозрачностью стекла.
Для сравнения окраски используют прибор, называемый компаратором. Прибор состоит из деревянного куба, в котором сверху просверлены два круглых вертикальных отверстия для пробирок и с боков — горизонтальные сквозные отверстия, пересекающиеся с первыми, через которые и сравнивают окраски исследуемого раствора без индикатора и с индикатором. Окраски сравнивают по горизонтальному направлению, подложив белый фон и держа пробирки в наклонном положению к фону, используя пленочные шкалы.
ОПРЕДЕЛЕНИЕ рН ПРИ ПОМОЩИ РАСТВОРА УНИВЕРСАЛЬНОГО ИНДИКАТОРА
Цель работы
Определение кислой, нейтральной или щелочной среды природной воды через концентрацию водородных ионов с использованием универсального индикатора Алямовского и стандартных окрашенных пленочных шкал.
Общие сведения
Водные растворы всегда содержат водородные и гидроксиль-ные ионы. Произведение концентрации водородных и гидроксиль-ных ионов в воде всегда постоянно и зависит только от температуры. Под концентрацией водородных и гидроксильных ионов понимают содержание грамм-эквивалентов соответствующего иона в одном литре раствора.
Если реакция водного раствора нейтральна, концентрация водородных и гидроксильных ионов одинакова и равна 


Обычно кислую, щелочную или нейтральную среду определяют через концентрацию водородных ионов. Для характеристики концентрации водородных ионов пользуются только показателем степени при десяти, отбрасывая отрицательный знак и обозначая символом рН (показатель концентрации водородных ионов).
Колориметрический метод определения рН основан на свойстве ряда индикаторов менять свою окраску в зависимости от концентрации ионов водорода, причем для каждого индикатора существуют вполне определенные границы, при которых происходит изменение окраски. В полевых условиях используют универсальный индикатор Алямовского и стандартные окрашенные пленочные шкалы (диапазон измерений рН 4-8.0). Чувствительность этого метода 0.1 рН.
Последнее изменение этой страницы: 2016-04-23; Нарушение авторского права страницы
источник
Аргентометрические методы анализа относятся к методам осаждения, которые нашли мировое применение. Аргентометрию используют для анализа роданидов, хлоридов, бромидов, йодидов щелочноземельных металлов и органических оснований.
Рабочим раствором является раствор AgNO3 0,1М, а в методе Фольгарда раствор NH4CNS 0,1М.
Для определения точки эквивалентности в зависимости от ph среды в аргентометрии применяют ряд индикаторов:
- 1. K2CrO4 — 5% раствор хромата калия;
- 2. NH4Fe (SO4) 2 12H2
O — насыщенный раствор железо — аммонийных квасцов, подкисленный азотной кислотой;
- 3. Адсорбционные индикаторы: эозинат натрия, бромфеноловый синий, флуоресцеин;
- 4. Свежеприготовленный раствор крахмала;
- 5. Нитрозо — крахмальная бумага.
Сущность аргентометрических методов заключается в выделении определяемого вещества в виде трудно растворимых осадков солей серебра:
После того, как все ионы галогенов будут осаждены, лишняя капля 0,1М AgNO3, будет взаимодействовать с индикатором с образованием окрашенных осадков или окрашенных растворов в точке эквивалентности.
Протекающие реакции должны удовлетворять следующим условиям:
- 1. Осадок должен выпадать быстро и быть практически нерастворимым.
- 2. На результаты титрования не должны влиять побочные реакции.
- 3. Точка эквивалентности должна легко фиксироваться.
Одной из основных задач фармацевтических и медицинских учреждений является отпуск и использование качественной продукции. По мере повышения требований к качеству лекарств возникает необходимость сбора материалов по химическому контролю. Ввиду того, что в рецептуре встречаются лекарственные формы с галогенидами, я поставила задачу собрать материал по аргентометрическим методам анализа с целью более широкого внедрения всех методов в работу. (1)
Титрование — метод количественного/массового анализа, который часто используется в аналитической химии, основанный на измерении объёма раствора реактива точно известной концентрации, расходуемого для реакции с определяемым веществом. Титрование — процесс определения титра исследуемого вещества. Титрование производят с помощью бюретки, заполненной титрантом до нулевой отметки. Титровать, начиная от других отметок, не рекомендуется, так как шкала бюретки может быть неравномерной. Заполнение бюреток рабочим раствором производят через воронку или с помощью специальных приспособлений, если бюретка полуавтоматическая. Конечную точку титрования (точку эквивалентности) определяют индикаторами или физико-химическими методами (по электропроводности, светопропусканию, потенциалу индикаторного электрода и т.д.). По количеству пошедшего на титрование рабочего раствора рассчитывают результаты анализа. (5)
Методы титрометрического анализа
В титрометрии используются самые разнообразные реакции. В зависимости от того, какая реакция лежит в основе титрования, различают следующие методы титрометрического анализа:
1. Методы кислотно-основного титрования, в основе которых лежит реакция нейтрализации:
Методом нейтрализации определяют количество кислот, оснований, а также некоторых солей.
Данный метод служит для определения концентрации кислот и оснований в биологических жидкостях и объектах окружающей среду, а, кроме того, метод позволяет определить концентрацию солей, имеющих кислую или щелочную среду вследствие гидролиза.
- 2. Методы окисления — восстановления (оксидиметрия). Эти методы основаны на реакциях окисления — восстановления. При помощи растворов окислителей определяют количества веществ, являющихся восстановителями, и наоборот.
- 3. Методы осаждения и комплексообразования, основанные на осаждении ионов в виде труднорастворимых соединений и на связывании ионов в малодиссоциированный комплекс. К ним относятся: аргентометрия, гексоцианоферратометрия, меркурометрия. (3)
Метод осадительного титрования
К методам осаждения в титрометрическом анализе относятся методы, основанные на реакциях образования малорастворимых соединений и могут быть классифицированы по признаку:
- — применяемых рабочих растворов: аргентометрия, меркурометрия, тиоцианатометрия и т.д.;
- — способу фиксирования точки конца титрования: индикаторные, безиндикаторные, физико-химические (например, потенциометрическое титрование галогенидов солями серебра).
- — имени автора метода: метод Мора, метод Фольгарда и т.д.
Реакции, применяющиеся в осадительном титровании, должны удовлетворять следующим условиям:
-осадок должен иметь низкую растворимость -осадок должен выпадать быстро -образующийся в процессе осаждения осадок должен иметь стехиометрический состав -должен существовать способ фиксирования конечной точки титрования -если побочные реакции имеют место, то они не должны оказывать влияние на результат титрования.
Условие низкой растворимости выполняется только при образовании осадков со сравнительно небольшой величиной произведения растворимости Ks (ранее использовалось обозначение ПР). Необходимая степень пересыщения раствора, обеспечивающая достаточную скорость реакции образования осадка, достигается только в растворах с относительно большой концентрацией. С другой стороны, при большой скорости реакции и высоких концентрациях возможны загрязнения осадков, обусловленные изоморфным соосаждением и адсорбцией, что приводит к нарушению стехиометричности осадка. В силу изложенных причин ряд реакций осаждения, успешно применяемых в гравиметрическом анализе, нельзя использовать в титриметрических методах.
Количественные расчеты в седиметрии, как и в большинстве методов количественного химического анализа, основаны на применении закона эквивалентов. Как правило, число эквивалентности определяемого иона (непосредственно или косвенно) считают равным абсолютному значению заряда, ориентируясь, в первую очередь, на катион.
Осадительное титрование является фармакопейным методом и используется для анализа таких лекарственных препаратов как калия иодид, натрия хлорид, калия бромид, нитрат серебра. Седиметрия широко применяется при анализе различных технологических объектов, содержащих сульфат-ионы или галогенид-ионы в сырье, сточных и технологических водах и т.п. (1)
Аргентометрический метод основан на применении в качестве титранта стандартного раствора нитрата серебра:
Для определения ионов серебра применяют хлорид натрия.
Аргентометрия принадлежит к давно известным методам анализа. До последнего времени им чаще всего пользовались для определения галогенид-ионов и ионов серебра. Одним из существенных недостатков метода является использование дорогостоящих солей серебра.
В методе аргентометрии обычно применяют индикаторные способы определения конечной точки титрования. В зависимости от этого различают метод Мора, метод Фаянса, метод Фольгарда (или тиоцианатометрия — титрование по остатку с использованием в качестве второго титранта раствора тиоцианата калия или аммония). Менее распространены безиндикаторные (метод Гей-Люссака, метод Либиха) и инструментальные способы фиксирования точки эквивалентности. (2)
1. Метод Мора Этот метод заключается в прямом титровании хлоридов и бромидов раствором нитрата серебра в присутствии индикатора хромата калия, с образованием нерастворимых осадков.
Cl — +Ag+ =AgClЇбелый Br — +Ag+ =AgBrЇжелтовато белый K2CrO4 +Ag+ =Ag2CrO4Їкрасный Растворимость хромата серебра Ag2CrO4 значительно больше растворимости хлорида серебра AgCl или бромида серебра AgBr. Поэтому в данных реакциях сначала образуется осадок AgCl или AgBr. После того, как все галогенид — ионы будут практически осаждены, начнется взаимодействие между ионами и ионами Ag+. Как только станет ясно заметна перемена лимонно — желтой окраски в слабо розовую, титрование прекращают. Это говорит о достижении точки эквивалентности. Титрование по методу Мора проводят в нейтральных или слабощелочных растворах при ph от 6,5 до 10.
Метод Мора имеет ряд недостатков:
- — применим только для определения хлоридов и бромидов и неприменим для определения иодидов и тиоцианатов, титрование которых сопровождается образованием коллоидных систем и адсорбцией, затрудняющих установление конечной точки титрования, а так же окислительно-восстановительными процессами.
- — нельзя применять в кислых и сильнощелочных средах. В кислых средах хромат переходит в дихромат, который образует с ионами серебра красный осадок, растворимый в кислоте. В сильнощелочном растворе образуется оксид серебра. Поэтому рН раствора должен быть не меньше 6,5 и не больше 10. В присутствии солей аммония водородный показатель должен лежать в области 6,5-7,2 т.к. значительные концентрации аммиака увеличивают растворимость солей серебра.
- — мешают ионы, образующие осадки с ионами индикатора или титранта (Hg2+,Pb2+,Ba2+,S2-,CO32-,PO43-,AsO43-,AsO33-, C2O42-и др.).
- -нельзя титровать окрашенные растворы, маскирующие окраску хромата серебра в точке эквивалентности. (3)
- 2. Метод Фаянса Более широкое применение находит метод Фаянса, с помощью которого можно определить содержание галогенидов, фосфатов, арсенатов, оксалатов и других анионов.
Метод Фаянса — это метод прямого титрования галогенидов раствором AgNO3 (0,1М) в слабо кислой среде с применением адсорбционных индикаторов, которые показывают изменение цвета не в растворах, а на поверхности выпавшего осадка.
Использование адсорбционных индикаторов основано на следующем. При титровании галогенидов образуется серебряная соль галогена, которая адсорбирует вначале на своей поверхности ионы галогена, находящиеся в избытке и заряжается отрицательно. В конце титрования все галогены уже связаны, частицы теряют свой заряд и наблюдается процесс коагуляции. При добавлении даже незначительного избытка раствора AgNO3 частицы адсорбируют ионы серебра, заряжаются положительно и притягивают к себе окрашенный анион адсорбированного индикатора. Осадок окрашивается, что и указывает на конец реакции.
В качестве адсорбционных индикаторов применяют:
- 1. Бромфеноловый синий, бромкрезеловый синий — в уксуснокислой среде;
- 2. Эозинат натрия — в уксуснокислой среде;
- 3. Флуоресцеин — в нейтральной и слабо щелочной среде.
Хлориды и бромиды можно титровать с бромфеноловым синим. Точную навеску хлорида или бромида растворяют в воде, прибавляют 2-3 капли индикатора бромфенолового синего, по каплям разведенную уксусную кислоту до зелено-желтого окрашивания и раствор AgNO3 0,1М до синего окрашивания. Можно с этим индикатором оттитровать и йодиды, только вместо синего окрашивания в точке эквивалентности будет зеленое окрашивание.
В качестве индикатора для определения йодидов применяют эозинат натрия. К точной навеске препарата прибавляют разведенную уксусную кислоту, 3-5 капель раствора эозината натрия и титруют раствором AgNO3 0,1М до розового окрашивания осадка. Определению йодидов методом Фаянса не мешают хлориды, но мешают бромиды.
Методом Фаянса определяют соли алкалоидов, соли азотосодержащих оснований (димедрол, новокаин, папаверин, дикаин, пилокарпил, эфедрин).
3. Метод Фольгарда Метод Фольгарда основан на реакции образования роданида серебра:
Ag+ + SCNЇ = AgSCN Рабочим раствором является раствор роданида калия KSCN или аммония NH4SCN. Метод Фольгарда является примером обратного титрования. Следовательно, в этом методе имеется второй рабочий раствор — титрованный раствор нитрата серебра AgN03. Поэтому метод Фольгарда можно в равной степени назвать и аргентометрией и роданометрией. Определение хлоридов бромидов и йодидов по методу Фольгарда сводится к следующему. К определяемому раствору прибавляют из бюретки точно отмеренный объем титрованного раствора нитрата серебра; этот объем должен быть значительно больше, чем нужно для полного осаждения всего количества ионов С1
(Вг_или Избыток раствора серебра оттитровывают раствором роданида калия или аммония.
Индикатором в этом случае служит раствор железо-аммонийных квасцов (NH4) Fe (S04) 2-12Н20. Пока в растворе присутствуют ионы серебра, прибавляемый роданид будет реагировать с ними, образуя белый осадок AgSCN. Как только реакция между ионами Ag+ и SCN
закончится, следующая капля рабочего раствора вступит в реакцию с индикатором FeS+ + 3SCN — = Fe (SCN) 3.
Образующаяся соль Fe (SCN) 3окрашивает раствор в красный цвет.
В отличие от метода Мора при методе Фольгарда присутствие кислоты не только не вредит титрованию, но, наоборот, способствует получению более точных ре зультатов. Кислота подавляет гидролиз соли железа и уничтожает желтую окраску раствора железо-аммонийных квасцов, связанную с гидролизом. Не мешает и присутствие в растворе солей Ва2+, РЬ2+и Bi3+.
При титровании по методу Фольгарда должны соблюдаться следующие условия:
- 1) титровать надо соль серебра роданидом, а не наоборот;
- 2) определение проводят в кислой среде;
- 3) определение проводят в отсутствие солей ртути и сильных окислителей.
В методах клинических исследований метод Фольгарда применяется для определения хлоридов в крови. (6)
4. Видоизмененный метод Фольгарда. Видоизмененный метод Фольгарда предусматривает прямое титрование растворомAgNO3 0,1М. Навеску соли галогенида растворяют в воде, подкисляют азотной кислотой, прибавляют 1мл железоаммониевых квасцов и 0,1 мл 0,1М раствора роданида аммония. При этом возникает буровато-оранжевое окрашивание вследствие образования роданида железа:
FeNH4 (SO4) 2+3NH4CNS?Fe (CNS) 3+ 2 (NH4) 2SO4 Раствор далее титруют 0,1М раствором AgNO3до исчезновения окраски.
Нитрат серебра реагирует вначале с галогенидом.
AgNO3+ KJ=AgJ +KNO3 После достижения точки эквивалентности избыточная капля раствора нитрата серебра реагирует с роданидом железа, вследствие чего раствор обесцвечивается.
- 3AgNO3+Fe (CNS) 3=3AgCNS + Fe (NO3) 3 Этим методом определяется витамин В1. Видоизмененный метод Фольгарда (3)
- 5. Метод Гей — Люссака (метод равнопомутнения). Вблизи точки эквивалентности отбираются малые порции прозрачного раствора, к которым добавляются одинаковые количества титранта и тируемого соединения. В точке эквивалентности степень помутнение в обоих растворах одинакова. Метод обладает достаточно высокой точностью, но чрезвычайно длителен и трудоемок. При низких степенях пересыщения растворов выпадение осадка происходит медленно и раствор начинает опалесцировать только через некоторое время. Для увеличения точности определения можно использовать нефелометр. (6)
- 6. Метод Либиха. Основан на фиксировании точки титрования по просветлению раствора в изоэлектрической точке (близкой к точке эквивалентности) вследствие разрушения коллоидных частиц и укрупнения осадка. Как правило, точность этого метода невелика и зависит от наличия фоновых электролитов и характеристик поверхности раздела фаз осадок-раствор. (4)
- 7. Метод Кальтгофа. Метод Кольтгофа применяют для определения йодидов. К раствору йодида калия прибавляют 20-30 капель воды, 1 каплю раствора йодата калия KJO3 0,1М, 2 мл свежеприготовленного раствора крахмала и по каплям разведенную серную кислоту до появления синего окрашивания жидкости.
KJO3+5KJ + 3H2SO4=3J2+3K2SO4+3H2O Далее титруют раствором нитрата серебра до исчезновения синего окрашивания Синее окрашивание присуще комплексу J2+J +крахмал. В точке эквивалентности из раствора исчезают йодид ионы.
KJ + AgNO3=AgJ+KNO3 — синее окрашивание исчезает. Эквивалент йодидов равен молекулярной массе.
Этим методом можно определять йодиды в присутствии хлоридов и бромидов.
Хлориды не мешают определению йодидов. А если присутствуют бромиды, то необходимо до прибавления серной кислоты прилить к реакционной смеси 5 мл 10% раствора карбоната аммония (NH4) 2CO3 Методом Кольтгофа определяют йодиды в смеси с эуфиллином, эфедрином.
аргентометрия раствор нитрат серебро
Подводя итоги, следует отметить, что методы аргентометрического анализа дают хорошие результаты, укладывающиеся в нормы отклонений не только в простых формах, но и в сложных сочетаниях веществ. Методы аргентометрического титрования весьма разнообразны, что дает возможность выбрать тот метод, который подходит для данного сочетания.
Из изложенного материала видно, что 1. Аргентометрические методы анализа технологически просты в исполнении;
- 2. Они не требуют больших затрат времени;
- 3. Конец титрования определяется ярко выраженными осадками или окрашиваниями;
- 4. Эти методы дают возможность количественного определения большого количества лекарственных веществ.
В заключение отметим, что аргентометрические методы анализа нашли широкое применение в медицинской и фармацевтической практике.
- 1. В.П. Зенлик. Аналитическая химия. М., «Медицина», 1971.
- 2. Кунце У., Шведт Г. Основы качественного и количественного анализа. Пер. с нем. — М.: Мир, 1997 3. Основы аналитической химии. Задачи и вопросы. / В.И. Фадеева, Ю.А. Барбалат, А.В. Гармаш и др.; Под ред. Ю.А. Золотова. — М.: Высш. шк. 2002.
- 4. Харитонов, Ю.Я. Аналитическая химия (аналитика). В 2 кн. Кн.2. Количественный анализ. Физико-химические (инструментальные) методы анализа: Учеб. для вузов. — 2-е изд., испр. — М.: Высш. шк., 2003
- 5. Алексеев В.Н. Количественный анализ. — М.: Химия; 1972.
источник
Использование аргентометрии для анализа роданидов, хлоридов, бромидов, йодидов щелочноземельных металлов и органических оснований. Методы титрометрического анализа, осадительного титрования. Применение в качестве титранта раствора нитрата серебра.
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«САМАРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ»
Кафедра общей, бионеорганической и биоорганической химии
«Методы аргентометрии в количественном анализе«
Реферат студента 141 группы
педиатрического факультета Е.В. Бердниковой
- Введение
- Титрование
- Методы титрометрического анализа
- Метод осадительного титрования
- Аргентометрическое титрование
- Методы аргентометрии
- Заключение
- Список литературы
Для определения точки эквивалентности в зависимости от ph среды в аргентометрии применяют ряд индикаторов:
Сущность аргентометрических методов заключается в выделении определяемого вещества в виде трудно растворимых осадков солей серебра:
После того, как все ионы галогенов будут осаждены, лишняя капля 0,1М AgNO3, будет взаимодействовать с индикатором с образованием окрашенных осадков или окрашенных растворов в точке эквивалентности.
Одной из основных задач фармацевтических и медицинских учреждений является отпуск и использование качественной продукции. По мере повышения требований к качеству лекарств возникает необходимость сбора материалов по химическому контролю. Ввиду того, что в рецептуре встречаются лекарственные формы с галогенидами, я поставила задачу собрать материал по аргентометрическим методам анализа с целью более широкого внедрения всех методов в работу. (1)
Данный метод служит для определения концентрации кислот и оснований в биологических жидкостях и объектах окружающей среду, а, кроме того, метод позволяет определить концентрацию солей, имеющих кислую или щелочную среду вследствие гидролиза.
2. Методы окисления — восстановления (оксидиметрия). Эти методы основаны на реакциях окисления — восстановления. При помощи растворов окислителей определяют количества веществ, являющихся восстановителями, и наоборот.
3. Методы осаждения и комплексообразования, основанные на осаждении ионов в виде труднорастворимых соединений и на связывании ионов в малодиссоциированный комплекс. К ним относятся: аргентометрия, гексоцианоферратометрия, меркурометрия. (3)
— способу фиксирования точки конца титрования: индикаторные, безиндикаторные, физико-химические (например, потенциометрическое титрование галогенидов солями серебра).
-осадок должен иметь низкую растворимость -осадок должен выпадать быстро -образующийся в процессе осаждения осадок должен иметь стехиометрический состав -должен существовать способ фиксирования конечной точки титрования -если побочные реакции имеют место, то они не должны оказывать влияние на результат титрования.
Условие низкой растворимости выполняется только при образовании осадков со сравнительно небольшой величиной произведения растворимости Ks (ранее использовалось обозначение ПР). Необходимая степень пересыщения раствора, обеспечивающая достаточную скорость реакции образования осадка, достигается только в растворах с относительно большой концентрацией. С другой стороны, при большой скорости реакции и высоких концентрациях возможны загрязнения осадков, обусловленные изоморфным соосаждением и адсорбцией, что приводит к нарушению стехиометричности осадка. В силу изложенных причин ряд реакций осаждения, успешно применяемых в гравиметрическом анализе, нельзя использовать в титриметрических методах.
Количественные расчеты в седиметрии, как и в большинстве методов количественного химического анализа, основаны на применении закона эквивалентов. Как правило, число эквивалентности определяемого иона (непосредственно или косвенно) считают равным абсолютному значению заряда, ориентируясь, в первую очередь, на катион.
Осадительное титрование является фармакопейным методом и используется для анализа таких лекарственных препаратов как калия иодид, натрия хлорид, калия бромид, нитрат серебра. Седиметрия широко применяется при анализе различных технологических объектов, содержащих сульфат-ионы или галогенид-ионы в сырье, сточных и технологических водах и т.п. (1)
Аргентометрия принадлежит к давно известным методам анализа. До последнего времени им чаще всего пользовались для определения галогенид-ионов и ионов серебра. Одним из существенных недостатков метода является использование дорогостоящих солей серебра.
В методе аргентометрии обычно применяют индикаторные способы определения конечной точки титрования. В зависимости от этого различают метод Мора, метод Фаянса, метод Фольгарда (или тиоцианатометрия — титрование по остатку с использованием в качестве второго титранта раствора тиоцианата калия или аммония). Менее распространены безиндикаторные (метод Гей-Люссака, метод Либиха) и инструментальные способы фиксирования точки эквивалентности. (2)
Cl — +Ag+ =AgClЇбелый Br — +Ag+ =AgBrЇжелтовато белый K2CrO4 +Ag+ =Ag2CrO4Їкрасный Растворимость хромата серебра Ag2CrO4 значительно больше растворимости хлорида серебра AgCl или бромида серебра AgBr. Поэтому в данных реакциях сначала образуется осадок AgCl или AgBr. После того, как все галогенид — ионы будут практически осаждены, начнется взаимодействие между ионами и ионами Ag+. Как только станет ясно заметна перемена лимонно — желтой окраски в слабо розовую, титрование прекращают. Это говорит о достижении точки эквивалентности. Титрование по методу Мора проводят в нейтральных или слабощелочных растворах при ph от 6,5 до 10.
— применим только для определения хлоридов и бромидов и неприменим для определения иодидов и тиоцианатов, титрование которых сопровождается образованием коллоидных систем и адсорбцией, затрудняющих установление конечной точки титрования, а так же окислительно-восстановительными процессами.
— нельзя применять в кислых и сильнощелочных средах. В кислых средах хромат переходит в дихромат, который образует с ионами серебра красный осадок, растворимый в кислоте. В сильнощелочном растворе образуется оксид серебра. Поэтому рН раствора должен быть не меньше 6,5 и не больше 10. В присутствии солей аммония водородный показатель должен лежать в области 6,5-7,2 т.к. значительные концентрации аммиака увеличивают растворимость солей серебра.
— мешают ионы, образующие осадки с ионами индикатора или титранта (Hg2+,Pb2+,Ba2+,S2-,CO32-,PO43-,AsO43-,AsO33-, C2O42-и др.).
2. Метод Фаянса Более широкое применение находит метод Фаянса, с помощью которого можно определить содержание галогенидов, фосфатов, арсенатов, оксалатов и других анионов.
Метод Фаянса — это метод прямого титрования галогенидов раствором AgNO3 (0,1М) в слабо кислой среде с применением адсорбционных индикаторов, которые показывают изменение цвета не в растворах, а на поверхности выпавшего осадка.
Использование адсорбционных индикаторов основано на следующем. При титровании галогенидов образуется серебряная соль галогена, которая адсорбирует вначале на своей поверхности ионы галогена, находящиеся в избытке и заряжается отрицательно. В конце титрования все галогены уже связаны, частицы теряют свой заряд и наблюдается процесс коагуляции. При добавлении даже незначительного избытка раствора AgNO3 частицы адсорбируют ионы серебра, заряжаются положительно и притягивают к себе окрашенный анион адсорбированного индикатора. Осадок окрашивается, что и указывает на конец реакции.
Хлориды и бромиды можно титровать с бромфеноловым синим. Точную навеску хлорида или бромида растворяют в воде, прибавляют 2-3 капли индикатора бромфенолового синего, по каплям разведенную уксусную кислоту до зелено-желтого окрашивания и раствор AgNO3 0,1М до синего окрашивания. Можно с этим индикатором оттитровать и йодиды, только вместо синего окрашивания в точке эквивалентности будет зеленое окрашивание.
В качестве индикатора для определения йодидов применяют эозинат натрия. К точной навеске препарата прибавляют разведенную уксусную кислоту, 3-5 капель раствора эозината натрия и титруют раствором AgNO3 0,1М до розового окрашивания осадка. Определению йодидов методом Фаянса не мешают хлориды, но мешают бромиды.
Методом Фаянса определяют соли алкалоидов, соли азотосодержащих оснований (димедрол, новокаин, папаверин, дикаин, пилокарпил, эфедрин).
Ag+ + SCNЇ = AgSCN Рабочим раствором является раствор роданида калия KSCN или аммония NH4SCN. Метод Фольгарда является примером обратного титрования. Следовательно, в этом методе имеется второй рабочий раствор — титрованный раствор нитрата серебра AgN03. Поэтому метод Фольгарда можно в равной степени назвать и аргентометрией и роданометрией. Определение хлоридов бромидов и йодидов по методу Фольгарда сводится к следующему. К определяемому раствору прибавляют из бюретки точно отмеренный объем титрованного раствора нитрата серебра; этот объем должен быть значительно больше, чем нужно для полного осаждения всего количества ионов С1
(Вг_или Избыток раствора серебра оттитровывают раствором роданида калия или аммония.
Индикатором в этом случае служит раствор железо-аммонийных квасцов (NH4) Fe (S04) 2-12Н20. Пока в растворе присутствуют ионы серебра, прибавляемый роданид будет реагировать с ними, образуя белый осадок AgSCN. Как только реакция между ионами Ag+ и SCN
закончится, следующая капля рабочего раствора вступит в реакцию с индикатором FeS+ + 3SCN — = Fe (SCN) 3.
В отличие от метода Мора при методе Фольгарда присутствие кислоты не только не вредит титрованию, но, наоборот, способствует получению более точных ре зультатов. Кислота подавляет гидролиз соли железа и уничтожает желтую окраску раствора железо-аммонийных квасцов, связанную с гидролизом. Не мешает и присутствие в растворе солей Ва2+, РЬ2+и Bi3+.
4. Видоизмененный метод Фольгарда. Видоизмененный метод Фольгарда предусматривает прямое титрование растворомAgNO3 0,1М. Навеску соли галогенида растворяют в воде, подкисляют азотной кислотой, прибавляют 1мл железоаммониевых квасцов и 0,1 мл 0,1М раствора роданида аммония. При этом возникает буровато-оранжевое окрашивание вследствие образования роданида железа:
FeNH4 (SO4) 2+3NH4CNS?Fe (CNS) 3+ 2 (NH4) 2SO4 Раствор далее титруют 0,1М раствором AgNO3до исчезновения окраски.
AgNO3+ KJ=AgJ +KNO3 После достижения точки эквивалентности избыточная капля раствора нитрата серебра реагирует с роданидом железа, вследствие чего раствор обесцвечивается.
3AgNO3+Fe (CNS) 3=3AgCNS + Fe (NO3) 3 Этим методом определяется витамин В1. Видоизмененный метод Фольгарда (3)
5. Метод Гей — Люссака (метод равнопомутнения). Вблизи точки эквивалентности отбираются малые порции прозрачного раствора, к которым добавляются одинаковые количества титранта и тируемого соединения. В точке эквивалентности степень помутнение в обоих растворах одинакова. Метод обладает достаточно высокой точностью, но чрезвычайно длителен и трудоемок. При низких степенях пересыщения растворов выпадение осадка происходит медленно и раствор начинает опалесцировать только через некоторое время. Для увеличения точности определения можно использовать нефелометр. (6)
6. Метод Либиха. Основан на фиксировании точки титрования по просветлению раствора в изоэлектрической точке (близкой к точке эквивалентности) вследствие разрушения коллоидных частиц и укрупнения осадка. Как правило, точность этого метода невелика и зависит от наличия фоновых электролитов и характеристик поверхности раздела фаз осадок-раствор. (4)
7. Метод Кальтгофа. Метод Кольтгофа применяют для определения йодидов. К раствору йодида калия прибавляют 20-30 капель воды, 1 каплю раствора йодата калия KJO3 0,1М, 2 мл свежеприготовленного раствора крахмала и по каплям разведенную серную кислоту до появления синего окрашивания жидкости.
KJO3+5KJ + 3H2SO4=3J2+3K2SO4+3H2O Далее титруют раствором нитрата серебра до исчезновения синего окрашивания Синее окрашивание присуще комплексу J2+J +крахмал. В точке эквивалентности из раствора исчезают йодид ионы.
Хлориды не мешают определению йодидов. А если присутствуют бромиды, то необходимо до прибавления серной кислоты прилить к реакционной смеси 5 мл 10% раствора карбоната аммония (NH4) 2CO3 Методом Кольтгофа определяют йодиды в смеси с эуфиллином, эфедрином.
аргентометрия раствор нитрат серебро
Из изложенного материала видно, что 1. Аргентометрические методы анализа технологически просты в исполнении;
В заключение отметим, что аргентометрические методы анализа нашли широкое применение в медицинской и фармацевтической практике.
1. В.П. Зенлик. Аналитическая химия. М., «Медицина», 1971.
2. Кунце У., Шведт Г. Основы качественного и количественного анализа. Пер. с нем. — М.: Мир, 1997 3. Основы аналитической химии. Задачи и вопросы. / В.И. Фадеева, Ю.А. Барбалат, А.В. Гармаш и др.; Под ред. Ю.А. Золотова. — М.: Высш. шк. 2002.
4. Харитонов, Ю.Я. Аналитическая химия (аналитика). В 2 кн. Кн.2. Количественный анализ. Физико-химические (инструментальные) методы анализа: Учеб. для вузов. — 2-е изд., испр. — М.: Высш. шк., 2003
5. Алексеев В.Н. Количественный анализ. — М.: Химия; 1972.
Понятие и виды титриметрического анализа. Характеристика комплексонообразующих агентов и индикаторов. Приготовление оттитрованного раствора для проведения комплексонометрического титрования. Методика исследования алюминия, висмута, свинца, магния, цинка.
курсовая работа [150,0 K], добавлен 13.01.2013
Хроматографический и оптический методы анализа. Определение состава смеси органических спиртов, содержания ионов металлов в растворе, содержания лактозы (сахарозы). Определение содержания карбоната и гидрокарбоната в смеси методом прямого титрования.
методичка [418,5 K], добавлен 13.11.2009
Физико-химические методы определения цинка. Люминесцентный, рентгенофлуоресцентный, полярографический, атомно-абсорбционный, радиоактивационный, фотометрический метод анализа. Кривые амперометрического титрования. Зависимость силы тока от объема титранта.
курсовая работа [463,5 K], добавлен 23.06.2015
Сущность и классификация методов кислотно-основного титрования, применение индикаторов. Особенности комплексонометрического титрования. Анализ методов осадительного титрования. Обнаружение конечной точки титрования. Понятие аргенометрии и тицианометрии.
контрольная работа [28,3 K], добавлен 23.02.2011
Общая характеристика группы. Бериллий и магний. История, распространенность, получение, особенности, физические свойства, применение щелочноземельных металлов. Химические свойства щелочноземельных металлов и их соединений.
реферат [59,1 K], добавлен 30.05.2003
Методы фармацевтического анализа и их классификация. Отличительные особенности полярографического метода анализа. Схема полярографической установки. Условия проведения полярографического анализа и его применение при контроле лекарственных средств.
реферат [113,0 K], добавлен 25.06.2015
Аналитическая химия — наука об определении химического состава веществ и их химической структуры. Понятие и сущность титриметрического метода анализа. Способы приготовления титрованного раствора. Методы кислотно-основного титрования (нейтрализации).
реферат [1,3 M], добавлен 22.02.2012
Классификация физико-химических методов анализа веществ и их краткая характеристика, определение эквивалентной точки титрования, изучение соотношений между составом и свойствами исследуемых систем. Метод низкочастотного кондуктометрического титрования.
учебное пособие [845,9 K], добавлен 04.05.2010
Расчет установки для непрерывного выпаривания раствора нитрата калия, для непрерывного концентрирования раствора нитрата аммония в одном корпусе. Определение температур и давлений. Расчет барометрического конденсатора и производительности вакуум насоса.
курсовая работа [529,5 K], добавлен 15.12.2012
Классификация окислительно-восстановительного титрования; его применение в фармацевтическом анализе, при определении окисляемости воды и органических соединений. Рассмотрение редокс-титрования на примере цериметрии. Титрование соли железа сульфатом церия.
курсовая работа [709,5 K], добавлен 12.09.2012
источник
Купить РД 52.24.407-2017 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку «Купить» и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО «ЦНТИ Нормоконтроль».
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Руководящий документ устанавливает методику измерений массовой концентрации хлоридов в пробах природных и очищенных сточных вод в диапазоне от 100 до 20000 мг/дм3 аргентометрическим методом. Руководящий документ предназначен для использования в лабораториях, осуществляющих анализ природных и очищенных сточных вод.
Документ зарегистрирован ФГБУ «НПО «Тайфун» от 22.11.2017 за номером РД 52.24.407-2017 и аттестован ФГБУ «ГХИ».
3 Требования к показателям точности измерений
4 Требования к средствам измерений, вспомогательным устройствам, реактивам, материалам
4.1 Средства измерений, вспомогательные устройства
6 Требования безопасности, охраны окружающей среды
7 Требования к квалификации операторов
8 Требования к условиям измерений
9 Подготовка к выполнению измерений
9.2 Приготовление растворов
9.3 Установление точной молярной концентрации растворов нитрата серебра
10 Порядок выполнения измерений
11 Обработка результатов измерений
12 Оформление результатов измерений
13 Контроль качества результатов измерений при реализации методики в лаборатории
13.2 Алгоритм оперативного контроля повторяемости
13.3 Алгоритм оперативного контроля процедуры выполнения измерений с использованием метода добавок совместно с методом разбавления проб
14 Проверка приемлемости результатов, полученных в условиях воспроизводимости
Приложение А (рекомендуемое). Методика приготовления аттестованного раствора хлорида натрия АРС для установления точной молярной концентрации растворов нитрата серебра
Приложение Б (обязательное). Подготовка активного угля
Приложение В (рекомендуемое). Предварительная оценка концентрации хлоридов в неизвестной пробе воды
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:
МИНИСТЕРСТВО ПРИРОДНЫХ РЕСУРСОВ и экологии РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральная служба по гидрометеорологии и мониторингу окружающей среды
РУКОВОДЯЩИЙ ДОКУМЕНТ 52.24.407-
МАССОВАЯ КОНЦЕНТРАЦИЯ ХЛОРИДОВ В ВОДАХ Методика измерений аргентометрическим методом
1 РАЗРАБОТАН федеральным государственным бюджетным учреждением «Гидрохимический институт» (ФГБУ «ПХИ»)
2 РАЗРАБОТЧИКИ Ю.А. Андреев, канд. хим. наук (руководитель разработки), О.А. Михайленко (ответственный исполнитель), Е.Л. Селю-тина
3 СОГЛАСОВАН с Федеральным государственным бюджетным учреждением «Научно-производственное объединение «Тайфун» (ФГБУ «НПО «Тайфун») 25.09.2017 и Управлением мониторинга загрязнения окружающей среды, полярных и морских работ (УМЗА) Росгидромета 27.10.2017
4 УТВЕРЖДЕН Руководителем Росгидромета 30.10.2017 ВВЕДЁН В ДЕЙСТВИЕ приказом Росгидромета от 11.12.2017 № 647
5 МЕТОДИКА ИЗМЕРЕНИЙ АТТЕСТОВАНА ФГБУ «ГХИ» Свидетельство об аттестации № 407.RA.RU.311345-2017 от
6 ЗАРЕГИСТРИРОВАН ФГБУ «НПО «Тайфун» от 22.11.2017 за номером РД 52.24.407-2017
7 ВЗАМЕН РД 52.24.407-2006 «Массовая концентрация хлоридов в водах. Методика выполнения измерений аргентометрическим методом»
8 СРОК ПЕРВОЙ ПРОВЕРКИ 2028 год ПЕРИОДИЧНОСТЬ ПРОВЕРКИ 10 лет
© Росгидромет, ФГБУ «ГХИ», 2017 Право тиражирования и реализации принадлежит ФГБУ «ГХИ»
азотнокислого растворением содержимого ампулы в мерной колбе вместимостью 2000 см 3 .
Точную молярную концентрацию раствора определяют титрованием аттестованного раствора хлоридов 1 раз в мес.
9.2.3 Аттестованный раствор хлоридов с молярной концентрацией 0,01410 моль/дм 3 (и массовой концентрацией 0,500 мг/см 3 )
Аттестованный раствор готовят из ГСО с концентрацией хлорид-ионов 10 мг/см 3 .
Вскрывают ампулу и переносят ее содержимое в сухую чистую коническую пробирку. Отбирают 5,0 см 3 образца с помощью чистой сухой пипетки с одной отметкой и переносят в мерную колбу вместимостью 100 см 3 . Доводят объем в колбе до метки дистиллированной водой и перемешивают.
Если концентрация хлорид-ионов в ГСО не равна точно 10,0 мг/см 3 , рассчитывают молярную и массовую концентрацию хлоридов в аттестованном растворе соответственно концентрации конкретного экземпляра ГСО. Раствор хранят в плотно закрытой посуде при комнатной температуре не более 3 мес.
При отсутствии ГСО допускается использовать аттестованный раствор хлоридов, приготовленный из хлорида натрия. Методика приготовления аттестованного раствора приведена в приложении А.
Допускается приготовление раствора хлоридов из стандарт-титров (фиксаналов) натрия хлористого или калия хлористого растворением содержимого ампулы в мерной колбе вместимостью 2000 см 3 . Условия хранения те же, что в приведены в приложении А для аттестованного раствора, приготовленного из хлорида натрия.
Растворяют 25 г хромата калия в 100 см 3 дистиллированной воды. Б полученный раствор для удаления хлоридов добавляют по каплям 10 %-ный раствор нитрата серебра до появления слабого красноватооранжевого осадка. Через 1 сут раствор фильтруют через фильтр «белая лента». К фильтрату добавляют 125 см 3 дистиллированной воды и перемешивают.
Раствор хранят при комнатной температуре в склянке из темного стекла не более 3 мес.
Растворяют 10 г нитрата серебра в 90 см 3 дистиллированной воды. К полученному раствору прибавляют 1-2 капли концентрированной азотной кислоты. При появлении мутности раствор отстаивают не менее 1 сут, затем осторожно сливают прозрачную жидкость. Хранят в плотно закрытой склянке из тёмного стекла. Срок хранения в плотно закрытой склянке из тёмного стекла не ограничен.
Растворяют 3,5 см 3 концентрированной азотной кислоты в 500 см 3 дистиллированной воды. Срок хранения в плотно закрытой посуде не ограничен.
Растворяют 35 см 3 концентрированной азотной кислоты в 215 см 3 дистиллированной воды. Срок хранения в плотно закрытой посуде не ограничен.
Растворяют 170 см 3 концентрированной соляной кислоты в 330 см 3 дистиллированной воды. Срок хранения в плотно закрытой посуде не ограничен.
9.2.9 Раствор гидроксида натрия, 0,4 %-ный
Растворяют 2 г гидроксида натрия в 500 см 3 дистиллированной воды. Срок хранения в полиэтиленовой посуде не более 6 мес.
Растворяют 20 г гидроксида натрия в 500 см 3 дистиллированной воды. Срок хранения в полиэтиленовой посуде не ограничен.
Растворяют 63 г алюмокалиевых квасцов в 500 см 3 дистиллированной воды в стакане вместимостью 1 дм 3 , нагревают раствор до 60 °С и при постоянном перемешивании медленно прибавляют 28 см 3 аммиака водного. Дают смеси отстояться в течение 1 ч, а затем промывают несколько раз дистиллированной водой, сливая жидкость над осадком. Последняя промывная вода не должна давать положительной реакции на хлориды (проба с 10 %-ным раствором нитрата серебра). Полученную суспензию хранят при комнатной температуре под слоем дистиллированной воды в защищенном от света месте не более 3 мес.
Подготовку к работе и регенерацию активного угля осуществляют в соответствии с приложением Б.
9.3.1 Для установления точной молярной концентрации раствора нитрата серебра, 0,05 моль/дм 3 , в коническую колбу вместимостью
250 см 3 с помощью пипетки с одной отметкой помещают 25,0 см 3 аттестованного раствора хлоридов с молярной концентрацией 0,01410 моль/дм 3 , добавляют мерным цилиндром 75 см 3 дистиллированной воды и градуированной пипеткой 1 см 3 раствора хромата калия.
Раствор в колбе перемешивают и титруют раствором нитрата серебра с молярной концентрацией 0,05 моль/дм 3 до появления красновато-оранжевого осадка.
Титрование повторяют и, при отсутствии расхождения в объемах раствора нитрата серебра более 0,05 см 3 , за результат принимают среднее арифметическое значение. В противном случае повторяют титрование до получения результатов, отличающихся не более, чем на 0,05 см 3 . Одновременно выполняют холостой опыт, используя для титрования 100 см 3 дистиллированной воды, отобранной мерным цилиндром.
Если для установления точной молярной концентрации раствора нитрата серебра используют аттестованный раствор хлоридов с молярной концентрацией 0,05000 моль/дм 3 (см. приложение А), в колбу помещают с помощью пипетки с одной отметкой 10,0 см 3 аттестованного раствора хлоридов, добавляют мерным цилиндром 90 см 3 дистиллированной воды и градуированной пипеткой 1 см 3 раствора хромата калия.
9.3.2 Для установления точной молярной концентрации раствора нитрата серебра, 0,02 моль/дм 3 , в коническую колбу вместимостью 250 см 3 с помощью пипетки с одной отметкой помещают 10,0 см 3 аттестованного раствора хлоридов с молярной концентрацией 0,01410 моль/дм 3 , добавляют мерным цилиндром 90 см 3 дистиллированной воды и градуированной пипеткой 1 см 3 раствора хромата калия.
Раствор в колбе перемешивают и титруют раствором нитрата серебра с молярной концентрацией 0,02 моль/дм 3 до появления красновато-оранжевого осадка. Титрование повторяют и, при отсутствии расхождения в объемах раствора нитрата серебра более 0,05 см 3 , за результат принимают среднее арифметическое значение. В противном случае повторяют титрование до получения результатов, отличающихся не более, чем на 0,05 см 3 . Одновременно выполняют холостой опыт, используя для титрования 100 см 3 дистиллированной воды, отобранной мерным цилиндром.
Если для установления точной молярной концентрации раствора нитрата серебра используют аттестованный раствор хлоридов с молярной концентрацией 0,05000 моль/дм 3 (см. приложение А), в колбу помещают с помощью пипетки с одной отметкой 5,0 см 3 аттестованного раствора хлоридов, добавляют мерным цилиндром 95 см 3 дистиллированной воды и градуированной пипеткой 1 см 3 раствора хромата калия.
9.3.3 Молярную концентрацию раствора нитрата серебра М2, моль/дм 3 , рассчитывают по формуле
где Mi — молярная концентрация аттестованного раствора хлоридов, моль/дм 3 ;
Vi — объем аттестованного раствора хлоридов, см 3 ;
1/2 — среднее арифметическое значение объема раствора нитрата серебра, израсходованного на титрование аттестованного раствора хлоридов, см 3 :
Ц(ол — объем раствора нитрата серебра, израсходованный на титрование холостой пробы, см 3 .
Рассчитанное значение молярной концентрации раствора нитрата серебра округляют и записывают таким образом, чтобы оно содержало четыре значащие цифры.
10.1 Перед выполнением измерений массовой концентрации хлоридов в пробе воды неизвестного состава следует провести предварительную оценку их концентрации в соответствии с приложением В.
В коническую колбу вместимостью 250 см 3 помещают пипеткой с одной отметкой аликвоту пробы водь?, объем которой зависит от результата предварительной оценки и предполагаемой концентрации хлоридов.
Рекомендуемые объемы аликвоты проб воды для анализа при следу
ющих концентрациях хлоридов составляют:
— от 10 до 250 мг/дм 3 вкпюч., см 3 . 100;
— св. 250 до 500 мг/дм 3 вкпюч., см 3 . 50;
— св. 500 до 1000 (или 1300) мг/дм 3 включ., см 3 . 25 (20);
— св. 1000 до 2600 мг/дм 3 .включ., см 3 . 10;
— св. 2600 до 5500 мг/дм 3 вкпюч., см 3 . 5;
— св. 5500 до 13000 мг/дм 3 включ., см 3 . 2;
— свыше 13000 мг/дм 3 , см 3 . 1.
Если объем аликвоты пробы меньше 100 см 3 , то в нее добавляют мерным цилиндром дистиллированную воду до 100 см 3 .
Проба должна иметь pH от 6 до 9, в противном случае его доводят до этих значений с помощью раствора азотной кислоты, 0,1 моль/дм 3 , или 0,4 %-ного раствора гидроксида натрия по универсальной индикаторной бумаге.
В пробу добавляют градуированной пипеткой 1 см 3 раствора хромата калия и при непрерывном перемешивании медленно титруют раствором нитрата серебра из бюретки. При массовой концентрации хлоридов 50 мг/дм 3 и менее для титрования используют раствор нитрата серебра с молярной концентрацией 0,02 моль/дм 3 , более 50 мг/дм 3 — 0,05 моль/дм 3 .
При титровании вначале появляется белый осадок хлорида серебра. При приближении к конечной точке титрования возникает оранжевая окраска, скорость исчезновения которой замедляется по мере титрования.
Окончание титрования определяют по неисчезающей при перемешивании оранжевой окраске, появляющейся от одной капли раствора нитрата серебра. Для более четкого установления конечной точки титрования целесообразно использовать «свидетель», в качестве которого используют недотитрованную пробу приблизительно с таким же содержанием хлоридов, как и в анализируемой пробе. Титрование повторяют и, если расхождение в объемах раствора нитрата серебра не превышает 0,1 см 3 при объеме нитрата серебра до 10 см 3 включительно и 0,2 см 3 при объеме нитрата серебра более 10 см 3 , то проводят оперативный контроль повторяемости по 13.2. В случае неудовлетворительного результата оперативного контроля повторяемости повторяют титрование до получения допустимого расхождения результатов.
Одновременно с титрованием анализируемых проб для учета индикаторной ошибки выполняют титрование холостой пробы, в качестве которой используют 100 см 3 дистиллированной воды; при этом массовая концентрация хлоридов в дистиллированной воде не должна превышать значений, установленных ГОСТ 6709.
Сливы растворов, содержащих соли серебра, собирают в специальную посуду, затем обрабатывают и утилизируют согласно правилам обращения с солями серебра.
10.2 При выполнении измерений массовой концентрации хлоридов аргентометрическим методом в природных водах мешающие влияния практически отсутствуют, за исключением цветности, обусловленной присутствием гумусовых веществ и (или) железа.
При выполнении измерений в очищенных сточных водах мешающие влияния могут также оказывать высокие концентрации сульфидов (более 1 мг/дм 3 ), сульфитов (более 50 мг/дм 3 ), тиосульфатов (более J 00 мг/дм 3 ), цианидов (более 1 мг/дм 3 ), тиоцианатов (более 2 мг/дм 3 ), аммиака (более 5 мг/дм 3 ), карбонатов (более 100 мг/дм 3 ), фосфатов (более 25 мг/дм 3 ).
10.3 Если анализируемая проба имеет высокую цветность, мешающую выполнению титрования, устранить ее можно одним из следующих способов:
— анализируемую воду медленно пропускают через колонку с активным углем, при этом первые 40 см 3 воды, прошедшие через колонку, следует отбросить;
— в коническую колбу вместимостью 500 см 3 помешают 200 см 3 анализируемой воды, приливают от 6,0 до 7,5 см 3 суспензии гидроксида алюминия и встряхивают до обесцвечивания жидкости. Дают пробе отстояться несколько минут и фильтруют через бумажный фильтр «белая лента», промытый дистиллированной водой. Первую порцию фильтрата следует отбросить.
10.4 При необходимости мешающее влияние карбонатов и аммиака устраняют подкислением пробы до pH от 6 до 7. Сульфиды,
сульфиты, тиосульфаты, цианиды разрушают, прибавляя к отмеренной для анализа слабощелочной пробе 1 см 3 пероксида водорода и оставляя на 10 мин.
Мешающее влияние перечисленных в 10.2 веществ можно также устранить разбавлением пробы, если исходная концентрация хлоридов достаточно высока.
10.5 Бромиды и йодиды титруются вместе с хлоридами в эквимолярных соотношениях. При выполнении измерений в природных водах, содержащих бромиды и йодиды в концентрациях намного ниже, чем концентрация хлоридов, их влиянием можно пренебречь; если же концентрации их известны (определены другими методиками), то из значения молярной концентрации хлоридов вычитают молярную концентрацию бромидов и йодидов.
11 Обработка результатов измерений
11.1 Массовую концентрацию хлоридов в анализируемой пробе воды X, мг/дм 3 , рассчитывают по формуле
где 35,45 — молярная масса хлоридов, г/моль:
V — объем раствора нитрата серебра, израсходованный на титрование анализируемой пробы, см 3 ;
Vxon — объем раствора нитрата серебра, израсходованный на титрование холостой пробы, см 3 ;
М- молярная концентрация раствора нитрата серебра, моль/дм э ;
1000 — коэффициент пересчета, мг/г;
У„р — объем аликвоты пробы воды, взятый для титрования, см 3 .
11.2 Если для устранения цветности использовали суспензию гидроксида алюминия, то в полученный результат следует ввести поправку на разбавление — умножить результат на коэффициент 1,03.
12 Оформление результатов измерений
12.1 Результат измерения в документах, предусматривающих его использование, представляют в виде
где X — среднее арифметическое значение двух результатов, разность между которыми не превышает предела повторяемости г„ (2,77 а,), мг/дм 3 ; при превышении предела повторяемости поступают согласно 13.2;
±Д — границы абсолютной погрешности результатов измерения для данной массовой концентрации хлоридов, мг/дм 3 (см. таблицу 1).
Абсолютные погрешности результатов измерений представляют числом, содержащим не более двух значащих цифр. Наименьшие разряды числовых значений результатов измерений принимают такими же, как и наименьшие разряды числовых значений абсолютных погрешностей результатов измерений.
12.2 Допустимо представлять результат в виде
12.3 Результаты измерения оформляют протоколом или записью в журнале по формам, приведенным в Руководстве по качестзу лаборатории.
13 Контроль качества результатов измерений при реализации методики в лаборатории
13.1.1 Контроль качества результатов измерений при реализации методики в лаборатории предусматривает:
— оперативный контроль исполнителем процедуры выполнения измерений (на основе оценки повторяемости и погрешности при реализации отдельно взятой контрольной процедуры);
— контроль стабильности результатов измерений (на основе контроля стабильности среднеквадратического отклонения повторяемости, внутрилабораторной прецизионности, погрешности).
13.1.2 Периодичность оперативного контроля исполнителем процедуры выполнения измерений, а также реализуемые процедуры контроля стабильности результатов выполняемых измерений регламентируются в Руководстве по качеству лаборатории.
13.2.1 Оперативный контроль повторяемости осуществляют для каждого из результатов измерений, полученных в соответствии с методикой. Для этого отобранную пробу воды делят на две части, и выполняют анализ в соответствии с разделом 10.
13.2.2 Результат контрольной процедуры гк, мг/дм 3 , рассчитывают по формуле
где Хь Х2 — результаты параллельных измерений массовой концентрации хлоридов в пробе, мг/дм 3 .
13.2.3 Предел повторяемости г„, мг/дм 3 , рассчитывают по формуле
где ог — показатель повторяемости для массовой концентрации, равной (X-i + Х2)/2, мг/дм 3 .
13.2.4 Результат контрольной процедуры должен удовлетворять условию
13.2.5 При несоблюдении условия (7) выполняют еще два измерения и сравнивают разницу методу максимальным и минимальным результатами с нормативом контроля. В случае превышения предела повторяемости, поступают в соответствии ГОСТ Р ИСО 5725-6 (раздел 5).
13.3 Алгоритм оперативного контроля процедуры выполнения измерений с использованием метода добавок совместно с методом разбавления проб
13.3.1 Оперативный контроль исполнителем процедуры
выполнения измерений проводят путем сравнения результатов
отдельно взятой контрольной процедуры Кк с нормативом контроля К.
13.3.2 Результат контрольной процедуры Кк, мг/дм 3 , рассчитывают по формуле
где X» — среднее арифметическое значение результатов контрольных
— „ 100 измерении массовой концентрации хлоридов в пробе, разбавленной в
раз с известной добавкой, мг/дм 3 ;
X’ — среднее арифметическое значение результатов контрольных измерений массовой концентрации хлоридов в пробе, разбавленной в
X — среднее арифметическое значение результатов контрольных измерений массовой концентрации хлоридов в рабочей пробе, мг/дм 3 ;
источник