Хлор — важный макроэлемент, входящий в состав всех тканей человеческого организма. В тканях хлор существует преимущественно в виде анионов (хлоридов) — отрицательно заряженных атомов. Чтобы подчеркнуть отрицательный заряд хлоридов, на письме их принято обозначать Cl — . Хлориды обычно связаны с положительно заряженными катионами натрия (Na + ) и калия (K + ) и вместе с ними формируют подвижный электролитный комплекс, основной регулятор кислотно-щелочного баланса.
Изменением количества хлоридов в крови и других тканях организм реагирует на многие патологические процессы.
Хлорные анионы обеспечивают в организме ряд важнейших функций:
- Вместе с катионами натрия и калия они являются одними из главных составляющих водно-солевого обмена. Как следствие, хлориды обеспечивают поддержание нормального артериального давления и предотвращают развитие отеков.
- Хлориды регулируют кислотно-щелочной баланс крови и осмотическое давление межклеточной жидкости.
- Анионы хлора принимают участие в процессе пищеварения: входят в состав желудочного сока и активируют пищеварительный фермент амилазу.
- Хлориды участвуют в синтезе литических ферментов фагоцитов, отвечающих за иммунитет организма.
- При участии хлоридов в печени протекают обменные процессы, которые обеспечивают детоксикационные функции этого органа.
Более 90% хлора поступает в организм с пищей — преимущественно с поваренной солью, а также с хлебом, мясом, молоком, морепродуктами, бобовыми и злаковыми.
Норма дневного потребления хлора (4-6 г) соответствует сбалансированному суточному рациону. Доза в 8-10 г считается избыточной, но безопасной для организма. Единовременно принятая доза хлора в 15 г оказывает сильный токсический эффект и может привести к летальному исходу.
Большая часть хлоридов концентрируется в межклеточном пространстве, в самих клетках анионов хлора в несколько раз меньше. Перемещение хлоридов из клеток в экстрацеллюлярное пространство и обратно способствует поддержанию нейтрального заряда клеточных мембран. Основным депо хлора в организме является подкожная клетчатка, способная хранить до 50-60% его запасов.
Большая часть хлоридов выводится из организма с мочой (до 90 %), в меньшей степени — с потом и калом. Обменные процессы хлора регулируются гормонами, которые вырабатываются в надпочечниках и щитовидной железе.
При жаркой погоде и интенсивных физических нагрузках, сопровождающихся усиленным потоотделением, возрастает потеря хлоридов. Врачи рекомендуют компенсировать ее повышенным потреблением поваренной соли и минеральных вод.
Нормальное содержание хлоридов в крови взрослого человека независимо от пола составляет 97-108 ммоль/л. У детей количество анионов хлора в крови примерно соответствует цифрам взрослых. Однако референсные значения (границы допустимых параметров) этого показателя в зависимости от возраста могут колебаться чуть больше, чем у взрослых — в пределах от 95 до 116 ммоль/л.
Поддержание постоянного водно-солевого баланса — одно из условия нормальной работы всех органов, поэтому содержание хлоридов в крови относительно стабильно. Стойкое увеличение или снижение количества хлора в организме говорит о наличии в нем патологических изменений.
Объектом биохимического исследования крови является образец объемом 5-10 мл, взятый натощак из локтевой вены. Забор образца для анализа назначают в следующих случаях:
- для оценки параметров кислотно-щелочного равновесия и баланса электролитов;
- в целях диагностики заболеваний почек и печени, сопровождающихся нарушениями метаболизма, а также судорожных состояний и нарушений сознания;
- для контроля водно-солевого баланса у пациентов, подвергающихся длительной инфузионной терапии, в том числе в палатах реанимационных отделений;
- при заболеваниях инфекционной и неинфекционной природы, сопровождающихся длительной диареей и рвотой.
Количество хлоридов в крови всегда оценивают в комплексе с показателями содержания катионов калия и натрия. Разница между количеством натрия как главного катиона крови и суммы хлора и бикарбоната (главных анионов) получило название анионного разрыва, или анионного промежутка. Этот показатель обычно составляет 8-16 ммоль/л, а его выход за границы нормы свидетельствует о грубых нарушениях кислотно-основного равновесия.
Снижение уровня хлоридов в крови ниже 97ммоль/л называется гипохлоремией. Ее причинами могут послужить:
- снижение поступления хлора в организм при бессолевой диете;
- «водное отравление» — неконтролируемый прием жидкости;
- продолжительная потеря хлоридов при рвоте и диарее;
- болезнь Аддисона (дефицит гормона альдостерона, регулирующего обмен хлора);
- обширные травмы и ожоги, при которых хлор связывается с ионами K + , высвобождающимися в результате разрушения клеток, и активно выводится через почки;
- длительное парентеральное введение растворов глюкозы и бикарбоната, а также лечение мочегонными средствами;
- врожденная хлоридорея — редкое наследственное заболевание, нарушение всасывания хлора в кишечнике;
- хронический пиелонефрит и наследственный синдром Бартера, сопровождающиеся нарушением фильтрации хлоридов в почках;
- осложненный кетоацидозом сахарный диабет.
Вариантом нормы считается кратковременная гипохлоремия после приема пищи. Снижения уровня хлора в плазме крови связанно с тем, что его анионы активно «направляются» организмом в обкладочные клетки стенок желудка, где синтезируется пищеварительный сок.
Гипохлоремия может сопровождаться потерей аппетита, снижением рефлекторной и эмоциональной возбудимости, запорами, а при длительном течении — выпадением волос и зубов, задержкой психосоматического развития у детей.
Крайнее проявление пониженного содержания хлоридов в плазме крови — метаболический алкалоз, сдвиг кислотно-щелочного равновесия организма в сторону оснований. В этом случае помимо симптомов гипохлоремии у пациентов могут наблюдаться судорожные сокращения мышц и сильное истощение организма.
Гиперхлоремия — повышение количества хлоридов в крови выше 108 ммоль/л. Гиперхлоремию могут вызвать:
- повышенное потребление солей хлора с пищей;
- заболевания и патологические состояния, связанные с обезвоживанием организма;
- сердечная и почечная недостаточность, при которых страдает выведение хлоридов из организма;
- длительная инфузионная терапия физиологическим раствором NaCl;
- синдром и болезнь Кушинга — гиперпродукция гормонов коры надпочечников, сопровождающаяся повышением уровня натрия и хлора в крови;
- гипервентиляция легких;
- несахарный диабет;
- интоксикация салицилатами.
Гиперхлоремия является побочным эффектом при уретеросигмостомии. Эта операция показана при онкологических заболеваниях мочевого пузыря. После его удаления мочеточник выводится в сигмовидную кишку, а хлор, поступающий с мочой в кишечник, снова всасывается и накапливается в организме.
К симптомам гиперхлоремии относятся обезвоживание организма, повышенное камнеобразование в мочевом пузыре и развитие заболеваний почек, осложнение течения диабета, отек конечностей, угнетение роста у детей.
Метаболический ацидоз, развивающийся при длительной гиперхлоремии, протекает с тошнотой и рвотой, повышенной утомляемостью и слабостью, а в крайних случаях проявляется учащающимися гипотоническими кризами. При отсутствии лечения у больного с симптомами метаболического ацидоза может развиться шок и кома.
Поскольку гипо- и гиперхлоремия являются элементами симптомокомплекса, развивающегося при многих заболеваниях, специфической терапии этих состояний не предусмотрено. При своевременной диагностике и лечении болезней, влекущих изменение содержания анионов хлора в крови, их показатели входят в границы нормы. Однако в тяжелых случаях, когда нарушение обмена электролитов ярко выражено, а в картине заболевания появляется вторичная симптоматика гипералкалоза и гиперацидоза, требуются неотложные действия.
Симптомы гипохлоремии снимаются с помощью заместительной терапии. Снижение уровня хлоридов обычно коррелирует с изменением количества натрия и калия в крови. Исходя из результатов анализов, рассчитывается дефицит электролитов, затем их недостаток восполняется комбинированным раствором из расчета ¾ NaCl и ¼ KCl.
При гиперхлоремии показано переливание умеренных объемов дистиллированной воды. Эта процедура проводится под тщательным контролем во избежание развития симптомов отека мозга.
Профилактика нарушения баланса хлоридов сводится к соблюдению режима питания. Пациентам, находящимся в зоне риска, рекомендовано следить за количеством потребляемой поваренной соли, частотой мочеиспускания и объемом мочи, исключить из рациона кофе, чай и алкоголь.
Определение содержания хлора в тканях является важным маркером клинической диагностики. Биохимический анализ крови, одним из компонентов которого является исследование уровня хлоридов, позволяет выявить нарушения водно-солевого обмена — предвестника развернутой клинической картины многих заболеваний. Особенно ценно это исследование при диагностике заболеваний мочевыводящей системы, протекающих со смазанной симптоматикой.
источник
Хлориды – это одна из трех основных групп электролитов, присутствующих в человеческом организме. Электролиты, это растворы солей, обеспечивающие перемещение по крови различных питательных веществ, доставку их в клетки и выводящие из клетки продукты метаболизма. Хлор способствует активации амилазы, входит в состав желудочного сока, образуя хлористоводородную кислоту. Также хлориды поддерживают нужный организму кислотно-щелочной баланс и баланс солей и воды. Говоря о хлоридах крови, в медицине могут также использовать просто термин «хлор», что в данном случае будет являться синонимом. Конечно, хлор содержится здесь не в чистом виде – он поступает в организм вместе с солями калия, натрия, кальция, железа, магния и других элементов, а затем эти соли диссоциируют, то есть, распадаются на ионы. Хлор является основным внеклеточным анионом, поддерживающим вместе с катионами натрия и калия электролитный баланс организма.
Больше всего хлора содержится в коже – около 60 % всего того хлора, который находится в организме. 90 % хлора выводится почками, остальной выходит с калом и через потовые железы. За обмен хлора в организме отвечают гормоны, вырабатываемые надпочечниками и щитовидной железой.
Дисбаланс электролитов в организме может быть симптомом самых разных заболеваний, как острых, так и хронических. Поэтому анализ крови на содержание хлоридов может быть назначен и вновь обратившимся за медицинской помощью пациентам, и тем, которые уже проходят лечение амбулаторно или в стационаре. Симптомы, которые требуют назначения подобного анализа:
- общая слабость,
- спутанность сознания,
- приступы тошноты,
- отеки,
- судороги,
- нарушение сердечного ритма.
Кроме того, тест на содержание хлоридов проводят для контроля эффективности лечения заболеваний печени и почек, стойкого повышения давления, сердечной недостаточности. Содержание хлоридов в крови является стабильной величиной, которая изменяется крайне редко. Анализ на концентрации хлоридов всегда проводят в комплексе с определением других показателей, в частности, содержания натрия, альдостерона, общего белка крови, биохимическим анализом и проч.
Забор крови производится из вены, с утра, натощак.
Норма хлоридов в крови обычных людей и беременных женщин:
Стойкое повышение уровня содержания хлоридов в крови называется гиперхлоремией. Она может быть абсолютной и относительной.
Абсолютная гиперхлоремия возникает при различных заболеваниях, вызывающих нарушение работы почек и их выделительной функции. Так, подобное состояние может развиться в случае хронического либо острого нефрита или нефросклероза. Почки перестают выводить достаточное количество хлора из организма, и он поступает в кровь, что и приводит к повышению его уровня.
Увеличение концентрации хлора в крови вследствие обезвоживания организма, например, при сильной рвоте, диарее, потере жидкости при обширных ожогах и проч., называется относительной гиперхлоремией. Уровень хлоридов в крови также повышается при
- не сахарном диабете,
- сердечной недостаточности,
- алкалозе,
- отравлении салицилатами,
- использовании капельниц с хлоридом натрия
- недостаточном поступлении жидкости в организм.
К подобному же результату может привести и прием некоторых лекарственных препаратов, в частности, минералокортикоидов, бромида калия, мочегонных препаратов, а также употребление большого количества хлора вместе с пищей. Например, обычной поваренной соли, которая, как известно, является хлоридом натрия.
Для диагностики муковисцидоза используется определение содержания хлоридов в жидкости, выделяющейся через потовые железы.
Отклонение содержания хлоридов в крови от нормы в сторону уменьшения, называется гипохлоремией. Подобное состояние может возникнуть в случае следующих заболеваний:
- хроническая или острая почечная недостаточность,
- хронический пиелонефрит,
- диабет почек,
- крупозное воспаление легких,
- хроническая обструктивная болезнь легких,
- застойная сердечная недостаточность,
- гипокалиемический метаболический алкалоз,
- диабетический ацидоз,
- заболевания синтезирующих контролирующие уровень хлоридов гормоны надпочечников – болезнь Адиссона,
- синдром недостаточной секреции антидиуретического гормона,
- заболевания, сопровождающиеся сильной диареей, когда хлор выходит из организма вместе с калом,
- сахарный диабет с диабетическим кетоацидозом,
- заболевания желудочно-кишечного тракта: язва двенадцатиперстной кишки, непроходимость кишечника, стеноз привратника. В этих случаях происходит большое выделение хлора из организма через рвотные массы с желудочным соком.
Уменьшение концентрации хлора в крови является естественной физиологической реакцией организма после различных оперативных вмешательств. Оно происходит за счет повышения СО2 в плазме крови и перемещения хлоридов в эритроциты. К такому же результату может привести и прием некоторых лекарственных препаратов, в частности – диуретиков (фуросемида). Или же недостаточное поступление хлора вместе с пищей. В частности, многие диеты, накладывающие запрет на употребление соли, могут привести к довольно тяжелым заболеваниям. К тому что понижается норма хлоридов в крови, может привести и повышенное потоотделение, например тяжелая работа в жарких помещениях и горячих цехах.
источник
Обзор характеристик воды с повышенным содержанием хлоридов (натрия, кальция), их норм примесей, а также раскрытие вопроса вредного воздействия на живые организмы, бытовую технику и коммуникации.
Хлориды – это соли соляной кислоты. Магматические породы с хлорсодержащими минералами (хлорапатит, содалит и др.), а также соленосные отложения (галит) являются первичными источниками данного элемента.
Все природные воды содержат в своем составе хлориды, чаще всего встречающиеся в виде натриевых, магниевых и кальциевых солей. Их естественное содержание в грунтовых и артезианских водах обусловлено вулканическими выбросами, а также результатами кругового взаимодействия атмосферных осадков с почвами и обмена через атмосферу с океаном.
Хлориды, содержащиеся в значительном количестве в воде, могут быть следствием вымывания хлористых соединений или поваренной соли из пластов, соприкасающихся с водой.
Воды подземных источников, некоторых озер и морей в большом количестве содержат хлорид натрия (NaCl), присутствующий в воде хлорид кальция (CaCb) придает ей некарбонатную жесткость.
При оценке санитарного состояния водоема учитывают показатель содержания хлоридов в воде. Так, к примеру, незначительное содержание отмечается в водах северной части России, обычно, не выше 10 мг/л, тогда как соответствующий показатель, характерный для южных регионов, доходит до 10-100 мг/л.
Прослеживается тенденция заметных сезонных колебаний концентрации хлорид-ионов в поверхностных водах, что связано с коррелирующим изменением общей минерализации. Это обусловлено критерием загрязнения водоема из-за попадания в него хозяйственно-бытовых стоков.
Высокое содержание хлоридов заметно ухудшает вкусовые качества воды, делает ее соленой на вкус, а также практически непригодной для хозяйственных и технических нужд, в том числе для оросительных работ на сельскохозяйственных угодьях.
ПДК (предельно допустимая концентрация) хлоридов в воде не должна превышать 350 мг/л, в противном случае вода будет неприятной по вкусу – чрезмерно соленой.
Соленые (хлоридные) воды содержат соли хлоридной группы. Чаще всего катионный состав таких вод представляет натрий, образующий в сочетании с хлором поваренную соль, чем и обеспечен их соленый вкус. Причем, хлористый натрий заметно доминирует относительно других солей практически во всех хлоридных водах.
Хлористый магний преобладает в горько-соленых водах, где его все равно намного меньше, чем поваренной соли. Превышает количество растворенной поваренной соли в некоторых случаях содержащийся хлористый кальций в водах хлоридно-кальциевого типа.
Отличием от карбонатных и сульфатных ионов является их не предрасположенность к созданию ионных ассоциированных пар. Слабо выраженная сорбция с взвешенными веществами, легкая растворимость и потребление водными организмами объясняется хорошей миграционной способностью хлоридных анионов.
При попадании в организм человека, а также домашних животных воды, содержащей избыточное количество хлоридов:
- раздражаются слизистые оболочки, глаза, кожные покровы, дыхательные пути;
- проявляется негативное воздействие на секреторную деятельность желудка;
- ухудшается пищеварение;
- нарушается водно-солевой баланс;
- возникает вероятность развития заболеваний системы кровообращения;
- появляется склонность к возникновению новообразований мочеполовых органов, органов пищеварения, желудка, пищевода;
- избыточное поступление в организм хлористого натрия увеличивает частоту сердечно сосудистых заболеваний;
- появляется склонность к гипертензивным состояниям, повышенной реактивности сосудов;
- возникает вероятность желче- и мочекаменных заболеваний.
источник
Химический состав воды является причиной заболеваний неинфекционной природы.
Причины изменения химического состава воды:
1) промышленная и сельскохозяйственная деятельность человека- поступление производственных и бытовых сточных вод, атмосферных осадков, содержащих вредные вещества.
2) очистка питьевой воды — применение химических приемов обработки воды и содержание остаточных количеств реагентов в воде.
- сухой остаток
- жесткость
- хлориды
- сульфаты
- нитраты и нитриты
- значение рН
- микроэлементы
Сухой остаток
Сухой остаток-это общее содержание растворенных твердых веществ в воде, он дает представление о степени минерализации воды. Основными ионами, определяющими сухой остаток,, являются карбонаты, бикарбонаты, хлориды, сульфаты, нитраты, натрий, калий, кальций, магний. Данный показатель влияет на другие показатели качества питьевой воды, такие как привкус, жесткость, коррозирующие свойства и тенденция к накипеобразованию.
Воду с сухим остатком свыше 1000 мг/л называют минерализованной, до 1000 мг/л — пресной. Воду, содержащую до 50 — 100 мг/л, считают слабоминерализованной (дистиллированная),100 — 300 мг/л — удовлетворительно минерализованной, 300 — 500 мг/л — оптимальной минерализации и 500 — 1000 мг/л — повышенно минерализованной. Минерализованной водой является морская, минеральная, пресной — речная, дождевая, вода ледников.
- Вода с повышенным содержанием минеральных солей непригодна для питья, так как имеет соленый или горько- солёный вкус, а её употребление в зависимости от состава солей приводит к неблагоприятным физиологическим изменениям в организме:
- способствует перегреву в жаркую погоду,
- ведет к нарушению утоления жажды,
- изменяет водно-солевой обмен за счёт увеличения гидрофильности тканей,
- усиливает моторную и секреторную желудка и кишечника.
- Слабоминерализованная вода неприятна на вкус, длительное её употребление может привести к нарушению водно-солевого обмена (уменьшение содержания хлоридов в тканях). Такая вода, как правило, содержит мало микроэлементов.
Общая жесткость воды обусловлена преимущественно присутствием в воде кальция и магния, которые находятся в виде гидрокарбонатов, карбонатов, хлоридов, сульфатов и других соединений; имеют также значение ионы стронция, железа, бария, марганца.
- Устранимая — величина, на которую уменьшается общая жесткость воды при кипячении её в течении 1часа. Обусловлена гидрокарбонатами кальция и магния, которые разрушаются и выпадают в виде карбонатов в осадок (накипь).
- Карбонатная — это жесткость, обусловленная бикарбонатами и малорастворимыми карбонатами. Устранимая жесткость приблизительно равна карбонатной, но когда в воде много гидрокарбонатов натрия и кальция, карбонатная жесткость значительно превышает устранимую.
- Постоянная — это жесткость, которая остается после кипячения и обусловлена хлоридами, карбонатами, и сульфатами кальция и магния.
Воду с общей жесткостью до 3,5 мг-экв/л называют мягкой, 3,5-7 — средней жесткости, 7-10 — жесткой, свыше-10 — очень жесткой.
Основными природными источниками жесткости воды являются осадочные породы, фильтрация и сток с почвы. Жесткая вода образуется в районах с плотным пахотным слоем и известковыми образованиями. Для подземных вод характерна большая жесткость, чем для поверхностных. Подземные воды, богатые карбоновыми кислотами и растворенным кислородом, обладают высокой растворяющей способностью по отношению к почвам и породам, содержащим минералы кальцита, гипса и доломита.
Основными промышленными источниками жесткости являются стоки предприятий, производящих неорганические химические вещества, и горнодобывающая промышленность. Оксид кальция используется в строительной промышленности, производстве бумажной массы и бумаги, рафинировании сахара, в очистке нефти, дублении и как реагент для очистки воды и сточных вод. Сплавы магния применяются в литейном и штамповочном производстве, бытовых продуктах. Соли магния используются в производстве металлического магния, удобрений, керамики, взрывчатых веществ, медикаментов.
— ухудшаются органолептические свойства — вода имеет неприятный вкус;
— нарушается всасывание жиров в кишечнике в результате образования кальциево-магнезиальных нерастворимых мыл при омылении жиров;
— у лиц с чувствительной кожей способствует появлению дерматитов в связи с тем, что кальциево-магнезиальные мыла обладают раздражающим действием
— в хозяйственно-бытовом аспекте: увеличивается расход моющих средств, образуется накипь при кипячении, волосы после мытья становятся жесткими, ткани одежды теряют мягкость и гибкость, ухудшается разваривание мяса и овощей с потерей витаминов в результате связывания их в неусвояемые комплексы,
— имеются данные, что употребление слишком жесткой воды может приводить к увеличению частоты мочекаменной болезни; хотя есть сведения о том, что жесткость может служить защитой от болезней;
— при резком переходе от пользования жесткой водой к мягкой и наоборот могут у людей наблюдаться диспептические явления;
— портит вид, вкус и качество чая, который является важнейшим напитком у населения, стимулирующим желудочную секрецию и утоляющим жажду;
Имеются данные о том, что употребление мягкой воды может явиться причиной сердечно-сосудистых заболеваний.
Хлориды могут быть минерального и органического происхождения. Присутствие хлоридов в природных водах может быть связано с растворением отложений солей, загрязнением, обусловливаемым нанесением соли на дороги с целью борьбы со снегом льдом, сбросом стоков предприятиями химической промышленности, эксплуатацией нефтяных скважин, сбросом сточных вод, ирригационным дренажом, загрязнением в результате вымывания твердых отбросов и вторжения морской воды в прибрежные районы. Каждый из этих источников может вызвать загрязнение поверхностных и подземных вод. Высокая растворимость хлоридов объясняет широкое распространение их во всех природных водах.
Влияние на здоровье. Хлориды — наиболее распространенные в организме человека анионы и играют большую роль в осмотической активности внеклеточной жидкости; 88% хлоридов в организме находятся во внеклеточном пространстве. У здоровых людей происходит почти полное всасывание хлоридов.
— ухудшаются органолептические свойства — вода приобретает солоноватый вкус и в связи с этим ограничивается водопотребление;
— влияет на водно — солевой обмен; повышается уровень хлоридов в крови, что приводит к снижению диуреза и перераспределению хлоридов в органах и тканях;
— вызывают угнетение желудочной секреции, в результате чего нарушается процесс переваривания пищи;
— имеются данные о том, что хлориды оказывают гипертензивный эффект и у людей, страдающих гипертонической болезнью употребление воды с повышенным содержанием хлоридов может вызвать утяжеление течения заболевания;
— являются показателем загрязнения подземных и поверхностных водоисточников, так как хлориды содержаться в сточных водах и физиологических выделениях человека.
Сульфаты поступают в водную среду со сточными водами многих отраслей промышленности. Атмосферная двуокись серы (SO2), образующаяся при сгорании топлива и выделяющаяся в процессах обжига в металлургии, может вносить вклад в содержание сульфатов в поверхностных водах. Трехокись серы (SO3), образующаяся при окислении двуокиси серы, в сочетании с парами воды образуют серную кислоту, которая выпадает в виде «кислого дождя» или снега. Большинство сульфатов растворимы в воде.
С сульфатом алюминия, который используется в качестве флоккулянта при очистке воды, в очищенную воду может дополнительно попадать 20-50 мг/л сульфатов. Сульфаты не удаляются из воды обычными методами очистки. Концентрация в большинстве пресных вод очень низкая.
— сульфаты плохо всасываются из кишечника человека. Они медленно проникают через клеточные мембраны и быстро выводятся через почки. Сульфат магния действует как слабительное в концентрации выше 100 мг/л, приводя к очищению ЖКТ. Такой эффект возникает у людей, впервые использующих воду с высоким содержанием сульфатов (при переезде на новое место жительства, где употребляют сульфатную воду). Со временем человек адаптируется к такой концентрации сульфатов в воде.
— ограничивается водопотребление, так как сульфаты придают воде горько-соленый вкус в концентрации свыше 500 мг/л.
— неблагоприятно влияют на желудочную секрецию, приводя к нарушению процессов переваривания и всасывания пищи.
— являются показателем загрязнения поверхностных вод производственными сточными водами и подземных вод водами вышележащих водоносных горизонтов.
Нитраты, нитриты
Аммиак является начальным продуктом разложения органических азотосодержащих веществ. Поэтому наличие аммиака в воде может расцениваться как показатель опасного в эпидемическом отношении свежего загрязнения воды органическими веществами животного происхождения. В некоторых случаях наличие аммиака не указывает на недоброкачественность воды. Например: в глубоких подземных водах аммиак образуется за счет восстановления нитратов при отсутствии кислорода или повышенное содержание аммиака в болотистых и торфяных водах (аммиак растительного происхождения).
Соли азотистой кислоты (нитриты) представляют собой продукты неполного окисления аммиака под влиянием микроорганизмов в процессе нитрификации. Наличие нитритов свидетельствует о возможном загрязнении воды органическими веществами, однако нитриты указывают на известную давность загрязнения.
Соли азотной кислоты (нитраты) — конечные продукты минерализации органических веществ бактериями, присутствующими в почве и в воде с достаточным содержанием кислорода. Присутствие в воде нитратов без аммиака и нитритов указывает на завершение процесса минерализации.
Одновременное содержание в воде аммиака, нитритов и нитратов свидетельствует о незавершенности этого процесса и продолжающемся, опасном в эпидемическом отношении загрязнении воды. Однако повышенное содержание нитратов может иметь минеральное происхождение. Нитраты используют в качестве удобрений (селитра), во взрывчатых веществах, в химическом производстве и в качестве консервантов пищевых продуктов. Некоторые нитраты являются результатом фиксации в почве атмосферного азота (бактериальный синтез). Нитриты используют в качестве консервантов пищевых продуктов. Некоторые нитраты и нитриты образуются при вымывании дождем окислов азота, которые являются результатом разряда молнии или поступают из антропогенных источников.
Нитраты и нитриты широко распространены в окружающей среде, они обнаруживаются в большинстве пищевых продуктов, в атмосфере и во многих водных источниках. Поступлению этих ионов в воду способствует использование удобрений, гниение растительного и животного материала, бытовые стоки, удаление в почву осадка сточных вод, промышленные сбросы, вымывание из мест захоронения отходов и вымывание из атмосферы. В природных чистых водах нитратов, как правило, немного. Однако в грунтовых водах в пределах населенных пунктов, животноводческих ферм и в других местах, где почва длительно и массивнозагрязняется, содержание нитратов может быть высоким.
Поскольку ни один из обычно используемых методов очистки и обеззараживания воды не изменяет значительно уровня содержания нитратов, и поскольку концентрация нитратов заметно не изменяется в системе распределения воды, уровни содержания в водопроводной воде часто полностью аналогичны таковым для водных источников. Содержание нитритов в водопроводной воде ниже, чем в водных источниках, что вызвано их окислением в процессе очистки воды, особенно при хлорировании.
Метаболизм. Нитраты и нитриты легко поглощаются организмом. Нитраты поглощаются в верхних отделах тонкого кишечника, концентрируются преимущественно в слюне через посредство слюнных желез, выводятся через почки. Нитрат может легко превращаться в нитрит в результате бактериального восстановления. Восстановление нитратов в нитриты происходит во всем организме, включая желудок. Это превращениезависит от значения рН. У грудных детей, у которых кислотность в желудке в норме очень низкая, образуется большое количество нитрита. У взрослых кислотность в желудке характеризуется значением рН 1-5 и в меньшей степени происходит превращение нитрата в нитриты. Нитрит может окислять гемоглобин в метгемоглобин. При определенных условия нитриты могут реагировать в организме человека с вторичными и третичными аминами и амидами (пища) с образованием нитрозаминов, некоторые из которых считаются канцерогенами.
Значение нитратов, нитритов:
— вызывают развитие «водно-нитратнойметгемоглобинемии» за счет окисления нитритами гемоглобина в метгемоглобин. В основном данное заболевание возникает у детей. Чувствительность грудных детей к действию нитратов относили за счет их высокого поступления в организм относительно массы тела, присутствием нитрат редуцирующих бактерий в верхних отделах ЖКТ и более легким окислением эмбрионального гемоглобина. Кроме того, повышенная чувствительность наблюдается у грудных детей, страдающих нарушениями функции ЖКТ, при которых увеличивается количество бактерий, способных превращать нитраты в нитриты. Использование искусственных смесей для вскармливания детей тоже рассматривается как причина увеличения заболеваемости, так как вода, используемая для приготовления смеси может содержать повышенное количество нитратов. У грудных детей в желудке значение рН, близкое к нейтральному, способствует бактериальному росту в желудке и в верхних отделах кишечника. У детей отмечается недостаточность по двум специфическим ферментам, которые осуществляют обратное превращение метгемоглобина в гемоглобин. Длительное кипячение может усугублять проблему вследствие увеличения количества нитратов при испарении воды. Чаще причиной заболевания являлось использование в качестве источника воды частных колодцев с микробиологическим загрязнением (в них отсутствуют водоросли, активно потребляющие нитраты). Заболевание характеризуется развитием одышки, цианоза, тахикардии, судорог. У детей старше 1 года и взрослых заболевание в форме острого токсического цианоза не наблюдается, но возрастает содержание метгемоглобина в крови, что ухудшает транспорт кислорода к тканям — это проявляется слабостью, бледностью кожных покровов, повышенной утомляемостью.
— вызывают образование нитрозаминов, некоторые из них могут быть канцерогенами. Образование этих веществ происходит во рту или где-либо ещё в организме, где кислотность относительно низкая.
— являются показателем загрязнения воды органическими веществами.
Значение рН (активная реакция).
Кислыми являются болотистые воды, содержащие гуминовые вещества, щелочными — подземные воды, богатые бикарбонатами.
— определяет природные свойства воды;
— является показателем загрязнения открытых водоемов при спуске в них кислых или щелочных производственных сточных вод;
— значение рН тесно связано с другими показателями качества питьевой воды. Рост железобактерий в большой степени зависит от рН. Они образуют в качестве конечного продукта метаболизма гидрат окиси железа, который придает красный цвет воде. При высоких значениях рН вода приобретает горький вкус.
— эффективность процессов коагуляции и обеззараживания зависит от рН. Обеззараживающее действие хлора в воде ниже при высоких значениях рН; это связано со снижением концентрации хлорноватистой кислоты.
источник
Содержание хлоридов в исследуемом растворе (рС1—) устанавливают по градуировочному графику.[ . ]
Содержание хлорид-ионов в воде природных водоемов варьирует в широких пределах. В речной и озерных водах, особенно в северных районах нашей страны (см. рис. 3.8), концентрация их невелика. Однако с увеличением минерализации воды абсолютное и относительное количество С1 возрастает;, в морях и большей части соляных озер он является главным анионом; в морской воде хлорид-ионы составляют 87% массы всех анионов. Объясняется это хорошей растворимостью хлоридов кальция, магния, натрия (см. п. 2.4.2.2) и малой растворимостью Са504 и СаС03. Поэтому с увеличением солесодержания в воде такие широко распространенные ионы, как БО и С03 (НСО ), достигая величин произведения растворимости в присутствии ионов Са2+ (см. п. 2.4.4), начинают выделяться в осадок, уступая» место иону С1 .[ . ]
Содержание хлорид-иона можно определять титрованием 0,05 н. раствором А§1 03, но лучше всего потенциометрически относительно серебряного электрода, покрытого хлоридом серебра. Предел обнаружения в зависимости от чувствительности титрования составляет 1—5 млн-1 в 60 л воздуха.[ . ]
Определение хлоридов служит контролем постоянства солевого фона сточной воды, изменяющейся во время очистки в органической части, и для суждения о «согласованности» анализируемых проб. Содержание хлоридов колеблется от 180 до 300 мг/л.[ . ]
Содержание хлоридов — ниже допустимой нормы, поэтому применение сточных вод в сельском хозяйстве при наличии достаточных площадей вполне возможно. Однако предварительно необходимо проверить, нужны ли и в какой степени мероприятия по уменьшению, а в некоторых случаях и уничтожению неприятного запаха.[ . ]
Содержание хлоридов в воде определяет и ее пригодность для питья. Для питьевой воды предельное значение составляет 200 мг/л. Вода с ббльшим содержанием либо солона, либо горька на вкус. Содержание хлоридов в воде также определяет возможность ее использования в сельском хозяйстве, в том числе для парников и оранжерей. В зависимости от вида растений предельная концентрация хлоридов составляет 50—300 мг/л.[ . ]
Хлориды являются составной частью большинства природных вод. Как и сульфаты, они определяют некарбонатную жесткость воды. Содержание хлоридов естественного происхождения имеет большой диапазон колебаний. Однако в воде рек концентрация хлоридов невелика — она не превышает обычно 10 мг/л, поэтому повышенное количество хлор-ионов указывает на загрязнение .источника сточными водами. В воде источников централизованного водоснабжения концентрация хлоридов не должна превышать 350 мг/л.[ . ]
Хлориды являются составной частью большинства природных вод. Большое содержание хлоридов геологического происхождения в поверхностных водах — явление редкое. Поэтому обнаружение большого количества хлоридов является показателем загрязнения воды бытовыми или некоторыми промышленными сточными водами. В промышленных сточных водах содержание хлоридов зависит от характера производства. Постепенное повышение содержания хлоридов в поверхностных водах может служить мерилом загрязнения водоемов сточными водами.[ . ]
Хлориды — главные ионы природных вод, обладают большой миграционной способностью, что объясняется их хорошей растворимостью, слабо выраженной способностью к сорбции на взвешенных веществах и к потреблению водными организмами. Хлориды ухудшают вкусовые качества воды и делают ее малопригодной для питьевого водоснабжения, поэтому контроль содержания хлоридов в воде водоемов имеет важное значение для оценки качества воды. Для рыбохозяйственных водных объектов ПДК хлоридов составляет 300 мг/л.[ . ]
Содержание хлоридов также более или менее постоянно. Изменение массы хлоридов указывает на примесь производственных сточных вод.[ . ]
Хлориды являются преобладающим анионом в высокоминерализованных водах. Концентрация хлоридов в поверхностных водах подвержена сезонным колебаниям, коррелирующим с изменением общей минерализации воды. В незагрязненных речных водах и водах пресных озер содержание хлоридов колеблется от долей миллиграмма до десятков и сотен, в подземных и морских водах — значительно выше.[ . ]
При содержании хлоридов менее 250 мг/л берут 100 мл фильтрованной испытуемой воды. При большем содержании хлоридов берут 10-50 мл. Испытуемую воду наливают в две конические колбы, доводят до 100 мл дистиллированной водой, прибавляют 5 капель раствора К2Сг04. Раствор в одной колбе титруют AgN03, а вторая колба используется для контроля.[ . ]
Помимо хлоридов кальция и магния в составе солей, растворенных в воде, присутствующей в сырье, находится хлорид натрия, который, как известно, гидролизу не подвергается, но существенно повышает проводимость коррозионной среды и за счет этого повышает ее агрессивность. С другой стороны, он способствует развитию питтинговой коррозии и коррозионному растрескиванию аустенит-ных сталей, так как, так же как хлориды магния и кальция, является поставщиком ионов хлора. Именно этим и объясняются, на наш взгляд, аномально высокие скорости коррозии верхних тарелок колонны, выполненных из стали 12Х18Н10Т в 1997 г., когда участились вынужденные остановки установки, а на завод поступала нефть с высоким содержанием хлоридов и воды. Как показано в отчетах главного технолога завода, всего после нескольких дней эксплуатации колонны в условиях образования аномально высокого содержания НС1 глубина поражения этих элементов достигла 0,5 мм. Таким образом, применявшиеся методы защиты (ингибирование, нейтрализация и использование тарелок из стали 12Х18Н10Т) не смогли привести к должному уровню надежности эксплуатации аппарата. Применение защитного колпака из стали 08Х17Н13М2Т можно считать лишь временной мерой, так как эта сталь, хоть и в меньшей мере, чем 12Х18Н10Т, все-таки подвержена питтинговой коррозии под действием хлоридов, особенно в кислой среде.[ . ]
Рио.35. Влияние содержания А1СЦ на величину pH и выход активного хлора в растворах с содержанием хлоридов 0.427 г-ион/л: I — выход активного хлора. 2 — напряжение, 3 — pH исходного электролита, 4 — pH электролита после электролиза.[ . ]
В питьевой воде содержание хлоридов не должно превышать 30—50 мг/л, а содержание сульфатов — 60 мг/л. Однако это не всегда достижимо в некоторых южных маловодных районах нашей страны (Туркмения, Казахстан и др.), где местные водоисточники сильно минерализованы.[ . ]
| Изменение . содержания хлоридов в растворах дихлоруксусной | 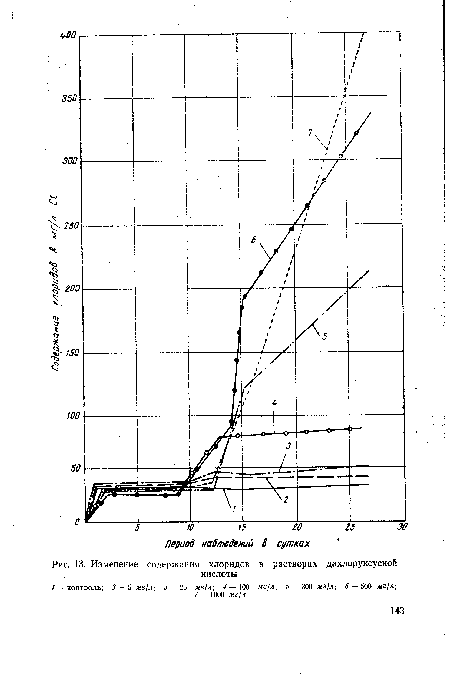 |
По ГОСТу предельное содержание сульфат-ионов в воде источников централизованного водоснабжения не должно превышать 500 мг/л, но, как правило, в речной воде концентрация сульфатов составляет 100—150 мг/л. Повышенная концентрация сульфатов может свидетельствовать о загрязнении источника сточными водами, в основном производственными. Хлориды являются составной частью большинства природных вод. Содержание хлоридов естественного происхождения имеет большой диапазон колебаний: Однако в воде рек концентрация хлоридов невелика — она превышает обычно 10—30 мг/л, поэтому повышенное количество хлор-ионов указывает на загрязнение источника сточными водами. В воде источников централизованного водоснабжения концентрация хлоридов не должна превышать 350 мг/л. Лимитирование верхнего предела концентраций сульфатов и хлоридов обусловлено тем, что более высокие концентрации этих ионов придают воде солоноватый привкус и могут вызывать нарушение в работе желудочно-кишечного тракта у людей. При некоторых соотношениях сульфатов и хлоридов вода становится агрессивной по отношению к различным типам бетона. Силикаты в растворе определяют лишь в тех природных водах, где их содержание зависит от геологическихусловий и присутствия некоторых организмов. Все эти кислоты при обычных для природных вод значениях pH малорастворимы и образуют в воде коллоидные растворы. Силикаты — нежелательная примесь в воде, питающей котлы, так как дает силикатную накипь на стенках котлов.[ . ]
Ход определения. Вносят в колбу несколько стеклянных бусинок, соединяют ее с обратным холодильником, нагревают содержимое колбы до кипения и кипятят 2 ч. Одновременно проводят холостое определение, взяв для него 25 мл дважды перегнанной (с добавлением перманганата в колбу для кипячения) воды. По охлаждении анализируемый раствор переносят в мерную колбу вместимостью 200 мл, стенки колбы при-, бора обмывают дважды перегнанной водой. Промывную — воду сливают в колбу и доводят той же водой анализируемый раствор до метки. Отобрав аликвотную порцию в 100 мл полученного раствора, переносят ее в стакан вместимостью 400—450 мл, разбавляют дистиллированной водой примерно до 300 мл и нейтрализуют 45%-ным раствором едкого натра: сначала приливают 30 мл этого раствора, потом после перемешивания прибавляют его по каплям до pH = 5—7. Нейтрализованный раствор нагревают до кипения, вносят 0,1 г прокаленной окиси магния и на-; гревают 20 мин при слабом кипении. Дают осадку собраться на дне стакана и фильтруют раствор через плотный фильтр, перенося осадок на фильтр к концу фильтрования. Осадок на фильтре промывают горячей водой до получения бесцветного фильтрата. Воронку с фильтром помещают на маленькую коническую колбу, в фильтре делают отверстие и через него смывают осадок горячей водой в колбу. Затем фильтр обрабатывают 3 мл 2 н. серной кислоты, обмывая ею предварительно стенки стакана. Фильтр и стакан хорошо промывают горячей водой, собирая промывные воды в ту же колбу и кипятят, содержимое колбы до полного растворения осадка. Полученный раствор переносят в мерную колбу вместимостью 100 мл, фильтруя его, если надо, через плотный фильтр. Приливают затем 5 мл 2 н. уксусной кислоты и смесь кипятят 5 мин. Охлаждают полученный ■ окрашенный раствор, разбавляют его дистиллированной водой до метки, перемешивают и измеряют его оптическую плотность при X = 536 нм в кювете с толщиной поглощающего слоя 5 см по отношению к раствору холостого опыта.[ . ]
Образцы для анализа на содержание органических веществ собирали в отмытые гексаном стеклянные бутылки вместимостью около 4 л, снабженные тефлоновыми пробками. Образцы для определения содержания хлоридов и взвешенных веществ отбирали в чистые полиэтиленовые литровые сосуды. Все образцы до анализа или экстрагирования хранили при 4 °С. Анализы и экстракцию взвешенных веществ проводили спустя 36 ч после отбора проб.[ . ]
Высокая растворимость хлоридов объясняет широкое распространение их во всех природных водах. В проточных водоемах содержание хлоридов обычно невелико (20-30мг/л). Незагрязненные грунтовые воды в местах с несолончаковой почвой обычно содержат до 30-50 мг/л хлор-иона. В водах, фильтрующихся через солончаковую почву, в 1 л могут содержаться сотни и даже тысячи миллиграммов хлоридов. Вода, содержащая хлориды в концентрации более 350 мг/л, имеет солоноватый привкус, а при концентрации хлоридов 500-1000 мг/л неблагоприятно влияет на желудочную секрецию. Содержание хлоридов является показателем загрязнения подземных и поверхностных водоисточников и сточных вод. Определение хлоридов ведется по методу Мора.[ . ]
Известно, что при растущем содержании хлоридов и сульфатов в бумаге, при уменьшающемся значении pH увеличивается корродирующее действие бумаги.[ . ]
Предварительные указания. Если содержание хлоридов во взятом объеме воды превышает 25 мг С1, то необходимо добавлять сульфат ртути. При наличии в воде других неорганических восстановителей следует внести поправку на потребление ими кислорода, которую устанавливают в 20 мл исследуемой воды путем ее титрования 0,0Ш раствором перманганата в слабокислой среде на холоде (см. «Определение перманганатной окисляемости»).[ . ]
Метод применяется для определения хлоридов при содержании их, превышающем 2 мг/л без разбавления можно титровать пробы с содержанием хлоридов до 400 мг/л. Точность определения +1—■ 3 мг/л. Для точного определения хлоридов при концентрациях меньше 10 мг/л пробы надо предварительно упаривать. В зависимости от концентрации хлоридов в пробе титруют 0,1 н., 0,05 н. или 0,02 н. раствором нитрата серебра.[ . ]
Наличие в сточных водах большого количества хлоридов отрицательно сказывается на процессе ионитовой очистки сточных вод. Следствием высокой концентрации хлор-ионов ¡в сточных водах являются низкая концентрация некаля в регенерате и большие расходы энергетических средств на его переработку. Содержание хлоридов в сточных водах ведет к снижению емкости поглощения ионита.[ . ]
При анализе целлюлоз, содержащих значительное количество хлоридов, может образоваться в колбе белый налет. В этом случае высушенный экстракт растворяют в 15 мл горячего спирта, добавляют 30 мл дистиллированной воды и определяют содержание хлоридов путем титрования 0,1 н. раствором AgNOз, используя в качестве индикатора К2СЮ4.[ . ]
При производстве калиевой селитры отходом является рассол с содержанием хлорида натрия 220—250 г/л. С вводом на заводе цеха утилизации хлорида натрия (рис. 1.12) содержание последнего в общем стоке снизилось с 4800 до 1200 мг/л. При этом ежегодно утилизируется свыше 3500 т хлорида натрия, 40 % которого выпускается в виде химической продукции реактивной чистоты.[ . ]
Между тем, расчетами по изменению солесодержания, в частности содержания хлоридов и солей жесткости, подтверждено уменьшение накипеобразования в 8—9 раз, т. е. примерно во столько же раз, как и при стендовых испытаниях.[ . ]
В работе [19] изучено также влияние низкомолекулярного электролита (хлорида натрия) на £-потенциал. При увеличении содержания хлорида натрия до 1,5 г/л и добавлении флокулянта отрицательный £■-потенциал резко уменьшался. При дальнейшем росте содержания хлорида натрия в сточной воде снижение £-потенциала замедлялось, оптимальная доза флокулянта увеличивалась, эффективность очистки ухудшалась. Это обусловлено уменьшением степени диссоциации ионогенных групп флокулянта, свертыванием макромолекул и снижением их суммарного положительного заряда.[ . ]
В ряде производств образуются жидкие и твердые отходы с высокой концентрацией хлорида натрия, а также органических и хлорорганических соединений. При огневой переработке этих отходов может быть получен продукт с высоким содержанием хлорида натрия, пригодный для дальнейшего использования.[ . ]
Биохимическое окисление 2,4-Д происходит с образованием хлор-ионов, причем повышение содержания хлоридов в пробах соответствует тому количеству хлор-ионов- которое содержится в 2,4-Д и высвобождается в процессе окисления.[ . ]
Настоящий стандарт распространяется на питьевую воду и устанавливает методы определения содержания хлоридов (хлор-иона).[ . ]
Основными показателями для характеристики состава очищенных сточных вод являются: остаток нефти или нефтепродуктов в воде (в мг/л), содержание взвешенных веществ по весу, высушенных при температуре 105°С (в мг/л). количество растворенного кислорода (в мг/л), прозрачность (в см), цветность (в град), окраска, содержание хлоридов и сероводорода (в мг/л), окисляемость (в мг02/л), активная реакция pH, биохимическая (ВПК) или химическая (ХПК) потребность в кислороде (в мг02/л). В особых случаях могут представлять интерес определение содержания сульфатов и сульфидов (в мг/л). Дополнительными показателями служат влажность и зольность осадка (в %). Определение влажности осадка должно производиться не реже одного раза в месяц.[ . ]
К настоящему времени качество подземных вод характеризуется следующим образом. В четвертичном горизонте в промышленных зонах увеличилось содержание хлоридов, сульфатов, сухого остатка и нитратов, концентрация последних превышает 50 мг/дм3.[ . ]
Основными проблемами угольных бассейнов являются очистка кислых и минерализованных сточных вод уральских месторождений и сточных вод с повышенным содержанием хлоридов и сульфатов Подмосковного бассейна, ликвидация мелких котельных и рекультивация земель для месторождений Восточной Сибири — очистка шахтных вод и хозяйственно-бытовых вод, рекультивация земель, для месторождений Дальнего Востока — строительство очистных сооружений для шахтных и карьерных вод, содержащих трудноосаждаемую дисперсную взвесь, повышение эффективности действующих сооружений и рекультивация земель.[ . ]
По данным табл.21, необходимую точность дозирования + 10% можно получить при учете двух вариантов работы ионатора: при работе на водах, не требующих добавления сульфата натрия (о содержанием хлоридов менее 10 к оумые анионов), режим приготовления 20 л концентрата — 6 мин электролиза при 3 А;, при работе с добавлением сульфата натрия режим приготовления — 7 мин электролиза при силе тока 3,2-3,4 А.[ . ]
В зависимости от результатов качественного определения отбирают 100 см3 испытуемой воды или меньший ее объем (10—50 см3) и доводят до 100 см3 дистиллированной водой. Без разбавления определяются хлориды в концентрации до 100 мг/дм3. pH титруемой пробы должен быть в пределах 6—10. Если вода имеет цветность выше 30°, пробу обесцвечивают добавлением гидроокиси алюминия. Для этого к 200 см3 пробы добавляют 6 см3 суспензии гидроокиси алюминия, а смесь встряхивают до обесцвечивания жидкости. Затем пробу фильтруют через беззольный фильтр. Первые порции фильтрата отбрасывают. Отмеренный объем воды вносят в две конические колбы и прибавляют по 1 см3 раствора хромовокислого калия. Одну пробу титруют раствором азотнокислого серебра до появления слабого оранжевого оттенка, вторую пробу используют в качестве контрольной пробы. При значительном содержании хлоридов образуется осадок А СЛ, мешающий определению. В этом случае к оттитрованной первой пробе приливают 2—3 капли титрованного раствора ЫаС1 до исчезновения оранжевого оттенка, затем титруют вторую пробу, пользуясь первой, как контрольной пробой.[ . ]
Контроль качества вода в емкости сезонного регулированйя постоянно показывает повышенный уровень минерализации этих вод, который зачастую превышает нормативы на 20-40 % и обусловливается. избыточным содержанием хлорида натрия. Основным источником его в сточных водах является регенерационный раствор, который используется для промывки ионообменных фильтров котельной.[ . ]
Отмеченное незначительное снижение количества гемоглобина у подопытных животных на 4-м месяце опыта по сравнению с контролем является статистически недостоверным. Содержание хлоридов и резервной щелочности в крови, а также хлоридов в моче во все сроки исследования не изменялось.[ . ]
Многие представители самого обширного в семействе рода парнолистник, насчитывающего около 100 видов, являются галофитами. Они населяют солончаки главным образом Азии, Африки и Австралии. Этот кустарник обладает небольшими мясистыми листьями и развивает мощный стержневой корень, который проникает до влажных горизонтов почвы.[ . ]
Известно, что чрезмерная соленость почвы характерна для многих горнорудных районов всего мира. В Германской Демократической Республике это является главным образом результатом добычи меди, сланца, поташа, бурого угля, а также производства соды. Большие количества хлоридов и солей, повышающих жесткость воды, попадают в реки с небольшим или средним расходом, вода которых используется для промышленных целей многими крупными коммерческими предприятиями. Даже после поглощения этих солей рекой (в Эльбе, например, в районе Магдебурга, в течение последних 20 лет среднегодовое содержание хлоридов составляло 77—423 мг/л и 9,9—20,5° общей жесткости) вредные последствия все же остаются значительными, что может быть продемонстрировано на следующих примерах.[ . ]
Количественный ионометрический экспресс-метод определения нитратов состоит в извлечении нитратов из материала раствором алюмокалиевых квасцов и последующим измерением нитрат-иона в вытяжке ионоселективным электродом. Метод непригоден для исследования продуктов, в которых содержание хлоридов превышает содержание нитратов более чем в 50 раз. Этот метод может быть использован только для анализа сырья.[ . ]
Имеются сообщения о возникновении гастроэнтеритов небактериального происхождения в Эссене (ФРГ) в 1959 г., которыми страдало около 7% населения (К. Im-hoff, 1970). Причиной было то, что засушливое лето 1959 г. обусловило значительное снижение расхода воды в реке Руре. Это снизило способность реки к разбавлению сточных вод. Содержание хлоридов в воде возросло со 100 до 507 мг/л, нитратов — до 24 мг/л, детергентов — до 1,2 мг/л. Частота повторного использования воды реки составила 0,9, что превышает допустимый предел (Н. Koenig et al„ 1970).[ . ]
Известен и нашел частичное применение в зарубежной практике [68] и метод разбрызгивания ОБР на пахотные земли после предварительной его нейтрализации. Однако использование указанного метода ограничивается типом и системой обработки бурового раствора. Этот метод не приемлем для минерализованных буровых растворов, т е , растворов с высоким содержанием хлоридов и других токсичных солевых компонентов. Но отсутствие в литературе сведений о нейтрализующих агентах не позволяет дать объективную оценку возможностей метода, а также практической и экономической целесообразности его применения.[ . ]
Известны отравляющие вещества самого различного действия, однако, попадая в воду, они ведут себя в основном как общеядовитые. На зараженность воды отравляющими веществами могут указывать некоторые внешние признаки и данные обычных методов контроля, так как наличие ОВ вызывает изменение многих показателей воды, например pH, окисляемости, хлоро-поглощаемости, содержания хлоридов и растворенного кислорода, а также данные биологических и бактериологических исследований. Поэтому все эти показатели в условиях возможного отравления воды ОВ должны определяться и фиксироваться систематически.[ . ]
При солянокислотном травлении стали взаимодействие 20%-ной кислоты с оксидами железа приводит к образованию хлористого и хлорного железа. Выводимый на регенерацию ОТР содержит, %: 5-10 HG1, 17-25 FeCl2, 0,4-0,8 FeClj. В многоступенчатых установках с противотоком обрабатываемого металла и травильного раствора в последнем могут быть получены очень низкая концентрация кислоты и весьма высокое содержание хлоридов железа (до 340 г/л). Продуктами регенерации являются соляная кислота, возвращаемая в травильную ванну, и оксид железа.[ . ]
Основным видом загрязнений является рудная и известняковая пыль. При контакте воды со шламом происходит выщелачивание извести и других компонентов, в результате чего солевой состав сточных вод претерпевает значительные изменения. Исследования показали, что pH воды возрастает с 7,5 до 12-13, щелочность с 1,3-3,6 до 21-22 мг-экв/дм3 в том числе гидратная от нуля до 17 мг-экв/дм3. Возрастает также содержание хлоридов и сульфидов.[ . ]
Загрязнение подземных вод в значительных объемах происходит за счет фильтрата —токсичной жидкости, выделяющейся со свалок твердых бытовых отходов. Только в черте города в Москве по официальным данным насчитывается более 100 свалок, а «полуночных»—вообще никогда не подсчитывалось. Состав фильтрата примерно может быть следующим и почти близким для всех свалок: повышенная до 10— 20 г/л минерализация, высокие содержания хлоридов и сульфатов, множество органических кислот (гуминовая, молочная, уксусная, пи-ровиноградная и др.), так называемые «ураганные» концентрации тяжелых металлов (в том числе и наиболее токсичных, таких, как ртуть), медикаментозные, санитарно-больничные, бактериологические и гель-минтозные загрязнения. Известно, что в теле свалок идут активные процессы брожения и гниения, т. е. разложения органики, конечным продуктом которых являются вода, тёпло, биогаз (диокси!д углерода и метан). Нередки случаи самовозгорания биогаза с негативными экологическими последствиями, так как многие свалки насыщены синтетическими пластмассами, горение которых в низкотемпературном режиме приводит к образованию диоксинов, попадающих в атмосферу, в гидросферу, а далее в трофические сети экосистем.[ . ]
Процесс реализуется в противоточном режиме в реакторе скруб-берного типа при 400°С. Его продуктами являются газ (около 7% HCl, 40 — водяных паров, 0,8-1,0% 02) и оксид железа. Основная масса последнего оседает в растворе, выделяется из него и отгружается потребителю: Газ очищается от остатков Fe203, охлаждается и отправляется в абсорбционную колонну, орошаемую водой из промывочных ванн. Из нижней ее части выводится 16-20%-ная соляная кислота с небольшим, около 2%, содержанием хлоридов железа. Газ после абсорбционной колонны освобождается от остатков хлористого водорода и других примесей в скруббере, орошаемом раствором каустической соды (NaOH), и выбрасывается в дымовую трубу.[ . ]
Воду с сухим остатком до 1000 мг/л называют пресной, свыше 1000 мг/л — минерализованной. Вода, содержащая избыточное количество минеральных солей, непригодна для питья, т.к. имеет соленый или горько-соленый вкус, а ее употребление (в зависимости от состава солей) приводит к различным неблагополучным физиологическим отклонениям в организме. С другой стороны, слабоминерализованная вода с сухим остатком ниже 50-100 мг/л неприятна на вкус, длительное ее употребление может привести также к некоторым неблагоприятным физиологическим сдвигам в организме (уменьшение содержания хлоридов в тканях и др.). Такая вода, как правило, содержит мало фтора и других микроэлементов.[ . ]
Данные, касающиеся окислительно-воостановительного потенциала проб, получены только для весны 1976 г. Исследовали воды скважины 12В; значения окислительно-восстановительного потенциала там изменялись от +100 до +150 мВ (максимум + 170 мВ). Неожиданно наиболее низкие значения ( + 55 и + 65 мВ) были зарегистрированы в скважинах 10 и 4 -соответственно. Вода скважины 7 имела окислительно-восстановительный потенциал +105 мВ. В ручье наблюдалось увеличениеокис-лительно-востановительного потенциала от +90 мВ (измерено выше по течению) до +107 мВ (измерено ниже по течению). За исключением летних и осенних данных анализа рроб из скважины 6А, наблюдается общая тенденция к уменьшению содержания хлоридов с увеличением расстояния от очистной станции [6]. Воды скважины 3 и высачиваний ниже дороги характеризуются высоким содержанием хлоридов, отражая поступления солей с дороги, как отмечалось ранее. Во всех случаях происходило небольшое увеличение содержания хлоридов в ручье Вест Брук из-за высачиваний.[ . ]
источник