Основными задачами химического анализа подземных вод в практике гидрогеологических исследований являются:
- изучение закономерностей формирования и распространения подземных вод различного состава;
- оценка состава и свойств подземных вод для питьевого, технического, сельскохозяйственного, лечебного и других видов исследования;
- исследования подземных вод как критерии при поисках месторождений полезных ископаемых — нефти, газа, солей, различных руд;
- оценка подземных вод как химического сырья для получения йода, брома, бора и других элементов.
Существует четыре типа химических анализов подземных вод: полевой, сокращенный, полный и специальный.
Полевой анализ наиболее прост, он применяется для предварительной характеристики подземных вод района. Его проводят в полевых условиях в походных гидрохимических лабораториях, часто упрощенными методами. При полевом анализе определяют: физические свойства воды, ее pH, наличие Сl — , SO 2- 4 , NO — 3, HCO — 3, СО3 2- , общую жесткость, присутствие Са 2+ , Fe 2+ , Fe 3+ , NH + 4 , N0 — 2, С02своб; вычисляют: Na + + К + , карбонатную жесткость, Mg 2+ и общую минерализацию.
Сокращенный анализ . Этот анализ производят более точными методами в стационарных лабораториях. При сокращенном анализе определяют: физические свойства воды, величину pH, содержание ионов и компонентов (Сl — , SO 2- 4 — , NO — 3, HCO — 3, СО3 2- , Na + , К + , Ca 2+ , Mg 2+ , Fe 2+ , Fe 3+ , NH + 4 , N0 — 2, свободную и агрессивную углекислоту С02, Si02, окисляемость, сухой остаток, жесткость общую, карбонатную и некарбонатную.
Полный анализ применяется для подробной характеристики химического состава подземных вод. Он производится наиболее точными методами в стационарных лабораториях. Анализ позволяет произвести контроль определений как по сухому остатку, так и по суммам мг-экв катионов и анионов. При полном анализе определяют: физические свойства воды, ее pH, наличие Сl — , SO 2- 4 — , NO — 3, HCO — 3, СО3 2- , Na + , К + , Ca 2+ , Mg 2+ , Fe 2+ , Fe 3+ , NH + 4 , N0 — 2, С02 своб и C0 2arpec, Si 0 2, окисляемость, сухой остаток; вычисляют: жесткость общую, карбонатную и некарбонатную, С0 2агрес.
Специальный анализ. Помимо характеристик, определяемых при перечисленных выше типах анализа, этот анализ включает установление специальных показателей (микрокомпонентов, органических веществ, газов, Eh и др.) по особому заданию в соответствии с целевым назначением исследований. Количество отбираемой для анализа воды зависит от точности и чувствительности анализа и минерализации воды. Чем выше требования к чувствительности и точности анализа, тем больше должен быть объем пробы; пресные и слабо минерализованные воды отбирают в ббльших объемах, чем сильно минерализованные. При полевом анализе обычно бывает достаточно 0,5 л воды, при сокращенном — от 0,5 до 1,0 л (в зависимости от минерализации), а при полном — от 1,0 до 2,0 л. Для определения неустойчивых (изменяющихся во времени) компонентов — С02, H 2 S, 02, Fe и др. — применяют специальные методы отбора и хранения проб.
Результаты химического анализа воды выражают в массовых количествах веществ, растворенных в 1 л (или в 1 кг воды), в эквивалентных количествах или в процент-эквивалентных количествах (%-экв) воды. В гидрогеологической практике принято массовые количества компонентов выражать в миллиграммах на 1 л (мг/л), а эквивалентные количества ионов — в миллиграмм-эквивалентах (мг-экв) каждого иона в 1 л воды.
Величину сухого (плотного) остатка получают взвешиванием пробы после выпаривания воды. Сумму ионов определяют суммированием массы всех ионов, содержащихся в исследуемой воде. Сумма минеральных веществ — более полное выражение, чем сумма ионов, так как она учитывает и недиссоциированные неорганические вещества Si0 2 и Fe 2 03.
В настоящее время принята ионная форма выражения химических анализов воды. Данные лабораторных анализов подземных
вод, выраженные в мг/л, подвергаются дальнейшей обработке (табл.ниже).
источник
Основными задачами химического анализа подземных вод в практике гидрогеологических исследований являются:
- • изучение закономерностей формирования и распространения подземных вод различного состава;
- • оценка состава и свойств подземных вод для питьевого, технического, сельскохозяйственного, лечебного и других видов исследования;
- • исследования подземных вод как критерии при поисках месторождений полезных ископаемых — нефти, газа, солей, различных руд;
- • оценка подземных вод как химического сырья для получения йода, брома, бора и других элементов.
Существует четыре типа химических анализов подземных вод: полевой, сокращенный, полный и специальный.
Полевой анализ наиболее прост, он применяется для предварительной характеристики подземных вод района. Его проводят в полевых условиях в походных гидрохимических лабораториях, часто упрощенными методами. При полевом анализе определяют: физические свойства воды, ее pH, наличие СГ, S04 _ , NO3, HCOj, СО 2- , общую жесткость, присутствие Са 2+ , Fe 2+ , Fe 3+ , NH4, N02, С02своб; вычисляют: Na + + К + , карбонатную жесткость, Mg 2+ и общую минерализацию.
Сокращенный анализ. Этот анализ производят более точными методами в стационарных лабораториях. При сокращенном анализе определяют: физические свойства воды, величину pH, содержание ионов и компонентов (СГ, S04
Ca 2+ , Mg 2+ , Fe 2+ , Fe 3+ , NH4, N02, свободную и агрессивную углекислоту С02, Si02, окисляемость, сухой остаток, жесткость общую, карбонатную и некарбонатную.
Полный анализ применяется для подробной характеристики химического состава подземных вод. Он производится наиболее точными методами в стационарных лабораториях. Анализ позволяет произвести контроль определений как по сухому остатку, так и по суммам мг-экв катионов и анионов. При полном анализе определяют: физические свойства воды, ее pH, наличие СГ, SO4 — , NO3, HCOJ, СО3 2 -, Na + , К + , Са 2+ , Mg 2+ , Fe 2+ , Fe 3+ , NHj, NOJ, С02своб и C02 arpec, Si02, окисляемость, сухой остаток; вычисляют: жесткость общую, карбонатную и некарбонатную, С02 агрес.
Специальный анализ. Помимо характеристик, определяемых при перечисленных выше типах анализа, этот анализ включает установление специальных показателей (микрокомпонентов, органических веществ, газов, Eh и др.) по особому заданию в соответствии с целевым назначением исследований. Количество отбираемой для анализа воды зависит от точности и чувствительности анализа и минерализации воды. Чем выше требования к чувствительности и точности анализа, тем больше должен быть объем пробы; пресные и слабо минерализованные воды отбирают в больших объемах, чем сильно минерализованные. При полевом анализе обычно бывает достаточно 0,5 л воды, при сокращенном — от 0,5 до 1,0 л (в зависимости от минерализации), а при полном — от 1,0 до 2,0 л. Для определения неустойчивых (изменяющихся во времени) компонентов — С02, H2S, 02, Fe и др. — применяют специальные методы отбора и хранения проб.
Результаты химического анализа воды выражают в массовых количествах веществ, растворенных в 1 л (или в 1 кг воды), в эквивалентных количествах или в процент-эквивалентных количествах (%-экв) воды. В гидрогеологической практике принято массовые количества компонентов выражать в миллиграммах на 1 л (мг/л), а эквивалентные количества ионов — в миллиграмм-эквивалентах (мг-экв) каждого иона в 1 л воды.
Величину сухого (плотного) остатка получают взвешиванием пробы после выпаривания воды. Сумму ионов определяют суммированием массы всех ионов, содержащихся в исследуемой воде. Сумма минеральных веществ — более полное выражение, чем сумма ионов, так как она учитывает и недиссоциированные неорганические вещества Si02 и Fe23.
В настоящее время принята ионная форма выражения химических анализов воды. Данные лабораторных анализов подземных вод, выраженные в мг/л, подвергаются дальнейшей обработке (табл. 7.1).
Результаты химического анализа подземных вод
Разнообразие химического состава подземных вод вызывает необходимость в их систематизации. Существуют различные формы и множество способов наглядного изображения химического состава вод (графики, формулы, коэффициенты и т.п.).
Формула Курлова. Принцип этой формулы — изображение содержащихся в воде ионов в убывающем порядке в виде псев- додроби, в числителе которой записаны анионы, а в знаменателе — катионы. Слева от дроби формулы приводятся следующие показатели: SP — микроэлементы (Br, I, As) и свободные газы (С02 и др.), мг/л, а также общая минерализация воды М в г/л; справа — pH, температура воды t и дебит D [14, 21].
Ионы, содержание которых в воде менее 10%, в формуле не указываются, однако некоторые исследователи считают, что следует указывать все ионы, входящие в состав подземных вод. В общем виде формула Курлова имеет вид:
Например, паспорт воды знаменитого кисловодского нарзана по формуле Курлова будет иметь следующий вид:
Формула Курлова была предложена в 1928 г., а затем претерпела некоторые изменения. Наиболее рациональным представляется вариант этой формулы, предложенный И.Ю. Соколовым в 1970 г. Он заключается в следующем.
- 1. В левой части формулы записывают (в мг/л) содержание газов, а затем микрокомпонентов, если их количество превышает норму для отнесения подземных вод к минеральным или представляет геохимический интерес.
- 2. Далее указывают величину минерализации воды М в виде дроби: в числителе — в г/л, с точностью до одного десятичного знака, в знаменателе — в эквивалентной форме, выраженной в мг-экв/л суммы анионов.
- 3. В знаменателе псевдодроби записывают в нисходящем порядке все катионы, в числителе — анионы, содержание которых составляет более 1%-экв (с точностью до целых процентов).
- 4. После псевдодроби указывают показатели, характеризующие состояние воды (pH и Eh) и ее температуру, а также перманга- натную окисляемость (в мг О/л). Для сильно минерализованных вод и рассолов в конце формулы проставляют плотность воды.
Формула Курлова позволяет полно отразить все важнейшие химические характеристики исследуемой воды и при этом считать эквивалентное и массовое содержание найденных при анализе ионов. Наименование воды по ее ионному составу, т.е. чтение этой формулы, согласно ГОСТу 13273—73 на минеральные воды таково: сначала называют подчиненные ионы, потом — преобладающие. Так, название воды, записанное в виде приведенной выше формулы, следующее: сульфатно-гидрокарбонатная, кальциево-натриевая вода (в названии обычно учитывают два катиона и два аниона или ионы, содержание которых равно или превышает 25%-экв).
Жесткость. Для пресной воды различают общую, временную (или устранимую) и постоянную жесткость. Общая жесткость обусловлена суммарным содержанием в воде ионов Са 2+ и Mg 2+ . Временную (устранимую) жесткость придают воде карбонаты кальция и магния, осаждающиеся при кипячении воды в виде накипи вследствие разрушения гидрокарбонат-иона:
Разность между общей и временной жесткостью называют постоянной жесткостью, она связана с присутствием сульфатов и галоидов кальция и магния. В настоящее время в России принято выражать жесткость в мг-экв/л (1 мг-экв/л соответствует содержанию 20,04 мг/л Са 2+ или 12,16 мг/л Mg 2+ ).
Для графического изображения химического состава вод пользуются различными геометрическими фигурами (квадратом, треугольником и т.д.), на сторонах которых откладываются преобладающие шесть катионов и анионов, а также различными химическими формулами, например, формулой Курлова, которую часто называют паспортом подземных вод (рис. 7.2).
Рис. 7.2. Способы графического изображения химического состава воды [20, 21]:
I, II — графики-прямоугольники (соответственно без учета и с учетом минерализации); III — график-круг; IV, V — графики-треугольники (соответственно катионного и анионного состава); 7 — К + ; 2 — Na + ; 3 — Mg 2+ ; 4 — Са 2+ ; 5 — NOj; 6 — Cl — ;
К основным видам гидрогеохимической графики относятся гидрогеохимические карты, профили, колонки, разрезы, которые позволяют комплексно изучать гидрохимический режим подземных вод и выявлять определенные закономерности формирования химического состава подземных вод.
источник
Формула Курлова, название воды. Графические изображения химического состава подземных вод.
1. Пересчет результатов химических анализов.Для выяснения количественных соотношений между ионами данные химических анализов, выполненные химической лабораторией, должны быть представлены в миллиграмм-эквивалентной форме, т.к. ионы в растворе реагируют между собой в эквивалентных количествах.
Пересчет из ионной формы, выраженной в мг/л в моль-экв, осуществляется делением числа кг каждого иона на его эквивалентный вес (ионный вес, деленный на валентность) или умножением на пересчетный коэффициент. Наиболее просто находить моль-экв.. пользуясь пересчетной таблицей.
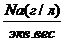
Na(мг/л)* К=Na моль- экв,.
где Кпересчетный коэффициент.
2.Пересчет результатов анализов. Пересчет результатов анализов заканчивается выражением его в процентах моль-эквивалентов. Для этого принимают каждую из вычисленных сумм мг/экв. катионов и анионов за 100% и по формулам

x = 
определяют процентное содержание каждого из катионов и анионов в отдельности. Все данные записывают в соответствующую ведомость химических анализов.
Ведомость химических анализов.
Содержание воды.
1. Вычисление видов жесткости. Жесткость воды обуславливается присутствием в воде ионов кальция,железа, алюминия, марганца, бария, стронция. Для вод , используемых в хозяйственных и технических целях, жесткость воды не учитывать нельзя. Жесткая вода требует больше мыла для получения пены, в ней медленнее развариваются овощи, мясо, образуется накипь на стенках труб и паровых котлов, что уменьшает теплоотдачу и требует большего потребления тепла. Различают жесткость воды общую, временную (устранимую, карбонатную) и постоянную (неустранимую, остаточную).
Общая жесткость определяется суммарным содержанием в воде иона Ca** и Mg**, так как содержание других элементов в воде ничтожно мало. Величина карбонатной жесткости соответствует количеству иона НСО 
Эта величина является расчетной и определяется по количеству ионов Са** Мg**, связанных с ионами НСО 



Временную жесткость определяют ионы Са** и Мg**, осаживающиеся при кипячении воды в виде карбонатов вследствие разрушения гидрокарбонат – иона.
Постоянную жесткость определяют ионы Са** и Мg**, остающиеся в воде после кипячения. Это есть разность между общей карбонатной жесткостью (в моль-экв).
Жесткость воды О.А.Алекин рекомендует следующее подразделение подземных вод по степени жесткости.
Классификация подземных вод по величине жесткости.
Для питьевых целей большей частью используются подземные воды с общей жесткостью до 7 моль-экв/л (около 20 нем. град.), но в некоторых местностях для питья потребляются и более жесткие воды.
2. Для наглядного изображения химического состава можно применять запись в виде формулы Курлова. Эта запись имеет структуру в виде дроби. В числителе в убывающем порядке (по абсолютному содержанию в % экв) записываются анионы, а в знаменателе в таком же порядке – катионы. Слева от дроби в кг/л становится газовый состав (СО 






[CO 





В наименование состава воды включаются анионы и катионы, содержание которых превышает 25%-экв, название включает и специфические элементы, а также газовый состав.
Основные ионы Курлов М.Г. предлагает назвать в убывающем порядке, причем, первыми называются анионы, а вторыми , в таком же порядке – катионы. В приведенном примере название состава воды, выраженной формулой Курлова, будет борная, углекислая, железистая, фтористая, хлоридно- сульфатная натриево-магниевое.
Как видно из указанного примера, основные ионы определяют химический состав воды, а газовый и специфические элементы – специфическое содержание. При составлении химического названия воды необходимо соблюдать элементарные правила русского языка, согласно которым основное прилагательное пишется полностью а прилагательное, указывающее на второстепенное свойство предмета, пишется сокращенно. Если в химическом составе воды преобладают анионы хлоридный и сульфатный, причем сульфатного больше, чем хлоридного, то воду следует называть хлоридно-сульфатной, а не сульфатно-хлоридной.
Приведем два примера. Химический состав вод изображен в виде формул Курлова, причем скобками второстепенные ионы отделены от главных.
Здесь мы имеем пресную, гидрокарбонатную магниево-кальциевую воду с повышенным содержанием сульфатов. По классификации О. А. Алекина, данная вода принадлежит к гидрокарбонатному классу, группе кальция и магния и второму типу (CII Ca , Mg 0.4).
Вода солоноватая, сульфатно-хлоридная магниево-натриевая.
Как установлено, ионная форма свойственна в полной мере лишь водам низкой минерализации. При увеличении концентрации растворенных солей между ионами усиливается взаимодействие, причем развивается процесс, обратный диссоциации, т. е. ассоциация. В растворе образуются ассоциированные пары: нейтральные ( СаSО4 0 , МgSО4 0 , СаСО3 0 ) или несущие заряд (Mg(HCO3)2 Са(НСО3)2 + ).Ввиду сложности химического состава природных растворов во многих случаях нельзя предугадать, какие соли в каком порядке будут выпадать из данного раствора, так как на ход кристаллизации влияет температура и другие факторы. Поэтому наши пересчеты из ионной в солевую форму принято называть гипотетическими. При оценке питьевых, лечебных, технических и других качеств воды полезно принимать во внимание не только абсолютное содержание отдельных ионов, но
и предполагаемые ассоциации анионов с катионами (соли). Изображение химического состава вод в виде солей следует рассматривать как очень удобную рабочую гипотезу, позволяющую лучше разобраться в химических свойствах и происхождении природных вод.Пересчет из ионной формы в солевую производится в соответствии с растворимостью солей. В первую очередь комбинируются малорастворимые, а затем все более и более растворимые.
Простейшим для изображения единичных анализов является график-прямоугольник химического состава воды. График строится в виде двух прямоугольников, на одном из которых в масштабе нанесены %-эквиваленты анионов, на другом %-эквивалента катионов в последовательности, определяемой правилом Фрезениуса, т.е. в порядке их химической активности: К*, Na*, Mg**, Fe, Mg, H, NO , Cl, Br, I, SO, НCO, CO, OH. .
Графически изображать единичные анализы можно также с помощью круглой диаграммой Н.И.Толстихина.
Горизонтальной линией круг делится на две части. В верхней части по секторам откладываются в масштабе катионы слева направо в обратном порядке , чем на прямоугольной диаграмме, а в нижней — в таком же порядке анионы. Диаметр круга в масштабе отвечает минерализации воды, точно также и ширина прямоугольной диаграммы в масштабе соответствует величине минерализации воды.
Классификация Алекина О.А. сочетает принцип преобладающего иона и соотношение между ионами. За основу взято шесть главных иона (3 катиона, 3 аниона), содержание которых выражено в моль- эквивалентах:
По преобладающему аниону воды подразделяются на три класса: гидрокарбонатные и карбонатные (НСО 

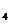
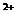
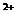


Каждая группа по соотношению между ионами подразделяются на три типа. Всего выделено четыре типа:
I) НСО 

II) НСО
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Да какие ж вы математики, если запаролиться нормально не можете. 8164 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Тел: +7 (495) 728-94-19
Тел: +7 (963) 659-59-00
Москва, Олонецкий пр. д. 4/2
выполняем работы по г. Москве
и всей Московской области
Геология
Грунтовая лаборатория
Грунтовая лаборатория
Оснащенность лаборатории
Область аккредитации
Типы исследуемых грунтов
песчаные грунты
глины, суглинки, супеси
заторфованные грунты
техногенные грунты
Механические свойства грунтов
испытания грунтов на срез
компрессионные испытания
трехосное сжатие
свободное набухание
Физические свойства грунтов
гранулометрический состав
природная влажность
показатель текучести
предел пластичности
пористость, коэфф. пористости
определение плотности грунта
Химический анализ
химанализ водной вытяжки
коррозийная агрессивность
Библиотека
ООО «Буровики»:
Контакты
Рекомендательные письма
Допуски и Лицензии
Цены и сроки, прайс лист
Написать письмо
1 400 рублей за метр. Подробнее
Почему стоит заказать именно у нас
Грунтовые воды относятся к разновидностям подземных вод, которые залегают на водоупоре, расположенном ближе к поверхности. На территориях с влажным климатом происходит развитие интенсивных процессов инфильтрации, а также подземного стока, что приводит к выщелачиванию грунтов и горных пород. В некоторых случаях происходит излишнее их испарение, что приводит к засолению почвы. Поэтому стандартный анализ грунтовой воды, когда выполняются инженерно-геологические изыскания для проектирования зданий (сооружений), считается обязательным.
Стандартный анализ грунтовой воды выполняется в условиях лаборатории для получения показателей минерализации образца, его жесткости, агрессивности по отношению к различным материалам строительства (в первую очередь к стали, бетону и алюминиевым оболочкам кабелей), электропроводность и т.д. Минерализацией следует считать сумму всех минеральных веществ, которые растворены в грунтовой воде. Данный показатель получается методом выпаривания исследуемого образца. Следует различать такие степени минерализации грунтовых вод:
Жёсткость грунтовой воды определяется исходя из наличия ионов кальция и магния. Эти химические показатели важны при бурении скважин для поиска пресной воды населению. Также под застройку домов (коттеджей, сооружений) геология участка исследуется на показатель чистоты и безопасности для проживания в данной местности. А, как известно грунтовые воды являются главными показателями чистоты грунта.
Проводя инженерные изыскания на отводимом участке (площадке) важно учитывать фактор агрессивности грунтовых вод. Грунтовые воды могут оказывать разрушающий эффект для бетона и других строительных материалов. Для этого в условиях лаборатории стандартный анализ грунтовой воды выполняется также для получения показателя агрессивности. Агрессивность грунтовых вод бывает таких типов:
- выщелачивающая;
- общекислотная;
- сульфатная;
- магнезиальная;
- углекислотная
СП 11-105-97 Часть I. Общие правила производства работ Приложение Н (обязательное)
Показатели химического состава подземных и поверхностных вод
и методы их лабораторных определений при инженерно-геологических изысканиях
Показатели химического состава воды
Коррозионная активность воды к оболочкам кабелей
Метод испытания или обозначение государственного
стандарта на методы определения
температура в момент взятия пробы, °С
вкус и привкус при температуре 20 °С
Примечание — При проведении комплексных изысканий состав определяемых компонентов следует устанавливать с учетом требований СП 11-102-97
Результаты анализа грунтовой воды позволяет определить уровень ее рН. Если он пребывает ниже уровня нейтрального значения, которое составляет 7 единиц, то вода является кислотной. В таком случае она может разрушать бетон, вне зависимости от того, какого типа портландцемент использован в нем. Степень разрушения также зависит от вида и концентрации кислоты, возможности непрерывного обновления кислоты, скорости течения и давление грунтовой воды на бетон, расхода цемента, непроницаемости бетона и типа заполнителя.
Сама по себе величина рН является определяющим фактором вида или концентрации присутствующей кислоты, ведь это всего лишь мера степени кислотности. В качестве предварительных данных измерения рН очень полезны и позволяют получить представление о наличии или отсутствии кислот. Однако в большинстве случаев необходимым является проведение химического анализа, при котором определяется характер и концентрация кислоты. Как правило, кислотность естественных грунтовых вод, которые имеют низкий рН, вызвана органическими кислотами и растворенной углекислотой, а также, в отдельных случаях, сернистой и серной кислотой, которая поступает из соединений серы в торфяных грунтах. По мере увеличения интенсивности агрессивного воздействия можно повышать качество бетона, например, увеличивать расход цемента с более низким водоцементным отношением.
В зависимости от типа агрессивности грунтовых вод проектировщик принимает решения по выбору материала для строительства строения, а также глубины фундамента.
Анализ грунтовой воды необходим для получения детальной информации об участке исследований. Зная особенности данной жидкости можно своевременно предотвратить неприятные последствия: разрушение, усадка фундамента, трещины на здании, сезонное подтопление и т.д. Для этого проектировщики на первоначальных стадиях проектирования объекта планируют защитные мероприятия (дренажную систему), а также по возможности выбирают более подходящий для данной среды тип фундамента. Для зданий, не имеющих подвальных помещений и при высоком уровне грунтовых вод достаточно просто изолировать стены строения от влаги (не дать возможности поднятию уровня грунтовых вод по стенам). В некоторых случаях выполняют гидроизоляцию фундамента. В любом случае, необходимо учитывать тот факт, что грунтовые воды неблагоприятно влияют на строение в разные времена года (особенно зимой и во время таяния) и заранее принимать меры по их устранению.
источник
Грунтовые воды залегают на первом от земной поверхности водоупорном слое. Они представляют собой разновидность подземных вод.
В регионах, где наблюдается климат с повышенной влажностью, процессы инфильтрации (впитывания) протекают более оживленно, вследствие чего уменьшается содержание минералов и солей в почвах и горных породах. Иногда присутствует обратный процесс: чрезмерное испарение влаги, содержащейся в грунтах, это приводит к повышению в них концентрации солей.
Стандартное исследование грунтовой воды – обязательная процедура при совершении инженерно-геологических исследований участка, который планируется под застройку. Выполнение стандартного анализа вод этого типа совершается в лабораторных условиях, так как для определения степени жесткости образца, его минерализации, способности оказывать разрушающее действие на стройматериалы необходимо специальное оборудование.
Минерализация воды – количественный показатель, указывающий концентрацию солей в жидкости. Для определения этого параметра вода выпаривается, затем проводится анализ образовавшихся в результате твердых веществ.
- Пресная – соли отсутствуют; Слабоминерализованная: на литр воды приходится 1-2 г солей; Малая: содержание солей колеблется в пределах 2-5 г/л; Среднеминерализованная, концентрация минеральных веществ составляет 5-15 г/л; Высокоминерализованная (15-30 мг/л); Рассол (30-150 мг солей на литр воды); Крепкий рассол (в литре жидкости содержится 150 г солей и больше).
Жесткость грунтовых вод – важный показатель, если речь идет о создании скважины для добычи питьевой воды. Определяется параметр содержанием ионов магния и кальция. Степень чистоты грунтовой воды, отсутствие в ней вредных веществ – эти свойства свидетельствуют и об отсутствии загрязнений грунта, что особенно важно при строительстве жилых объектов.
Показатель агрессивности, способности разрушать стройматериалы, также важен, он обязательно исследуется при совершении инженерных изысканий на стройплощадке. Под действием химических веществ, содержащихся в грунтовых водах, бетон и другие строительные материалы могут утратить свою прочность. Поэтому стандартный анализ грунтовой воды обязательно включает в себя определение агрессивности среды. Она бывает следующих видов:
- Углекислотная; Общекислотная; Магнезиальная; Сульфатная; Выщелачивающая.
При исследовании грунтовой воды определяют показатель кислотно-щелочного баланса. Он измеряется в единицах, нейтральное значение равно 7. Если параметр рН меньше этой цифры, значит вода кислотная: она оказывает разрушающее действие на бетон. При этом не важно, какой именно портландцемент входит в бетонную смесь.
Насколько сильным будет разрушающее действие такой воды, зависит от содержания в ней кислоты, ее способности к регенерации, скорости восстановительных процессов и давления, оказываемого грунтовой водой на бетон. Имеет значение и состав бетона: содержание в нем цемента, используемый наполнитель.
Показатель рН указывает на присутствие кислоты и ее концентрацию. Этот параметр становится известным после проведения предварительного исследования грунтовых вод. Для установления, какое именно вещество входит в состав жидкости, и с целью узнать его концентрацию проводится химический анализ.
При низком показателе рН можно утверждать, что в воде присутствуют органические кислоты и растворенная углекислота. Иногда в грунтовые воды попадают соединения серной и сернистой кислот, содержащихся в торфяных почвах. При наличии значительного агрессивного влияния грунтовых вод следует позаботиться об улучшении качества бетона: повысить содержание цемента, снизить количество воды в смеси.
Приступать к выбору строительных материалов и проектированию фундамента следует после определения качественных и количественных показателей грунтовых вод. Имея результаты этих исследований, можно избежать многих неприятностей:
- Усадки и разрушения фундамента; Появления в здании трещин; Сезонных затоплений грунтовыми водами; Иных негативных факторов.
Знание о возможных проблемах позволяет еще на начальном этапе работы над проектом объекта создать систему защиты (дренаж), подобрать оптимально подходящий для имеющихся условий фундамент. Если не планируется строительство подвального этажа, можно обойтись оборудованием качественной изоляции от влаги, которая будет препятствовать увлажнению стен. Иногда необходима гидроизоляция фундамента.
источник
Любой человек, который учился в школе, с легкостью ответит вам на вопрос о том, на сколько процентов человек состоит из воды. И показатель этот составляет 80%. Питьевая вода является очень важным источником здоровья и хорошего повседневного самочувствия, потому ее качество является более чем важным для человека.
Методы очистки сточных вод.
По этим причинам имеет огромное значение то, какая химия содержится в воде, которую каждый день потребляет человек. То же самое касается и грунтовых вод, добываемых из загородных участков. При желании или необходимости существует возможность произвести лабораторный химический анализ питьевой воды.
Только в случае, если анализ грунтовых вод был произведен в специализированной профессиональной лаборатории, он может иметь наиболее точную степень результатов, которые не подлежат сомнениям. Лаборатория должна быть хорошо оснащенной и обязана использовать современные методы по определению качества воды.
Структурные схемы очистки сточных вод от нефтепродуктов.
Перед тем как сдавать воду для выполнения необходимого анализа в конкретную лабораторию, необходимо узнать, какой репутацией обладает эта лаборатория, и изучить ценовой вопрос. Стоит собрать как можно более подробную информацию об отзывах о качестве работы лаборатории.
Одним из признаков уровня работы лаборатории является предоставление не только информации о составе грунтовых вод, но и о том, какими физическими и химическими свойствами она обладает, о том, какую микрофлору она содержит, об уровне концентрации ионов водорода (уровень рН).
В результате профессиональная лаборатория должна снабдить точной и верной информацией о том, каким наилучшим образом можно эту воду использовать.
Схема получения анализа воды.
Довольно часто грунтовые источники, питающие колодцы, располагаются недостаточно глубоко и больше всех подвергаются различным видам загрязнений, которые возникают в итоге технологического развития человечества.
Такими загрязнениями чаще всего являются отходы с предприятий, работающих с химическими веществами и химические загрязнители, попадающие в состав грунтовых вод, расположенных в верхних слоях грунта после использования на угодьях сельского хозяйства. В конечном итоге все это может оказаться в колодцах.
Для наиболее верного подбора системы очищения воды, взятой из колодца, нужно учесть и то, что состав биологических и химических элементов может быть разным, в зависимости от конкретного сезона. Чтобы учесть этот фактор, анализ воды из колодца необходимо будет произвести два раза за год (осень и весна, к примеру).
Во время выполнения первых двух исследований воды из колодца стоит выполнить эту процедуру по наиболее возможному количеству элементов, загрязняющих источники. Произвести эти исследования необходимо в профессиональной лаборатории.
После этого можно приступать к процессу выбора очищающей системы, с оглядкой на результаты исследований. Дальнейший анализ можно выполнять периодически. С этой целью можно купить специализированные наборы, с помощью которых можно выполнять исследование уровня чистоты грунтовых вод, следуя обнаруженным признакам загрязнения.
Чтобы собрать необходимое количество воды для того, чтобы можно было выполнить нужные исследования, можно использовать стеклянную бутылку 0,5 л, которую нужно обязательно промыть с помощью проточной воды.
Во время процесса промывания бутылки запрещено использовать любые очищающие средства, дабы не загрязнить ими набираемую воду. Наполняться бутылка должна таким образом, чтобы внутри не осталось никакого воздуха. После набирания воды бутылку можно хранить не больше 24 часов, поскольку в ином случае она утратит прежние свойства и окажется неподходящей для выполнения исследований.
Для наиболее верного выбора систем, выполняющих функции извлечения грунтовых вод из скважины и ее очищения вы будете вынуждены провести исследования состава воды, содержащейся в скважине. Особенно если скважина является единственным способом снабжать водой ваш дом или хозяйство.
Состав воды, находящейся в скважине, может иметь достаточно заметные отличия от состава воды из колодца. Наблюдать это можно по той причине, что в воде из скважины могут встречаться загрязняющие вещества, которые встречаются в глубинных слоях грунта чаще, чем на поверхности. Это могут быть: кадмий, алюминий, марганец, мышьяк.
Загрязнение подземных вод.
Проводить исследования состава воды из скважины можно во время любого сезона в течение года. Нужно лишь правильно приготовить емкость для забора воды, выполнить забор необходимого количества воды и отнести образец на анализ в течение 24 часов с момента забора.
В течение процесса лабораторных исследований обычно определяются следующие параметры:
- степень прозрачности воды и содержание в ее составе механических элементов в процентах;
- уровень минерализации;
- свойства воды, касающиеся процессов окисления;
- степень содержания в составе воды угрожающих жизни и здоровью веществ и просто вредных примесей;
- уровень рН.
Выполнение лабораторных исследований на должном профессиональном уровне окажет отличную помощь в том, чтобы узнать, как можно использовать воду и можно ли ее использовать. Кроме того, результаты анализа помогут наиболее удачно подобрать подходящую систему для фильтрования воды.
К таким водам на участке загородного дома, как правило, причисляют атмосферные осадки, которые обычно собирают в некоторые емкости, обладающие хорошей вместительностью. Затем эти воды могут быть использованы с целью полива всяческих грядок и огородов. В наше время окружающая среда в некоторых районах подвергается техногенным воздействиям настолько сильно, что даже атмосферные осадки могут иметь достаточно высокий уровень загрязнения.
Традиционная схема очистки сточных вод.
По этой причине по таким водам тоже должен быть произведен анализ на предмет различных загрязняющих веществ. Если этого не сделать, то существует опасность использования загрязненной воды для полива растущих на огороде овощей, после чего свинец, соли тяжелых металлов и многие другие разновидности химических загрязнителей могут попасть к вам на стол вместе с овощами, впитавшими в себя эти токсины вместе с водой.
Исследования сточных вод вполне успешно выполняются в обычных СЭС-лабораториях. После завершения анализа делается вывод о том, пригодна ли вода к использованию, или ее нужно предварительно очищать перед применением. Пробу воды можно делать таким же способом, как это делается при заборе воды из колодца.
Бывает такое, что требуются лишь только исследования микробиологического состава воды, которая используется. Данное действие тоже выполняется только в профессиональной лаборатории. В основном данное исследование отличается только методом собирания образца для анализа.
С целью забора образцов и сохранения их в надлежащем состоянии до самого момента начала исследования обычно пользуются специальными герметичными пакетами, которые можно купить в лабораториях СЭС.
Можно сделать следующий вывод: во многих районах экологическая ситуация оставляет желать лучшего или ухудшается. Данные процессы, несомненно, влияют на качество грунтовых вод. По этой причине перед началом использования колодца или скважины нужно обязательно провести исследования воды, содержащейся в источнике. И поставить фильтрующую систему, если в ней есть необходимость.
Далее можно периодически выполнять профилактическую проверку качества питьевой воды из грунтовых вод. Что касается сточных вод, то проверка тоже нужна, особенно если поблизости находятся крупные предприятия, выбрасывающие большое количество загрязнителей через трубы в атмосферу.
источник
Химический, микробиологический анализы воды из скважин, и центрального водоснабжения, с примером допустимых показателей
Вода – это источник энергии и жизни человека, поэтому на всех этапах строительства, начиная с изысканий, обязательно проводят анализ воды из скважин, колодцев и водоемов, находящихся непосредственно на территории объекта. Состав воды подвержен постоянному воздействию внешних факторов, ведь не исключено, что ранее около водоема, скважины или колодца располагались промышленные предприятия, захоронения тяжелых металлов или несанкционированная свалка отходов. Определить годность воды к использованию в бытовых условиях может своевременный анализ воды.
Исследования помогают установить химический состав и свойства воды и выявить концентрацию всех вредных примесей. Это необходимо для обеспечения любого объекта строительства качественной питьевой водой, а также для расчетов и выбора подходящего очистительного и распределительного оборудования. От состава и свойств воды зависит расчетный срок службы прокладываемых коммуникаций и здоровье людей, использующих ее для питьевых или бытовых нужд. Именно по этой причине одним из основных этапов геоизысканий является обязательное проведение различных анализов воды из скважины, которое назначается застройщиками любых объектов, в том числе и промышленных.

При этом стоит учесть, что подобные лабораторные исследования рекомендуется проводить систематически, так как химический состав воды подвержен изменениям под действием внешней среды.
Выделяют 3 основных вида показателей:
- Физические показатели, которые позволяют оценить основные свойства воды, а именно ее вкус, цвет, мутность, температурные данные, запах и информацию о взвешенных частицах в составе.
- Химические показатели. Они позволяют охарактеризовать состав воды за счет оценки концентрации основных ионов. Также в процессе исследования определяют основные показатели жесткости, уровень pH, число общей минерализации и содержание отдельных ионов, отвечающих за качество воды, фтора, железа, калия и т. д. Стоит отметить, что избыток железа влияет на цвет воды и вызывает образование осадка в трубах, который может негативно влиять на сантехническое оборудование и трубы. В то время как избыток меди влияет на вкусовые качества.
- Бактериологические показатели также отвечают за качество воды и позволяют своевременно определить заражение различными микроорганизмами. Чаще всего бактерии попадают в жидкость под воздействием внешних факторов и человеческой жизнедеятельности. Например, заражение может произойти при попадании сточных вод, при контакте воды с животными и при загрязнении различными промышленными отходами.
Показатели качества воды определяются:
- химическим анализом;
- органолептическим исследованием, в результате которого определяется жесткость и наличие железа;
- токсическим анализом, направленным на определение наличия опасных веществ;
- микробиологическим исследованием, позволяющим определить содержание бактерий в скважине, водоеме или колодце.
Результаты проверки указывают на количество определенных веществ в разных единицах измерения. При знании норм можно самостоятельно оценить основные показатели. Если все в норме, то жидкость можно считать чистой и пригодной к использованию. В противном случае нужно проводить дополнительную фильтрацию. Обычно в результатах указывают предельно допустимую концентрацию (ПДК) примесей. Этот показатель говорит, что количество определенного вещества не несет негативного воздействия. ПДК прописываются в нормативных документах.
Исследование производят для установления точного химического состава воды, а также для оценки основных свойств. Характер исследования может отличаться в зависимости от поставленных задач. Химический анализ воды подразделяют на общий и специальный. Во время общего анализа воды определяется ее общая характеристика, необходимая для ее классификации, а также для получения информации о содержании отдельных солей и ионов. Данные результаты имеют широкое назначение.
Согласно СанПиН 2.1.4.559-96, на сегодняшний день в результате исследования воды обязательно устанавливают концентрацию ионов кальция, магния, натрия, которые наряду с другими составляют основу шестикомпонентного анализа, также позволяющего определить содержание железа и уровень pH. Исследование не включает в себя определение газового состава.
Краткое описание основных исследуемых в процессе химического анализа показателей:
- Водородный коэффициент (pH) зависит от концентрации ионов.
- Жесткость воды определяют исходя из концентрации в ней солей кальция и магния.
- Щелочность базируется содержанием гидроксидов, анионов слабых кислот, бикарбонатов и карбонатов.
- Хлориды связаны с присутствием в жидкости обычной соли. При наличии с хлоридами азотсодержащих веществ есть угроза загрязнения централизованного водоснабжения бытовыми отходами.
- Сульфаты могут вызывать проблемы пищеварительной системы.
- Элементы, содержащие азот, показывают присутствие в жидкости животной органики. К ним относится аммиак, нитриты, нитраты.
- Фтор и йод. Оба вещества несут негативные последствия как при избытке, так и при дефиците. Первое вещество может вызвать рахит, заболевания зубов и крови. Второе – проблемы щитовидной железы.
- Железо в составе воды может находиться в растворенном, не растворенном, коллоидном состоянии, а также в виде органических примесей и бактерий.
- Марганец вместе с железом оставляют желтые потеки труб, аналогичные следы остаются и на чистом белье, а также вызывают характерный привкус. Это пагубно действует на печень.
- Сероводород можно встретить в подземных водах, проводя анализ колодезной воды. Вещество относится к ядам, серьезно влияющим на здоровье людей. В воде, используемой для бытовых и питьевых нужд, присутствие сероводорода крайне опасно и запрещено.
- Хлор – наиболее распространенное средство санитарной обработки водопроводной воды. Вещество оказывает пагубное воздействие на организм и является одной из причин генетических мутаций, тяжелых отравлений, онкологических болезней. Однако в воде часто наблюдается остаточный хлор, используемый для ее обеззараживания, в безопасной концентрации.
- Натрий и калий – следствие растворения коренных пород.
Среди специальных анализов подземных вод важное место занимают:
- Санитарный, направленный на определения уровня жесткости и кислотности, содержания солей и ионов NH4, NO2, NO3. Анализ выявляют в целях определения пригодности воды для питья и бытового использования и уровня ее загрязненности.
- Бальнеологический анализ – кроме главных ионов, позволяет выявить уровень газовых компонентов, радиоактивность, число сульфатов, железо, мышьяк, литий и ряд иных показателей качества. Он считается наиболее полным и применяется для нормирования целебных источников минеральной воды, установленных требованиям ГОСТ Р 54316-2011, расположенных , например, в Карловых Варах, Ессентуках, Железноводске, Трускавце.
- Технический анализ производят для того, чтобы оценить коррозионные и агрессивные свойства воды, а также определить ее пригодность для использования в нефтедобыче, для питания паровых котельных установок или в иной технической сфере.
- Поисковый анализ питьевой воды используют наряду с техническим анализом для поиска агрессивных примесей и оценки способов ее дальнейшего использования.
Анализы воды из скважины проводят как в стационарных лабораторных условиях, так и с использованием полевых лабораторных установок непосредственно на объекте строительства. В полевых условиях часто используют исследовательские лаборатории и передвижные конструкции для анализа, разработанные учеными А. А. Резниковым (ПЛАВ), И. Ю. Соколовой и другими. Данный вид оборудования обычно состоит из упакованных смонтированных комплектов оборудования, посуды и реактивов, которые предназначены для исследований объемным, колориметрическим и нефелометрическим методами.
Химическая экспертиза воды имеет широкий спектр действия и применяется для:
- анализа питьевой воды;
- определения чистоты промышленных источников;
- подбора фильтров на производстве.
Для точности результатов рекомендуют соблюдать следующие требования:
- Емкость для пробы воды на анализ должна быть стерильной. Объем тары – 500 гр. Простерилизовать посуду может лаборатория, проводящая исследование, но процедуру несложно провести и дома. Для этой цели пробирку необходимо простерилизовать кипятком или паром. Также можно подержать емкость 10-15 мин в духовке или над открытым огнем.
- Перед забором нужно продезинфицировать кран открытым пламенем и обтереть спиртом. После этих манипуляций нужно спустить воду на полной мощности в течение 5-7 мин. Запрещается притрагиваться к крышке и горловине тары.
- Жидкость необходимо оградить от тепла и прямых солнечных лучей, так как такое воздействие способно нарушить качество, и результаты будут недостоверными. Лучше во время перевозки поместить пробирку в холодное место.
- Образец нужно передать в лабораторию и приступить к определениям максимум через 3 часа после забора.
К образцу прилагают документацию, содержащую информацию о виде источника (колодец, скважина, природный водоем и т. д.), место пробы, правильную дату и время забора, а также точный юридический адрес источника.
Изображение результатов химического анализа
Качество воды из скважины и ее состав можно определить несколькими методиками. Каждая из них устанавливает определенный показатель. Химический состав воды из скважины, водоема или колодца обычно изображают в ионной, процент-эквивалентной или эквивалентной форме. Ионная форма позволяет выразить химический состав питьевой воды в виде отдельных ионов, содержащихся в ней. Они выражаются в миллиграммах (мг) или же в граммах (гр), изредка данные могут быть предоставлены как отношение к массе и объему исследуемой жидкости.

Сегодня все сертифицированные лаборатории, куда доставляются пробы, предоставляют результаты гидрохимических исследований в ионной форме, которая является основным изображением состава воды. Ионная форма считается основной и используется для дальнейших переходов. Если надо выполнить перевод результатов, изображенных в виде отношения к единице объема, к составу, отнесенному к единице массы, количество отдельных ионов нужно поделить на плотность, а в случае обратного перехода — помножить.
Эквивалентная форма изображения результатов и получила значительное распространение. Она дает развернутое представление о свойствах воды, позволяет определить содержание ионов и установить происхождение вод. Форма используется в аналитических целях и позволяет контролировать результаты.

Эквивалент иона представляет собой частное от деления ионной массы на валентность иона. В качестве примера можно рассмотреть содержание иона натрия в эквивалентном виде иона: Na+ = 23/1, а эквивалент иона С = 35,5/1, из этого следует вывод, что на 23 единицы массы иона Na+ приходится 35,5 единицы иона, выраженных в эквивалентах. Исходя из этого, нужно отметить, что для перехода от ионной формы к эквивалентному изображению результатов нужно разделить количество иона, выраженное в миллиграммах (мг) или граммах (гр), на величину эквивалента иона.

Процент-эквивалентная форма позволяет более наглядно показать ионно-солевой состав, соотношение между ионами, а также определяет черты сходства вод с различной величиной минерализации, что делает данную форму наиболее распространенной. Но изображение содержания солей в составе исследуемых жидкостей только в одной из вышеперечисленных форм не дает возможности установить абсолютное содержание ионов в воде. По этой причине желательно предоставить результаты исследований, изобразив их в эквивалентной и ионной формах.
источник




