Химический анализ подземных вод может служить качественным показателем использования воды для хозяйственно-питьевого водоснабжения, бальнеологических, промышленных и хозяйственных целей, а также диагностическим признаком при гидрохимических методах поисков и разведки месторождений полезных ископаемых.
Результаты химического анализа подземных вод могут быть выражены в табличной или сокращенной отчетной форме в виде формулы Курлова.
1). Табличная форма выражения химического анализа.
Количественно концентрация катионов и анионов выражается в г/дм 3 , мг/дм 3 , а эквивалентное содержание – миллимолях (ммоль) и процентах (%).
Пример расчета химического анализа воды в табличной форме приводится ниже.
| Ионы | Содержание, мг/дм 3 | Эквивалентное содержание | |
| ммоль | % | ||
| Na + Ca 2+ Mg 2+ | 88,04 22,75 15,62 | 69,9 17,6 12,5 | |
| Сумма катионов | — | 126,41 | |
| Cl — SO4 2 — HCO3 — | 98,40 17,43 3,51 | 82,5 14,5 3,0 | |
| Сумма анионов | — | 119,34 | |
| М (сухой остаток) | — | — | |
| СО2(свободный) | — | — | |
| рН водородный показатель | 5,3 | — | — |
| Т воды, градус С | — | — |
Эквивалентное (молярное) содержание определяется путем умножения каждого иона на пересчетный коэффициент, учитывающий его атомный вес и валентность и представляющий собой величины, обратные эквивалентным массам ионов (таблица 2).
| Катионы | Коэффициент | Анионы | Коэффициент |
| Na + Ca 2+ Mg 2+ | 0,0435 0,0499 0,08222 | Cl — SO4 2- HCO3 — | 0,0282 0,0208 0,0164 |
Для пересчета в %-эквивалентную форму суммы катионов и анионов в миллимолях принимаются за 100%, а затем определяется доля каждого катиона и аниона в % от соответствующей суммы катионов и анионов.
Химический анализ считается достоверным, если ошибка анализа не превышает 5%.
В нашем случае С = 2,88%. Анализ достоверен.
2) Сокращенная форма выражения химического анализа (формула М.Г. Курлова)
Формула Курлова представляет собой псевдодробь, в числителе которой в порядке убывания в %-эквивалентной форме располагаются анионы, а в знаменателе – катионы. Ионы, содержание которых менее 1%, в формулу не включаются. Проценты округляют до целых чисел.
Слева от дроби указывается содержание газов в мг/дм 3 и минерализация (М) в г/дм 3 , за которую принимается сухой остаток. Справа записывают значение (рН), температуру воды (Т) в градусах Цельсия, дебит источника в м 3 /сут и содержание микроэлементов, если такие имеются.
В нашем случае формула Курлова (таблица 1):
3) Наименование воды по химическому составу.
Наименование химического типа подземных вод должно состоять из двух частей, отражающих преобладающий анионный и катионный состав воды. Наименование химического типа воды начинается с ее анионного, а затем катионного состава в %-эквивалентной форме, превышающего 20% от суммы миллимолярной концентрации. Перечисление ионов производится в порядке возрастания концентрации – от меньшего значения к большему.
В сокращенном анализе анионы представлены хлоридами, сульфатами и гидрокарбонатами, а катионы – натрием, кальцием и магнием. В нашем случае вода хлоридно-натриевая.
4) Классификация воды по минерализации.
В зависимости от величины минерализации, за которую принимается сухой остаток, подземные воды классифицируются в соответствии с приведенной таблицей 3.
| Минерализация М, г/дм 3 | Подгруппа | Группа |
| £ 0,5 >0,5-1,0 | Весьма пресные Пресные | Пресные |
| >1,0-1,5 >1,5-3,0 >3,0-5,0 >5,0-10,0 >10,0-25,0 | Весьма слабосолоноватые Слабо солоноватые Умеренно солоноватые Солоноватые Сильно солоноватые | Солоноватые |
| >25,0-36,0 >36,0-50,0 | Слабосоленые Сильносоленые | Соленые |
| >50,0-150,0 >150,0-350,0 >350,0 | Рассолы слабые Рассолы крепкие Рассолы весьма крепкие (рапа) | Рассолы |
В нашем случае М = 6,9 г/дм 3 . Вода солоноватая.
Реакция воды обусловлена величиной концентрации водородных ионов рН, которая представляет собой обратный логарифм концентрации ионов водорода. Классификация воды по водородному показателю приведена в таблице 4.
| Водородный показатель рН при Т22 о С | Подгруппа | Группа |
| £ 3,5 >3,5-4,5 >4,5-5,5 >5,5-6,0 | Весьма кислая Кислая Умеренно кислая Слабокислая | Кислая |
| >6,0-8,0 | Нейтральная | Нейтральная |
| >8,0-8,5 >8,5-9,0 >9,0-9,5 >9,5 | Слабощелочная Умеренно щелочная Щелочная Весьма щелочная | Щелочная |
В нашем случае рН = 5,3. Вода умеренно кислая.
6) Классификация подземных вод по температуре воды.
Классификация воды по температуре приведена в таблице 5.
| Температура, Т о С | Наименование |
| 0-4 >4-20 >20-37 >37-50 >50-75 >75-100 >100-200 >200-374 | Переохлажденная Очень холодная Холодная Теплая Очень теплая Горячая Очень горячая Слабо перегретая Весьма перегретая |
Примечание: воды с температурой от 20 до 100 о С называются термальными.
В нашем случае Т15 о С. Вода холодная.
Жесткость воды имеет большое значение при использовании подземных вод для питьевого водоснабжения, промышленных и хозяйственных целей. Жесткость воды обусловливается содержанием в ней солей кальция и магния. Измеряется в миллимолях (мг-экв/дм 3 ).
Различают общую жесткость (ОЖ), устранимую или временную жесткость (УЖ) и постоянную жесткость (ПЖ).
Общая жесткость обусловлена присутствием в воде гидрокарбонатов, хлоридов и сульфатов кальция и магния и равняется сумме устранимой и постоянной жесткости.
Устранимая жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния. Такая жесткость получила название карбонатной (КЖ) и может быть устранена при кипячении
Карбонат кальция и магния выпадает в осадок, образуя накипь. При использовании такой воды для промышленных и коммунальных целей происходит отложение карбоната кальция и магния на стенках котлов и трубопроводов, что приводит к выводу их из эксплуатации.
При высоком содержании НСО3 — в воде, превышающем суммарную концентрацию кальция и магния, вся жесткость считается карбонатной.
Постоянная жесткость обусловлена наличием в воде сульфатов и хлоридов кальция и магния и равняется разности между общей и карбонатной жесткостью.
Классификация воды по общей жесткости приводится в таблице 6 (ГОСТ 6055-86).
| Содержание в ммоль | Группа жесткости |
| £ 1,5 >1,5-3,0 >3,0-6,0 >6,0-9,0 >9,0 | Очень мягкая Мягкая Умеренно жесткая Жесткая Очень жесткая |
Подземные воды, жесткость которых превышает 7 ммоль, не могут быть использованы для питьевого и промышленного водоснабжения.
В нашем случае общая жесткость составляет 38,37 ммоль, устранимая (карбонатная) – 3,50 ммоль, постоянная – 34,86 ммоль. Вода очень жесткая, непригодная для питьевого и промышленного водоснабжения.
8) Пригодность для питьевого водоснабжения.
Пригодность воды для питьевого водоснабжения нормируется ГОСТ 6055-86 «Вода питьевая». В рамках сокращенного гидрохимического анализа нормативными являются минерализация, общая жесткость, содержание Cl — и SO 2- 4 , а также величина рН с предельно допустимыми концентрациями, приведенными в таблице 7.
| Наименование показателей | ПДК | Содержание в нашем примере | Степень пригодности |
Минерализация М, мг/дм 3 Общая жесткость ОЖ, ммоль 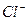 , мг/дм 3 , мг/дм 3 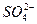 , мг/дм 3 рН , мг/дм 3 рН | 6,5-8,5 | 38,37 5,3 | Не пригодна Не пригодна Не пригодна Не пригодна Не пригодна |
В нашем случае вода по всем компонентам не пригодна для водоснабжения.
9) Пригодность для ирригационных целей.
Пригодность использования подземных вод, в том числе и шахтных, для ирригационных целей в сельском хозяйстве нормируется степенью минерализации воды и расчетным ирригационным коэффициентом. Классификация воды по минерализации, нормирующая степень пригодности для орошения сельскохозяйственных угодий, приведена в таблице 8.
| Минерализация, г/дм 3 | Степень пригодности для орошения |
| £1,7 >1,7-5,0 >5,0 | Пригодна Пригодна условно (возможно засоление) Не пригодна |
В нашем случае минерализация 6,9 г/дм 3 . Вода для орошения не пригодна.
Расчет ирригационного коэффициента выполняется в зависимости от соотношения ионов натрия, хлора и сульфатов в эквивалентной форме в миллимолях.


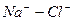
 |
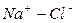

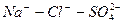
Во втором случае избыточное содержание катионов натрия может быть нейтрализовано содержащимся в воде сульфат-ионом. В третьем случае избыток натрия накапливается в почве в виде поглощенных катионов.
В первых двух случаях вода улучшению не подлежит, в третьем случае воду можно улучшить добавкой гипса. Классификация воды по ирригационному коэффициенту приведена в таблице 9.
| Ирригационный коэффициент | Характеристика воды | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| >18 >6-18 ³1,2-6,0 + — , Кир= 0,58. Вода очень плохая и улучшению не подлежит. 10) Агрессивность подземных вод. Подземные воды в зависимости от состава могут оказывать разрушающее действие на бетоны, цементы и металлы. Оценка агрессивности подземных вод по отношению к бетонам марки W4 и металлам производится на основании таблиц 5-7 и 26 СНиП 2.03.11-85 «Защита строительных конструкций от коррозии» (в скобках указаны номера таблиц согласно СНиП). Дата добавления: 2015-04-18 ; просмотров: 71 ; Нарушение авторских прав источник Классификация О.А. Алекина Химическая классификация природных вод Содержание растворенных газов, температура, дебит Минерализация воды Определение состава природных вод 2.2.1 Жёсткость воды Жёсткость воды определяется содержанием растворённых солей, кальция и магния. Различают общую, устранимую и постоянную жёсткости воды. Общая жёсткость обусловлена суммарным содержанием ионов Ca 2+ и Mg 2+ , устранимая представляет собой ту часть жёсткости, которая вызывается бикарбонатами Ca 2+ и Mg 2+ и устраняется кипячением воды, постоянная равно общей жёсткости минус устранимая. Общая жёсткость принято выражать в миллиграмм – моль (эквивалент) на дм 3 (ммоль/дм 3 ) и в немецких градусах ( о Н). Миллиграмм – моль жёсткости соответствует раздельному содержанию в дм 3 воды эквивалентных количеств Ca 2+ , Mg 2+ и CaО, а именно 20,04 мг Ca 2+ , 12,16 мг Mg 2+ или 28 мг CaО. Немецкий градус жесткости эквиваленте содержанию 10 мг CaО в литре воды. Сопоставляя названные показатели жесткости по величине CaО устанавливаем, что один ммоль жесткости равен 2,8 немецких градусов. Значение общей жесткости воды в ммоль/дм 3 находится суммированием содержания иона Ca 2+ и Mg 2+ в молярной форме. Умножая полученную величину на 2,8 находим общую жесткость в немецких градусах. Минерализация воды определяется содержанием растворенных минеральных веществ и рассчитывается как арифметическая сумма весовых количеств всех ионов в дм 3 воды. При подсчете минерализации суммарное содержание ионов, выраженное в миллиграммах на дм 3 переводится в граммы, с округлением до первого знака после запятой. Пример: сумма ионов составляет 14176 миллиграмм, минерализация воды 14,2 г/ дм 3 . Полный химический анализ воды предусматривает определение растворенных газов (СО2, Н2S и др.) содержание которых выражается миллиграммами на дм 3 (мг/ дм 3 ). При полевых исследованиях устанавливается температура природных вод (Т) и определяется дебит источников или скважин путем замера вытекающей или откачиваемой из них воды. Дебит (Д) выражается литрами в секунду (л/с) или кубометрами в сутки (м 3 /сутки). Классификация О.А. Алекина (рисунок 8) сочетает принцип деления подземных вод по преобладающим ионам и по соотношению между ними. По преобладающему аниону О.А. Алекиным /4/ выделяются три класса вод: гидрокарбонатная, сульфатная и хлоридная. По ведущему катиону различают группы кальциевых, магниевых и натриевых вод. Соотношение ионов позволяет установить различные типы вод. При выделении которых содержание ионов выражается в молярной форме (r) 1тип r > r Ca 2+ + r Mg 2+ (гидрокарбонатный натриевый), 2тип r 2+ + r Mg 2+ (сульфатный натриевый), 3тип r + 2+ + r Mg 2+ или r Сl — >r Na + 4тип r + =0 3 тип подразделяется: 3а rCl — + + r Mg 2+ (хлормагниевый), 3б rCl — + + r Mg 2+ (хлоркальциевый).
Типы гидрокарбонатных: Ca — I,II,III; Mg – I,II,III; Na – I,II,III Типы сульфатных: Ca — IV,II,III; Mg – IV,II,III; Na – I,II,III Типы хлоридных: Ca — IV,II,III; Mg – IV,II,III; Na – I,II,III Рисунок 8 Классификация природных вод по О.А. Алекину Эти гидрохимические оценки можно записать и в более сжатой форме. Если классы вод обозначить условными индексами (С-гидрокарбонатные воды, S-сульфатные, Cl-хлоридные), а типы римскими выделить символами ведущих катионов (Ca,Mg, Na), а типы римскими цифрами (I-IV), то химическая характеристика вод указанного состава запишется так: . Эту краткую форму записи следует использовать, указывая класс воды по Алекину в таблице результатов химических анализов природных вод (таблица 5). При массовых определениях химического состава природных вод возникает необходимость обобщения, полученных результатов и изображения анализов воды в виде кратких формул, допускающих обзор и интерпретацию аналитического материала. Формула Курлова представляет собой псевдо-дробь, в числителе которой в порядке убывающего содержания записываются анионы, а в знаменателе катионы, выраженные в процентах (дробные величины процентов округляются до целых чисел). Слева от полученной «простой дроби» указывается содержание растворенных газов в мг/ дм 3 и величина минерализации воды в г/ дм 3 , справа от нее температура воды и дебит скважины в м 3 /сутки. Образец записи результатов анализа в виде формулы Курлова приводится ниже: . Наименование водам дается по преобладающим (свыше 20% моль) анионам и катионам в порядке их возрастания (приведенный анализ читается – вода сульфатно-хлоридно-карбонатная, магниево-кальциевая). 2.3.3 Пересчет из ионной формы в солевую производится по правилу фрезенуса в соответствии с растворимостью солей. В первую очередь комбинируются малорастворимые, а затем более растворимые. Общая схема связывания следующая. Ионы Ca 2+ связываются последовательно с , , Cl в зависимости от его содержания в процентах. В такой же последовательности связываются ионы Mg 2+ и Na + . Пересчет в солевую форму имеет важное значение при оценке питьевых, лечебных, технических и др. качеств воды, т.к. полезно принять во внимание не только абсолютное содержание ионов но и предполагаемые ассоциации анионов с катионами (соли). Дата добавления: 2015-06-27 ; Просмотров: 3877 ; Нарушение авторских прав? ; Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет источник При изучении химического состава подземных вод нередко накапливается очень большое количество анализов — полных и кратких. Их бывает трудно сопоставить при разнообразии состава вод. Для лучшего обзора полученных аналитических данных предложено несколько способов наглядного написания результатов анализов. Некоторые авторы выражают результаты анализов при помощи формулы М. Г. Курлова. Пересчитанные в миллиграмм-эквивалент процентах данные анализа выписывают в виде математической формулы. На первом месте внизу буквы М (масса) плотный остаток в г/л (или сумму миллиграмм-эквивалентов), рядом с ним выписывают в мг/л специфичные для данного анализа элементы с указанием их количеств, например, бром, сероводород, редкие элементы и пр.; далее данные записывают в виде дроби: в числителе анионы в порядке убывания их количеств (символ элемента с показателем при нем числа мг/экв-%), а в знаменателе — катионы тем же способом; после дроби даются в виде множителя температура воды ( Т) и величина расхода Д (дебита) воды из родника, источника или колодца (в литрах в секунду, в минуту, в час и т. д., согласно сделанной оговорке). Так, например, формула: Она означает, что анализируемая вода содержит 4, 5г растворенных солей в 1 л: хлора 48% мг/экв, серной кислоты 40%, натрия 62%, магния 34%; температура воды 25° С, а расход воды достигает 2450 л/ч (или в другую условленную величину времени). Написанную выше формулу состава и состояния воды, по Курлову, читают так: солоноватая, хлоридно-сульфатная натриево-магниевая теплая вода. (Следует иметь в виду, что некоторые авторы рассчитывают проценты мг/экв, исходя из суммы мг/экв в 100 %, а другие исчисляют проценты, относя 100 % отдельно к сумме анионов и к сумме катионов, что более удобно.) Пользуясь такими формулами, удобнее сравнивать между собой анализы и классифицировать проанализированные воды по их химическому составу. В настоящее время предложено заменить при предварительной обработке гидрохимических материалов громоздкие формулы Курлова, включающие точные химические обозначения анионов и катионов, упрощенными индексами (показателями). К.В. Филатов и С.М. Шагоянц упростили формулу Курлова, заменив обозначения анионов Cl — , SO4, НСО3 русскими буквами X, С, Гк. Обозначений катионов они, не дают, делая упор на классификацию по анионам. Обозначение анионов и катионов русскими буквами представляет, однако, большое неудобство, так как оно противоречит общепринятой индексации химических элементов латинскими буквами. Индексация русскими буквами делает химические формулы недоступными для понимания в международном масштабе. Если ограничить упрощение формулы только заменой обозначений анионов (и лишь по ним подразделять состав вод), то лучше использовать предложение О. А. Алекина обозначать анионы бикарбоната буквой С (карбо-уголь), а сульфатного иона — буквой S (сульфур — сера). О. А. Алекин делит природные воды на группы: В каждой группе по преобладающему катиону он выделяет классы: Наконец, каждый класс распадается на виды вод: Кроме того, удобно заменить псевдодробь Курлова, занимающую две строки текста, однострочным написанием формулы, отделив анионы от катионов квадратными скобками. Например, М 2,5 [С65 S25 С110] [Са75 Mg20 Na5]. Удобны графические выражения результатов анализов. Если мы имеем дело с сокращенным анализом, при котором определяют из анионов НСО3, SO4, С l — , а из катионов Са 2+ и Na + + К + , то пользуются следующими приемами: График Роджерса. График состоит из двух параллельных прямоугольных полосок, подразделяемых каждая на 50 или 100 частей в зависимости от того, как ведется суммарный подсчет анионов — на 100 или на 200 %. Перед полосками ставится буква М, с указанием плотного остатка раствора в мг/л или в мг/экв%. Верхняя полоска отводится анионам в таком порядке — Cl — , SO4, НСО3, а нижняя — катионам — Nа + + К + , Са 2+ , Mg 2+ . Такое графическое изображение анализа очень наглядно и облегчает сопоставление результатов анализа. Некоторые авторы меняют положение полосок: одни ставят вертикально двумя столбиками, другие накладывают один столбик на другой: получается длинная колонна, нижняя часть которой отводится анионам, а верхняя катионам. Н. И. Толстихин предложил для этой же цели использовать круг, который делится на 2 половины вертикальным диаметром. Каждая половина по окружности делится на 50 или 100 частей. Левая половина отводится анионам, а правая катионам. Отмечая на окружности процентное содержание того или иного аниона, катиона, точки-отметки соединяют с центром. Таким образом секторы наглядно указывают на соотношение величин анионов и катионов на кругах, отведенных для отдельных анализов. Если анализов немного и они отличаются друг от друга своими плотными остатками, то круги можно чертить пропорционально плотным остаткам. Накладывая меньший круг на больший, можно очень четко представить себе соотношение в растворе анионов и катионов. «Треугольник Ферре», широко используемый и в других дисциплинах, когда требуется выяснить закономерности в трех составных сочетаниях. Если берут анионы, то в вершинах треугольников располагаются: в верхнем углу НСО3, в нижнем левом С l — , в нижнем правом SO4. Если используют катионы, то в верхнем углу Na + + К + , в левом нижнем Са 2+ , в правом нижнем Mg 2+ . Каждая сторона треугольника делится на 50 или на 100 частей, в зависимости от того, на 100 или на 200 % производился расчет анализа. Количество процентов данного иона убывает от вершины, где стоит его символ, к противоположным углам. На каждый треугольник можно нанести результаты большого количества анализов и получить ясное представление о соотношении в анализируемых водах анионов и катионов. При небольшом количестве анализов можно использовать один треугольник для нанесения на него анионов и катионов. При этом анионы и катионы наносятся различными значками, например, анионы точками, а катионы крестиками. Значки аниона и катиона, относящиеся к одному анализу, соединяются между собой прямой линией. Таким образом удается сопоставить результаты различных анализов с достаточной наглядностью. Одновременно нанести на график анионы и катионы можно и при пользовании «квадратом Толcтихи на». Нижняя горизонтальная сторона квадрата отводится для Са 2+ + Mg 2+ + Fe 2+ , а верхняя для Na + + К + ; правая вертикальная сторона квадрата отводится для Cl — + SO4, а левая — для НСО3 + СО3. Места нулевых величин находятся в левом верхнем и правом нижнем углах, откуда они нарастают к нижнему левому и верхнему правому углам. Н. И. Толстихин делает свои расчеты на 200%, но можно, конечно, делать их на 100 % суммы катионов и анионов. Квадрат Н. И. Толстихина состоит из рядов полос вертикальных и горизонтальных. В вертикальных рядах слева направо убывают количества К + + Na + и нарастают Са 2+ + Mg 2+ . Практически К + никогда не преобладает над Na + ; Са 2+ и Mg 2+ бывают то в равных количествах, то один из них преобладает над другим. Таким образом по средним вертикалям располагаются смешанные щелочные и щелочноземельные воды, в крайней левой вертикали — чистые щелочные (натриевые) воды, а в крайней правой — чистые щелочноземельные воды. По горизонтальным рядам сверху вниз убывают бикарбо- натные соли и нарастают сульфаты и хлориды. Следовательно, в левом верхнем углу скапливаются бикарбонаты натрия, а в левом нижнем углу — хлориды и сульфаты натрия; в правом верхнем углу — бикарбонаты кальция и магния, а в правом нижнем — хлориды и сульфаты кальция и магния. Так как при построении квадрата приходится пользоваться суммами ионов в % мг/экв К + + Na + , Са 2+ + Mg 2+ , Cl — + SO4, то при этом скрадывается соотношение ионов каждой паре. Раскрыть эти соотношения можно на треугольниках, которые, по совету Н. И. Толстихина, следует причлепять к квадрату: один справа, так, чтобы линия SO4 —Сl — представляла продолжение линии Са 2+ + Mg 2+ ; тогда в левом нижнем углу треугольника располагается максимум SO4, в правом нижнем — максимум Cl — , а в верхнем углу — НСО3. Другой треугольник причленя- ется сверху так, что его линия Mg 2 + — Са 2+ продолжает линию Cl — — SO4 квадрата; тогда в ближнем к квадрату углу располагается максимум Mg 2+ , в дальнем — максимум Са 2+ , а в третьем углу — Na + + К + . При таком расположении фигур вертикальные ряды катионов продолжаются в верхнем треугольнике, а горизонтальные ряды анионов — в боковом треугольнике. источник Наиболее часто используются в практике формула Курлова и формула солевого состава воды. Формула Курлова – прием наглядного изображения химического состава природной воды. Эта формула представляет собой дробь (ложную дробь, т. к. операция деления не производится), в числителе которой в убывающем порядке записывают содержание анионов (в %-экв), а в знаменателе катионов. В формуле пишутся все доминирующие анионы и катионы, содержание которых более 10 %. Формула сопровождается дополнительными данными. Перед дробью записывают содержание газов и компонентов, придающих воде специфические свойства (СО2, Н2S, Вг, V, радиоактивность и др.) и общую минерализацию М (в г/л) с точностью до одного десятичного знака. После дроби указывают показатели, характеризующие рН, температуру Т (°С), при наличии данных – дебит Q скважины или источника в м 3 /сут. В наименование состава воды включаются анионы и катионы, содержание которых превышает 25 %-экв. Название воды записывается через дефис в следующем порядке: сначала по специфическим компонентам и по минерализации, затем по анионному и катионному составу (в порядке увеличения их величин), по величине рН, по температуре. В качестве примера рассмотрим формулу состава воды: СО2 1,2 М 2,5 рН 7.8 Т 0 15, Q (л/с). В нашем примере вода: углекислая, слабосолоноватая сульфатно-гидрокарбонатная магниево-кальциевая, слабощелочная, холодная. Формулу солевого состава также составляют в виде дроби, в числителе которой записывают анионный состав воды (%-экв) в убывающем порядке, а в знаменателе – катионный. В отличие от формулы Курлова в формуле солевого состава пишутся все анионы и катионы, содержание которых более 1 %. Перед дробью записывают содержание газов и специфических элементов, если они имеются в воде, и общую минерализацию М. Температура и дебит воды не указываются. В названии читаются первые два аниона, а затем первые два катиона. Общая минерализация воды – это сумма ионов, молекул и различных соединений, содержащихся в воде (табл. 16). Величина ее определяется по сухому остатку, полученному после выпаривания воды. Хорошая питьевая вода должна содержать не более 1 г/л. Классификация вод по общей минерализации (упрощенная схема)
Концентрация водородных ионов (рН). Этот показатель важен для правильного определения химического состава воды. Определяют индикатором, лакмусовой бумажкой (допустимо для питьевой воды 6,5–8,0). Классификация по величине рН приведена в табл.17. Классификация подземных вод по величине рН
Классификация подземных вод по температуре
Не нашли то, что искали? Воспользуйтесь поиском: Лучшие изречения: На стипендию можно купить что-нибудь, но не больше. 8625 — 193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь. Отключите adBlock! источник Природные воды как все воды земного шара как планеты, их описание по формуле М.Г. Курлова. Водородный показатель – pH и его нормирование. Виды жесткости воды, основные критерии и принципы проведения ее оценки. Анализ степени минерализации образцов.Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны. Размещено на http://www.allbest.ru/ Размещено на http://www.allbest.ru/ Природные воды — все воды земного шара планеты. В природных условиях вода не встречается в химически чистом виде. Она представляет собой раствор, часто сложного состава, который включает газы (O2, CO2, H2S, CH4 и др.), органические и минеральные вещества. В природных водах обнаружено подавляющее большинство химических элементов. Наиболее распространенные ионы: Na + , Ca 2+ , Mg 2+ , Fe 2+ , Fe 3+ , Cl — , SO42- , HCO3— , NO3— , а также кремниевая кислота H2SiO3. Описание природной воды по формуле М.Г. Курлова Для удобства сопоставления анализов воды существуют различные способы сокращённого изображения состава. Наиболее часто применяется формула М.Г. Курлова — это наглядное изображение химического состава природной воды. В этой формуле, выражаемой в виде псевдодроби, в числителе пишут в процент-эквивалентах в убывающем порядке анионы, а в знаменателе в таком же порядке катионы. Ионы, присутствующие в количестве менее 10% экв, в формулу не вносят. К символу иона приписывают его содержание в процент-эквивалентах в целых числах. Впереди дроби указывают величину минерализации (М) в г/л, pH, жёсткость в мг·экв /л и компоненты, специфичные для данного анализа (CO2, H2S, Br — , J — , радиоактивность и др.). После дроби указывают температуру воды (t C) и дебит источника или скважины в (D), м 3 / сут. А теперь последовательно рассмотрим составные части формулы М.Г. Курлова. Водородный показатель — pH В воде часть молекул всегда находится в диссoциированном состоянии в виде ионов H + и OH — Концентрация недиссоциированной воды считается постоянной, поэтому количество ионов водорода и ионов гидроксила при данной температуре будет тоже величиной постоянной. При t 22 0 С эта величина равна 10 -14 . Чистая вода имеет нейтральную реакцию и количество ионов H + должно быть равно количеству ионов OH — . Это выражение показывает, что при 22 0 С в 1 л чистой воды содержится 10 -7 грамм-молекул воды в ионизированном виде, т.е. 10 -7 грамм-ионов водорода и 10 -7 грамм-ионов гидроксила. Если [H+] = 10 -7 , то lg [H + ] = -7, а — lg [H + ] = 7 Выражение — lg [H + ] означает pH — отрицательный десятичный логарифм концентрации водородных ионов. Если pH 7 — реакция воды щелочная; Жёсткостью воды называется свойство воды, обусловленное содержанием в ней ионов кальция (1/2 Ca 2+ ) и магния (1/2 Mg 2+ ). Единицей жёсткости воды является моль на кубический метр (моль/м 3 ). Числовое значение жёсткости, выраженное в моль /м 3 равно числовому значению жёсткости, выраженному в мг·экв /л. 1 мг/л жёсткости воды отвечает содержанию ионов кальция (1/2 Ca 2+ ) 20,04 мг/л и ионов магния (1/2 Mg 2+ ) 12,153 мг/л. Различают жёсткость воды общую — общее количество содержащихся в воде ионов кальция и магния; устранимую — жёсткость воды, обусловленная наличием в воде карбонатных (CO32- ) и гидрокарбонатных (HCO3— ) ионов солей кальция и магния, удаляемая при кипячении и определяемая экспериментально; неустранимую — разность между общей жесткостью и устранимой жесткостью; карбонатную — сумма карбонатных (CO32- ) и гидрокарбонатных (HCO3— ) ионов в воде; некарбонатную — разность между общей жёсткостью и карбонатной. По величине общей жёсткости (по А.О. Алекину) различают следующие природные воды: очень мягкие до 1,5 мг·экв /л умеренно-жёсткие 3 — 6 мг·экв /л Минерализация воды. Минерализация (М) воды — концентрация растворённых в воде твёрдых неорганических веществ. Различают характер и степень минерализации. Характер минерализации обусловлен химическим типом воды. По О.А. Алекину воды делятся на три класса по преобладающему аниону — гидрокарбонатные, сульфатные, хлоридные. Каждый класс подразделяется на три группы по преобладающему катиону — Na + , Ca 2+ , Mg 2+ . Степень минерализации. Степень минерализации выражают в мг/л или г/л (иногда г/кг) и определяют: 1). По сухому остатку, который получают путём выпаривания природной воды. Если количество воды выражено в мл, концентрацию солей в воде называют минерализацией — М (г/л, мг/л). Если количество воды взято в г, то концентрацию солей в воде называют с о л ё н о с т ь ю — S (г/кг, % 0). 2). По химическому составу природной воды. Определяют как арифметическую сумму весовых количеств всех ионов в 1 л воды: природный вода жесткость минерализация По степени минерализации (по В.И. Вернадскому, 1931-36 гг.; И.К. Зайцеву, 1958 г.) природные воды подразделяются на: 1. Из лаборатории получаем результаты химических анализов воды в мг/л. 2. Полученные исходные данные пересчитываем в мг·экв путём деления результатов анализа в мг/л на э к в и в а л е н т н у ю массу соответствующего иона (табл. 1). Например: концентрация Ca 2+ 79 мг/л (результат химического анализа (табл. 2), чтобы получить эквивалентную массу кальция, нужно его атомную массу 40,08 разделить на валентность, т.е. 2, получим эквивалентную массу 20,04, затем 79:20,04 = 3,95 мг·экв/л. Пересчитать в мг·экв форму можно другим способом. Для этого исходные данные в мг/л умножить на соответствующие пересчётные коэффициенты. Величину пересчётного коэффициента получим путём деления е д и н и ц ы на эквивалентную массу. Пересчётный коэффициент для кальция: 1:20,04 = 0,0499. Для одновалентных ионов эквивалентной массой будет атомная масса. 3. Для вычисления процент — эквивалентов (% · экв.) принимаем сумму мг · экв. анионов (УА), содержащихся в 1 л воды за 100% и вычисляем процент содержания каждого аниона в мг? экв по отношению к этой сумме. Аналогично вычисляем% экв. катионов. Например: (табл. 2) сумма катионов равна 8,51 Суммы катионов и анионов, выраженные в мг·экв /л, должны быть равны между собой. Часто точного совпадения цифр в виду погрешностей анализа не бывает. Допустимая неточность анализа (х) определяется по формуле: У А — сумма мг·экв /л анионов; У К — сумма мг·экв /л катионов. М= (61+612+147+556+491+555+640) мг/л/1000=3,06 Вода, слабощелочная, очень жесткая, солоноватая. В название химического состава воды входят ионы, содержание которых ? 25% экв. и называют воду, начиная с анионов от 25% экв. в возрастающем порядке, затем катионы в таком же порядке. Вывод: Вода не пригодна для питья: 5. если сульфатов > 500 мг/л; 6. если У Cl + SO4 ? 450 мг/л. М= (202+129+57+86+319+12+555+46) мг/л/1000=1,44 г./л Вывод: Вода слабощелочная, солоноватая, очень жесткая, гидрокарбонатно — магниево-кальциевая. В название химического состава воды входят ионы, содержание которых ? 25% экв. и называют воду, начиная с анионов от 25% экв. в возрастающем порядке, затем катионы в таком же порядке. Вода не пригодная для питья т.к.: 4. если У Cl + SO4 ? 450 мг/л. М= (41,9+2,5+2,15+56+5,69+30,31) мг/л/1000=0,1г/л Вывод: Вода близкая к нейтральной, мягкая, пресная, хлоро-гидрокарбонатно-натриевая. Вода пригодна для питья. Чистый экономический эффект определяется с целью технико-экономического обоснования выбора наилучших вариантов природоохранных решений, различающихся между собой по воздействиям на среду и производственные результаты отрасли, а также для экономической оценки фактически осуществленных мероприятий [3]. Требуется определить экономическую эффективность комплекса природоохранных мероприятий (для атмосферы, водных и других ресурсов), планируемых в заданном объеме К, тыс. руб. капитальных вложений и С тыс. руб./год текущих годовых затрат на эксплуатацию и обслуживание объектов природоохранного назначения. Порядок расчетов. Находим годовую оценку ущербов до (У1) и после (У2) проведения водоохранного (атмосфероохранного) мероприятия на конкретном объекте. Значения У1, тыс. руб./год, берутся из практических работ №1 и №2 (У1 = П). Значение ущерба У2, тыс. руб./год, определяется по формуле где n — количество сбрасываемых в водоем или выбрасываемых в атмосферу загрязняющих веществ; У1i — платежи за сброс в водоем (практ. работа №1: У1i = Пнi + Пснi) или выброс в атмосферу (практ. раб. №2: У1i = Пi) i-й примеси, тыс. руб./год; hji — эффективность j-го средства очистки по i-й примеси; m — количество применяемых средств очистки. Прирост дохода ДД представляет собой дополнительную прибыль от улучшения показателей работы основного производства (при его реконструкции), а также от полезного использования (реализации или использования в производстве) отходов, выделенных при работе природоохранного оборудования [3]. В качестве примера можно привести реализацию или использование в котельной в качестве топлива нефтепродуктов, улавливаемых в нефтеловушке. В связи с небольшим количеством улавливаемых отходов в данной практической работе для всех природоохранных мероприятий принимаем ДД = 0. Капитальные вложения в природоохранное мероприятие К, тыс. руб., определяются как суммарная стоимость применяемых средств очистки: где Кj — стоимость j-го средства очистки, тыс. руб. Средства очистки сточных вод выбираются исходя из условий конкретного варианта (в зависимости от загрязняющего вещества, платежи за сброс которого наибольшие), сведения об эффективности технических средств по различным веществам приведены в табл. 1.4. Атмосфероохранное оборудование выбирается аналогично (скруббер или электрофильтр), эффективность указана в практ. работе №2. Ориентировочная стоимость технических средств очистки сточных вод и отходящих газов приведена соответственно в таблицах 5.2. и 5.3. Текущие затраты (эксплуатационные расходы) С, тыс. руб./год, определяются с учетом капитальных вложений [8]: — для мероприятий по очистке воды или воздуха от твердых загрязнителей: — для мероприятий по очистке воды или воздуха от газообразных и жидких загрязнителей: Формула для определения текущих затрат выбирается в зависимости от того, какая примесь наносит наибольший ущерб. Используя полученные данные по ущербам до и после предлагаемых природоохранных мероприятий, а также капитальным вложениям и текущим затратам, нетрудно определить экономическую эффективность таких мероприятий. Структура расчетов представлена в табл. 5.1. При R > 0 оцениваемый комплекс мероприятий экономически эффективен. При наличии нескольких вариантов природоохранного мероприятия на одном и том же объекте предпочтение отдается варианту с минимальным сроком окупаемости Т. Срок окупаемости не должен превышать нормативного (Т і Тн, для объектов энергетики (котельных) Тн = 8,3 лет, для прочих объектов железнодорожного транспорта Тн = 6,7 лет). Величиной, обратной сроку окупаемости, является общая (абсолютная) эффективность мероприятий, 1/год: Индивидуальная таблица расчетов экономической эффективности природоохранных мероприятий источник ФОРМЫ ИЗОБРАЖЕНИЯ ХИМИЧЕСКОГО СОСТАВА ПЛАСТОВЫХ ВОД Химический анализ природных вод заключается в определении наличия и количества растворенных в ней веществ. По результатам химического анализа оценивают пригодность воды для тех или иных целей. Анализы осуществляют как в стационарных, так и полевых лабораториях с применением различных методик. Различают общий и специальный виды анализов. Общий анализ – это определение наличия и количества шести главных ионов: Cl — , SO4 2- , HCO3 — , Ca 2+ , Mg 2+ , Na + . Общий анализ, в котором указывается значение плотности и рН воды, называют стандартным. Специальные анализы более обширны и включают дополнительные исследования, например, для нефтегазопоисковых целей также определяют наличие специфических видов бактерий. При санитарном анализе определяют отсутствие вредных бактерий, устанавливают значение солености, жесткости, окисляемости и содержание ионов NH4 + , NO2 — , NO3 — . Данный анализ проводят для оценки питьевых свойств воды. При бальнеологическом анализе дополнительно определяют наличие в воде различных компонентов, характеризующих ее лечебные свойства. Технический анализ проводят для оценки пригодности воды для ее использования в парокотельных установках, при закачке в нефтяные пласты. Результаты общего анализа природных и пластовых вод могут быть представлены в разных формах. Различают ионную, эквивалентную и процент-эквивалентную формы. Ионная форма (С). Принимают, что растворенные в воде соли полностью диссоциируют на ионы. В результате находят количество (массу) каждого из ионов выражают в миллиграммах в одном литре, килограмме или 100 г воды. Для пресных вод отнесение содержания ионов к единицам массы или объема не имеет значения, для рассолов эти отношения существенно расходятся. При переходе от состава воды, отнесенного к единице объема, к составу, отнесенному к единице массы, содержание отдельных ионов необходимо разделить, а в обратном случае – умножить на ее плотность. Ионная форма приводится обязательно при всех гидрохимических исследованиях. Ионная форма не охватывает растворенные газы и некоторые вещества, содержащиеся в виде коллоидных частиц. Результаты определения солевого состава воды пересчитывают в эквивалентную форму. Чтобы выразить эквивалентное содержание иона в водном растворе (пластовой воде), необходимо массовую концентрацию (ионная форма) разделить на его эквивалент: где r (ион) – эквивалентная концентрация иона, г-экв/м 3 , мг-экв/л; С(ион) – концентрация иона в пластовой воде, г/м 3 , мг/л; Эквивалентом иона называется эквивалентное (равное по заряду) количество молей тех же ионов, но таких, как если бы каждый из них имел единичный заряд, то есть суммарный заряд эквивалентного количества ионов равен фактическому заряду этих ионов, содержащихся в воде: где Ми(ион) – относительная молекулярная масса иона; е – количество зарядов иона. Значения эквивалентов ионов представлены в таблице 2. Таблица 2 – Эквиваленты ионов пластовых вод нефтяных месторождений
По принципу электронейтральности растворов сумма катионов, выраженная в эквивалентной форме, равна сумме анионов, выраженной в эквивалентной форме. Используя это равенство, определяют содержание ионов Na + : r(Na + ) = (r(Cl — ) + r(HCO3 — ) + r(SO4 2- )) – (r(Ca 2+ ) + r(Mg 2+ ) Для определения содержания иона Na + и K + в ионной форме полученную величину умножают на эмпирический коэффициент: 25 – для пресных вод, 24 – для минерализованных. Процент–эквивалентная форма может быть получена из эквивалентной формы, которая показывает относительную долю, занимаемую разными ионами во всей массе, содержащейся в воде. Сумму всех ионов, взятых в эквивалентной форме, принимают за 100 %: Σ r(анионы) + Σ r(катионы) = 100 %-эвк. Затем вычисляют процент содержания каждого иона – содержание иона в процент-эквивалентной форме. Пример изображения результатов химического анализа воды представлен в таблице 1. Таблица 1 – Солевой состав пластовой воды
К числу форм наглядного изображения состава вод принадлежит формула Курлова – псевдодробь, в числителе указывают содержание главных анионов в процент-эквивалентной форме, в знаменателе – содержание катионов, величины записывают в виде индексов. Содержание ионов располагают в порядке убывания значения процент-эквивалентов. Те ионы, содержание которых менее 1 %-экв не указывают. Перед дробью указывают важнейшие газообразные компоненты и величину общей минерализации воды (г/л), после дроби – температуру воды. Формула Курлова для солевого состава воды, приведенного в таблице 3 (данные по газам и температуре добавлены): Дата добавления: 2016-11-20 ; просмотров: 1524 | Нарушение авторских прав источник Курлов, 1921, — псевдоформула, наглядно изображающая основные свойства хим. сост. воды. В числителе дроби пишут анионы, в знаменателе — катионы, присутствующие в количестве более 5%-экв. (из расчета, что анионы и катионы составляют по 100 %). Рядом с символом иона указывают содер. его в %-экв. Впереди дроби сокращенно указывают величину минерализации М (в г/л) и недиссоциированные части или газы (в мг/л) и радиоактивность (в эманах), если они придают воде специфические свойства, а в конце дроби — температуру Т (в °С), и дебит Д (в м 3 /сут). Напр.: Однако рекомендуется вписывать второй анион и катион, даже если его содер. очень незначительно. Графические методы систематизации химического анализа подземных Для отображения химического состава подземных вод удобно использовать метод равносторонних треугольников Ферре или метод треугольных координат. На каждом графике-треугольнике Ферре можно показать соотношение трех компонентов (анионов(CI,SO4,HCO3) и катионов(Na,Mg,Ca,K)), а при большем их количестве, близкие по химическим составам компоненты объединяются в родственные группы: например, калий с натрием (например, ΣNa++K+), хлор с нитратным ионом. Для выражения анионов используется один треугольник, а для выражения катионов — другой. По данному графику можно определить место подземных вод по классификации. При сопоставлении целого ряда анализов и выяснении генезиса вод с помощью треугольников Ферре (наличии точек, полученных при соотношении трех компонентов, соответствующих фрагменту треугольника) можно раздельно выделять воды хлоридные, гидрокарбонатные и сульфатные, натриевые, кальциевые и магниевые. Воды зоны аэрации: условия залегания, распространения, питания и Верхняя часть земной коры залегающая выше уровня грунтовых вод называется зоной временного содержания воды или зоной аэрации. Зона аэрации измеряется от 0 (болота) до 50-100 (пустыни) зоны питания и области расположения. Воды зоны аэрации находятся непосредственно у поверхности Земли и имеют ограниченное распространение и временное существование. К водам зоны аэрации относятся почвенные воды и верховодки. В зоне аэрации могут временно находиться поверхностные воды, идущие на соединение с грунтовыми водами. Эти воды называются верхними водами или верховодкой. Образуются они, как правило, после снеготаяния и дождей. Грунтовые воды: условия залегания, распространения, питания и Грунтовыми называют свободные воды первого от поверхности постоянно существующего водоносного горизонта, залегающего в зоне полного насыщения. Область питания грунтовых вод, как правило, совпадает с областью их распространения. Грунтовые воды тесно связаны с атмосферными осадками, поверхностными водами и верховодкой и поэтому зональны. В зависимости от условий залегания грунтовых вод различают грунтовый поток и грунтовый бассейн. Первый характеризуется движением воды, происходящим под влиянием силы тяжести в направлении уклона свободной поверхности, второй — наличием в водоупорном ложе понижений и движением воды на отдельном отрезке в восходящем направлении. Грунтовые воды, как и все воды верхней части земной коры, зональны. Их состав закономерно изменяется в соответствии с изменением климатических особенностей территории. Областью разгрузки (дренирования) грунтовых вод являются близлежащие долины рек и оврагов, которые называются местным базисом подземного стока.Зеркало грунтовых вод — свободная поверхность грунтовых вод. Карты гидроизогипс и гидроизобат. Их анализ. Карта гидроизогипс — карта, на которой отображается положение зеркала грунтовых вод в виде гидроизогипс.ГИДРОИЗОБАТЫ— линии, соединяющие на плане (карте) точки зеркала подземных вод, расположенные на одинаковой глубине от земной поверхности. Анализ карт дает представление о скорости фильтрации подземных вод, пропорциональной напорному градиенту, величине водопроницаемости и изменении геометрических параметров потока. Что такое режим рек? От чего зависит режим? режим реки представляет собой обычный для каждой реки ход изменений уровня, скорости и температуры, а также движения, состава и берегового рельефа, который отвечает за форму реки.Режим реки может зависеть от множества факторов, которые, в свою очередь, зависят от географического расположения, климата, водного питания, рельефа земли, фауны, смены времен года, механического и химического воздействия, а также от природных явлений.По режиму различают реки горные и равнинные. Межпластовые подземные воды. Основные типы межпластовых Подземных вод по характеру формирования и режиму (напорные и безнапорные Межпластовыми водами называют водоносные горизонты, залегающие между двумя водоупорными слоями. В зависимости от условий залегания они могут иметь свободную поверхность или обладать напором. Межпластовые ненапорные воды встречаются сравнительно редко. Уровень этих вод располагается ниже кровли первого водоупора, то есть водопроницаемый слой не имеет полного заполнения. По условиям передвижения и характеру напоров эти воды аналогичны грунтовым водам. Однако область питания межпластовых вод не совпадает с областью их распространения. Питание вод происходит на участках выхода водоносного пласта на дневную поверхность или путём фильтрации из рек и других поверхностных водотоков и водоёмов. Межпластовыми напорными или артезианскиминазывают воды, залегающие между двумя водоупорными слоями и обладающие гидростатическим напором. В отличии от межпластовых ненапорных вод артезианские воды полностью насыщают водопроницаемый слой от подошвы до кровли. При вскрытии напорного водоносного пласта скважинами вода поднимается выше его водоупорной кровли, а при сильном напоре и низких абсолютных отметках земной поверхности может самоизливаться на поверхность с высотой фонтанирования до нескольких десятков метров. источник
Лабораторные занятия по курсу «Гидрогеология и инженерная геология» представляют собой весьма важную и сложную часть этого курса. Они имеют своей задачей ознакомить студентов специальности 050706 – «Геология и разведка месторождений полезных ископаемых» с условиями формирования химического состава подземных вод, основами расчетов, определяющих движение подземных вод в естественных условиях и при откачках воды из скважин. В методических указаниях изложены сведения об инженерно-геологических и гидрогеологических картах и разрезах. Даны основные приемы гидрогеологической и инженерно-геологической оценки территорий месторождений полезных ископаемых. ОСНОВЫ ГИДРОГЕОЛОГИИ Лабораторная работа «Физические свойства и химический состав подземных вод» Свойства и химический состав подземных вод Вода представляет собой химическое соединение водорода (11,11%) и кислорода (88,89%). Показателями физического состояния и свойств подземных вод служат: температура, прозрачность, цвет, запах, вкус, плотность, сжимаемость, вязкость, электропроводность, радиоактивность. Состав подземных вод отражает историю геологического развития Земли, условия взаимодействия их с горными породами, органическим веществом, микроорганизмами газами, характер и интенсивность антропогенных воздействий на геологическую среду. В природных водах в той или иной степени рассеяния присутствует более 60 из известных устойчивых элементов периодической системы Д.И. Менделеева. В состав подземных вод входят: ионы, недиссоциированные молекулы, коллоиды, органические вещества и микроорганизмы, нерастворенные взвешенные частицы, газы. Среди ионов различают: макрокомпоненты, включающие элементы и комплексные соединения, составляющие основу подземных вод; микрокомпоненты, включающие элементы или соединения в количестве менее 10, редко 100 мг/л; ультрамикрокомпоненты (Rb, Au, Hg), содержание которых редко превышает 0,1 мг/л. Макрокомпоненты (О, Ca, Mg, Na, K, Cl, S) составляют основную часть минерального состава природных вод. В пресных водах содержится свыше 90-95% макрокомпонентов, в высокоминерализованных более 99%. Микрокомпоненты (Li, B, F, Ti, V, Cr, Mn, Co, Ni, Cu, Zn, Ba) не определяют химический тип воды, однако оказывают значительное влияние на специфические особенности их состава. Типизация и классификация подземных вод по химическому составу производится по макрокомпонентам. В одной из классификаций (О.А. Алехина) подземные воды разделены на классы, группы и типы в зависимости от преобладающих ионов и соотношений между главными ионами (Приложение В). Воды первого типа – маломинерализованные, второго – мало- и среднеминерализованные (подземные воды, воды рек и озер), третьего типа – сильноминерализованные (воды океанов, морей, реликтовые воды), четвертого типа – кислые. Из недиссоциированных соединений в подземных водах распространены SIO2, Fe2 O3, Al2O3, из газов – O2, H2S, CO2, H2, CH4 и тяжелые углеводороды (этан, пропан, бутан). Для выявления химического состава выполняют химические анализы подземных вод (полевые, сокращенные, полные и специальные). Выбор типа анализа определяется целевым назначением и требуемой точностью определений. Сумма минеральных веществ, выделенных из воды при помощи химических анализов, определяет ее химическую минерализацию. Величину минерализации оценивают по сухому остатку, получаемому путем выпаривания и высушивания пробы воды или по сумме ионов, определенных химическим анализом. Общая минерализация подземных вод изменяется от нескольких десятков мг на литр до 650 г/л. Содержание компонентов выражается в миллиграммах на литр и процентах, содержание обменного комплекса и жесткость воды — в миллиграмм-эквивалентахна литр. Принимая эквивалентное содержание суммы катионов и анионов за 100%, можно найти процентное содержание каждого иона. При сопоставлении целого ряда анализов, выяснении генезиса вод удобно выражать анализы в виде предложенного Н.И. Толстихиным графика–квадрата, иногда комбинированного с треугольником Ферре (Приложение Г). В практике производственных лабораторий для обозначения единичных химических анализов широко используются формулы М.Г. Курлова, И.Ю. Соколова. Формула Курлова записывается в виде псевдодроби: А; М где А — специфический элемент, содержащийся в воде, мг/л; М — общая минерализация, г/л; Т — температура воды, о С; Q — расход источника (дебит скважины), м 3 /сут. Анионы и катионы выражают в процентах в убывающем порядке их содержания; ионы с содержанием менее 10 в формуле не учитываются. Оценка качества воды для питьевых целей производится по ГОСТ 2874-82, определяющим пределы допустимых концентраций (ПДК) тех или иных компонентов в воде. В качестве предельно допустимой, принимается концентрация отдельных компонентов, которая полностью исключает вредное воздействие на организм человека. Органические примеси установливаются по окисляемости — количество кислорода или марганциево-кислого калия, расходуемого на окисление этих примесей. В питьевой воде окисленность должна быть не более 10 мг/л. О концентрации микроорганизмов судят по результатам анализов, определяющих количество бактерий в данном объеме жидкости. Общее количество бактерий в 1 см 3 воды не должно превышать 100. Наиболее важный показатель бактериальной чистоты воды — коли-титр—количество воды, содержащее одну кишечную палочку.Для водоснабжения пригодна вода с коли-титром 300. Жесткостью оценивается возможность использования воды для хозяйственно-питьевых целей. Она зависит от присутствия Ca 2+ и Mg 2+ . Различают общую жесткость, связанную с содержанием в воде всех солей кальция и магния; карбонатную (временную), связанную с наличием бикарбонатов кальция и магния; постоянную, остающуюся после удаления бикарбонатов. Жесткость воды оценивают в мг экв/л Ca и Mg. 1 мг экв/л соответствует содержанию 20,04 мг/л Ca или 12,16 мг/ л Mg.Жесткость природных вод изменяется от нескольких до десятков сотен мг экв/л. Наличие в воде гидратов натрия, карбонатов и бикарбонатов натрия определяет ее щелочность. Различают гидратную, карбонатную, бикарбонатную, фосфатную и силикатную щелочности. Концентрация иона водорода (pH воды) Концентрацией водородных ионов оценивается степень кислотности воды. При нейтральной реакции воды рН = 7, при кислой — меньше 7, при щелочной — больше 7. Для выражения концентрации водородных ионов принято пользоваться логарифмом концентрации их (т.е количества грамм эквивалентов этого иона в 1 л воды), взятым с обратным знаком : Оценка агрессивных свойств воды Агрессивной является вода, содержащая сверх допустимого количества сульфаты и агрессивную углекислоту. Разрушающее действие вода может оказывать на бетон в виде: кристаллизации в бетоне новых соединений с увеличением его объема или выщелачивания из бетона его составных частей, растворимых в воде. И то и другое приводит к разрушению бетона. Сульфатная агрессия наблюдается при наличии в воде сульфатов SО4 2- свыше 250 мг/л и одновременном содержании иона Cl — свыше 1000 мг/л. При этом в бетоне образуется гипс с увеличением объема в 2-3 раза и сульфат-алюминат кальция – бетонная бациллас увеличением объема в 2,5 раза. При углекислой агрессии происходит растворение и выщелачивание извести CaSO4, составляющей основу цемента. Агрессивность выщелачивания – агрессия по временной (бикарбонатной) жесткости. Если содержание щелочи меньше 1,5 мг экв/л, происходит растворение и вымыв из бетона извести. Общекислотная агрессия обусловлена низкими значениями водородного показателя рН (менее 7 при временной жесткости менее 8,6 мг экв/л и менее 6-7 при временной жесткости более 8,6 мг экв/л), вызывающее усиленное растворение извести. Магнезиальная агрессия приводит к разрушению бетона при проникновении в него воды с содержанием Mg +2 ,более 1000 мг экв/л. 1.1.2 Задания для лабораторных работ Химическим анализом установлена приведенная концентрация водородных ионов. Определите рН и наименование воды по его значению в соответствии с вариантом таблицы 1. Таблица 1 — Исходные данные к заданию 1
Пример решения задачи для варианта № 0 Для выражения концентрации водородных ионов принято пользоваться логарифмом концентрации их, взятым с обратным знаком pН= — lg (Н + ), следовательно pН= — lg (10 -5 ) = 5. Для ответа используйте классификацию воды по значению водородного показателя (приложение А). Вывод: по величине pH — вода кислая. Используя результаты химического анализа подземной воды, приведенные в таблице 2, определите ее класс, группу и тип по классификации О.А. Алекина и номер воды по графику-квадрату Н.И. Толстихина. Таблица 2 — Исходные данные к заданию 2
Пример решения задачи для варианта № 0 Выразите химический состав воды в % экв. Сумма катионов и анионов каждая в отдельности принимается равной 100%. Далее рассчитывается % экв каждого аниона и катиона. Сумма анионов-13,15 мг экв/л – 100%, 5,79 мг экв/л HCO3 — равен 5,79 ´ 100% и разделить на 13,15. Равно 44%. Данные заносят в таблицу 3. Таблица 3 – Химический состав подземных вод
Затем по приложениям В, Г определите наименование и номер. Вывод: по классификации О.А. Алекина вода относится к классу — гидрокарбонатной, группе – натриевой, I типа (HCO3 — > Ca 2+ + Mg 2+ ). По Н.И. Толстихину № 58. Запишите приведенные ниже в таблице 4 результаты химического анализа подземной воды в виде формулы М.Г. Курлова. Определите вид жесткости и дайте наименование воды с учетом информации, полученной в результате химического анализа. Таблица 4 — Исходные данные к заданию 3
Пример решения задачи для варианта № 0 Теоретические суммы анионов и катионов, выраженные в мг-экв форме должны быть равны, поэтому для решения задачи необходимо пересчитать данные анализа из мг/л в мг-экв/л, используя пересчетные коэффициенты (приложение Б). Результаты вычислений записывают в таблицу 5 и суммируют содержание катионов и анионов. Далее выражают химический состав воды в % -экв форме. Таблица 5 – Химический состав подземных вод
Формула М.Г. Курлова представляет собой дробь (ложную), в числителе которой записывают анионный состав воды (в %-экв) в убывающем порядке, а в знаменателе- катионный. Запись ионов с содержанием менее 10 %-экв не производится. Перед дробью записывают содержание газов и специфических элементов, если они имеются в воде и общую минерализацию М в г/л, после дроби указывают температуру воды и дебит источника или скважины. Название воды записывают через черточку: сначала анионный, затем катионный составы. В данном случае формула имеет вид: М1,0 Общую жесткость определяют как сумму катионов кальция и магния, выраженных в мг-экв/л: 9,68+3,70=13,38 мг-экв/л. По этому показателю вода классифицируется как очень жесткая (приложение А). Учитывая общую минерализацию, химический состав, содержание ионов водорода (рН), температуру и вычисленную жесткость, окончательно дают воде наименование по приложению А. Вывод: вода пресная, гидрокарбонатная кальциево-натриево-магниевая, холодная, щелочная, очень жесткая. источник |
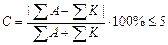

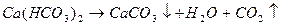
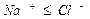
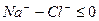
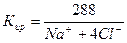
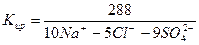
 | 7079 —
| 7079 —  или читать все.
или читать все. 
 рH; Т; Q,
рH; Т; Q, Найти: рН, наименование воды
Найти: рН, наименование воды tº12, pH 7,3
tº12, pH 7,3