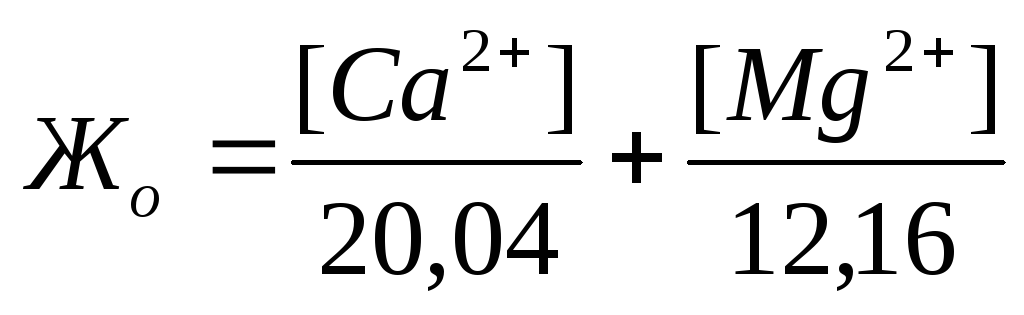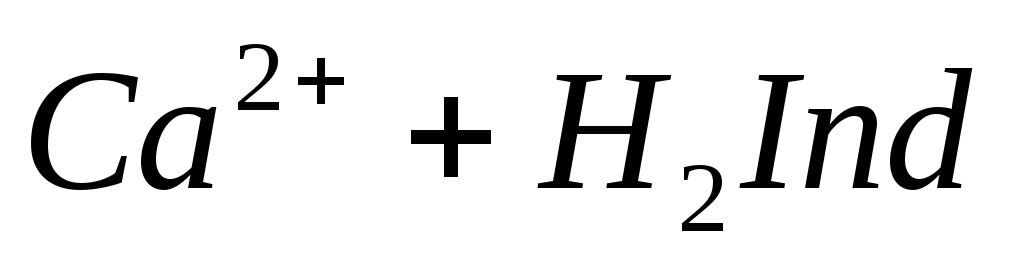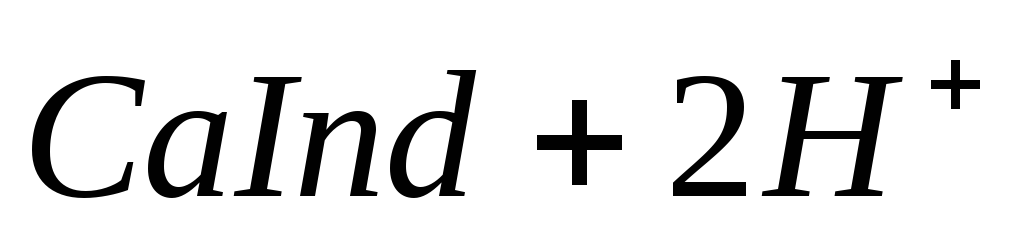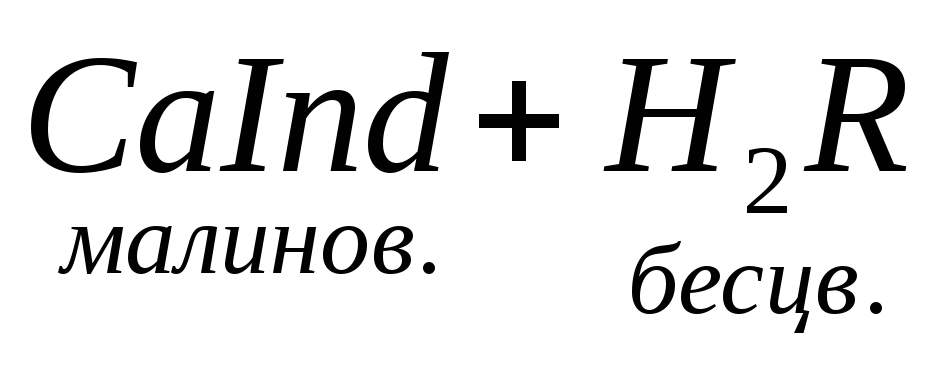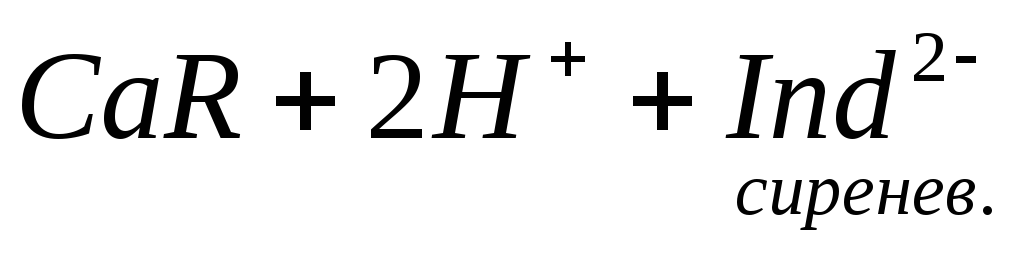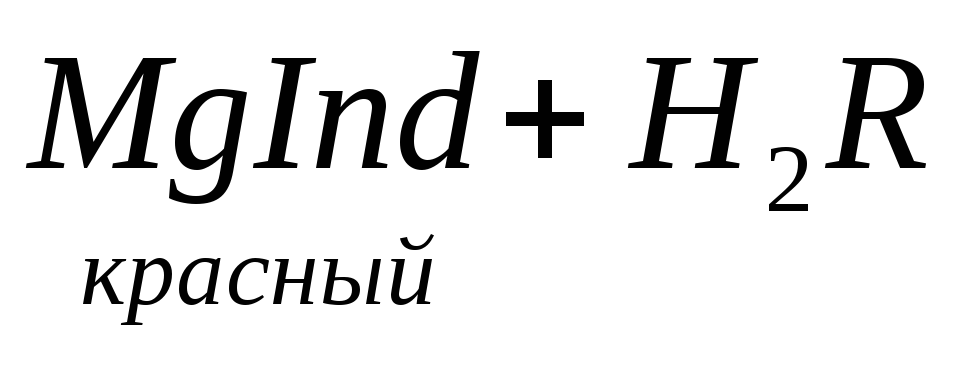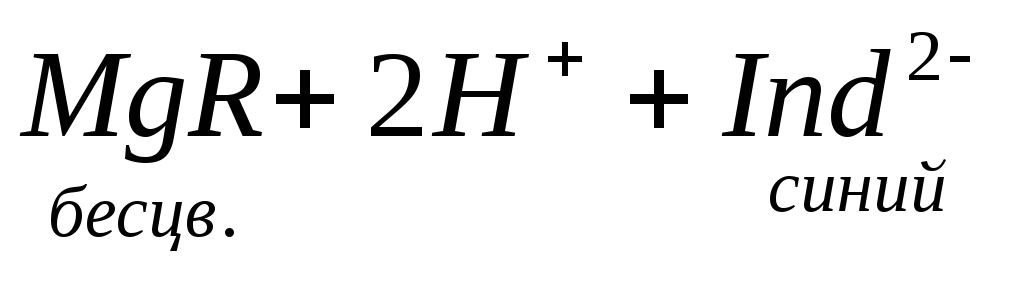Данная группа включает показатели, свойственные воде в ее естественном (природном) состоянии, характеризующие химический состав воды и определяемые, как правило, гидрохимическими методами. В число основных гидрохимических показателей качества воды входят: водородный показатель (рН), растворенный кислород, минерализация (анионы – карбонаты, гидрокарбонаты, сульфаты, хлориды; и катионы – кальций, магний, натрий и калий), сухой остаток, общая жесткость, биогенные элементы (нитраты, фосфаты, аммоний, нитриты), фториды, железо общее. Количественные данные по этим показателям занимают значительное место в совокупности данных о состоянии водного объекта и могут быть определены без серьезных трудностей полевыми и лабораторными методами, при соблюдении правил отбора и хранения проб.
Водородный показатель (рН). Содержание ионов водорода (гидроксония – H3O + ) в природных водах определяется в основном количественным соотношением концентраций угольной кислоты и ее ионов:
Для удобства выражения содержания водородных ионов была введена величина, представляющая собой логарифм их концентрации, взятый с обратным знаком:
Для поверхностных вод, содержащих небольшие количества диоксида углерода, характерна щелочная реакция. Изменения pH тесно связаны с процессами фотосинтеза (при потреблении CO2 водной растительностью высвобождаются ионы ОН — ). Источником ионов водорода являются также гумусовые кислоты, присутствующие в почвах. Гидролиз солей тяжелых металлов играет роль в тех случаях, когда в воду попадают значительные количества сульфатов железа, алюминия, меди и других металлов:
Значение pH в речных водах обычно варьирует в пределах 6,5–8,5, в атмосферных осадках 4,6–6,1, в болотах 5,5–6,0, в морских водах
7,9–8,3. Концентрация ионов водорода подвержена сезонным колебаниям. Зимой величина pH для большинства речных вод составляет 6,8–7,4, летом 7,4–8,2. Величина pH природных вод определяется в некоторой степени геологией водосборного бассейна.
В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого водопользования, воды водных объектов в зонах рекреации, а также воды водоемов рыбохозяйственного назначения величина pH не должна выходить за пределы интервала значений 6,5–8,5.
Величина pH воды – один из важнейших показателей качества вод. Величина концентрации ионов водорода имеет большое значение для химических и биологических процессов, происходящих в природных водах. От величины pH зависит развитие и жизнедеятельность водных растений, устойчивость различных форм миграции элементов, агрессивное действие воды на металлы и бетон. Величина pH воды также влияет на процессы превращения различных форм биогенных элементов, изменяет токсичность загрязняющих веществ.
В водоеме можно выделить несколько этапов процесса его закисления. На первом этапе рН практически не меняется (ионы бикарбоната успевают полностью нейтрализовать ионы Н + ). Так продолжается до тех пор, пока общая щелочность в водоеме не упадет примерно в 10 раз до величины менее 0,1 моль/дм 3 .
На втором этапе закисления водоема рН воды обычно не поднимается выше 5,5 в течение всего года. О таких водоемах говорят как об умеренно кислых. На этом этапе закисления происходят значительные изменения в видовом составе живых организмов.
На третьем этапе закисления водоема рН стабилизируется на значениях рН 8,5 (CO3 2- , S2 — , PO4 3- , SiO3 2- и др.);
2) слабые основания и анионы летучих и нелетучих слабых кислот (HCO3 — , H2PO4 — , CH3COO — , HS — , анионы гуминовых кислот и др.).
Щелочность обусловлена наличием в воде анионов слабых кислот (карбонатов, гидрокарбонатов, силикатов, боратов, сульфитов, гидросульфитов, сульфидов, гидросульфидов, анионов гуминовых кислот, фосфатов). Их сумма называется общей щелочностью. Ввиду незначительной концентрации трех последних ионов общая щелочность воды обычно определяется только анионами угольной кислоты (карбонатная щелочность). Анионы, гидролизуясь, образуют гидроксид-ионы:
Щелочность определяется количеством сильной кислоты, необходимой для нейтрализации 1 дм 3 воды. Щелочность большинства природных вод определяется только гидрокарбонатами кальция и магния, pH этих вод не превышает 8,3.
Определение щелочности полезно при дозировании химических веществ, необходимых на обработку вод для водоснабжения, а также при реагентной очистке некоторых сточных вод. Определение щелочности при избыточных концентрациях щелочноземельных металлов важно для установлении пригодности воды для ирригации. Вместе со значениями рН щелочность воды служит для расчета содержания карбонатов и баланса угольной кислоты в воде.
Щелочность пробы воды измеряется в г-экв/л или мг-экв/л и определяется количеством сильной кислоты (обычно используют соляную кислоту с концентрацией 0,05 или 0,1 г-экв/л), израсходованной на нейтрализацию раствора.
При нейтрализации до значений рН 8,0 – 8,2 в качестве индикатора используют фенолфталеин. Определяемая таким образом величина называется свободной щелочью. При нейтрализации до значений рН 4,2 – 4,5 в качестве индикатора используют метиловый оранжевый. Определяемая таким образом величина называется общей щелочностью. При рН 4,5 проба воды имеет нулевую щелочность.
источник
От каких факторов зависит качество поверхностных вод? Зачем нужен химический анализ состава вод суши, что он позволяет выявить. Что такое поверхностные воды, их классификация и особенности. Характеристика качества поверхностных вод. Очистка вод суши, различные методы, их преимущества и недостатки. Качество поверхностных вод напрямую связано с климатическими и геологическими особенностями региона. Химический анализ различных водоёмов позволяет выявить различные элементы и микроорганизмы, чтобы сделать выводы о пригодности данных вод для жизнедеятельности человека.
Поверхностными водами называются водотоки, собирающиеся на поверхности земли в крупные водоёмы. Все они делятся на:
- Озёрные водоёмы
- Речные воды
- Болотные скопления
- Морские водоёмы
Данные воды могут находиться в комплексе поверхностных водных объектов непостоянное время или на протяжении длительного промежутка времени (постоянно). В перечень водных объектов включаются болота, озёра, моря, реки и другие скопления воды. Вода в этих водоёмах может быть пресной или солёной.
Чистота поверхностных вод может быть разной. В процессе движения воды по суше она собирает и несёт в своих потоках различные минеральные элементы, части грунта и песка. Некоторые из частиц могут осесть на дно в процессе движения, некоторые растворятся, а другие попадут в большой водоём. Так во время прохождения потоком скалистой местности, различных препятствий и водопадов вода насыщается частицами кислорода. За счёт наличия различных органических и неорганических веществ, кислорода и при достаточном поступлении солнечного света в воде развивается и процветает множество форм жизни. Это простейшие, грибы, представители водной флоры, рыбы и ракообразные. За счёт опавшей с деревьев листвы в составе воды появляются ионообменные смолы.
Химический и физический состав поверхностной воды способен со временем меняться. А природные катаклизмы могут вызвать молниеносное изменение состава и чистоты таких вод. Поэтому так важно постоянно контролировать качество поверхностных вод.
Основное влияние на качество поверхностных вод оказывают такие факторы:
- Климатические изменения
- Геологические особенности
Точнее говоря, влияние оказывает не каждый фактор по отдельности, а их совокупность. Если говорить о климатическом факторе, то основное влияние оказывает частота и объём выпадающих осадков. Не менее важна и экологическая ситуация в данном районе. С дождевой водой водоёмы насыщаются нерастворёнными частицами пыли, пепла, микроорганизмами, растительной пыльцой, грибными спорами и различными бактериями. Не меньшее воздействие на состояние вод суши оказывает хозяйственная и промышленная деятельность человека. Так, атмосферные выбросы с различных предприятий попадают с осадками в воду. Это могут быть частицы серы и азота.
Среди геологических факторов можно назвать особенности русла рек, а именно то, какими породами оно образовано. Например, известняковое русло даёт прозрачную воду с высокой жёсткостью. А в русле, образованном непроницаемыми породами, образуется мягкая и мутная водная среда. Это связано с попаданием в водоток большого числа взвешенных частиц различного происхождения.
Анализ поверхностных вод позволяет выявить показатели из трёх разных групп:
- Ионные составляющие воды и общий уровень насыщения минералами. Уровень минерализации воды вычисляется по принципам «венецианской» экологической концепции, а ионные составляющие находятся по методике Алекина.
- Группа эколого-санитарных показателей, куда относятся насыщенность воды торфом и сапробность. В данном случае рассматриваются показатели, влияющие на биотические и абиотические составляющие жидкостных систем, а именно бактериологические, гидрофизические и гидрохимические показатели. Все они выполняют важные функции при жизнедеятельности системы. В группу гидрофизических показателей попадают такие характеристики воды, как цвет, мутность, количество взвешенных части. К гидрохимическим показателям можно отнести кислотность среды, насыщенность кислородом, концентрацию азотных содержаний и фосфорных включений, а также окисляемость среды. Гидробиологические показатели характеризуют способность системы к самозагрязнению и самоочищению, описывают биологическую активность колоний.
- Концентрация токсических веществ и радионуклеидных компонентов. Данный показатель характеризует наличие в водной среде элементов, поступающий с дренажных, промышленных, почвенных или бытовых загрязнителей. Также к данной группе относится загрязнение воды веществами техногенного происхождения, к которым можно отнести частицы фармакологических препаратов, ПАВы, отравляющие вещества, пестициды, углеводороды, цианиды и др.
Химический анализ поверхностных вод позволяет выявить различные загрязнения, которые должны быть удалены перед подачей воды в трубопроводы. Принципы очистки поверхностных вод подразумевают дезинфекцию с целью уничтожения всех опасных микроорганизмов, к которым относятся микроскопические водоросли, бактерии, вирусы.
Существует несколько методов очистки поверхностных вод:
- Окислительная методика (хлорирование)
- Облучение ультрафиолетом
Хлорирование воды – это самый недорогой метод очищения вод от вредных микроорганизмов. Конечно, для этого могут использоваться различные реагенты, но хлор наиболее доступный. Однако его вредность может изменить состав воды в худшую сторону. Более эффективным, менее опасным является обработка озоном, но цена такой процедуры будет намного выше.
Самым безопасным и эффективным способом очистки воды является её обработка ультрафиолетовыми лучами. За счёт попадания таких лучей в ядра клеток структура ДНК необратимо повреждается, чем вызывает нарушения в репродуктивной способности микроорганизмов.
Хотите оценить качество поверхностных вод? Такой химический анализ вы можете заказать в нашей лаборатории, позвонив по указанным на сайте телефонам.
источник
Требования, предъявляемые к качеству воды, могут быть самыми различными и определяются её целевым назначением. Для оценки качества пластовых, природных и сточных вод их образцы подвергают анализу. На основании результатов анализа делаются выводы о пригодности воды для конкретного вида потребления, возможности применения тех или иных методов очистки. Анализы подземных вод позволяют прогнозировать сопутствующие месторождения полезных ископаемых. При анализе вод для характеристики их свойств определяют химические, физические и бактериологические показатели. Основными показателями, определяющими пригодность воды для определенной отрасли народного хозяйства, являются химические, так как физические (содержание взвешенных частиц, температура, цвет, запах, плотность, сжимаемость, вязкость, поверхностное натяжение) и бактериологические (наличие бактерий) показатели зависят от химического состава воды.
К химическим показателям качества воды относятся:
состав растворенных газов.
Общее солесодержание характеризует присутствие в воде минеральных и органических примесей, количество этих примесей в виде общей минерализации, сухого и плотного остатков. Общая минерализация представляет собой сумму всех найденных в воде анализом катионов и анионов. Минерализацию выражают в миллиграмм-эквивалентах солей, находящихся в I л воды, или в процентах, то есть числом граммов растворенных веществ, содержащихся в 100 г раствора. Сухим остатком называется суммарное количество нелетучих веществ, присутствующих в воде во взвешенном, коллоидном и растворенном состоянии, выраженное в мг/л. Сухой остаток определяют путем выпаривания пробы воды, последующего высушивания при 105 о С и взвешивания. Плотный остаток – это сухой остаток, определенный из профильтрованной пробы воды. Следовательно, разница двух показателей соответствует содержанию взвешенных веществ пробы. Если сухой остаток прокалить при температуре 500-600 о С, то масса его уменьшится и получится остаток, называемый золой. Уменьшение массы происходит за счет сгорания органических веществ, удаления кристаллизационной воды, разложения карбонатов. Потери при прокаливании приближенно относят за счет органических примесей.
Жесткость воды обусловливается наличием в ней ионов Са 2+ и Mg 2+ . Для большинства производств жесткость воды является основным показателем её качества. В жесткой воде плохо пенится мыло. При нагревании и испарении жесткой воды образуется накипь на стенках паровых котлов, труб, теплообменных аппаратов, что ведет к перерасходу топлива, коррозии металлов и авариям.
Жесткость количественно выражается числом миллиграмм-эквивалентов ионов кальция и магния в 1 л воды (мг-экв/л); 1 мг-экв/л жесткости соответствует содержанию в воде 20,04 мг/л ионов Са 2+ или
12,16 мг/л ионов Mg 2 + . Различают жесткость общую, карбонатную и некарбонатную.
Карбонатная жесткость связана с присутствием в воде в основном гидрокарбонатов и карбонатов кальция и магния, которые при кипячении воды переходят в нерастворимые средние или основные соли и выпадают в виде плотного осадка:
Таким образом, при кипячении карбонатная жесткость устраняется. Поэтому она называется также временной жесткостью. Следует сказать, что при переходе HCO3 – в CO32 – и при выпадении карбонатов кальция и магния в воде остается некоторое количество ионов Са 2+ , Mg 2+ , CO32 – , соответствующее произведению растворимости СаСО3 и (MgOH)2CO3. В присутствии посторонних ионов растворимость этих соединений повышается.
Некарбонатная (постоянная) жесткость не разрушается кипячением. Она обусловливается присутствием в воде кальциевых и магниевых солей сильных кислот, главным образом сульфатов и хлоридов.
Общаяжесткость воды представляет собой сумму карбонатной и некарбонатной жесткости и обусловливается суммарным содержанием в воде растворенных солей кальция и магния. По величине общей жесткости принята следующая классификация природных вод:
Если известны концентрации (мг/л) в воде Ca 2+ , Mg 2+ и HCO3 – , то жесткость рассчитывается по следующим формулам:
Общая жесткость
Карбонатная жесткость равна концентрации (мг/л) [HCO3– ]; в случае, если содержание ионов кальция и магния в воде выше, чем количество гидрокарбонатов:
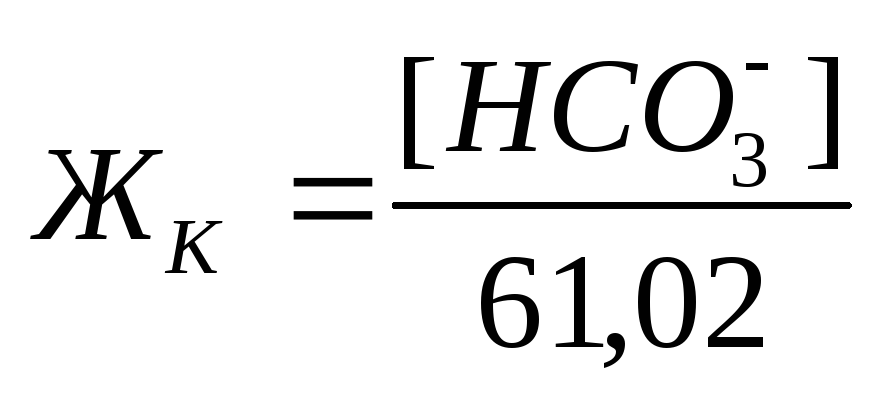
Если же количество гидрокарбонатов в воде превышает содержание ионов кальция и магния, то карбонатная жесткость соответствует общей жесткости. Разность между общей и карбонатной жесткостью составляет некарбонатную жесткость: ЖНК= ЖО– ЖК . Следовательно, ЖНК – это содержание Ca 2+ и Mg 2 + , эквивалентное концентрации всех остальных анионов, в том числе и некомпенсированных гидрокарбонатов.
Окисляемость характеризует содержание в воде восстановителей, к которым относятся органические и некоторые неорганические (сероводород, сульфиты, соединения двухвалентного железа и др.) вещества. Величина окисляемости определяется количеством затраченного окислителя и выражается числом миллиграммов кислорода, необходимого для окисления веществ, содержащихся в 1 л воды. Различают общую и частичную окисляемость. Общую окисляемость определяют обработкой воды сильным окислителем – бихроматом калия K2Cr2O7 или йодатом калия KIO3. Частичную окисляемость определяют по реакции с менее сильным окислителем – перманганатом калия КMnO4. По этой реакции окисляются только сравнительно легко окисляющиеся вещества.
Для полного окисления содержащихся в воде органических веществ, при котором происходят превращения по схеме
требуется количество кислорода (или окислителя в расчете на кислород), называемое химическим потреблением кислорода (ХПК) и выражаемое в мг/л.
При любом методе определения ХПК вместе с органическими веществами окисляются и неорганические восстановители, содержащиеся в пробе. Тогда содержание неорганических восстановителей в пробе определяют отдельно специальными методами и результаты этих определений вычитают из найденного значения ХПК.
Реакция среды характеризует степень кислотности или щелочности воды. Концентрация водородных ионов природных вод зависит главным образом от гидролиза солей, растворенных в воде, количества растворенных угольной кислоты и сероводорода, содержания различных органических кислот. Обычно для большинства природных вод величина рН изменяется в пределах 5,5-8,5. Постоянство рН природных вод обеспечивается наличием в ней буферных смесей. Изменение значения рН свидетельствует о загрязнении природной воды сточными водами.
Определение иона Cl – . В основу определения иона хлора положен аргентометрический метод Мора. Принцип анализа заключается в том, что при прибавлении к воде раствора AgNO3 образуется белый осадок хлорида серебра:
Определение хлорид-ионов ведут в интервале рН = 6,5 ÷ 10, чтобы одновременно с AgCl не выпадал осадок Ag2CO3. Проведению определения Сl – мешает наличие в воде ионов брома, йода, сероводорода, от которых освобождаются предварительной обработкой воды.
Определение иона SO42– . Метод определения сульфат-ионов основан на малой растворимости сульфата бария, количественно выпадающего в кислой среде при добавлении к воде раствора хлорида бария: Ba 2+ + SO42– = BaSO4↓
По массе образовавшегося осадка рассчитывают содержание иона SO42– .
Определение ионов CO32– и HCO3– . Эти ионы определяют титрованием пробы воды растворами серной или соляной кислот последовательно с индикаторами фенолфталеином и метилоранжем. Реакция нейтрализации протекает в две стадии.
Первые порции кислоты вступают в реакции с карбонат-ионом, образуя гидрокарбонат-ион:
Окраска фенолфталеина при рН = 8,4 переходит из розовой в бесцветную, что совпадает с таким состоянием раствора, когда в нем остаются лишь гидрокарбонаты. По количеству кислоты, пошедшей на титрование, рассчитывают содержание карбонат-иона. Расход кислот на титрование с фенолфталеином эквивалентен содержанию половины карбонатов, т.к. последние нейтрализуются только наполовину до HCO3 – . Поэтому общее количество CO32 – эквивалентно удвоенному количеству кислоты, затраченной на титрование. При дальнейшем титровании в присутствии метилоранжа происходит реакция нейтрализации гидрокарбонатов:
Метилоранж меняет окраску при pH = 4,3, т.е. в момент, когда в растворе остается только свободный диоксид углерода.
При расчете содержания ионов HCO3 – в воде следует из количества кислоты, пошедшей на титрование с метилоранжем, вычесть количество кислоты, идущей на титрование с фенолфталеином. Общее количество кислоты, затраченной на нейтрализацию ионов ОН – , СО32– и НСО3– , характеризует общую щелочность воды. Если рН воды ниже 4,3, то её щелочность равна нулю.
Определение ионов Ca 2+ , Mg 2+ . Имеется несколько методов обнаружения и определения содержания ионов Са 2+ и Mg 2+ . При добавлении в воду оксалата аммония (NH4)2C2O4 в случае присутствия ионов кальция образуется белый осадок оксалата кальция:
После отделения осадка оксалата кальция в воде можно определить ионы Mg 2+ с помощью раствора гидрофосфата натрия Na2HPO4 и аммиака. При наличии иона Mg 2 + образуется мелкокристаллический осадок соли магния:
Полученные осадки прокаливают и взвешивают. На основании полученных результатов вычисляется величина кальциевой и магниевой жесткости.
Наиболее быстрым и точным методом определения Са 2 + и Mg 2 + является комплексонометрический метод, основанный на способности двунатриевой соли этилендиаминотетрауксусной кислоты (трилон Б)
N
образовывать с ионами кальция и магния прочные комплексные соединения.
При титровании пробы воды трилоном Б происходит последовательное связывание в комплекс сначала ионов кальция, а затем ионов магния. Содержание ионов кальция определяют, титруя воду в присутствии индикатора — мурексида. Мурексид образует с ионами кальция малодиссоциированное комплексное соединение, окрашенное в малиновый цвет.
Ионы магния не дают комплекса с мурексидом. Трилон Б извлекает Са 2+ из его растворимого комплекса с мурексидом, вследствие чего окраска раствора, изменяется на сиреневую:
По количеству трилона Б, расходуемого на титрование, определяют содержание Са 2 + . Титрованием пробы воды трилоном Б в присутствии индикатора хромогена черного определяют суммарное содержание Са 2 + и Mg 2 + , то есть общую жесткость воды. Вода, содержащая Са 2 + и Mg 2 + , в присутствии хромогена черного окрашивается в красный цвет вследствие образования комплекса с Mg 2 + . При титровании воды в точке эквивалентности происходит изменение цвета на синий вследствие протекания следующей реакции:
Содержание Mg 2+ вычисляют по разности между общим содержанием (Са 2+ + Mg 2+ ) и содержанием Са 2 + . Трилонометрическое определение каждого иона производится при том значении рН, при котором этот ион образует с трилоном Б соединение более прочное, чем с индикатором. Для поддержания заданного значения рН к титруемому раствору добавляют буферные растворы. Кроме того, поддержание заданной величины рН обеспечивает определенную окраску индикатора. Общую жесткость воды определяют при рН > 9, кальциевую – при рН = 12.
Определение ионов Na + , K + . Производится вычислением по разности между суммой мг-экв найденных анионов и катионов, поскольку вода электронейтральна:
С достаточно высокой точностью все присутствующие в воде катионы можно определить эмиссионной спектроскопией сухого остатка.
Растворенные в воде газы определяют химическими методами или газовой хроматографией.
Определение диоксида углерода производят титрованием пробы воды щелочью в присутствии индикатора–фенолфталеина:
Определение растворенного кислорода производится йодометрическим методом.
Для анализа в пробу воды поcледовательно добавляют раствор хлорида марганца и щелочной раствор йодида калия. Метод основан на окислении свежеполученного гидроксида двухвалентного марганца содержащимся в воде кислородом:
Количество образовавшегося в воде бурого осадка гидроксида четырехвалентного марганца эквивалентно количеству растворенного кислорода. При последующем добавлении к пробе соляной или серной кислоты четырехвалентный марганец вновь восстанавливается до двухвалентного, окисляя при этом йодид калия. Это приводит к выделению свободного йода, эквивалентного содержанию четырехвалентного марганца, или, что то же самое, растворенного кислорода в пробе:
Выделившийся свободный йод определяется количественно путем титрования раствором тиосульфата натрия:
I2+ 2Na2S2O3
Йодометрический метод определения растворенного кислорода неприменим для вод, содержащих сероводород, так как сероводород вступает во взаимодействие с йодом и занижает результат. Во избежание этой ошибки предварительно связывают содержащийся в пробе сероводород в соединение, не препятствующее нормальному течению реакции. Для этой цели обычно используют хлорид ртути (II):
Определение H2S. Прежде чем приступить к количественному определению сероводорода, определяют его качественное присутствие по характерному запаху. Более объективным качественным показателем служат свинцовые индикаторные бумажки (фильтровальная бумага, пропитанная раствором ацетата свинца). При опускании в воду, содержащую сероводород, свинцовая бумага темнеет, принимая желтую (малое содержание), бурую (среднее содержание) или темно-коричневую (высокое содержание) окраску.
В водных растворах сероводород присутствует в трех формах: недиссоциированный H2S, в виде ионов HS – и S 2 – . Относительные концентрации этих форм в воде зависят от рН этой воды и в меньшей степени от температуры и общего солесодержания.
Если анализируемая вода не содержит веществ, реагирующих с иодом, то сероводород и его ионы можно определить следующим образом.
В основе количественного метода определения H2S лежит реакция окисления сероводорода йодом:
К точно отмеренному подкисленному раствору йода, взятого в избытке по отношению к ожидаемому содержанию сероводорода, прибавляют определенное количество воды. Количество йода, израсходованное на окисление сероводорода, определяется обратным титрованием остатка йода тиосульфатом. Разница между количеством раствора тиосульфата, соответствующим всему количеству взятого для анализа йода, и количеством этого же раствора, затраченного на титрование остатка йода в пробе, эквивалентна содержанию сероводорода в исследуемой пробе.
источник
Данная группа включает показатели, свойственные воде в ее естественном (природном) состоянии, характеризующие химический состав воды и определяемые, как правило, гидрохимическими методами. В число основных гидрохимических показателей качества воды входят: водородный показатель (рН), растворенный кислород, минерализация (анионы – карбонаты, гидрокарбонаты, сульфаты, хлориды; и катионы – кальций, магний, натрий и калий), сухой остаток, общая жесткость, биогенные элементы (нитраты, фосфаты, аммоний, нитриты), фториды, железо общее. Количественные данные по этим показателям занимают значительное место в совокупности данных о состоянии водного объекта и могут быть определены без серьезных трудностей полевыми и лабораторными методами, при соблюдении правил отбора и хранения проб.
Водородный показатель (рН). Содержание ионов водорода (гидроксония – H3O + ) в природных водах определяется в основном количественным соотношением концентраций угольной кислоты и ее ионов:
Для удобства выражения содержания водородных ионов была введена величина, представляющая собой логарифм их концентрации, взятый с обратным знаком:
Для поверхностных вод, содержащих небольшие количества диоксида углерода, характерна щелочная реакция. Изменения pH тесно связаны с процессами фотосинтеза (при потреблении CO2 водной растительностью высвобождаются ионы ОН — ). Источником ионов водорода являются также гумусовые кислоты, присутствующие в почвах. Гидролиз солей тяжелых металлов играет роль в тех случаях, когда в воду попадают значительные количества сульфатов железа, алюминия, меди и других металлов:
Значение pH в речных водах обычно варьирует в пределах 6,5–8,5, в атмосферных осадках 4,6–6,1, в болотах 5,5–6,0, в морских водах
7,9–8,3. Концентрация ионов водорода подвержена сезонным колебаниям. Зимой величина pH для большинства речных вод составляет 6,8–7,4, летом 7,4–8,2. Величина pH природных вод определяется в некоторой степени геологией водосборного бассейна.
В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого водопользования, воды водных объектов в зонах рекреации, а также воды водоемов рыбохозяйственного назначения величина pH не должна выходить за пределы интервала значений 6,5–8,5.
Величина pH воды – один из важнейших показателей качества вод. Величина концентрации ионов водорода имеет большое значение для химических и биологических процессов, происходящих в природных водах. От величины pH зависит развитие и жизнедеятельность водных растений, устойчивость различных форм миграции элементов, агрессивное действие воды на металлы и бетон. Величина pH воды также влияет на процессы превращения различных форм биогенных элементов, изменяет токсичность загрязняющих веществ.
В водоеме можно выделить несколько этапов процесса его закисления. На первом этапе рН практически не меняется (ионы бикарбоната успевают полностью нейтрализовать ионы Н + ). Так продолжается до тех пор, пока общая щелочность в водоеме не упадет примерно в 10 раз до величины менее 0,1 моль/дм 3 .
На втором этапе закисления водоема рН воды обычно не поднимается выше 5,5 в течение всего года. О таких водоемах говорят как об умеренно кислых. На этом этапе закисления происходят значительные изменения в видовом составе живых организмов.
На третьем этапе закисления водоема рН стабилизируется на значениях рН 8,5 (CO3 2- , S2 — , PO4 3- , SiO3 2- и др.);
2) слабые основания и анионы летучих и нелетучих слабых кислот (HCO3 — , H2PO4 — , CH3COO — , HS — , анионы гуминовых кислот и др.).
Щелочность обусловлена наличием в воде анионов слабых кислот (карбонатов, гидрокарбонатов, силикатов, боратов, сульфитов, гидросульфитов, сульфидов, гидросульфидов, анионов гуминовых кислот, фосфатов). Их сумма называется общей щелочностью. Ввиду незначительной концентрации трех последних ионов общая щелочность воды обычно определяется только анионами угольной кислоты (карбонатная щелочность). Анионы, гидролизуясь, образуют гидроксид-ионы:
Щелочность определяется количеством сильной кислоты, необходимой для нейтрализации 1 дм 3 воды. Щелочность большинства природных вод определяется только гидрокарбонатами кальция и магния, pH этих вод не превышает 8,3.
Определение щелочности полезно при дозировании химических веществ, необходимых на обработку вод для водоснабжения, а также при реагентной очистке некоторых сточных вод. Определение щелочности при избыточных концентрациях щелочноземельных металлов важно для установлении пригодности воды для ирригации. Вместе со значениями рН щелочность воды служит для расчета содержания карбонатов и баланса угольной кислоты в воде.
Щелочность пробы воды измеряется в г-экв/л или мг-экв/л и определяется количеством сильной кислоты (обычно используют соляную кислоту с концентрацией 0,05 или 0,1 г-экв/л), израсходованной на нейтрализацию раствора.
При нейтрализации до значений рН 8,0 – 8,2 в качестве индикатора используют фенолфталеин. Определяемая таким образом величина называется свободной щелочью. При нейтрализации до значений рН 4,2 – 4,5 в качестве индикатора используют метиловый оранжевый. Определяемая таким образом величина называется общей щелочностью. При рН 4,5 проба воды имеет нулевую щелочность.
источник
Тел: +7 (495) 728-94-19
Тел: +7 (963) 659-59-00
Москва, Олонецкий пр. д. 4/2
выполняем работы по г. Москве
и всей Московской области
Геология
Грунтовая лаборатория
Грунтовая лаборатория
Оснащенность лаборатории
Область аккредитации
Типы исследуемых грунтов
песчаные грунты
глины, суглинки, супеси
заторфованные грунты
техногенные грунты
Механические свойства грунтов
испытания грунтов на срез
компрессионные испытания
трехосное сжатие
свободное набухание
Физические свойства грунтов
гранулометрический состав
природная влажность
показатель текучести
предел пластичности
пористость, коэфф. пористости
определение плотности грунта
Химический анализ
химанализ водной вытяжки
коррозийная агрессивность
Библиотека
ООО «Буровики»:
Контакты
Рекомендательные письма
Допуски и Лицензии
Цены и сроки, прайс лист
Написать письмо
1 400 рублей за метр. Подробнее
Почему стоит заказать именно у нас
Грунтовые воды относятся к разновидностям подземных вод, которые залегают на водоупоре, расположенном ближе к поверхности. На территориях с влажным климатом происходит развитие интенсивных процессов инфильтрации, а также подземного стока, что приводит к выщелачиванию грунтов и горных пород. В некоторых случаях происходит излишнее их испарение, что приводит к засолению почвы. Поэтому стандартный анализ грунтовой воды, когда выполняются инженерно-геологические изыскания для проектирования зданий (сооружений), считается обязательным.
Стандартный анализ грунтовой воды выполняется в условиях лаборатории для получения показателей минерализации образца, его жесткости, агрессивности по отношению к различным материалам строительства (в первую очередь к стали, бетону и алюминиевым оболочкам кабелей), электропроводность и т.д. Минерализацией следует считать сумму всех минеральных веществ, которые растворены в грунтовой воде. Данный показатель получается методом выпаривания исследуемого образца. Следует различать такие степени минерализации грунтовых вод:
Жёсткость грунтовой воды определяется исходя из наличия ионов кальция и магния. Эти химические показатели важны при бурении скважин для поиска пресной воды населению. Также под застройку домов (коттеджей, сооружений) геология участка исследуется на показатель чистоты и безопасности для проживания в данной местности. А, как известно грунтовые воды являются главными показателями чистоты грунта.
Проводя инженерные изыскания на отводимом участке (площадке) важно учитывать фактор агрессивности грунтовых вод. Грунтовые воды могут оказывать разрушающий эффект для бетона и других строительных материалов. Для этого в условиях лаборатории стандартный анализ грунтовой воды выполняется также для получения показателя агрессивности. Агрессивность грунтовых вод бывает таких типов:
- выщелачивающая;
- общекислотная;
- сульфатная;
- магнезиальная;
- углекислотная
СП 11-105-97 Часть I. Общие правила производства работ Приложение Н (обязательное)
Показатели химического состава подземных и поверхностных вод
и методы их лабораторных определений при инженерно-геологических изысканиях
Показатели химического состава воды
Коррозионная активность воды к оболочкам кабелей
Метод испытания или обозначение государственного
стандарта на методы определения
температура в момент взятия пробы, °С
вкус и привкус при температуре 20 °С
Примечание — При проведении комплексных изысканий состав определяемых компонентов следует устанавливать с учетом требований СП 11-102-97
Результаты анализа грунтовой воды позволяет определить уровень ее рН. Если он пребывает ниже уровня нейтрального значения, которое составляет 7 единиц, то вода является кислотной. В таком случае она может разрушать бетон, вне зависимости от того, какого типа портландцемент использован в нем. Степень разрушения также зависит от вида и концентрации кислоты, возможности непрерывного обновления кислоты, скорости течения и давление грунтовой воды на бетон, расхода цемента, непроницаемости бетона и типа заполнителя.
Сама по себе величина рН является определяющим фактором вида или концентрации присутствующей кислоты, ведь это всего лишь мера степени кислотности. В качестве предварительных данных измерения рН очень полезны и позволяют получить представление о наличии или отсутствии кислот. Однако в большинстве случаев необходимым является проведение химического анализа, при котором определяется характер и концентрация кислоты. Как правило, кислотность естественных грунтовых вод, которые имеют низкий рН, вызвана органическими кислотами и растворенной углекислотой, а также, в отдельных случаях, сернистой и серной кислотой, которая поступает из соединений серы в торфяных грунтах. По мере увеличения интенсивности агрессивного воздействия можно повышать качество бетона, например, увеличивать расход цемента с более низким водоцементным отношением.
В зависимости от типа агрессивности грунтовых вод проектировщик принимает решения по выбору материала для строительства строения, а также глубины фундамента.
Анализ грунтовой воды необходим для получения детальной информации об участке исследований. Зная особенности данной жидкости можно своевременно предотвратить неприятные последствия: разрушение, усадка фундамента, трещины на здании, сезонное подтопление и т.д. Для этого проектировщики на первоначальных стадиях проектирования объекта планируют защитные мероприятия (дренажную систему), а также по возможности выбирают более подходящий для данной среды тип фундамента. Для зданий, не имеющих подвальных помещений и при высоком уровне грунтовых вод достаточно просто изолировать стены строения от влаги (не дать возможности поднятию уровня грунтовых вод по стенам). В некоторых случаях выполняют гидроизоляцию фундамента. В любом случае, необходимо учитывать тот факт, что грунтовые воды неблагоприятно влияют на строение в разные времена года (особенно зимой и во время таяния) и заранее принимать меры по их устранению.
источник
Анализ природных вод — очень широкое понятие, он может включать исследование различных видов вод: в водоемах, в грунте, из атмосферных осадков, из артезианских скважин. Состав показателей для анализа зависит от целей, для которых вам нужно проверить воду. Так, самым подробным является анализ воды, которая будет использоваться для питья, например, анализ родниковой воды.
Вода из родника обычно чистая: она выходит с большой глубины и к тому же естественным образом «фильтруется» через много слоев песка и грунта. Именно поэтому родниковая вода отлично подходит для питья. Также её используют в медицинских целях, на производстве, в строительстве, в сельском хозяйстве и т.д. Но вода из родника бывает пресной или, наоборот, с содержанием минеральных солей и различных примесей, а значит, она может не подойти для ваших целей.
Сделать анализ родниковой воды нужно, чтобы узнать ее состав и выяснить, сможете ли вы пользоваться ей.
Реки и озера являются отличным источником пресной воды. Её чаще всего применяют для полива сельскохозяйственных культур и в животноводстве, используют на разных производствах и для устройства зон отдыха (пляжей, курортов, кемпингов и т.п.). Однако водоемы могут загрязняться сточными водами, которые сбрасываются в них, отходами жизнедеятельности животных и человека, бытовыми отходами и др. Перед использованием речной и озерной воды её, как правило, нужно очистить. А чтобы знать, от чего требуется очищать и каким способом, нужно заказать анализ воды. С помощью такого исследования вы увидите, какие химические элементы, микроорганизмы и, возможно, радиоактивные элементы есть в воде.
В таблице ниже приведен перечень параметров исследования, из которого берутся те пункты, которые нужно проверить вам.
Следует отметить, что альфа-активность определяется в любой питьевой воде, а суммарная бета-активность может быть обнаружена только в природной воде. Она обусловлена распадом естественных и техногенных радионуклидов. При повышенной бета-радиоактивности воды необходимо делать расширенный ее радиохимический анализ (определение естественных и техногенных радионуклидов). По результатам этого анализа можно понять за счет каких именно радионуклидов вода становится бета-радиоактивной.
Закажите анализ природных вод в нашей лаборатории по доступной цене. Стоимость анализа рассчитывается по списку показателей, которые интересуют вас. Анализ природных вод проводят в том числе в рамках инженерно-экологических изысканий. За подробностями обращайтесь по телефону 8(351)735-97-17 (старший специалист Алена Михайловна). Срок изготовления заказа — 1-3 рабочих дня.
| ПОКАЗАТЕЛЬ | СТОИМОСТЬ |
| Органолептический анализ | |
| Вкус (привкус) | 70 |
| Запах | 70 |
| Цветность | 180 |
| Мутность (каол.) | 180 |
| Мутность (форм.) | 180 |
| Температура | 50 |
| Обобщенные показатели | |
| рН | 110 |
| Минерализация | 110 |
| Жесткость общая | 180 |
| Окисляемость перм | 130 |
| Окисляемость бихр | 130 |
| Нефтепродукты | 190 |
| АПАВ (СПАВ) | 180 |
| Щелочность | 150 |
| Фенолы | 190 |
| Неорганические вещества | |
| Алюминий | 180 |
| Аммоний | 180 |
| Барий | 240 |
| Бериллий | 240 |
| Бор | 240 |
| Ванадий | 240 |
| Висмут | 240 |
| Гидрокарбонаты | 150 |
| Гидросульфиды | 180 |
| Железо | 240 |
| Кадмий | 240 |
| Калий | 180 |
| Кальций | 130 |
| Карбонаты | 150 |
| Кобальт | 240 |
| Литий | 240 |
| Магний | 240 |
| Марганец | 236 |
| Медь | 180 |
| Молибден | 240 |
| Мышьяк | 240 |
| Натрий | 190 |
| Никель | 240 |
| Нитраты | 180 |
| Нитриты | 180 |
| Олово | 240 |
| Полифосфаты | 180 |
| Ртуть | 240 |
| Свинец | 240 |
| Селен | 240 |
| ПОКАЗАТЕЛЬ | СТОИМОСТЬ |
| Серебро | 240 |
| Сероводород | 180 |
| Стронций | 240 |
| Сульфаты | 180 |
| Сульфиды | 180 |
| Сурьма | 240 |
| Титан | 240 |
| Фосфаты | 180 |
| Фториды | 180 |
| Хлориды | 130 |
| Хром | 240 |
| Цианиды | 180 |
| Цинк | 240 |
| Органические вещества | |
| Бенз(а)пирен | 240 |
| Метанол | 300 |
| Полиакриламид | 240 |
| Формальдегид | 180 |
| Линдан (ГХЦГ) | 300 |
| ДДТ | 300 |
| ДДЭ | 300 |
| 2,4-Д | 300 |
| Бактериологический анализ | |
| ОМЧ | 210 |
| ОКБ | 235 |
| ТКБ | 210 |
| Колифаги | 210 |
| Клостридии | 210 |
| Синегнойная пал-ка | 210 |
| Паразитологический анализ | |
| Цисты лямблий | 330 |
| Яйца гельминтов | 330 |
| Радиологический анализ | |
| Альфа-активность | 510 |
| Бета-активность | 510 |
| ОА радона-222 | 260 |
| Стронций-90 | 535 |
| Цезий-137 | 535 |
| Плутоний-239 (240) | 1100 |
| Полоний-210 | 535 |
| Свинец-210 | 535 |
| Радий-226 (228) | 375 |
| Торий-232 (228 230) | 750 |
| Показатели водоподготовки | |
| Хлор свободный | 130 |
| Хлор связанный | 130 |
| Хлороформ | 300 |
| Озон остаточный | 100 |
Предназначен для измерения атмосферного давления в диапазоне от 80 до 106 кПа, Используется для контроля условий проведения лабораторных испытаний
Предназначены для взвешивания в пределах от 0,0001 г до 210 г. Используются для взвешивания сыпучих реактивов, навесок проб с точность до тысячных долей грамма .
Предназначены для взвешивания сыпучих реактивов, навесок проб с точность до сотых долей грамма в пределах от 0,5 г до 1500 г.
Предназначены для взвешивания сыпучих реактивов, навесок проб в пределах от 1 г до 500 г. Предел допускаемой погрешности 20 мг.
Предназначены для взвешивания сыпучих реактивов, навесок проб в диапазоне от 20 г до 2 кг с погрешностью 2 г.
Предназначены для взвешивания в пределах от 0,0001 г до 210 г. Используются для взвешивания сыпучих реактивов, навесок проб с точность до тысячных долей грамма .
Предназначен для измерения относительной влажности и температуры воздуха в диапазоне 20-90 % и 15-40 град С. Применяется для контроля микроклиматических условий проведения лабораторных испытаний
Предназначен для экспрессноых измерений проводимости растворов и анализа содержания солей в чистой воде (до 100мкСим/см) с автоматической температурной компенсацией как в лабораторных, так и в полевых условиях в диапазоне 0,1- 99,9 мкСим/см с точностью 2% от диапазона.
Используется в комплексе с экстрактором ЭЛ-1 и предназначен для экстракционного концентрирования и определения массовой концентрации нефтепродуктов в пробах питьевых, природных, сточных и очищенных сточных вод, в пробах почв и донных отложений, определения жиров в пробах природных и очищенных сточных вод, определения НПАВ в пробах питьевых, природных и сточных вод, определения суммы предельных и непредельных углеводородов в атмосферном воздухе и промышленных выбросах в атмосферу.
Дозаторы пипеточные предназначены для забора и точного дозирования малых объемов жидкостей с минимальной погрешностью (0,5-2%). При работе с дозаторами используются одноразовые наконечники из обесцвеченного полипропилена, который считается материалом свободным от контаминации.
Предназначен для измерения кислотности, окислительно-восстановительных потенциалов и температуры водных растворов. Измерения осуществляются с помощью измерительного преобразователя и набора электродов: электродов сравнения, комбинированных электродов, ионоселективных. Измерение активности ионов водорода осуществляется в пределах от 1 до 14 ед рН с точностью до 0,01 ед рН.
Предназначены для измерения коэффициента пропускания и оптической плотности биологических жидкостей с целью определения содержания растворенных в них компонентов, а также для измерения коэффициента пропускания и оптической плотности твердых и жидких проб различного происхождения.
Предназначен для измерения концентраций химический элементов в растворах путем измерений интенсивности эмиссионных линий при распылении анализируемого раствора в пламени. Используется для одновременного измерения концентраций в пробе кальция, калия, натрия и лития в диапазоне 0,5 -40 мг/л. Прибор автоматизирован и позволяет достигнуть высокой точности пр работе с малыми концентрациями искомых элементов — менее 2,5%.
Представляет собой аналитический комплекс функционально объединенных устройств, обеспечивающих разделение жидких смесей веществ методом высокоэффективной жидкостной хроматографии, детектирование с помощью двулучевого УФ-детектора, идентификацию и колическтвеный анализ компонентов.
Предназначен для сушки стеклянной, металлической посуды, чашек Петри, колб, лабораторных инструментов, термостойких порошков и других материало. Шкаф обеспечивает непрерывное поддержание температуры внутри рабочей камеры от 50 до 350 град С.
Центрифуга лабораторная предназначена для разделения суспензий, шламов, эмульсий на составляющие под действием центробежных сил. Центрифуга обеспечивает центрифугирование в диапазоне от 1000 до 8000 оборотов в минуту. Применяется для подготовки проб в соответсвии с методиками выполняемых измерений.
Термостат предназначен для получения и поддрежания внутри рабочей камеры стабильной температуры при проведении бактериологических и токсикологических испытаний в диапазоне от 3 до 40 град. С с погрешностью не более 0,5 град С. Время непрерывной автоматической работы составляет не менее 1000 часов.
Аквадистиллятор предназначен для получения высококачественной дистиллированной воды по принципу конденсации тщательно отсепарированного пара.
Применяются для взвешиваний с высокой точностью, а также для калибровки весов перед началом взвешиваний. Номинальные значения масс определены с точностью до 5-го знака после запятой.
Орбитальный шейкер является вспомогательным оборудованием, предназанченным для перемешивания жидкостей в лабораторной посуде в сответствии с используемой методикой выполнения измерений. Благодаря автоматическому перемешиванию обеспечивается необходимая степень контакта реагирующих веществ, более эффективны процессы экстракции, адсорции и др. Исключается человеческий фактор.
Роторный испаритель предназначен для проведения физико-химических процессов, сопряженных с быстрым удалением растворителей из растворов или суспензий органических и неорганических соединенйи путем пленочного испарения при нормальном и пониженном давлениях и контролируемых температурах.
Предназначен для измерения показателя активности (Ph, Px) и массовой (С) или полярной (Cm) концентрации ионов, окислительно-восстановительного потенциала (Eh), температуры (Т) и концентрации растворенного кислорода (О2) в воде и водных средах
Предназначен для измерения показателя (Ph, Px) и массовой (С) и молярной (Cm) концентрации ионов, окислительно-восстановительного потенциала (Eh), температуры (T) в воде и водных средах.
Предназначены для высокоточного статического взвешивания грузов в различных лабораториях
Предназначен для определения следовых количеств тяжелых металлов в почвах отходах, донных отложениях, водных растворах, пробах пищевых продуктов, пробах воздуха, промышленных выбросов, сточной, питьевой, природной водах.
Предназначена для перемешивания жидкостей с помощью магнитного якоря
Предназначен для измерения активности (pX, в том числе pH), концентрации ионов любой валентности, окислительно-восстановительного потенциала (Eh), а также температуры водных растворов.
источник