Присутствующие в воде органические соединения могут претерпевать не только аэробное биохимическое окисление в результате жизнедеятельности бактерий, используемое при определении БПК (см. раздел 6.2.5). При наличии в пробе воды сильных окислителей и соответствующих условий протекают химические реакции окисления органических веществ, причем характеристикой процесса химического окисления, а также мерой содержания в пробе органических веществ является потребление в реакции кислорода, химически связанного в окислителях. Показатель, характеризующий суммарное содержание в воде органических веществ по количеству израсходованного на окисление химически связанного кислорода, называется химическим потреблением кислорода (ХПК). Являясь интегральным (суммарным) показателем, ХПК в настоящее время считается одним из наиболее информативных показателей антропогенного загрязнения вод. Этот показатель, в том или ином варианте, используется повсеместно при контроле качества природных вод, исследовании сточных вод и др. Результаты определения окисляемости выражаются в миллиграммах потребленного кислорода на 1 л воды (мгО/л).
Однако не все органические вещества в равной степени участвуют в реакции химического окисления. Так же, как и при биохимическом окислении, при химическом окислении можно выделить группы легко, нормально и тяжело окисляющихся органических веществ. Поэтому всегда существует разница между теоретически возможным и практически достигаемым значениями ХПК.
Теоретическим значением ХПК (ХПКтеор) называют количество кислорода (или окислителя в пересчете на кислород) в мг/л, необходимое для полного окисления содержащихся в пробе органических веществ, т.е. всех способных окисляться элементов из состава органического соединения. При таком окислении углерод теоретически количественно окисляется до CO2, а сера и фосфор (если они присутствуют в соединении) – до SO3 и P2O5. Азот превращается в аммонийную соль; кислород, входивший в состав окисляемых органических молекул, является «строительным материалом» для образующихся продуктов окисления, а водород переходит в структуру H2O или аммонийной соли.
Например, при окислении синильной кислоты и гликоколя протекают реакции:
Практически используемые методы определения ХПК дают результаты, близкие к ХПКтеор, но всегда отклоняющиеся в ту или иную сторону. При наличии трудно окисляющихся органических веществ их окисление за время реакции проходит неполностью, и это приводит к занижению результата. В то же время, при наличии в пробе неорганических восстановителей, также потребляющих кислород на собственное окисление, результат получается завышенный. Совместное действие обоих факторов и вызывает отклонение реального ХПК от ХПКтеор.
Таким образом, окисляемость, или ХПК, характеризует общее количество содержащихся в воде восстановителей (органических и неорганических), реагирующих с сильными окислителями. В качестве таких окислителей обычно используют бихромат- и перманганат-анионы, и соответственно называются основные методы определения ХПК – бихроматный и перманганатный. Следует отметить, что результаты определения окисляемости одной и той же воды с помощью разных окислителей обычно неоднозначны из-за неодинаковой степени окисления веществ, присутствующих в воде. Результаты зависят также от свойств окислителя, его концентрации, температуры, рН, продолжительности окисления и др. Получаемые результаты сопоставимы только в том случае, когда точно соблюдены все условия проведения анализа.
Бихроматная окисляемость позволяет получить значение ХПК, наиболее приближенное к ХПКтеор, т.е. наиболее полное окисление достигается бихроматом калия. Поэтому определение бихроматной окисляемости является основным методом определения ХПК. Именно бихроматную окисляемость часто называют «химическим потреблением кислорода»*. В условиях этого метода большинство органических соединений окисляется на 95% и более, однако окисляются не все соединения (толуол, бензол, пиридин, парафин и др. практически не окисляются). Катализатором окисления является сульфат серебра, который добавляется в аналитическую рецептуру для ускорения реакции и повышения полноты окисления органических веществ. Избыток бихромата оттитровывается раствором соли Мора. Реакцию проводят в жестких условиях – в 50%-ной (18-нормальной, разбавление 1:1) серной кислоте при кипячении. Содержание неорганических восстановителей в пробе определяют отдельно специальными методами и вычитают из ХПК пробы.
Бихромат при этом восстанавливается согласно уравнению:
В таких условиях получаемый результат обычно составляет 95–98% от ХПКтеор.
На примере окисления фталата калия бихроматом реакцию можно записать следующим образом:
Из уравнения реакции следует, что на окисление 2 молекул фталата калия расходуется 16 молекул кислорода, связанного в бихромате. В весовом отношении ХПКтеор для 1 мг фталата калия составляет 1,175 мгО.
Значения ХПКтеор (в мг кислорода на 1 мг вещества) для разных соединений по данным [12] приведены в табл. 14.
Значения ХПКтеор для разных соединений
| Соединение | ХПКтеор , мгО/л |
| Щавелевая кислота | 0,18 |
| Синильная кислота | 0,59 |
| Гликоколь | 0,64 |
| Глюкоза | 1,07 |
| Уксусная кислота | 1,07 |
| Сахароза | 1,12 |
| Масляная кислота | 1,82 |
| Этанол | 2,09 |
| Додецилбензоат натрия | 2,34 |
| Фенол | 2,38 |
| Бутанол | 2,59 |
Бихроматная окисляемость определяется методом титрования. Соответствующие методики, с незначительными различиями, регламентированы как отечественными руководящими документами, так и международным стандартом ИСО 6060. Согласно методу титрования, избыток бихромата калия после операции окисления (уравнение реакции см. выше) оттитровывают солью Мора в присутствии индикатора, в качестве которого обычно используется ферроин – комплекс 1,10-фенатролина с сульфатом железа (II) (в качестве индикатора может быть также использована N-фенилантраниловая кислота). При этом катион Fe 2+ в титранте реагирует с катионом хрома:
Индикатор образует интенсивно окрашенное соединение с Fe 2+ , и бесцветное – с Fe 3+ . По этой причине, когда восстановление Cr 6+ до Cr 3+ завершено, Fe 2+ реагирует с индикатором с образованием ферроинового комплекса. При этом окраска раствора отчетливо изменяется от синевато-зеленой до красно-коричневой, что указывает момент окончания титрования. Момент окончания титрования может быть установлен также потенциометрически.
Для определения ХПК, наряду с окислением бихроматом, проводят также окисление перманганатом. Соответствующий показатель называется перманганатной окисляемостью (за рубежом также используют термин «перманганатный индекс»). Перманганатная окисляемость является мерой загрязнения воды окисляемыми органическими и неорганическими веществами, способными к окислению в условиях анализа, и такими условиями являются окисление 0,01 ммоль/л экв. раствором перманганата калия в сернокислой среде или кипячение в течении 10 мин.
Уравнение реакции при окислении пробы перманганатом можно записать следующим образом:
Для определения перманганатной окисляемости используется более простой метод, чем для бихроматной окисляемости, однако он имеет ограниченное применение. Так, определение перманганатной окисляемости может быть рекомендовано (и широко используется) лишь при анализе природных вод для контроля за динамикой содержания легкоокисляющихся веществ природного происхождения (например, гуминовых кислот). И это понятно, т.к. «жестко» окисляющиеся органические загрязнители, часто присутствующие в сточных водах, в природной воде практически не встречаются. Следует отметить также, что именно перманганатная окисляемость является единственным показателем ХПК, регламентирующим качество питьевой воды согласно СанПиН 2.1.4.559-96 (норматив составляет 5,0 мгО/л).
Перманганатная окисляемость может давать некорректные результаты при анализе сточных вод по следующим причинам:
перманганат – недостаточно сильный окислитель, поэтому окисление многих веществ проходит неполно или совсем не проходит;
при кипячении растворов, содержащих перманганат, последний разлагается до диоксида марганца и кислорода (как в кислой, так и в щелочной средах). Выпадающий диоксид марганца каталитически ускоряет процесс, однако в холостой пробе или относительно чистой воде этого не происходит. Процесс осложняется тем, что количество выпадающего диоксида марганца зависит от условий и состава анализируемой пробы.
Как уже отмечалось, в природных водах содержание трудно окисляющихся органических веществ обычно крайне мало, и результаты, получаемые при анализе природных вод бихроматным и перманганатным методами, практически достаточно близки.
Перманганатную окисляемость используют для оценки качества питьевой, водопроводной воды, природной воды источников водоснабжения и др. Ее определение предусмотрено ГОСТом 2761 при обследовании источников хозяйственно-питьевого водоснабжения. Более загрязненные поверхностные и сточные воды** также, с известным приближением, можно анализировать этим методом, однако их необходимо разбавлять. Перманганатную окисляемость нельзя рассматривать как меру теоретического потребления кислорода или общего содержания органических веществ в воде, т.к. ряд органических соединений в условиях этого метода окисляются лишь частично.
Таким образом, для характеристики ХПК как показателя химической активности пробы, традиционно используются методы «мокрой» химии. Тем не менее ХПК определяют также и «сухими» приборными методами. Например, методами сжигания органических веществ пробы в токе кислорода или СО2. Эти методы также позволяют получить результаты, близкие ХПКтеор, однако требуют приборного оснащения, а приборы – соответствующего обслуживания, поверки и т.п.
Мешающее влияние при определении ХПК оказывают, в первую очередь, хлорид-анионы, как правило, содержащиеся в природных и, особенно, в сточных водах. Хлориды окисляются в условиях анализа до элементарного хлора, поэтому при содержании в пробе в концентрации свыше 300 мг/л их влияние устраняется (или минимизируется) путем добавления сульфата ртути (II) в количестве 22,2 мг HgSO4 на 1 мг Cl – . Образующийся малодиссоциированный хлорид ртути (II) устойчив в присутствии большой концентрации серной кислоты и бихромата.
Определению также мешают нитриты, часто присутствующие в водах, прошедших биохимическую очистку. Для их устранения в пробу вводят по 10 мг сульфаминовой кислоты на 3 мг NO 2– . При кипячении раствора нитрит-анионы удаляются в виде азота, а избыток сульфаминовой кислоты переходит в сульфат аммония:
Помимо хлоридов и нитритов, определению мешают сульфиды, сероводород и железо (2). Все указанные соединения, при их присутствии в пробе, могут быть определены индивидуально, и результат анализа на окисляемость в таком случае уменьшают на величину потребления кислорода этими соединениями. В частности, 1 мг H2S соответствует 0,47 мгО, 1 мг NO 2– – 0,35 мгО, 1 мг Fe 2+ – 0,14 мгО.
Нормативы на ХПК в воде водоемов: для питьевой воды – 5,0 мгО/л (для перманганатной окисляемости), ХПН – 15 мгО/л; КБН – 30 мгО/л (для бихроматной окисляемости).
* Показатель ХПК по международной терминологии (англ.) называется «Сhemical oxyden demand» (COD). При этом имеется в виду исключительно бихроматная окисляемость.
** Для оценки загрязненности сточных вод органическими веществами используют обычно бихроматную окисляемость.
источник
Настоящий документ устанавливает методику количественного химического анализа проб природных и очищенных сточных вод для определения в них величины химического потребления кислорода (ХПК) при содержании органических веществ, эквивалентном потреблению молекулярного кислорода в диапазоне от 4,0 до 80,0 мг/дм 3 титриметрическим методом без концентрирования пробы.
При величине ХПК > 50 мг/дм 3 определение следует проводить при соответствующем разбавлении пробы дистиллированной водой.
Определению мешают хлориды, сульфиды, соединения железа(II), нитриты и другие неорганические вещества, способные окисляться бихроматом в кислой среде.
Мешающие влияния устраняют в соответствии с п. 10.
Титриметрический метод определения ХПК основан на окислении органических веществ избытком бихромата калия в растворе серной кислоты при нагревании в присутствии катализатора — сульфата серебра. Остаток бихромата калия находят титрованием раствором соли Мора и по разности определяют количество K 2 Cr 2 O 7 , израсходованное на окисление органических веществ.
Настоящая методика обеспечивает получение результатов анализа с погрешностью, не превышающей значений, приведённых в таблице 1.
Диапазон измерений, значения показателей точности, повторяемости, воспроизводимости
Показатель точности (границы относительной погрешности при вероятности Р = 0,95),
± d , %
Показатель повторяемости (относительное среднеквадратическое отклонение повторяемости),
s r, %
Показатель воспроизводимости (относительное среднеквадратическое отклонение воспроизводимости),
s R, %
Значения показателя точности методики используют при:
— оформлении результатов анализа, выдаваемых лабораторией;
— оценке деятельности лабораторий на качество проведения испытаний;
— оценке возможности использования результатов анализа при реализации методики в конкретной лаборатории.
Весы лабораторные общего назначения с наибольшим пределом
взвешивания 200 г и ценой наименьшего деления 0,1 мг любого типа
Весы лабораторные общего назначен ия с наибольш им пределом
взвешивания 200 г и ценой наименьшего деления 10 мг любого типа
СО с аттестованным содержанием ХПК с погрешностью не более 1 % при Р = 0,95
Цилиндры мерные или мензурки
Плитки электрические с закрытой спиралью и регулируемой
мощностью нагрева
Шкаф сушильный лабораторный с температурой нагрева до 130 °С
Стаканчики для взвешивания (бюксы)
Установки для определения ХПК в составе:
Колба К-1-250-29/32 ТС или колба Гр-250-29/32
Обратный холодильник ХПТ-2-400-29/32 ХС
Прибор вакуумного фильтрования ПВФ-35 или ПВФ-47
Средства измерений должны быть поверены в установленные сроки.
Допускается использование других, в том числе импортных, средств измерений и вспомогательных устройств с характеристиками не хуже, чем у приведенных в п.п. 4.1 и 4.2.
Бихромат калия (калий двухромовокислый)
N-фенилантраниловая кислота или
Бумага индикаторная универсальная
Фильтры мембранные Владипор типа МФАС-МА или МФАС-ОС-2 (0,45 мкм)
или фильтры бумажные обеззоленные «синяя лента»
Все реактивы, используемые для анализа, должны быть квалификации ч.д.а. или х.ч.
Допускается использование реактивов, изготовленных по другой нормативно-технической документации, в том числе импортных, с квалификацией не ниже ч.д.а.
5.1. При выполнении анализов необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007.
5.2. Электробезопасность при работе с электроустановками обеспечивается по ГОСТ 12.1.019.
5.3. Организация обучения работающих безопасности труда проводится по ГОСТ 12.0.004.
5.4. Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004 и иметь средства пожаротушения по ГОСТ 12.4.009.
Выполнение измерений может производить химик-аналитик, владеющий техникой титриметрического метода анализа.
При выполнении измерений в лаборатории должны быть соблюдены следующие условия:
· температура окружающего воздуха (22 ± 6) °С;
· атмосферное давление (84 — 106) кПа;
· относительная влажность не более 80 % при температуре 25 °С;
· частота переменного тока (50 ± 1) Гц;
· напряжение в сети (220 ± 22) В.
8.1. Отбор проб производится в соответствии с требованиями ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб».
8.2. Посуду, предназначенную для отбора и хранения проб, моют хромовой смесью, затем тщательно (не менее 10 раз) промывают водопроводной и ополаскивают дистиллированной водой.
8.3. Пробы воды отбирают в стеклянную посуду с пробками, не загрязняющими пробу органическими соединениями.
В зависимости от целей анализа определение ХПК можно проводить в нефильтрованной или фильтрованной пробе. В последнем случае пробу предварительно фильтруют через мембранный фильтр 0,45 мкм, очищенный двухкратным кипячением в дистиллированной воде. Допустимо использование бумажных фильтров «синяя лента», промытых дистиллированной водой. При фильтровании через любой фильтр первые порции фильтрата отбрасывают.
Объем отбираемой пробы должен быть не менее 100 см 3 .
8.4. Определение ХПК, особенно в загрязненных водах, следует проводить как можно скорее после отбора пробы. Допускается хранение пробы при температуре не выше 4 °С не более суток при консервации добавлением раствора серной кислоты (1:2) из расчета 2 см 3 на каждые 100 см 3 пробы воды.
8.5. При отборе проб составляется сопроводительный документ по утвержденной форме, в котором указывается:
— цель анализа, предполагаемые загрязнители;
— должность, фамилия отбирающего пробу, дата.
9.1. Приготовление растворов и реактивов
9.1.1. Раствор бихромата калия с концентрацией 0,25 моль/дм 3 эквивалента .
6,129 г бихромата калия, предварительно высушенного в течение 2 ч при 105 °С, количественно переносят его в мерную колбу вместимостью 500 см 3 , растворяют в дистиллированной воде, доводят до метки и перемешивают. Раствор устойчив при хранении в плотно закрытой темной склянке в течение 6 мес.
50 см 3 раствора бихромата калия с концентрацией 0,25 моль/дм 3 эквивалента помещают в мерную колбу вместимостью 500 см 3 и доводят объем раствора до метки дистиллированной водой. Хранят в склянке с притертой пробкой в темном месте не более 6 мес.
9.1.3. Раствор соли Мора с концентрацией 0,25 моль/дм 3 эквивалента.
49,0 г соли Мора переносят в мерную колбу вместимостью 500 см 3 , растворяют в дистиллированной воде, осторожно добавляют 10 см 3 концентрированной серной кислоты и после охлаждения доводят объем раствора до метки дистиллированной водой. Хранят в плотно закрытой посуде не более 6 мес.
50 см 3 раствора соли Мора с концентрацией 0,25 моль/дм 3 эквивалента помещают в мерную колбу вместимостью 500 см 3 и доводят объем раствора до метки дистиллированной водой. Хранят в плотно закрытой посуде не более 3 мес.
Точную концентрацию раствора устанавливают ежедневно или перед серией определений в соответствии с п. 10.2.
В качестве индикатора используют раствор N-фенилантраниловой кислоты или ферроина (комплекс сульфата железа(II) с 1,10-фенантролином).
Для приготовления раствора N -фенилантраниловой кислоты 0,25 г реактива растворяют в 12 см 3 раствора гидрооксида натрия (для ускорения процесса раствор можно слегка подогреть) и разбавляют дистиллированной водой до 250 см 3 .
Для приготовления раствора ферроина 2,43 г индикатора растворяют в 100 см 3 дистиллированной воды.
При приготовлении раствора ферроина на основе 1,10-фенантролина растворяют 0,980 г соли Мора ( NH 4 )2 Fe (SO 4 )2 · 6H 2 O в 100 см 3 дистиллированной воды, добавляют 2,085 г 1,10-фенантролина моногидрата или 2,93 г сульфата и перемешивают до растворения последнего.
Раствор индикатора хранят в плотно закрытой склянке из темного стекла не более 3 мес.
9.1.6. Раствор гидроксида натрия, 0,4 %.
0,4 г NaOH растворяют в 100 см 3 дистиллированной воды. Раствор устойчив при хранении в плотно закрытой полиэтиленовой посуде не более 2 мес.
9.1.7. Раствор сульфата серебра.
5,0 г Ag 2 SO 4 растворяют в 1 дм 3 концентрированной серной кислоты. Раствор устойчив в склянке из темного стекла в течение 6 мес.
9.2. Установление точной концентрации раствора соли Мора
Пипеткой вместимостью 10 см 3 отбирают 10 см 3 раствора бихромата калия с концентрацией 0,025 моль/дм 3 эквивалента (п. 9.1.2), переносят в коническую колбу, добавляют 180 см 3 дистиллированной воды и 20 см 3 концентрированной серной кислоты. После охлаждения добавляют в пробу 3 — 4 капли индикатора ферроина или 10 капель раствора N -фенилантраниловой кислоты и титруют раствором соли Мора с концентрацией 0,025 моль/дм 3 эквивалента (п. 9.1.4) до перехода окраски из синевато-зеленой в красно-коричневую при использовании в качестве индикатора ферроина и из красно-фиолетовой в синевато-зеленую при использовании N-фенилантраниловой кислоты.
Титрование повторяют и при отсутствии расхождения в объемах титранта более 0,05 см 3 за результат принимают среднее значение. В противном случае повторяют титрование до получения результатов, отличающихся не более, чем на 0,05 см 3 .
Точную концентрацию раствора соли Мора находят по формуле:
где С м — концентрация раствора соли Мора, моль/дм 3 эквивалента;
Сб — концентрация раствора бихромата калия, моль/дм 3 эквивалента;
V б — объем раствора бихромата калия, взятый для титрования, см 3 ;
V м — объем раствора соли Мора, пошедший на титрование см 3 .
Мешающее влияние хлоридов при концентрациях менее 300 мг/дм 3 устраняется за счет присутствия в пробе катализатора (сульфата серебра). При больших содержаниях хлоридов к пробе добавляют сульфат ртути (II) из расчета 100 мг на 10 мг хлоридов.
Мешающее влияние сульфидов и соединений железа (II) устраняют предварительной продувкой пробы воды воздухом, если она не содержит летучих органических соединений, или учитывают при расчете ХПК. В последнем случае определяют их концентрации и пересчитывают на величины ХПК, исходя из того, что 1 мг H 2 S и 1 мг Fe 2+ эквивалентны соответственно 0,47 и 0,14 мг O 2 . Таким же образом учитывают влияние нитритов (1 мг N О 2 эквивалентен 0,35 мг O 2 ).
Если концентрация хлоридов в пробе анализируемой воды составляет менее 300 мг/дм 3 , в колбу со шлифом установки для определения ХПК вносят с помощью пипетки 20 см 3 воды (или аликвоту, доведенную дистиллированной водой до 20 см 3 ), добавляют 10,0 см 3 раствора бихромата калия с концентрацией 0,025 моль/дм 3 эквивалента (п. 9.1.2) и 30 см 3 раствора сульфата серебра в концентрированной серной кислоте. Для равномерного кипения в колбу бросают 2 — 3 капилляра, присоединяют к ней обратный холодильник и кипятят содержимое на песчаной бане в течение 2 ч.
После охлаждения установки промывают холодильник дистиллированной водой (около 50 см 3 ), отсоединяют его, добавляют в колбу, обмывая ее стенки, еще 50 см 3 дистиллированной воды, вновь охлаждают, переносят пробу в коническую колбу, дважды споласкивая колбу, где кипятилась проба, дистиллированной водой (по 20 — 30 см 3 ). Добавляют 3 — 4 капли раствора ферроина (или 10 капель раствора фенилантраниловой кислоты) и титруют избыток непрореагировавшего бихромата калия раствором соли Мора (п. 9.1.4) до перехода окраски индикатора из синевато-зеленой в красно-коричневую при использовании в качестве индикатора ферроина и из красно-фиолетовой в синевато-зеленую при использовании N-фенилантраниловой кислоты.
Аналогичным образом проводят холостой опыт с 20 см 3 дистиллированной воды.
Если концентрация хлоридов в воде превышает 300 мг/дм 3 , к отобранной для анализа пробе (20 см 3 или меньшей аликвоте, доведенной до 20 см 3 дистиллированной водой) добавляют сульфат ртути из расчета 100 мг на каждые 10 мг содержащихся в пробе хлоридов и тщательно перемешивают. Далее выполняют определение, как описано в п. 11.1. Наличие небольшого количества осадка, образовавшегося после добавления сульфата ртути, не мешает определению.
12.1. Величину ХПК (бихроматной окисляемости) анализируемой пробы воды X находят по формуле:
где V мх — объем раствора соли Мора, израсходованный на титрование в холостом опыте, см 3 ;
V м — объем раствора соли Мора, израсходованный на титрование в пробы воды, см 3 ;
С м — концентрация раствора соли Мора, моль/дм 3 эквивалента;
V — объем пробы воды, взятый для определения, см 3 ;
8,0 — масса миллиграмм-эквивалента кислорода, мг.
Если величина ХПК в анализируемой пробе превышает верхнюю границу диапазона (80 мг/дм 3 ), разбавляют пробу с таким расчетом, чтобы величина ХПК входила в регламентированный диапазон, и выполняют определение в соответствии с п. 11.2.
В этом случае величину ХПК в анализируемой пробе воды X находят по формуле:
где Х V — величина ХПК в разбавленной пробе воды, мг/дм 3 ;
V V — объем пробы воды после разбавления, см 3 ;
v — объем аликвоты пробы воды, взятой для разбавления, см 3 .
12.2. Расхождение между результатами анализа, полученными в двух лабораториях, не должно превышать предела воспроизводимости. При выполнении этого условия приемлемы оба результата анализа, и в качестве окончательного может быть использовано их среднее арифметическое значение. Значения предела воспроизводимости приведены в таблице 2.
Значения предела воспроизводимости при вероятности Р = 0,95
Предел воспроизводимости (относительное значение допускаемого расхождения
между двумя результатами измерений, полученными в разных лабораториях), R, %
При превышении предела воспроизводимости могут быть использованы методы оценки приемлемости результатов анализа согласно раздела 5 ГОСТ Р ИСО 5725-6.
Результат анализа X в документах, предусматривающих его использование, может быть представлен в виде:
где D — показатель точности методики.
Значение D рассчитывают по формуле:
Значение d приведено в таблице 1.
Если проводилось разбавление пробы воды из-за превышения величины ХПК верхней границы диапазона, значение d выбирают из таблицы 1 для величины ХПК в разбавленной пробе воды Х V .
Допустимо результат анализа в документах, выдаваемых лабораторией, представлять в виде:
где Х — результат анализа, полученный в соответствии с прописью методики;
± D л — значение характеристики погрешности результатов анализа, установленное при реализации методики в лаборатории, и обеспечиваемое контролем стабильности результатов анализа.
Численные значения результата измерения должны оканчиваться цифрой того же разряда, что и значения характеристики погрешности.
Контроль качества результатов анализа при реализации методики в лаборатории предусматривает:
— оперативный контроль процедуры анализа (на основе оценки погрешности при реализации отдельно взятой контрольной процедуры);
— контроль стабильности результатов анализа (на основе контроля стабильности среднеквадратического отклонения повторяемости, среднеквадратического отклонения внутрилабораторной прецизионности, погрешности).
14.1. Алгоритм оперативного контроля процедуры анализа с использованием метода добавок
Оперативный контроль процедуры анализа проводят путем сравнения результата отдельно взятой контрольной процедуры К к с нормативом контроля К.
Результат контрольной процедуры К к рассчитывают по формуле:
где X ¢ — результат анализа величины ХПК в пробе с известной добавкой;
X — результат анализа величины ХПК в исходной пробе;
Норматив контроля К рассчитывают по формуле.
где D л,Х¢ , D л,Х — значения характеристики погрешности результатов анализа, установленные в лаборатории при реализации методики, соответствующие величине ХПК в пробе с известной добавкой и в исходной пробе соответственно.
Примечание. Допустимо характеристику погрешности результатов анализа при внедрении методики в лаборатории устанавливать на основе выражения: D л = 0,84 · D , с последующим уточнением по мере накопления информации в процессе контроля стабильности результатов анализа.
Процедуру анализа признают удовлетворительной, при выполнении условия:
При невыполнении условия (1) контрольную процедуру повторяют. При повторном невыполнении условия (1) выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
14.2. Алгоритм оперативного контроля процедуры анализа с применением образцов для контроля
Оперативный контроль процедуры анализа проводят путем сравнения результата отдельно взятой контрольной процедуры К к с нормативом контроля К.
Результат контрольной процедуры К к рассчитывают по формуле:
где Х к — результат анализа величины ХПК в образце для контроля;
С — аттестованное значение образца для контроля.
Норматив контроля К рассчитывают по формуле:
где ± D л — характеристика погрешности результатов анализа, соответствующая аттестованному значению образца для контроля.
Примечание. Допустимо характеристику погрешности результатов анализа при внедрении методики в лаборатории устанавливать на основе выражения: D л = 0,84 · D с последующим уточнением по мере накопления информации в процессе контроля стабильности результатов анализа.
Процедуру анализа признают удовлетворительной, при выполнении условия:
При невыполнении условия (2) контрольную процедуру повторяют. При повторном невыполнении условия (2) выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
Периодичность оперативного контроля процедуры анализа, а также реализуемые процедуры контроля стабильности результатов анализа регламентируют в Руководстве по качеству лаборатории.
источник
Для оценки загрязнения воды органическими соединениями используется величина БПК, однако, для определения БПК необходимо 5 суток, а иногда данные требуются гораздо быстрее. В этом случае вместо микроорганизмов для окисления органических веществ используют бихромат калия в присутствии серной кислоты (при нагревании). Эта смесь окисляет практически все органические вещества, содержащиеся в загрязненной воде. Величину, характеризующую содержание в воде органических веществ, окисляемых одним из сильных химических окислителей при определенных условиях, называют химическим потреблением кислорода (ХПК) или окисляемостью воды. ХПК выражается в миллиграммах кислорода, пошедшего на окисление веществ, содержащихся в 1 дм 3 воды.Метод определения – титриметрический.
В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого водопользования величина ХПК не должна превышать 15 мг О2/дм 3 ; в зонах рекреации в водных объектах допускается величина ХПК до 30 мг О2/дм 3 .
Растворенный кислород находится в природной воде в виде молекул O2. На его содержание в воде влияют две группы противоположно направленных процессов: одни увеличивают концентрацию кислорода, другие уменьшают ее. К первой группе процессов, обогащающих воду кислородом, следует отнести:
процесс абсорбции кислорода из атмосферы;
выделение кислорода водной растительностью в процессе фотосинтеза;
поступление в водоемы с дождевыми и снеговыми водами, которые обычно пересыщены кислородом.
Абсорбция кислорода из атмосферы происходит на поверхности водного объекта. Скорость этого процесса повышается с понижением температуры, с повышением давления и понижением минерализации. Аэрация – обогащение глубинных слоев воды кислородом – происходит в результате перемешивания водных масс, в том числе ветрового, вертикальной температурной циркуляции и т.д.
Выделение кислорода в результате фотосинтеза происходит при ассимиляции диоксида углерода водной растительностью (прикрепленными, плавающими растениями и фитопланктоном). Процесс фотосинтеза протекает тем сильнее, чем выше температура воды, интенсивность солнечного освещения и больше биогенных (питательных) веществ (P,Nи др.) в воде. Продуцирование кислорода происходит в поверхностном слое водоема, глубина которого зависит от прозрачности воды (для каждого водоема и сезона может быть различной, от нескольких сантиметров до нескольких десятков метров).
К группе процессов, уменьшающих содержание кислорода в воде, относятся реакции потребления его на окисление органических веществ: биологическое (дыхание организмов), биохимическое (дыхание бактерий, расход кислорода при разложении органических веществ) и химическое (окисление Fe 2+ ,Mn 2+ ,NO2— ,NH4+ ,CH4,H2S). Скорость потребления кислорода увеличивается с повышением температуры, количества бактерий и других водных организмов и веществ, подвергающихся химическому и биохимическому окислению. Кроме того, уменьшение содержания кислорода в воде может происходить вследствие выделения его в атмосферу из поверхностных слоев и только в том случае, если вода при данных температуре и давлении окажется пересыщенной кислородом.
В поверхностных водах содержание растворенного кислорода варьирует в широких пределах – от 0 до 14 мг/дм 3 – и подвержено сезонным и суточным колебаниям. Суточные колебания зависят от интенсивности процессов его продуцирования и потребления и могут достигать 2,5 мг/дм 3 растворенного кислорода. Дефицит кислорода чаще наблюдается в водных объектах с высокими концентрациями загрязняющих органических веществ и в эвтрофированных водоемах, содержащих большое количество биогенных и гумусовых веществ.
Концентрация кислорода определяет величину окислительно-восстановительного потенциала и в значительной мере направление и скорость процессов химического и биохимического окисления органических и неорганических соединений. Кислородный режим оказывает глубокое влияние на жизнь водоема. Минимальное содержание растворенного кислорода, обеспечивающее нормальное развитие рыб, составляет около 5 мг/дм 3 . Понижение его до 2 мг/дм 3 вызывает массовую гибель (замор) рыбы.
Содержание кислорода в водоемах с различной степенью загрязненности
Уровень загрязненности воды и класс качества
источник
Метод определения химического потребления кислорода
Water. Method for determination of chemical oxygen demand
МКС 13.060.50
ТН ВЭД 220100000
220110000
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2-2009 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены».
Сведения о стандарте
1 ПОДГОТОВЛЕН Обществом с ограниченной ответственностью «Протектор» совместно с группой компаний «Люмэкс»
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии (Техническим комитетом по стандартизации ТК 343 «Качество воды»)
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 15 ноября 2012 г. N 42)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97
Сокращенное наименование национального органа по стандартизации
Госстандарт Республики Казахстан
Госстандарт Республики Беларусь
4 Настоящий стандарт соответствует международному стандарту ISO 15705:2002* Water quality — Determination of the chemical oxygen demand index (ST-COD) — Small-scale sealed-tube method (Качество воды. Определение индекса химического потребления кислорода. Маломасштабный метод герметичных пробирок)
________________
* Доступ к международным и зарубежным документам, упомянутым здесь и далее по тексту, можно получить, перейдя по ссылке на сайт http://shop.cntd.ru. — Примечание изготовителя базы данных.
Степень соответствия — неэквивалентная (NEQ).
Настоящий стандарт подготовлен на основе применения ГОСТ Р 52708-2007 «Вода. Метод определения химического потребления кислорода»
5 Приказом Федерального агентства по техническому регулированию и метрологии от 29 ноября 2012 года N 1618-ст межгосударственный стандарт ГОСТ 31859-2012 введен в действие в качестве национального стандарта Российской Федерации с 1 января 2014 года.
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе «Национальные стандарты», а текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
Настоящий стандарт устанавливает метод определения химического потребления кислорода (далее — ХПК) в воде с использованием фотометрии. Метод распространяется на все типы воды (питьевые, природные, сточные) в диапазоне значений ХПК от 10 до 800 мгО/дм . Метод может быть использован для анализа проб воды с более высокими значениями ХПК при условии их разбавления, но не более чем в 100 раз.
К мешающим факторам при проведении определения относят наличие в пробе воды хлоридов при их содержании свыше 1000 мг/дм и марганца (II) при его содержании свыше 50 мг/дм . Мешающие факторы устраняют разбавлением пробы воды.
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:
ГОСТ 17.1.5.05-85 Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков
ГОСТ 1770-74 (ИСО 1042-83, ИСО 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 4204-77 Реактивы. Кислота серная. Технические условия
ГОСТ 4220-75 Реактивы. Калий двухромовокислый. Технические условия
ГОСТ ИСО 5725-6-2003 Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике*
________________
* В Российской Федерации действует ГОСТ Р ИСО 5725-6-2002 «Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике».
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 12026-76 Бумага фильтровальная лабораторная. Технические условия
ГОСТ ИСО/МЭК 17025-2009 Общие требования к компетентности испытательных и калибровочных лабораторий
ГОСТ 24104-2001 Весы лабораторные. Общие технические требования*
________________
* В Российской Федерации действует ГОСТ Р 53228-2008 «Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания».
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 29169-91 (ИСО 648-77) Посуда лабораторная стеклянная. Пипетки с одной отметкой
ГОСТ 29227-91 (ИСО 835-1-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
ГОСТ 30813-2002 Вода и водоподготовка. Термины и определения
ГОСТ 31861-2012 Вода. Общие требования к отбору проб
ГОСТ 31862-2012 Вода питьевая. Отбор проб
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя «Национальные стандарты» за текущий год. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
В настоящем стандарте применены термины по ГОСТ 30813 и следующий термин с соответствующим определением:
химическое потребление кислорода; ХПК: Количество кислорода, потребляемое при химическом окислении содержащихся в воде органических и неорганических веществ под действием различных окислителей.
[ГОСТ 27065-86, статья 29]Фотометр, спектрофотометр или фотометрический анализатор (далее — анализатор), снабженный адаптером для измерений оптической плотности воды и водных растворов, непосредственно находящихся в реакционных сосудах, в диапазоне длин волн от 400 до 700 нм.
Реакционные сосуды из термостойкого стекла (пробирки с завинчивающимися крышками вместимостью от 10 до 15 см ), предназначенные для обработки проб воды и измерений оптической плотности воды и водных растворов.
Нагревательный блок (термореактор), предназначенный для нагревания реакционных сосудов, обеспечивающий поддержание температуры содержимого реакционных сосудов (150±5) °С.
Перемешивающее устройство, например магнитная мешалка, эксикатор или ультразвуковая ванна.
Весы лабораторные по ГОСТ 24104 высокого или специального класса точности с ценой деления (дискретностью отсчета) 0,1 мг и наибольшим пределом взвешивания 220 г.
Колбы мерные по ГОСТ 1770 2-го класса точности вместимостью 25, 50, 1000 см .
Цилиндры мерные по ГОСТ 1770 2-го класса точности.
Стаканы химические термостойкие по ГОСТ 25336 вместимостью 1000 см .
Пипетки градуированные 2-го класса точности по ГОСТ 29227 или пипетки с одной отметкой 2-го класса точности по ГОСТ 29169, или дозаторы пипеточные с допускаемой предельной погрешностью дозирования ±5%.
Государственный (межгосударственный) стандартный образец (ГСО) бихроматной окисляемости с погрешностью аттестованного значения не более ±2%.
Вода дистиллированная по ГОСТ 6709.
Кислота серная по ГОСТ 4204, х.ч.
Сульфат ртути (II), х.ч. или ч.д.а.
Сульфат серебра, х.ч. или ч.д.а.
Калий двухромовокислый (бихромат калия) по ГОСТ 4220, х.ч. или стандарт-титр (фиксанал).
Бумага фильтровальная лабораторная по ГОСТ 12026.
Пробы воды отбирают по ГОСТ 31861, ГОСТ 31862, ГОСТ 17.1.5.05.
Для отбора, транспортирования и хранения проб воды используют емкости из стекла или полимерных материалов с навинчивающейся или пришлифованной пробкой. Емкости из полимерных материалов используют только для хранения замороженных проб воды при температуре минус 20 °С. Объем отбираемой пробы воды — не менее 100 см .
Отбор проб проводят в день выполнения анализа. Если пробы воды хранят до проведения анализа, то их подкисляют до рН меньше 2 разбавленной серной кислотой (см. 7.3.3), добавляя 10 см кислоты в расчете на 1000 см пробы. При этом пробы воды хранят при температуре от 2 °С до 8 °С не более 5 сут в защищенном от света месте.
Срок хранения замороженных до минус 20 °С проб воды — не более 1 мес.
Если проба содержит осадок, видимый невооруженным глазом, взвесь или нерастворенные органические вещества, например жиры, то перед отбором аликвотной порции пробы воды для обеспечения однородности, пробу интенсивно перемешивают, используя любое перемешивающее устройство (например магнитную мешалку, экстрактор или ультразвуковую ванну).
7.1 Подготовку анализатора к работе проводят в соответствии с руководством (инструкцией) по эксплуатации.
7.2 Подготовка реакционных сосудов
Из новой партии реакционных сосудов отбирают методом случайной выборки от 5% до 10% всего количества реакционных сосудов, но не менее трех штук. В каждый сосуд помещают по 5 см дистиллированной воды. Реакционный сосуд закрывают крышкой и проверяют на отсутствие видимых невооруженным глазом пузырьков воздуха в дистиллированной воде. При наличии пузырьков их удаляют легким постукиванием по стенке реакционного сосуда. Измеряют оптическую плотность дистиллированной воды в реакционном сосуде при длине волны 440 или 600 нм в зависимости от предполагаемого диапазона измерения значений ХПК (см. раздел 4).
Если измеренные значения оптической плотности дистиллированной воды в каждом реакционном сосуде отличаются не более чем на 0,01 единицы оптической плотности, то всю партию реакционных сосудов используют для проведения измерений ХПК.
Если измеренные значения оптической плотности дистиллированной воды в реакционных сосудах отличаются более чем на 0,01 единицы оптической плотности, то проводят сплошной контроль всей партии реакционных сосудов, отбирая для проведения измерений ХПК те из них, которые по значению оптической плотности отличаются друг от друга не более чем на 0,01 единицы оптической плотности.
Последующие проверки пригодности реакционных сосудов для измерений проводят с периодичностью не реже одного раза в месяц аналогично проверке новой партии реакционных сосудов.
7.3 Приготовление вспомогательных растворов
7.3.1 Раствор бихромата калия для измерения значений ХПК в диапазоне от 10 до 160 мгО/дм
Бихромат калия высушивают при (105±5) °С в течение 2 ч. Навеску 4,90 г высушенного бихромата калия растворяют в дистиллированной воде в мерной колбе вместимостью 1000 см и доводят объем раствора в колбе дистиллированной водой до метки. Молярная концентрация эквивалента бихромата калия составляет 0,1 моль/дм .
Допускается готовить раствор бихромата калия из стандарт-титра по прилагаемой к нему инструкции.
Срок хранения раствора — не более 6 мес.
7.3.2 Раствор бихромата калия для измерения значений ХПК в диапазоне от 80 до 800 мгО/дм
Бихромат калия высушивают при (105±5) °С в течение 2 ч. Навеску 24,52 г высушенного бихромата калия, растворяют в дистиллированной воде в мерной колбе вместимостью 1000 см и доводят объем раствора в колбе дистиллированной водой до метки. Молярная концентрация эквивалента бихромата калия составляет 0,5 моль/дм .
Допускается готовить раствор бихромата калия из стандарт-титра по прилагаемой к нему инструкции.
Срок хранения раствора — не более 6 мес.
7.3.3 Раствор серной кислоты молярной концентрации 4 моль/дм
В стеклянный стакан вместимостью 1000 см помещают около 700 см дистиллированной воды, осторожно добавляют при перемешивании 220 см концентрированной серной кислоты, охлаждают и доводят объем раствора в стакане дистиллированной водой до метки.
Срок хранения раствора — не более 12 мес.
7.3.4 Раствор серной кислоты молярной концентрации 1,8 моль/дм
В стеклянный стакан вместимостью 1000 см помещают 180 см дистиллированной воды, осторожно добавляют при перемешивании 20 см концентрированной серной кислоты.
Срок хранения раствора — не более 12 мес.
7.3.6 Раствор сульфата серебра в серной кислоте
Растворяют в стеклянной емкости 3,25 г сульфата серебра в 250 см концентрированной серной кислоты. Раствор перемешивают и оставляют в защищенном от света месте на 12 ч при комнатной температуре. Затем раствор вновь интенсивно перемешивают до полного растворения сульфата серебра.
Раствор хранят в емкости из темного стекла в условиях, исключающих воздействие прямых солнечных лучей, не более 12 мес.
7.3.7 Реагент для заполнения реакционных сосудов при измерении значений ХПК в диапазоне от 10 до 160 мгО/дм
Перед началом работы в реакционный сосуд пипеткой или дозатором вносят 0,5 см раствора бихромата калия (см. 7.3.1), осторожно добавляют 2,5 см раствора сульфата серебра (см. 7.3.6), затем 0,2 см раствора сульфата ртути (II) (см. 7.3.5). Допускается добавлять 0,05 г сухой соли сульфата ртути (II) вместо раствора сульфата ртути (II). Смесь осторожно перемешивают вращательными движениями или с использованием любого перемешивающего устройства, затем закрывают сосуд крышкой. Реакционные сосуды, заполненные реагентом, хранят в светонепроницаемой таре в защищенном от света месте при температуре от 2 °С до 8 °С.
Срок хранения заполненного реагентом реакционного сосуда — не более 12 мес. Содержимое реакционного сосуда перед применением перемешивают.
7.3.8 Реагент для заполнения реакционных сосудов при измерении значений ХПК в диапазоне от 80 до 800 мгО/дм
Реагент готовят по 7.3.7, используя раствор бихромата калия (см. 7.3.2).
Условия и срок хранения заполненного реагентом реакционного сосуда по 7.3.7. Содержимое реакционного сосуда перед применением перемешивают.
7.4 Приготовление градуировочных растворов
7.4.1 Приготовление основного раствора со значением ХПК 1000 мгО/дм
Основной раствор для измерения ХПК готовят из ГСО бихроматной окисляемости в соответствии с инструкцией по применению. Например при использовании ГСО бихроматной окисляемости с аттестованным значением ХПК 10000 мгО/дм , в мерную колбу вместимостью 50 см вносят мерной пипеткой 5 см ГСО бихроматной окисляемости и доводят объем в колбе дистиллированной водой до метки. Раствор стабилен в течение 1 мес при хранении в колбе с притертой пробкой при температуре от 2 °С до 8 °С.
7.4.2 Приготовление градуировочных растворов для диапазона значений ХПК от 10 до 160 мгО/дм
В мерные колбы вместимостью 50 см мерными пипетками вносят 0,5; 1,0; 2,0; 3,5; 5,0; 8,0 см основного раствора (см. 7.4.1) и доводят объемы в колбах дистиллированной водой до метки. Значения ХПК приготовленных растворов составляют соответственно 10; 20; 40; 70; 100; 160 мгО/дм . Растворы используют в день приготовления.
7.4.3 Приготовление градуировочных растворов для диапазона значений ХПК от 80 до 800 мгО/дм
В мерные колбы вместимостью 25 см мерными пипетками вносят 2; 5; 10; 20 см основного раствора (см. 7.4.1) и доводят объемы в колбах дистиллированной водой до метки. Значения ХПК приготовленных растворов составляют соответственно 80; 200; 400; 800 мгО/дм .
Растворы используют в день приготовления.
7.5 Градуировка анализатора
Градуировку анализатора проводят в соответствии с руководством (инструкцией) по эксплуатации с использованием градуировочных растворов (см. 7.4.2 и 7.4.3) в зависимости от диапазона измеряемых значений ХПК. В качестве нулевой пробы используют дистиллированную воду. Градуировочные растворы и нулевую пробу воды подготавливают к измерениям аналогично анализируемым пробам (см. 8.5-8.7), измеряют значения оптической плотности растворов в реакционных сосудах при длинах волн (см. раздел 4) и устанавливают градуировочную зависимость оптической плотности растворов от значения ХПК (градуировочная характеристика), используя программное обеспечение к анализатору и/или программное обеспечение, предназначенное для обработки градуировочных зависимостей. Градуировочную характеристику признают стабильной, если абсолютное значение коэффициента корреляции, установленное программным обеспечением, не менее 0,98. Если коэффициент корреляции менее 0,98, градуировку анализатора повторяют.
Контроль стабильности градуировочной характеристики проводят не реже одного раза в три месяца в соответствии с периодичностью, установленной в Руководстве по качеству лаборатории*, с использованием не менее двух заново приготовленных градуировочных растворов с различными значениями ХПК (см. 7.4.2 и 7.4.3). Контроль стабильности градуировочной характеристики проводят также при смене партии реагента.
* Документ не приводится. За дополнительной информацией обратитесь по ссылке. — Примечание изготовителя базы данных.
8.3 Проводят визуальный осмотр реакционных сосудов и их содержимого. При обнаружении в сосуде трещин, повреждений любого типа или признаков зеленой окраски раствора, реакционный сосуд не используют.
8.4 Включают нагревательный блок, нагревают его до 150 °С и выдерживают при этой температуре не менее 10 мин.
8.6 На реакционный сосуд плотно навинчивают крышку и перемешивают его содержимое, осторожно переворачивая несколько раз. Вытирают внешнюю поверхность реакционного сосуда фильтровальной бумагой. Помещают реакционный сосуд в нагревательный блок и выдерживают в течение (120±10) мин.
8.7 Осторожно, например специальными захватами, вынимают реакционные сосуды из нагревательного блока и охлаждают при комнатной температуре до температуры не выше 60 °С. Перемешивают содержимое, переворачивая реакционные сосуды. Затем охлаждают реакционные сосуды до комнатной температуры. Реакционные сосуды, в которых произошло визуально заметное уменьшение объема содержимого, для измерений не используют. Анализ пробы воды в этом случае повторяют (см. 8.1-8.6).
8.8 Если раствор после охлаждения прозрачен, то измеряют оптическую плотность пробы воды при рабочей длине волны 440 нм, используя реагент (см. 7.3.7), или при 600 нм, используя реагент (см. 7.3.8).
Если раствор мутный, то ему дают отстояться, затем измеряют его оптическую плотность как описано выше. Если после отстаивания раствор остается мутным, то анализ пробы воды повторяют, предварительно разбавив ее дистиллированной водой.
где — объем пробы воды после разбавления, см ;
— объем аликвотной порции пробы воды до разбавления (см. 8.1), см .
где — максимальное значение ХПК из двух параллельных определений (см. 9.1), мгО/дм ;
— минимальное значение ХПК из двух параллельных определений (см. 9.1), мгО/дм ;
— относительное значение предела повторяемости по таблице 1, %.
Таблица 1
источник

После активного участия в том или ином процессе промышленного толка сточная вода накапливает огромное количество вредных элементов, которые, при попадании в открытый водоем, приводят к гибели водных обитателей и растений, а также к другим неприятным последствиям.
Для измерения степени загрязненности стоков берут за основу некоторые показатели, один из которых – это ХПК. Что такое ХПК, и как снизить этот показатель, мы и расскажем в данном материале.
Объем загрязнения сточных вод можно выявить по ряду показателей, наиболее распространенные среди них – это:
- ХПК либо химическое потребление кислорода;
- БПК – это биохимическое его потребление.
Измерение такого показателя, как ХПК нужно затем, чтобы проанализировать качество сточной воды или жидкости в водоеме либо с целью исследования состояния вод в целом. ХПК – это количественный показатель, он относится к наиболее информативным и подробным.
В качестве загрязнителей сточных вод выступают такие вещества, как:

Окисляемость в зависимости от происхождения окислителей, бывает таких видов:
Самые точные показатели определяются путем применения бихроматного или йодатного метода. Окисляемость выражается в соотношении объема кислорода, который был потрачен на окисление минеральных и органических веществ. Она выражается в миллиграммах из расчета на 1 кв. дм. жидкости.
Очищать сточные воды необходимо с целью сокращения концентрации вредных веществ до нормальных показателей, которые утверждены в нормативных документах.
Очистка проводится на специальных очистных сооружениях или станциях. Их компоновка зависит от количества и качества сточной воды, а также уровня ее загрязнения. Однако схема обработки стоков будет одинаковой и главная цель работы – сократить показатели ХПК и БПК.
Значение ХПК включает в себя суммарное содержание в жидкости органических веществ в объеме израсходованного связанного кислорода на их окисление. ХПК – это общий показатель загрязнений промышленных и природных вод.
А вот такой показатель, как БПК определяет количество растворенного кислорода, который потрачен на окисление бактериями органических веществ в нужном объеме жидкости.
Для одинаковых проб по величине ХПК будет выше показателя БПК, поскольку больше веществ подвергается химическому окислению.

Эти вещества могут поступать в водоем следующим образом:
- вместе с атмосферными осадками;
- вместе с бытовыми или хозяйственными сточными водами;
- с подземными и поверхностными сточными водами.
Их структура и состав могут быть очень разными, в частности, которые из них могут быть устойчивыми по отношению к окислителям. В зависимости от этого фактора нужно выбирать наиболее эффективный окислитель для тех или иных веществ.
В поверхностных водах органические вещества могут иметь взвешенный, растворенный или коллоидный вид. Окисляемость отличается для фильтрованных и нефильтрованных проб. Природные же воды менее подвержены загрязнению органикой естественного происхождения.
Поверхностные воды имеют более высокую степень окисляемости по сравнению с такими типами вод, как:
Например, горные реки и озера имеют окисление в районе 2–3 мг на кубический дециметр, реки с болотным питанием – 20 мг/куб. дм и равнинные водоемы – от 5 до 12 соответственно.
Существенный фактор, который влияет на окисляемость – это сезонные изменения, происходящие в гидробиологическом и гидрологическом режимах.
Также окисляемость водоема может меняться под воздействием человеческой деятельности, в зависимости от сферы деятельности людей в водоем поступают загрязнения того или иного вида.
По нормативу показатели ХПК должны колебаться в пределах от 15 до 30 мг/ куб. дм. Степени загрязнения сточных вод согласно показателям ХПК выглядят так:
- очень чистые – до 2 мг/куб. дм;
- относительно чистые – 3 мг/куб. дм;
- средней загрязненности – 4 мг/куб. дм;
- загрязненные – 15 мг/куб дм. и выше.
Очистка сточных вод включает в себя такие стадии:
- первичная очистка – это удаление масляных пленок, крупных частей грязи и численных загрязнений, которые легко удаляются. Данная стадия предусматривает очистку физико-механическим способом;
- вторичная очистка. На данном этапе отделяют взвешенные части и загрязнители, которые содержатся даже в растворенном виде. Некоторые загрязнители имеют органическое происхождение и их нужно удалять с помощью биологического окисления. Данная стадия подразумевает биологический метод очистки сточных вод;
- третичная очистка – это удаление всех оставшихся мелких частиц и загрязнителей, включая соли металлов. Очистка осуществляется методом осмоса, электродиализа, фильтрования через адсорбент и т. д.;
- четвертая стадия – на данном этапе идет обезвоживание шлама, что сводит его объем и вес к минимуму.
Уровень ХПК и БПК постепенно сокращается до тех или иных значений на каждой из стадии, объем их сокращения зависит от особенностей сточных вод.
Далеко не всегда сточные воды очищаются во все четыре стадии. Очень часто очистные сооружения сбрасывают сточные воды в коллектор уже после первой стадии очистки, и это приводит показатели ХПК в норму. В некоторых странах очистка осуществляется только в два этапа, третий этап применяется лишь в крайнем случае.
Сточные воды могут иметь промышленное или бытовое происхождение, природа загрязнений в них тоже отличается. Так, как правило, бытовые стоки загрязнены такими вещами, как:
- мусор;
- органические остатки;
- моющие вещества.
А вот промышленные стоки наполняются отходами производства, если это пищевая промышленность, то там больше всего будет взвешенных веществ и жиров. Значения ХПК и БПК в промышленных стоках будут выше, чем в бытовых.
Иногда стоки объединяются, вследствие чего органика из бытовых сточных вод становится питательной средой для активного ила биоочистки.
Анализ такого показателя, как ХПК проводят, чтобы определить, сколько всего содержится эквивалентного бихромату кислорода, который пошел на окисление всех находящихся в пробе органических и неорганических веществ.
Как уже упоминалось ранее, такая величина, как ХПК, которая оценивает восстановительную активность химических веществ, будет больше БПК, значение которого зависит исключительно от количества органики, подверженной биохимическому разложению. Соотношение между этими двумя показателями отражает полноту биохимического окисления веществ, которые содержатся в сточных водах. Чем больше разница между этими показателями, тем больше прирост биологически активных масс. В частности, по этому соотношению можно определить, насколько пригодны сточные воды для биологической очистки.

Оптимальный диапазон соотношения БПК и ХПК – это от 0,4 и до 0, 75 единиц. Оптимальное значение для соотношения между химической и биологической потребностью в кислороде – это 0,7, при нем процесс биологической очистке сможет проходить полноценно и в полном объеме.
После того, когда сточные воды разделены гравитационным способом, из них удаляют преимущественно те вещества, которые трудно окислить. После этой стадии соотношение показателей увеличивается.
Затем следует стадия биологической очистки, вследствие которой соотношение показателей снижается на 0,2, поскольку в сточных водах исчезают органические вещества, подвергающиеся биохимическому окислению.
Также с целью оценки наличия в водах биологически разлагаемых частиц можно применять и обратное соотношение показателей. Например, согласно санитарным требованиям, которые подразумевают, что ХПК для сточных вод, пригодных к биоочистке, этот показатель не должен превышать показатель БПК более чем в полтора раза.
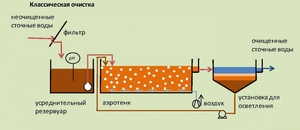
Как видите, значение ХПК позволит проанализировать состояние жидкости в водоемах и даст возможность выяснить, насколько эта она пригодна к очистке и в какой степени. Подробные исследования этого и прочих значений позволят сделать окружающую нас среду гораздо чище.
источник