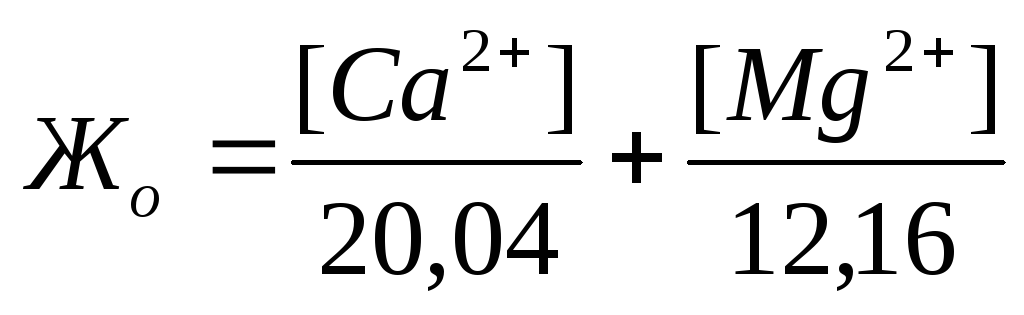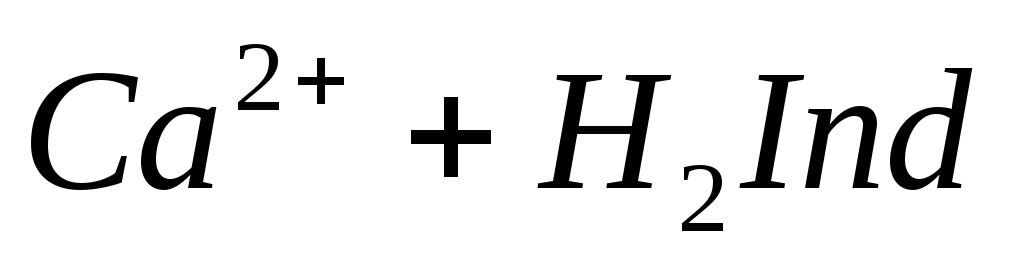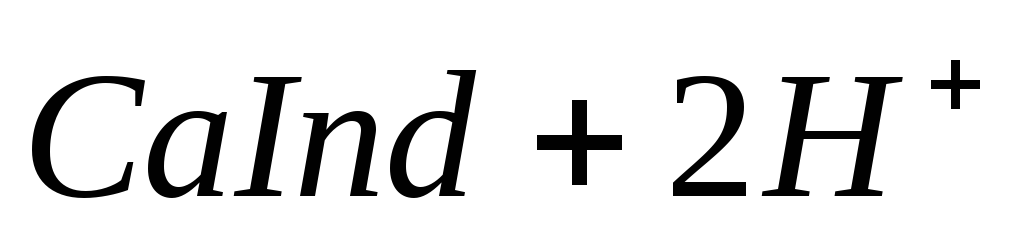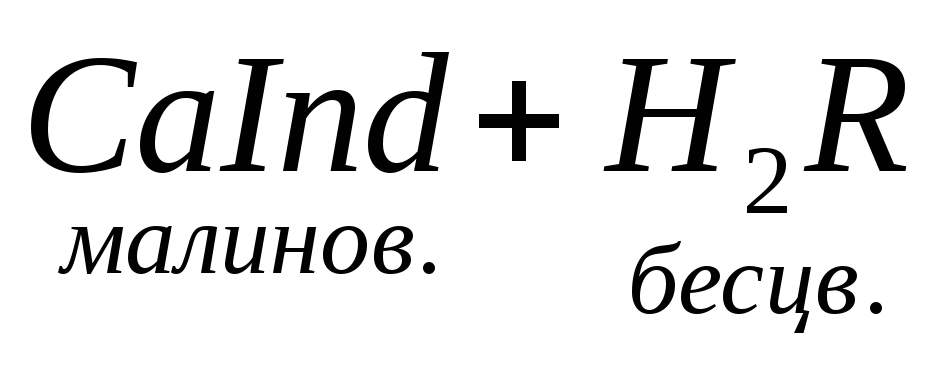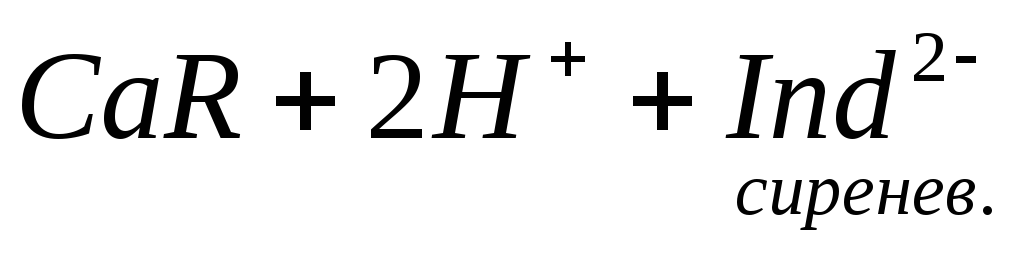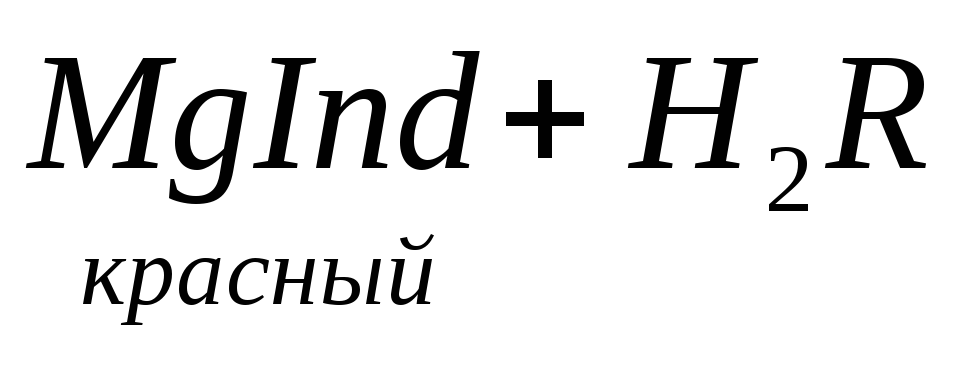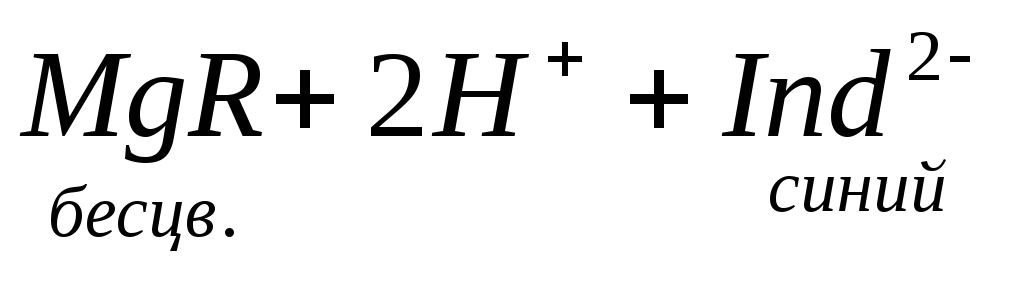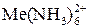Жёсткость – технологическая характеристика качества воды любого происхождения, связанная с содержанием растворимых в ней соединений кальция и магния. Она определят, в основном, потребительские качества воды и потому анализ воды на жесткость имеет важное хозяйственное значение. Общая жесткость определяется как суммарное содержание всех солей кальция и магния в растворе.
В разных странах существуют свои нормы жесткости для воды. У нас в стране вода классифицируется по жесткости таким образом: вода считается мягкой, если её жёсткость (Q) меньше 4 ммоль/л, средняя – 4-8, жёсткая – 8-12, очень жёсткая – свыше 12ммоль/л.
Рекомендованная единица СИ для измерения концентрации — моль на кубический метр (моль/м³), однако, на практике для измерения жёсткости используются градусы жёсткости и миллиграммы эквивалента на литр (мг-экв/л).
— Мягкая вода с жесткостью менее 3,0 мг-экв/л,
— Средней жесткости – 3,0-6,0 мг-экв/л
— Жесткая – более 6,0 мг-экв/мл.
В разных странах использовались (иногда используются до сих пор) различные внесистемные единицы — градусы жёсткости. По величине общей жёсткости различают воду мягкую (до 2 °Ж), средней жёсткости (2-10 °Ж) и жёсткую (более 10 °Ж).
Жёсткость воды поверхностных источников существенно колеблется в течение года; она максимальна в конце зимы, минимальна — в период паводка
Химический анализ воды показал, что существует два типа жесткости: временная и постоянная. Временная (карбонатная) жёсткость обусловлена наличием гидрокарбонатов кальция и магния (Ca(HCO3)2 , Mg(HCO3)2). Устраняется кипячением.Если в воде присутствуют ионы железа, то образуется FeCO3 — неустойчивое в воде вещество. В присутствии кислорода конечным продуктом цепочки реакций оказывается Fe(OH)3, представляющий собой темно-рыжий осадок. Поэтому, чем больше в воде железа, тем сильнее окраска у накипи, которая осаждается на стенках и дне сосуда при кипячении
Постоянная (некарбонатная) жёсткость обусловлена наличием хлоридов, сульфатов, нитратов и других анионов. Кипячением не устраняется. Для её устранения используют химические и физические способы.
Химический способ основан на переводе растворимых соединений кальция и магния в нерастворимые и удалением их при фильтровании.
. Физические способы основаны на применении ионообменных смол. Наиболее широко используется катионообменный способ, основанный на применении специальных реагентов – катионитов, которые загружаются в фильтры и при пропускании через них воды, заменяют катионы кальция и магния на катион натрия.
Лучшим реагентом для устранения общей жесткости воды является ортофосфат натрия Na3PO4, входящий в состав большинства препаратов бытового и промышленного назначения
Полностью очистить воду от солей жёсткости можно дистилляцией.
Анализ воды на жесткость в лаборатории производится комплексонометрическийм методом и методом нейтрализации.
Комплексонометрический метод основан на образовании устойчивых комплексонатов при взаимодействии ионов металлов с комплексоном III (метод комплексонометрии). В основе этого метода лежит титрование воды в присутствии аммонийного буферного раствора (pH=10,0) и индикатора хромогена чёрного раствором комплексона III до перехода винно-красной окраски в синюю.
Анализ проб воды на временную жесткость проводят, используя метод нейтрализации в основе, которого лежит титрование воды в присутствии индикатора метилового оранжевого раствором соляной кислоты до перехода жёлтой окраски индикатора в оранжевую. При добавлении кипячении карбонатная жесткость воды уменьшается на 57-70%.
Таким образом, можно определить общую и временную жесткость воды и частично снизить ее негативное воздействие на организм.
источник
Настоящий нормативный документ устанавливает пламенный атомно-абсорбционный метод определения массовых концентраций магния, кальция и стронция в питьевых, природных и сточных водах. Диапазоны определяемых концентраций указаны в таблице 1.
Мешающее влияние со стороны сопутствующих элементов: алюминия, кремния, титана, цинка, щелочных металлов, серной кислоты, фосфорной кислоты в воздушно-ацетиленовом пламени устраняют введением в анализируемые растворы хлорида лантана.
Блок-схема анализа приведена в Приложении 1.
Диапазоны определяемых концентраций
Диапазоны определяемых концентраций, мг/дм 3
Питьевая и природная вода
При соответствующем дальнейшем разбавлении возможен анализ проб с более высокими содержаниями кальция, магния и стронция.
Метод основан на измерении резонансного поглощения света свободными атомами магния, кальция или стронция при прохождении света через атомный пар исследуемого образца, образующийся в пламени.
Настоящая методика обеспечивает получение результатов анализа с погрешностями, не превышающими значений, приведенных в табл. 2.
3.1.1. Атомно-абсорбционный спектрометр с пламенным атомизатором.
3.1.2. Лампы с полым катодом на кальций, магний, стронций.
3.1.4. Государственные стандартные образцы (ГСО) состава водных растворов магния, кальция и стронция с относительной погрешностью аттестованных значений массовых концентраций не более 1 % при Р = 0,95.
3.1.5. Бидистиллятор стеклянный БС ТУ 25-11.1592 или установка для получения деионизированной воды (степень чистоты 2 по ГОСТ Р 52501).
3.1.6. Плитка электрическая по ГОСТ 14919 или баня песчаная, или микроволновая печь с закрытыми стаканами, например, MDS-2000 (СЕМ) или Mars 5 (СЕМ).
Примечание : Допускается использовать средства измерений и вспомогательное оборудование с метрологическими и техническими характеристиками не хуже, чем у вышеуказанных
Диапазон измеряемых концентраций, относительные показатели точности, правильности, повторяемости и воспроизводимости методики при доверительной вероятности Р = 0,95
Показатель повторяемости (относительное среднеквадратическое отклонение повторяемости), s r( d ), %
Показатель воспроизводимости (относительное среднеквадратическое отклонение воспроизводимости) s R( d ), %
Показатель правильности (границы относительной систематической погрешности при вероятности Р = 0,95) ± d c, %
Показатель точности (границы, в которых находится погрешность методики при Р = 0,95), ± d , %
3.2.1. Колбы мерные вместимостью 25, 50, 100, 1000 см 3 , по ГОСТ 1770, 2 класс точности.
3.2.2. Пипетки градуированные вместимостью 1, 2, 5, 10 см 3 , по ГОСТ 29227 или с одной меткой по ГОСТ 29169.
3.2.3. Цилиндры мерные наливные вместимостью 50, 100, 1000 см 3 , по ГОСТ 1770, 2 класс точности.
3.2.4. Стаканы химические термостойкие из боросиликатного стекла вместимостью 50, 100, 1000 см 3 , по ГОСТ 25336.
3.2.5. Полиэтиленовые емкости или емкости из боросиликатного стекла для хранения проб вместимостью 500 см 3 .
3.3.1. Фильтры мембранные с диаметром пор 0,45 мкм (тип МФА-МА по ТУ 6-05-1903) или 5 мкм, или аналогичные.
3.3.3. Ацетилен растворенный газообразный по ГОСТ 5457.
3.3.4. Фильтры обеззоленные «белая лента» по ТУ 6-09-1678.
3.3.5. Бумага индикаторная универсальная по ТУ 6-09-1181.
3.4.1. Лантан хлористый семиводный, LaCl 3 × 7H 2 O, х.ч., ТУ 6-09-4773.
3.4.2. Кислота соляная, конц. (d = 1,18 г/см 3 ), НСl, о.с.ч., ГОСТ 3118, или фиксаналы соляной кислоты с концентрацией 0,1 моль/дм 3 .
3.4.3. Кислота азотная, конц. (d = 1,42 г/см 3 ), HNO 3 , о.с.ч., ГОСТ 4461.
3.4.4. Вода дистиллированная по ГОСТ 6709 или вода для лабораторного анализа по ГОСТ Р 52501 (степень чистоты 2).
3.4.5. Перекись водорода 30 %, ос.ч., ТУ 2611-003-57856778.
4.1. При выполнении анализов необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007.
4.2. При работе с оборудованием необходимо соблюдать правила электробезопасности по ГОСТ 12.1.019.
4.3. Обучение работающих безопасности труда должно быть организовано в соответствии с ГОСТ 12.0.004.
4.4. Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004 и иметь средства пожаротушения по ГОСТ 12.4.009.
К выполнению измерений и обработке их результатов допускают лиц, имеющих высшее инженерно-химическое образование, владеющих методом атомно-абсорбционного анализа, знающих принцип действия, конструкцию и правила эксплуатации данного оборудования.
К выполнению работ по пробоподготовке допускают лиц, имеющих среднее специальное химическое образование, обученных методике подготовки проб.
При выполнении измерений в лаборатории должны быть соблюдены следующие условия:
относительная влажность воздуха
7.1. Отбор проб воды осуществляют в соответствии с ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб» и ГОСТ Р 51593-2000 «Отбор проб. Питьевая вода».
7.2. Пробы отбирают в емкости из полиэтилена или боросиликатного стекла. Требуемый объем пробы не менее 0,2 дм 3 .
7.3. При определении растворенных кальция, магния и стронция пробы воды фильтруют через мембранный фильтр 0,45 мкм и подкисляют азотной кислотой до рН
7.4. При определении общего содержания кальция, магния и стронция нефильтрованные пробы воды подкисляют концентрированной азотной кислотой до рН 3 кислоты на 1 дм 3 пробы). Срок хранения проб 1 месяц.
7.5. Срок хранения проб без консервации 2 суток.
7.6. При отборе проб составляется сопроводительный документ по утвержденной форме, в котором указывается:
— цель анализа, предполагаемые загрязнители;
— должность, фамилия отбирающего пробу, дата.
Подготовку спектрометра к работе проводят в соответствии с инструкцией по эксплуатации. Рекомендуемая длина волны для измерения кальция — 422,7 нм; для магния — 285,2 нм; для стронция — 460,7 нм.
Примечание : Условия определения элементов (длина волны, ширина щели, расход газов, скорость распыления раствора и др.) могут варьироваться в зависимости от модели спектрометра и версии используемого программного обеспечения.
8.2.1. Приготовление 1 % (v/v) раствора азотной кислоты
В мерную колбу вместимостью 1 дм 3 наливают 700 — 800 см 3 дистиллированной воды и осторожно приливают к ней 10 см 3 концентрированной азотной кислоты, отмеренные цилиндром. Объем раствора доводят до метки водой и перемешивают.
Срок хранения раствора 3 месяца при комнатной температуре.
0,1 моль/дм 3 раствора соляной кислоты
В мерную колбу вместимостью 1 дм 3 наливают 700 — 800 см 3 дистиллированной воды и осторожно приливают к ней 8 см 3 концентрированной соляной кислоты, доводят объем до метки дистиллированной водой и тщательно перемешивают.
При использовании фиксаналов соляной кислоты в мерную колбу вместимостью 1 дм 3 наливают 700 — 800 см 3 дистиллированной воды и в колбу количественно переносят содержимое ампулы, доводят до метки дистиллированной водой и тщательно перемешивают.
Срок хранения раствора 3 месяца.
8.2.3. Приготовление спектроскопического буферного раствора
250 г хлористого лантана растворяют в 500 — 600 см 3 0,1 моль/дм 3 раствора НСl, переносят в мерную колбу вместимостью 1 дм 3 , доводят до метки 0,1 моль/дм 3 раствором НСl.
В закрытом стеклянном сосуде раствор устойчив в течение 3 месяцев.
8.2.4. Приготовление градуировочных растворов кальция
10 см 3 стандартного раствора кальция ГСО (С = 1 мг/см 3 ) с помощью пипетки переносят в мерную колбу вместимостью 100 см 3 . Доводят до метки 1 % (v/v) раствором азотной кислоты и перемешивают. Полученный основной градуировочный раствор содержит 0,1 мг/см 3 кальция. Срок хранения раствора 2 месяца при температуре 2 — 10 °С или 14 суток при комнатной температуре.
10 см 3 основного градуировочного раствора с помощью пипетки переносят в мерную колбу вместимостью 100 см 3 и доводят объем до метки 1 % (v/v) раствором азотной кислоты (промежуточный раствор). Концентрация кальция в полученном растворе 10 мг/дм 3 . Срок хранения раствора 1 месяц при температуре 2 — 10 °С или 14 суток при комнатной температуре.
Градуировочные растворы кальция готовят в соответствии с таблицами 3 и 4, добавляя в мерные колбы по 5 см 3 раствора соли лантана перед доведением объема до метки 1 % (v/v) раствором азотной кислоты. Срок хранения растворов 1 месяц при температуре 2 — 10 °С или 14 суток при комнатной температуре.
8.2.5. Приготовление градуировочных растворов магния
10 см 3 стандартного раствора магния ГСО (С = 1 мг/см 3 ) с помощью пипетки переносят в мерную колбу вместимостью 100 см 3 . Доводят объем до метки 1 % (v/v) раствором азотной кислоты и перемешивают. Полученный основной градуировочный раствор содержит 0,1 мг/см 3 магния. Срок хранения раствора 2 месяца при температуре 2 — 10 °С или 14 суток при комнатной температуре.
10 см 3 основного градуировочного раствора с помощью пипетки переносят в мерную колбу вместимостью 100 см 3 и доводят объем до метки 1 % (v/v) раствором азотной кислоты (промежуточный раствор). Концентрация магния в полученном растворе 10 мг/дм 3 . Срок хранения раствора 1 месяц при температуре 2 — 10 °С или 14 суток при комнатной температуре.
Градуировочные растворы магния готовят в соответствии с таблицами 5 и 6, добавляя в мерные колбы по 5 см 3 раствора соли лантана перед доведением объема до метки 1 % (v/v) раствором азотной кислоты. Срок хранения растворов 1 месяц при температуре 2 — 10 °С или 14 суток при комнатной температуре.
8.2.6. Приготовление градуировочных растворов стронция
10 см 3 стандартного раствора стронция ГСО (С = 1 мг/см 3 ) с помощью пипетки переносят в мерную колбу вместимостью 100 см 3 . Доводят объем до метки 1 % (v/v) раствором азотной кислоты и перемешивают. Полученный основной градуировочный раствор содержит 0,1 мг/см 3 стронция. Срок хранения раствора 2 месяца при температуре 2 — 10 °С или 14 суток при комнатной температуре.
10 см 3 основного градуировочного раствора с помощью пипетки переносят в мерную колбу вместимостью 100 см 3 и доводят объем до метки 1 % (v/v) раствором азотной кислоты (промежуточный раствор). Концентрация стронция в полученном растворе 10 мг/дм 3 . Срок хранения раствора 1 месяц при температуре 2 — 10 °С или 14 суток при комнатной температуре.
Градуировочные растворы стронция готовят в соответствии с таблицей 7, добавляя в мерные колбы по 0,5 см 3 раствора соли лантана перед доведением объема до метки 1 % (v/v) раствором азотной кислоты. Срок хранения растворов 1 месяц при температуре 2 — 10 °С или 14 суток при комнатной температуре.
Распыляют градуировочные растворы в пламени горелки и регистрируют поглощение каждого элемента при требуемой длине волны.
Оптическую плотность градуировочных растворов измеряют в порядке возрастания массовой концентрации определяемого элемента.
Градуировочную характеристику, выражающую зависимость показаний прибора от количества определяемого элемента (мг/дм 3 ), устанавливают по среднеарифметическим результатам трех измерений для каждой точки за вычетом среднеарифметического результата трех измерений холостой пробы. Для установления градуировочной характеристики используют не менее 5 точек. Холостой пробой является 1 % раствор азотной кислоты, к которому добавляют такое же количество спектроскопического буфера, как и в градуировочные растворы.
Через каждые десять проб повторяют измерение одного из градуировочных растворов. Если измеренная концентрация этого градуировочного раствора отличается от истинной более, чем на 8 %, градуировку повторяют полностью.
Приготовление шкалы градуировочных растворов кальция
(используется при анализе проб питьевых, природных и сточных вод)
Объем основного раствора кальция (100 мг/дм 3 ), см 3
Объем промежуточного раствора кальция, (10 мг/дм 3 ), см 3
Концентрация градуировочного раствора кальция, мг/дм 3
Приготовление шкалы градуировочных растворов кальция
(используется при анализе проб дистиллированной или деионизированной воды)
Объем промежуточного раствора кальция, (10 мг/дм 3 ), см 3
Концентрация градуировочного раствора кальция, мг/дм 3
Приготовление шкалы градуировочных растворов магния
(используется при анализе проб питьевых, природных и сточных вод)
Объем промежуточного раствора магния, (10 мг/дм 3 ), см 3
Объем раствора магния с концентрацией 1 мг/дм 3 , см 3
Концентрация градуировочного раствора магния, мг/дм 3
Приготовление шкалы градуировочных растворов магния
(используется при анализе проб дистиллированной или деионизированной воды)
Объем промежуточного раствора магния, (10 мг/дм 3 ), см 3
Объем раствора магния с концентрацией 1 мг/дм 3 , см 3
Концентрация градуировочного раствора магния, мг/дм 3
Приготовление шкалы градуировочных растворов стронция
Объем промежуточного раствора стронция, (10 мг/дм 3 ), см 3
Концентрация градуировочного раствора стронция, мг/дм 3
При определении растворенных металлов пробу воды фильтруют через мембранный фильтр с диаметром пор 0,45 мкм. Фильтрат подкисляют концентрированной азотной кислотой до рН = 2 — 3. К 50 см 3 фильтрата добавляют 2,5 см 3 конц. азотной кислоты и в полученном растворе определяют содержание металлов.
При определении взвешенных (суспендированных) форм металлов хорошо перемешанную пробу воды определенного объема фильтруют через обеззоленный фильтр. Осадок с фильтром подвергают озолению конц. азотной кислотой при нагревании на электроплитке с закрытой спиралью, либо на песчаной бане, или в микроволновой печи. Полученный раствор фильтруют через мембранный фильтр 0,45 мкм, количественно переносят в мерную колбу, доводят объем до метки дистиллированной водой и в нем определяют содержание элементов. Концентрацию взвешенных (суспендированных) форм элементов рассчитывают с учетом объема взятой для анализа пробы воды.
При определении кислото-экстрагируемых металлов хорошо перемешанную пробу воды подкисляют азотной кислотой до рН = 2 — 3, нагревают на водяной бане или электроплитке, охлаждают, фильтруют через мембранный фильтр 0,45 мкм. Объем полученного раствора доводят до первоначального объема пробы воды и в полученном растворе определяют содержание металлов.
При определении общего содержания металлов нефильтрованную хорошо перемешанную пробу воды подвергают кислотному озолению на электроплитке, песчаной бане или в микроволновой печи (МВП).
Примечание 1: При анализе сточных вод предпочтительно проводить минерализацию в микроволновой печи.
При использовании электроплитки, песчаной или водяной бани к 50 см 3 тщательно гомогенизированной пробы анализируемой воды добавляют 2,5 см 3 концентрированной азотной кислоты и нагревают, не доводя до кипения, до образования влажных солей. Если проба содержит значительное количество органических веществ, например, проба сточной воды, в процессе нагрева добавляют 1 — 3 см 3 перекиси водорода до получения прозрачного раствора. Объем полученного раствора доводят до первоначального объема пробы воды дистиллированной водой. Полученные растворы в зависимости от дисперсности и размеров частиц осадка фильтруют через мембранный фильтр с диаметром пор 0,45 или 5,00 мкм или через фильтр «белая лента» и в полученном растворе определяют содержание металлов.
При использовании микроволновой печи к 50 см 3 тщательно гомогенизированной пробы воды в стакане, предназначенном для микроволновой печи, приливают 2,5 см 3 концентрированной азотной кислоты, выдерживают 15 — 30 мин. Подготовленные стаканы ставят в турель микроволновой печи и проводят разложение по подобранному лабораторией режиму.
По окончании разложения пробы воды охлаждают в закрытых стаканах для микроволновой печи, затем открывают стаканы и фильтруют полученные растворы через мембранный фильтр с диаметром пор 0,45 или 5,00 мкм (в зависимости от дисперсности и размера частиц осадка) или через фильтр «белая лента».
Независимо от способа минерализации предварительно проводится холостой опыт для каждого типа используемых фильтров.
При необходимости подготовленные пробы анализируемой воды разбавляют таким образом, чтобы величина измеряемого сигнала абсорбции попадала в диапазон построенного для каждого элемента градуировочного графика. Например, при необходимости разбавления пробы в 5 раз в мерную колбу вместимостью 50 см 3 вносят 10 см 3 пробы, 5 см 3 раствора хлорида лантана при определении кальция и магния, или 0,5 см 3 при определении стронция, доводят объем до метки дистиллированной водой. Можно использовать меньшие объемы, например: в мерную колбу вместимостью 10 см 3 вносят 2 см 3 пробы, 1 см 3 спектроскопического буфера при определении кальция и магния, или 0,1 см 3 при определении стронция, доводят объем до метки дистиллированной водой. При разбавлении пробы более чем в 5 раз для доведения объема используют 1 % (v/v) раствор азотной кислоты.
Примечание 2: Для разбавления проб возможно использовать программируемый автоматический разбавитель.
Перед проведением серии анализов контролируются чистота посуды и качество используемых реактивов путем предварительного анализа холостого опыта.
При обработке результатов измерений содержания кальция, магния и стронция в анализируемой воде следует учитывать разбавление пробы. Содержание металла в пробе рассчитывают по формуле:
А — содержание металла в анализируемой пробе воды, найденное по градуировочному графику или рассчитанное с использованием градуировочных коэффициентов, мг/дм 3 ;
V 1 — объем колбы, в которой проводили разбавление, см 3 ;
V — объем пробы анализируемой воды, см 3 .
Результаты анализа в протоколе представляют в виде:
Значения d (показатель точности) приведены в табл. 2
12.1. При необходимости проверку приемлемости результатов измерений, полученных в условиях повторяемости (сходимости), осуществляют в соответствии с требованиями раздела 5.2. ГОСТ Р ИСО 5725-6-2002. Расхождение между результатами измерений не должно превышать предела повторяемости (r). Значения r приведены в таблице 8.
12.2. При необходимости проверку приемлемости результатов измерений, полученных в условиях воспроизводимости, проводят с учетом требований раздела 5.3 ГОСТ Р ИСО 5725-6-2002. Расхождение между результатами измерений, полученными двумя лабораториями, не должно превышать предела воспроизводимости (R). Значения R приведены в таблице 8.
Контроль качества результатов измерений при реализации методики в лаборатории предусматривает:
— контроль стабильности результатов измерений путем контроля стабильности среднеквадратического отклонения повторяемости, промежуточной прецизионности и погрешности;
— контроль исполнителем процедуры выполнения измерений путем оценки погрешности при реализации отдельно взятой контрольной процедуры.
Периодичность контроля исполнителем процедуры выполнения измерений и алгоритмы контрольных процедур (с использованием метода добавок, с использованием образцов для контроля и т.п.), а также реализуемые процедуры контроля стабильности результатов измерений регламентируют во внутренних документах лаборатории.
Диапазон измеряемых массовых концентраций и пределы повторяемости и воспроизводимости результатов измерений при доверительной вероятности Р = 0,95
(относительное значение допускаемого расхождения между двумя параллельными результатами измерений), r, %
(относительное значение допускаемого расхождения между двумя результатами измерений, полученными в разных лабораториях), R, %
источник
Химический анализ природной и питьевой воды. Метод ионообменной хроматографии и титриметрический метод определения ионов кальция и магния. Особенности приготовления растворов. Устранение мешающего влияния катионов железа, марганца, цинка, меди и олова.
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Методика определения ионов кальция и магния в природных водах (определение общей жесткости воды)
2. Приготовление растворов
3.1 Титриметрический метод
3.2 Метод ионообменной хроматографии
Химический анализ природной и питьевой воды показывает, что любая вода представляет собой не чистое вещество с формулой Н2О, а смесь большого количества веществ.
Многочисленные анализы природных вод показали, что среди большого числа компонентов, растворенных в них, 90 % солесодержания составляют карбонаты, гидрокарбонаты, хлориды и сульфаты кальция, магния и натрия. О.А. Алекиным предложена классификация природных вод по результатам их химического анализа. По преобладающему аниону воды делятся на три класса: карбонатные (гидрокарбонатные), хлоридные и сульфатные. По преобладающему катиону воды делятся на три группы: кальциевые, магниевые и натриевые.
В природных водах постоянно находятся ионы кальция и магния, обеспечивающие жесткость воды. Источник их поступления в воду — растворение гипса, известняков и доломитов, входящих в состав горных пород. В санитарно-гигиеническом отношении ионы кальция и магния не представляют большой опасности, но чрезмерная жесткость воды делает ее непригодной для бытовых целей, т.к. образующаяся накипь выводит из строя нагревательные элементы электрических систем нагрева воды. Оптимальная жесткость воды — до 7 мг-экв/л.
Для определения ионов кальция и магния используются два метода:
2. метод ионообменной хроматографии
1. Наиболее точный и распространенный метод определения общей жесткости — комплексометрический, основанный на образовании ионами Са 2+ и Mg 2+ прочных внутрикомплексных соединений с трилоном Б. В качестве индикатора при определении общей жесткости используется эриохром черный. В зависимости от общей жесткости концентрация рабочего раствора трилона Б и объем пробы воды могут быть различными.
Для определения кальция в природных водах преимущественно используются трилонометрический метод с индикатором мурексидом.
Содержание магния проводят расчетным методом, зная общую жесткость и содержание кальция.
2. Приготовление растворов
Раствор трилона Б с концентрацией 0,02 моль/дм 3 эквивалента.
Навеску 3,72г. трилона Б растворяют в 1 дм 3 дистиллированной воды. Точную концентрацию устанавливают по стандартному раствору хлорида цинка. Раствор хранят в полиэтиленовой посуде, проверяют его концентрацию не реже 1 раза в месяц.
Раствор хлорида цинка с концентрацией 0,02 моль/ дм 3 эквивалента.
Отвешивают на технических весах около 0,35 г металлического цинка, смачивают его небольшим количеством концентрированной соляной кислоты и сейчас же промывают дистиллированной водой. Цинк сушат в сушильном шкафу при 105 течение 1ч, затем охлаждают и взвешивают на аналитических весах.
Навеску цинка помещают в мерную колбу вместимостью 500 см 3 , в которую предварительно вносят 10-15 см 3 дистиллированной воды и 1,5 см 3 концентрированной соляной кислоты. Цинк растворяют. После растворения цинка объём раствора доводят до метки на колбе дистиллированной водой. Рассчитывают молярную концентрацию эквивалента раствора хлорида цинка CZn(1/2 ZnCl2), моль/дм 3 , по формуле:
где m — навеска металлического цинка, г; 32,69 — молярная масса эквивалента Zn 2+ , г/моль; V — объём мерной колбы, см 3 .
Буферный раствор NH4Cl +NH4OH.
7,0 г хлорида аммония растворяют в мерной колбе вместимостью 500 см 3 в 100 см 3 дистиллированной воды и добавляют 75 см 3 концентрированного раствора аммиака. Объем раствора доводят до метки дистиллированной водой и тщательно перемешивают. Буферный раствор хранят в стеклянной или полиэтиленовой посуде не более 2 месяцев. Гидроксид натрия, 2 моль/дм 3 .
40 г гидроксида натрия растворяют в мерной колбе вместимостью 500 см 3 и раствор доводят до метки дистиллированной водой.
Индикатор эриохром черный Т.
Растереть в ступке 0,25 г эриохрома черного Т с 50 г хлорида натрия.
0,5 г мурексида растереть с 100 г хлорида натрия. Водный раствор лучше не готовить, т.к. мурексид нестоек в растворе.
Раствор сульфида натрия, 4%.
2 г сульфида натрия растворяют в 50 см 3 дистиллированной воды. Хранят в плотной закрытой полиэтиленовой посуде не более недели.
Раствор гидрохлорида гидроксиламина.
5 г гидрохлорида гидроксиламина растворяют в 100 см 3 дистиллированной воды. Хранят не более 2 месяцев.
Установление точной концентрации раствора трилона Б.
В коническую колбу вместимостью 250 см 3 вносят 10 см 3 раствора хлорида цинка, добавляют дистиллированной воды приблизительно до 100 см 3 , 5 см 3 буферного раствора и 10-15 мг индикатора эриохрома чёрного Т. Содержимое конической колбы тщательно перемешивают и титруют из бюретки раствором трилона Б до перехода окраски красной в голубую. Концентрацию раствора трилона Б рассчитывают по формуле:
3.1 Титриметрический метод
Определение ионов кальция и магния
Устранение мешающих ионов
Для устранения мешающего влияния катионов железа, цинка, меди и олова в пробу добавляют 0,5 мл раствора сульфида натрия.
Для устранения мешающего влияния марганца в пробу добавляют 0,5 мл солянокислого раствора гидроксиламина.
Перед выполнением анализа пробы воды с неизвестной величиной жёсткости проводят оценочное титрование. Для этого берут 10 см 3 воды, добавляют 0,5 см 3 буферного раствора, индикатор (эриохром чёрный Т) и титруют до перехода окраски из красной в голубую. По величине израсходованного трилона Б выбирают из таблицы 1 соответствующий объём пробы воды.
ионообменный хроматография вода магний
Таблица 1. Объём пробы воды, рекомендуемый для определения жёсткости по результатам оценочного титрования
Объём израсходованного раствора трилона Б, см 3
Рекомендуемый объём пробы, см 3
v Определение суммы кальция и магния
К пробе необходимого объёма (см. Оценочное титрование) 100 см 3 добавляют 5 см 3 буфера, индикатор (эриохром чёрный Т) на шпателе. Сразу же титруют при перемешивании до перехода окраски от винно-красной к синей.
К пробе необходимого объёма (см. Оценочное титрование) 100 см 3 добавляют 2 см 3 NaOH (2н) и индикатора (мурексид) на шпателе. Титруют до перехода окраски от красной в фиолетовую. Окраску раствора следует сравнивать с цветом перетитрованного раствора.
Содержание кальция высчитывают по формуле:
где Стр — молярная концентрация эквивалента трилона Б, моль/дм 3 ; V’ тр — объем трилона Б, пошедший на титрование с мурексидом, см 3 (см. Определение кальция); 20,04 — масса эквивалента Ca 2+ ; Vпробы — объем пробы, взятый для анализа, см 3 .
Содержание магния высчитывают по формуле:
где Стр — молярная концентрация эквивалента трилона Б, моль/дм 3 ; V тр — объем трилона Б, пошедший на титрование с эриохромом черным Т, см 3 (см. Определение суммы кальция и магния); V’тр — объем трилона Б, пошедший на титрование с мурексидом, см 3 (см. Определение кальция); 12,15- масса эквивалента Mg 2+ ; Vпробы- объем пробы, взятый для анализа, см 3 .
v Определение общей жесткости воды
Общую жесткость находят по формуле:
где Стр — молярная концентрация эквивалента трилона Б, моль/дм 3 ; Vтр — объем раствора трилона Б, пошедшего на титрование пробы, см 3 ; Vпробы — объем пробы, взятый для анализа, см 3 .
Метод добавок. Для определения данным методом в пробу вводят добавку, равную 50-150% (желательно 100%) жёсткости воды (см. Определение общей жёсткости воды) ГСО 8206-2002.
Затем высчитывают общую жесткость воды с добавкой.
a. Результаты измерений, полученных в условиях воспроизводимости для пробы 1.
Проба 1: оз. Среднее, с. Озёрное, 85 км от берега, дата: 1.10.13, время: 16.55, t = +3.
Установлена точная концентрация трилона Б: Стрилона = 0,002226 (моль/дм 3 ). При выполнении оценочного титрования объем необходимой пробы соответствует 100 (мл).
источник
Требования, предъявляемые к качеству воды, могут быть самыми различными и определяются её целевым назначением. Для оценки качества пластовых, природных и сточных вод их образцы подвергают анализу. На основании результатов анализа делаются выводы о пригодности воды для конкретного вида потребления, возможности применения тех или иных методов очистки. Анализы подземных вод позволяют прогнозировать сопутствующие месторождения полезных ископаемых. При анализе вод для характеристики их свойств определяют химические, физические и бактериологические показатели. Основными показателями, определяющими пригодность воды для определенной отрасли народного хозяйства, являются химические, так как физические (содержание взвешенных частиц, температура, цвет, запах, плотность, сжимаемость, вязкость, поверхностное натяжение) и бактериологические (наличие бактерий) показатели зависят от химического состава воды.
К химическим показателям качества воды относятся:
состав растворенных газов.
Общее солесодержание характеризует присутствие в воде минеральных и органических примесей, количество этих примесей в виде общей минерализации, сухого и плотного остатков. Общая минерализация представляет собой сумму всех найденных в воде анализом катионов и анионов. Минерализацию выражают в миллиграмм-эквивалентах солей, находящихся в I л воды, или в процентах, то есть числом граммов растворенных веществ, содержащихся в 100 г раствора. Сухим остатком называется суммарное количество нелетучих веществ, присутствующих в воде во взвешенном, коллоидном и растворенном состоянии, выраженное в мг/л. Сухой остаток определяют путем выпаривания пробы воды, последующего высушивания при 105 о С и взвешивания. Плотный остаток – это сухой остаток, определенный из профильтрованной пробы воды. Следовательно, разница двух показателей соответствует содержанию взвешенных веществ пробы. Если сухой остаток прокалить при температуре 500-600 о С, то масса его уменьшится и получится остаток, называемый золой. Уменьшение массы происходит за счет сгорания органических веществ, удаления кристаллизационной воды, разложения карбонатов. Потери при прокаливании приближенно относят за счет органических примесей.
Жесткость воды обусловливается наличием в ней ионов Са 2+ и Mg 2+ . Для большинства производств жесткость воды является основным показателем её качества. В жесткой воде плохо пенится мыло. При нагревании и испарении жесткой воды образуется накипь на стенках паровых котлов, труб, теплообменных аппаратов, что ведет к перерасходу топлива, коррозии металлов и авариям.
Жесткость количественно выражается числом миллиграмм-эквивалентов ионов кальция и магния в 1 л воды (мг-экв/л); 1 мг-экв/л жесткости соответствует содержанию в воде 20,04 мг/л ионов Са 2+ или
12,16 мг/л ионов Mg 2 + . Различают жесткость общую, карбонатную и некарбонатную.
Карбонатная жесткость связана с присутствием в воде в основном гидрокарбонатов и карбонатов кальция и магния, которые при кипячении воды переходят в нерастворимые средние или основные соли и выпадают в виде плотного осадка:
Таким образом, при кипячении карбонатная жесткость устраняется. Поэтому она называется также временной жесткостью. Следует сказать, что при переходе HCO3 – в CO32 – и при выпадении карбонатов кальция и магния в воде остается некоторое количество ионов Са 2+ , Mg 2+ , CO32 – , соответствующее произведению растворимости СаСО3 и (MgOH)2CO3. В присутствии посторонних ионов растворимость этих соединений повышается.
Некарбонатная (постоянная) жесткость не разрушается кипячением. Она обусловливается присутствием в воде кальциевых и магниевых солей сильных кислот, главным образом сульфатов и хлоридов.
Общаяжесткость воды представляет собой сумму карбонатной и некарбонатной жесткости и обусловливается суммарным содержанием в воде растворенных солей кальция и магния. По величине общей жесткости принята следующая классификация природных вод:
Если известны концентрации (мг/л) в воде Ca 2+ , Mg 2+ и HCO3 – , то жесткость рассчитывается по следующим формулам:
Общая жесткость
Карбонатная жесткость равна концентрации (мг/л) [HCO3– ]; в случае, если содержание ионов кальция и магния в воде выше, чем количество гидрокарбонатов:
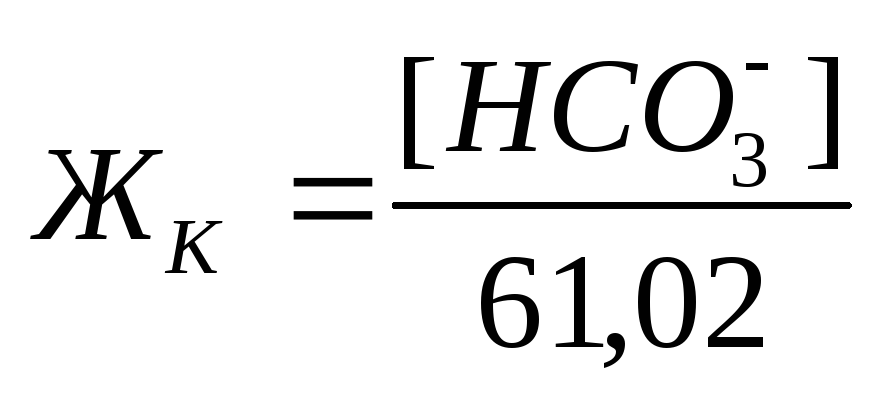
Если же количество гидрокарбонатов в воде превышает содержание ионов кальция и магния, то карбонатная жесткость соответствует общей жесткости. Разность между общей и карбонатной жесткостью составляет некарбонатную жесткость: ЖНК= ЖО– ЖК . Следовательно, ЖНК – это содержание Ca 2+ и Mg 2 + , эквивалентное концентрации всех остальных анионов, в том числе и некомпенсированных гидрокарбонатов.
Окисляемость характеризует содержание в воде восстановителей, к которым относятся органические и некоторые неорганические (сероводород, сульфиты, соединения двухвалентного железа и др.) вещества. Величина окисляемости определяется количеством затраченного окислителя и выражается числом миллиграммов кислорода, необходимого для окисления веществ, содержащихся в 1 л воды. Различают общую и частичную окисляемость. Общую окисляемость определяют обработкой воды сильным окислителем – бихроматом калия K2Cr2O7 или йодатом калия KIO3. Частичную окисляемость определяют по реакции с менее сильным окислителем – перманганатом калия КMnO4. По этой реакции окисляются только сравнительно легко окисляющиеся вещества.
Для полного окисления содержащихся в воде органических веществ, при котором происходят превращения по схеме
требуется количество кислорода (или окислителя в расчете на кислород), называемое химическим потреблением кислорода (ХПК) и выражаемое в мг/л.
При любом методе определения ХПК вместе с органическими веществами окисляются и неорганические восстановители, содержащиеся в пробе. Тогда содержание неорганических восстановителей в пробе определяют отдельно специальными методами и результаты этих определений вычитают из найденного значения ХПК.
Реакция среды характеризует степень кислотности или щелочности воды. Концентрация водородных ионов природных вод зависит главным образом от гидролиза солей, растворенных в воде, количества растворенных угольной кислоты и сероводорода, содержания различных органических кислот. Обычно для большинства природных вод величина рН изменяется в пределах 5,5-8,5. Постоянство рН природных вод обеспечивается наличием в ней буферных смесей. Изменение значения рН свидетельствует о загрязнении природной воды сточными водами.
Определение иона Cl – . В основу определения иона хлора положен аргентометрический метод Мора. Принцип анализа заключается в том, что при прибавлении к воде раствора AgNO3 образуется белый осадок хлорида серебра:
Определение хлорид-ионов ведут в интервале рН = 6,5 ÷ 10, чтобы одновременно с AgCl не выпадал осадок Ag2CO3. Проведению определения Сl – мешает наличие в воде ионов брома, йода, сероводорода, от которых освобождаются предварительной обработкой воды.
Определение иона SO42– . Метод определения сульфат-ионов основан на малой растворимости сульфата бария, количественно выпадающего в кислой среде при добавлении к воде раствора хлорида бария: Ba 2+ + SO42– = BaSO4↓
По массе образовавшегося осадка рассчитывают содержание иона SO42– .
Определение ионов CO32– и HCO3– . Эти ионы определяют титрованием пробы воды растворами серной или соляной кислот последовательно с индикаторами фенолфталеином и метилоранжем. Реакция нейтрализации протекает в две стадии.
Первые порции кислоты вступают в реакции с карбонат-ионом, образуя гидрокарбонат-ион:
Окраска фенолфталеина при рН = 8,4 переходит из розовой в бесцветную, что совпадает с таким состоянием раствора, когда в нем остаются лишь гидрокарбонаты. По количеству кислоты, пошедшей на титрование, рассчитывают содержание карбонат-иона. Расход кислот на титрование с фенолфталеином эквивалентен содержанию половины карбонатов, т.к. последние нейтрализуются только наполовину до HCO3 – . Поэтому общее количество CO32 – эквивалентно удвоенному количеству кислоты, затраченной на титрование. При дальнейшем титровании в присутствии метилоранжа происходит реакция нейтрализации гидрокарбонатов:
Метилоранж меняет окраску при pH = 4,3, т.е. в момент, когда в растворе остается только свободный диоксид углерода.
При расчете содержания ионов HCO3 – в воде следует из количества кислоты, пошедшей на титрование с метилоранжем, вычесть количество кислоты, идущей на титрование с фенолфталеином. Общее количество кислоты, затраченной на нейтрализацию ионов ОН – , СО32– и НСО3– , характеризует общую щелочность воды. Если рН воды ниже 4,3, то её щелочность равна нулю.
Определение ионов Ca 2+ , Mg 2+ . Имеется несколько методов обнаружения и определения содержания ионов Са 2+ и Mg 2+ . При добавлении в воду оксалата аммония (NH4)2C2O4 в случае присутствия ионов кальция образуется белый осадок оксалата кальция:
После отделения осадка оксалата кальция в воде можно определить ионы Mg 2+ с помощью раствора гидрофосфата натрия Na2HPO4 и аммиака. При наличии иона Mg 2 + образуется мелкокристаллический осадок соли магния:
Полученные осадки прокаливают и взвешивают. На основании полученных результатов вычисляется величина кальциевой и магниевой жесткости.
Наиболее быстрым и точным методом определения Са 2 + и Mg 2 + является комплексонометрический метод, основанный на способности двунатриевой соли этилендиаминотетрауксусной кислоты (трилон Б)
N
образовывать с ионами кальция и магния прочные комплексные соединения.
При титровании пробы воды трилоном Б происходит последовательное связывание в комплекс сначала ионов кальция, а затем ионов магния. Содержание ионов кальция определяют, титруя воду в присутствии индикатора — мурексида. Мурексид образует с ионами кальция малодиссоциированное комплексное соединение, окрашенное в малиновый цвет.
Ионы магния не дают комплекса с мурексидом. Трилон Б извлекает Са 2+ из его растворимого комплекса с мурексидом, вследствие чего окраска раствора, изменяется на сиреневую:
По количеству трилона Б, расходуемого на титрование, определяют содержание Са 2 + . Титрованием пробы воды трилоном Б в присутствии индикатора хромогена черного определяют суммарное содержание Са 2 + и Mg 2 + , то есть общую жесткость воды. Вода, содержащая Са 2 + и Mg 2 + , в присутствии хромогена черного окрашивается в красный цвет вследствие образования комплекса с Mg 2 + . При титровании воды в точке эквивалентности происходит изменение цвета на синий вследствие протекания следующей реакции:
Содержание Mg 2+ вычисляют по разности между общим содержанием (Са 2+ + Mg 2+ ) и содержанием Са 2 + . Трилонометрическое определение каждого иона производится при том значении рН, при котором этот ион образует с трилоном Б соединение более прочное, чем с индикатором. Для поддержания заданного значения рН к титруемому раствору добавляют буферные растворы. Кроме того, поддержание заданной величины рН обеспечивает определенную окраску индикатора. Общую жесткость воды определяют при рН > 9, кальциевую – при рН = 12.
Определение ионов Na + , K + . Производится вычислением по разности между суммой мг-экв найденных анионов и катионов, поскольку вода электронейтральна:
С достаточно высокой точностью все присутствующие в воде катионы можно определить эмиссионной спектроскопией сухого остатка.
Растворенные в воде газы определяют химическими методами или газовой хроматографией.
Определение диоксида углерода производят титрованием пробы воды щелочью в присутствии индикатора–фенолфталеина:
Определение растворенного кислорода производится йодометрическим методом.
Для анализа в пробу воды поcледовательно добавляют раствор хлорида марганца и щелочной раствор йодида калия. Метод основан на окислении свежеполученного гидроксида двухвалентного марганца содержащимся в воде кислородом:
Количество образовавшегося в воде бурого осадка гидроксида четырехвалентного марганца эквивалентно количеству растворенного кислорода. При последующем добавлении к пробе соляной или серной кислоты четырехвалентный марганец вновь восстанавливается до двухвалентного, окисляя при этом йодид калия. Это приводит к выделению свободного йода, эквивалентного содержанию четырехвалентного марганца, или, что то же самое, растворенного кислорода в пробе:
Выделившийся свободный йод определяется количественно путем титрования раствором тиосульфата натрия:
I2+ 2Na2S2O3
Йодометрический метод определения растворенного кислорода неприменим для вод, содержащих сероводород, так как сероводород вступает во взаимодействие с йодом и занижает результат. Во избежание этой ошибки предварительно связывают содержащийся в пробе сероводород в соединение, не препятствующее нормальному течению реакции. Для этой цели обычно используют хлорид ртути (II):
Определение H2S. Прежде чем приступить к количественному определению сероводорода, определяют его качественное присутствие по характерному запаху. Более объективным качественным показателем служат свинцовые индикаторные бумажки (фильтровальная бумага, пропитанная раствором ацетата свинца). При опускании в воду, содержащую сероводород, свинцовая бумага темнеет, принимая желтую (малое содержание), бурую (среднее содержание) или темно-коричневую (высокое содержание) окраску.
В водных растворах сероводород присутствует в трех формах: недиссоциированный H2S, в виде ионов HS – и S 2 – . Относительные концентрации этих форм в воде зависят от рН этой воды и в меньшей степени от температуры и общего солесодержания.
Если анализируемая вода не содержит веществ, реагирующих с иодом, то сероводород и его ионы можно определить следующим образом.
В основе количественного метода определения H2S лежит реакция окисления сероводорода йодом:
К точно отмеренному подкисленному раствору йода, взятого в избытке по отношению к ожидаемому содержанию сероводорода, прибавляют определенное количество воды. Количество йода, израсходованное на окисление сероводорода, определяется обратным титрованием остатка йода тиосульфатом. Разница между количеством раствора тиосульфата, соответствующим всему количеству взятого для анализа йода, и количеством этого же раствора, затраченного на титрование остатка йода в пробе, эквивалентна содержанию сероводорода в исследуемой пробе.
источник
Цель работы: определить комплексонометрическим методом:
– проба А – общую жесткость воды, ммоль экв/л;
– проба Б – массу кальция и магния в пробе, г.
Сущность работы. Ионы Са 2+ и Mg 2+ образуют комплексонаты, которые устойчивы в щелочной среде, поэтому их титруют стандартным раствором ЭДТА в присутствии аммиачного буфера. Если использовать индикатор эриохром черный Т, то в к. т. т. наблюдается переход окраски раствора от сиреневой (комплексы индикатора с Са 2+ и Mg 2+ ) к синей (свободная форма индикатора в этих условиях).
Жесткость воды – это суммарный показатель качества воды. Она обусловлена наличием ионов Са 2+ и Mg 2+ . Общая жесткость воды показывает, сколько миллимоль эквивалентов Са 2+ и Mg 2+ в сумме содержится в 1 л воды.
Суммарное содержание Са 2+ и Mg 2+ определяют прямым титрованием пробы воды в аммонийном буфере стандартным раствором
ЭДТА в присутствии индикатора эриохрома черного Т:
Me 2+ + H2Y 2– = MeY 2– + 2H + Þ fэкв(Me 2+ ) = 
Поскольку концентрация Са 2+ и Mg 2+ в воде незначительна, для титрования берут большие аликвоты анализируемой воды (50,00 или 100,00 мл) с помощью специальных пипеток большой вместимости.
Раздельное определениеСа 2+ и Mg 2+ при совместном присутствии в растворе основано на титровании пробы с разными индикаторами в разных условиях.
Сначала определяют суммарное содержание кальция и магния в пробе. С этой целью титруют аликвоту анализируемого раствора комплексоном III с индикатором эриохромом черным Т в среде аммиачного буфера. При этом протекают следующие реакции:
Mg 2+ + H2Y 2– = MgY 2– + 2H + Þ
Þ fэкв(Ca 2+ ) = 


Затем определяют содержание кальция, титруя такую же аликвоту раствором ЭДТА с индикатором мурексидом в сильнощелочной среде. При добавлении щелочи ионы магния маскируются за счет осаждения в виде Mg(OH)2¯ и не реагируют с ЭДТА. Следовательно, титруются только ионы кальция:
Свободная форма индикатора мурексида в этих условиях имеет сиренево-фиолетовую окраску, а комплекс его с кальцием – кирпично-красную. Содержание магния в пробе находят по разности.
Оборудование и реактивы: бюретка, мерный цилиндр (25 мл), стандартный раствор ЭДТА, аммиачный буфер с рН 9, индикатор эриохром черный Т в смеси с NaCl (1 : 100). Для анализа пробы А дополнительно: пипетка Мора большой вместимости (50,00 или 100,00 мл), конические колбы большой вместимости (250 мл). Для анализа пробы Б дополнительно: мерная колба, пипетка Мора, конические колбы, гранулированный NaOH, мурексид в смеси с NaCl (1 : 100).
Выполнение работы
Проба А. Определение общей жесткости воды. Получают у лаборантов анализируемый раствор в коническую колбу. Отбирают пипеткой аликвоту 50,00 или 100,00 мл и переносят в другую коническую колбу. Прибавляют 20–25 мл аммонийного буфера, индикатор на кончике шпателя и титруют раствором комплексона III до перехода окраски раствора от сиреневой к синей.
По результатам титрования рассчитывают общую жесткость воды (ммоль-экв/л):
Делают вывод о характеристике воды, используя справочные данные (см. &).
Проба Б. Раздельное определение кальция и магния. Получают у лаборантов анализируемый раствор в мерную колбу, доводят до метки и перемешивают.
Для определения суммарной концентрации кальция и магния отбирают пипеткой аликвоту анализируемого раствора в колбу для титрования, добавляют 20–25 мл аммиачного буфера и индикатор эриохром черный Т на кончике шпателя. Титруют раствором ЭДТА до перехода сиреневой окраски раствора в синюю. Усредняют полученные близкие объемы ЭДТА и получают среднее значение объема титранта V1(Na2H2Y), который затрачен на титрование Ca 2+ и Mg 2+ в сумме.
Для определения кальция отбирают пипеткой такую же аликвоту анализируемого раствора, вносят в него 2–3 гранулы NaOH (для создания сильнощелочной среды, проверить с помощью универсальной индикаторной бумаги!), мурексид на кончике шпателя и титруют раствором ЭДТА до перехода кирпично-красной окраски в сиренево-фиолетовую. Усредняют полученные близкие объемы ЭДТА и получают среднее значение объема титранта V2(Na2H2Y), который затрачен на титрование Ca 2+ . По разности находят объем титранта, пошедший на титрование Mg 2+ :
Исходя из полученных значений объемов V2(Na2H2Y) и V3(Na2H2Y), рассчитывают массу кальция и магния в пробе (г).
| & | М(Ca 2+ ) = 40,078 г/моль | М(Mg 2+ ) = 24,3050 г/моль | ||
| Ж(Н2О), ммоль-экв/л | 12 | |||
| Характеристика воды | Мягкая | Средней жесткости | Жесткая | Очень жесткая |
В Западной Европе жесткость воды выражают в немецких градусах жесткости ( ° d). 1 ° d соответствует 10 мг CaO в 1 л воды. Переход к моль-экв/л: 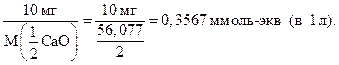 1 ° d = 0,3567 ммоль-экв/л. 1 ° d = 0,3567 ммоль-экв/л. | ||||
| : | С использованием ПО «Практикум по АХ и ФХМА»: – оценить неопределенность измерений; – провести Q-тест и статистическую обработку результатов анализа, если имеется 4 и более результатов параллельных измерений. |
Лабораторная работа № 20
Комплексонометрическое определение ионов поливалентных
металлов
Цель работы: определить по указанию преподавателя массу определяемого иона металла в растворе (г) или массовую долю (%) соли металла в образце (табл. 15).
Задания для выполнения лабораторной работы
| Проба | Определяемое вещество | Способ титрования | Индикатор, условия проведения анализа | |
| Ион | Соль | |||
| А | Co 2+ | CoSO4 · 7H2O | Прямое титрование | Мурексид; в аммиачном буфере |
| Ni 2+ | NiSO4 · 7H2O | |||
| Cu 2+ | CuSO4 · 5H2O | |||
| Б | Fe 3+ | FeCl3 · 6H2O Fe2(SO4)3 · 9H2O NH4Fe(SO4)2 · 12H2O | Прямое титрование | Сульфосалициловая кислота; в ацетатном буфере при 60 о С |
| В | Al 3+ | AlCl3 · 6H2O Al(NO3)3 · 9H2O NH4Al(SO4)2 · 12H2O KAl(SO4)2 · 12H2O | Обратное титрование солью Zn 2+ | Ксиленоловый оранжевый; образование AlY – – в кислом кипящем растворе; титрование – в ацетатном буфере |
Сущность работы. Важнейшим достоинством комплексонометрии является возможность определения практически всех катионов поливалентных металлов. В зависимости от устойчивости комплексонатов металлов и их комплексов с индикатором, а также других особенностей титруемой системы применяют методы прямого, обратного титрования или титрования по замещению. Прямым титрованием определяют Mg 2+ , Ca 2+ , Zn 2+ , Cd 2+ , Pb 2+ , Co 2+ , Ni 2+ , Cu 2+ , Mn 2+ , Fe 3+ и др. Если реакция с ЭДТА протекает слишком медленно (Al 3+ , Cr 3+ ), отсутствует подходящий индикатор для условий существования иона в растворе (Hg 2+ ), то применяют обратное титрование.
Определение Co 2+ , Ni 2+ , Cu 2+ основано на прямом комплексонометрическом титровании в присутствии мурексида при значении рH 7–8, которое поддерживается с помощью аммиачного буфера. При более высоких значениях pH происходит образование аммиачных комплексов
Me 2+ + 6NH3 =
и разрушение комплекса металла с индикатором, что снижает точность титрования.
Определение Fe 3+ проводится прямым титрованием в присутствии сульфосалициловой кислоты при pH о С.
Определение Al 3+ проводится обратным титрованием солью цинка (II) в присутствии ксиленолового оранжевого или солью меди(II) в присутствии индикатора ПАН.
Оборудование и реактивы: технические и аналитические весы, мерные колбы, бюретка, пипетка Мора, мерный цилиндр, конические колбы, стандартный раствор ЭДТА.
Для анализа пробы А: аммиачный буферный раствор, мурексид.
Для анализа пробы Б: ацетатный буферный раствор pH 2,5,
25 %-ный раствор сульфосалициловой кислоты, кислота для растворения сухой соли, водяная баня.
Для анализа пробы В: кристаллический ZnSO4 · 7H2O, 0,25 М раствор ацетата натрия, 1 М раствор HCl, ксиленоловый оранжевый, водяная баня.
Выполнение работы. Если проводят анализ раствора, то получают его в мерную колбу, доводят до метки дистиллированной водой и перемешивают. Затем отбирают отдельные аликвоты анализируемого раствора в колбы для титрования, создают необходимые условия и проводят титрование в соответствии с описанными ниже методиками. По результатам титрования рассчитывают массу определяемого иона в пробе (г).
Если для анализа предложена сухая смесь соли с индифферентными примесями, то рассчитывают навеску соли, необходимую для приготовления раствора заданной концентрации в имеющейся мерной колбе. Затем берут навеску, переносят в мерную колбу, растворяют в дистиллированной воде (в случае солей Fe 3+ – с добавлением кислоты), доводят до метки и перемешивают. Затем отбирают отдельные аликвоты полученного раствора в колбы для титрования, создают необходимые условия и проводят титрование в соответствии с описанными ниже методиками. По результатам титрования рассчитывают массовую долю кристаллогидрата в образце (%).
Проба А. Определение Co 2+ , Ni 2+ , Cu 2+ . К аликвоте раствора медленно, по каплям, при перемешивании добавляют аммиачный буферный раствор. При этом вначале протекает образование осадка гидроксида металла, а затем его растворение с образованием аммиачного комплекса. Как только осадок растворится, добавление буферного раствора прекращают. К раствору добавляют мурексид на кончике шпателя и титруют раствором ЭДТА до перехода окраски к яркой фиолетово-сиреневой.
Проба Б. Определение Fe 3+ . К аликвоте раствора добавляют 5 мл ацетатного буферного раствора, нагревают до 60 о С, добавляют 1 мл раствора сульфосалициловой кислоты и титруют раствором ЭДТА до перехода окраски от красно-фиолетовой к бледно-желтой.
Проба В. Определение Al 3+ . Готовят 0,05 н. стандартный раствор сульфата цинка по точной навеске, как описано в лабораторной работе № 18.
К аликвоте раствора, содержащего Al 3+ , добавляют 20,00 мл стандартного раствора ЭДТА и 2 мл 1 М HCl. Нагревают до кипения и оставляют на кипящей водяной бане на 10 минут. После охлаждения добавляют в колбу 10 мл раствора ацетата натрия, ксиленоловый оранжевый на кончике шпателя и титруют раствором сульфата цинка до перехода окраски от желтой к красной.
| & | М(Co 2+ ) = 58,9332 г/моль М(Ni 2+ ) = 58,69 г/моль М(Cu 2+ ) = 63,546 г/моль М(Fe 3+ ) = 55,847 г/моль М(Al 3+ ) = 26,9815 г/моль М(CoSO4 · 7H2O) = 281,11 г/моль М(NiSO4 · 7H2O) = 280,86 г/моль М(CuSO4 · 5H2O) = 249,69 г/моль | М(FeCl3 · 6H2O) = 270,298 г/моль М(Fe2(SO4)3 · 9H2O) = 562,02 г/моль М(NH4Fe(SO4)2 · 12H2O) = 482,20 г/моль М(AlCl3 · 6H2O) = 241,432 г/моль М(Al(NO3)3 · 9H2O) = 375,134 г/моль М(NH4Al(SO4)2 · 12H2O) = 453,33 г/моль М(KAl(SO4)2 · 12H2O) = 474,39 г/моль |
| : | С использованием ПО «Практикум по АХ и ФХМА»: – оценить неопределенность измерений; – провести Q-тест и статистическую обработку результатов анализа, если имеется 4 и более результатов параллельных измерений. |
Программа курса
Предмет аналитической химии. Значение аналитической химии. Аналитический контроль технологических процессов. Классификация методов аналитической химии: методы разделения, методы обнаружения и методы определения. Цели и задачи методов.
Общая схема аналитического определения. Выбор метода анализа. Отбор пробы и пробоподготовка. Метрологические основы аналитической химии. Статистическая обработка результатов анализа.
Последнее изменение этой страницы: 2017-01-25; Нарушение авторского права страницы
источник