Химический состав воды является причиной заболеваний неинфекционной природы.
Причины изменения химического состава воды:
1) промышленная и сельскохозяйственная деятельность человека- поступление производственных и бытовых сточных вод, атмосферных осадков, содержащих вредные вещества.
2) очистка питьевой воды — применение химических приемов обработки воды и содержание остаточных количеств реагентов в воде.
- сухой остаток
- жесткость
- хлориды
- сульфаты
- нитраты и нитриты
- значение рН
- микроэлементы
Сухой остаток
Сухой остаток-это общее содержание растворенных твердых веществ в воде, он дает представление о степени минерализации воды. Основными ионами, определяющими сухой остаток,, являются карбонаты, бикарбонаты, хлориды, сульфаты, нитраты, натрий, калий, кальций, магний. Данный показатель влияет на другие показатели качества питьевой воды, такие как привкус, жесткость, коррозирующие свойства и тенденция к накипеобразованию.
Воду с сухим остатком свыше 1000 мг/л называют минерализованной, до 1000 мг/л — пресной. Воду, содержащую до 50 — 100 мг/л, считают слабоминерализованной (дистиллированная),100 — 300 мг/л — удовлетворительно минерализованной, 300 — 500 мг/л — оптимальной минерализации и 500 — 1000 мг/л — повышенно минерализованной. Минерализованной водой является морская, минеральная, пресной — речная, дождевая, вода ледников.
- Вода с повышенным содержанием минеральных солей непригодна для питья, так как имеет соленый или горько- солёный вкус, а её употребление в зависимости от состава солей приводит к неблагоприятным физиологическим изменениям в организме:
- способствует перегреву в жаркую погоду,
- ведет к нарушению утоления жажды,
- изменяет водно-солевой обмен за счёт увеличения гидрофильности тканей,
- усиливает моторную и секреторную желудка и кишечника.
- Слабоминерализованная вода неприятна на вкус, длительное её употребление может привести к нарушению водно-солевого обмена (уменьшение содержания хлоридов в тканях). Такая вода, как правило, содержит мало микроэлементов.
Общая жесткость воды обусловлена преимущественно присутствием в воде кальция и магния, которые находятся в виде гидрокарбонатов, карбонатов, хлоридов, сульфатов и других соединений; имеют также значение ионы стронция, железа, бария, марганца.
- Устранимая — величина, на которую уменьшается общая жесткость воды при кипячении её в течении 1часа. Обусловлена гидрокарбонатами кальция и магния, которые разрушаются и выпадают в виде карбонатов в осадок (накипь).
- Карбонатная — это жесткость, обусловленная бикарбонатами и малорастворимыми карбонатами. Устранимая жесткость приблизительно равна карбонатной, но когда в воде много гидрокарбонатов натрия и кальция, карбонатная жесткость значительно превышает устранимую.
- Постоянная — это жесткость, которая остается после кипячения и обусловлена хлоридами, карбонатами, и сульфатами кальция и магния.
Воду с общей жесткостью до 3,5 мг-экв/л называют мягкой, 3,5-7 — средней жесткости, 7-10 — жесткой, свыше-10 — очень жесткой.
Основными природными источниками жесткости воды являются осадочные породы, фильтрация и сток с почвы. Жесткая вода образуется в районах с плотным пахотным слоем и известковыми образованиями. Для подземных вод характерна большая жесткость, чем для поверхностных. Подземные воды, богатые карбоновыми кислотами и растворенным кислородом, обладают высокой растворяющей способностью по отношению к почвам и породам, содержащим минералы кальцита, гипса и доломита.
Основными промышленными источниками жесткости являются стоки предприятий, производящих неорганические химические вещества, и горнодобывающая промышленность. Оксид кальция используется в строительной промышленности, производстве бумажной массы и бумаги, рафинировании сахара, в очистке нефти, дублении и как реагент для очистки воды и сточных вод. Сплавы магния применяются в литейном и штамповочном производстве, бытовых продуктах. Соли магния используются в производстве металлического магния, удобрений, керамики, взрывчатых веществ, медикаментов.
— ухудшаются органолептические свойства — вода имеет неприятный вкус;
— нарушается всасывание жиров в кишечнике в результате образования кальциево-магнезиальных нерастворимых мыл при омылении жиров;
— у лиц с чувствительной кожей способствует появлению дерматитов в связи с тем, что кальциево-магнезиальные мыла обладают раздражающим действием
— в хозяйственно-бытовом аспекте: увеличивается расход моющих средств, образуется накипь при кипячении, волосы после мытья становятся жесткими, ткани одежды теряют мягкость и гибкость, ухудшается разваривание мяса и овощей с потерей витаминов в результате связывания их в неусвояемые комплексы,
— имеются данные, что употребление слишком жесткой воды может приводить к увеличению частоты мочекаменной болезни; хотя есть сведения о том, что жесткость может служить защитой от болезней;
— при резком переходе от пользования жесткой водой к мягкой и наоборот могут у людей наблюдаться диспептические явления;
— портит вид, вкус и качество чая, который является важнейшим напитком у населения, стимулирующим желудочную секрецию и утоляющим жажду;
Имеются данные о том, что употребление мягкой воды может явиться причиной сердечно-сосудистых заболеваний.
Хлориды могут быть минерального и органического происхождения. Присутствие хлоридов в природных водах может быть связано с растворением отложений солей, загрязнением, обусловливаемым нанесением соли на дороги с целью борьбы со снегом льдом, сбросом стоков предприятиями химической промышленности, эксплуатацией нефтяных скважин, сбросом сточных вод, ирригационным дренажом, загрязнением в результате вымывания твердых отбросов и вторжения морской воды в прибрежные районы. Каждый из этих источников может вызвать загрязнение поверхностных и подземных вод. Высокая растворимость хлоридов объясняет широкое распространение их во всех природных водах.
Влияние на здоровье. Хлориды — наиболее распространенные в организме человека анионы и играют большую роль в осмотической активности внеклеточной жидкости; 88% хлоридов в организме находятся во внеклеточном пространстве. У здоровых людей происходит почти полное всасывание хлоридов.
— ухудшаются органолептические свойства — вода приобретает солоноватый вкус и в связи с этим ограничивается водопотребление;
— влияет на водно — солевой обмен; повышается уровень хлоридов в крови, что приводит к снижению диуреза и перераспределению хлоридов в органах и тканях;
— вызывают угнетение желудочной секреции, в результате чего нарушается процесс переваривания пищи;
— имеются данные о том, что хлориды оказывают гипертензивный эффект и у людей, страдающих гипертонической болезнью употребление воды с повышенным содержанием хлоридов может вызвать утяжеление течения заболевания;
— являются показателем загрязнения подземных и поверхностных водоисточников, так как хлориды содержаться в сточных водах и физиологических выделениях человека.
Сульфаты поступают в водную среду со сточными водами многих отраслей промышленности. Атмосферная двуокись серы (SO2), образующаяся при сгорании топлива и выделяющаяся в процессах обжига в металлургии, может вносить вклад в содержание сульфатов в поверхностных водах. Трехокись серы (SO3), образующаяся при окислении двуокиси серы, в сочетании с парами воды образуют серную кислоту, которая выпадает в виде «кислого дождя» или снега. Большинство сульфатов растворимы в воде.
С сульфатом алюминия, который используется в качестве флоккулянта при очистке воды, в очищенную воду может дополнительно попадать 20-50 мг/л сульфатов. Сульфаты не удаляются из воды обычными методами очистки. Концентрация в большинстве пресных вод очень низкая.
— сульфаты плохо всасываются из кишечника человека. Они медленно проникают через клеточные мембраны и быстро выводятся через почки. Сульфат магния действует как слабительное в концентрации выше 100 мг/л, приводя к очищению ЖКТ. Такой эффект возникает у людей, впервые использующих воду с высоким содержанием сульфатов (при переезде на новое место жительства, где употребляют сульфатную воду). Со временем человек адаптируется к такой концентрации сульфатов в воде.
— ограничивается водопотребление, так как сульфаты придают воде горько-соленый вкус в концентрации свыше 500 мг/л.
— неблагоприятно влияют на желудочную секрецию, приводя к нарушению процессов переваривания и всасывания пищи.
— являются показателем загрязнения поверхностных вод производственными сточными водами и подземных вод водами вышележащих водоносных горизонтов.
Нитраты, нитриты
Аммиак является начальным продуктом разложения органических азотосодержащих веществ. Поэтому наличие аммиака в воде может расцениваться как показатель опасного в эпидемическом отношении свежего загрязнения воды органическими веществами животного происхождения. В некоторых случаях наличие аммиака не указывает на недоброкачественность воды. Например: в глубоких подземных водах аммиак образуется за счет восстановления нитратов при отсутствии кислорода или повышенное содержание аммиака в болотистых и торфяных водах (аммиак растительного происхождения).
Соли азотистой кислоты (нитриты) представляют собой продукты неполного окисления аммиака под влиянием микроорганизмов в процессе нитрификации. Наличие нитритов свидетельствует о возможном загрязнении воды органическими веществами, однако нитриты указывают на известную давность загрязнения.
Соли азотной кислоты (нитраты) — конечные продукты минерализации органических веществ бактериями, присутствующими в почве и в воде с достаточным содержанием кислорода. Присутствие в воде нитратов без аммиака и нитритов указывает на завершение процесса минерализации.
Одновременное содержание в воде аммиака, нитритов и нитратов свидетельствует о незавершенности этого процесса и продолжающемся, опасном в эпидемическом отношении загрязнении воды. Однако повышенное содержание нитратов может иметь минеральное происхождение. Нитраты используют в качестве удобрений (селитра), во взрывчатых веществах, в химическом производстве и в качестве консервантов пищевых продуктов. Некоторые нитраты являются результатом фиксации в почве атмосферного азота (бактериальный синтез). Нитриты используют в качестве консервантов пищевых продуктов. Некоторые нитраты и нитриты образуются при вымывании дождем окислов азота, которые являются результатом разряда молнии или поступают из антропогенных источников.
Нитраты и нитриты широко распространены в окружающей среде, они обнаруживаются в большинстве пищевых продуктов, в атмосфере и во многих водных источниках. Поступлению этих ионов в воду способствует использование удобрений, гниение растительного и животного материала, бытовые стоки, удаление в почву осадка сточных вод, промышленные сбросы, вымывание из мест захоронения отходов и вымывание из атмосферы. В природных чистых водах нитратов, как правило, немного. Однако в грунтовых водах в пределах населенных пунктов, животноводческих ферм и в других местах, где почва длительно и массивнозагрязняется, содержание нитратов может быть высоким.
Поскольку ни один из обычно используемых методов очистки и обеззараживания воды не изменяет значительно уровня содержания нитратов, и поскольку концентрация нитратов заметно не изменяется в системе распределения воды, уровни содержания в водопроводной воде часто полностью аналогичны таковым для водных источников. Содержание нитритов в водопроводной воде ниже, чем в водных источниках, что вызвано их окислением в процессе очистки воды, особенно при хлорировании.
Метаболизм. Нитраты и нитриты легко поглощаются организмом. Нитраты поглощаются в верхних отделах тонкого кишечника, концентрируются преимущественно в слюне через посредство слюнных желез, выводятся через почки. Нитрат может легко превращаться в нитрит в результате бактериального восстановления. Восстановление нитратов в нитриты происходит во всем организме, включая желудок. Это превращениезависит от значения рН. У грудных детей, у которых кислотность в желудке в норме очень низкая, образуется большое количество нитрита. У взрослых кислотность в желудке характеризуется значением рН 1-5 и в меньшей степени происходит превращение нитрата в нитриты. Нитрит может окислять гемоглобин в метгемоглобин. При определенных условия нитриты могут реагировать в организме человека с вторичными и третичными аминами и амидами (пища) с образованием нитрозаминов, некоторые из которых считаются канцерогенами.
Значение нитратов, нитритов:
— вызывают развитие «водно-нитратнойметгемоглобинемии» за счет окисления нитритами гемоглобина в метгемоглобин. В основном данное заболевание возникает у детей. Чувствительность грудных детей к действию нитратов относили за счет их высокого поступления в организм относительно массы тела, присутствием нитрат редуцирующих бактерий в верхних отделах ЖКТ и более легким окислением эмбрионального гемоглобина. Кроме того, повышенная чувствительность наблюдается у грудных детей, страдающих нарушениями функции ЖКТ, при которых увеличивается количество бактерий, способных превращать нитраты в нитриты. Использование искусственных смесей для вскармливания детей тоже рассматривается как причина увеличения заболеваемости, так как вода, используемая для приготовления смеси может содержать повышенное количество нитратов. У грудных детей в желудке значение рН, близкое к нейтральному, способствует бактериальному росту в желудке и в верхних отделах кишечника. У детей отмечается недостаточность по двум специфическим ферментам, которые осуществляют обратное превращение метгемоглобина в гемоглобин. Длительное кипячение может усугублять проблему вследствие увеличения количества нитратов при испарении воды. Чаще причиной заболевания являлось использование в качестве источника воды частных колодцев с микробиологическим загрязнением (в них отсутствуют водоросли, активно потребляющие нитраты). Заболевание характеризуется развитием одышки, цианоза, тахикардии, судорог. У детей старше 1 года и взрослых заболевание в форме острого токсического цианоза не наблюдается, но возрастает содержание метгемоглобина в крови, что ухудшает транспорт кислорода к тканям — это проявляется слабостью, бледностью кожных покровов, повышенной утомляемостью.
— вызывают образование нитрозаминов, некоторые из них могут быть канцерогенами. Образование этих веществ происходит во рту или где-либо ещё в организме, где кислотность относительно низкая.
— являются показателем загрязнения воды органическими веществами.
Значение рН (активная реакция).
Кислыми являются болотистые воды, содержащие гуминовые вещества, щелочными — подземные воды, богатые бикарбонатами.
— определяет природные свойства воды;
— является показателем загрязнения открытых водоемов при спуске в них кислых или щелочных производственных сточных вод;
— значение рН тесно связано с другими показателями качества питьевой воды. Рост железобактерий в большой степени зависит от рН. Они образуют в качестве конечного продукта метаболизма гидрат окиси железа, который придает красный цвет воде. При высоких значениях рН вода приобретает горький вкус.
— эффективность процессов коагуляции и обеззараживания зависит от рН. Обеззараживающее действие хлора в воде ниже при высоких значениях рН; это связано со снижением концентрации хлорноватистой кислоты.
источник
Настоящий документ устанавливает методику выполнения измерений (МВИ) массовой концентрации сульфат-ионов турбидиметрическим методом природной, а также неопалесцирующих, неокрашенных или слабоокрашенных проб сточной воды, содержащей не более 5 мг/дм 3 железа.
Диапазон измеряемых концентраций от 10 до 1000 мг/дм 3 сульфат-ионов. При более высокой концентрации сульфат-ионов (до 10000 мг/дм 3 ) допускается разбавление проб дистиллированной водой.
Мешающее влияние карбонатов и гидрокарбонатов устраняют соляной кислотой (в составе осадительной смеси).
Настоящая методика обеспечивает получение результатов анализа с погрешностью, не превышающей значений, приведенных в Таблице 1.
Диапазон измерений, значения показателей точности, повторяемости и воспроизводимости методики
Показатель точности (границы относительной погрешности при вероятности Р = 0,95), ± d , %
Показатель повторяемости (относительное среднеквадратическое отклонение повторяемости), s r
Показатель воспроизводимости (относительное среднеквадратическое отклонение воспроизводимости), s R, %
Значения показателя точности методики используют при:
— оформлении результатов измерений, выдаваемых лабораторией;
— оценке деятельности лабораторий на качество проведения испытаний;
— оценке возможности использования результатов измерений при реализации методики в конкретной лаборатории.
При выполнении измерений массовой концентрации сульфат-ионов применяют следующие средства измерения, реактивы, вспомогательные устройства, материалы и растворы.
3.1 Средства измерений и стандартные образцы
— Прибор для фотометрического анализа (фотометр, фотоэлектроколориметр или спектрофотометр, позволяющий измерять оптическую плотность в диапазоне 600 — 670 нм в кюветах с толщиной поглощающего слоя 30 и 50 мм.
— Весы лабораторные общего назначения (например, ВЛР-200, ВЛА-200) по ГОСТ 24104-2001.
— Колбы мерные вместимостью 100, 50, 25 см 3 2-го класса точности по ГОСТ 1770-74.
— Пипетки с одной отметкой 2-го класса точности вместимостью 5, 10, 25, 50 см 3 по ГОСТ 29169-91.
— Пипетки градуированные 2-го класса точности вместимостью 1, 2, 5, 10 см 3 по ГОСТ 29227-91.
— Государственный стандартный образец состава раствора сульфат-иона (1 мг/см 3 ) ГСО 7253-96.
Примечание. Допускается использование средств измерения и стандартных образцов с аналогичными или лучшими метрологическими характеристиками. Средства измерения должны быть поверены в установленные сроки.
3.3 Вспомогательные устройства в материалы
— Фильтры обеззоленные «синяя лента» по ТУ 609-1678-86.
— Колбы конические вместимостью 25, 100, 500, 1000 см 3 по ГОСТ 25336-82. Воронки лабораторные по ГОСТ 25336-82.
— Бутыли стеклянные и полиэтиленовые для хранения вспомогательных растворов, а также для хранения и транспортировки проб.
3.4 Приготовление растворов для анализа
60 г хлорида бария и 30 г борной кислоты растворяют при нагревании в 500 — 600 см 3 дистиллированной воды и охлаждают. Приливают 200 см 3 глицерина, 50 см 3 концентрированной соляной кислоты, разбавляют дистиллированной водой до 1000 см 3 , перемешивают и оставляют на 2 — 3 дня. Затем приготовленный раствор декантируют с осадка.
3.4.2 . Рабочий раствор сульфат-иона, массовая концентрация 100 мг/дм 3
В мерную колбу вместимостью 50 см 3 помещают 5 см 3 ГСО состава раствора сульфат-иона (массовая концентрация 1 мг/см 3 ), разбавляют до метки дистиллированной водой и тщательно перемешивают. Срок хранения полученного раствора — 3 месяца.
Примечание. При использовании ГСО с концентрацией сульфат-иона 10 мг/см 3 необходимо приготовить промежуточный раствор с концентрацией 1 мг/см 3 , разбавляя в мерной колбе 5 см 3 раствора ГСО до 50 см 3 дистиллированной водой.
Метод измерения массовой концентрации сульфат-иона основан на образовании стабилизированной суспензии сульфата бария в солянокислой среде с последующим измерением светорассеяния в направлении падающего луча (в единицах оптической плотности).
При выполнении измерений массовой концентрации сульфат-ионов необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007-76, требования электробезопасности при работе с электроустановками по ГОСТ 12.1.019-79.
Помещение должно соответствовать требованиям пожаробезопасности по ГОСТ 12.1.004-91 и иметь средства пожаротушения по ГОСТ 12.4.009-83. Содержание вредных веществ в воздухе не должно превышать допустимых значений по ГОСТ 12.1.005-88. Организация обучения работающих безопасности труда по ГОСТ 12.0.004-90.
К выполнению измерений и обработке результатов допускают специалиста, имеющего высшее или среднее специальное химическое образование или опыт работы в химической лаборатории, прошедшего соответствующий инструктаж, освоившего метод в процессе тренировки и уложившегося в нормативы оперативного контроля при выполнении процедур контроля погрешности.
При выполнении измерений в лаборатории должны быть соблюдены следующие условия:
температура воздуха 20 ± 5 °С;
атмосферное давление 84,0 — 106,7 кПа (630 — 800 мм рт.ст.);
влажность воздуха не более 80 % при температуре 25 °С;
напряжение в сети 220 ± 22 В;
частота переменного тока 50 ± 1 Гц.
Отбор проб производится в соответствии с требованиями ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб».
Объем отбираемой пробы составляет не менее 100 см 3 . Пробу можно не консервировать, однако при наличии соединений серы иных форм (сульфиты, сульфиды, тиосульфаты) проба должна быть проанализирована в течение 2 час.
При подготовке к выполнению измерений должны быть проведены следующие работы: приготовление вспомогательных (п. 3.4) и градуировочных растворов (п. 9.1) и градуировка фотометра (спектрофотометра).
9.1 Приготовление градуировочных растворов
В шесть мерных колб вместимостью 50 см 3 помещают по 20 см 3 осадительного раствора по п. 3.4.1 и затем в пять из них приливают по каплям 2,0; 4,0; 6,0; 8,0; 10,0 см 3 рабочего раствора сульфат-иона с концентрацией 100 мг/дм 3 , что соответствует его содержанию 0,2; 0,4; 0,6; 0,8; 1,0 мг в 50 см 3 , и затем содержимое всех колб (включая колбу, в которую сульфат-ион не добавляли) разбавляют до метки дистиллированной водой.
Растворы перемешивают в течение 30 сек и через 5 — 10 мин измеряют оптическую плотность каждого раствора относительно раствора, приготовленного без сульфат-ионов.
Примечание. Измерения для каждого раствора должны производиться строго в одно и то же время после добавления раствора сульфат-ионов.
9.2 Построение градуировочного графика
Через 5 — 10 мин после приготовления растворов по п. 9.1 измеряют оптическую плотность (не менее пяти отсчетов) полученных растворов при длине волны 600 — 670 нм в зависимости от спектральных характеристик светофильтра, входящего в комплект прибора. При использовании спектрофотометров измерения производят при длине волны 650 нм. Толщина поглощающего слоя — 30 или 50 мм, раствор сравнения — первый градуировочный раствор (без сульфат-иона).
Вычисляют среднее арифметическое полученных значений оптической плотности и строят градуировочный график в координатах оптическая плотность — содержание сульфат-ионов в растворах градуировочной серии, мг.
Рекомендуется для хранения и обработки градуировочного графика использовать возможности микропроцессора прибора и программы для ПЭВМ.
9.3 Контроль стабильности градуировочной характеристики
Контроль стабильности градуировочной характеристики проводят при смене партий реактивов, но не реже одного раза в месяц. Средствами контроля являются вновь приготовленные образцы для градуировки (не менее 3 образцов из приведенных в п. 9.1). Измеряют оптическую плотность (не менее 5 измерений) и находят среднее арифметическое полученных значений.
Градуировочную характеристику считают стабильной при выполнении для каждого образца для градуировки следующего условия:
где X — результат контрольного измерения массовой концентрации сульфат-ионов в образце для градуировки;
С — аттестованное значение массовой концентрации сульфат-ионов в образце для градуировки;
s Rл — среднеквадратическое отклонение внутрилабораторной прецизионности, установленное при реализации методики в лаборатории.
Примечание. Допустимо среднеквадратическое отклонение внутрилабораторной прецизионности при внедрении методики в лаборатории устанавливать на основе выражения: s Rл= 0,84 s R, с последующим уточнением по мере накопления информации в процессе контроля стабильности результатов анализа.
Значения s R приведены в Таблице 1.
Если условие стабильности градуировочной характеристики не выполняется только для одного образца для градуировки, необходимо выполнить повторное измерение этого образца с целью исключения результата, содержащего грубую погрешность.
Если градуировочная характеристика нестабильна, выясняют причины и повторяют контроль с использованием других образцов для градуировки, предусмотренных методикой. При повторном обнаружении нестабильности градуировочной характеристики строят новый градуировочный график.
Пробу сточной воды фильтруют через фильтр «синяя лента», отбрасывая первые порции фильтрата. Затем анализируют две аликвотные порции воды. Содержание сульфат-ионов в аликвотной порции должно составлять 0,2 — 1,5 мг, желательно 0,5 — 1,5 мг.
В три мерные колбы вместимостью 50 см 3 помещают по 20 см 3 осадительной смеси по п. 3.4.1, затем в две из них по каплям вносят 1 — 20 см 3 анализируемой пробы. Содержимое всех колб быстро доводят до метки дистиллированной водой, перемешивают в течение 30 сек и через 5 — 10 мин (точное значение времени выдержки должно быть таким же, как и при приготовлении градуировочных растворов) измеряют оптическую плотность растворов проб относительно раствора, приготовленного без введения пробы. Условия измерения оптической плотности те же, что и при построении градуировочной зависимости.
Вычисляют среднее арифметическое полученных значений оптической плотности для каждого из двух растворов проб и находят при помощи градуировочной зависимости содержание сульфат-ионов в отобранной аликвотной порции анализируемой пробы воды, мг.
Примечание. Если содержание сульфат-ионов в аликвотной порции пробы оказывается менее 0,2 мг или более 1,5 мг, то анализ повторяют, изменив аликвотную порцию.
Массовую концентрацию сульфата вычисляют по формуле:
где X — массовая концентрация сульфат-ионов в пробе, мг/дм 3 ;
Q — содержание сульфат-ионов в аликвотной порции пробы, найденное по градуировочному графику, мг;
V — объем аликвотной порции пробы, см 3 .
За результат измерения Хсрпринимают среднее арифметическое значение двух параллельных определений Х1и Х2
для которых выполняется следующее условие:
где r — предел повторяемости, значения которого приведены в Таблице 2.
Значения предела повторяемости при вероятности Р = 0,95
Предел повторяемости (относительное значение допускаемого расхождения между двумя результатами параллельных определений), r, %
При невыполнении условия (1) могут быть использованы методы проверки приемлемости результатов параллельных определений и установления окончательного результата согласно раздела 5 ГОСТ Р ИСО 5725-6.
Расхождение между результатами измерений, полученными в двух лабораториях, не должно превышать предела воспроизводимости. При выполнении этого условия приемлемы оба результата измерений, и в качестве окончательного может быть использовано их среднее арифметическое значение. Значения предела воспроизводимости приведены в Таблице 3.
Значения предела воспроизводимости при вероятности Р = 0,95
Предел воспроизводимости (относительное значение допускаемого расхождения между двумя результатами измерений, полученными в разных лабораториях), R, %
При превышения предела воспроизводимости могут быть использованы методы оценки приемлемости результатов анализа согласно раздела 5 ГОСТ Р ИСО 5725-6.
Результат измерения Хсрв документах, предусматривающих его использование, может быть представлен в виде: Хср± D , Р = 0,95,
где D — показатель точности методики.
Значение D рассчитывают по формуле: D = 0,01 ×d × Хср. Значение d приведено в таблице 1.
Допустимо результат измерения в документах, выдаваемых лабораторией, представлять в виде: Хср± D л , Р = 0,95, при условии D л D , где
Хср — результат измерения, полученный в соответствии с прописью методики;
± D л — значение характеристики погрешности результатов измерений, установленное при реализации методики в лаборатории, и обеспечиваемое контролем стабильности результатов измерений.
Примечание. При представлении результата измерения в документах, выдаваемых лабораторией, указывают:
— количество результатов параллельных определений, использованных для расчета результата измерения;
— способ определения результата измерения (среднее арифметическое значение или медиана результатов параллельных определений).
Контроль качества результатов измерений при реализации методики в лаборатории предусматривает:
— оперативный контроль процедуры измерений (на основе оценки погрешности при реализации отдельно взятой контрольной процедуры);
— контроль стабильности результатов измерений (на основе контроля стабильности среднеквадратического отклонения повторяемости, среднеквадратического отклонения внутрилабораторной прецизионности, погрешности).
13.1 Алгоритм оперативного контроля процедуры измерений с использованием метода добавок
Оперативный контроль процедуры измерений проводят путем сравнения результата отдельно взятой контрольной процедуры Ккс нормативом контроля К.
Результат контрольной процедуры Кк рассчитывают по формуле
где Х ¢ ср — результат измерения массовой концентрации сульфат-ионов в пробе с известной добавкой — среднее арифметическое двух результатов параллельных определений, расхождение между которыми удовлетворяет условию (1) раздела 11.
X ср — результат измерения массовой концентрации сульфат-ионов в исходной пробе — среднее арифметическое двух результатов параллельных определений, расхождение между которыми удовлетворяет условию ( 1 ) раздела 11 .
Норматив контроля К рассчитывают по формуле
где 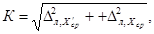
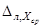
Примечание. Допустимо характеристику погрешности результатов измерений при внедрении методики в лаборатории устанавливать на основе выражения: D л = 0,84 × D , с последующим уточнением по мере накопления информации в процессе контроля стабильности результатов измерений.
Процедуру измерений признают удовлетворительной, при выполнении условия:
При невыполнении условия (2) контрольную процедуру повторяют. При повторном невыполнении условия (2) выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
13.2 Алгоритм оперативного контроля процедуры измерений с применением образцов для контроля
Оперативный контроль процедуры анализа проводят путем сравнения результата отдельно взятой контрольной процедуры Ккс нормативом контроля К.
Результат контрольной процедуры Кк рассчитывают по формуле
где Сср — результат измерения массовой концентрации сульфат-ионов в образце для контроля — среднее арифметическое двух результатов параллельных определений, расхождение между которыми удовлетворяет условию (1) раздела 11;
С — аттестованное значение образца для контроля.
Норматив контроля К рассчитывают по формуле
где ± D л — характеристика погрешности результатов измерений, соответствующая аттестованному значению образца для контроля.
Примечание. Допустимо характеристику погрешности результатов измерений при внедрении методики в лаборатории устанавливать на основе выражения: D л = 0,84 × D , с последующим уточнением по мере накопления информации в процессе контроля стабильности результатов измерений.
Процедуру измерений признают удовлетворительной, при выполнении условия:
При невыполнении условия (3) контрольную процедуру повторяют. При повторном невыполнении условия (3) выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
Периодичность оперативного контроля процедуры измерений, а также реализуемые процедуры контроля стабильности результатов измерений регламентируют в Руководстве по качеству лаборатории.
источник
Аналитический центр более 20 лет занимается химическим анализом и разработкой новых методов анализа и диагностики веществ и материалов
В нашем распряжении самый современный приборный парк благодаря научно-техническому взаимодействию с крупнейшими мировыми разработчиками аналитического оборудования
Наши сотудники — это лучшие специалисты страны в области химического анализа, кандидаты и доктора наук
Аккредитация позволяет исследовать питьевую, природную, морскую, технологическую, талую воду и воду бассейнов
Обратившись к нам, Вы получите не только точные данные о присутствующих в воде загрязнителях, но и подробные рекомендации о способах очистки воды.
На основании анализа воды БЕСПЛАТНО подберем несколько вариантов систем водоочистки!
В нашей лаборатории Вы можете проверить качество воды из любого источника: колодца, скважины, водопровода, бассейна, родника, водоема. Для каждого источника есть оптимальный набор показателей, характеризующий возможность использования воды для тех или иных нужд. Чтобы правильно подобрать набор показателей, свяжитесь с нами по номеру +7 (495)149-23-57 или напишите на почту info@ion-lab.ru
Мы рекомендуем выбирать набор параметров в зависимости от того, какой у Вас источник водоснабжения, а также для каких целей планируете использовать воду. Для воды из городского водопровода, а также для воды, используемой в технических целях, подойдут наборы «Минимальный» или «Начальный». Для воды природных источников (скважины, колодцы, родники и т.д.) мы рекомендуем проверить воду на химический состав (наборы «Расширенный» или «Максимальный»), а также сделать анализ на микробиологию.
Да, Вы можете самостоятельно отобрать воду для анализа, следуя инструкции. Или же заказать выезд специалиста, который приедет в назначенное время со всей необходимой тарой, отберет воду и доставит ее в лабораторию.
Да, конечно! Пункт приема проб расположен по адресу: Москва, ул. Добролюбова, 21А, корпус А, пом. 14 (в пешей доступности от метро Фонвизинская, Бутырская, Тимирязевская)
Стоимость выезда специалиста зависит от выбранного Вами набора показателей и удаленности. Более точная информация размещена в разделе Доставка и оплата
© 1997-2019 — Лаборатория ИОН. Все права защищены.
Для химического анализа необходимо заполнить водой чистую пластиковую тару (оптимально 1,5 л). Использовать бутылки из-под сладких, газированных или ароматизированных напитков, а также солёной или минеральной воды недопустимо.
Если выбранный Вами анализ включает определение содержания нефтепродуктов, необходимо заполнить дополнительную стеклянную тару объемом 0,2 л.
Если выбранный Вами анализ включает определение содержания сероводорода, необходимо заполнить дополнительную стеклянную тару объемом 0,5 л (необходимо использовать консервант).
При отборе воды из проточного источника, непосредственно перед отбором необходимо пролить воду сильной струёй в течение 3-5 минут. Перед отбором проб ёмкости и крышки необходимо 3 раза промыть изнутри водой, подлежащей анализу. Использование моющих средств недопустимо. Наполнять тару необходимо тонкой струёй по стенке сосуда «под горлышко». Это снижает насыщение воды кислородом и предотвращает протекание реакций.
Для микробиологического анализа необходимо использовать стерильный контейнер для биоматериалов объемом 150-200 мл.
Перед взятием пробы необходимо протереть водопроводный кран спиртовой салфеткой, уделив особое внимание месту выхода воды.
При отборе воды из водопровода, скважины или колонки необходимо пролить воду сильной струёй в течение 3–5 минут.
При отборе воды из колодца с помощью ведра необходимо обдать ведро кипятком для дезинфекции. Отбор пробы через поливочные шланги и предметы, контактирующие с почвой, не допускается.
Для отбора пробы необходимо надеть перчатки и вскрыть упаковку стерильного контейнера. Не касаясь внутренней поверхности ёмкости, отобрать образец воды (2/3 объема контейнера) и закрыть крышкой.
Рекомендуем доставлять пробу сразу после отбора.
Если сразу после отбора нет возможности доставить пробу в лабораторию, допускается хранение образцов при температуре 2–10 °C в течение 1 суток.
Съезд на ул. Руставели, на первом светофоре поворот налево на ул. Яблочкова.
Через 300 м поворот направо на ул. Гончарова, через 500 м поворот налево (напротив дома №6), через 200 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Поворот на ул. Руставели, на светофоре поворот направо на ул. Добролюбова, через 300м на светофоре поворот налево на ул. Гончарова, напротив дома №6 поворот направо, через 200 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Двигаясь по ул. Милошенкова, поворачиваем на ул. Добролюбова
Через 150 метров поворот направо, за домом 21АкБ поворот налево, через 100-120 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Ближайшее станция метро – Фонвизинская (600 м)
Последний вагон из центра. Выход в сторону улицы Фонвизина. Из стеклянный дверей направо. Перейти через пешеходный переход и идти через дворы в соответствии со схемой. Пункт назначения — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Анализ «Минимальный» содержит минимальный и обязательный перечень загрязнителей, часто встречающихся в питьевой воде, и включает 16 показателей:
- органолептические: мутность, цветность, запах, привкус;
- общехимические: рН, жесткость, окисляемость перманганатная, минерализация, электропроводность, щелочность общая, щелочность свободная;
- катионы: железо, аммоний;
- анионы: нитраты, карбонат, гидрокарбонат.
Данный набор рекомендуется для исследования воды хозяйственно-бытового назначения. Анализ «Минимальный» не обладает достаточной информативностью для подбора системы водоочистки, так как не позволяет получить полную картину о безопасности воды. Если Вы планируете использовать воду в питьевых целях, рекомендуем обратить внимание на наборы, содержащие большее число параметров.
- Точность определения
- Подходит для воды, применяемой в хоз-бытовом назначении
- Срок выполнения — 3-4 рабочих дня
- Не подходит для воды, применяемой в питьевых целях
- Не подходит для корректного подбора фильтров
- Не содержит определения опасных загрязнителей
Анализ «Начальный» предназначен для выявления наиболее часто встречающихся вредных веществ в питьевой воде и включает 23 параметра: мутность, цветность, запах, привкус, рН, жесткость, окисляемость, минерализация, электропроводность, щелочность свободная, щелочность общая, железо, марганец, калий, магний, кальций, фториды, хлориды, нитраты, сульфаты, карбонат, гидрокарбонат, аммоний Данный анализ рекомендуется для оценки качества воды из колодцев, скважин, родников. По протоколу анализа «Начальный» возможен подбор системы водоочистки и типа фильтрующей загрузки. В перечень определяемых параметров входят органолептические показатели, общие химические показатели, а также содержание катионов и анионов
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для колодцев и скважин
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Позволяет корректно и экономично настроить водоочистное оборудование
- Не содержит перечень тяжелых металлов
- Не содержит перечень всех опасных загрязнений
- Срок выполнения исследований 5-6 рабочих дней
Анализ «Расширенный» содержит перечень наиболее часто встречающихся загрязнителей воды, вне зависимости от источника, и включает 31 показатель: мутность, цветность, запах, привкус, рН, жесткость, окисляемость, минерализация, электропроводность, щелочность общая, щелочность свободная, аммоний, алюминий, железо общее, магний, кальций, калий, натрий, марганец, медь, мышьяк, свинец, кадмий, цинк, стронций, фториды, хлориды, нитраты, сульфаты, гидрокарбонат, карбонат. Данный набор рекомендуется, в первую очередь, владельцам колодцев и скважин. Содержит перечень основных тяжелых металлов. Перед покупкой системы водоподготовки рекомендуем провести исследование воды с данным перечнем загрязнителей. Ориентируясь на полученную информацию, Вы сможете подобрать оборудование водоочистки с эффективностью до 98%, а так же корректно его настроить.
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для колодцев и скважин
- Содержит перечень тяжелых металлов
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Позволяет корректно и экономично настроить водоочистное оборудование
Анализ «Максимальный» содержит полный перечень опасных для здоровья человека веществ, встречающихся в воде, поступающих из скважин или колодцев, включая ионы тяжелых металлов и органические вещества, а именно: мутность, цветность, запах, привкус, рН, жесткость, окисляемость, минерализация, электропроводность, щелочность общая, щелочность свободная, аммоний, натрий, калий, магний, кальций, алюминий, железо, марганец, литий, барий, бериллий, бор, ванадий, молибден, кобальт, цинк, никель, хром, стронций, кадмий, мышьяк, медь, свинец, кремний, серебро, титан, ртуть, гиброкарбонат, карбонат, нитрат, хлорид, сульфат, фосфат, фторид, нитрит, сероводород, сульфид, гидросульфид, хлор общий, хлор остаточный, хлор остаточный свободный, АПАВ, нефтепродукты, фенол, формальдегид, бензол, толуол, о-ксилол, п-ксилол, м-ксилол, стирол Данное исследование рекомендуется для клиентов, которые серьезно относятся к выбору питьевой воды. Протокол анализа «Максимальный» позволяет со 100% уверенностью сделать вывод о пригодности воды для питья и приготовления пищи. Результаты исследования позволяют выбрать схему водоочиски, а также оценить эффективность уже установленного оборудования.
Воды, применяемой в хозяйственно-бытовом назначении; оценки работы системы водоочистки.
пластиковая бутылка 1,5 — 2 л.
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для любых источников воды
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Включает полный перечень тяжелых металлов
- Позволяет корректно и экономично настроить водоочистное оборудование
- Содержит полный перечень опасных органических веществ
Помимо хичиеского анализа воды мы настоятельно рекомендуем провести микробиологическое исследование Вашей воды. Микробиологический анализ воды включает определение общего микробного числа (ОМЧ), количества общих колиформных и колиформных термотолерантных бактерий.
источник
Сульфаты присутствуют практически во всех поверхностных водах и являются одними из важнейших анионов. Главным источником сульфатов в поверхностных водах являются процессы химического выветривания и растворения серосодержащих минералов, в основном гипса, а также окисления сульфидов и серы:
Значительные количества сульфатов поступают в водоемы в процессе отмирания организмов, окисления наземных и водных веществ растительного и животного происхождения и с подземным стоком. В больших количествах сульфаты содержатся в шахтных водах и в промышленных стоках производств, в которых используется серная кислота, например, окисление пирита. Сульфаты выносятся также со сточными водами коммунального хозяйства и сельскохозяйственного производства.
Ионная форма SO4 2- характерна только для маломинерализованных вод. При увеличении минерализации сульфатн ые ио ны склонны к образованию устойчивых ассоциированных нейтральных пар типа CaSO4, MgSO4.
Содержание сульфатных ионов в растворе ограничивается сравнительно малой растворимостью сульфата кальция (произведение растворимости сульфата кальция L=6,1·10 -5 ). При низких концентрациях кальция, а также в присутствии посторонних солей концентрация сульфатов может значительно повышаться.
Сульфаты активно участвуют в сложном круговороте серы. При отсутствии кислорода под действием сульфатредуцирующих бактерий они восстанавливаются до сероводорода и сульфидов, которые при появлении в природной воде кислорода снова окисляются до сульфатов. Растения и другие автотрофные организмы извлекают растворенные в воде сульфаты для построения белкового вещества. После отмирания живых клеток гетеротрофные бактерии освобождают серу протеинов в виде сероводорода, легко окисляемого до сульфатов в присутствии кислорода.
Концентрация сульфата в природной воде изменяется в широких пределах. В речных водах и в водах пресных озер содержание сульфатов часто колеблется от 5-10 до 60 мг/дм 3 , в дождевых водах – от 1 до 10 мг/дм 3 . В подземных водах содержание сульфатов может достигать значительно больших величин.
Концентрация сульфатов в поверхностных водах подвержена заметным сезонным колебаниям и обычно коррелирует с изменением общей минерализации воды. Важнейшим фактором, определяющим режим сульфатов, является меняющееся соотношение между поверхностным и подземным стоками. Заметное влияние оказывают окислительно-восстановительные процессы, биологическая обстановка в водном объекте и хозяйственная деятельность человека.
Повышенное содержание сульфатов ухудшает органолептические свойства воды и оказывают физиологическое воздействие на организм человека. Поскольку сульфат обладает слабительными свойствами, его предельно допустимая концентрация строго регламентируется нормативными актами. Весьма жесткие требования по содержанию сульфатов предъявляются к водам, питающим паросиловые установки, поскольку сульфаты в присутствии кальция образуют прочную накипь. Вкусовой порог сульфата магния лежит в пределах от 400 до 600 мг/дм 3 , для сульфата кальция – от 250 до 800 мг/дм 3 .
ПДК сульфатов в воде водоемов хозяйственно-питьевого назначения составляет 500 мг /дм 3 , лимитирующий показатель вредн ости – о рганолептический.
Не замечено, чтобы сульфат в питьевой воде влиял на процессы коррозии, но при использовании свинцовых труб концентрация сульфатов выше 200 мг/дм 3 может привести к вымыванию в воду свинца.
Сульфаты – распространенные компоненты природных вод. Их присутствие в воде обусловлено растворением некото рых минералов – природных сульфатов (гипс), а также перено сом с дождями содержащихся в воздухе сульфатов. Последние образуются при реакциях окисления в атмосфере оксида серы ( IV ) до оксида серы ( VI ), образования серной кислоты и ее нейтрализации (полной или частичной):
Наличие сульфатов в промышленных сточных водах обыч но обусловлено технологическими процессами, протекающими с использованием серной кислоты (производство минеральных удоб рений, производства химических веществ). Сульфаты в питьевой воде не оказывают токсического эффекта для человека, однако ухудшают вкус воды: ощущение вкуса сульфатов возникает при их концентрации 250-400 мг/л. Сульфаты могут вызывать отложе ние осадков в трубопроводах при смешении двух вод с разным минеральным составом, например, сульфатных и кальциевых, в осадок выпадает Са S О4.
источник
Сульфаты – распространенные компоненты природных вод. Их присутствие в воде обусловлено растворением некоторых минералов – природных сульфатов (гипс), а также переносом с дождями содержащихся в воздухе сульфатов. Последние образуются при реакциях окисления в атмосфере оксида серы (IV) до оксида серы (VI), образования серной кислоты и ее нейтрализации (полной или частичной):
Наличие сульфатов в промышленных сточных водах обычно обусловлено технологическими процессами, протекающими с использованием серной кислоты (производство минеральных удобрений, производства химических веществ). Сульфаты в питьевой воде не оказывают токсического воздействия на человека, однако ухудшают вкус воды: ощущение вкуса сульфатов возникает при их концентрации 250–400 мг/л. Сульфаты могут вызывать отложение осадков в трубопроводах при смешении двух вод с разным минеральным составом, например сульфатных и кальциевых (в осадок выпадает СаSO4).
Метод определения массовой концентрации сульфат-аниона основан на реакции сульфат-анионов с катионами бария с образованием нерастворимой суспензии сульфата бария по реакции:
О концентрации сульфат-анионов судят по количеству суспензии сульфата бария, которое определяют турбидиметрическим методом. Предлагаемый, наиболее простой, вариант турбидиметрического метода основан на измерении высоты столба суспензии по его прозрачности и применим при концентрациях сульфат-анионов не менее 30 мг/л.
Анализ выполняют в прозрачной воде (при необходимости воду фильтруют). Для работы необходим мутномер – несложное приспособление, которое может быть изготовлено и самостоятельно.
ПДК сульфатов в воде водоемов хозяйственно-питьевого назначения составляет 500 мг/л, лимитирующий показатель вредности – органолептический.
Мутномер (см. рис. 2), пипетка на 2 мл или на 5 мл с резиновой грушей (медицинским шприцем) и соединительной трубкой, пипетка-капельница, пробирки мутномерные с рисунком-точкой на дне и резиновым кольцом-фиксатором, пробка для мутномерной пробирки.
Раствор нитрата бария (насыщенный), раствор соляной кислоты (20%).
Приготовление растворов см. приложение 3.
Экран мутномера устанавливают под углом около 45° к подставке. Работа проводится при рассеянном, но достаточно сильном (200–500 Лк) дневном (искусственном, комбинированном) освещении экрана мутномера.
В каждое отверстие мутномера вставляют мутномерную пробирку с надетым на нее резиновым кольцом в положении, фиксирующем пробирку таким образом, чтобы нижняя ее часть была выдвинута в вырез мутномера на расстояние около 1 см (при этом дно пробирки окажется на требуемом расстоянии – около 2 см от экрана).
1. Поместите в отверстия мутномера две пробирки с рисунком на дне. В одну из пробирок налейте анализируемую воду до высоты 100 мм (20–30 мл).
2. Добавьте к содержимому пробирки пипетками 2 капли раствора соляной кислоты и 14–15 капель раствора нитрата бария.
Соблюдайте осторожность: нитрат бария токсичен!
3. Герметично закройте пробирку пробкой и встряхните, чтобы перемешать содержимое.
4. Пробирку с раствором оставьте на 5–7 мин. для образования белого осадка (суспензии).
5. Закрытую пробирку снова встряхните, чтобы перемешать содержимое.
6. Пипеткой переносите образовавшуюся суспензию во вторую (пустую) пробирку до тех пор, пока в первой пробирке не появится изображение рисунка на дне*. Измерьте высоту столба суспензии в первой пробирке (h1, мм). Наблюдение проводите, как показано на рисунке (направляя свет на вращающийся экран мутномера, установленный под углом 45°).
7. Продолжайте переносить суспензию до тех пор, пока в ней не скроется изображение рисунка. Измерьте высоту столба суспензии во второй пробирке (h2, мм).
8. Рассчитайте среднее арифметическое измерений высоты столба суспензии (h) по формуле:
9. По табл. 10 определите концентрацию сульфат-аниона в мг/л.
Определение концентрации сульфат-аниона
источник
Химический состав воды является причиной заболеваний неинфекционной природы.
Причины изменения химического состава воды:
1) промышленная и сельскохозяйственная деятельность человека- поступление производственных и бытовых сточных вод, атмосферных осадков, содержащих вредные вещества.
2) очистка питьевой воды — применение химических приемов обработки воды и содержание остаточных количеств реагентов в воде.
- сухой остаток
- жесткость
- хлориды
- сульфаты
- нитраты и нитриты
- значение рН
- микроэлементы
Сухой остаток
Сухой остаток-это общее содержание растворенных твердых веществ в воде, он дает представление о степени минерализации воды. Основными ионами, определяющими сухой остаток,, являются карбонаты, бикарбонаты, хлориды, сульфаты, нитраты, натрий, калий, кальций, магний. Данный показатель влияет на другие показатели качества питьевой воды, такие как привкус, жесткость, коррозирующие свойства и тенденция к накипеобразованию.
Воду с сухим остатком свыше 1000 мг/л называют минерализованной, до 1000 мг/л — пресной. Воду, содержащую до 50 — 100 мг/л, считают слабоминерализованной (дистиллированная),100 — 300 мг/л — удовлетворительно минерализованной, 300 — 500 мг/л — оптимальной минерализации и 500 — 1000 мг/л — повышенно минерализованной. Минерализованной водой является морская, минеральная, пресной — речная, дождевая, вода ледников.
- Вода с повышенным содержанием минеральных солей непригодна для питья, так как имеет соленый или горько- солёный вкус, а её употребление в зависимости от состава солей приводит к неблагоприятным физиологическим изменениям в организме:
- способствует перегреву в жаркую погоду,
- ведет к нарушению утоления жажды,
- изменяет водно-солевой обмен за счёт увеличения гидрофильности тканей,
- усиливает моторную и секреторную желудка и кишечника.
- Слабоминерализованная вода неприятна на вкус, длительное её употребление может привести к нарушению водно-солевого обмена (уменьшение содержания хлоридов в тканях). Такая вода, как правило, содержит мало микроэлементов.
Общая жесткость воды обусловлена преимущественно присутствием в воде кальция и магния, которые находятся в виде гидрокарбонатов, карбонатов, хлоридов, сульфатов и других соединений; имеют также значение ионы стронция, железа, бария, марганца.
- Устранимая — величина, на которую уменьшается общая жесткость воды при кипячении её в течении 1часа. Обусловлена гидрокарбонатами кальция и магния, которые разрушаются и выпадают в виде карбонатов в осадок (накипь).
- Карбонатная — это жесткость, обусловленная бикарбонатами и малорастворимыми карбонатами. Устранимая жесткость приблизительно равна карбонатной, но когда в воде много гидрокарбонатов натрия и кальция, карбонатная жесткость значительно превышает устранимую.
- Постоянная — это жесткость, которая остается после кипячения и обусловлена хлоридами, карбонатами, и сульфатами кальция и магния.
Воду с общей жесткостью до 3,5 мг-экв/л называют мягкой, 3,5-7 — средней жесткости, 7-10 — жесткой, свыше-10 — очень жесткой.
Основными природными источниками жесткости воды являются осадочные породы, фильтрация и сток с почвы. Жесткая вода образуется в районах с плотным пахотным слоем и известковыми образованиями. Для подземных вод характерна большая жесткость, чем для поверхностных. Подземные воды, богатые карбоновыми кислотами и растворенным кислородом, обладают высокой растворяющей способностью по отношению к почвам и породам, содержащим минералы кальцита, гипса и доломита.
Основными промышленными источниками жесткости являются стоки предприятий, производящих неорганические химические вещества, и горнодобывающая промышленность. Оксид кальция используется в строительной промышленности, производстве бумажной массы и бумаги, рафинировании сахара, в очистке нефти, дублении и как реагент для очистки воды и сточных вод. Сплавы магния применяются в литейном и штамповочном производстве, бытовых продуктах. Соли магния используются в производстве металлического магния, удобрений, керамики, взрывчатых веществ, медикаментов.
— ухудшаются органолептические свойства — вода имеет неприятный вкус;
— нарушается всасывание жиров в кишечнике в результате образования кальциево-магнезиальных нерастворимых мыл при омылении жиров;
— у лиц с чувствительной кожей способствует появлению дерматитов в связи с тем, что кальциево-магнезиальные мыла обладают раздражающим действием
— в хозяйственно-бытовом аспекте: увеличивается расход моющих средств, образуется накипь при кипячении, волосы после мытья становятся жесткими, ткани одежды теряют мягкость и гибкость, ухудшается разваривание мяса и овощей с потерей витаминов в результате связывания их в неусвояемые комплексы,
— имеются данные, что употребление слишком жесткой воды может приводить к увеличению частоты мочекаменной болезни; хотя есть сведения о том, что жесткость может служить защитой от болезней;
— при резком переходе от пользования жесткой водой к мягкой и наоборот могут у людей наблюдаться диспептические явления;
— портит вид, вкус и качество чая, который является важнейшим напитком у населения, стимулирующим желудочную секрецию и утоляющим жажду;
Имеются данные о том, что употребление мягкой воды может явиться причиной сердечно-сосудистых заболеваний.
Хлориды могут быть минерального и органического происхождения. Присутствие хлоридов в природных водах может быть связано с растворением отложений солей, загрязнением, обусловливаемым нанесением соли на дороги с целью борьбы со снегом льдом, сбросом стоков предприятиями химической промышленности, эксплуатацией нефтяных скважин, сбросом сточных вод, ирригационным дренажом, загрязнением в результате вымывания твердых отбросов и вторжения морской воды в прибрежные районы. Каждый из этих источников может вызвать загрязнение поверхностных и подземных вод. Высокая растворимость хлоридов объясняет широкое распространение их во всех природных водах.
Влияние на здоровье. Хлориды — наиболее распространенные в организме человека анионы и играют большую роль в осмотической активности внеклеточной жидкости; 88% хлоридов в организме находятся во внеклеточном пространстве. У здоровых людей происходит почти полное всасывание хлоридов.
— ухудшаются органолептические свойства — вода приобретает солоноватый вкус и в связи с этим ограничивается водопотребление;
— влияет на водно — солевой обмен; повышается уровень хлоридов в крови, что приводит к снижению диуреза и перераспределению хлоридов в органах и тканях;
— вызывают угнетение желудочной секреции, в результате чего нарушается процесс переваривания пищи;
— имеются данные о том, что хлориды оказывают гипертензивный эффект и у людей, страдающих гипертонической болезнью употребление воды с повышенным содержанием хлоридов может вызвать утяжеление течения заболевания;
— являются показателем загрязнения подземных и поверхностных водоисточников, так как хлориды содержаться в сточных водах и физиологических выделениях человека.
Сульфаты поступают в водную среду со сточными водами многих отраслей промышленности. Атмосферная двуокись серы (SO2), образующаяся при сгорании топлива и выделяющаяся в процессах обжига в металлургии, может вносить вклад в содержание сульфатов в поверхностных водах. Трехокись серы (SO3), образующаяся при окислении двуокиси серы, в сочетании с парами воды образуют серную кислоту, которая выпадает в виде «кислого дождя» или снега. Большинство сульфатов растворимы в воде.
С сульфатом алюминия, который используется в качестве флоккулянта при очистке воды, в очищенную воду может дополнительно попадать 20-50 мг/л сульфатов. Сульфаты не удаляются из воды обычными методами очистки. Концентрация в большинстве пресных вод очень низкая.
— сульфаты плохо всасываются из кишечника человека. Они медленно проникают через клеточные мембраны и быстро выводятся через почки. Сульфат магния действует как слабительное в концентрации выше 100 мг/л, приводя к очищению ЖКТ. Такой эффект возникает у людей, впервые использующих воду с высоким содержанием сульфатов (при переезде на новое место жительства, где употребляют сульфатную воду). Со временем человек адаптируется к такой концентрации сульфатов в воде.
— ограничивается водопотребление, так как сульфаты придают воде горько-соленый вкус в концентрации свыше 500 мг/л.
— неблагоприятно влияют на желудочную секрецию, приводя к нарушению процессов переваривания и всасывания пищи.
— являются показателем загрязнения поверхностных вод производственными сточными водами и подземных вод водами вышележащих водоносных горизонтов.
Нитраты, нитриты
Аммиак является начальным продуктом разложения органических азотосодержащих веществ. Поэтому наличие аммиака в воде может расцениваться как показатель опасного в эпидемическом отношении свежего загрязнения воды органическими веществами животного происхождения. В некоторых случаях наличие аммиака не указывает на недоброкачественность воды. Например: в глубоких подземных водах аммиак образуется за счет восстановления нитратов при отсутствии кислорода или повышенное содержание аммиака в болотистых и торфяных водах (аммиак растительного происхождения).
Соли азотистой кислоты (нитриты) представляют собой продукты неполного окисления аммиака под влиянием микроорганизмов в процессе нитрификации. Наличие нитритов свидетельствует о возможном загрязнении воды органическими веществами, однако нитриты указывают на известную давность загрязнения.
Соли азотной кислоты (нитраты) — конечные продукты минерализации органических веществ бактериями, присутствующими в почве и в воде с достаточным содержанием кислорода. Присутствие в воде нитратов без аммиака и нитритов указывает на завершение процесса минерализации.
Одновременное содержание в воде аммиака, нитритов и нитратов свидетельствует о незавершенности этого процесса и продолжающемся, опасном в эпидемическом отношении загрязнении воды. Однако повышенное содержание нитратов может иметь минеральное происхождение. Нитраты используют в качестве удобрений (селитра), во взрывчатых веществах, в химическом производстве и в качестве консервантов пищевых продуктов. Некоторые нитраты являются результатом фиксации в почве атмосферного азота (бактериальный синтез). Нитриты используют в качестве консервантов пищевых продуктов. Некоторые нитраты и нитриты образуются при вымывании дождем окислов азота, которые являются результатом разряда молнии или поступают из антропогенных источников.
Нитраты и нитриты широко распространены в окружающей среде, они обнаруживаются в большинстве пищевых продуктов, в атмосфере и во многих водных источниках. Поступлению этих ионов в воду способствует использование удобрений, гниение растительного и животного материала, бытовые стоки, удаление в почву осадка сточных вод, промышленные сбросы, вымывание из мест захоронения отходов и вымывание из атмосферы. В природных чистых водах нитратов, как правило, немного. Однако в грунтовых водах в пределах населенных пунктов, животноводческих ферм и в других местах, где почва длительно и массивнозагрязняется, содержание нитратов может быть высоким.
Поскольку ни один из обычно используемых методов очистки и обеззараживания воды не изменяет значительно уровня содержания нитратов, и поскольку концентрация нитратов заметно не изменяется в системе распределения воды, уровни содержания в водопроводной воде часто полностью аналогичны таковым для водных источников. Содержание нитритов в водопроводной воде ниже, чем в водных источниках, что вызвано их окислением в процессе очистки воды, особенно при хлорировании.
Метаболизм. Нитраты и нитриты легко поглощаются организмом. Нитраты поглощаются в верхних отделах тонкого кишечника, концентрируются преимущественно в слюне через посредство слюнных желез, выводятся через почки. Нитрат может легко превращаться в нитрит в результате бактериального восстановления. Восстановление нитратов в нитриты происходит во всем организме, включая желудок. Это превращениезависит от значения рН. У грудных детей, у которых кислотность в желудке в норме очень низкая, образуется большое количество нитрита. У взрослых кислотность в желудке характеризуется значением рН 1-5 и в меньшей степени происходит превращение нитрата в нитриты. Нитрит может окислять гемоглобин в метгемоглобин. При определенных условия нитриты могут реагировать в организме человека с вторичными и третичными аминами и амидами (пища) с образованием нитрозаминов, некоторые из которых считаются канцерогенами.
Значение нитратов, нитритов:
— вызывают развитие «водно-нитратнойметгемоглобинемии» за счет окисления нитритами гемоглобина в метгемоглобин. В основном данное заболевание возникает у детей. Чувствительность грудных детей к действию нитратов относили за счет их высокого поступления в организм относительно массы тела, присутствием нитрат редуцирующих бактерий в верхних отделах ЖКТ и более легким окислением эмбрионального гемоглобина. Кроме того, повышенная чувствительность наблюдается у грудных детей, страдающих нарушениями функции ЖКТ, при которых увеличивается количество бактерий, способных превращать нитраты в нитриты. Использование искусственных смесей для вскармливания детей тоже рассматривается как причина увеличения заболеваемости, так как вода, используемая для приготовления смеси может содержать повышенное количество нитратов. У грудных детей в желудке значение рН, близкое к нейтральному, способствует бактериальному росту в желудке и в верхних отделах кишечника. У детей отмечается недостаточность по двум специфическим ферментам, которые осуществляют обратное превращение метгемоглобина в гемоглобин. Длительное кипячение может усугублять проблему вследствие увеличения количества нитратов при испарении воды. Чаще причиной заболевания являлось использование в качестве источника воды частных колодцев с микробиологическим загрязнением (в них отсутствуют водоросли, активно потребляющие нитраты). Заболевание характеризуется развитием одышки, цианоза, тахикардии, судорог. У детей старше 1 года и взрослых заболевание в форме острого токсического цианоза не наблюдается, но возрастает содержание метгемоглобина в крови, что ухудшает транспорт кислорода к тканям — это проявляется слабостью, бледностью кожных покровов, повышенной утомляемостью.
— вызывают образование нитрозаминов, некоторые из них могут быть канцерогенами. Образование этих веществ происходит во рту или где-либо ещё в организме, где кислотность относительно низкая.
— являются показателем загрязнения воды органическими веществами.
Значение рН (активная реакция).
Кислыми являются болотистые воды, содержащие гуминовые вещества, щелочными — подземные воды, богатые бикарбонатами.
— определяет природные свойства воды;
— является показателем загрязнения открытых водоемов при спуске в них кислых или щелочных производственных сточных вод;
— значение рН тесно связано с другими показателями качества питьевой воды. Рост железобактерий в большой степени зависит от рН. Они образуют в качестве конечного продукта метаболизма гидрат окиси железа, который придает красный цвет воде. При высоких значениях рН вода приобретает горький вкус.
— эффективность процессов коагуляции и обеззараживания зависит от рН. Обеззараживающее действие хлора в воде ниже при высоких значениях рН; это связано со снижением концентрации хлорноватистой кислоты.
источник