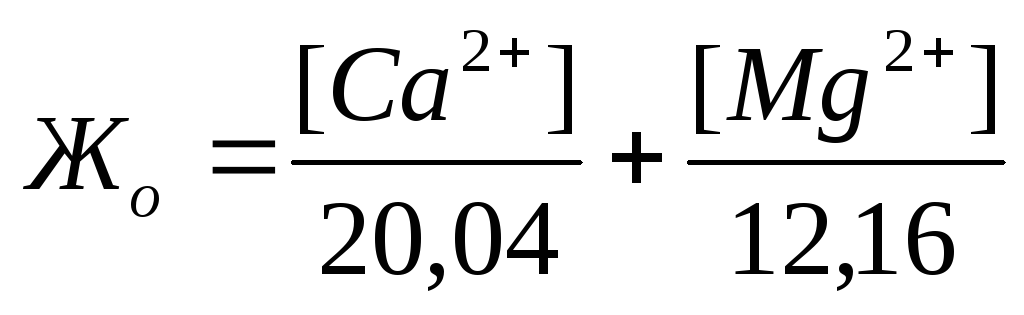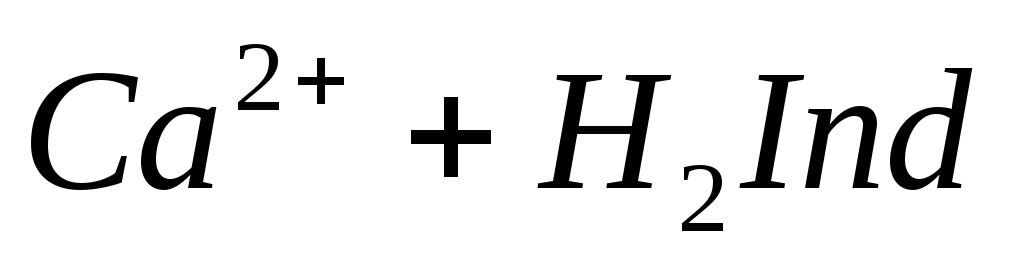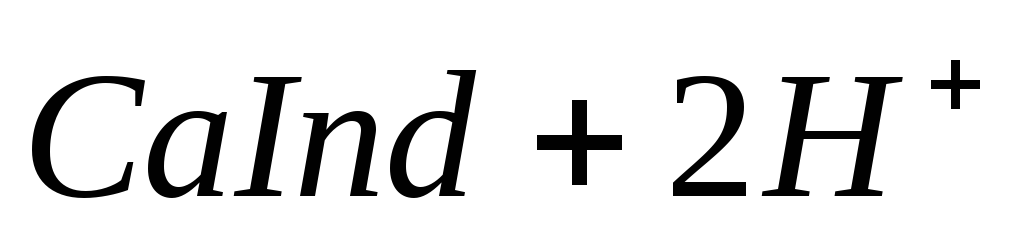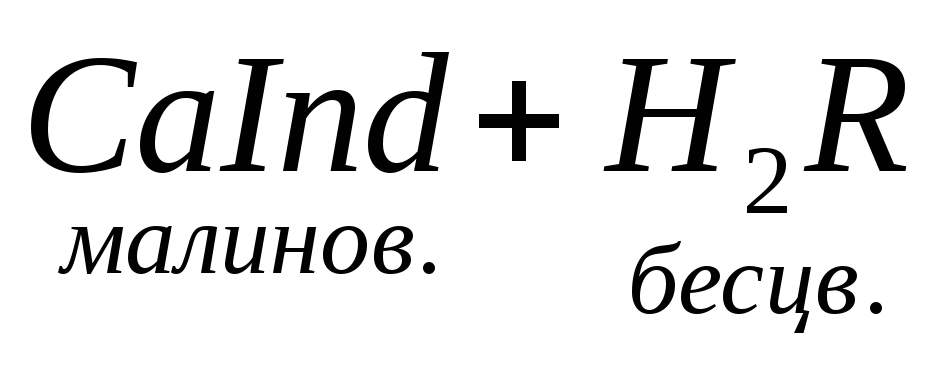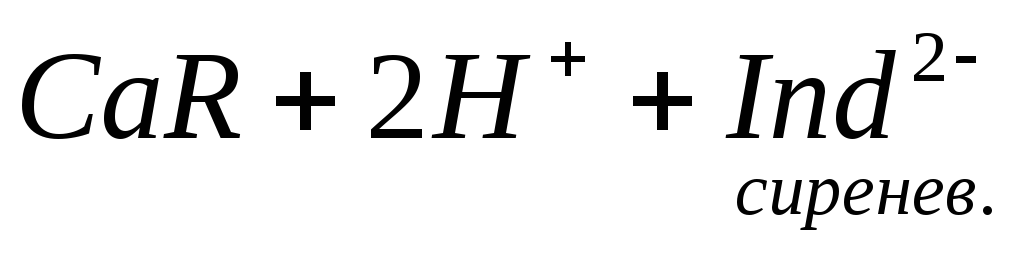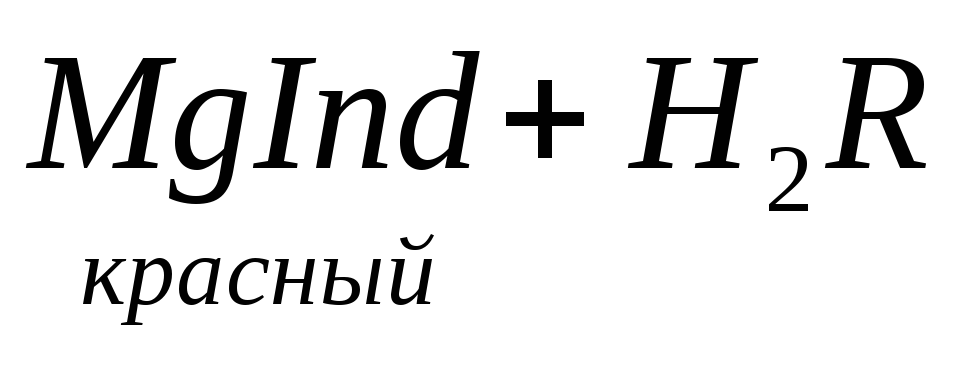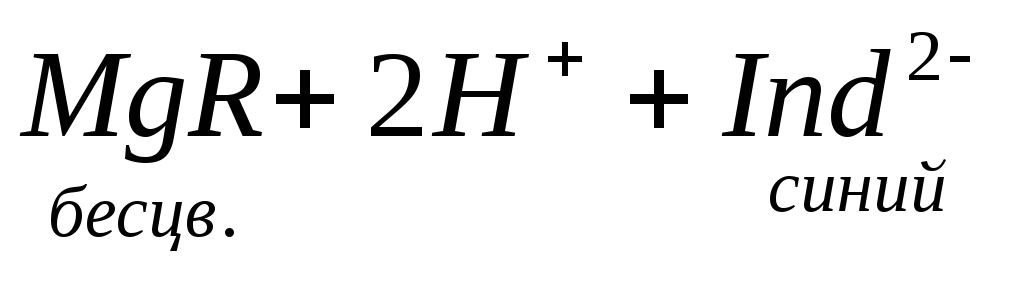Исследовательская работа по проведению химического анализа проб воды. Методика простая и доступная, не требуются дефицитные реактивы.
Муниципальное общеобразовательное учреждение
«Средняя общеобразовательная школа № 108 »
Советского района г. Казани
Исследовательская работа по теме
«Химический анализ воды в речке Нокса»
Работу выполнил ученик 7 класса
Руководитель: учитель химии
Латфуллина Резеда Нурахметовна
Кузнецов Андрей 6 класс.doc
2.1. Пробоотбор и подготовка воды к анализу
2.5. определение присутствия масел и жиров
4. Список использованной литературы
Наша республика богата природными источниками и водными ресурсами. А мой родной город расположен на прекрасном и живописном берегу великой реки Волга, в которую впадает.
А в р. Казанку в свою очередь впадает речка Нокса, которая протекает совсем рядом с нашей школой.
Целью моей работы является изучение химического состава и свойств воды речки Нокса.
Исходя из этой цели я поставил перед собой следующие задачи :
1. На основании качественного и количественного анализа определить
физические показатели качества воды.
2. Расширить и углубить знания о качестве воды, оказывающей влияние на
Актуальность выбранной мною темы в том, что вода является источником всего живого на Земле. Этой исследовательской работой я хотел расширить свои знания о составе и свойствах воды, с которой мы имеем дело ежедневно.
— забор пробы из речки Нокса;
— практические и лабораторные работы по определению физических
показателей, качественных и количественных анализов воды.
· Прямые факторы, непосредственно воздействующие на воду (т. е. действие веществ, которые могут обогащать воду растворёнными соединениями или, наоборот, выделять их из воды); состав горных пород, живые организмы, хозяйственная деятельность человека;
· Косвенные факторы, определяющие условия, в которых протекает взаимодействие веществ с водой: климат, рельеф, гидрологический режим, растительность, гидрогеологические и гидродинамические условия.
Самой чистой природной водой считают дождевую, снеговую воду; но и она, падая на поверхность земли, увлекает с собой взвешенные в воздухе минеральные, органические и организованные примеси (микроорганизмы). Проходя через слои земли, загрязнённые различными отбросами, вода получает продукты распада этих органических веществ.
При отборе проб воды используют посуду из бесцветного стекла или полиэтилена марок, разрешенных для контакта с питьевой водой. Посуда должна быть тщательно вымыта моющими средствами, многократно ополоснута водопроводной и дистиллированной водой, а непосредственно перед забором воды посуду несколько раз ополаскивают исследуемой водой. Пробки желательно использовать стеклянные или полиэтиленовые; корковые или резиновые пробки обертывают полиэтиленовой пленкой.
На практике удобно пользоваться банкой или бутылью. В местах с затрудненным доступом к воде банку или бутыль можно прикрепить к шесту.
Отбор проб воды на проточных водоемах производится 1 км выше ближайшего по течению пункта водопользования (водозабор для питьевого водоснабжения, места купания, организованного отдыха, территория населенного пункта), а на непроточных водоемах и водохранилищах — в 1 км в обе стороны от пункта от пункта водопользования.
Обычно пробы в створе отбирают в трех точках (у обоих берегов и в фарватерах); при ограниченных же технических же возможностях или на небольших водоемах допускается отбор проб в одной — двух точках (в местах наиболее сильного течения). Чаще всего пробы отбирают в 5-10 м от берега га глубине 50 см. Объектом особого внимания должны стать загрязненные реки. Для получения достоверных результатов анализ следует проводить как можно быстрее. В воде происходят процессы окисления-восстановления, физико-химические, биохимические, вызванные деятельностью микроорганизмов, сорбции, десорбции, седиментации и т.д. Могут изменяться и органолептические свойства воды — запах, цвет и др. Некоторые вещества способны адсорбироваться на стенках сосудов (железо, алюминий, медь, кадмий, марганец и др.), а из стекла бутылей могут выщелачиваться микроэлементы
Запах воды обусловлен наличием в ней пахнущих веществ, которые попадают в нее естественным путем и со сточными водами. Запах воды водоемов не должен превышать 2 баллов, обнаруживаемых непосредственно в воде или (для водоемов хозяйственно-питьевого назначения) после ее хлорирования. Определения основано на органолептическом исследовании характера и интенсивности запаха воды при 20 и 60 °С. По предлагаемой методике определяют характер и интенсивность запаха.
100 мл исследуемой воды при комнатной температуре наливают в колбу вместимостью 150-200 мл с широким горлом, накрывают часовым стеклом или притертой пробкой, встряхивают вращательным движением, открывают пробку или сдвигают часовое стекло и быстро определяют характер и интенсивность запаха. Затем колбу нагревают до 60 °С на водяной бане и также оценивают запах.
(от живущих в воде и отмерших организмов, от влияния почв и т.п.) находят по классификации, приведенной в таблице 2.
Характер и род запаха воды естественного происхождения
Мокрой щепы, древесной коры
Прелый, свежевспаханной земли, глинистый
Не подходящий под предыдущие определения
(от промышленных выбросов, для питьевой воды — от обработки воды реагентами на водопроводных сооружениях и т.п.) называются по соответствующим веществам: хлорфенольный, камфорный, бензиновый, хлорный и т.п. Интенсивность запаха также оценивается при 20 и 60 °С по 5-балльной системе согласно табл. 3.
Интенсивность запаха воды
Отсутствие ощутимого запаха
Запах, не поддающийся обнаружению потребителем, но обнаруживаемый в лаборатории опытным исследователем
Запах, не привлекающий внимания потребителя, но обнаруживаемый, если на него обратить внимание
Запах, легко обнаруживаемый и дающий повод относится к воде с неодобрением
Запах, обращающий на себя внимание и делающий воду непригодной для питья
Запах настолько сильный, что вода становится непригодной для питья
Запах воды следует определять в помещении, где воздух не имеет постороннего запаха. Желательно, чтобы характер и интенсивность запаха отмечали несколько исследователей .
Чистые природные воды почти бесцветны, наличие окраски поверхностных вод обычно связано с присутствием гуминовых веществ и соединений железа. При загрязнении сточными водами наблюдается окрашивание, не свойственное природным водам. Цвет вод, содержащих большое количество взвешенных веществ определяют после отстаивания или фильтрования.
1. Заполните пробирку водой до высоты 10-12 см.
2. Определите цветность воды, рассматривая пробирку на белом фоне при достаточном боковом освещении (дневном, искусственном).
Большинство известных элементов, входящих в состав вод в сравнительно больших количествах, существуют в виде ионов. Для доказательства наличия этих ионов в воде использовалась методика качественного химического полумикроанализа. Качественный анализ пробы воды проводился на наличие в воде: катионов магния, железа(II,III), кальция, свинца, меди; анионов брома, йода, хлора, сульфата.
Хлориды являются составной частью большинства природных вод. Обнаружение большого количества хлоридов является показателем загрязнения природных вод бытовыми и промышленными сточными водами.
Для определения хлоридов используется 10% раствор нитрата серебра. Необходимо взять 5 мл исследуемой воды и добавить 3 капли 10% раствора нитрата серебра. При наличии ионов хлора возникает опалесценция или выпадает белый осадок. Приближенную количественную оценку дают в соответствии с таблицей:
источник
Набор «Река, пруд, аквариум» предназначен для оценки безопасности открытых водоёмов, которые используются для пляжного отдыха и купания.
Кроме прудов и других природных водоёмов такой анализ будет полезен для исследования воды в аквариумах или рыбоводческих хозяйствах, а также в домашних бассейнах, владельцы которых не обеззараживают воду путём хлорирования или озонирования.
Исследование поможет Вам убедиться в том, что вода в Вашем водоёме не наносит вреда организму, а получив тревожные результаты, взяться за решение выявленных проблем.
Срок выполнения: 6–8 рабочих дней.
Минимальный объём пробы (материал тары): 1,5 л (пластик) и 0,2 л (стекло).
- подходит для оценки безопасности и полезных свойств природной и аквариумной вод;
- учитывает специфику природной воды в целом и поверхностных водоёмов в частности;
- включает определение содержания наиболее опасных тяжёлых металлов и органических загрязнителей, таких как ртуть, свинец, кадмий и фенол;
- включает определение показателей БПК и ХПК, которые необходимы для оценки состояния водной экосистемы и качества, растворенного в воде органического вещества;
- обладает высокой точностью, подтверждённой Межлабораторными Сличительными Испытаниями и поверками.
- может потребовать дополнительного времени для проведения испытаний – до 5 рабочих дней;
- может потребоваться дополнительная тара для отбора воды для определения рядя показателей: нефтепродукты, фенол, ХПК и БПК.
| Определяемый показатель | Нормативный документ на методику |
|---|---|
| Обобщённые показатели | |
| pH | РД 52.24.495-2017 |
| БПК5 | ПНД Ф 14.1:2:3:4.123-97 (йодометрический метод) (издание 2004 г.) |
| Нефтепродукты | выбирается лабораторией |
| Химическое потребление кислорода | ГОСТ 31859-2012 |
| Неорганические соединения | |
| Ионы аммония | ПНД Ф 14.1:2:4.276-2013 (издание 2013 г.) |
| Нитрат-ионы | ПНД Ф 14.1:2:4.132-98 (издание 2008 г.) |
| Нитрит-ионы | ПНД Ф 14.1:2:4.132-98 (издание 2008 г.) |
| Сульфат-ионы | ПНД Ф 14.1:2:4.132-98 (издание 2008 г.) |
| Фосфат-ионы | ПНД Ф 14.1:2:4.132-98 (издание 2008 г.) |
| Фторид-ионы | ПНД Ф 14.1:2:4.132-98 (издание 2008 г.) |
| Хлорид-ионы | ПНД Ф 14.1:2:4.132-98 (издание 2008 г.) |
| Элементы | |
| Железо | выбирается лабораторией |
| Кадмий | ЦВ 3.18.05-2005 |
| Марганец | ЦВ 3.18.05-2005 |
| Медь | ЦВ 3.18.05-2005 |
| Мышьяк | ЦВ 3.18.05-2005 |
| Никель | ЦВ 3.18.05-2005 |
| Ртуть | выбирается лабораторией |
| Свинец | ЦВ 3.18.05-2005 |
| Цинк | ЦВ 3.18.05-2005 |
| Органические соединения | |
| АПАВ | ПНД Ф 14.1:2:4.158-2000 (издание 2014 г.) |
| Фенол | ПНД Ф 14.1:2:4.225-2006 (издание 2018 г.) |
Анализ проводится с использованием передовых методик и техник анализа, в том числе фотометрии, ионной хроматографии, атомной абсорбции и потенциометрии, масс-спектрометрии, жидкостной хроматографии, что обеспечивает высокую точность и низкие уровни риска получения недостоверных результатов.
источник
Зачем нужен анализ воды пруда? С какой целью проводится анализ донных отложений и воды? Разновидности анализов воды в водоёме. Тесты для самостоятельного анализа, как пользоваться, как оценивать результаты. Что делать, чтобы улучшить ситуацию. Анализ донных отложений. Если вы решили заселить водоём рыбой, то прежде нужно сделать анализ воды пруда. При этом вам понадобится провести анализ донных отложений и воды.
При заселении водоёма или использовании воды из него для хозяйственных или бытовых целей вам обязательно нужно провести анализ воды пруда.
При этом частота проверок зависит от сроков существования водного объекта. Так, если ваш пруд только начал заселяться рыбой, то проверку нужно проводить 2-3 раза в неделю. Это нужно делать так часто по той причине, что по мере заселения пруда рыбами его биологическая система будет только формироваться и развиваться, а показатели воды будут постоянно меняться в ту или иную сторону. При наличии анализов вы сможете своевременно отслеживать неблагоприятные изменения водной среды и корректировать ситуацию.
Когда водоём будет заселен и его экосистема сформируется анализ воды можно проводить один раз в две недели. При этом нет нужды делать полный комплекс анализов, достаточно контролировать базовые показатели (кислотность, наличие нитратов и нитритов). Так вы сможете делать выводы о чистоте воды, здоровье и благополучии его обитателей.
Обычно на начальном этапе контроль осуществляется по семи показателям, условно разделённым на две группы:
- Биологическая группа показателей
- Химическая группа показателей
В данной группе показателей оцениваются вещества, образующиеся в ходе жизнедеятельности обитателей водоёма, а именно нитраты, нитриты и аммиак. Данные вещества перерабатываются и нейтрализуются бактериями. К ним относятся:
- Токсичный аммиак – продукт жизнедеятельности рыб. Он не имеет цвета и быстро растворяется в воде. Вещество попадает в воду через жабры рыб. Аммиак способен отравлять обитателей пруда, поэтому важно его полностью удалять.
- В ходе переработка бактериями аммиака образуются нитриты. Их токсичность также высока. Процесс расщепления нитритов более длительный из-за повышенной стойкости вещества. От этого компонента также лучше избавляться. Но в новом водоёме процесс практически неконтролируемый, поскольку переизбыток нитритов может приводить к гибели бактерий, их перерабатывающих.
- Ещё одна группа азотистых компонентов воды – нитраты. Они не такие токсичные, как первые два вещества. Нитраты могут собираться в воде и употребляться водной флорой либо нейтрализоваться заменой воды. Не желательно, чтобы концентрация этого вещества превышала 50 промилле.
В химической группе показателей пруда определяются кислотность, жёсткость воды и степень озонирования.
- Кислотно-щелочной баланс водоёма (его кислотность) должен быть в пределах 7-8,5 рН. Хорошо, если он не будет меняться на протяжении существования водоёма. Если ваш пруд заселен рыбами, то невысокая щелочная среда будет благоприятной для них.
- Также при анализе определяется общая жёсткость воды в водоёме. Жёсткость зависит от присутствия ионов кальция и магния. Обычно в естественных водоёмах жёсткость воды находится в пределах от 6 до 25. Показатель карбонатной жёсткости воды напрямую связан с общей жёсткостью. Старайтесь, чтобы этот показатель был средним или высоким, это даст стабильную жёсткость водоёма.
- Концентрация кислорода в пруду должна быть минимальной. Иногда по утрам в летнюю пору она может снижаться до критического значения из-за дыхания представителей водной флоры. Этот показатель должен быть выше 6 мг/л.
Мутная вода в водоёме может быть по причине того, что пруд заселён обилием водорослей или бактерий. Для очистки водоёма можно использовать специальную растительность.
Конечно, наиболее точный и развёрнутый анализ вы можете провести только в лаборатории, но некоторые анализы можно выполнить самостоятельно, используя:
- Портативные электронные тесты. Это специальные откалиброванные приборы для оценки разных показателей воды.
- Колориметрические тесты. Бывают тест-полоски, капли и таблетки. Обычно оценка результатов происходит по полученному цвету жидкости, полоски или количеству капель.
При превышении показателей по содержанию аммиака или нитритов необходимо перестать кормить рыбу, прекратить заселение водоёма и выполнить замену воды. Кормёжку рыбы можно начинать после отрицательных результатов этих анализов. Если предпринятые меры не помогли снизить уровень содержания токсичных веществ, то процедуры придётся повторить.
Для получения полной картины о состоянии пруда недостаточно выполнить проверку воды, также может потребоваться анализ донных отложений. Данная проверка может выполняться двумя методами:
Механический метод проверки ещё называется гранулометрическим. Он позволяет подсчитать концентрацию тех или иных частиц в отложениях и на основании это сделать выводы о состоянии пруда.
Вторая методика позволяет выявить химический состав донных отложений. Элементный анализ поможет подсчитать концентрацию железа, калия, натрия, алюминия, кальция, магния, серы, магния и других элементов в отложениях. А анализ водной вытяжки даст полную картину о присутствии в отложениях карбонатов, сульфатов, хлоридов. Также по результатам можно судить о водопоглощении почвы и концентрации питательных веществ (азота, фтора, калия).
Если вам необходим анализ воды из пруда или оценка его донных отложений, можете смело обращаться в нашу лабораторию, где за приемлемую цену проведут полную проверку. Чтобы заказать анализ, можете позвонить по указанным телефонам.
источник
Анализ питьевой воды позволяет точно понять, пригодна ли она для употребления человеком или может быть опасна для здоровья. Лабораторные исследования могут проводиться в разных вариантах, все зависит от поставленной задачи (от простого анализа на жёсткость до многоступенчатого исследования пробы на включение в состав редких элементов). Выбор методики зависит от типа пробы (из водопровода или забор на природе) и цели исследования. Есть контроль качества, соответствие нормам, степень превышения включения в состав примесей относительно ПДК. Стоит подробнее изучить вопросы о том, что включает в себя анализ, как проводится и какова его стоимость.
Основа в осуществлении анализов – полная качественная оценка качества воды из скважины, пробы из природного источника, осадков атмосферы, а также вод из стоков. Сегодня многие компании предоставляют квалифицированные услуги по определению физических и химических показателей качества и пригодности для употребления воды.
Благодаря анализу воды можно определить, пригодна ли она для употребления или нет
Обычно проводится проверка вод:
- Для питья центрального и нецентрального трубопровода снабжения водой. Эта жидкость, нужная для употребления людьми внутрь, в бытовых целях, для применения в процессе перерабатывания продовольствия и производства пищи. Регламент — СанПиН 2.1.4.1074-01.
- Из природных источников (поверхностная, подземная), осадки атмосферы. Задача охраны вод на поверхности от загрязнения актуальны для России, особенно для регионов вдоль реки Волги. Исследования поверхностных вод в лаборатории выполняются с целью выявления качества жидкости для питья и бытовых нужд, контроля за загрязнением производством, стоками в быту, а также для выявления качества объектов рыбно-хозяйственного назначения.
- Вода сточная.
При сбрасывании сточных вод в канализационную сеть необходимо проводить проверку результативности очищения и соответствия стоков прописанным в законе нормам. Проверка должна проводиться регулярно, сроки также указаны в законодательных документах.
Первостепенно нужно определение элементарного состава воды (30 самых распространенных химических элементов). Второй момент — выявление присутствия в нем дополнительных химических веществ, если это нужно или если проба имеет особенности (забор воды из грязных водоносных горизонтов или стоки промышленного предприятия).
В целом мощности хороших лабораторий дают возможность выполнять анализ проб на выявление 72 химических элементов разного рода.
Залог успеха и правильного исследования жидкости – это качественно взятая проба. Важно обращать внимание на требования к забору проб для исследования.\
Для проведения анализа воды нужно обладать специальными знаниями и оборудованием
Требования к таре и объёму воды следующие:
- Применение стерильной емкости из пластика или тары из-под дистиллированной воды. Запрещается использовать в качестве тары емкости из-под газировки, бутылки, в которых находились агрессивные среды.
- Минимум воды для исследования, взятой из скважины, колодца, крана – не меньше 0,5 л.
- Перед тем как забирать пробу для исследований, нужно, чтобы вода протекла в течение 5 минут, следует предварительно ополоснуть тару водой из этого источника.
Период, на протяжении которого взятая проба должна быть отправлена на исследование, не может быть больше 2 суток. Взятую пробу необходимо хранить в холодильнике. Также на каждой емкости должны быть нанесены данные о времени, дате и месте забора, а также о виде источника.
Исследование обычно состоит из 30 самых распространенных элементов. Образец следует передать на анализ в лабораторию не позже 48 часов с момента забора жидкости. Промаркированный образец нельзя оставлять без присмотра.
Цена исследования высчитывается в зависимости от его сложности.
Если это стандартная услуга (на выявление 30 веществ), то стоимость классическая (комплекс, примерно 60 руб./вещество). За каждый дополнительный элемент берется дополнительная сумма, все зависит от типа пробы. Однако в лабораториях для постоянных клиентов, а также при больших объёмах заказа на исследования предоставляются скидки.
Хорошая лаборатория должна иметь аттестат аккредитации на выполнение исследований воды из разных источников, а именно:
- Водопроводной воды;
- Питьевой;
- Минеральной;
- Из скважины;
- Колодезной.
Анализ воды выполняется достаточно быстро и стоит это недорого
Лабораторный анализ воды в хорошем центре основан на инновационной методике исследования – масс-спектрометрии, которая дает возможность выявлять присутствие в пробе элементов даже в микроскопических дозах. Аккредитованная лаборатория гарантирует качественный результат проведенных исследований.
Химический анализ воды направлен на определение органики и неорганики, а также степени жёсткости, мутности и прочих важных показателей пригодности и качества. Сегодня разработано больше 100 разнообразных методов, часть которых применяется на практике только в единичных лабораториях.
В перечне самых актуальных методик находятся:
- Спектрофотометрия;
- Биотестирование;
- Кондуктометрия;
- Фотометрия;
- Капиллярный электрофорез;
- Турбидиметрия;
- Газовая хроматография;
- Гравиметрия;
- Нефелометрия.
После выполнения анализа воды результаты будут перенесены на листок в виде таблицы
Обычно центры, которые специализируются на диагностировании качества воды, предлагают сокращенное и полное химическое исследование пробы. Первая методика включает диагностирование по 25 пунктам и выявляет соответствие на нормы: присутствие посторонних запахов, жесткость, мутность, общая минерализация, окисляемость, присутствие железа и магния. Сокращенный метод можно применять при переезде на новое место и для выбора фильтра в домах с централизованным снабжением водой.
Полное исследование дает возможность с высочайшей точностью выявить процент включения в состав образца следующих веществ: металлов, газов, нефтепродуктов, щелочей, мочевины, нитритов, аммиака.
Расширенное диагностирование предполагает тест по 100 и больше пунктам. Эта методика должна быть выбрана владельцами частных скважин и колодцев ещё во время стройки. Для тех, кто не может обратиться в лабораторию, выпускают уникальные наборы для химического диагностирования воды из источника своими руками дома.
Наборы для анализа в домашних условиях дают возможность в общих чертах понять, какова жёсткость воды, увеличен ли уровень солей и металлов:
Можно найти дешевые тесты, созданные специально для водопроводной системы, скважин, природных источников и колодцев. Это могут быть наборы для выявления одного или нескольких видов веществ. Тесты реализуются с описанием, оно поможет выполнить экспресс-анализ жидкости дома, понять результат и правильно подобрать устройство для фильтрации воды.
Исследование проб воды требует профессионализма, поэтому для своей же безопасности правильно будет доверить дело экспертам.
источник
Муниципальное образовательное учреждение
Пятницкая основная общеобразовательная школа
на тему «Исследование качества воды
Выполнили учащиеся 7 и 8 класса
Руководитель: учитель химии – Смирнова С.Н.
Качество воды в реке Конглас.
Качество воды — один из важнейших показателей качества окружающей среды, влияющий на здоровье человека и на развитие флоры и фауны водоёма, которое можно оценить с помощью физических, химических, биологических исследований и обозначить тенденции
Цель исследования: дать оценку экологического состояния реки Конглас.
Проведению данных исследований предшествовала большая подготовительная работа: тщательное изучение литературы по методике проведения подобных работ, подготовка химической посуды и реактивов. Затем был проведен согласно методике отбор проб воды. После подготовки их к исследованию начались экспериментальные работы, к которым мы отнеслись очень серьезно, подолгу проверяя полученные результаты. Каждый шаг работы и результаты исследований тщательно фиксировались, составляли
таблицы, схемы, делали выводы, оформляли презентацию.
При исследовании были соблюдены следующие правила:
— для получения максимально достоверного вывода брали три пробы воды, а результат рассчитывали по среднему значению;
— чем меньше времени проходит после отбора воды перед её анализом, тем точнее результат;
— выполняли эксперименты, строго следуя методическим рекомендациям.
1. Определение содержания ионов водорода в воде: рН-фактор воды.
С помощью данного исследования определили содержание ионов водорода в воде с помощью бумажных индикаторов (универсальная индикаторная бумага) немедленно после снятия пробы, поскольку изменение температуры воды влияет на значение рН. Вывод : индикаторная бумага стала бесцветной, по шкале соответствует рН=7,0 (среда нейтральная).
Взвесили бумажный фильтр, определили массу фильтра, отфильтровали 1 литр воды, высушили его, взвесили и определили массу, вычислили разницу массы фильтра до и после фильтрования.
Разница в массе и есть величина мутности в мг/л (допустимая мутность питьевой
Вывод: масса фильтра до фильтрации 500 мг/л, после фильтрования 504 мг/л., мутность воды в реке составляет 4 мг/л.
3. Исследование цвета воды.
Цвет природной воды обусловлен наличием в нем кислот, загрязнений промышленных предприятий, соединений железа, цветущих водорослей. Для описания цвета воды использовали стеклянный сосуд и лист белой бумаги. В сосуд набирают воду и на белом фоне бумаги определили её цвет (желтый, светло-желтый, зеленоватый, бурый, голубой – показатель определённого вида загрязнения).
Вывод: вода в реке Конглас бесцветная.
4. Определение прозрачности воды.
Прозрачность исследуемой воды оценивается по одной из трёх характеристик: прозрачная, малопрозрачная, непрозрачная. Метод исследования основывается на чтении текста через прозрачный мерный цилиндр с плоским дном.
— Налили в стеклянный мерный цилиндр высотой 30 см. речную воду.
— На столе разместили газетный текст стандартного шрифта.
— Цилиндр с водой находится над текстом на высоте 4 см.
— Прочитали текст сквозь водяной столб.
— Прозрачность исследуемой воды оценивается по одной из трех характеристик: прозрачная, малопрозрачная, непрозрачная.
Вывод: вода в реке Конглас малопрозрачная.
5. Определение запаха воды.
Запах воды определяют при комнатной температуре и при нагревании до 50-60С и характеризуется качественно (запах ароматический, гнилостный, болотный, землистый…) и количественно.
Сила и характеристика при пятибалльной шкале.
Запах совсем не ощущается
Запах обычно не наблюдается, определяется
Запах обнаруживается потребителем
Запах легко замечается, заставляет воздержаться от питья.
Запах резко выраженный, вода непригодна для питья.
Вывод: запах воды реки Конглас не ощущается и составляет 0 баллов.
6. Определение содержания растворённого кислорода в пробе воды.
Растворенный кислород – важный фактор, говорящий о благополучном состоянии водоёма, о возможности существования в нём живых организмов (способ определения по Насоновой).
Способ определения по Насоновой.
— К 10мл. отфильтрованной воды добавили 0,5мл. 30% серной кислоты и 1мл. 0,001н раствора перманганата калия.
— Тщательно перемешали содержимое и оставили на 20 минут при t=20 градусов.
Если раствор остался ярко-розовым, то содержание растворенного кислорода в воде можно считать = 1мг/л., если окраска раствора стала лилово-розовой, то 2мг/л.,если слабо лилово-розовой, то 4мг/л., если бледно-лилово-розовой, то 6мг/л., если бледно-розовой, то 8мг/л., если желтой, то 16мг/л.
Вывод: окраска раствора стала бледно-лилово-розовой, значит содержание растворенного кислорода в пробе воды 6 мл.
Концентрация сульфатов в воде допускается до 500 мг/л.
1). Налить в пробирку 10 мл. воды;
2). Добавить 0.5 мл. соляной кислоты;
3). Добавить 2 мл.5% раствора хлорида бария, всё перемешать.
По характеру осадка определяют содержание сульфатов.
Концентрация хлоридов, мг/л.
Слабая муть, появляющаяся не сразу, а через несколько минут
Слабая муть, появляющаяся сразу после добавления хлорида бария
Сильная, быстро оседающая муть
Более 100 мг/л — высокое содержание сульфатов
Вывод: содержание сульфатов соответствует ПДК, так как в ходе исследований обнаружили слабую муть, появляющаяся сразу после добавления хлорида бария.
8. Определение хлоридов в воде.
Хлориды – один из самых серьёзных загрязнителей.
2). Добавить 3 капли 10%-го раствора нитрата серебра.
Приблизительное содержание хлоридов определяют по осадку или помутнению и их концентрация в водоёмах допускается до 350 мг\л.
Концентрация хлоридов, мг/л.
Образуются хлопья, но осаждается не сразу
Вывод: содержание хлоридов соответствует ПДК, так как в ходе анализа наблюдали слабую муть.
1). Взять 100мл. исследуемой воды;
3). Через 10 минут определяли запах, характерный для хлорфенолов (аптечный запах).
Вывод: фенолов не обнаружено.
10. Определение нитратов в воде.
Азот является важным элементом, необходимым для построения белков и нуклеиновых кислот всеми живыми организмами. В водных экосистемах азот присутствует в молеку-лярном виде и в составе ионов. Бумажный индикатор (одна полоска) опускали в исследуемую воду.
Нормальным считается содержание нитрат-ионов 10 мг/л., а нитрит- ионов – 1 мг/л.
Вывод: содержание нитрат – ионов в воде составляет 0,02мг/л.
11. Определение общего железа в воде.
Железа немало в ландшафтах Русской равнины. Многие видели, как на белой раковине остаётся ржавая полоса.
Избыток железа означает жёсткую и малопригодную для бытовых нужд и водоснабжения воду.
1). В пробирку взять 10 мл. воды.
2). Добавить 1 каплю Н NO 3 (конц.).
3). Добавить несколько капель раствора перекиси водорода (Н2О2) .
4). Прилить 0,5 мл. раствора роданида калия (К S С N )
Если железа 0,1 мг/л. – появится розовое окрашивание.
Если железа больше, чем 0,1 мг/л. – то красное окрашивание.
ПДК общего железа в воде водоёмов 0,3 мг/л.
Вывод: при исследовании появилось розовое окрашивание, следовательно, содержание железа соответствует норме.
Мы провели много экспериментов для определения содержания в воде тех или иных веществ. И выявили, что Конглас – условно чистая река. Вода прозрачная, бесцветная, осадок незначительный, песчаный. Видимые признаки загрязнения отсутствуют.
Анализ показал, что кислотность воды, содержание в ней хлоридов, сульфатов, нитратов и железа соответствуют ПДК.
Таким образом, река Конглас экологически чистый водоём.
источник
Анализ питьевой воды позволяет точно понять, пригодна ли она для употребления человеком или может быть опасна для здоровья. Лабораторные исследования могут проводиться в разных вариантах, все зависит от поставленной задачи (от простого анализа на жёсткость до многоступенчатого исследования пробы на включение в состав редких элементов). Выбор методики зависит от типа пробы (из водопровода или забор на природе) и цели исследования. Есть контроль качества, соответствие нормам, степень превышения включения в состав примесей относительно ПДК. Стоит подробнее изучить вопросы о том, что включает в себя анализ, как проводится и какова его стоимость.
Основа в осуществлении анализов – полная качественная оценка качества воды из скважины, пробы из природного источника, осадков атмосферы, а также вод из стоков. Сегодня многие компании предоставляют квалифицированные услуги по определению физических и химических показателей качества и пригодности для употребления воды.
Благодаря анализу воды можно определить, пригодна ли она для употребления или нет
Обычно проводится проверка вод:
- Для питья центрального и нецентрального трубопровода снабжения водой. Эта жидкость, нужная для употребления людьми внутрь, в бытовых целях, для применения в процессе перерабатывания продовольствия и производства пищи. Регламент — СанПиН 2.1.4.1074-01.
- Из природных источников (поверхностная, подземная), осадки атмосферы. Задача охраны вод на поверхности от загрязнения актуальны для России, особенно для регионов вдоль реки Волги. Исследования поверхностных вод в лаборатории выполняются с целью выявления качества жидкости для питья и бытовых нужд, контроля за загрязнением производством, стоками в быту, а также для выявления качества объектов рыбно-хозяйственного назначения.
- Вода сточная.
При сбрасывании сточных вод в канализационную сеть необходимо проводить проверку результативности очищения и соответствия стоков прописанным в законе нормам. Проверка должна проводиться регулярно, сроки также указаны в законодательных документах.
Первостепенно нужно определение элементарного состава воды (30 самых распространенных химических элементов). Второй момент — выявление присутствия в нем дополнительных химических веществ, если это нужно или если проба имеет особенности (забор воды из грязных водоносных горизонтов или стоки промышленного предприятия).
В целом мощности хороших лабораторий дают возможность выполнять анализ проб на выявление 72 химических элементов разного рода.
Залог успеха и правильного исследования жидкости – это качественно взятая проба. Важно обращать внимание на требования к забору проб для исследования.\
Для проведения анализа воды нужно обладать специальными знаниями и оборудованием
Требования к таре и объёму воды следующие:
- Применение стерильной емкости из пластика или тары из-под дистиллированной воды. Запрещается использовать в качестве тары емкости из-под газировки, бутылки, в которых находились агрессивные среды.
- Минимум воды для исследования, взятой из скважины, колодца, крана – не меньше 0,5 л.
- Перед тем как забирать пробу для исследований, нужно, чтобы вода протекла в течение 5 минут, следует предварительно ополоснуть тару водой из этого источника.
Период, на протяжении которого взятая проба должна быть отправлена на исследование, не может быть больше 2 суток. Взятую пробу необходимо хранить в холодильнике. Также на каждой емкости должны быть нанесены данные о времени, дате и месте забора, а также о виде источника.
Исследование обычно состоит из 30 самых распространенных элементов. Образец следует передать на анализ в лабораторию не позже 48 часов с момента забора жидкости. Промаркированный образец нельзя оставлять без присмотра.
Цена исследования высчитывается в зависимости от его сложности.
Если это стандартная услуга (на выявление 30 веществ), то стоимость классическая (комплекс, примерно 60 руб./вещество). За каждый дополнительный элемент берется дополнительная сумма, все зависит от типа пробы. Однако в лабораториях для постоянных клиентов, а также при больших объёмах заказа на исследования предоставляются скидки.
Хорошая лаборатория должна иметь аттестат аккредитации на выполнение исследований воды из разных источников, а именно:
- Водопроводной воды;
- Питьевой;
- Минеральной;
- Из скважины;
- Колодезной.
Анализ воды выполняется достаточно быстро и стоит это недорого
Лабораторный анализ воды в хорошем центре основан на инновационной методике исследования – масс-спектрометрии, которая дает возможность выявлять присутствие в пробе элементов даже в микроскопических дозах. Аккредитованная лаборатория гарантирует качественный результат проведенных исследований.
Химический анализ воды направлен на определение органики и неорганики, а также степени жёсткости, мутности и прочих важных показателей пригодности и качества. Сегодня разработано больше 100 разнообразных методов, часть которых применяется на практике только в единичных лабораториях.
В перечне самых актуальных методик находятся:
- Спектрофотометрия;
- Биотестирование;
- Кондуктометрия;
- Фотометрия;
- Капиллярный электрофорез;
- Турбидиметрия;
- Газовая хроматография;
- Гравиметрия;
- Нефелометрия.
После выполнения анализа воды результаты будут перенесены на листок в виде таблицы
Обычно центры, которые специализируются на диагностировании качества воды, предлагают сокращенное и полное химическое исследование пробы. Первая методика включает диагностирование по 25 пунктам и выявляет соответствие на нормы: присутствие посторонних запахов, жесткость, мутность, общая минерализация, окисляемость, присутствие железа и магния. Сокращенный метод можно применять при переезде на новое место и для выбора фильтра в домах с централизованным снабжением водой.
Полное исследование дает возможность с высочайшей точностью выявить процент включения в состав образца следующих веществ: металлов, газов, нефтепродуктов, щелочей, мочевины, нитритов, аммиака.
Расширенное диагностирование предполагает тест по 100 и больше пунктам. Эта методика должна быть выбрана владельцами частных скважин и колодцев ещё во время стройки. Для тех, кто не может обратиться в лабораторию, выпускают уникальные наборы для химического диагностирования воды из источника своими руками дома.
Наборы для анализа в домашних условиях дают возможность в общих чертах понять, какова жёсткость воды, увеличен ли уровень солей и металлов:
Можно найти дешевые тесты, созданные специально для водопроводной системы, скважин, природных источников и колодцев. Это могут быть наборы для выявления одного или нескольких видов веществ. Тесты реализуются с описанием, оно поможет выполнить экспресс-анализ жидкости дома, понять результат и правильно подобрать устройство для фильтрации воды.
Исследование проб воды требует профессионализма, поэтому для своей же безопасности правильно будет доверить дело экспертам.
источник
Набор «Река, пруд, аквариум» предназначен для оценки безопасности открытых водоёмов, которые используются для пляжного отдыха и купания.
Кроме прудов и других природных водоёмов такой анализ будет полезен для исследования воды в аквариумах или рыбоводческих хозяйствах, а также в домашних бассейнах, владельцы которых не обеззараживают воду путём хлорирования или озонирования.
Исследование поможет Вам убедиться в том, что вода в Вашем водоёме не наносит вреда организму, а получив тревожные результаты, взяться за решение выявленных проблем.
Срок выполнения: 6–8 рабочих дней.
Минимальный объём пробы (материал тары): 1,5 л (пластик) и 0,2 л (стекло).
- подходит для оценки безопасности и полезных свойств природной и аквариумной вод;
- учитывает специфику природной воды в целом и поверхностных водоёмов в частности;
- включает определение содержания наиболее опасных тяжёлых металлов и органических загрязнителей, таких как ртуть, свинец, кадмий и фенол;
- включает определение показателей БПК и ХПК, которые необходимы для оценки состояния водной экосистемы и качества, растворенного в воде органического вещества;
- обладает высокой точностью, подтверждённой Межлабораторными Сличительными Испытаниями и поверками.
- может потребовать дополнительного времени для проведения испытаний – до 5 рабочих дней;
- может потребоваться дополнительная тара для отбора воды для определения рядя показателей: нефтепродукты, фенол, ХПК и БПК.
| Определяемый показатель | Нормативный документ на методику |
|---|---|
| Обобщённые показатели | |
| pH | РД 52.24.495-2017 |
| БПК5 | ПНД Ф 14.1:2:3:4.123-97 (йодометрический метод) (издание 2004 г.) |
| Нефтепродукты | выбирается лабораторией |
| Химическое потребление кислорода | ГОСТ 31859-2012 |
| Неорганические соединения | |
| Ионы аммония | ПНД Ф 14.1:2:4.276-2013 (издание 2013 г.) |
| Нитрат-ионы | ПНД Ф 14.1:2:4.132-98 (издание 2008 г.) |
| Нитрит-ионы | ПНД Ф 14.1:2:4.132-98 (издание 2008 г.) |
| Сульфат-ионы | ПНД Ф 14.1:2:4.132-98 (издание 2008 г.) |
| Фосфат-ионы | ПНД Ф 14.1:2:4.132-98 (издание 2008 г.) |
| Фторид-ионы | ПНД Ф 14.1:2:4.132-98 (издание 2008 г.) |
| Хлорид-ионы | ПНД Ф 14.1:2:4.132-98 (издание 2008 г.) |
| Элементы | |
| Железо | выбирается лабораторией |
| Кадмий | ЦВ 3.18.05-2005 |
| Марганец | ЦВ 3.18.05-2005 |
| Медь | ЦВ 3.18.05-2005 |
| Мышьяк | ЦВ 3.18.05-2005 |
| Никель | ЦВ 3.18.05-2005 |
| Ртуть | выбирается лабораторией |
| Свинец | ЦВ 3.18.05-2005 |
| Цинк | ЦВ 3.18.05-2005 |
| Органические соединения | |
| АПАВ | ПНД Ф 14.1:2:4.158-2000 (издание 2014 г.) |
| Фенол | ПНД Ф 14.1:2:4.225-2006 (издание 2018 г.) |
Анализ проводится с использованием передовых методик и техник анализа, в том числе фотометрии, ионной хроматографии, атомной абсорбции и потенциометрии, масс-спектрометрии, жидкостной хроматографии, что обеспечивает высокую точность и низкие уровни риска получения недостоверных результатов.
источник
Требования, предъявляемые к качеству воды, могут быть самыми различными и определяются её целевым назначением. Для оценки качества пластовых, природных и сточных вод их образцы подвергают анализу. На основании результатов анализа делаются выводы о пригодности воды для конкретного вида потребления, возможности применения тех или иных методов очистки. Анализы подземных вод позволяют прогнозировать сопутствующие месторождения полезных ископаемых. При анализе вод для характеристики их свойств определяют химические, физические и бактериологические показатели. Основными показателями, определяющими пригодность воды для определенной отрасли народного хозяйства, являются химические, так как физические (содержание взвешенных частиц, температура, цвет, запах, плотность, сжимаемость, вязкость, поверхностное натяжение) и бактериологические (наличие бактерий) показатели зависят от химического состава воды.
К химическим показателям качества воды относятся:
состав растворенных газов.
Общее солесодержание характеризует присутствие в воде минеральных и органических примесей, количество этих примесей в виде общей минерализации, сухого и плотного остатков. Общая минерализация представляет собой сумму всех найденных в воде анализом катионов и анионов. Минерализацию выражают в миллиграмм-эквивалентах солей, находящихся в I л воды, или в процентах, то есть числом граммов растворенных веществ, содержащихся в 100 г раствора. Сухим остатком называется суммарное количество нелетучих веществ, присутствующих в воде во взвешенном, коллоидном и растворенном состоянии, выраженное в мг/л. Сухой остаток определяют путем выпаривания пробы воды, последующего высушивания при 105 о С и взвешивания. Плотный остаток – это сухой остаток, определенный из профильтрованной пробы воды. Следовательно, разница двух показателей соответствует содержанию взвешенных веществ пробы. Если сухой остаток прокалить при температуре 500-600 о С, то масса его уменьшится и получится остаток, называемый золой. Уменьшение массы происходит за счет сгорания органических веществ, удаления кристаллизационной воды, разложения карбонатов. Потери при прокаливании приближенно относят за счет органических примесей.
Жесткость воды обусловливается наличием в ней ионов Са 2+ и Mg 2+ . Для большинства производств жесткость воды является основным показателем её качества. В жесткой воде плохо пенится мыло. При нагревании и испарении жесткой воды образуется накипь на стенках паровых котлов, труб, теплообменных аппаратов, что ведет к перерасходу топлива, коррозии металлов и авариям.
Жесткость количественно выражается числом миллиграмм-эквивалентов ионов кальция и магния в 1 л воды (мг-экв/л); 1 мг-экв/л жесткости соответствует содержанию в воде 20,04 мг/л ионов Са 2+ или
12,16 мг/л ионов Mg 2 + . Различают жесткость общую, карбонатную и некарбонатную.
Карбонатная жесткость связана с присутствием в воде в основном гидрокарбонатов и карбонатов кальция и магния, которые при кипячении воды переходят в нерастворимые средние или основные соли и выпадают в виде плотного осадка:
Таким образом, при кипячении карбонатная жесткость устраняется. Поэтому она называется также временной жесткостью. Следует сказать, что при переходе HCO3 – в CO32 – и при выпадении карбонатов кальция и магния в воде остается некоторое количество ионов Са 2+ , Mg 2+ , CO32 – , соответствующее произведению растворимости СаСО3 и (MgOH)2CO3. В присутствии посторонних ионов растворимость этих соединений повышается.
Некарбонатная (постоянная) жесткость не разрушается кипячением. Она обусловливается присутствием в воде кальциевых и магниевых солей сильных кислот, главным образом сульфатов и хлоридов.
Общаяжесткость воды представляет собой сумму карбонатной и некарбонатной жесткости и обусловливается суммарным содержанием в воде растворенных солей кальция и магния. По величине общей жесткости принята следующая классификация природных вод:
Если известны концентрации (мг/л) в воде Ca 2+ , Mg 2+ и HCO3 – , то жесткость рассчитывается по следующим формулам:
Общая жесткость
Карбонатная жесткость равна концентрации (мг/л) [HCO3– ]; в случае, если содержание ионов кальция и магния в воде выше, чем количество гидрокарбонатов:
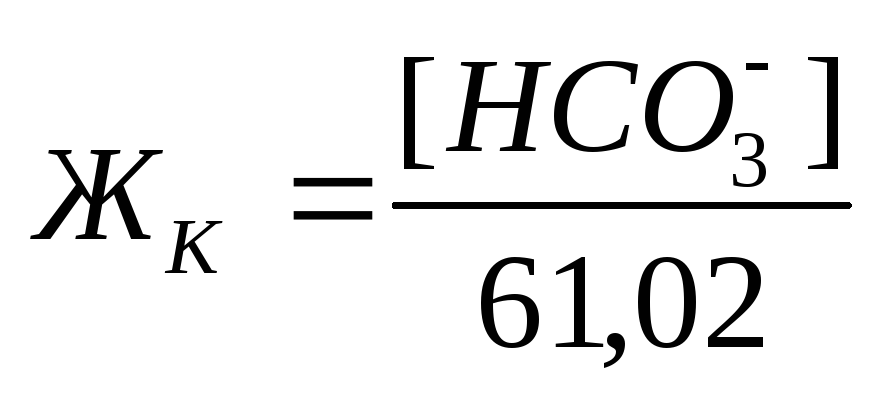
Если же количество гидрокарбонатов в воде превышает содержание ионов кальция и магния, то карбонатная жесткость соответствует общей жесткости. Разность между общей и карбонатной жесткостью составляет некарбонатную жесткость: ЖНК= ЖО– ЖК . Следовательно, ЖНК – это содержание Ca 2+ и Mg 2 + , эквивалентное концентрации всех остальных анионов, в том числе и некомпенсированных гидрокарбонатов.
Окисляемость характеризует содержание в воде восстановителей, к которым относятся органические и некоторые неорганические (сероводород, сульфиты, соединения двухвалентного железа и др.) вещества. Величина окисляемости определяется количеством затраченного окислителя и выражается числом миллиграммов кислорода, необходимого для окисления веществ, содержащихся в 1 л воды. Различают общую и частичную окисляемость. Общую окисляемость определяют обработкой воды сильным окислителем – бихроматом калия K2Cr2O7 или йодатом калия KIO3. Частичную окисляемость определяют по реакции с менее сильным окислителем – перманганатом калия КMnO4. По этой реакции окисляются только сравнительно легко окисляющиеся вещества.
Для полного окисления содержащихся в воде органических веществ, при котором происходят превращения по схеме
требуется количество кислорода (или окислителя в расчете на кислород), называемое химическим потреблением кислорода (ХПК) и выражаемое в мг/л.
При любом методе определения ХПК вместе с органическими веществами окисляются и неорганические восстановители, содержащиеся в пробе. Тогда содержание неорганических восстановителей в пробе определяют отдельно специальными методами и результаты этих определений вычитают из найденного значения ХПК.
Реакция среды характеризует степень кислотности или щелочности воды. Концентрация водородных ионов природных вод зависит главным образом от гидролиза солей, растворенных в воде, количества растворенных угольной кислоты и сероводорода, содержания различных органических кислот. Обычно для большинства природных вод величина рН изменяется в пределах 5,5-8,5. Постоянство рН природных вод обеспечивается наличием в ней буферных смесей. Изменение значения рН свидетельствует о загрязнении природной воды сточными водами.
Определение иона Cl – . В основу определения иона хлора положен аргентометрический метод Мора. Принцип анализа заключается в том, что при прибавлении к воде раствора AgNO3 образуется белый осадок хлорида серебра:
Определение хлорид-ионов ведут в интервале рН = 6,5 ÷ 10, чтобы одновременно с AgCl не выпадал осадок Ag2CO3. Проведению определения Сl – мешает наличие в воде ионов брома, йода, сероводорода, от которых освобождаются предварительной обработкой воды.
Определение иона SO42– . Метод определения сульфат-ионов основан на малой растворимости сульфата бария, количественно выпадающего в кислой среде при добавлении к воде раствора хлорида бария: Ba 2+ + SO42– = BaSO4↓
По массе образовавшегося осадка рассчитывают содержание иона SO42– .
Определение ионов CO32– и HCO3– . Эти ионы определяют титрованием пробы воды растворами серной или соляной кислот последовательно с индикаторами фенолфталеином и метилоранжем. Реакция нейтрализации протекает в две стадии.
Первые порции кислоты вступают в реакции с карбонат-ионом, образуя гидрокарбонат-ион:
Окраска фенолфталеина при рН = 8,4 переходит из розовой в бесцветную, что совпадает с таким состоянием раствора, когда в нем остаются лишь гидрокарбонаты. По количеству кислоты, пошедшей на титрование, рассчитывают содержание карбонат-иона. Расход кислот на титрование с фенолфталеином эквивалентен содержанию половины карбонатов, т.к. последние нейтрализуются только наполовину до HCO3 – . Поэтому общее количество CO32 – эквивалентно удвоенному количеству кислоты, затраченной на титрование. При дальнейшем титровании в присутствии метилоранжа происходит реакция нейтрализации гидрокарбонатов:
Метилоранж меняет окраску при pH = 4,3, т.е. в момент, когда в растворе остается только свободный диоксид углерода.
При расчете содержания ионов HCO3 – в воде следует из количества кислоты, пошедшей на титрование с метилоранжем, вычесть количество кислоты, идущей на титрование с фенолфталеином. Общее количество кислоты, затраченной на нейтрализацию ионов ОН – , СО32– и НСО3– , характеризует общую щелочность воды. Если рН воды ниже 4,3, то её щелочность равна нулю.
Определение ионов Ca 2+ , Mg 2+ . Имеется несколько методов обнаружения и определения содержания ионов Са 2+ и Mg 2+ . При добавлении в воду оксалата аммония (NH4)2C2O4 в случае присутствия ионов кальция образуется белый осадок оксалата кальция:
После отделения осадка оксалата кальция в воде можно определить ионы Mg 2+ с помощью раствора гидрофосфата натрия Na2HPO4 и аммиака. При наличии иона Mg 2 + образуется мелкокристаллический осадок соли магния:
Полученные осадки прокаливают и взвешивают. На основании полученных результатов вычисляется величина кальциевой и магниевой жесткости.
Наиболее быстрым и точным методом определения Са 2 + и Mg 2 + является комплексонометрический метод, основанный на способности двунатриевой соли этилендиаминотетрауксусной кислоты (трилон Б)
N
образовывать с ионами кальция и магния прочные комплексные соединения.
При титровании пробы воды трилоном Б происходит последовательное связывание в комплекс сначала ионов кальция, а затем ионов магния. Содержание ионов кальция определяют, титруя воду в присутствии индикатора — мурексида. Мурексид образует с ионами кальция малодиссоциированное комплексное соединение, окрашенное в малиновый цвет.
Ионы магния не дают комплекса с мурексидом. Трилон Б извлекает Са 2+ из его растворимого комплекса с мурексидом, вследствие чего окраска раствора, изменяется на сиреневую:
По количеству трилона Б, расходуемого на титрование, определяют содержание Са 2 + . Титрованием пробы воды трилоном Б в присутствии индикатора хромогена черного определяют суммарное содержание Са 2 + и Mg 2 + , то есть общую жесткость воды. Вода, содержащая Са 2 + и Mg 2 + , в присутствии хромогена черного окрашивается в красный цвет вследствие образования комплекса с Mg 2 + . При титровании воды в точке эквивалентности происходит изменение цвета на синий вследствие протекания следующей реакции:
Содержание Mg 2+ вычисляют по разности между общим содержанием (Са 2+ + Mg 2+ ) и содержанием Са 2 + . Трилонометрическое определение каждого иона производится при том значении рН, при котором этот ион образует с трилоном Б соединение более прочное, чем с индикатором. Для поддержания заданного значения рН к титруемому раствору добавляют буферные растворы. Кроме того, поддержание заданной величины рН обеспечивает определенную окраску индикатора. Общую жесткость воды определяют при рН > 9, кальциевую – при рН = 12.
Определение ионов Na + , K + . Производится вычислением по разности между суммой мг-экв найденных анионов и катионов, поскольку вода электронейтральна:
С достаточно высокой точностью все присутствующие в воде катионы можно определить эмиссионной спектроскопией сухого остатка.
Растворенные в воде газы определяют химическими методами или газовой хроматографией.
Определение диоксида углерода производят титрованием пробы воды щелочью в присутствии индикатора–фенолфталеина:
Определение растворенного кислорода производится йодометрическим методом.
Для анализа в пробу воды поcледовательно добавляют раствор хлорида марганца и щелочной раствор йодида калия. Метод основан на окислении свежеполученного гидроксида двухвалентного марганца содержащимся в воде кислородом:
Количество образовавшегося в воде бурого осадка гидроксида четырехвалентного марганца эквивалентно количеству растворенного кислорода. При последующем добавлении к пробе соляной или серной кислоты четырехвалентный марганец вновь восстанавливается до двухвалентного, окисляя при этом йодид калия. Это приводит к выделению свободного йода, эквивалентного содержанию четырехвалентного марганца, или, что то же самое, растворенного кислорода в пробе:
Выделившийся свободный йод определяется количественно путем титрования раствором тиосульфата натрия:
I2+ 2Na2S2O3
Йодометрический метод определения растворенного кислорода неприменим для вод, содержащих сероводород, так как сероводород вступает во взаимодействие с йодом и занижает результат. Во избежание этой ошибки предварительно связывают содержащийся в пробе сероводород в соединение, не препятствующее нормальному течению реакции. Для этой цели обычно используют хлорид ртути (II):
Определение H2S. Прежде чем приступить к количественному определению сероводорода, определяют его качественное присутствие по характерному запаху. Более объективным качественным показателем служат свинцовые индикаторные бумажки (фильтровальная бумага, пропитанная раствором ацетата свинца). При опускании в воду, содержащую сероводород, свинцовая бумага темнеет, принимая желтую (малое содержание), бурую (среднее содержание) или темно-коричневую (высокое содержание) окраску.
В водных растворах сероводород присутствует в трех формах: недиссоциированный H2S, в виде ионов HS – и S 2 – . Относительные концентрации этих форм в воде зависят от рН этой воды и в меньшей степени от температуры и общего солесодержания.
Если анализируемая вода не содержит веществ, реагирующих с иодом, то сероводород и его ионы можно определить следующим образом.
В основе количественного метода определения H2S лежит реакция окисления сероводорода йодом:
К точно отмеренному подкисленному раствору йода, взятого в избытке по отношению к ожидаемому содержанию сероводорода, прибавляют определенное количество воды. Количество йода, израсходованное на окисление сероводорода, определяется обратным титрованием остатка йода тиосульфатом. Разница между количеством раствора тиосульфата, соответствующим всему количеству взятого для анализа йода, и количеством этого же раствора, затраченного на титрование остатка йода в пробе, эквивалентна содержанию сероводорода в исследуемой пробе.
источник