В природной воде водоемов всегда присутствуют органические вещества. Их концентрации могут быть иногда очень малы (например, в родниковых и талых водах). Природными источниками органических веществ являются разрушающиеся останки организмов растительного и животного происхождения, как живших в воде, так и попавших в водоем с листвы, по воздуху, с берегов и т.п. Кроме природных, существуют также техногенные источники органических веществ: транспортные предприятия (нефтепродукты), целлюлозно-бумажные и лесоперерабатывающие комбинаты (лигнины), мясокомбинаты (белковые соединения), сельскохозяйственные и фекальные стоки и т.д. Органические загрязнения попадают в водоем разными путями, главным образом со сточными водами и дождевыми поверхностными смывами с почвы.
В естественных условиях находящиеся в воде органические вещества разрушаются бактериями, претерпевая аэробное биохимическое окисление с образованием двуокиси углерода. При этом на окисление потребляется растворенный в воде кислород. В водоемах с большим содержанием органических веществ большая часть РК потребляется на биохимическое окисление, лишая таким образом кислорода другие организмы. При этом увеличивается количество организмов, более устойчивых к низкому содержанию РК, исчезают кислородолюбивые виды и появляются виды, терпимые к дефициту кислорода. Таким образом, в процессе биохимического окисления органических веществ в воде происходит уменьшение концентрации РК, и эта убыль косвенно является мерой содержания в воде органических веществ. Соответствующий показатель качества воды, характеризующий суммарное содержание в воде органических веществ, называется биохимическим потреблением кислорода (БПК).
Определение БПК основано на измерении концентрации РК в пробе воды непосредственно после отбора, а также после инкубации пробы. Инкубацию пробы проводят без доступа воздуха в кислородной склянке (т.е. в той же посуде, где определяется значение РК) в течение времени, необходимого для протекания реакции биохимического окисления. Так как скорость биохимической реакции зависит от температуры, инкубацию проводят в режиме постоянной температуры (20±1)°С, причем от точности поддержания значения температуры зависит точность выполнения анализа на БПК. Обычно определяют БПК за 5 суток инкубации (БПК5)*, однако содержание некоторых соединений более информативно характеризуется величиной БПК за 10 суток или за период полного окисления (БПК10 или БПКполн соответственно). Погрешность в определении БПК может внести также освещение пробы, влияющее на жизнедеятельность микроорганизмов и способное в некоторых случаях вызывать фотохимическое окисление. Поэтому инкубацию пробы проводят без доступа света (в темном месте).
Величина БПК увеличивается со временем, достигая некоторого максимального значения – БПКполн, причем загрязнители различной природы могут повышать (понижать) значение БПК. Динамика биохимического потребления кислорода при окислении органических веществ в воде приведена на рис. 8.
Рис. 8. Динамика биохимического потребления кислорода:
а – легкоокисляющиеся («биологически мягкие») вещества – сахара, формальдегид, спирты, фенолы и т.п.;
в – нормально окисляющиеся вещества – нафтолы, крезолы, анионогенные ПАВ, сульфанол и т.п.;
с – тяжело окисляющиеся («биологически жесткие») вещества – неионогенные ПАВ, гидрохинон и т.п.
Таким образом, БПК – количество кислорода в миллиграммах, требуемое для окисления находящихся в 1 л воды органических веществ в аэробных условиях, без доступа света, при 20°С, за определенный период в результате протекающих в воде биохимических процессов. Ориентировочно принимают, что БПК5 составляет около 70% БПКполн, но может составлять от 10 до 90% в зависимости от окисляющегося вещества.
Особенностью биохимического окисления органических веществ в воде является сопутствующий ему процесс нитрификации, искажающий характер потребления кислорода (рис. 9).
Рис. 9. Изменение характера потребления кислорода при нитрификации.
Нитрификация протекает под воздействием особых нитрифицирующих бактерий – Nitrozomonas, Nitrobacter и др. Эти бактерии обеспечивают окисление азотсодержащих соединений, которые обычно присутствуют в загрязненных природных и некоторых сточных водах, и тем самым способствуют превращению азота сначала из аммонийной в нитритную, а затем и нитратную формы. Соответствующие процессы описываются уравнениями:
где: Q – энергия, высвобождающаяся при реакциях.
Процесс нитрификации происходит и при инкубации пробы в кислородных склянках. Количество кислорода, пошедшее на нитрификацию, может в несколько раз превышать количество кислорода, требуемое для биохимического окисления органических углеродсодержащих соединений. Начало нитрификации можно зафиксировать по минимуму на графике суточных приращений БПК за период инкубации. Нитрификация начинается приблизительно на 7-е сутки инкубации (см. рис. 9), поэтому при определении БПК за 10 и более суток необходимо вводить в пробу специальные вещества – ингибиторы, подавляющие жизнедеятельность нитрифицирующих бактерий, но не влияющие на обычную микрофлору (т.е. на бактерии – окислители органических соединений). В качестве ингибитора применяют тиомочевину (тиокарбамид), который вводят в пробу либо в разбавляющую воду в концентрации 0,5 мг/мл.
В то время как и природные, и хозяйственно-бытовые сточные воды содержат большое количество микроорганизмов, способных развиваться за счет содержащихся в воде органических веществ, многие виды промышленных сточных вод стерильны или содержат микроорганизмы, которые не способны к аэробной переработке органических веществ. Однако микробы можно адаптировать (приспособить) к присутствию различных соединений, в том числе токсичных. Поэтому при анализе таких сточных вод (для них характерно, как правило, повышенное содержание органических веществ) обычно применяют разбавление водой, насыщенной кислородом и содержащей добавки адаптированных микроорганизмов. При определении БПКполн. промышленных сточных вод предварительная адаптация микрофлоры имеет решающее значение для получения правильных результатов анализа, т.к. в состав таких вод часто входят вещества, которые сильно замедляют процесс биохимического окисления, а иногда оказывают токсическое действие на бактериальную микрофлору.
Для исследования различных промышленных сточных вод, которые трудно подвергаются биохимическому окислению, используемый метод может применяться в варианте определения полного БПК (БПКполн.).
Если в пробе очень много органических веществ, к ней добавляют разбавляющую воду. Для достижения максимальной точности анализа БПК анализируемая проба или смесь пробы с разбавляющей водой должна содержать такое количество кислорода, чтобы во время инкубационного периода произошло снижение его концентрации на 2 мг/л и более, причем остающаяся концентрация кислорода спустя 5 суток инкубации должна составлять не менее 3 мг/л. Если же содержание РК в воде недостаточно, то пробу воды предварительно аэрируют для насыщения кислородом воздуха**. Наиболее правильным (точным) считается результат такого определения, при котором израсходовано около 50% первоначально присутствующего в пробе кислорода.
В поверхностных водах величина БПК5 колеблется в пределах от 0,5 до 5,0 мг/л; она подвержена сезонным и суточным изменениям, которые, в основном, зависят от изменения температуры и от физиологической и биохимической активности микроорганизмов. Весьма значительны изменения БПК5 природных водоемов при загрязнении сточными водами.
Норматив на БПКполн. не должен превышать: для водоемов хозяйственно-питьевого водопользования – 3 мг/л, для водоемов культурно-бытового водопользования – 6 мг/л. Соответственно можно оценить предельно-допустимые значения БПК5 для тех же водоемов, равные примерно 2 мг/л и 4 мг/л.
Определение концентрации растворенного кислорода при анализе воды на БПК может выполняться различными методами. Наиболее распространен для определения РК при анализе БПК метод йодометрического титрования – метод Винклера (подробно описан в разделе «Растворенный кислород»).
Мешающее влияние на определение БПК оказывают процессы, происходящие в пробе в промежуток времени между отбором пробы и ее обработкой в лаборатории. Для исключения этого влияния начинать определение необходимо сразу же на месте отбора пробы. При этом следует соблюдать те же условия, что и при работе в лаборатории (хранение пробы в темноте, без доступа воздуха, при температуре 20°С).
Поскольку анализ на БПК связан с определением РК, мешающее влияние на результат анализа могут оказывать те же примеси, которые оказывают мешающее влияют на определение РК (взвешенные и окрашенные вещества, биологически активные взвешенные вещества, восстановители и окислители). Следует отметить, что мешающее влияние указанные компоненты оказывают, как правило, в концентрациях, встречающихся только в сточных и загрязненных поверхностных водах.
В полевом варианте предлагаемый метод определения БПК*** предусматривает определение БПК5 для относительно незагрязненных и обычно достаточно насыщенных кислородом природных поверхностных вод, поэтому аэрацию проб, добавление разбавляющей воды и введение ингибиторов нитрификации не проводится. Используемый метод применим для арбитражного анализа поверхностных и сточных вод при содержании органических веществ, соответствующем потреблению кислорода на их окисление до 6 мг/л. Однако при высоком содержании органических веществ в воде данный метод в предлагаемом, упрощенном, варианте не может дать точных результатов (весь РК расходуется еще до окончания 5-дневной инкубации), поэтому необходимо применять разбавление пробы незагрязненной аэрированной водой.
Альтернативным методом определения БПК может быть метод с электродным (потенциометрическим) измерением концентрации РК с помощью оксиметра. При этом следует иметь в виду все вышеизложенные особенности БПК как показателя качества воды, а также биохимические процессы, протекающие в пробе.
Оборудование, реактивы и принадлежности для определения растворенного кислорода методом Винклера (см. раздел «Растворенный кислород»); кислородные калиброванные склянки для инкубирования проб; чашки Петри; термостат-инкубатор, обеспечивающий поддержание температуры (20±1)°С.
1. Отберите пробы воды в кислородные склянки (не менее 3 шт.) как описано в методе определения РК.
Примечание. Для получения представительной пробы отбор проб воды проводите, по возможности, на удалении от берегов, дна, водных растений и т.п., которые могут быть источниками выделений в воду органических веществ или/и микроорганизмов.
2. В первой склянке сразу же фиксируйте кислород и определите концентрацию РК.
3. Другие склянки – инкубационные (две или больше) поместите в темноте в инкубатор через водяной затвор из чашки Петри, как показано на рисунке (это воспрепятствует контакту воды в склянке с воздухом).
Примечание. Инкубации желательно подвергнуть несколько проб, т.к. в случае получения ошибочных результатов (об этом можно судить по сходимости анализов проб, см. главу 3) выполнить анализ повторно будет уже невозможно.
4. По истечении 5 суток инкубации в склянках определите концентрацию остаточного РК как среднее арифметическое результатов по каждой инкубационной склянке.
5. Рассчитайте значение БПК5 в мг/л по формуле:
БПК5 = С1 – С2 ,
где: С1 – концентрация РК в первоначальной пробе, мг/л;
С2 – средняя концентрация РК по истечение периода инкубации, мг/л.
* Может определяться также БПК10 (за 10 суток) и БПКполн. (за 20 суток), при этом окисляется около 90 и 99% органических веществ соответственно.
** Для определения БПК необходимым фактором является не абсолютное количество РК в начале окисления, а достаточное его количество для окисления органических соединений. При этом после окисления остаточная концентрация РК в воде также должна иметь измеряемое значение.
*** Полевой вариант метода является адаптированным вариантом метода, приведенного в РД 52.24.420-95 и ИСО 5815.
источник
1.1. Настоящий руководящий документ устанавливает методику выполнения измерений (далее — методика) БПК5 в пробах поверхностных вод суши и очищенных сточных вод скляночным методом при содержании органических веществ, эквивалентном потреблению кислорода в диапазоне от 1,0 до 11,0 мг/дм 3 . При значении БПК5 более 6,0 мг/дм 3 определение следует проводить при соответствующем разбавлении пробы.
1.2. Настоящий руководящий документ предназначен для использования в лабораториях, осуществляющих анализ поверхностных вод суши и очищенных сточных вод.
В настоящем руководящем документе использованы ссылки на следующие нормативные документы:
ГОСТ 12.1.005-88 ССБТ. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 ССБТ. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 17.1.5.04-81 Охрана природы. Гидросфера. Приборы и устройства для отбора, первичной обработки и хранения проб природных вод. Общие технические условия
ГОСТ 17.1.5.05-85 Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков.
ГОСТ Р ИСО 5725-6-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике
ГОСТ Р 51592-2000 Вода. Общие требования к отбору проб
МИ 2881-2004 Рекомендация. ГСИ. Методики количественного химического анализа. Процедуры проверки приемлемости результатов анализа.
Ссылки на остальные нормативные документы приведены в разделе 4.
3.1. При соблюдении всех регламентируемых методикой условий проведения измерений характеристики погрешности результата измерения с вероятностью 0,95 не должны превышать значений, приведенных в таблице 1.
Таблица 1 — Диапазон измерений, значения характеристик погрешности и ее составляющих
Показатель повторяемости (среднеквадратическое отклонение повторяемости)
s r, мг/дм 3
Показатель воспроизводимости (среднеквадратическое отклонение воспроизводимости)
s R, мг/дм 3
Показатель точности (границы погрешности при вероятности P = 0,95)
± D , мг/дм 3
При выполнении измерений в пробах с величиной БПК5 свыше 11,0 мг/дм 3 после соответствующего разбавления погрешность измерения не превышает величины D · η, где D — погрешность измерения БПК5 в разбавленной пробе; η — степень разбавления.
Предел обнаружения БПК5 скляночным методом равен 0,5 мг/дм 3 .
3.2. Значения показателя точности методики используют при:
— оформлении результатов измерений, выдаваемых лабораторией;
— оценке деятельности лабораторий на качество проведения измерений;
— оценке возможности использования результатов измерений при реализации методики в конкретной лаборатории.
При выполнении измерений применяют следующие средства измерений и другие технические средства:
4.1.1. Весы лабораторные высокого ( II ) класса точности по ГОСТ 24104-2001.
4.1.2. Весы лабораторные обычного ( IV ) класса точности по ГОСТ 29329-92 с наибольшим пределом взвешивания 200 г и 500 г.
4.1.3. Колбы мерные 2 класса точности исполнения 2, 2а по ГОСТ 1770-74 вместимостью:
4.1.4. Пипетки градуированные 2 класса точности исполнения 1, 2 по ГОСТ 29227-91 вместимостью:
4.1.5. Пипетка с одной отметкой 2 класса точности исполнения 1, 2 по ГОСТ 29169-91 вместимостью:
4.1.6. Бюретка 2 класса точности исполнения 1, 2 по ГОСТ 29251-91 вместимостью:
4.1.7. Цилиндры мерные, исполнения 1, 3 по ГОСТ 1770-74 вместимостью:
4.1.8. Колбы конические исполнения 1, 2 по ГОСТ 25336-82 вместимостью:
4.1.9. Колбы конические или плоскодонные Кн или П, исполнения 1, 2, ТС по ГОСТ 25336-82 вместимостью:
4.1.10. Стаканы химические, тип В, исполнения 1, ТХС по ГОСТ 25336-82 вместимостью:
4.1.11. Склянки с притертыми пробками (кислородные) для проб воды вместимостью 100 — 250 см 3 (или склянки БПК).
4.1.12. Элемент ЭП1 (трубка хлоркальциевая) по ГОСТ 25336-82 — 1 шт.
4.1.13. Стаканчики для взвешивания (бюксы) СВ-19/9 по ГОСТ 25336-82 — 2 шт.
4.1.14. Воронка лабораторная по ГОСТ 25336-82 диаметром 75 мм — 1 шт.
4.1.15. Колба с тубусом (Бунзена) исполнения 1, 2 по ГОСТ 25336-82 вместимостью 0,25 — 0,5 дм 3 — 1 шт.
4.1.16. Воронка Бюхнера 1 или 2 по ГОСТ 9147-80
4.1.17. Термостат для проб, поддерживающий температуру (20 ± 1) °C.
4.1.18. Насос вакуумный любого типа.
4.1.20. Флаконы с пробками стеклянные для хранения реактивов вместимостью 100 см 3 , 100 см 3 , 500 см 3 .
4.1.21. Посуда стеклянная и полиэтиленовая для хранения проб и реактивов вместимостью 0,1; 0,25 и 1 дм 3 .
4.1.22. Шпатель (стеклянная лопатка).
4.1.23. Кюветы фотографические или кристаллизатор.
4.1.24. Отрезок гибкой пластиковой трубки длиной 50 — 70 см (сифон).
4.1.25. Микрокомпрессор аквариумный.
4.1.27. Шкаф сушильный общелабораторного назначения.
Допускается использование других типов средств измерений, вспомогательных устройств, в том числе импортных, с характеристиками не хуже, чем у приведенных в 4.1.
При выполнении измерений применяют следующие реактивы и материалы:
4.2.1. Марганец (II) хлористый 4-водный (хлорид марганца) по ГОСТ 612-75, ч.д.а. или марганец (II) сернокислый 5-водный (сульфат марганца) по ГОСТ 435-77, ч.д.а. (допустимо ч.).
4.2.2. Калий йодистый (йодид калия) по ГОСТ 4232-74, ч.д.а. или натрий йодистый 2-водный (йодид натрия) по ГОСТ 8422-76, ч.д.а.
4.2.3. Калий двухромовокислый (дихромат калия) по ГОСТ 4220-75 , х.ч. или калий двухромовокислый, стандарт-титр с молярной концентрацией количества вещества эквивалента (КВЭ) 0,1 моль/дм по ТУ 6-09-2540-72.
4.2.4. Натрий серноватистокислый (натрия тиосульфат) 5-водный по ГОСТ 27068-86 , ч.д.а. или натрий серноватистокислый (тиосульфат), стандарт-титр с молярной концентрацией КВЭ 0,1 моль/дм 3 по ТУ 6-09-2540-72.
4.2.5. Натрия гидроокись (гидроксид натрия) по ГОСТ 4328-77, ч.д.а., или калия гидроокись (гидроксид калия) по ГОСТ 24363-80, ч.д.а.
4.2.6. Натрий углекислый безводный (карбонат натрия) по ГОСТ 83-79, ч.д.а.
4.2.7. Кислота соляная по ГОСТ 3118-77, ч.д.а., или кислота серная по ГОСТ 4204-77, ч.д.а.
4.2.8. Аммоний хлористый (хлорид аммония) по ГОСТ 3773-72, ч.д.а.
4.2.9. Железо (III), хлорид (хлорид железа) 6-водный гексагидрат по ГОСТ 4147-74, ч.д.а.
4.2.10. Калий фосфорнокислый однозамещенный (дигидрофосфат калия) по ГОСТ 4198-75, ч.д.а.
4.2.11. Калий фосфорнокислый двузамещенный (гидрофосфат калия) 3-водный по ГОСТ 2493-75, ч.д.а.
4.2.12. Натрий фосфорнокислый двузамещенный (гидрофосфат натрия) по ГОСТ 11773-76 или натрий фосфорнокислый двузамещенный (гидрофосфат натрия), 12-водный по ГОСТ 4172-76, ч.д.а.
4.2.13. Хлорид кальция, гексагидрат по ТУ 6-09-4578-81, ч.д.а.
4.2.14. Магний сернокислый (сульфат магния) 7-водный по ГОСТ 4523-77, ч.д.а.
4.2.15. Хлороформ по ГОСТ 20015-88, очищенный.
4.2.16. Крахмал растворимый по ГОСТ 10163-76, ч.д.а.
4.2.17. Спирт этиловый ректификованный по ГОСТ 18300-87.
4.2.18. Вода дистиллированная по ГОСТ 6709-72, свежепрокипяченная и охлажденная в закрытой склянке до комнатной температуры.
4.2.19. Универсальная индикаторная бумага по ТУ 6-09-1181-77.
4.2.20. Фильтры обеззоленные «белая лента» и «синяя лента» по ТУ 6-09-1678-86.
Допускается использование реактивов, изготовленных по другой нормативно-технической документации, в том числе импортных, с квалификацией не ниже указанной в 4.2.
Определение основано на измерении массовой концентрации растворенного кислорода скляночным методом путем йодометрического титрования в первоначальной или разбавленной пробе воды до и после ее инкубации в течение 5 сут. при стандартных условиях (20 °C, отсутствие доступа воздуха и света).
6.1. При выполнении измерений БПК5 в пробах поверхностных вод суши и очищенных сточных вод соблюдают требования безопасности, установленные в национальных стандартах и соответствующих нормативных документах.
6.2. По степени воздействия на организм вредные вещества, используемые при выполнении измерений, относятся ко 2, 3 классам опасности по ГОСТ 12.1.007.
6.3. Содержание используемых вредных веществ в воздухе рабочей зоны не должно превышать установленных предельно допустимых концентраций в соответствии с ГОСТ 12.1.005.
6.4. Дополнительных требований по экологической безопасности не предъявляется.
К выполнению измерений и обработке их результатов допускаются лица со средним профессиональным образованием или без профессионального образования, но имеющие стаж работы в лаборатории не менее года и освоившие методику.
8.1. При выполнении измерений в лаборатории должны быть соблюдены следующие условия:
— температура окружающего воздуха (22 ± 5) °C;
— атмосферное давление от 84,0 до 106,7 кПа (от 630 до 800 мм рт. ст.);
— влажность воздуха не более 80 % при 25 °C;
— напряжение в сети (220 ± 10) В;
— частота переменного тока в сети питания (50 ± 1) Гц.
Отбор проб производится в соответствии с ГОСТ 17.1.5.05 и ГОСТ Р 51592. Оборудование для отбора проб должно соответствовать ГОСТ 17.1.5.04 и ГОСТ Р 51592.
Определяемое значение БПК5 в значительной степени зависит от особенностей химических и биохимических процессов, протекающих в пробе в промежутке времени между ее отбором и началом анализа. Пробы для определения БПК5 консервировать не допускается. Поэтому пробу необходимо обрабатывать сразу же после отбора, как описано в разделе 11. Если это невозможно, то отбирают пробу воды в посуду темного стекла, заполняя склянку под горло и хранят при температуре не выше 4 °C не более 4 ч.
10.1.1. Раствор хлорида (сульфата) марганца
Растворяют 210 г хлорида марганца (М n Сl 2 · 4Н2О) или 260 г сульфата марганца ( MnSO 4 · 5H 2 O) или 290 г сульфата марганца ( MnSO 4 · 7H 2 O) в 300 — 350 см 3 дистиллированной воды, фильтруют в мерную колбу вместимостью 500 см 3 и доливают дистиллированной водой до метки на колбе. Хранят в плотно закрытой склянке.
10.1.2. Щелочной раствор йодида калия (или натрия)
Растворяют 15 г йодида калия или 18 г йодида натрия ( NaI · H 2 O) в 20 см 3 , а 50 г гидроксида натрия — в 50 см 3 дистиллированной воды.
Полученные растворы смешивают в мерной колбе вместимостью 100 см 3 и доводят объем дистиллированной водой до метки на колбе. При наличии мути раствор фильтруют. Хранят в склянке из темного стекла с плотной резиновой пробкой.
10.1.3. Раствор соляной кислоты 2:1 (по объему)
К 170 см 3 дистиллированной воды 340 см 3 концентрированной соляной кислоты добавляют.
Вместо раствора соляной кислоты 2:1 (по объему) во всех случаях можно использовать раствор серной кислоты 1:4 (по объему). Для его приготовления 100 см 3 концентрированной серной кислоты добавляют к 400 см 3 дистиллированной воды.
ВНИМАНИЕ! СЕРНУЮ КИСЛОТУ ОТМЕРИВАЮТ СУХИМ ЦИЛИНДРОМ И ОСТОРОЖНО ПРИЛИВАЮТ К ДИСТИЛЛИРОВАННОЙ ВОДЕ НЕБОЛЬШИМИ ПОРЦИЯМИ ПРИ ПЕРЕМЕШИВАНИИ (В ТЕРМОСТОЙКОМ СТАКАНЕ).
Проверку чистоты растворов хлорида марганца, йодида калия (или натрия), соляной (или серной) кислоты и их очистку осуществляют, как описано в 10.2.
10.1.4. Раствор крахмала, 0,5 %-ный
Взбалтывают 0,5 г крахмала с 15 — 20 см 3 дистиллированной воды.
Суспензию постепенно приливают к 80 — 85 см кипящей дистиллированной воды и кипятят еще 2 — 3 мин. После охлаждения раствора его консервируют добавлением 2 — 3 капель хлороформа или нескольких кристалликов салициловой кислоты.
Раствор используют до помутнения.
10.1.5. Раствор дихромата калия с молярной концентрацией количества вещества эквивалента (КВЭ) 0,0200 моль/дм 3
При использовании стандарт-титра (см. 4.2.3) последний переносят в мерную колбу вместимостью 500 см 3 , растворяют в дистиллированной воде и доводят до метки. Затем пипеткой с одной отметкой отбирают 50 см 3 полученного раствора, переносят его в мерную колбу вместимостью 500 см 3 и доводят объем дистиллированной водой до метки.
При отсутствии стандарт-титра для приготовления стандартного раствора взвешивают 0,4904 г дихромата калия, предварительно высушенного в сушильном шкафу при температуре 105 °C в течение 1 — 2 ч, количественно переносят в мерную колбу вместимостью 500 см 3 , растворяют в дистиллированной воде и доводят объем раствора до метки на колбе. Хранят в склянке с притертой пробкой в темном месте не более 6 мес.
10.1.6. Раствор тиосульфата натрия с молярной концентрацией КВЭ 0,02 моль/дм 3
При использовании стандарт-титра (см. 4.2.4) последний переносят в мерную колбу вместимостью 500 см 3 , растворяют в дистиллированной воде и доводят до метки. Затем пипеткой с одной отметкой отбирают 50 см 3 полученного раствора, переносят его в мерную колбу вместимостью 500 см 3 и доводят объем дистиллированной водой до метки.
Для приготовления стандартного раствора из навески при отсутствии стандарт-титра 2,5 г тиосульфата натрия (Na 2 S 2 O 3 · 5H 2 O) переносят в мерную колбу вместимостью 500 см 3 , растворяют в дистиллированной воде и доводят объем раствора до метки на колбе.
В качестве консерванта к полученному раствору добавляют 3 см 3 хлороформа. Перед определением точной концентрации раствор выдерживают не менее 5 сут. Хранят в склянке из темного стекла, закрытой пробкой с вставленными в нее сифоном с бюреткой и хлоркальциевой трубкой, заполненной гранулированным гидроксидом калия или гидроксидом натрия.
Точную концентрацию стандартного раствора тиосульфата натрия определяют, как описано в 10.4 не реже 1 раза в неделю. Результаты проверки заносят в специальный журнал.
Растворяют в дистиллированной воде 4,25 г дигидрофосфата калия (КН2РО4), 14,25 г гидрофосфата калия (К2НРО4 · 3Н2О), 8,85 г гидрофосфата натрия ( Na 2 HPO 4 ) или 22,3 г гидрофосфата натрия (Na 2 HPO 4 · 12H 2 O) и 0,85 г хлорида аммония ( NH 4 Cl) в мерной колбе вместимостью 500 см 3 , доводят объем до метки и перемешивают.
10.1.8. Раствор сульфата магния, 1,1 %-ный
В 500 см 3 дистиллированной воды растворяют 11,25 г сульфата магния (MgSO 4 · 7H 2 O).
10.1.9. Раствор хлорида кальция, 2,7 %-ный
В 500 3 см дистиллированной воды растворяют 28,2 г хлорида кальция (СаСl 2 · 6Н2О) (или 13,8 г СаСl 2 ).
В 500 см 3 дистиллированной воды растворяют 0,13 г хлорида железа (FeCl 3 · 6H 2 O).
Разбавляющую воду готовят в день применения из дистиллированной воды с температурой 20 °C, добавляя фосфатный буферный раствор, растворы сульфата магния, хлорида кальция и хлорида железа (см. 10.1.7 — 10.1.10) из расчета по 1 см 3 на 1 дм 3 .
Затем насыщают воду кислородом воздуха интенсивным встряхиванием, после чего оставляют на 3 — 5 мин (до исчезновения мелких пузырьков воздуха) для установления равновесия.
Все растворы, необходимые для приготовления разбавляющей воды, хранят до появления в них осадка или до повышения значения БПК разбавляющей воды более 0,5 мг/дм 3 (см. 11.3).
10.1.12. Раствор соляной кислоты, 1 моль/дм 3
К 92 см 3 дистиллированной воды добавляют 8,5 см 3 концентрированной соляной кислоты и перемешивают.
10.1.13. Раствор гидроксида натрия, 1 моль/дм 3
В 100 см 3 дистиллированной воды растворяют 4 г гидроксида натрия. Хранят в полиэтиленовой посуде.
Для проверки чистоты 1 г йодида калия растворяют в 100 см 3 свежепрокипяченной и охлажденной до комнатной температуры дистиллированной воды, приливают 10 см 3 раствора соляной кислоты, проверенной на чистоту, и 1 см 3 раствора крахмала.
Если в течение 5 мин голубая окраска не появляется, реактив пригоден для использования. В противном случае йодид калия должен быть очищен от свободного йода.
Для этого 30 — 40 г йодида калия помещают в воронку Бюхнера и промывают при перемешивании охлажденным до 3 — 5 °C этиловым спиртом до появления бесцветной порции последнего. Промытый йодид калия сушат в темноте между листами фильтровальной бумаги в течение суток. Хранят в плотно закрытой склянке из темного стекла.
Проверку чистоты и очистку йодида натрия проводят аналогичным образом.
10.2.2. Раствор хлорида (сульфата) марганца
К 100 см 3 свежепрокипяченной и охлажденной дистиллированной воды добавляют 1 см 3 раствора соли марганца, 0,2 г сухого йодида калия, 5 см 3 раствора соляной кислоты, проверенных на чистоту, и 1 см 3 раствора крахмала.
Отсутствие через 10 мин синей окраски указывает на чистоту реактива. В противном случае для очистки раствора на каждые 100 см 3 его добавляют около 1 г безводного карбоната натрия, хорошо перемешивают, отстаивают в течение суток, а затем фильтруют через бумажный фильтр «синяя лента».
10.2.3. Раствор кислоты (соляной или серной)
К 50 см 3 дистиллированной воды добавляют 1 см 3 раствора крахмала, 1 г проверенного на чистоту йодида калия и 10 см 3 раствора соляной кислоты.
Если в течение 5 мин не появится синяя окраска, кислота может быть использована в анализе, в противном случае следует заменить исходный реактив.
Чтобы установить вместимость склянки для определения кислорода, ее тщательно моют, высушивают (снаружи и изнутри) и взвешивают вместе с пробкой с точностью до 0,01 г. Предварительно склянки выдерживают в комнате для взвешивания не менее 30 мин.
Затем наполняют ее дистиллированной водой до краев и закрывают стеклянной пробкой так, чтобы под пробкой не оставалось пузырьков воздуха. Обтирают склянку досуха и снова взвешивают с точностью до 0,01 г. Дистиллированную воду также выдерживают в комнате для взвешивания не менее 30 мин и измеряют ее температуру.
По разности двух взвешиваний рассчитывают массу воды в склянке, которую для перевода в объем следует разделить на коэффициент, равный 0,998 при температуре воды 15 °C, 0,997 — при 20 °C и 0,996 — при 25 °C.
В колбу для титрования вносят 80 — 90 см 3 дистиллированной воды, 10 см 3 раствора дихромата калия, 0,0200 моль/дм 3 КВЭ, добавляют 1 г сухого йодида калия и 10 см 3 раствора соляной кислоты. Раствор перемешивают, выдерживают 5 мин в темном месте и титруют раствором тиосульфата натрия до светло-желтой окраски. Затем добавляют 1 см 3 раствора крахмала и продолжают титрование до исчезновения синей окраски. Повторяют титрование и, если расхождение между значениями объемов титранта не более 0,05 см 3 , за результат принимают их среднее.
В противном случае повторяют титрование до получения результатов, отличающихся не более, чем на 0,05 см 3 .
Точную молярную концентрацию КВЭ тиосульфата натрия в растворе рассчитывают по формуле
(2)
где Cm — молярная концентрация раствора тиосульфата натрия, моль/дм 3 КВЭ;
C д — молярная концентрация раствора дихромата калия, моль/дм 3 КВЭ;
V т — объем раствора тиосульфата натрия, пошедший на титрование, см 3 ;
V д — объем раствора дихромата калия, взятый для титрования, см 3 .
Если проба не содержит визуально заметного количества взвешенных веществ, 1,0 — 1,4 дм 3 ее помещают в достаточно большую (2 дм 3 ) колбу, устанавливают pH в пределах 6 — 8 по универсальной индикаторной бумаге добавлением раствора соляной кислоты или гидроксида натрия 1 моль/дм 3 . Доводят температуру пробы до (20 ± 1) °C, нагревая (при помощи водяной бани) или охлаждая ее (под струей водопроводной воды). Затем энергично взбалтывают пробу не менее 10 мин, чтобы насытить ее кислородом. Насыщение пробы кислородом можно также осуществить, пропуская через нее воздух с помощью аквариумного микрокомпрессора. После завершения процедуры насыщения пробу следует оставить на 3 — 5 мин для удаления избытка воздуха (до отсутствия поднимающихся к поверхности мелких пузырьков).
Если проба содержит грубую взвесь, ее наливают в склянку (лучше, цилиндр) вместимостью не менее 1 дм 3 и отстаивают 0,5 — 1 ч. После отстаивания отбирают сифоном осветлившийся средний слой воды в колбу для насыщения кислородом. Если пробу отстаиванием в течение часа осветлить не удается, ее фильтруют через бумажный фильтр «белая лента». Всегда в результатах анализа следует указывать принятый способ предварительной обработки воды.
Подготовленную пробу наливают в 3 сухие кислородные склянки, заполняя их до края так, чтобы внутри склянки не образовывалось пузырьков. В одной из 3-х склянок сразу же фиксируют и определяют концентрацию растворенного кислорода (см. 11.2). Время между аэрацией пробы и фиксированием кислорода при определении его концентрации не должно быть более 15 мин.
Две другие склянки закрывают, помещают пробками вниз в наполненную дистиллированной водой фотографическую кювету или кристаллизатор (гидрозатвор) и устанавливают в термостат. При использовании склянок БПК колпачок заполняется той же пробой. Склянки выдерживают при отсутствии доступа света в термостате при (20 ± 1) °C в течение 5 сут. По истечении этого срока в инкубированных склянках определяют концентрацию неизрасходованного растворенного кислорода (см. 11.2).
Сразу же после заполнения склянки (или после инкубации) фиксируют растворенный кислород, для чего в склянку с пробой воды вводят отдельными пипетками 1 см 3 (при вместимости склянки до 150 см 3 ) или 2 см 3 (при вместимости более 150 см 3 ) раствора хлорида (сульфата) марганца и 1 см 3 или 2 см 3 щелочного раствора йодида калия (при вместимости склянки до 150 см 3 и более 150 см 3 соответственно).
Пипетку погружают каждый раз до половины склянки и поднимают вверх по мере истечения реактива из нее. Затем быстро закрывают склянку стеклянной пробкой таким образом, чтобы в ней не оставалось пузырьков воздуха, и содержимое тщательно перемешивают 15 — 20-кратным переворачиванием склянки до равномерного распределения осадка в воде по всему объему склянки. Склянки с зафиксированным в них кислородом помещают в темное место для отстаивания (на время не менее 10 мин и не более 24 ч).
После того, как опустившийся на дно осадок будет занимать менее половины высоты склянки, к пробе приливают 5 или 10 см 3 (в зависимости от вместимости склянки) раствора соляной кислоты, погружая при этом пипетку до дна склянки к осадку (не взмучивать) и медленно поднимая ее вверх по мере опорожнения. Вытеснение из склянки части прозрачной жидкости для анализа значения не имеет.
Склянку закрывают пробкой, и содержимое тщательно перемешивают. После полного растворения бурого осадка пипеткой с одной отметкой отбирают 50 см 3 раствора, предварительно ополаскивая пипетку этим же раствором, переносят его в колбу для титрования и титруют раствором тиосульфата натрия из бюретки вместимостью 10 см 3 до тех пор, пока он не станет светло-желтым. Затем прибавляют 1 см 3 раствора крахмала и продолжают титрование до исчезновения синей окраски.
В склянках после инкубации, повторяют определение растворенного кислорода, отбирая аликвоту из второй (следующей) склянки.
Если предполагается, что значение БПК5 будет больше 5 мг/дм 3 , то растворенного кислорода может не хватить для окисления органического вещества пробы. В этом случае исходную пробу разбавляют. Для разбавления используют воду, подготовленную в соответствии с 10.1.11.
В зависимости от предполагаемого значения БПК5 при разбавлении для выбора объема пробы анализируемой воды руководствуются таблицей 2.
Таблица 2 — Рекомендуемое разбавление проб анализируемой воды при определении БПК5
источник
Вода незагрязненных водоемов в зависимости от температуры (от 30ºС до 0 ºС) содержит 8-14 мг/л кислорода в насыщенном состоянии при атмосферном давлении. Поступающие в водоем вместе со сточными водами бактерии и некоторые химические вещества потребляют для своего окисления растворенный в воде кислород, понижая тем самым содержание его в воде.
При очень низком содержании кислорода жизнедеятельность в водоеме затухает, интенсивность процессов самоочищения снижается, а иногда и почти прекращается. Процесс окисления поступающих в водоем вместе со сточными водами веществ может быть разделен на три стадии, характеризующиеся определенной последовательностью расходования кислорода.
Вначале идет процесс химического окисления легко и трудно окисляющихся соединений, затем биохимическое окисление органических веществ, и, наконец, нитрификация азотсодержащих веществ с образованием солей азотной кислоты.
Если первая стадия (чисто химическое потребление кислорода) не длительна, то вторая (биохимическое окисление), в зависимости от температуры сточной воды и концентрации органических веществ — длится несколько суток. Процесс нитрификации может происходить более продолжительное время (до 40 – 50 суток).
Практическое значение имеет вторая фаза окисления сточных вод, протекающая при участии микроорганизмов в присутствии растворенного в воде свободного кислорода, в результате которой сточная вода приобретает способность не загнивать.
Под влиянием микроорганизмов органическое вещество сточных вод постепенно минерализуется, требуя для своего окисления все меньше кислорода (происходит распад органического вещества).
БПК сточных вод при этом постепенно уменьшается до момента полной минерализации, когда кислород уже не расходуется.
Биохимическое потребление кислорода (БПК) определяется количеством кислорода в мг/л, которое требуется для окисления находящихся в воде органических веществ, что устанавливается по разности в содержании кислорода в момент взятия пробы и спустя определенное время, например 5 суток (БПК ).
При относительно сильном загрязнении воды открытых водоемов может оказаться, что спустя 5 суток в ней совсем не окажется кислорода. Поэтому анализ начинают с того, что исследуемую воду предварительно взбалтывают в продолжении 1 мин в присутствии воздуха для насыщения ее кислородом. Потом определяют растворенный кислород в одной части ее пробы сразу же после взбалтывания, а в другой – спустя 5 суток выстаивания в темном месте при t = 18 – 20ºС.
Полное окисление происходит где-то за 20 суток, но для практических целей обычно определяют БПК через 5 суток и только для более полной качественной характеристики сточной воды в ней определяют БПК и БПК .
Растворенный в воде кислород находят по методу Винклера. Принцип данного метода основан на том, что гидроокись двухвалентного марганца MnO (белый осадок) поглощает свободный кислород, образуя двуокись марганца MnO (бурый осадок).
Осадок растворяют в соляной кислоте. При этом выделяется йод в количестве, эквивалентном содержанию в воде растворенного кислорода. Выделившийся йод оттитровывается раствором гипосульфита (тиосульфата натрия) в присутствии крахмала:
2MnCl + O + 4NaOH = 2MnO + 4NaCl + 2H O;
MnO + 2KI + 4HCl = MnCl + I + 2KCl + 2H O;
I + 2Na S O = Na S O + 2NaI
Цель анализа – провести оценку качества сточной воды по результатам ее анализов на БПК.
Принцип метода анализа основан на определении убыли растворенного в воде кислорода за определенное время (5 или 20 суток).
— раствор хлористого марганца: 50 г MnCl растворяют в 100 см 3 дистиллированной воды;
— смесь едкого натрия и йодистого калия: 32 г х.ч. гидроокиси натрия растворяют в 100 см 3 воды и затем прибавляют 2 г йодистого калия.
Раствор, подкисленный соляной или серной кислотами, не должен давать синей окраски с крахмалом;
— 0,02 н. раствор тиосульфата натрия (титр устанавливают по бихромату калия);
— склянка с притертой пробкой вместимостью 250 см 3 ;
Ход определения
Две одинаковые склянки с притертыми пробками вместимостью 250 см 3 заполняют испытуемой водой и закрывают пробками так, чтобы под ними не было ни одного пузырька воздуха.
В одной пробе содержание кислорода определяют сразу, в другой — через 5 суток. Причем пробу хранят в темноте при комнатной температуре.
В склянку сразу после взятия анализируемой на содержание кислорода пробы, сразу после взятия пробы, вводят пипеткой 1 см 3 раствора хлористого марганца и 3 – 4 см 3 щелочного раствора йодистого калия.
При этом пипетку опускают до дна склянки и постепенно поднимают по мере вытекания из нее реактива. Затем склянку тут же осторожно закрывают пробкой. При этом часть жидкости, эквивалентная объему введенных растворов реактивов, вытесняется. Содержимое склянки перемешивают, переворачивая ее не менее 15 раз. После 10 – минутного отстаивания, когда жидкость над осадком просветлеет, образовавшийся осадок гидроокиси марганца растворяют добавлением 1 см 3 концентрированной серной кислоты. Для полного растворения осадка склянку встряхивают. Затем из нее отбирают в коническую колбу адекватную часть жидкости, равную точно 200 см 3 раствора, и титруют выделившийся йод 0,02 н. раствором тиосульфата натрия. К концу титрования, когда раствор приобретает бледно – желтый цвет, в него добавляют 0,5%-ный раствор крахмала и продолжают титрование до его обесцвечивания.
Формула для определения содержания кислорода в воде (в мг на 1л) имеет вид
,
где О — концентрация кислорода в воде, мг/ дм 3 ;
А — количество 0,02 н. раствора тиосульфата натрия, затраченного на титрование, см 3 ;
К – поправочный коэффициент тиосульфата натрия;
V — объем воды, взятый из склянки для титрования, см 3 .
Содержание кислорода в другой склянке, хранившейся в течение 5 суток (или другое время), устанавливают подобным же способом.
Формула для расчета БПК имеет вид
,
где Х – искомое БПК , мг/ дм 3 О ;
А — содержание растворенного кислорода в воде до инкубации, мг/ дм 3 ;
А — содержание растворенного кислорода в воде после инкубации, мг/ дм 3 .
источник
В природной воде водоемов всегда присутствуют органические вещества. Их концентрации могут быть иногда очень малы (например, в родниковых и талых водах). Природными источниками органических веществ являются разрушающиеся останки организмов растительного и животного происхождения, как живших в воде, так и попавших в водоем с листвы, по воздуху, с берегов и т.п. Кроме природных, существуют также техногенные источники органических веществ: транспортные предприятия (нефтепродукты), целлюлозно-бумажные и лесоперерабатывающие комбинаты (лигнины), мясокомбинаты (белковые соединения), сельскохозяйственные и фекальные стоки и т.д. Органические загрязнения попадают в водоем разными путями, главным образом со сточными водами и дождевыми поверхностными смывами с почвы. В естественных условиях находящиеся в воде органические вещества разрушаются бактериями, претерпевая аэробное биохимическое окисление с образованием двуокиси углерода. При этом на окисление потребляется растворенный в воде кислород. В водоемах с большим содержанием органических веществ большая часть РК потребляется на биохимическое окисление, лишая таким образом кислорода другие организмы. При этом увеличивается количество организмов, более устойчивых к низкому содержанию РК, исчезают кислородолюбивые виды и появляются виды, терпимые к дефициту кислорода. Таким образом, в процессе биохимического окисления органических веществ в воде происходит уменьшение концентрации РК, и эта убыль косвенно является мерой содержания в воде органических веществ. Соответствующий показатель качества воды, характеризующий суммарное содержание в воде органических веществ, называется биохимическим потреблением кислорода (БПК).
Определение БПК основано на измерении концентрации РК в пробе воды непосредственно после отбора, а также после инкубации пробы. Инкубацию пробы проводят без доступа воздуха в кислородной склянке (т.е. в той же посуде, где определяется значение РК) в течение времени, необходимого для протекания реакции биохимического окисления. Так как скорость биохимической реакции зависит от температуры, инкубацию проводят в режиме постоянной температуры (20±1)°С, причем от точности поддержания значения температуры зависит точность выполнения анализа на БПК. Обычно определяют БПК за 5 суток инкубации (БПК5), однако содержание некоторых соединений более информативно характеризуется величиной БПК за 10 суток или за период полного окисления (БПК10 или БПКполн соответственно). Погрешность в определении БПК может внести также освещение пробы, влияющее на жизнедеятельность микроорганизмов и способное в некоторых случаях вызывать фотохимическое окисление. Поэтому инкубацию пробы проводят без доступа света (в темном месте).
Таблица. Величины БПК5 в водоемах с различной степенью загрязненности
Степень загрязнения (классы водоемов)
Для водоемов, загрязненных преимущественно хозяйственно-бытовыми сточными водами, БПК5 составляет обычно около 70% БПКП.
Определение БПКп в поверхностных водах используется с целью оценки содержания биохимически окисляемых органических веществ, условий обитания гидробионтов и в качестве интегрального показателя загрязненности воды. Необходимо использовать величины БПК5 при контроле эффективности работы очистных сооружений.
В зависимости от категории водоема величина БПК5 регламентируется следующим образом: не более 3 мг О2/дм 3 для водоемов хозяйственно-питьевого водопользования и не более 6 мг О2/дм 3 для водоемов хозяйственно-бытового и культурного водопользования. Для морей (I и II категории рыбохозяйственного водопользования) пятисуточная потребность в кислороде (БПК5) при 20°С не должна превышать 2 мг О2/дм 3 .
Полным биохимическим потреблением кислорода (БПКП) считается количество кислорода, требуемое для окисления органических примесей до начала процессов нитрификации. Количество кислорода, расходуемое для окисления аммонийного азота до нитритов и нитратов, при определении БПК не учитывается. Для бытовых сточных вод (без существенной примеси производственных) определяют БПК20, считая, что эта величина близка к БПКП.
Полная биологическая потребность в кислороде БПКП для внутренних водоемов рыбохозяйственного назначения (I и II категории) при 20°С не должна превышать 3 мг О2/дм 3 .
Пробоотбор и подготовка воды к анализу
Для проведения физико-химического анализа воды необходимо правильно провести пробоотбор. В зависимости от цели исследования проба воды для анализа может быть получена несколькими способами:
путем однократного отбора всего количества воды, нужного для анализа;
смешением проб, отобранных через определенные промежутки времени в одном месте исследуемого водоема;
смешением проб, отобранных одновременно в разных местах исследуемого водоема.
При отборе проб воды используют посуду из бесцветного стекла или полиэтилена марок, разрешенных для контакта с питьевой водой. Посуда должна быть тщательно вымыта моющими средствами, многократно ополоснута водопроводной и дистиллированной водой, а непосредственно перед забором воды посуду несколько раз ополаскивают исследуемой водой. Пробки желательно использовать стеклянные или полиэтиленовые; корковые или резиновые пробки обертывают полиэтиленовой пленкой.
На практике удобно пользоваться банкой или бутылью. В местах с затрудненным доступом к воде банку или бутыль можно прикрепить к шесту. Для взятия проб с определенной глубины используются батометры (рисунок). При отсутствии данного прибора можно сделать самодельный батометр, состоящий из бутыли (1л), с прикрепленным к ней тонким прочным шнуром необходимой длины. Бутыль закрывают пробкой со шнуром и помещают в футляр, имеющий груз и петлю. К петле привязывают веревку с отметками, указывающими глубину погружения. На нужной глубине выдергивают пробку из бутыли и после наполнения емкости водой и поднимают ее.
Отбор проб воды на проточных водоемах производится в 1 км выше ближайшего по течению пункта водопользования (водозабор для питьевого водоснабжения, места купания, организованного отдыха, территория населенного пункта), а на непроточных водоемах и водохранилищах — в 1 км в обе стороны от пункта водопользования.
Обычно пробы в створе отбирают в трех точках (у обоих берегов и в фарватере); при ограниченных же технических возможностях или на не-
больших водоемах допускается отбор проб в одной-двух точках (в местах наиболее сильного течения). Чаще всего пробы отбирают в 5 — 10 м от берега на глубине 50 см. Объектом особого внимания должны стать загрязненные струи.
Если на реке имеется сброс сточных вод от промышленных предприятий, стоки животноводческих ферм и т. д., то отбор проб воды проводят ниже сброса на 500 м, что позволяет контролировать степень загрязнения воды в реке сточными водами (для сравнения следует взять пробу на 500 м выше сброса сточных вод).
Если предполагается, что в результате сброса сточных вод в придонных слоях накапливаются оседающие вредные вещества, которые могут стать источником вторичного загрязнения воды, отбирают придонные пробы на расстоянии 30 — 50 см от дна.
В водохранилищах, озерах, прудах, где течение воды резко замедленно, качество воды может быть неоднородным на различных участках (здесь возможно возникновение вторичных источников загрязнения), поэтому в этих водоемах обычно берут серию проб по глубине.
Сразу же после взятия пробы необходимо сделать запись об условиях сбора, направлении ветра, указать дату и час отбора воды.
Подготовка воды к анализу
Для получения достоверных результатов анализ следует проводить возможно быстрее. В воде происходят процессы окисления-восстановления, физико-химические, биохимические, вызванные деятельностью микроорганизмов, сорбции, десорбции, седиментации и т. д. Могут изменяться и органолептические свойства воды — запах, цвет и др. Некоторые вещества способны адсорбироваться на стенках сосудов (железо, алюминий, медь, кадмий, марганец и др.), а из стекла бутылей могут выщелачиваться микроэлементы. При невозможности исследовать воду в установленные для соответствующих показателей сроки (таблица) ее охлаждают или консервируют.
Биохимические процессы в воде можно замедлить, охладив ее до 4°С. В этих условиях медленнее разрушаются и многие органические вещества.
Универсального консервирующего средства не существует, поэтому пробы для анализа отбирают в несколько бутылей. В каждой из них на месте отбора пробу консервируют, добавляя различные реагенты (таблица). Подготовка воды непосредственно перед анализом заключается в следующем:
— консервированные пробы при необходимости нейтрализуют, а охлажденные нагревают до комнатной температуры (не на нагревательном приборе);

Находящиеся в природной и питьевой воде загрязняющие вещества имеют, как правило, очень маленькие концентрации. Для того чтобы определить присутствие этих загрязнителей следует провести концентрирование этих примесей.
Если при анализе проводилось концентрирование пробы, то при последующих расчетах необходимо учитывать объем исходного образца воды.
Метод определения концентрации РК
Определение концентрации РК в воде проводится методом Винклера, который широко используется для санитарно-химического и экологического контроля.
3.2 Метод определения концентрации РК основан на способности гидроксида марганца (II) окисляться в щелочной среде до гидроксида марганца (IV), количественно связывая при этом кислород. В кислой среде гидроксид марганца (IV) снова переходит в двухвалентное состояние, окисляя при этом эквивалентное связанному кислороду количество йода. Выделившийся йод титруют раствором тиосульфата натрия в присутствии крахмала.
Определение РК проводится в несколько этапов. Сначала в анализируемую воду добавляют соль Мn (II), который в щелочной среде реагирует с растворенным кислородом с образованием нерастворимого гидроксида Мn (IV) по уравнению:
2Мn 



Таким образом, кислород «фиксируется» в пробе (количественно связывается). Кислород — неустойчивый компонент химического состава воды, поэтому фиксация должна быть проведена сразу после отбора пробы.
Далее к пробе добавляют раствор кислоты для растворения осадка и раствор йодида калия, в результате чего протекает химическая реакция с образованием свободного йода по уравнению:
2МnО(ОН)




Затем свободный йод титруют раствором тиосульфата натрия в присутствии крахмала, который добавляют в качестве индикатора для определения точки эквивалентности. Реакции описываются уравнениями:
J



J 
В точке эквивалентности происходит обесцвечивание раствора.
3.3 По результатам титрования определяют абсолютное содержание РК в воде в мг О
Метод определения биохимического потребления кислорода основан на способности микроорганизмов потреблять растворенный кислород при биохимическом окислении органических и неорганических веществ в воде.
Биохимическое потребление кислорода определяют количеством кислорода в мг/дм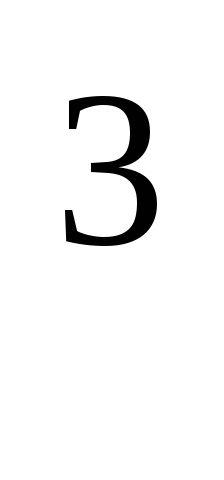
3.5 По разности содержания РК в воде до и после инкубации пробы в кислородной склянке при стандартных условиях (продолжительность инкубации — 5 суток при температуре 20±1°С без доступа света и воздуха) определяют БПК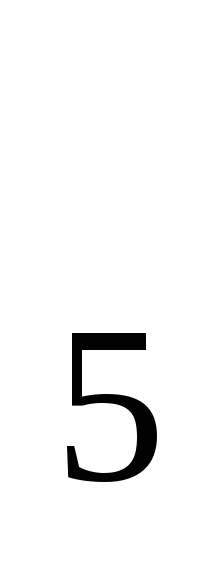
3.6 В поверхностных водах суши величина БПК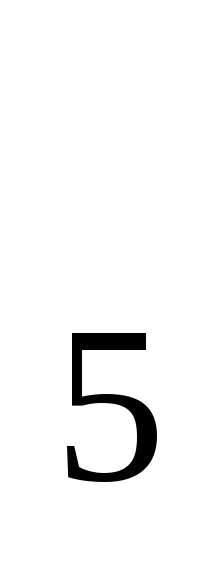

3.7 Мешающее влияние на аналитическое определение РК могут оказывать вещества (взвешенные и окрашенные, биологически активные, восстановители, реагирующие с выделившимся йодом, окислители, выделяющие йод из йодида калия) в концентрациях, встречающихся только в сточных и загрязненных поверхностных водах.
3.8 Точность выполнения анализа определяется:
качеством растворов, которое может ухудшиться при их загрязнении, хранении в негерметично закрытых склянках, в теплом месте или на свету, а также при хранении растворов слишком продолжительное время (без проведения периодического контроля);
чистотой используемой посуды для отбора проб и выполнения нализов;
полнотой учета мешающих примесей, которые могут присутствовать в анализируемой воде;
При работе с комплектом в полевых и лабораторных условиях руководствуются основными правилами техники безопасности, предусмотренными для химико-аналитических работ.
4.2 Методика выполнения анализа предусматривает использование щелочного раствора йодида калия и раствора серной кислоты. Следует избегать попадания щелочного и сернокислотного растворов на слизистые оболочки, кожные покровы, одежду, обувь, оборудование и т.п. При попадании на кожу или слизистые оболочки следует быстро и обильно промыть водой, при необходимости обратиться к специалисту в медицинское учреждение.
4.3. Едкие вещества требуют особого обращения:
хранения в специальном месте, недоступном для неспециалистов:
использования их только оператором (преподавателем);
Подготовка к проведению анализа
Подготовка к проведению анализа включает: проверку целостности мерной и др. посуды; проверку наличия растворов в склянках; приготовление растворов.
Раствор крахмала неустойчив при хранении. Для приготовления свежего — растворите содержимое капсулы в 10-15 мл холодной дистиллированной воды, полученную суспензию постепенно прилейте к 35-40 мл кипящей дистиллированной воды и кипятите 2-3 минуты. Раствор охладите.
По мере использования рабочего раствора тиосульфата натрия (0,02 моль/л экв.) приготовьте новый. Отберите мерной пипеткой 20,0 мл раствора тиосульфата натрия (0,1 моль/л экв.), поместите в мерную колбу вместимостью 100 мл, доведите объем раствора до метки дистиллированной водой, перемешайте раствор.
Оборудование и реактивы: Барометр любого типа; груша резиновая или медицинский шприц; колба коническая вместимостью 250–300 мл; склянка кислородная калиброванная (100–200 мл) с пробкой; мешалка (стеклянные шарик, палочка и т.п.) известного объема; пипетки мерные на 1 мл и 10 мл; термометр; раствор соли марганца; раствор серной кислоты (1:2); раствор тиосульфата натрия (0,02 моль/л экв.); раствор крахмала (0,5%); раствор йодида калия щелочной.
1. Добавьте в склянку с пробой анализируемой воды разными пипетками 1 мл раствора соли марганца, 1 мл раствора йодида калия, погружая пипетку с раствором в кислородную склянку на глубину 2-3 см, как показано на рисунке и по мере выливания раствора поднимайте пипетку вверх.
Излишек жидкости из склянки стечет через край на подставленную чашку Петри.
Слегка наклоните склянку, закройте пробкой. Излишек жидкости стечет через край. Следите, чтобы в склянке не осталось пузырьков воздуха.
Склянка не должна оставаться открытой.
2. Перемешайте содержимое склянки имеющейся внутри мешалкой, удерживая склянку рукой. Поместите склянку с зафиксированной пробой в темное место для отстаивания (не менее 10 минут и не более 24 часов).
Добавьте пипеткой 2 мл раствора серной кислоты.
Закройте склянку пробкой и перемешайте содержимое до полного растворения осадка.
5. Перенесите содержимое склянки в коническую колбу для титрования вместимостью 250 мл.
Примечание. Можно проводить титрование части пробы. Для этого из кислородной склянки в колбу для титрования перенесите цилиндром 50,0 мл обработанной пробы.
6. Заполните пипетку (бюретку), закрепленную в стойке-штативе раствором тиосульфата натрия (0,02 моль/л экв.) и титруйте пробу до слабо желтой окраски. Затем добавьте пипеткой 1 мл раствора крахмала (раствор в колбе синеет) и продолжайте титровать до полного обесцвечивания раствора.
7. Определите общий объем раствора тиосульфата натрия, израсходованного на титрование (как до, так и после добавления раствора крахмала).
источник