Повсеместное и неконтролируемое применение различных минеральных удобрений и других агрохимикатов привели к значительному ухудшению экологической ситуации: фосфорорганические, хлорорганические и азотистые соединения загрязняют почву, а, следовательно, и подземные водоносные горизонты. Кроме того, по пищевой цепочке они попадают в продукты питания не только растительного, но и животного происхождения.
Снижение неблагоприятной химической «нагрузки» является одним из важнейших условий сохранения здоровья. Применение различных способов очистки воды, включая удаление нитратов, тяжелых металлов и других химических примесей является обязательным процессом водоподготовки при централизованном и децентрализованном водоснабжении.
Специалистами в области водоснабжения соединения азота рассматриваются как косвенный показатель органического и фекального загрязнения. Дело в том, что вещества белковой природы, попадая в воду, подвергаются ряду химических превращений, включая образование:
- Аммиака, который свидетельствует о свежем органическом загрязнении (белки распадаются до аминокислот, от которых в дальнейшем отсоединяется аминоостаток – «исходный материал» для аммиака).
- Нитритов – промежуточный продукт окисления аммиачных соединений, свидетельствующий о загрязнении средней давности.
- Нитратов – окончательный продукт окислившихся белков, присутствие которого может означать давнее загрязнение воды.
Присутствие всей триады азота (аммиак, соединения азотистой и азотной кислоты) свидетельствуют о постоянном органическом загрязнении, что может быть обусловлено неправильным расположением водоисточника (отсутствие так называемых санитарных разрывов до потенциально опасных объектов – например, дворовых туалетов). Помимо этого нитраты могут попадать в воду и в результате применения азотистых минеральных удобрений на приусадебном участке.
Из указанных соединений азота наибольшую опасность представляют нитраты. Попадая в организм, они могут привести к развитию так называемого эндемического заболевания – нитратная метгемоглобинемия, или токсический цианоз. Это обусловлено возможностью остатка NO3 присоединяться к гемоглобину, блокируя перенос кислорода. В результате нарушается его доставка к клеткам и тканям и возникает гипоксия. Наиболее подвержены данной болезни дети грудного возраста.
Кроме того, попадая в организм человека, нитраты трансформируются в нитрозамины, обладающие канцерогенными свойства (способствуют развитию онкологических заболеваний). Поэтому превышение их нормативной концентрации требует обязательной очистки воды, применяемой для питьевых целей.
Необходимость очистки грунтовой воды от нитратов (именно в подземных водах чаще встречаются данные загрязнители) наиболее остро стоит в следующих случаях водопользования:
- из трубчатых колодцев;
- из шахтных колодцев;
- из скважин, для которых используется неглубокий водоносный горизонт, имеющий лабильный химический и микробиологический состав, что связано с незащищенностью водоисточника от поверхностного стока.
В настоящее время очистка воды от нитратов осуществляется с помощью следующих методов и установок:
- Применение анионообменной смолы. Поскольку нитрат-ион является отрицательно заряженной частицей, т.е. анионом, он будет притягиваться к молекуле с положительным зарядом. Так, нитрат-ионы (NO3), содержащиеся в воде замещают хлорид-ионы и «прилипают» к поверхности смолы. Недостатком данного способа очистки воды от нитратов является необходимость регулярной замены картриджа (для установок картриджного типа) или регенерации раствором пищевой соли. Кроме того, затруднено определение периодичности восстановления ионообменной способности устройства.
- Обратноосмотические установки – это наиболее эффективный метод очистки воды от разного рода примесей, включая азотистые соединения. «Продавливая» воду через мелкопористую мембрану происходит разделение водного потока, в результате чего удаляется до 99% нитратов.
По мнению наших специалистов на муниципальных очистных сооружениях происходит частичное удаление таких примесей из питьевой воды. В связи с этим применения дополнительных ультратонких способов водоподготовки требуется не только для источников децентрализованного водоснабжения, но и для городского водопровода. Нажмите здесь, чтобы узнать какие существуют устройства для дополнительной очистки воды, об их производительности и стоимости.
Автор: Жанна Мелешкина, к. мед. н., доцент кафедры гигиены и социальной медицины
Дата публикации: 25 Января 2016 года
Понравилась статья? Расскажите друзьям:
источник
При установке очистных систем как бытового, так и промышленного назначения необходимо обладать знаниями относительно основных и дополнительных параметров вредных загрязнений. Далее обсудим, в каких случаях требуется очистка воды от нитратов и какие способы для этого используются.
Из этой статьи вы узнаете:
Надо ли очищать воду от нитратов
Как происходит очистка воды от нитратов
Как очистить воду от нитратов с помощью цеолита
В первую очередь напомним, что нитратами называют ионы с одним зарядом (NO3) соли азотной кислоты. Одним из наиболее известных примеров нитратов является селитра, которая используется в сельском хозяйстве в качестве удобрения. Ее достоинства состоят в результативности и низкой стоимости, а недостаток кроется в потенциальной опасности для здоровья человека. Тем не менее она до сих пор остается популярной.
Но стоит оговориться, ее применение в строго ограниченных нормативами дозах не может причинить вреда. К сожалению, это правило соблюдается не всегда, виной тому современные тенденции:
интенсификация производственных процессов в соответствующей отрасли;
экономические факторы, способствующие сокращению затрат.
Если говорить об угрозе для человеческой жизни, то ее представляют нитриты. Эти вещества могут образовываться в желудочно-кишечном тракте или попадать в организм с пищей. В итоге происходит реакция между ними и гемоглобином, который призван разносить кислород по тканям – он преобразуется в метгемоглобин, теряя свою основную функцию.
Наибольшую угрозу такие процессы несут детскому организму, поскольку только эритроциты взрослых способны в ограниченных объемах возвращать гемоглобину его свойства. Тогда у ребенка блокируется поступление кислорода к органам и запускается развитие разного рода заболеваний, в результате чего возможен даже летальный исход.
Вот почему так важна очистка воды от нитратов. Однако существует еще ряд направлений, в которых нитриты и нитраты действуют на наш организм:
Поступая в организм вместе с питьевой водой, они могут стать причиной появления раздражений, неприятных, даже опасных аллергических реакций.
Угнетают функции щитовидной железы.
Нарушают нормальную работу нервной системы.
Из-за нитратов в желудке создается среда, подходящая для жизнедеятельности вредных микроорганизмов. В результате развития такой патогенной микрофлоры образуются яды, отравляющие организм.
Нормальный обмен веществ затрудняется под воздействием нитритов.
Отдельно стоит подчеркнуть способность этих опасных соединений со временем накапливаться в организме. Изменения зачастую происходят незаметно и могут впоследствии привести к серьезным проблемам и большим финансовым вложениям, если вовремя не заняться профилактикой и очисткой воды от нитратов.
Статьи, рекомендуемые к прочтению:
Как вы понимаете, чтобы грамотно проводить очистку питьевой воды от нитратов и других веществ, важно представлять себе нормы их содержания:
Нитраты (класс опасности – 3). Их доля не может быть свыше 45 единиц (по СанПин) или 50 единиц по правилам Евросоюза (в миллиграммах на 1 дм 3 воды).
Нитриты имеют более высокий, второй класс опасности, поэтому показатель их содержания должен быть еще ниже: согласно СанПин – 3,0 мг на дм 3 , в соответствии с требованиями ЕС – 0,5 мг на дм 3 .
Безусловно, все мы можем сами выбрать те нормы, которые нас устроят. Но нужно помнить о свойстве нитратов со временем накапливаться в организме, и, следовательно, отдавать предпочтение минимально возможным показателям.
Каким образом нитраты появляются в природной воде?
В результате слива воды с полей, где для повышения урожайности использовались соответствующие удобрения (нитрат натрия, кальция, калия). Отметим, что в нашей стране самое серьезное превышение доли нитратов в природных водах зафиксировано в равнинных местностях, таких как Воронежская.
Вместе со сточными, хозяйственно-бытовыми и промышленными водами.
Во время грозовых ливней нитраты могут образовываться в почве, откуда потом попадать в воду. Дело в том, что под действием электрических разрядов (молнии) из азота, содержащегося в воздухе, образуется оксид азота (II). Далее под действием кислорода он окисляется до оксида азота (IV). А при взаимодействии с водой в присутствии кислорода происходит формирование азотной кислоты, вступающей в реакцию с натрием, калием и кальцием, содержащимся в почве.
Профессиональная очистка воды от нитратов осуществляется посредством таких методов:
ионный обмен с помощью нитрат-селективных или иных смол;
Первый вариант называют одним из наиболее эффективных, причем не только в деле очистки воды от нитратов, но также от прочих загрязняющих жидкость соединений. Иными словами, здесь производится комплексное умягчение воды. Если говорить про ионный обмен, то его считают также довольно эффективным при борьбе с нитратами и прочими веществами. Остановимся на каждом способе подробнее.
При помощи этой технологии из воды удаляются азотная кислота и соли, а именно сульфаты, хлориды, гидрокарбонаты. Таким образом, жидкость обессоливается, лишается минералов. В этом и состоит ключевой недостаток данной обработки, ведь очищение, помимо прочего, меняет вкус воды и ее качество.
Не секрет, что потребляемая нами жидкость должна приносить пользу, тогда как после обратного осмоса в наш организм попадает практически дистиллированная вода. В результате мы недополучаем важные минералы. Однако такая установка прекрасно справляется, если требуется обезжелезивание жидкости.
Также рынок предлагает ассортимент систем разной производительности – выбор зависит от результатов лабораторной проверки воды. Серьезным достоинством такого метода можно назвать способность установки стабильно и качественно работать даже во время резкого повышения уровня загрязнения.
Еще один недостаток такого фильтра для очистки воды от нитратов кроется в высокой цене. Стандартная система, используемая в коттеджах и имеющая производительность в 1,5 кубических метра в час, не каждому будет по карману. Конечно, ее компактные аналоги, монтируемые под мойку, стоят значительно меньше, но они решают проблему на небольшой срок. Дело в том, что простому потребителю не всегда удается успешно рассчитать ресурс купленного фильтра. В результате, новый картридж устанавливается слишком поздно, а значит, загрязнения все-таки попадут в питьевую воду.
Отметим, что такая установка обычно имеет не очень большие размеры. В роли фильтров здесь выступают перегородки-мембраны – они способны пропускать воду, при этом улавливая органические и неорганические соединения. Название «осмос» связано с самой технологией. Вещество проходит сквозь полупроницаемую мембрану, на выходе получаются два раствора разной концентрации. В системе создается осмотическое давление, которое позволяет воздействовать на скорость перехода жидкости через мембраны.
Если вы не готовы столкнуться с названными выше проблемами, хорошим выходом будет выбор простой системы очистки воды от нитратов на базе баллонного фильтра с применением нитрат-селективной смолы. Этот материал удаляет из воды исключительно нитраты, не затрагивая необходимые человеку соли. Приятно, что и цена вопроса здесь ниже, если сравнивать с первой технологией. Но будьте готовы, что такой фильтр для очистки воды от нитратов будет дороже, чем стандартная система для умягчения.
Помните, что смола требует периодического проведения регенерации специальными таблетками. Но как показывают наблюдения, даже во время этой процедуры попадание нитратов в питьевую воду полностью исключается, что достигается за счет автоматизации системы. Таким образом, циклы регенерации происходят в установленное время, не требуя вмешательства человека.
Такая очистка воды от нитратов проводится в два этапа:
Вода проходит через водород-катионитный фильтр, при помощи которого катионы заменяются на водород-катионы.
Жидкость поступает в анионитный фильтр, где анионы уступают место ионам. Иными словами, нитраты задерживаются фильтрующей средой.
Отметим, что могут выбираться установки с разным количеством ступеней очистки – данный показатель зависит от доли нитратов в воде. Каждая ступень содержит два фильтра: катионитный и анионитный. Изготовители предлагают одно-, двух-, трехступенчатые фильтры. Первый и второй варианты предполагают раздельные фильтрующие среды. Тогда как в трехступенчатом фильтре допустимы отдельное использование катионитного и анионитного фильтров либо их совмещение в одном фильтре.
Но стоит сказать и о недостатках этой технологии очистки воды от нитратов. Во-первых, это большой объем реагентов и воды, используемых в процессе регенерации. Также стоит понимать, что такие установки являются параллельноточными, то есть жидкость движется в одном направлении, сверху вниз. Если же в системе не предусмотрена автоматическая регенерация, необходимо рассчитывать время для каждой такой процедуры. В противном случае, смола потеряет свои свойства, а иногда даже происходит выброс скопившихся нитратов в питьевую воду, после чего жидкость становится опасной.
Следующий вариант очистки воды от нитратов предполагает использование в качестве загрузки природных минеральных сорбентов (шунгита) или молекулярных сит (цеолитов).
Сразу скажем о названии технологии: цеолиты – синтетические или природные адсорбенты с регулярной структурой пор, представляющие собой алюмосиликаты натрия, калия либо иных элементов. В промежутках кристаллического каркаса расположены гидратированные положительные ионы щелочных и щелочно-земельных металлов, компенсирующих заряд каркаса, и молекулы воды.
Общая химическая формула цеолитов:
где Me – катион щелочного металла; n – его валентность.
В качестве катионов природные цеолиты чаще всего включают натрий, калий, кальций, реже – магний, барий, стронций. Кристаллическая структура цеолитов образована тетраэдрами Si04 и Аl04.
Поскольку цеолит обладает способностью поглощать или пропускать через кристаллический каркас молекулы других химических соединений, он играет роль своего рода молекулярного сита. Также цеолиты относят к ионообменникам катионного типа, то есть они могут очищать воду от тяжелых металлов. И если сравнивать с синтетическими смолами, то этот способ лучше избавляет жидкость от ионов цезия, свинца, кадмия, стронция.
При очистке воды от нитратов, например, из скважины, природные цеолиты используются в виде порошков и фильтрующих материалов для очистки воды от ПАВ, тяжелых металлов, ароматических органических соединений, красителей, пестицидов, коллоидных и бактериальных загрязнений. Отработавший цеолит подвергают неоднократной регенерации при помощи исходный воды либо солевого раствора – выбор зависит от целевого использования.
В таблице вы видите степень эффективности водоочистки цеолитом от органических, неорганических загрязнителей.
Эффективность водоочистки цеолитом по органическим и неорганическим загрязнителям:
источник
Нитраты являются солью азотной кислоты, которые могут попасть в организм человека только двумя путями – с водой и овощами. Контролировать нитраты в пище сложно, а вот в воде их можно обнаружить, проведя простой анализ воды. При этом проводится очистка воды от нитратов. Если химический анализ показал, что содержание данного вещества в воде превышает отметку в 45 мг/л, то необходимо устанавливать фильтр.
Обычно нитраты могут попадаться только в грунтовых и поверхностных водах. Более редким, но все же возможным вариантом являются неглубокие скважины, чья глубина не превышает 30 метров. В артезианских скважинах этой кислоты практически не наблюдается. Попадают вредные вещества в воду с полей (в равнинных частях страны азотная кислота встречается в гораздо больших количествах в питьевой воде), со стоков. Образовываются нитраты после грозовых ливней в полях. Есть несколько степеней токсичности нитратов, где первая степень – это непосредственно нитраты, вторая – образованные из них нитриты и третья – образованные из вышеперечисленных соединений нитрозамины.
Длительное употребление данных веществ ведет к развитию метгемоглобинемии (характеризуется недостатком кислорода в дыхательных путях, из-за чего постепенно развивается отдышка, а позже дыхательные пути могут совсем закрыться). Нитраты пагубно воздействуют не только на дыхательную, но и на сердечно-сосудистую систему, ЖКТ и иные органы. Данное вещество особенно опасно для детей. У маленьких детей ферментная система еще не сформирована, а потом организм просто не подготовлен к борьбе с подобными загрязнителями.
Поэтому обычно устанавливают фильтры для очистки воды от нитратов или предпринимают иные меры по очищению воды.
Как временный вариант многие рассматривают приобретение бутилированной воды.
Максимально допустимая концентрация данного соединения в воде составляет 45 мг/л. Класс опасности данного загрязнителя – 3, что означает умеренно опасное вещество. Профессионально очистку проводят двумя способами:
- Обратный осмос
- Ионный обмен с помощью нитрат-селективных или иных смол
Обратный осмос считается одним из наиболее эффективных способов очистки воды не только от нитратных, но и других соединений, которые загрязняют воду. По сути, происходит умягчение воды. Ионный обмен достаточно эффективен в борьбе с нитратами и некоторыми другими веществами.
Данный метод удаляет почти полностью кроме азотной кислоты также и ряд солей: сульфатов, хлоридов, гидрокарбонатов. То есть вода обессоливается, лишаясь минералов. Здесь кроется один из основных минусов этой установки, так как такое очищение воды не только меняет вкус жидкости, но и ее качество. Вода должна приносить пользу, а обратный осмос выдает почти дистиллированную воду, которая не может обеспечить воду необходимыми минералами. Но эта установка помогает еще и в вопросе обезжелезивания воды. Кроме того, можно выбрать установку меньшей или большей производительности. Все зависит от показателей анализа воды. Отличает данный метод тот факт, что даже когда происходит скачок загрязнителей в воде, то установка продолжает работать на оптимальном уровне, очищая воду до заданного состояния.
Второй минус данной установки – высокая стоимость. Стандартная система для коттеджей с производительность в 1,5 кубических метра в час будет далеко не всем доступна. Малогабаритный аналоги данной системы, устанавливающиеся под мойку, будут стоить на порядок ниже, но проблема в данном случае будет решена лишь временно, так как потребитель зачастую не умеет рассчитать ресурс данного фильтра. А потому замена картриджа производится обычно с опозданием. В таких случаях «проскок» загрязнителей в воду неизбежен.
Установка обычно имеет сравнительно компактные габариты. Фильтрами в данной системе служат особые перегородки-мембраны, которые пропускают воду, но задерживают органические и неорганические соединения. Осмосом данный процесс назвали из-за самого процесса: вещество проходит через полупроницаемую мембрану, после чего в результате получаются два раствора, которые имеют различную концентрацию. В системе создается осмотическое давление, благодаря которому изменяется скорость перехода жидкости сквозь мембраны.
Всех вышеперечисленных проблем вполне можно избежать простой установкой системы очистки воды от нитратов на основе баллонного фильтра, в котором используется специальная нитрат-селективная смола. Устроен этот материал так, что из воды поглощаются только нитраты. Полезные для человеческого организма соли фильтром не трогаются. Стоимость данного метода несколько ниже, чем обратный осмос, но дороже, чем стандартное умягчение воды.
Время от времени необходимо проводить регенерацию смолы с помощью специальных таблеток. Отмечено, что используя подобные фильтры, проскок нитратов исключается полностью, благодаря автоматизации системы. В результате циклы регенерации производятся в заданное время без вмешательства со стороны человека с некоторым коэффициентом запаса.
Производится очистка ионообменом в два этапа:
- Сперва очищаемую воду пропускают через водород-катионитный фильтр, в котором катионы заменяются на водород-катионы.
- Далее вода поступает в анионитный фильтр, где происходит обмен анионов на ионы (то есть нитраты задерживаются фильтрующей средой).
В зависимости от количества содержащихся в воде нитратов применяют разные установки с разным количеством ступеней очистки. Каждая ступень – это два фильтра (катионитный и анионитный). Бывают одно-, двух- и трехступенчатые фильтры. В первых двух применяются раздельные фильтрующие среды. В трехступенчатой системе могут применяться в отдельности катионитный и анионитный фильтры или же данные фильтрующие среды соединяют в одном фильтре.
Теперь о минусах данного способа. Первый, о котором стоит упомянуть – большое количество реагентов и используемой для регенерации воды. Кроме того, данные установки – параллельно точные (вода в них движется исключительно в одном направлении – сверху и вниз). Также, если система не оснащена автоматической регенеративной программой, то потребителю необходимо самому высчитывать время проведения регенерации, иначе смола просто перестанет фильтровать, а в отдельных случаях может произойти выброс нитратов в питьевую воду. А высокая концентрация вещества в воде может сделать жидкость высокотоксичной.
Установка подобных систем требует контроля со стороны специалистов, так как неправильный монтаж может привести к том, что фильтрация воды будет проходить на довольно низком уровне или вовсе не проводиться из-за погрешностей, допущенных в ходе работы.
Кроме того, прежде чем выбирать тот или иной фильтр, стоит позаботиться о предварительном проведении химического анализа воды, чтобы подобрать наиболее оптимальный вариант очистки воды от нитратов и иных загрязнителей.
источник
Цель работы:ознакомление с фотометрическим методом определения нитратов в питьевой, сточной и других видах вод.
Нитраты – соли азотной кислоты, например NaNO3,KNO3, NH4NO3, Mg(NO3)2. Они являются нормальными продуктами обмена азотистых веществ любого живого организма – растительного и животного, поэтому «безнитратных» продуктов в природе не бывает.
Нитраты встречаются почти во всех видах вод. Большое количество нитратов в поверхностных и подземных водах указывает иногда на загрязнение в прошлом фекальными водами. Значительные количества нитратов содержат некоторые промышленные сточные воды. При современной технологии внесения удобрений в почву растения усваивают только 50 % их, остальные уходят со стоком. Азот поступает в почву в нескольких формах. Нитратная форма вследствие подвижности легко вымывается из почвы. Вода с повышенным содержанием нитратов — потенциальная опасность для здоровья животных и человека. Для воды питьевой (ГОСТ 2874-82) содержание нитратов (NO3) должно составлять не более 45 мг/л. Предельно допустимая концентрация (ПДК) нитратов (по азоту) в воде водоемов хозяйственно-питьевого и культурно-бытового водопользования составляет (по ЛПВ)
В производственных сточных водах, а также сельскохозяйственных водах (стоки от животноводческих ферм) содержание нитратов может достигать до 1000 мг/л. Такая сточная вода должна подвергаться очистке на сооружениях перед ее сбросом в поверхностный водоем или повторном использовании в производстве. Внесение больших доз нитратов при несбалансированности по фосфору, калию, молибдену и др. приводит к накоплению нитратов в растениях.
Определение нитратов в грунтовых водах может служить оценкой характера процессов минерализации при фильтровании воды через почвенные соли. При исследовании поверхностных вод по содержанию нитратов можно судить о протекающих процессах самоочищения, а при биологической очистке сточных вод – о процессе нитрификации.
Содержание нитратов в растениях выше 0,5 % представляет потенциальную опасность отравления животных. В кишечнике нитраты способны под действием бактерий переходить в нитриты, которые характеризуются значительной токсичностью. Они способны соединяться с гемоглобином крови вместо кислорода, переводя его в метгемоглобин, препятствующего переносу кислорода кровеносной системой. Это заболевание называется метгемоглобинемией. Поэтому для профилактики загрязнения окружающей среды, особенно в районах высоких норм применения азотных удобрений, необходимо наблюдение за составом грунтовых и поверхностных вод и содержанием в них нитратов.
Вода, забираемая в водопроводную сеть в качестве питьевой, а также для нужд производства, контролируется на содержание нитратов.
В производстве вода, используемая в водооборотных системах, также должна контролироваться на содержание нитратов. Их высокая концентрация может спровоцировать рост водорослей и микроорганизмов в трубопроводах (застойные зоны) и вторичное загрязнение циркулируемой воды в системе продуктами их жизнедеятельности и, соответственно, инициировать процессы биохимической коррозии. Кроме того, биообрастание внутри систем теплообмена снижает теплопередачу и эффективность их работы.
Разработано и применяется несколько способов определения нитратов в воде. Выбор метода зависит от концентрации нитратов и цели исследования.
Хорошие результаты даёт фотометрический метод с применением химического реагента — салицилата натрия. Интервал определяемых концентраций нитратов — 0,1-20 мг/л. Это определение основано на реакции взаимодействия нитратов с салицилатом натрия в среде концентрированной серной кислоты. При этом образуется смесь 3-нитросалициловой и 5-нитросалициловой кислот, соли которых в щелочной среде имеют жёлтую окраску. Фотометрирование желтоокрашенных растворов проводят при длине волны 
источник
Вряд ли найдётся человек, который бы не слышал о вреде нитратов. Мы привыкли думать, что основную опасность в плане содержания нитратов представляют ранние и несезонные овощи и фрукты. Но нитраты в питьевой воде – довольно распространённое явление. Откуда они там берутся, существует ли допустимая норма нитратов в воде и как обезопасить себя – узнаете из нашей статьи.
Для начала давайте выясним – что же такое нитраты и как они могут попасть в воду. Это соли азотной кислоты, которые могут оказывать токсичное воздействие на организм. Нитраты в воде, как правило, являются результатом попадания в источники водоснабжения стоков промышленных предприятий или азотосодержащих удобрений с полей.
Многие люди думают, что вода из скважины или колодца априори чище и здоровее той, что течёт из крана. Это далеко не так. Специалисты отмечают, что при анализе воды на нитраты, довольно часто бракуют как раз пробы воды из колодцев и скважин небольшой глубины. Также в зоне риска и поверхностные источники (реки, озёра). Причина этого заключается, в первую очередь, в использовании большого количества азотосодержащих удобрений и неразумной хозяйственной деятельности (например, когда колодец находится недалеко от места стоков с полей). Нитраты попадают в почву, а оттуда в грунтовые воды, а из них – в скважины и колодцы.
Если содержание нитратов в питьевой воде превышено, то её употребление может иметь довольно серьёзные последствия для здоровья. По статистике ВОЗ, во всём мире в результате отравления нитратами в воде умирает 3, 5 млн. человек. Подавляющее большинство из них (около 90%) –это дети до пяти лет. Именно поэтому нужно уделять внимание качеству питьевой воды, особенно, если в семье есть маленькие дети.
Чем же опасны нитраты в питьевой воде? При единоразовом попадании в организм большой дозы нитратов, они могут вызвать серьёзное отравление, вплоть до летального исхода (особенно у детей раннего возраста). Но даже если последствия отравления нитратами в воде вы заметили не сразу, накапливаясь в организме, они могут привести к развитию серьёзных заболеваний.
- Онкологические заболевания (в частности, желудочно-кишечного тракта).
- Нарушение работы поджелудочной и щитовидной железы
- Сердечная недостаточность
- Заболевания почек
- Заболевания сердечно-сосудистой системы
Накапливаясь в организме, нитраты провоцируют так называемую метгемоглобинемию. При этом заболевании гемоглобин в крови замещается метгемоглобином, который не выполняет функцию переноса кислорода. Это ведёт к таким серьёзным последствиям как кислородное голодание, резко ухудшается состояние здоровья.
Учитывая опасность попадания нитратов в организм, актуальным становится вопрос, сколько нитратов может содержаться в воде, чтобы она не представляла опасности для здоровья. Этот параметр регулируется Государственными санитарными нормами. Согласно гигиеническим требованиям к качеству питьевой воды, содержание в ней нитратов не должно превышать 50 мг/л.
Определение нитратов в воде лучше провести, отдав её на анализ в лабораторию. Конечно, существуют и специальные тест-полоски, которые можно использовать в домашних условиях. Но если вы хотите получить точную исчерпывающую информацию, то лучше обратится к специалистам. Кроме того, у вас будет возможность провести сравнительный анализ воды сразу из нескольких источников.
После того, как проведено определение нитратов в воде, и результаты показали превышение нормы, необходимо решать проблему как можно скорее. Очистку воды от нитратов можно эффективно провести при помощи фильтра обратного осмоса. Но проблема в том, что зачастую нитраты в воде обнаруживаются именно в колодцах и скважинах. Тут наладить систему фильтрации сложнее, но всё же возможно. Для этого можно использовать насос и фильтровать уже ту воду, которую он качает. Если же возможности наладить очистку нет, то безопаснее перестать пользоваться водой из данного источника.
Если в качестве источника водоснабжения вы используете скважину и колодец важно не забывать о простых правилах профилактики, которые помогут минимизировать или исключить содержание нитратов в питьевой воде.
- Размещайте колодец как можно дальше от уборной и хозяйственных построек.
- Не разбивайте грядки вблизи источника водоснабжения
- Правильно используйте удобрения на участке, не допускайте их «передозировки».
- Организуйте над колодцем крышку или навес – это поможет избежать механических загрязнений.
Соблюдая эти простые правила, вы защитите воду от загрязнения и сохраните своё здоровье.
источник
Фотометрический метод определения массовой концентрации нитрат-иона основан на взаимодействии нитрат-ионов с салициловой кислотой с образованием желтого комплексного соединения.
Настоящая методика обеспечивает получение результатов анализа с погрешностью, не превышающей значений, приведенных в таблице 1.
Диапазон измерений, значения показателей точности, повторяемости и воспроизводимости
Показатель точности (границы относительной погрешности при вероятности Р = 0,95), ± d , %
Показатель повторяемости (относительное среднеквадратическое отклонение повторяемости) s r, %
Показатель воспроизводимости (относительное среднеквадратическое отклонение воспроизводимости), s R, %
Значения показателя точности методики используют при:
— оформлении результатов анализа, выдаваемых лабораторией;
— оценке деятельности лабораторий на качество проведения испытаний;
— оценке возможности использования результатов анализа при реализации методики в конкретной лаборатории.
Спектрофотометр или фотоэлектроколориметр, позволяющие измерять светопоглощение при значениях l = 410 нм.
ГСО c аттестованным содержанием нитрат-ионов.
Кюветы кварцевые с толщиной поглощающего слоя 20 мм.
Весы лабораторные, 2 кл. точности ГОСТ 24104.
Колбы мерные наливные 2-50-2
ПНД Ф 14.1:2.4-95 G ) Внесены дополнения и изменения согласно протоколу № 23 заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Стаканчики для взвешивания СВ ГОСТ 25336.
Стаканы термостойкие В-1-1000
Пробирки колориметрические П-2-10-0,1 ХС ГОСТ 1770.
3.2 . Вспомогательное оборудование, материалы
Сушильный шкаф электрический ОСТ 16.0.801.397.
Чашки выпарительные фарфоровые ГОСТ 9147.
Фильтры обеззоленные ТУ 6-09-1678.
Бутыли из стекла или полиэтилена с притертыми или винтовыми пробками вместимостью 500 — 1000 см 3 для отбора и хранения проб.
Активированный уголь БАУ-Э, ТУ 6-16-3075.
Натрий салициловокислый ГОСТ 17628 G ) .
ПНД Ф 14.1:2.4-95 G ) Внесены дополнения и изменения согласно протоколу № 23 заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Калий-натрий виннокислый 4-водный (Сегнетова соль) ГОСТ 5845.
Серебро сернокислое ТУ 6-09-3703.
Все реактивы должны быть квалификации х.ч. или ч.д.а. и не содержать примесей нитрат-ионов.
4.1 . При выполнении анализов необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007 .
4.2 . Электробезопасность при работе с электроустановками по ГОСТ 12.1.019 .
4.3 . Организация обучения работающих безопасности труда по ГОСТ 12.0.004 .
4.4 . Помещение лаборатории должно соответствовать пожарной безопасности по ГОСТ 12.1.004 и иметь средства пожаротушения по ГОСТ 12.4.009 .
Выполнение измерений может производить химик-аналитик, владеющий техникой фотометрического и спектрофотометрического анализов, изучивший инструкцию по работе с соответствующими приборами.
Измерения проводятся в следующих условиях:
температура окружающего воздуха (20 ± 5) °С;
относительная влажность (80 ± 5) %;
атмосферное давление (84 — 106) кПа (630 — 800 мм рт.ст.);
частота переменного тока (50 ± 1) Гц;
напряжение в сети (220 ± 10) В.
7.1 . Подготовка посуды для отбора проб
Бутыли для отбора и хранения проб воды обезжиривают раствором CMC, промывают водопроводной водой, хромовой смесью, опять водопроводной водой, а затем 3 — 4 раза дистиллированной водой.
Отбор проб производится в соответствии с требованиями ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб». G )
ПНД Ф 14.1:2.4-95 G ) Внесены дополнения и изменения согласно протоколу № 23 заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Пробы воды (объем не менее 200 см 3 ) отбирают в стеклянные или полиэтиленовые бутыли, предварительно ополоснутые отбираемой водой.
Если определение нитратов производят в день отбора пробы, то консервирование не требуется.
Если проба не будет проанализирована в день отбора, то ее консервируют добавлением концентрированной серной кислоты (на 1 дм 3 воды — 1 см 3 H 2 SO 4 конц.). Консервированная проба может храниться не более 2 суток при температуре (3 — 4) °С.
Проба воды не должна подвергаться воздействию прямого солнечного света. Для доставки в лабораторию сосуды с пробами упаковывают в тару, обеспечивающую сохранность и предохраняющую от резких перепадов температуры. При отборе проб составляют сопроводительный документ по утвержденной форме, в котором указывают:
— цель анализа, предполагаемые загрязнители;
— должность, фамилия отбирающего пробу, дата.
7.3 . Подготовка прибора к работе
Подготовку спектрофотометра или фотоэлектроколориметра к работе проводят в соответствии с рабочей инструкцией по эксплуатации прибора.
7.4 . Освобождение от мешающих влияний
1. Взвешенные, окрашен. органические вещества. Железо(> 5 мг/дм 3 )
К 150 см 3 пробы добавить 3 см 3 гидроксида алюминия, пробу перемешивают, дают отстояться и фильтруют через фильтр «белая лента», отбрасывая первую порцию фильтрата.
В ходе анализа добавляют сернокислое серебро в количестве, эквивалентном содержанию хлорид-иона. Осадок хлорида серебра отфильтровывают через фильтр «белая лента».
К 20 см 3 пробы добавляют 0,05 г сернокислого аммония и упаривают досуха на водяной бане, доводят до первоначального объема дистиллированной водой.
Основной раствор нитрат-ионов.
Навеску (0,1631 г) калия азотнокислого, предварительно высушенного при 105 °С, помещают в стакан вместимостью 100 см 3 , растворяют в 50 см 3 дистиллированной воды, переносят в мерную колбу вместимостью 1000 см 3 и доводят до метки дистиллированной водой.
1 см 3 содержит 0,1 мг нитрат-ионов. Раствор устойчив в течение 3 мес.
При наличии ГСО: раствор готовят в соответствии с прилагаемой к образцу инструкцией.
1 см 3 раствора должен содержать 0,1 мг нитрат-ионов.
Рабочий раствор нитрат-ионов.
10 ,0 см 3 основного раствора нитрат-ионов переносят в мерную колбу на 100 см 3 и доводят до метки дистиллированной водой.
1 см 3 раствора содержит 0,01 мг нитрат-ионов. Раствор готовят в день проведения анализа.
Раствор гидроксида натрия и сегнетовой соли.
400 г гидроксида натрия и 60 г сегнетовой соли помещают в стакан вместимостью 1000 см 3 , растворяют в 500 см 3 дистиллированной воды, охлаждают, переносят в мерную колбу вместимостью 1000 см 3 G ) и доводят до метки дистиллированной водой G ) .
ПНД Ф 14.1:2.4-95 G ) Внесены дополнения и изменения согласно протоколу № 23 заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Раствор салициловой кислоты (о-гидроксибензойной).
Навеску (1,0 г) салициловой кислоты помещают в стакан вместимостью 100 см 3 , растворяют в 50 см 3 этилового спирта, переносят в мерную колбу вместимостью 100 см 3 , доводят до метки этиловым спиртом. Раствор готовят в день использования.
Навеску (0,5 г) натрия салициловокислого растворяют в 100 см 3 дистиллированной воды. Раствор готовят в день использования G ) .
ПНД Ф 14.1:2.4-95 G ) Внесены дополнения и изменения согласно протоколу № 23 заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Суспензия гидроксида алюминия.
125 г алюмоаммонийных или алюмокалиевых квасцов растворяют в 1 дм 3 дистиллированной воды, раствор нагревают до 60 °С и медленно при непрерывном перемешивании прибавляют 55 см 3 концентрированного раствора аммиака. Дают смеси отстояться около 1 часа, фильтруют и промывают осадок гидроксида алюминия многократной декантацией дистиллированной водой до полного удаления свободного аммиака.
7.6 . Приготовление градуировочных растворов
В ряд колориметрических пробирок на 10 см 3 отбирают последовательно пипеткой 0,1; 0,5; 1,0; 2,0; 4,0; 6,0; 10,0 см 3 рабочего раствора нитрат-иона (0,01 мг/см 3 ) и доводят дистиллированной водой до метки. G ) Содержание нитрат-ионов в растворах соответственно равно 0,1; 0,5; 1,0; 2,0; 4,0; 6,0; 10,0 мг/дм 3 G ) .
ПНД Ф 14.1:2.4-95 G ) Внесены дополнения и изменения согласно протоколу № 23 заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Растворы переносят в фарфоровые чашки, добавляют 2 см 3 раствора салициловой кислоты (или 2 см 3 раствора натрия салициловокислого) и выпаривают в фарфоровой чашке на водяной бане досуха. После охлаждения сухой остаток смешивают с 2 см 3 серной кислоты и оставляют на 10 мин. Затем содержимое чашки разбавляют 10 — 15 см 3 дистиллированной воды, приливают приблизительно 15 см 3 раствора гидроксида натрия и сегнетовой соли, переносят в мерную колбу вместимостью 50 см 3 , смывая стенки чашки дистиллированной водой, охлаждают колбу в холодной воде до комнатной температуры, доводят дистиллированной водой до метки и полученный окрашенный раствор сразу фотометрируют при l = 410 нм в кюветах с толщиной поглощающего слоя 20 мм. Одновременно с обработкой градуировочных растворов проводят «холостой опыт» с дистиллированной водой, который используют в качестве раствора сравнения.
Градуировочный график строят методом наименьших квадратов в координатах: А — оптическая плотность; С — концентрация нитрат-ионов в градуировочном растворе (мг/дм 3 ).
7.7 . Контроль стабильности градуировочной характеристики
Контроль стабильности градуировочной характеристики проводят не реже одного раза в квартал или при смене партий реактивов. Средствами контроля являются вновь приготовленные образцы для градуировки (не менее 3 образцов из приведенных в п. 7.6).
Градуировочную характеристику считают стабильной при выполнении для каждого образца для градуировки следующего условия:
где Х — результат контрольного измерения массовой концентрации нитрат-ионов в образце для градуировки;
С — аттестованное значение массовой концентрации нитрат-ионов;
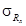
Примечание . Допустимо среднеквадратическое отклонение внутрилабораторной прецизионности при внедрении методики в лаборатории устанавливать на основе выражения: 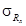
Значения s R приведены в таблице 1.
Если условие стабильности градуировочной характеристики не выполняется только для одного образца для градуировки, необходимо выполнить повторное измерение этого образца с целью исключения результата, содержащего грубую погрешность.
Если градуировочная характеристика нестабильна, выясняют причины и повторяют контроль с использованием других образцов для градуировки, предусмотренных методикой. При повторном обнаружении нестабильности градуировочной характеристики строят новый градуировочный график.
Пробу объемом 150 см 3 обрабатывают как указано в п. 7.4. Для анализа используют фильтрат. Его объем может составлять 5,0 — 10 см 3 в зависимости от концентрации нитрат-ионов в воде. Далее поступают, как описано в пункте 7.6. При анализе пробы воды выполняют не менее двух параллельных определений.
Содержание нитрат-ионов, X , мг/дм 3 вычисляют по формуле:
где С — содержание нитрат-ионов, найденное по графику, мг/дм 3 ;
V — объем исследуемой пробы, взятой на анализ, дм 3 .
За результат анализа Хср принимают среднее арифметическое значение двух параллельных определений Х1 и X 2
для которых выполняется следующее условие:
где r — предел повторяемости, значения которого приведены в таблице 2.
Значения предела повторяемости при вероятности Р = 0,95
Предел повторяемости (относительное значение допускаемого расхождения между двумя результатами параллельных определений), r, %
источник
Цель работы: ознакомление с фотометрическим методом определения нитратов в питьевой, сточной и других видах вод.
1.1. Общие сведения и характеристика метода определения нитратов
Нитраты – соли азотной кислоты, например NaNO3,KNO3, NH4NO3, Mg(NO3)2. Они являются нормальными продуктами обмена азотистых веществ любого живого организма – растительного и животного, поэтому «безнитратных» продуктов в природе не бывает.
Нитраты встречаются почти во всех видах вод. Большое количество нитратов в поверхностных и подземных водах указывает иногда на загрязнение в прошлом фекальными водами. Значительные количества нитратов содержат некоторые промышленные сточные воды. При современной технологии внесения удобрений в почву растения усваивают только 50 % их, остальные уходят со стоком. Азот поступает в почву в нескольких формах. Нитратная форма вследствие подвижности легко вымывается из почвы. Вода с повышенным содержанием нитратов — потенциальная опасность для здоровья животных и человека. Для воды питьевой (ГОСТ 2874-82) содержание нитратов (NO3) должно составлять не более 45 мг/л. Предельно допустимая концентрация (ПДК) нитратов (по азоту) в воде водоемов хозяйственно-питьевого и культурно-бытового водопользования составляет (по ЛПВ)
В производственных сточных водах, а также сельскохозяйственных водах (стоки от животноводческих ферм) содержание нитратов может достигать до 1000 мг/л. Такая сточная вода должна подвергаться очистке на сооружениях перед ее сбросом в поверхностный водоем или повторном использовании в производстве. Внесение больших доз нитратов при несбалансированности по фосфору, калию, молибдену и др. приводит к накоплению нитратов в растениях.
Определение нитратов в грунтовых водах может служить оценкой характера процессов минерализации при фильтровании воды через почвенные соли. При исследовании поверхностных вод по содержанию нитратов можно судить о протекающих процессах самоочищения, а при биологической очистке сточных вод – о процессе нитрификации.
Содержание нитратов в растениях выше 0,5 % представляет потенциальную опасность отравления животных. В кишечнике нитраты способны под действием бактерий переходить в нитриты, которые характеризуются значительной токсичностью. Они способны соединяться с гемоглобином крови вместо кислорода, переводя его в метгемоглобин, препятствующего переносу кислорода кровеносной системой. Это заболевание называется метгемоглобинемией. Поэтому для профилактики загрязнения окружающей среды, особенно в районах высоких норм применения азотных удобрений, необходимо наблюдение за составом грунтовых и поверхностных вод и содержанием в них нитратов.
Вода, забираемая в водопроводную сеть в качестве питьевой, а также для нужд производства, контролируется на содержание нитратов.
В производстве вода, используемая в водооборотных системах, также должна контролироваться на содержание нитратов. Их высокая концентрация может спровоцировать рост водорослей и микроорганизмов в трубопроводах (застойные зоны) и вторичное загрязнение циркулируемой воды в системе продуктами их жизнедеятельности и, соответственно, инициировать процессы биохимической коррозии. Кроме того, биообрастание внутри систем теплообмена снижает теплопередачу и эффективность их работы.
Разработано и применяется несколько способов определения нитратов в воде. Выбор метода зависит от концентрации нитратов и цели исследования.
Хорошие результаты даёт фотометрический метод с применением химического реагента — салицилата натрия. Интервал определяемых концентраций нитратов — 0,1-20 мг/л. Это определение основано на реакции взаимодействия нитратов с салицилатом натрия в среде концентрированной серной кислоты. При этом образуется смесь 3-нитросалициловой и 5-нитросалициловой кислот, соли которых в щелочной среде имеют жёлтую окраску. Фотометрирование желтоокрашенных растворов проводят при длине волны = 410 нм.При необходимости мешающее влияние окрашенных органических веществ устраняют предварительной обработкой пробы суспензией гидроксида алюминия и ее последующего осветления (фильтрования).
1.2. Фотометрический метод анализа
Фотоколориметрический метод анализа основан на измерении интенсивности светового потока, прошедшего через окрашенный раствор (предложен русским ученым В.М. Севергиным, 1795 г.).
Сущность анализа заключается в переводе различных исследуемых соединений (в составе газов, воды и почвы) в раствор с последующим их окрашиванием. Через окрашенный раствор пропускают световой поток и по светопоглощению такого окрашенного раствора определяют содержание окрашенного исследуемого соединения в анализируемом растворе.
Зависимость между интенсивностью окрашивания раствора и содержанием в нем окрашенного соединения может быть выражена зависимостью
| (закон Бугера-Ламберта-Бера), где, | (1) |
— интенсивность света, прошедшего через окрашенный раствор;
— интенсивность падающего света;
— коэффициент поглощения света (зависит от природы окрашенного вещества);
— концентрация окрашенного вещества в растворе;
— толщина слоя светопоглощающего раствора, см.
Если прологарифмировать уравнение (1) и изменить знаки на обратные, то уравнение примет вид:
| (2) |
— называют оптической плотностью (Д) раствора, которая прямо пропорциональна концентрации окрашенного вещества и толщине слоя раствора.
Прибор для фотоколориметрии – ФЭК (фотоэлектроколориметр).
В состав прибора КФК-2 входятLоптическая система) — источник света, светофильтры, линзы, фотоэлемент, преобразователь светового потока в электросигнал на гальванометре, гальванометр, кюветодержатель, ручки (чувствительность и длина волны), набор кювет для растворов.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1. Устройство и принцип работы фотоэлектроколориметра (КФК-2)
КФК-2 является однолучевым прибором и предназначен для измерения коэффициентов пропускания (в диапазоне длин волн 315-980 нм) и абсорбционности растворов. Пределы измерения коэффициентов пропускания от 100 до 5 % .
На рис. 1 приведена оптическая схема КФК-2.
Рис. 1 Оптическая схема КФК-2
1 — лампа накаливания ; 2 — конденсоры; 3 — диафрагма; 4,5 — объективы; 6,7,8 – светофильтры; 9,11 – защитные стекла ; 10 – кювета с раствором; 12 – фотодиод ; 13 – светофильтр ; 14 – делительная пластина ;15 – фотоэлемент.
Колориметр включают в сеть за 15 минут до начала измерений (кюветное отделение открыто).
Кюветы установленного размера подготавливают к работе следующим образом: рабочие поверхности кювет протирают обезжиривающей смесью. После каждого определения на приборе, кюветы промывают от рабочей смеси дистиллированной водой не менее трех раз и тщательно протирают фильтровальной бумагой.
В приборе КФК используют для измерения две кюветы. Одна – с «холостой» пробой и вторая – для анализа исследуемой пробы. Измерение оптической плотности начинают с «холостой» пробы (Д1), после нее измеряют оптическую плотность окрашенного исследуемого раствора (Д2). Разница между показаниями фиксируется в виде показателя Д – светопропускания. Данная величина будет расти по мере увеличения разницы концентраций «холостой» и контрольной пробами. Графическая зависимость оптической плотности (светопропускания) Д от концентрации анализируемого соединения называется калибровочным графиком. На нем принято указывать дату калибрования на приборе, чувствительность, светофильтр, размер кюветы для раствора.
На приборе левой ручкой устанавливают заданную измерением длину волны (светофильтр), а верхней правой — минимальную чувствительность прибора. В кюветодержатель прибора вставляют кювету с «холостой» пробой (дистиллированная вода + реактивы для определения анализируемого вещества), закрывают крышку кюветного отделения и ручками «чувствительность», «установка 100», «грубо» и «точно» устанавливают ноль по шкале абсорбционности (Д – оптическая плотность). Поворотом ручки кюветодержателя (снизу) кювету с «холостой» пробой заменяют на кювету с рабочим окрашенным раствором. Снимают отсчет по шкале микроамперметра. Измерения одной пробы проводят не менее 3-х раз и окончательное значение измеренной абсорбционности определяют как среднее арифметическое из полученных значений.
2.2. Методика проведения работы
2.2.1. Построение калибровочного графика.
Используя рабочий раствор нитрата калия, согласно таблице 1 готовят серию стандартных растворов, содержащих NO3. Рабочий раствор KNO3 содержит 10 мг/л . Для этого в мерные колбы на 50 мл вносят определенное количество рабочего раствора и доводят дистиллированной водой до метки.
Растворы для приготовления шкалы стандартов при определении
| № колбы | Количество рабочего раствора, мл | Содержание , мг/л |
| 1. | ||
| 2. | 0,2 | |
| 3. | 0,4 | |
| 4. | 0,6 | |
| 5. | 1,0 | |
| 6. | 2,0 | |
| 7. | 3,0 | |
| 8. | 4,0 | |
| 9. | 5,0 | |
| 10. | 6,0 | |
| 11. | 7,0 | |
| 12. | 8,0 | |
| 13. |
В фарфоровые чашки отбирают пробы по 20 мл с различным содержанием NO3, добавляют по 2 мл салицилата натрия и выпаривают на песчаной бане досуха. Затем охлаждают чашки с осадком, добавляют в них по 2 мл концентрированной серной кислоты и оставляют на 10 минут. По истечении этого времени в чашки приливают 15 мл дистиллированной воды, 15 мл раствора едкого натра и сегнетовой соли. Внимание. Реагенты приливать в указанном порядке! Далее полученную смесь количественно переносят в мерные колбы ёмкостью 50 мл, обмывая стенки чашек дистиллированной водой, колбы охлаждают до комнатной температуры.
После охлаждения доводят объём дистиллированной водой до метки и измеряют оптическую плотность растворов при длине 410 нм (фиолетовый фильтр) в кюветах толщиной слоя 5 см. Измерение нужно проводить не позднее, чем через 10 мин. после приливания гидрооксида натрия, в противном случае окраска раствора изменяется.
Для построения калибровочного графика можно сократить количество замеров (колб с пробами) до 4-5 штук.
Калибровочный график строят в координатах: оптическая плотность Д – концентрация нитрат-ионов ( )
2.2.2. Определение нитратов в пробах воды
Проводят анализ проб воды различных источников (по заданию преподавателя).
Перед началом работы необходимо внимательно осмотреть пробу. Если очевидно, что в ней присутствуют окрашенные органические соединения, необходимо отобрать 150 мл пробы, прибавить к ней 3 мл суспензии гидроксида алюминия. После тщательного перемешивания пробу воды отстаивают, затем фильтруют, отбрасывая первые порции фильтрата.
Затем отбирают 20 мл фильтрата и анализируют пробу как указано выше (см. п. 2.2.1.).
Параллельно проводят холостую пробу с 20 мл дистиллированной воды. Результаты анализов заносят в таблицу 2.
2.3. Обработка результатов эксперимента
Обработка результатов измерений ведется МНК с использованием ПЭВМ и представляется в графическом виде (см. рисунок 1) с указанием ошибки в определении ( ).
По полученным данным строится график зависимости оптической плотности Д от концентрации нитратов в пробах (шкала стандартов). На графике приводят данные по условиям анализа (номер светофильтра, толщина кюветы, чувствительность и дату выполнения калибровочного графика).
Рис.2. Калибровочный график
По оптической плотности анализируемых проб воды на калибровочном графике находят содержание нитратов в растворе. По найденным значениям рассчитывают содержание нитрат-ионов в исследуемых пробах (мг/л):
,
где С – концентрация нитрат-ионов, найденная по калибровочной кривой, мг/л;
V – объём пробы, взятой для анализа, мл.
Результаты анализа и расчета концентрации нитратов в пробах воды приводят в таблицу 2.
Результаты анализа воды различного происхождения
| № п/п | Образец пробы воды | Оптическая плотность, Д | Концентрация нитратов, , мг/л |
| Вода водопроводная сырая | |||
| Вода водопроводная кипяченая | |||
| Сточная вода НПЗ | |||
| Сточная вода химкомбината |
1. Построить калибровочный график.
2. Провести анализ проб воды различных источников (по заданию преподавателя).
3. На основании результатов анализа сделать вывод о качестве воды и ее пригодности для целевого использования (питьевое снабжение, водооборотная система производства, сброс в поверхностный водоем).
1. Опасно ли использовать воду как питьевую, если в ней содержание нитратов 35 мг/л?
2. Устройство и принцип работы фотоэлектроколориметра.
3. Теоретические основы колориметрии.
4. Принцип построения калибровочного графика. Точность определения анализируемого компонента.
5. С каким содержанием нитратов (после сооружений очистки сточных вод) можно сбрасывать очищенную сточную воду в поверхностный водоем?
6. Почему вводят ограничения на содержание в воде нитратов?
1. Перед работой ознакомиться с устройством и принципом работы фотоэлектроколориметра (КФК).
2. Всю работу с фарфоровыми чашками проводить только в вытяжном шкафу при включенной тяге.
3. С реактивами работать в резиновых перчатках.
4. Отбор серной кислоты проводить под тягой с помощью пипетки.
5. Реагенты приливать в строго указанном порядке.
6. По окончании работы вымыть руки с мылом.
ОПРЕДЕЛЕНИЕ ФОСФАТОВ В ПРИРОДНОЙ И СТОЧНОЙ ВОДЕ
В сточных водах, как и в природных водах, фосфор может присутствовать в различных видах. В жидкой фазе анализируемой воды он может быть в виде ортофосфорной кислоты и её ионов ( ), в виде мета-, пиро- и полифосфатов органических соединений (нуклеиновых кислот, нуклеопротеиды, фосфоролипиды и др.)
При взаимодействии ортофосфат-ионов с молибдатом в кислой среде образуется жёлтая гетерополикислота, которая под действием восстановителей превращается в интенсивно окрашенное синее соединение. Восстановление можно проводить оловом или аскорбиновой кислотой.
Восстановление аскорбиновой кислотой, сравнительно слабым восстановителем, происходит только при повышенной температуре, т.е. в условиях, когда полифосфат и органические эфиры фосфорной кислоты гидролизуются с образованием ортофосфорной кислоты. Для ускорения реакции при комнатной температуре и интенсификации окраски вводят соль сурьмы (антимонилтартрат калия – КSbH4O6·0,5H2O).
Мешающие вещества. Сильнокислые и сильнощелочные пробы предварительно нейтрализуют. Определению мешают сульфиды и Н2S, в концентрации, превышающих 3 мг/л. Мешающие влиянию можно устранить, прибавляя несколько мг КMnО4 на 100 мл пробы и встряхивая 1-2 мин; раствор должен быть розовым. Затем прибавляют требуемые для определения реактивы, но в обратном порядке: сначала раствор аскорбиновой кислоты, перемешивают и вливают раствор молибтана.
Для устранения влияния нитритов вводят сульфаминовой кислоты, которую вводят в состав применяемого реактива. При большом содержании железа следует ввести эквивалентное количество ЭДТА.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Концентрацию фосфатов определяем в питьевой и сточной воде.
К 50 мл пробы, профильтрованной в день отбора через мембранный фильтр № 1 или через плотный бумажный фильтр (синяя лента), приливают 2 мл смешанного раствора через короткое время – 0,5 мл раствора аскорбиновой кислоты (в присутствии мешающих веществ, реактивы приливают в обратном порядке). Смесь перемешивают. Одновременно проводят холостое определение с 50 мл дистиллированной воды. Через 15 мин (20 мин.) определяют оптическую плотность. Измерение проводят при = 800 нм или при максимально возможном для данного прибора значении.
Содержание растворённых неорганических фосфатов (мг/л) ( ) определяют по формуле:
где С – концентрация фосфатов, определённая по калибровочной кривой, мг/л;
V – объём пробы, взятой для анализа, мл.
В диапазоне концентраций до 1 мг/л результаты округляют до сотых долей мг/л, свыше 1 мг/л – до десятых долей мг/л.
Построение калибровочного графика
Берут 0; 1,0; 2,5; 5,0…..50,0 мл рабочего стандартного раствора 2 фосфата калия, разбавляют каждый раствор до 50 мл дистиллированной Н2О и далее продолжают, как в ходе определения (общее содержание растворённых ортофосфатов, найденных экспериментально, выражают в мг/л ).
Измеряют оптическую плотность и строят график зависимости оптической плотности от концентрации ионов фосфорной кислоты.
Построение калибровочной кривой.
| Реактивы | Номер мерной колбы | |||||
| Количество ст. раствора 2, мл | 1,0 | 2,5 | 5,0 | 10,0 | ||
| Количество дист. Н2О, мл | 49,0 | 47,5 | 45,0 | 40,0 | 25,0 | |
| Содержание , мг/л | 0,02 | 0,05 | 0,1 | 0,2 | 0,5 | 1,0 |
1. Построить калибровочную кривую в диапазоне 0-1 мг/л (табл.1).
2. Провести определение фосфата в водопроводной воде (сравнить данные с ГОСТ на воду питьевую).
3. Рассчитать и построить калибровочную кривую на содержание фосфатов до 50 мг/л.
4. Провести определение содержание в пробе сточной воды (с учётом мешающего влияния отдельных компонентов сточной воды).
Давление насыщенного водяного пара
при температурах от 10 до 39 °С
| , °C | , мм.рт.ст. | , °C | , мм.рт.ст. | , °C | , мм.рт.ст. |
| 9.2 9.8 10.5 11.2 12.0 12.8 13.6 14.5 15.5 16.5 | 17.5 18.7 19.8 21.1 22.4 23.8 25.2 26.7 28.3 30.0 | 31.8 33.7 35.7 37.7 39.9 42.2 44.6 47.1 49.7 52.4 |
| Формула | Плотность, г/см 3 | Формула | Плотность, г/см 3 | Формула | Плотность, г/см 3 |
| Al Be Cd Co Cr Cu Fe | 2.70 1.85 8.64 8.80 7.16 8.93 7.86 | Mg Mn Mo Nb Ni Pb Si | 1.74 7.30 10.23 8.56 8.90 11.34 2.00 | Sn Ta Ti V W Zn Zr | 7.30 16.60 4.54 6.11 19.3 7.14 6.50 |
Десятибалльная шкала коррозионной стойкости металлов
| Группа стойкости | Скорость коррозии металла, мм/год | Балл |
| Совершенно стойкие Весьма стойкие Стойкие Пониженно-стойкие Малостойкие Нестойкие | Менее 0,001 Свыше 0,001 до 0,005 Свыше 0,005 до 0,01 Свыше 0,01 до 0,05 Свыше 0,05 до 0,1 Свыше 0,1 до 0,5 Свыше 0,5 до 1,0 Свыше 1,0 до 5,0 Свыше 5,0 до 10,0 Свыше 10,0 |
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: При сдаче лабораторной работы, студент делает вид, что все знает; преподаватель делает вид, что верит ему. 8930 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник