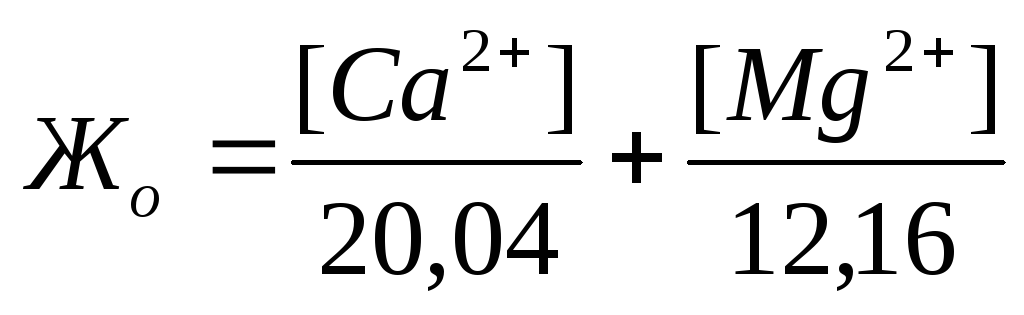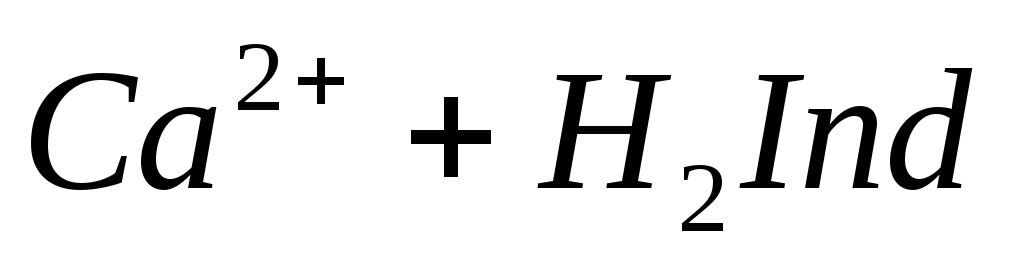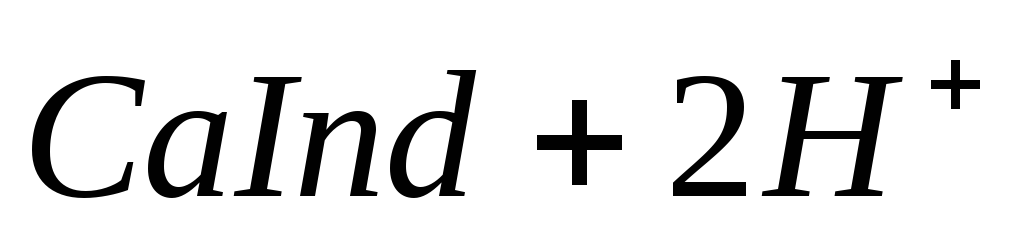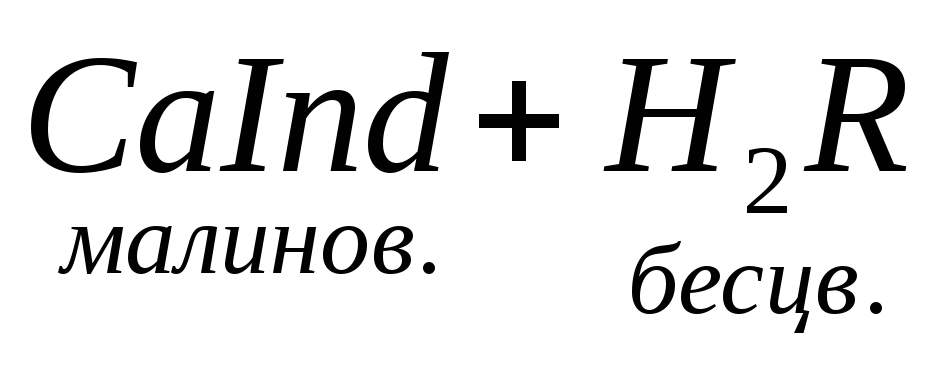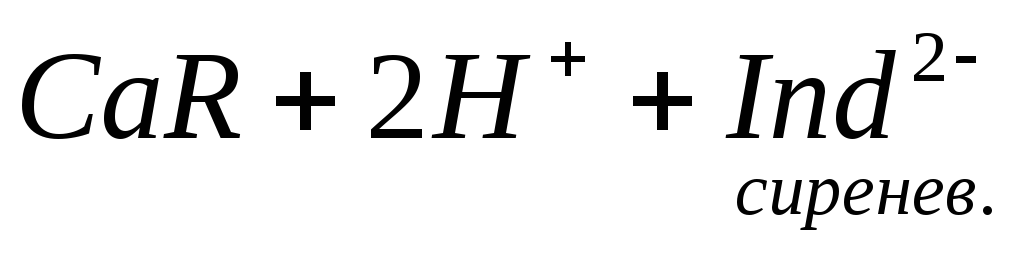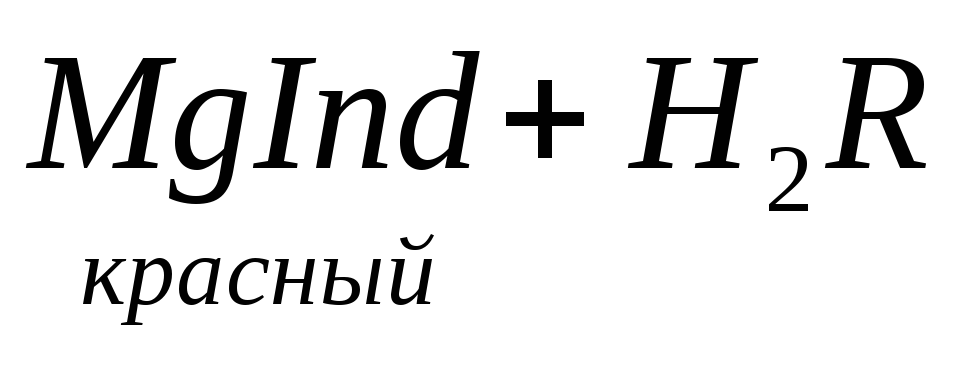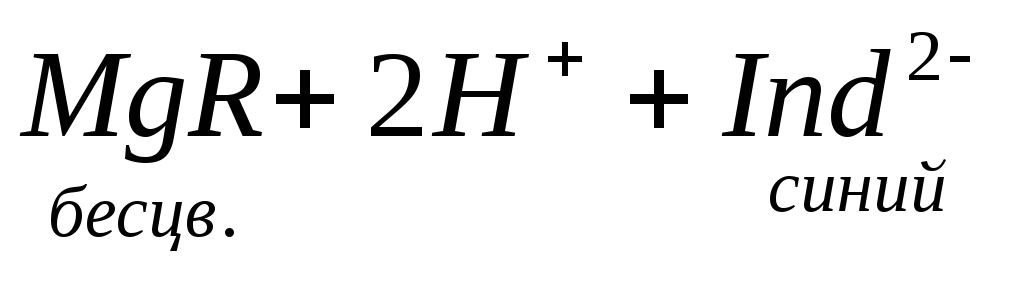Анализ питьевой воды позволяет точно понять, пригодна ли она для употребления человеком или может быть опасна для здоровья. Лабораторные исследования могут проводиться в разных вариантах, все зависит от поставленной задачи (от простого анализа на жёсткость до многоступенчатого исследования пробы на включение в состав редких элементов). Выбор методики зависит от типа пробы (из водопровода или забор на природе) и цели исследования. Есть контроль качества, соответствие нормам, степень превышения включения в состав примесей относительно ПДК. Стоит подробнее изучить вопросы о том, что включает в себя анализ, как проводится и какова его стоимость.
Основа в осуществлении анализов – полная качественная оценка качества воды из скважины, пробы из природного источника, осадков атмосферы, а также вод из стоков. Сегодня многие компании предоставляют квалифицированные услуги по определению физических и химических показателей качества и пригодности для употребления воды.
Благодаря анализу воды можно определить, пригодна ли она для употребления или нет
Обычно проводится проверка вод:
- Для питья центрального и нецентрального трубопровода снабжения водой. Эта жидкость, нужная для употребления людьми внутрь, в бытовых целях, для применения в процессе перерабатывания продовольствия и производства пищи. Регламент — СанПиН 2.1.4.1074-01.
- Из природных источников (поверхностная, подземная), осадки атмосферы. Задача охраны вод на поверхности от загрязнения актуальны для России, особенно для регионов вдоль реки Волги. Исследования поверхностных вод в лаборатории выполняются с целью выявления качества жидкости для питья и бытовых нужд, контроля за загрязнением производством, стоками в быту, а также для выявления качества объектов рыбно-хозяйственного назначения.
- Вода сточная.
При сбрасывании сточных вод в канализационную сеть необходимо проводить проверку результативности очищения и соответствия стоков прописанным в законе нормам. Проверка должна проводиться регулярно, сроки также указаны в законодательных документах.
Первостепенно нужно определение элементарного состава воды (30 самых распространенных химических элементов). Второй момент — выявление присутствия в нем дополнительных химических веществ, если это нужно или если проба имеет особенности (забор воды из грязных водоносных горизонтов или стоки промышленного предприятия).
В целом мощности хороших лабораторий дают возможность выполнять анализ проб на выявление 72 химических элементов разного рода.
Залог успеха и правильного исследования жидкости – это качественно взятая проба. Важно обращать внимание на требования к забору проб для исследования.\
Для проведения анализа воды нужно обладать специальными знаниями и оборудованием
Требования к таре и объёму воды следующие:
- Применение стерильной емкости из пластика или тары из-под дистиллированной воды. Запрещается использовать в качестве тары емкости из-под газировки, бутылки, в которых находились агрессивные среды.
- Минимум воды для исследования, взятой из скважины, колодца, крана – не меньше 0,5 л.
- Перед тем как забирать пробу для исследований, нужно, чтобы вода протекла в течение 5 минут, следует предварительно ополоснуть тару водой из этого источника.
Период, на протяжении которого взятая проба должна быть отправлена на исследование, не может быть больше 2 суток. Взятую пробу необходимо хранить в холодильнике. Также на каждой емкости должны быть нанесены данные о времени, дате и месте забора, а также о виде источника.
Исследование обычно состоит из 30 самых распространенных элементов. Образец следует передать на анализ в лабораторию не позже 48 часов с момента забора жидкости. Промаркированный образец нельзя оставлять без присмотра.
Цена исследования высчитывается в зависимости от его сложности.
Если это стандартная услуга (на выявление 30 веществ), то стоимость классическая (комплекс, примерно 60 руб./вещество). За каждый дополнительный элемент берется дополнительная сумма, все зависит от типа пробы. Однако в лабораториях для постоянных клиентов, а также при больших объёмах заказа на исследования предоставляются скидки.
Хорошая лаборатория должна иметь аттестат аккредитации на выполнение исследований воды из разных источников, а именно:
- Водопроводной воды;
- Питьевой;
- Минеральной;
- Из скважины;
- Колодезной.
Анализ воды выполняется достаточно быстро и стоит это недорого
Лабораторный анализ воды в хорошем центре основан на инновационной методике исследования – масс-спектрометрии, которая дает возможность выявлять присутствие в пробе элементов даже в микроскопических дозах. Аккредитованная лаборатория гарантирует качественный результат проведенных исследований.
Химический анализ воды направлен на определение органики и неорганики, а также степени жёсткости, мутности и прочих важных показателей пригодности и качества. Сегодня разработано больше 100 разнообразных методов, часть которых применяется на практике только в единичных лабораториях.
В перечне самых актуальных методик находятся:
- Спектрофотометрия;
- Биотестирование;
- Кондуктометрия;
- Фотометрия;
- Капиллярный электрофорез;
- Турбидиметрия;
- Газовая хроматография;
- Гравиметрия;
- Нефелометрия.
После выполнения анализа воды результаты будут перенесены на листок в виде таблицы
Обычно центры, которые специализируются на диагностировании качества воды, предлагают сокращенное и полное химическое исследование пробы. Первая методика включает диагностирование по 25 пунктам и выявляет соответствие на нормы: присутствие посторонних запахов, жесткость, мутность, общая минерализация, окисляемость, присутствие железа и магния. Сокращенный метод можно применять при переезде на новое место и для выбора фильтра в домах с централизованным снабжением водой.
Полное исследование дает возможность с высочайшей точностью выявить процент включения в состав образца следующих веществ: металлов, газов, нефтепродуктов, щелочей, мочевины, нитритов, аммиака.
Расширенное диагностирование предполагает тест по 100 и больше пунктам. Эта методика должна быть выбрана владельцами частных скважин и колодцев ещё во время стройки. Для тех, кто не может обратиться в лабораторию, выпускают уникальные наборы для химического диагностирования воды из источника своими руками дома.
Наборы для анализа в домашних условиях дают возможность в общих чертах понять, какова жёсткость воды, увеличен ли уровень солей и металлов:
Можно найти дешевые тесты, созданные специально для водопроводной системы, скважин, природных источников и колодцев. Это могут быть наборы для выявления одного или нескольких видов веществ. Тесты реализуются с описанием, оно поможет выполнить экспресс-анализ жидкости дома, понять результат и правильно подобрать устройство для фильтрации воды.
Исследование проб воды требует профессионализма, поэтому для своей же безопасности правильно будет доверить дело экспертам.
источник
Вода требуется любому организму, но из источника жизни она способна превратиться в причину болезней и отравлений. Помимо полезных микроэлементов, в воде растворяются многие химические соединения и могут развиваться микробы.
В современных условиях нельзя быть уверенным даже в чистоте воды из родника. Прежде чем применять воду для хозяйственных нужд либо питья, следует убедиться в ее качестве и безопасности. Это позволяет сделать лабораторный анализ воды.
Перед применением воды на производстве либо для хознужд проводится предварительная водоподготовка, предполагающая удаление из состава жидкости вредных компонентов, снижение ее жесткости и очистку от тяжелых металлов. Для определения конкретных веществ, подлежащих удалению, существуют химические методы анализа качества воды. Полученные данные позволяют правильно выбрать и установить требуемые очистные установки.
Эффективность работы фильтров проверяется аналогичным способом: анализ проводится повторно, а полученные данные сравниваются с первоначальными результатами. Если показатели улучшились, значит, установленные фильтры выбраны верно.
Для проведения проверки разработаны специальные методы химического анализа воды, при этом каждый из них направлен на установление содержания в жидкости определенного вещества либо группы веществ:
- Фотометрия и люминесценция. В основе методики лежит эффект свечения. Тестируемая жидкость обрабатывается ультрафиолетом, в ответ на обработку разные вещества светятся по-разному. Зафиксировать реакцию позволяют специальные приборы. Подобная методика дает возможность установить присутствие в воде нитратов, растворенного сероводорода, отравляющих цианидов, анионных веществ и других компонентов.
- ИК-спектрометрия – используется для выявления присутствия жиров и нефтепродуктов. Через воду пропускается инфракрасное излучение, заставляющее молекулы неравномерно колебаться. Длина волн служит маркером для определения примеси конкретного вещества.
- Полярография – позволяет установить концентрацию в воде ионов свинца, цинка и органических веществ. Метод основан на движении ионов при проведении электролитической диссоциации.
- Масс-спектрометрия – анализирует структуру вещества с помощью данных о его массе и заряде ионов. Применяется для определения изотопного состава молекул.
- Потенциометрия – методика химического анализа воды, позволяющая установить наличие фторидов и водородный показатель (pH). В основе способа лежит измерение электродвижущих сил.
- Дозиметрия – устанавливает наличие в жидкости радиоактивных примесей.
Многообразие существующих методик позволяет провести общий и полный анализ. При общем качество жидкости проверяется по уровню главных показателей каждой группы. С его помощью делаются выводы о качественном составе воды, однако не определяется концентрация конкретных веществ. Для ее определения проводится полный анализ, предполагающий углубленное исследование исходных образцов.
С помощью общего анализа устанавливаются следующие характеристики:
- Жесткость.
- Органолептика.
- Состав по основным хим. элементам.
- Кислотность.
Полный анализ предполагает углубленные исследования показателей каждой группы, что позволяет определить точную концентрацию веществ в растворе. Данный метод химического анализа питьевой воды можно использовать для проверки жидкости на содержание патогенной микрофлоры, токсинов, химических компонентов.
Для получения достоверных данных анализ любого вида должен выполняться при строгом соблюдении условий, установленных нормативами. То же самое относится к методике отбора проб воды для химического анализа, их хранению и транспортировке.
Для проб воды применяется тара из стекла или пластика, а колпачки должны закрываться герметично. Хранение исходного материала для последующих анализов происходит при условии их консервации в специальном водном растворе. Максимальный срок хранения – две недели.
Оптимальный объем воды для проведения исследований составляет не менее 3,5 дм3. При взятии образцов составляется акт, в котором указываются причины анализа и его назначение, определяются показатели для проверки, отмечается место и время забора жидкости.
При появлении сомнений относительно качества водопроводной воды либо воды, поступающей в дом из колодца и скважины, лучше не рисковать собственным здоровьем, а обратиться в нашу компанию. По результатам выполненной проверки вы сможете понять, есть ли необходимость устанавливать системы очистки воды. Опытные специалисты подберут подходящие фильтры, а также выполнят их монтаж и последующее обслуживание на выгодных условиях.
Автор: Андрей Караим, технический специалист
Дата публикации: 14 Марта 2017 года
Понравилась статья? Расскажите друзьям:
источник
Качество потребляемой человеком воды определяется с учетом ее свойств и состава. Данные показатели также определяют пригодность применения воды в тех или иных сферах жизнедеятельности. Нормативы (или стандарты) качества составляются с учетом требований заказчика и основных характеристик. Во многом содержание воды определяется с учетом источника ее происхождения (он может быть антропогенным либо естественным).
Чистая питьевая вода – залог здоровья человека и его отличного самочувствия. Чтобы понять, является она такой или нет, обращайтесь в специализированные инстанции, которые проводят анализ качества жидкости и ее соответствия нормативным стандартам, принятым на сегодняшний день. При выполнении анализа учитываются бактериологические, химические и физические показатели.
Проводить химический анализ по закону обязаны различные организации и предприятия при выполнении определенных работ – например, возведении моста через реку. Обязаны соблюдать требования к химсоставу предприятия, которые осуществляют выпуск бутилированной воды. Частные лица заказывают проведение анализа для:
- оценки качества питьевой воды из водопровода, скважин, родников;
- подтверждения качества бутилированной воды;
- подбора фильтра для воды, оценки его эффективности;
- контроля качества воды в бассейнах;
- оценки качества жидкости, используемой для полива растений;
- контроля среды в аквариуме;
- пр.
- щелочность;
- жесткость;
- содержание ионов;
- водородный фактор;
- минерализация.
Бактериологические параметры жидкости:
- степень загрязненности источника кишечной палочкой;
- наличие радиоактивных, токсичных элементов;
- бактериальная зараженность.
Рассмотрим данные характеристики подробнее.
Цветность – показатель, который всегда должен учитываться при анализе воды. Он обуславливает присутствие железа и включений других металлов в виде коррозионных продуктов. Цветность является косвенной характеристикой присутствия в жидкости растворенной органики, зависит от загрязненности источника стоками промышленной категории, определяется путем сравнения образцов с эталонными. Максимально допустимый показатель составляет 20°.
Мутность зависит от наличия мелкодисперсных взвесей нерастворенных частиц. Выражается она в:
- наличии осадка;
- взвешенных, грубодисперсных примесях, определяемых в ходе фильтрации;
- степени прозрачности.
Можно определять мутность фотометрическим путем – то есть по качеству проходящего через толщу жидкости светового луча.
Запах зависит от присутствия в воде пахнущих веществ, которые попадают в нее из стоков. Практически все органические жидкие вещества передают воде специфический аромат растворенных в ней газов, органики, минеральных солей. Запахи делятся на природные (гнилостные, болотные, серные) и искусственные (фенольные, нефтяные, пр.).
Вкус воды может быть соленым, кислым, сладким или горьким, все остальные «нотки» относятся уже к привкусам – например, хлорные, аммиачные, металлические, сладковатые, пр. Оценка привкуса и запаха производится по пятибалльной шкале.
Химические показатели, степень загрязненности зависят от глубины забора водных масс, просачивания в стоки различных веществ (отбросы предприятий, свалки, выгребные ямы и т.д.). Анализ проводить нужно обязательно, поскольку загрязнению подвергаются даже артезианские скважины с низким давлением, а что уже говорить о колодцах.
Жесткость характеризуется наличием в жидкости элементов кальция и магния, которые со временем превращаются в нерастворимые соли. Итог – образование накипи, отложений на внутренних поверхностях емкостей, котлов, рабочих узлах бытовой техники.
Сухой осадок указывает на степень концентрации органических элементов, а также растворенных неорганических солей. Его высокое содержание приводит к нарушению солевого баланса организма человека.
Водородный фактор рН характеризуется щелочным и кислотным фоном жидкости. Изменение фактора указывает на нарушения в технологиях водоподготовки. Норма – 6-9 единиц.
Некоторые компоненты ухудшают пищевые качества воды, а также являются потенциально опасными для здоровья человека. Рассмотрим основные:
- Железо в составе сульфатов, гидрокарбонатов, органических соединений, хлоридов. Может оно присутствовать и в виде высокодисперсных взвесей, придающих жидкости коричневый с красным оттенком цвет, снижающий вкусовые качества. Из-за высокой концентрации железа в воде начинают развиваться железобактерии, образуются засоры труб. Максимально допустимая концентрация железа по нормам составляет 0,3 мг/л.
- Марганец – главная причина генетических мутаций. Элемент оказывает негативное влияние на вкусовые характеристики жидкости, после стирки на белье появляются характерные пятна и разводы, на сантехнике образуется осадок. Максимальная концентрация согласно нормативам – 0,1 мг/л.
- Катионы марганца и кальция повышают жесткость воды. Для измерения их содержания обычно используется такой показатель как мг-экв/л. Пороговые значения находятся на отметке 3-3.5 мг-экв/л, при более высоком содержании катионов накапливается осадок на сантехническом оборудовании, нагревательных элементах бытовых приборов. Для здоровья человека жесткая вода очень вредна.
- Перманганатная окисляемость указывает на количественное содержание кислорода к концентрации иона перманганата, который принимает участие в процессах окисления воды. Предельно допустимое значение составляет 5 мг О2/л. При высоких показателях перманганатной окисляемости страдают почки и печень, репродуктивная функция, иммунная, нервная системы человека. Не рекомендуют употреблять воду без обработки при значении перманганатной окисляемости выше 2 мг О2/л.
- Сульфиды – благодаря им жидкость приобретает посторонние неприятные ароматы, а трубы начинают ржаветь. Именно сульфиды являются токсичными компонентами, вызывающими кожные аллергические реакции.
- Фториды – их концентрация не должна составлять более 1,5 мг/л. Обратите внимание, что полностью лишенная фтора вода также не полезна.
Перечисленные компоненты к сильно токсичным не относятся и отравлений не вызывают, но их постоянное употребление в пищу (даже в малых дозах) наносит непоправимый вред здоровью и приводит к хронической интоксикации.
Определение токсичных соединений, содержащихся в сравнительно небольших количествах, становится с каждым годом все более сложным и затратным. Определенные вещества в воде присутствовать могут, но строго в установленных количествах. Важно контролировать как структурный состав жидкости, так и ее функциональные интегральные характеристики.
Метрологические приборы позволяют определять только основные химические показатели, для проверки бактериального состава образцы отправляются в лаборатории. В зависимости от глубины проверки данных, анализы делятся на полные химические, сокращенные, направленные на определение некоторых составляющих. В большинстве случаев сокращенного анализа достаточно, но в целях определения полного набора компонентов требуется выполнение более глубокой проверки.
При анализе результатов нужно учитывать все показатели и сравнивать данные анализа с полученными характеристиками. Для каждого элемента есть предельно допустимая концентрация – она не должна быть превышена.
Рассмотрим основные способы, используемые для проверки качества воды.
Метод позволяет оценивать те качества, которые доступные органам чувств. Органолептическое исследование предполагает оценку цветности, прозрачности, аромата и вкуса воды.
Анализ воды на физико-химические показатели учитывает:
- жесткость;
- минерализацию;
- щелочность;
- окисляемость.
Методика позволяет определять наличие в воде паразитов и бактерий, среди которых могут присутствовать болезнетворные микроорганизмы. Обычно подсчитывается количество организмов на 1 мл жидкости
При анализе химического состава определяется наличие и количество органических, неорганических включений – к ним относят сложные органические вещества, металлы, нефтепродукты, ПАВы и так далее. Под сложными органическими веществами подразумеваются акриламиды, стиролы, фенолы, винилхлориды, тетрахлорид углероды, диоксины.
Анализ на альфа- и бета-частицы, радий проводится в целях определения радиационной безопасности жидкости. Определение содержания радионуклидов – основа для снижения дозовых нагрузок на организм. Вместе с результатами по комплексному анализу заказчик обычно получает также рекомендации, которые помогут ему улучшить качество воды.
Экспресс-анализы используются в целях ускорения процедуры проверки и снижения ее стоимости. Они позволяют анализировать такие показатели как:
- биохимическое потребление кислорода;
- число адсорбируемых либо экстрагируемых галогенов органического происхождения;
- кислотно-щелочной баланс;
- органолептические свойства воды.
Экспресс-анализ позволяет сокращать потребность в сложном оборудовании и реактивам. Важно! Высокое качество исследования поверхностная проверка гарантировать не может.
Все чаще в последние годы для проверки состава воды используются сенсоры – чувствительные элементы, которые являются основой большинства многокомпонентных анализаторов и экспрессных тест-систем. Они эффективно определяют содержание ферментов антропогенного происхождения, а также патогенную микрофлору.
Биотестирование – передовая методика определения токсичности химического вещества на биоценоз или водные организмы. Оценочные критерии – выживаемость и активность микроорганизмов, скорость их размножения, пр. Для получения корректных результатов биотестирования нужны соответствующие показатели температуры, освещенности, состава, кислотности и так далее.
Существует множество других быстрых способов определения качества питьевой воды – например, на вкус или используя другие органы чувств. Но вы должны понимать, что подобная оценка является очень субъективной, поэтому ставку следует делать на лабораторные исследования.
источник
Требования, предъявляемые к качеству воды, могут быть самыми различными и определяются её целевым назначением. Для оценки качества пластовых, природных и сточных вод их образцы подвергают анализу. На основании результатов анализа делаются выводы о пригодности воды для конкретного вида потребления, возможности применения тех или иных методов очистки. Анализы подземных вод позволяют прогнозировать сопутствующие месторождения полезных ископаемых. При анализе вод для характеристики их свойств определяют химические, физические и бактериологические показатели. Основными показателями, определяющими пригодность воды для определенной отрасли народного хозяйства, являются химические, так как физические (содержание взвешенных частиц, температура, цвет, запах, плотность, сжимаемость, вязкость, поверхностное натяжение) и бактериологические (наличие бактерий) показатели зависят от химического состава воды.
К химическим показателям качества воды относятся:
состав растворенных газов.
Общее солесодержание характеризует присутствие в воде минеральных и органических примесей, количество этих примесей в виде общей минерализации, сухого и плотного остатков. Общая минерализация представляет собой сумму всех найденных в воде анализом катионов и анионов. Минерализацию выражают в миллиграмм-эквивалентах солей, находящихся в I л воды, или в процентах, то есть числом граммов растворенных веществ, содержащихся в 100 г раствора. Сухим остатком называется суммарное количество нелетучих веществ, присутствующих в воде во взвешенном, коллоидном и растворенном состоянии, выраженное в мг/л. Сухой остаток определяют путем выпаривания пробы воды, последующего высушивания при 105 о С и взвешивания. Плотный остаток – это сухой остаток, определенный из профильтрованной пробы воды. Следовательно, разница двух показателей соответствует содержанию взвешенных веществ пробы. Если сухой остаток прокалить при температуре 500-600 о С, то масса его уменьшится и получится остаток, называемый золой. Уменьшение массы происходит за счет сгорания органических веществ, удаления кристаллизационной воды, разложения карбонатов. Потери при прокаливании приближенно относят за счет органических примесей.
Жесткость воды обусловливается наличием в ней ионов Са 2+ и Mg 2+ . Для большинства производств жесткость воды является основным показателем её качества. В жесткой воде плохо пенится мыло. При нагревании и испарении жесткой воды образуется накипь на стенках паровых котлов, труб, теплообменных аппаратов, что ведет к перерасходу топлива, коррозии металлов и авариям.
Жесткость количественно выражается числом миллиграмм-эквивалентов ионов кальция и магния в 1 л воды (мг-экв/л); 1 мг-экв/л жесткости соответствует содержанию в воде 20,04 мг/л ионов Са 2+ или
12,16 мг/л ионов Mg 2 + . Различают жесткость общую, карбонатную и некарбонатную.
Карбонатная жесткость связана с присутствием в воде в основном гидрокарбонатов и карбонатов кальция и магния, которые при кипячении воды переходят в нерастворимые средние или основные соли и выпадают в виде плотного осадка:
Таким образом, при кипячении карбонатная жесткость устраняется. Поэтому она называется также временной жесткостью. Следует сказать, что при переходе HCO3 – в CO32 – и при выпадении карбонатов кальция и магния в воде остается некоторое количество ионов Са 2+ , Mg 2+ , CO32 – , соответствующее произведению растворимости СаСО3 и (MgOH)2CO3. В присутствии посторонних ионов растворимость этих соединений повышается.
Некарбонатная (постоянная) жесткость не разрушается кипячением. Она обусловливается присутствием в воде кальциевых и магниевых солей сильных кислот, главным образом сульфатов и хлоридов.
Общаяжесткость воды представляет собой сумму карбонатной и некарбонатной жесткости и обусловливается суммарным содержанием в воде растворенных солей кальция и магния. По величине общей жесткости принята следующая классификация природных вод:
Если известны концентрации (мг/л) в воде Ca 2+ , Mg 2+ и HCO3 – , то жесткость рассчитывается по следующим формулам:
Общая жесткость
Карбонатная жесткость равна концентрации (мг/л) [HCO3– ]; в случае, если содержание ионов кальция и магния в воде выше, чем количество гидрокарбонатов:
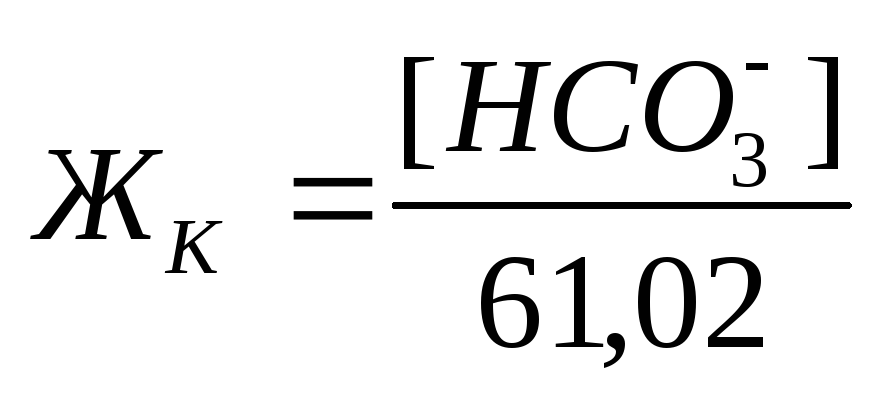
Если же количество гидрокарбонатов в воде превышает содержание ионов кальция и магния, то карбонатная жесткость соответствует общей жесткости. Разность между общей и карбонатной жесткостью составляет некарбонатную жесткость: ЖНК= ЖО– ЖК . Следовательно, ЖНК – это содержание Ca 2+ и Mg 2 + , эквивалентное концентрации всех остальных анионов, в том числе и некомпенсированных гидрокарбонатов.
Окисляемость характеризует содержание в воде восстановителей, к которым относятся органические и некоторые неорганические (сероводород, сульфиты, соединения двухвалентного железа и др.) вещества. Величина окисляемости определяется количеством затраченного окислителя и выражается числом миллиграммов кислорода, необходимого для окисления веществ, содержащихся в 1 л воды. Различают общую и частичную окисляемость. Общую окисляемость определяют обработкой воды сильным окислителем – бихроматом калия K2Cr2O7 или йодатом калия KIO3. Частичную окисляемость определяют по реакции с менее сильным окислителем – перманганатом калия КMnO4. По этой реакции окисляются только сравнительно легко окисляющиеся вещества.
Для полного окисления содержащихся в воде органических веществ, при котором происходят превращения по схеме
требуется количество кислорода (или окислителя в расчете на кислород), называемое химическим потреблением кислорода (ХПК) и выражаемое в мг/л.
При любом методе определения ХПК вместе с органическими веществами окисляются и неорганические восстановители, содержащиеся в пробе. Тогда содержание неорганических восстановителей в пробе определяют отдельно специальными методами и результаты этих определений вычитают из найденного значения ХПК.
Реакция среды характеризует степень кислотности или щелочности воды. Концентрация водородных ионов природных вод зависит главным образом от гидролиза солей, растворенных в воде, количества растворенных угольной кислоты и сероводорода, содержания различных органических кислот. Обычно для большинства природных вод величина рН изменяется в пределах 5,5-8,5. Постоянство рН природных вод обеспечивается наличием в ней буферных смесей. Изменение значения рН свидетельствует о загрязнении природной воды сточными водами.
Определение иона Cl – . В основу определения иона хлора положен аргентометрический метод Мора. Принцип анализа заключается в том, что при прибавлении к воде раствора AgNO3 образуется белый осадок хлорида серебра:
Определение хлорид-ионов ведут в интервале рН = 6,5 ÷ 10, чтобы одновременно с AgCl не выпадал осадок Ag2CO3. Проведению определения Сl – мешает наличие в воде ионов брома, йода, сероводорода, от которых освобождаются предварительной обработкой воды.
Определение иона SO42– . Метод определения сульфат-ионов основан на малой растворимости сульфата бария, количественно выпадающего в кислой среде при добавлении к воде раствора хлорида бария: Ba 2+ + SO42– = BaSO4↓
По массе образовавшегося осадка рассчитывают содержание иона SO42– .
Определение ионов CO32– и HCO3– . Эти ионы определяют титрованием пробы воды растворами серной или соляной кислот последовательно с индикаторами фенолфталеином и метилоранжем. Реакция нейтрализации протекает в две стадии.
Первые порции кислоты вступают в реакции с карбонат-ионом, образуя гидрокарбонат-ион:
Окраска фенолфталеина при рН = 8,4 переходит из розовой в бесцветную, что совпадает с таким состоянием раствора, когда в нем остаются лишь гидрокарбонаты. По количеству кислоты, пошедшей на титрование, рассчитывают содержание карбонат-иона. Расход кислот на титрование с фенолфталеином эквивалентен содержанию половины карбонатов, т.к. последние нейтрализуются только наполовину до HCO3 – . Поэтому общее количество CO32 – эквивалентно удвоенному количеству кислоты, затраченной на титрование. При дальнейшем титровании в присутствии метилоранжа происходит реакция нейтрализации гидрокарбонатов:
Метилоранж меняет окраску при pH = 4,3, т.е. в момент, когда в растворе остается только свободный диоксид углерода.
При расчете содержания ионов HCO3 – в воде следует из количества кислоты, пошедшей на титрование с метилоранжем, вычесть количество кислоты, идущей на титрование с фенолфталеином. Общее количество кислоты, затраченной на нейтрализацию ионов ОН – , СО32– и НСО3– , характеризует общую щелочность воды. Если рН воды ниже 4,3, то её щелочность равна нулю.
Определение ионов Ca 2+ , Mg 2+ . Имеется несколько методов обнаружения и определения содержания ионов Са 2+ и Mg 2+ . При добавлении в воду оксалата аммония (NH4)2C2O4 в случае присутствия ионов кальция образуется белый осадок оксалата кальция:
После отделения осадка оксалата кальция в воде можно определить ионы Mg 2+ с помощью раствора гидрофосфата натрия Na2HPO4 и аммиака. При наличии иона Mg 2 + образуется мелкокристаллический осадок соли магния:
Полученные осадки прокаливают и взвешивают. На основании полученных результатов вычисляется величина кальциевой и магниевой жесткости.
Наиболее быстрым и точным методом определения Са 2 + и Mg 2 + является комплексонометрический метод, основанный на способности двунатриевой соли этилендиаминотетрауксусной кислоты (трилон Б)
N
образовывать с ионами кальция и магния прочные комплексные соединения.
При титровании пробы воды трилоном Б происходит последовательное связывание в комплекс сначала ионов кальция, а затем ионов магния. Содержание ионов кальция определяют, титруя воду в присутствии индикатора — мурексида. Мурексид образует с ионами кальция малодиссоциированное комплексное соединение, окрашенное в малиновый цвет.
Ионы магния не дают комплекса с мурексидом. Трилон Б извлекает Са 2+ из его растворимого комплекса с мурексидом, вследствие чего окраска раствора, изменяется на сиреневую:
По количеству трилона Б, расходуемого на титрование, определяют содержание Са 2 + . Титрованием пробы воды трилоном Б в присутствии индикатора хромогена черного определяют суммарное содержание Са 2 + и Mg 2 + , то есть общую жесткость воды. Вода, содержащая Са 2 + и Mg 2 + , в присутствии хромогена черного окрашивается в красный цвет вследствие образования комплекса с Mg 2 + . При титровании воды в точке эквивалентности происходит изменение цвета на синий вследствие протекания следующей реакции:
Содержание Mg 2+ вычисляют по разности между общим содержанием (Са 2+ + Mg 2+ ) и содержанием Са 2 + . Трилонометрическое определение каждого иона производится при том значении рН, при котором этот ион образует с трилоном Б соединение более прочное, чем с индикатором. Для поддержания заданного значения рН к титруемому раствору добавляют буферные растворы. Кроме того, поддержание заданной величины рН обеспечивает определенную окраску индикатора. Общую жесткость воды определяют при рН > 9, кальциевую – при рН = 12.
Определение ионов Na + , K + . Производится вычислением по разности между суммой мг-экв найденных анионов и катионов, поскольку вода электронейтральна:
С достаточно высокой точностью все присутствующие в воде катионы можно определить эмиссионной спектроскопией сухого остатка.
Растворенные в воде газы определяют химическими методами или газовой хроматографией.
Определение диоксида углерода производят титрованием пробы воды щелочью в присутствии индикатора–фенолфталеина:
Определение растворенного кислорода производится йодометрическим методом.
Для анализа в пробу воды поcледовательно добавляют раствор хлорида марганца и щелочной раствор йодида калия. Метод основан на окислении свежеполученного гидроксида двухвалентного марганца содержащимся в воде кислородом:
Количество образовавшегося в воде бурого осадка гидроксида четырехвалентного марганца эквивалентно количеству растворенного кислорода. При последующем добавлении к пробе соляной или серной кислоты четырехвалентный марганец вновь восстанавливается до двухвалентного, окисляя при этом йодид калия. Это приводит к выделению свободного йода, эквивалентного содержанию четырехвалентного марганца, или, что то же самое, растворенного кислорода в пробе:
Выделившийся свободный йод определяется количественно путем титрования раствором тиосульфата натрия:
I2+ 2Na2S2O3
Йодометрический метод определения растворенного кислорода неприменим для вод, содержащих сероводород, так как сероводород вступает во взаимодействие с йодом и занижает результат. Во избежание этой ошибки предварительно связывают содержащийся в пробе сероводород в соединение, не препятствующее нормальному течению реакции. Для этой цели обычно используют хлорид ртути (II):
Определение H2S. Прежде чем приступить к количественному определению сероводорода, определяют его качественное присутствие по характерному запаху. Более объективным качественным показателем служат свинцовые индикаторные бумажки (фильтровальная бумага, пропитанная раствором ацетата свинца). При опускании в воду, содержащую сероводород, свинцовая бумага темнеет, принимая желтую (малое содержание), бурую (среднее содержание) или темно-коричневую (высокое содержание) окраску.
В водных растворах сероводород присутствует в трех формах: недиссоциированный H2S, в виде ионов HS – и S 2 – . Относительные концентрации этих форм в воде зависят от рН этой воды и в меньшей степени от температуры и общего солесодержания.
Если анализируемая вода не содержит веществ, реагирующих с иодом, то сероводород и его ионы можно определить следующим образом.
В основе количественного метода определения H2S лежит реакция окисления сероводорода йодом:
К точно отмеренному подкисленному раствору йода, взятого в избытке по отношению к ожидаемому содержанию сероводорода, прибавляют определенное количество воды. Количество йода, израсходованное на окисление сероводорода, определяется обратным титрованием остатка йода тиосульфатом. Разница между количеством раствора тиосульфата, соответствующим всему количеству взятого для анализа йода, и количеством этого же раствора, затраченного на титрование остатка йода в пробе, эквивалентна содержанию сероводорода в исследуемой пробе.
источник
Вывоз, переработка и утилизация отходов с 1 по 5 класс опасности
Работаем со всеми регионами России. Действующая лицензия. Полный комплект закрывающих документов. Индивидуальный подход к клиенту и гибкая ценовая политика.
С помощью данной формы вы можете оставить заявку на оказание услуг, запросить коммерческое предложение или получить бесплатную консультацию наших специалистов.
Вода из скважины или колодца не всегда пригодна для питья. Чтобы выяснить, можно ли готовить на такой воде, требуется провести химический анализ воды. Полный химический анализ воды может потребоваться также для изучения качество водопроводной или родниковой воды, а также в научных целях и в рамках экологического мониторинга.
Во время анализа представленные образцы исследуют на наличие различных загрязнений: растворенных веществ, нерастворимых соединений, бактерий и простейших. Кроме того, можно исследовать радиоактивность воды. По результатам, лаборанты выносят вердикт – можно ли употреблять воду в пищу, насколько она пригодна для бытовых целей, какие загрязнители содержит.
Отправляя пробы на физико-химический анализ воды, необходимо помнить, что существуют правила забора образцов:
- Нужно подготовить чистую тару – подойдет бутыль, в которой до этого была негазированная чистая питьевая вода.
- Перед наполнением тару рекомендуется промыть – можно той же жидкостью, которая предназначена для сбора.
Правила разработаны для каждого источника. Так, для сбора из водопроводного крана алгоритм такой:
- Открыть кран не менее чем на 10 минут на среднем напоре.
- Наполнить бутылку, стараясь не допускать появления пузырьков воздуха.
Для скважины правила похожие:
- Открыть кран не менее чем на 10 минут, поддерживать средний напор.
- В случае если скважина была заброшена или использовалась редко, то необходимо откачать верхний слой насосом – не менее 2 часов.
Правила для точного анализа:
- Пробу из колодца набирают с глубины в 4 метра. Ведро должно быть чистым.
- Иногда для полного анализа скважины может потребоваться придонная вода – ее собирают так, чтобы исключить попадание ила и песка.
- При заборе пробы в бутылку, ее нужно наполнять медленно.
- Сразу после забора, тару необходимо плотно закрыть.
- Лучше всего отдавать образцы сразу. Если такой возможности нет – правильный образец можно хранить в холодильнике до 2 суток.
Пробу отдают вместе с сопроводительным листком. На нем указывают:
- Юридический и фактический адрес источника.
- Тип источника.
- Точную дату и время забора пробы.
- Нуждается ли вода в срочной диагностике.
Чем лучше собрана проба – тем точнее будут результаты исследования.
Как узнать, нужны ли исследования? Если спросить специалиста, то гигиенист скажет, что проводить такой анализ лучше всего регулярно – даже если кажется, что не происходит никаких изменений.
Но есть ситуации, в которых проверка качества воды не просто рекомендована, но очень желательна:
- Если заметно изменились цвет, запах или вкус. В таком случае отправить пробу на экспертизу стоит как можно раньше. А до тех пор воздержаться от питья. Это особенно актуально для городских жителей – вода из подземных источников часто меняет цвет в зависимости от количества атмосферных осадков.
- Если рядом со скважиной или колодцем велось строительство. Особенно опасны строительные работы на промышленных объектах. Микрочастицы самых разных токсичных веществ попадают воду. Если водоем не проточный – они задержатся надолго.
- При покупке участка рядом с оживленной трассой стоит проверить качество питьевой воды из колодца.
- После аварийных ситуаций на производствах в районе скважины. Анализ требуется, чтобы убедиться, что в почву, а значит, и в воду не попади токсичные отходы производства.
- При выборе фильтра для домашнего использования – чтобы знать, что именно требуется отфильтровать. Многие компании, предлагающие услуги по установке фильтров под ключ, сразу же предлагают провести анализ. Стоит исследовать воду и после установки фильтра – через несколько месяцев – чтобы убедиться, что оборудование работает должным образом.
Существуют ситуации, в которых проверка предусмотрена федеральным законодательством:
- Регулярно – в медицинских, детских и оздоровительных учреждениях.
- На производстве бутилированной питьевой воды.
- При открытии новых веток трубопровода.
- На промышленных предприятиях – обязательная экспертиза сточных вод.
Подобные требования содержатся в Водном Кодексе РФ, а также в проекте ФЗ «О водоснабжении» и действующем ФЗ «О санитарно-эпидемиологическом благополучии населения».
Основные типы нормативных документов, устанавливающих требования к качеству на территории России:
- СанПиН – санитарно-токсикологические и органолептические показатели.
- Гигиенические критерии.
- Эпидемиологические нормативы.
- Медицинские критерии оценки качества.
- Госстандарты для производства.
- Технические условия.
- Справочники ПДК.
Такое большое количество стандартов легко объяснимо – ведь вред от использования в пищевых целях воды ненадлежащего качества может быть очень серьезным.
При оценке качества с помощью химико-физических методов оценивают следующие показатели:
- pH (норма находится в пределах от 6 до 9).
- минерализация (норма составляет не более 1000 мг на литр).
- Содержание отдельных химических элементов – для каждого установлен максимальный порог.
- Фенольный индекс.
Помимо этого проводится микробиологическая оценка безопасности, оценивают органолептические свойства, содержание некоторых классов органических соединений.
Бутилированные воды делят на две основные категории – высшая и первая.Продукт обеих категорий обязан соответствовать стандартам качества и безопасности, прописанным в СанПиНе. Отличие в том, что продукт высшей категории может добываться только из сертифицированных природных источников, защищенных от загрязнений любого характера.
Количественный химический анализ оценивает содержание:
- Общий химический состав.
- Микробиологические параметры.
- Радиационные показатели.
- Наличие токсичных металлов.
Проведение экспертизы строго регламентировано – существуют методические рекомендации для сотрудников лабораторий оценки качества.
Естественные источники – это:
- Колодцы и скважины.
- Реки и ручьи.
- Озера и водохранилища.
- Родники.
Исследование открытых источников затруднено, так как их химический состав постоянно меняется – вместе с изменением погоды, времени года и уровнем атмосферных осадков. Существуют индивидуальные нормативы для каждого открытого источника. Наиболее строгие нормативы действуют в отношении родников, скважин и колодцев – вода из них часто используется для питья без дополнительной обработки.
Методы химического анализа воды:
- Качественный.
- Количественный химический анализ воды.
Качественный позволяет установить присутствие в растворе каких-либо веществ. А количественный – их содержание.
Оценивая качество, проводят следующие исследования:
- Органолептическое. Органолептическое исследование – это метод, который позволяет оценить цвет, прозрачность, запах и вкус – то есть характеристики, важные для потребителей. Другие способы оценивают менее очевидные показатели.
- Физико-химическое. Физико-химическое исследование – это изучение таких показателей, как минерализация, жесткость, рН.
- Микробиологическое и паразитологическое. Микробиологическое и паразитологическое исследования позволяют выявить наличие патогенных микроорганизмов или паразитов, которые могут быть опасны для человека.
- Химическое. Химические исследования – это определение количества различных примесей – металлов, нефтепродуктов и прочего.
- Радионуклидное. Определение радионуклидов позволяет убедиться в радиационной безопасности.
Для определения качества стоит обратиться в местную экспертную организацию или в филиал СЭС. Как правило, специалисты не просто проводят анализ, но также выдают рекомендации по улучшению качества.
источник
Вода – это источник жизни, но она может стать и причиной отравления или заболевания.
Кроме полезных минералов вода растворяет в себе вредные химические вещества, а также является благоприятной средой для обитания микроорганизмов.
Прежде, чем использовать воду в хозяйстве, нужно убедиться в ее безопасности.
Перед использованием воды в хозяйстве или на производстве необходимо произвести предварительную подготовку: из питьевой воды нужно удалить все вредные вещества и оставить питательные минералы, а для производства нужно понизить жесткость воды и содержание тяжелых металлов.
Чтобы узнать, какие именно вещества нужно удалить из воды производится химический и бактериологический анализ. На основании полученных результатов можно подобрать подходящее очистное оборудование.
Контроль эффективности работы фильтрации воды можно определить путем проведения повторного анализа. Сравнив результаты двух последних отборов проб можно судить о правильности выбора очистного оборудования.
Минерализация – это сумма всех растворенных веществ в воде. Этот параметр еще называют солесодержанием. Единицей измерения минерализации является миллиграмм на литр (мг/л.). Существуют нормы, определяющие пригодность воды для питья. Предельно-допустимый уровень минерализации для питьевой воды составляет 500 мг/л.
Для проведения анализа на уровень минерализации в воде необходимо произвести предварительную подготовку пробы. Она заключается в разложении органических веществ и выделения определяемых элементов, которые остаются в виде неорганических соединений. Выделяется два основных метода подготовки проб: сухой – нагревание в печи, мокрый – использование кислот-окислителей.
Одним из приборов для подготовки проб является СВЧ минерализатор. Его принцип действия: подготавливаемая проба и окислительные реагенты помещаются в стеклянный сосуд, плотно закрытый крышкой. Колба переносится в СВЧ минерализатор, и прибор включается в работу. При повышении температуры ускоряется процесс окисления, и все органические примеси разлагаются за короткий промежуток времени.
Проведение анализа воды осуществляется несколькими методами, каждый из которых предназначен для определения конкретного вещества или группы веществ.
Люминесценция и фотометрия – этот метод основан на явлении люминесценции, то есть свечении. Тестируемая вода подвергается действию ультрафиолета, и различные вещества проявляют свою реакцию: ответное свечение определенного цвета.
Для фиксации этой реакции применяются регистрирующие приборы. С помощью этого метода определяется содержание следующих примесей: нефтепродукты, нитриты, нитраты, фосфаты, анионные вещества, цианиды, формальдегидов и сероводород.
ИК-спектрометрия – это анализ воды для определения наличия нефтепродуктов и жиров. Принцип действия инфракрасного спектрометра – пропускание инфракрасного излучения через воду, что вызывает колебание молекул, распространяющееся неравномерно. По длинам волн определяется примесь того или иного вещества.
Полярография – это метод анализа воды для определения концентрации ионов кадмия, цинка, свинца, органических веществ. В его основе лежит движение ионов в результате электролитической диссоциации.
Масс-спектрометрия – это анализ структуры вещества на основании отношения массы вещества к заряду ионов. Этот метод позволяет определить изотопный состав молекул.
Потенциометрия – это метод анализа воды, позволяющий определить водородный показатель (рН) и наличие фторидов. Он основан на измерении электродвижущих сил.
Дозиметрия – это метод анализа воды, выявляющий радиоактивные примеси.
Электроосмос – это процесс движения жидкости через капилляры под воздействием электрического поля.
Цель физико-химического анализа воды – выявление состава растворенных веществ. Полученная информация дает возможность применить подходящее очистное сооружение, чтобы предотвратить отравление человека, загрязнение окружающей среды или нарушения технологического процесса.
Химический анализ воды применяется во многих сферах жизни: в быту – для получения чистой и полезной питьевой воды, в промышленности – для контроля очистных сооружений сточных вод, в промышленных технологических процессах – для получения конденсата с минимальным содержанием растворенных примесей.
Существует различное оборудование для проведения анализа воды: портативные приборы для бытового использования и высокоточное лабораторное оборудование, способное проводить анализы бытовой и промышленной воды.
Анализатор жидкости «ФЛЮОРАТ – 02 – 5М» выполняет функции флуориметра, фотометра, хемилюминоминометра. Этот прибор позволяет определять содержание в воде следующих веществ: алюминия, бериллия, бора, ванадия, марганца, меди, молибдена, взвешенных частиц, мышьяка, нефтепродуктов, никеля, нитрита, общего железа, общего хрома, олова, селена, фенолов, флуоресцеина, формальдегида, цианидов и цинка.
Технические характеристики аппарата:
- Время измерения – не более 16 с.
- Допустимая погрешность 0.02.
- Рабочий спектральный диапазон 200-900 мм.
- Температура окружающего воздуха 10-350С.
- Средний срок службы – не менее 5 лет.
- Габариты: 305х320х110 мм.
- Масса – 6,5 кг.
- Питание от электросети 220 В.
- Питание от батареи 12 В.
- Частота тока 50 Гц.
Цена прибора: 564 000 рублей.
Экотестер «СОЭКС» — это дозиметрический прибор для бытового пользования, позволяющий определить радиоактивные излучения гамма-частиц и бета-частиц. Этот прибор обладает второй функцией – определение содержания нитратов в воде и продуктах питания.
- диапазон измерения радиоактивности 3-100000 мкР/ч;
- диапазон измерения концентрации нитратов: 20-5000 мг./кг;
- время измерения: 10 сек;
- питание: 2 батареи аккумуляторы, заряжаемые от электросети 220 В. 10 часов непрерывной работы.
Спектрометр TRIDION™-9 GC-TMS способен производить анализ воды, воздуха и почвы. Это портативный анализатор, производящий качественный и количественный анализ воды (химический и биологический состав воды).
- размеры 380*390*229 мм;
- вес: 14,5 кг;
- рабочая температура: 5-400С;
- влажность: до 100%;
- электропитание: от литиевой батареи;
- ввод пробы: впрыск жидкости;
- предел обнаружения: от РРВ до РРМ для большинства веществ;
- запись данных: USB накопитель.
СВЧ-минерализатор «МИНОТАВР®-2» — прибор минерализации воды под воздействием микроволнового поля. Его назначение – разложение органических веществ в воде для проведения физико-химического анализа.
Цена прибора: 357 000 рублей.
Чтобы получить официальный документ о пригодности воды к использованию в хозяйстве или на производстве нужно обратиться в сертифицированную лабораторию.
Корректность анализов будет зависеть от соблюдения технологии отбора проб и возможностей оборудования. Гарантию на чистоту анализа можно получить только в лаборатории.
источник
Химический, микробиологический анализы воды из скважин, и центрального водоснабжения, с примером допустимых показателей
Вода – это источник энергии и жизни человека, поэтому на всех этапах строительства, начиная с изысканий, обязательно проводят анализ воды из скважин, колодцев и водоемов, находящихся непосредственно на территории объекта. Состав воды подвержен постоянному воздействию внешних факторов, ведь не исключено, что ранее около водоема, скважины или колодца располагались промышленные предприятия, захоронения тяжелых металлов или несанкционированная свалка отходов. Определить годность воды к использованию в бытовых условиях может своевременный анализ воды.
Исследования помогают установить химический состав и свойства воды и выявить концентрацию всех вредных примесей. Это необходимо для обеспечения любого объекта строительства качественной питьевой водой, а также для расчетов и выбора подходящего очистительного и распределительного оборудования. От состава и свойств воды зависит расчетный срок службы прокладываемых коммуникаций и здоровье людей, использующих ее для питьевых или бытовых нужд. Именно по этой причине одним из основных этапов геоизысканий является обязательное проведение различных анализов воды из скважины, которое назначается застройщиками любых объектов, в том числе и промышленных.

При этом стоит учесть, что подобные лабораторные исследования рекомендуется проводить систематически, так как химический состав воды подвержен изменениям под действием внешней среды.
Выделяют 3 основных вида показателей:
- Физические показатели, которые позволяют оценить основные свойства воды, а именно ее вкус, цвет, мутность, температурные данные, запах и информацию о взвешенных частицах в составе.
- Химические показатели. Они позволяют охарактеризовать состав воды за счет оценки концентрации основных ионов. Также в процессе исследования определяют основные показатели жесткости, уровень pH, число общей минерализации и содержание отдельных ионов, отвечающих за качество воды, фтора, железа, калия и т. д. Стоит отметить, что избыток железа влияет на цвет воды и вызывает образование осадка в трубах, который может негативно влиять на сантехническое оборудование и трубы. В то время как избыток меди влияет на вкусовые качества.
- Бактериологические показатели также отвечают за качество воды и позволяют своевременно определить заражение различными микроорганизмами. Чаще всего бактерии попадают в жидкость под воздействием внешних факторов и человеческой жизнедеятельности. Например, заражение может произойти при попадании сточных вод, при контакте воды с животными и при загрязнении различными промышленными отходами.
Показатели качества воды определяются:
- химическим анализом;
- органолептическим исследованием, в результате которого определяется жесткость и наличие железа;
- токсическим анализом, направленным на определение наличия опасных веществ;
- микробиологическим исследованием, позволяющим определить содержание бактерий в скважине, водоеме или колодце.
Результаты проверки указывают на количество определенных веществ в разных единицах измерения. При знании норм можно самостоятельно оценить основные показатели. Если все в норме, то жидкость можно считать чистой и пригодной к использованию. В противном случае нужно проводить дополнительную фильтрацию. Обычно в результатах указывают предельно допустимую концентрацию (ПДК) примесей. Этот показатель говорит, что количество определенного вещества не несет негативного воздействия. ПДК прописываются в нормативных документах.
Исследование производят для установления точного химического состава воды, а также для оценки основных свойств. Характер исследования может отличаться в зависимости от поставленных задач. Химический анализ воды подразделяют на общий и специальный. Во время общего анализа воды определяется ее общая характеристика, необходимая для ее классификации, а также для получения информации о содержании отдельных солей и ионов. Данные результаты имеют широкое назначение.
Согласно СанПиН 2.1.4.559-96, на сегодняшний день в результате исследования воды обязательно устанавливают концентрацию ионов кальция, магния, натрия, которые наряду с другими составляют основу шестикомпонентного анализа, также позволяющего определить содержание железа и уровень pH. Исследование не включает в себя определение газового состава.
Краткое описание основных исследуемых в процессе химического анализа показателей:
- Водородный коэффициент (pH) зависит от концентрации ионов.
- Жесткость воды определяют исходя из концентрации в ней солей кальция и магния.
- Щелочность базируется содержанием гидроксидов, анионов слабых кислот, бикарбонатов и карбонатов.
- Хлориды связаны с присутствием в жидкости обычной соли. При наличии с хлоридами азотсодержащих веществ есть угроза загрязнения централизованного водоснабжения бытовыми отходами.
- Сульфаты могут вызывать проблемы пищеварительной системы.
- Элементы, содержащие азот, показывают присутствие в жидкости животной органики. К ним относится аммиак, нитриты, нитраты.
- Фтор и йод. Оба вещества несут негативные последствия как при избытке, так и при дефиците. Первое вещество может вызвать рахит, заболевания зубов и крови. Второе – проблемы щитовидной железы.
- Железо в составе воды может находиться в растворенном, не растворенном, коллоидном состоянии, а также в виде органических примесей и бактерий.
- Марганец вместе с железом оставляют желтые потеки труб, аналогичные следы остаются и на чистом белье, а также вызывают характерный привкус. Это пагубно действует на печень.
- Сероводород можно встретить в подземных водах, проводя анализ колодезной воды. Вещество относится к ядам, серьезно влияющим на здоровье людей. В воде, используемой для бытовых и питьевых нужд, присутствие сероводорода крайне опасно и запрещено.
- Хлор – наиболее распространенное средство санитарной обработки водопроводной воды. Вещество оказывает пагубное воздействие на организм и является одной из причин генетических мутаций, тяжелых отравлений, онкологических болезней. Однако в воде часто наблюдается остаточный хлор, используемый для ее обеззараживания, в безопасной концентрации.
- Натрий и калий – следствие растворения коренных пород.
Среди специальных анализов подземных вод важное место занимают:
- Санитарный, направленный на определения уровня жесткости и кислотности, содержания солей и ионов NH4, NO2, NO3. Анализ выявляют в целях определения пригодности воды для питья и бытового использования и уровня ее загрязненности.
- Бальнеологический анализ – кроме главных ионов, позволяет выявить уровень газовых компонентов, радиоактивность, число сульфатов, железо, мышьяк, литий и ряд иных показателей качества. Он считается наиболее полным и применяется для нормирования целебных источников минеральной воды, установленных требованиям ГОСТ Р 54316-2011, расположенных , например, в Карловых Варах, Ессентуках, Железноводске, Трускавце.
- Технический анализ производят для того, чтобы оценить коррозионные и агрессивные свойства воды, а также определить ее пригодность для использования в нефтедобыче, для питания паровых котельных установок или в иной технической сфере.
- Поисковый анализ питьевой воды используют наряду с техническим анализом для поиска агрессивных примесей и оценки способов ее дальнейшего использования.
Анализы воды из скважины проводят как в стационарных лабораторных условиях, так и с использованием полевых лабораторных установок непосредственно на объекте строительства. В полевых условиях часто используют исследовательские лаборатории и передвижные конструкции для анализа, разработанные учеными А. А. Резниковым (ПЛАВ), И. Ю. Соколовой и другими. Данный вид оборудования обычно состоит из упакованных смонтированных комплектов оборудования, посуды и реактивов, которые предназначены для исследований объемным, колориметрическим и нефелометрическим методами.
Химическая экспертиза воды имеет широкий спектр действия и применяется для:
- анализа питьевой воды;
- определения чистоты промышленных источников;
- подбора фильтров на производстве.
Для точности результатов рекомендуют соблюдать следующие требования:
- Емкость для пробы воды на анализ должна быть стерильной. Объем тары – 500 гр. Простерилизовать посуду может лаборатория, проводящая исследование, но процедуру несложно провести и дома. Для этой цели пробирку необходимо простерилизовать кипятком или паром. Также можно подержать емкость 10-15 мин в духовке или над открытым огнем.
- Перед забором нужно продезинфицировать кран открытым пламенем и обтереть спиртом. После этих манипуляций нужно спустить воду на полной мощности в течение 5-7 мин. Запрещается притрагиваться к крышке и горловине тары.
- Жидкость необходимо оградить от тепла и прямых солнечных лучей, так как такое воздействие способно нарушить качество, и результаты будут недостоверными. Лучше во время перевозки поместить пробирку в холодное место.
- Образец нужно передать в лабораторию и приступить к определениям максимум через 3 часа после забора.
К образцу прилагают документацию, содержащую информацию о виде источника (колодец, скважина, природный водоем и т. д.), место пробы, правильную дату и время забора, а также точный юридический адрес источника.
Изображение результатов химического анализа
Качество воды из скважины и ее состав можно определить несколькими методиками. Каждая из них устанавливает определенный показатель. Химический состав воды из скважины, водоема или колодца обычно изображают в ионной, процент-эквивалентной или эквивалентной форме. Ионная форма позволяет выразить химический состав питьевой воды в виде отдельных ионов, содержащихся в ней. Они выражаются в миллиграммах (мг) или же в граммах (гр), изредка данные могут быть предоставлены как отношение к массе и объему исследуемой жидкости.

Сегодня все сертифицированные лаборатории, куда доставляются пробы, предоставляют результаты гидрохимических исследований в ионной форме, которая является основным изображением состава воды. Ионная форма считается основной и используется для дальнейших переходов. Если надо выполнить перевод результатов, изображенных в виде отношения к единице объема, к составу, отнесенному к единице массы, количество отдельных ионов нужно поделить на плотность, а в случае обратного перехода — помножить.
Эквивалентная форма изображения результатов и получила значительное распространение. Она дает развернутое представление о свойствах воды, позволяет определить содержание ионов и установить происхождение вод. Форма используется в аналитических целях и позволяет контролировать результаты.

Эквивалент иона представляет собой частное от деления ионной массы на валентность иона. В качестве примера можно рассмотреть содержание иона натрия в эквивалентном виде иона: Na+ = 23/1, а эквивалент иона С = 35,5/1, из этого следует вывод, что на 23 единицы массы иона Na+ приходится 35,5 единицы иона, выраженных в эквивалентах. Исходя из этого, нужно отметить, что для перехода от ионной формы к эквивалентному изображению результатов нужно разделить количество иона, выраженное в миллиграммах (мг) или граммах (гр), на величину эквивалента иона.

Процент-эквивалентная форма позволяет более наглядно показать ионно-солевой состав, соотношение между ионами, а также определяет черты сходства вод с различной величиной минерализации, что делает данную форму наиболее распространенной. Но изображение содержания солей в составе исследуемых жидкостей только в одной из вышеперечисленных форм не дает возможности установить абсолютное содержание ионов в воде. По этой причине желательно предоставить результаты исследований, изобразив их в эквивалентной и ионной формах.
источник