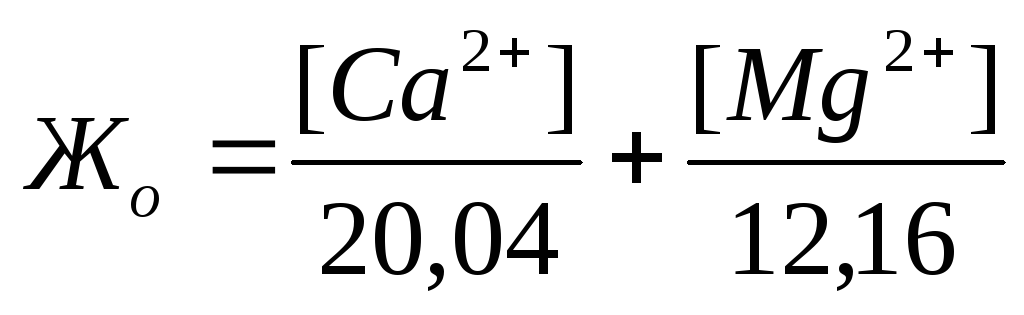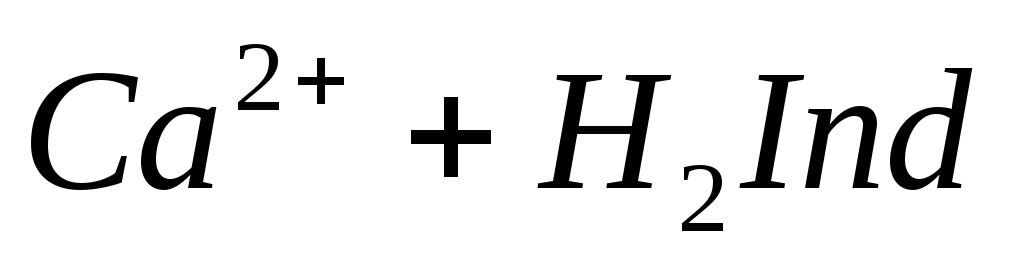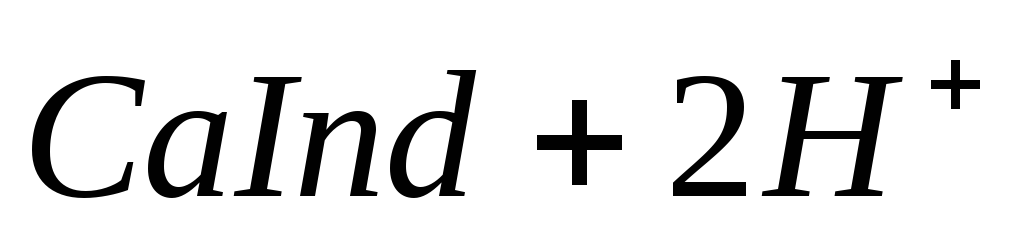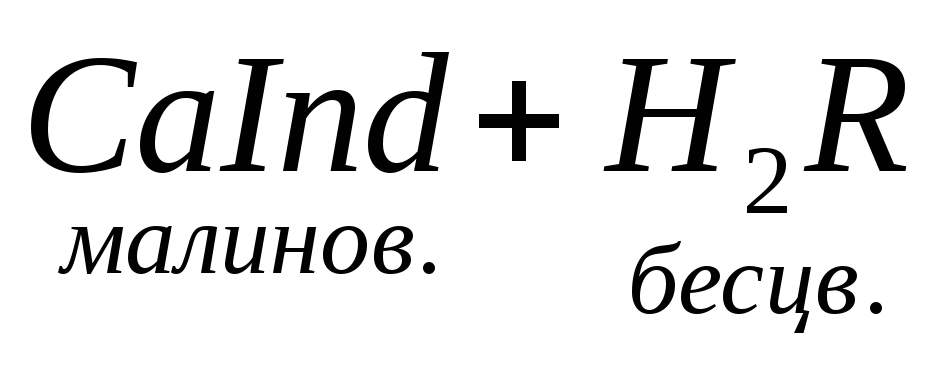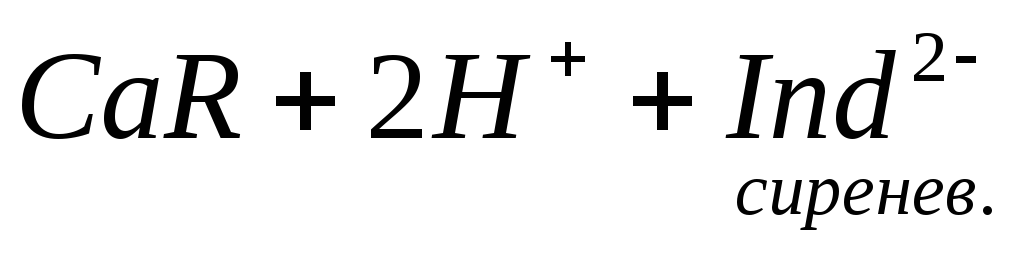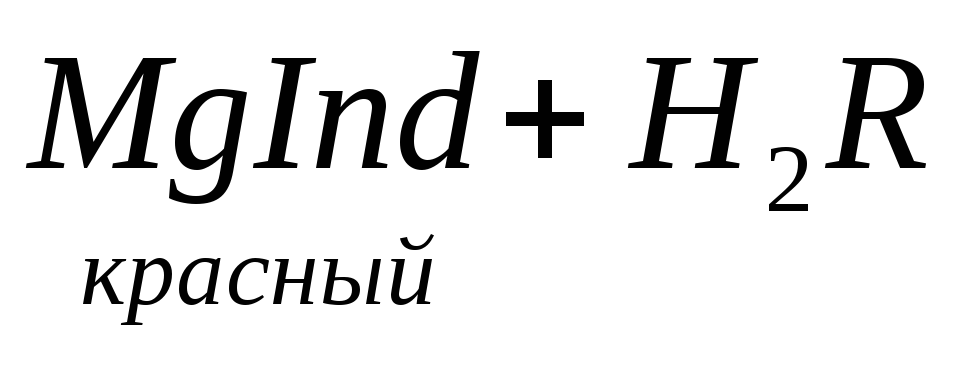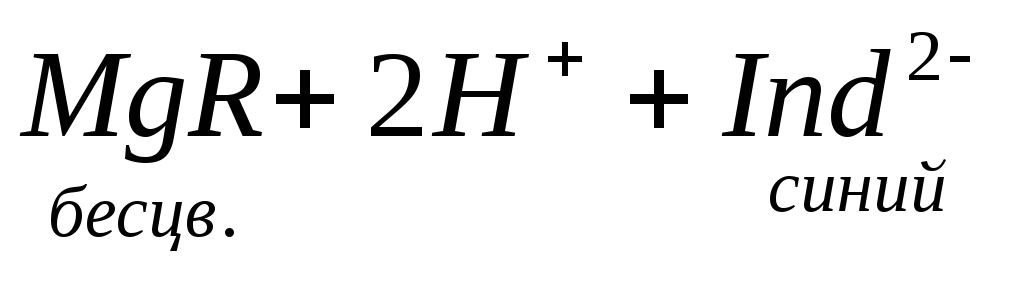Получив на руки анализ воды, обязательно нужно знать химические показатели, указанные в нем, т. к. от этого завист верный подбор фильтров для воды.
Активную реакцию воды определяет концентрация ионов водорода, находящихся в ней. Реакция эта может быть кислотной, щелочной или нейтральной и, как правило, выражается через отрицательный логарифм данной концентрации, обозначающийся как рН. При нейтральной реакции водородный показатель равен 7 (рН=7); рН (б)7 указывает на щелочную реакцию; рН (м) 7 обозначает кислую среду. Питьевая вода в соответствии с нормами СанПиН 2.1.4.559-96 должна иметь рН в диапазоне 6,0-9,0 единиц.
Жесткость воды является одним из важных показателей ее качества, и напрямую зависит от количества растворенных в ней солей кальция и магния. Выражается жесткость в мг-экв/л (миллиграмм-эквивалент на литр). Существуют три вида жесткости:
-карбонатная жесткость определяет концентрацию в воде гидрокарбоната кальция, разлагающегося при кипячении на углекислоту и нерастворимый карбонат. Карбонатная жесткость, также может называться временной жесткостью.
— постоянная жесткость является некарбонатной жесткостью, которая определяется концентрацией в воде солей кальция и магния, некарбонатного происхождения.
— общая жесткость является суммой временной (карбонатной) и постоянной (некарбонатной) жесткости.
Существует определенная зависимость между местонахождения источников воды и их жесткостью. Так, например, вода из поверхностных источников более мягкая (3-6 мк-экв/л), однако чем южнее, тем она становится жестче. Вода из подземных горизонтов имеет более высокую жесткость, величина которой зависит от глубины их залегания и годового количества осадков. Жесткость воды, находящейся между известковых водоупорных слоев, находится обычно выше 6 мг-экв/л. В соответствии с нормами СанПиН 2.1.4.559-96 питьевая вода должна иметь жесткость, не превышающую 7 мк-экв/л.
Общая щелочность воды выражается суммарными концентрациями анионов и гидратов слабых кислот (кремниевой, угольной, фосфорной и прочих). Под общей щелочностью подземных вод подразумевается, как правило, щелочность гидрокарбонатная – суммарное содержание гидрокарбонатов.
Воды большинства источников содержат хлориды. Обогащение вод хлоридами происходит в процессе вымывания хлорида натрия из горных пород. Хлорид натрия, известный нам как поваренная соль, является самым распространенным хлоридом на планете. Пробы воды с повышенным содержанием хлоридов и одновременного присутствия высоких концентраций аммиака, нитритов и нитратов, скорее всего, говорят о загрязнения источника неочищенными бытовыми стоками. ПДК (предельно допустимая концентрация) хлоридов в питьевой воде находится в пределах 300-500 мг/л (определяется стандартом).
Сульфаты, находящиеся в подземных водах, являются следствием присутствия гипса в водоупорных пластах. Слишком высокое содержание растворенных сульфатов в питьевой воде приводит к расстройствам желудка. Эффект слабительного, вызываемый приемом определенной дозы сульфатов, давно используют фармацевты. Так, всем известная «английская соль» представляет собой ничто иное, как сульфат магния, а «глауберова соль» – сульфат натрия. В питьевой воде общее содержание сульфатов не должно превышать 500 мг/л.
Азотосодержащие вещества являются результатом разложения в воде белковых веществ и мочевины, попадающих туда в результате загрязнения бытовыми стоками. Чаще всего – это ионы NO2-, NO3- и NH4. Первоочередным продуктом распада является аммонийный азот (аммиак). В природе ионы аммония, находящиеся в воде, окисляются бактериями рода Nitrobacter и Nitrosomonas до состояния нитратов и нитритов соответственно.
Присутствие в воде азотосодержащих веществ, а также их количество и соотношение, может рассказать о степени и давности загрязнений водоисточников продуктами жизнедеятельности человека. В результате употребления человеком воды с высоким содержанием нитратов и нитритов нарушается окислительная функция крови. Предельно допустимая концентрация нитратов в воде – 45,0 мг/л, нитритов – 3,0 мг/л, аммония – 2,0 мг/л.
Наличие большого количество фосфатов в воде указывает на ее загрязнение стоками промышленного происхождения, а также смывом с культивируемых полей, удобряемых фосфатами. Высокая концентрация фосфатов способствует бурному развитию сине-зеленых водорослей, которые после отмирания выделяют в воду токсины. ПДК фосфора в питьевой воде находится на уровне 3,5 мг/л.
Фториды и йодиды имеют некоторое сходство относительно влияния на качество воды. Недостаток или избыток фтора или йода в организме приводит к серьезным нарушениям эндокринной системы и, как следствие, к внутренним заболеваниям. При дефиците йода (суточное потребление менее 0,003 мг) развивается болезнь щитовидной железы и увеличением ее размеров. Похожие нарушения возникают и от переизбытка йода в организме, возникающем при его потреблении более 0,01 мг в сутки. Восполнить недостаток йода можно, используя вместо обычной поваренной соли – йодированную. Еще лучшие результаты достигаются обильным содержанием морепродуктов, а также морской капусты в рационе.
Дефицит фтора в питьевой воде со временем приводит к кариесу, а его переизбыток способствует развитию малокровья, рахита и флюороза – размягчение костной ткани. Таким образом, оптимальная концентрация фтора в воде должна находиться в пределах 0,7-1,2 мг/л. Если питьевая вода содержит фтора меньше оптимального уровня, то его дефицит можно восполнить, пользуясь зубными пастами, обогащенными фтором. Однако лучше всего фтор усваивается организмом, если растворен в воде.
Степень окисляемости воды отражает количественное содержание в ней органических веществ и может служить показателем загрязнения источников сточными водами, которые всегда богаты органикой. Различают два вида окисляемости: перманганатную и бихроматную (она же – химическая потребность в кислороде (ХПК)). Перманганатная окисляемость отражает концентрацию легкоокисляемой органики. Бихроматная окисляемость характеризует содержание в воде всех органических веществ. Количественные значения окисляемости и их соотношения могут косвенно отражать природу и происхождение органики, находящейся в воде, а также помогают определить рациональные способы ее эффективной очистки. Нормы СанПиН определяют максимально допустимую окисляемость – 5,0 мг О2/л.
Сухой остаток и общее содержание солей растворенных в воде определяют ее минерализацию, которая в соответствии с СанПиН 2.1.4.559-96 должна составлять не более 1000 мг/л (в сухом остатке).
Железо. Этот распространенный элемент присутствует в воде в нескольких видах:
— истинно растворенный вид – двухвалентное железо (вода не имеет цвета и взвеси);
— нерастворенный вид – трехвалентное железо (вода имеет механическую взвесь в виде коричневато-бурых частиц или хлопьев, которые оседают, оставляя воду прозрачной).
— коллоидный вид (опалесцирующая вода с оттенком ржавчины, которая не изменяется даже при продолжительном отстаивании);
— железобактерии – форма содержания железа, проявляющаяся как слизистая оболочка на внутренней поверхности водопроводных труб;
— железоорганика – встречается в виде солей железа и гуминовых кислот, придающих воде темно-оранжевый оттенок, но, не влияя на ее прозрачность.
В похожих модификациях встречается и марганец. Высокая концентрация и марганца, и железа придает воде металлический привкус, окрашивает белое белье при стирке, оставляет коричневые потеки на сантехнике. Использовать такую воду для питья и приготовления пищи нельзя, поскольку это приводит к накоплению обоих элементов в печени. В свою очередь, такая вода наносит ей больший вред, чем может нанести злоупотребление алкоголем. ПДК марганца в воде – 0,1мг/л; для железа – 0,3 мг/л.
Сероводород, находящийся в подземных водоносных горизонтах, чаще всего имеет неорганическое происхождение. Его образование происходит в процессе разложения кислыми водами сульфидных пород (серный колчедан, пирит), а также при восстановлении сульфатредуцирующими бактериями сульфатов. Сероводород имеет ярко выраженный запах протухших яиц. Он является сильнейшим каталитическим и общеклеточным ядом. Находясь в воде, сероводород также способствует усилению коррозийных процессов сантехнического оборудования и коммуникаций. Вследствие этих причин сероводород должен быть удален как из питьевой, так и из хозяйственно-бытовой воды в соответствии с ГОСТ 2874-82 «Вода питьевая».
В ходе диссоциации сероводорода и сульфидов в водной среде с показателем рН=9,0 (что является верхним пределом для питьевой воды) на долю сульфидов приходится около 98,5-99%, а это в 100 раз (!) больше, чем доля сероводорода. Это означает, что ПДК сульфидов в питьевой воде не должно превышать 0,3 мг/л. Однако СанПиН 2.1.4.559-96 для питьевой воды допускают концентрацию сероводорода до 0,003 мг/л, а сульфидов до 3 мг/л. Таким образом, действующие санитарные нормы, относительно содержания в питьевой воде сероводорода и сульфидов, можно считать химически не обоснованными.
Хлор используется для обеззараживания воды, и поэтому зачастую в ней присутствует. Уничтожение микроорганизмов происходит в результате окисления веществ в составе цитоплазмы живых клеток, отчего бактерии и вирусы гибнут. Пагубное воздействие хлора также заключается в замещении молекул веществ цитоплазмы. К хлору чувствительна вся патогенная микрофлора, включая возбудителей холеры, паратифов, брюшного тифа и дизентерии. Относительно малые дозы хлора способны дезинфицировать даже сильно зараженную воду. Однако речь не идет о 100% стерилизации, поскольку часть хлоррезистентных особей остается невредимой.
Концентрация остаточного хлора (не израсходованного в ходе обеззараживания воды) должна находиться в диапазоне 0,3 мг/л…0,5 мг/л. Он необходим для предохранения воды от повторного заражения в водопроводных сетях.
Растворенный кислород не присутствует в подземных водах. Поверхностные воды содержат его в количестве, соответствующем парциальному давлению, и зависящем от интенсивности процессов обеднения или обогащения кислородом, а также от их температуры. Количество кислорода в поверхностных водах может доходить до 14 мг/л.
Такие элементы, как натрий и калий, как правило, попадают в подземные воды в результате их вымывания из коренных пород. Залежи NaCl (поваренная соль), на месте которых находились древние моря, являются основным источником натрия, растворенного в природных водах. Калий присутствует в гораздо меньшем количестве, поскольку активно поглощается растениями, а также хорошо абсорбируется почвой.
Тяжелые металлы такие, как свинец, мышьяк, никель, хром, ртуть, а также цинк и медь преимущественно попадают в воду с техногенными стоками. Цинк и медь может присутствовать в воде, идущей по оцинкованным и медным водопроводам, если в ней присутствует в избытке агрессивная углекислота. Все тяжелые металлы имеют свойство накапливаться в организме, и при достижении критической массы пагубно влиять на него. ПДК цинка в питьевой воде равняется 5,0 мг/л; меди – 1,0 мг/л.
Присутствие алюминия в воде может объясняться ее загрязнением стоками предприятий, перерабатывающих бокситы. ПДК солей алюминия составляет – 0,5 мг/л.
Селен и бор в воде могут присутствовать, но в незначительных концентрациях. Наличие этих микроэлементов в превышающих дозах вызывает серьезные отравления.
источник
Выпускается в 7-ми различных вариантах исполнения — ручное или автоматическое управление, корпус из армированного пластика или нержавейки, есть вариант нержавеющего корпуса с нижним сливом для простоты консервации на зиму. Посмотреть все варианты исполнения фильтров
Анализ воды из скважины, колодца или водопровода сделать в лаборатории Санкт-Петербурге, стоимость экспертизы питьевой воды, где сделать, цена.
Согласно санитарным нормам питьевая вода должна быть безопасна в эпидемиологическом и радиационном отношении, безвредна по химическому составу, и иметь приятные органолептические свойства. Поэтому, целесообразно проверить качество воды из вашего источника — сделать анализ качества воды на соответствие требованиям санитарных норм и правил на питьевую воду. Для выбора системы очистки воды из скважины или колодца важно проверить воду не менее, чем по 15-ти основным показателям.
Требования (нормативы), которым должна соответствовать вода, изложены в санитарных нормах и правилах РФ (СанПиН) и международных нормативах Всемирной организации здравоохранения (ВОЗ), основные положения которых приведены в представленной ниже таблице. И так, рассмотрим основные показатели качества воды.
К органолептическим свойствам воды относят следующие характеристики: запах, привкус, цветность и мутность.
Запах и привкус воды объясняются присутствием в ней естественных или искусственных загрязнений. Природа запахов и привкусов очень различна, и может быть обусловлена как наличием в воде определенных растворенных солей, так и содержанием различных химических и органических соединений.
Кроме того, следует отметить, что запах и привкус может появиться в воде на нескольких этапах: из исходной природной воды, в процессе водоподготовки (в том числе в водонагревателе), при транспортировке по трубопроводам. Правильное определение источника запахов и привкусов — залог успешности их устранения.
Величина (интенсивность) запаха определяется по 6-ти бальной шкале. Например, запах тухлых яиц обусловлен наличием в воде сероводорода (Н2S), а также присутствием сульфатредуцирующих бактерий, вырабатывающих этот газ, а гнилостный запах обусловлен присутствием в воде природных органических соединений. Химические запахи (например, бензиновый, фенольный) указывают на антропогенный характер загрязнений.
Вкус воды обусловлен растворенными в воде природными веществами, каждое из которых придает воде определенный привкус:
- солоноватый — хлоридом натрия;
- горьковатый — сульфатом магния;
- кисловатый — растворенным углекислым газом или растворенными кислотами.
Приятный или неприятный вкус воды обеспечивается как наличием, так и концентрацией находящихся в ней примесей.
Под цветностью понимается естественная окраска природной и питьевой воды. Цветность косвенно характеризует наличие в воде некоторых органических и неорганических растворенных веществ и является одним из важных показателей, позволяющих правильно выбрать систему водоочистки.
Цветность воды определяется сравнением с растворами специально приготовленной шкалы цветности (на основе определенных концентраций хромово-кобальтового раствора) и выражается в градусах цветности этой шкалы. По требованиям к питьевой воде данный показатель не должен превышать 20 градусов.
Главными «виновниками» цветности воды, являются вымываемые из почвы органические вещества (в основном гуминовые и фульвовые кислоты). Повышенная цветность воды также может свидетельствовать о возможной ее техногенной загрязненности. Наличие гуминовых кислот может приводить к определенной биологической активности воды, повышает проницаемость в кишечнике ионов металлов: железа, марганца и др.
Показатель, характеризующий наличие в воде взвешенных веществ неорганического происхождения (например, карбонаты различных металлов, гидроокиси железа), органического происхождения (коллоидное железо и т.п.), минерального происхождения (песка, глины, ила), а также микробиологического происхождения (бактерио-, фито- или зоопланктона). Мутность выражается в мг/дм3.
Мутность также может быть обусловлена наличием на поверхности и внутри взвешенных частиц различных микроорганизмов, которые защищают их как от химического, так и от ультрафиолетового обеззараживания воды. Поэтому снижение мутности в процессе очистки воды способствует также значительному снижению уровня микробиологического загрязнения.
Химические показатели характеризуют химический состав воды. К данным показателям относят водородный показатель воды рН, жесткость и щелочность, минерализацию (сухой остаток), анионный и катионный состав (неорганические вещества), содержание органических веществ.
Показатель, характеризующий интегральную загрязненность воды, т.е. содержание в воде окисляющихся органических и неорганических примесей, которые в определенных условиях способны окисляться сильным химическим окислителем. К упомянутым выше загрязнителям относятся в основном органические вещества — для воды из поверхностных источников, и неорганические ионы (Fe 2+ ,Mn 2+ , и т.п.) — для воды из артезианских скважин.
Различают несколько видов окисляемости воды: перманганатную (ПМО), бихроматную, иодатную. Как видно из названий — при этом для проведения химического анализа воды используются соответствующие окислители. Показатель окисляемости — мгО2/л. Это количество миллиграмм кислорода, эквивалентное количеству реагента (окислителя), пошедшего на окисление веществ, содержащихся в 1 л воды.
Величина бихроматной окисляемости обычно используется для определения такого важного показателя воды как ХПК — химическая потребность в кислороде. ХПК используется для характеристики загрязненных природных поверхностных вод, а также для сточных вод. Этот показатель свидетельствует о степени биогенной загрязненности воды.
Бихроматная окисляемость позволяет получить значение наиболее полно характеризующее присутствие органических загрязнителей, за исключением таких химически инертных веществ как бензин, керосин, бензол, толуол и т.п. Считается, что при определении этого показателя окисляются до 90% органических примесей.
На практике для характеристики питьевой воды обычно используется показатель перманганатная окисляемость (ПМО) или перманганатный индекс (ПМИ). Чем больше значение ПМО, тем выше концентрация загрязнителей. Отметим, что величина перманганатной окисляемости ниже, чем значение, полученное для бихроматной примерно в 3 раза.
Водородный показатель или рН представляет собой логарифм концентрации ионов водорода, взятый с обратным знаком, т.е. pH = -logH + 1. Величина рН определяется количественным соотношением в воде ионов Н + и ОН — , образующихся при диссоциации воды. Если ионы ОН — в воде преобладают, что соответствует значению рН>7, то вода будет иметь щелочную реакцию, а при повышенном содержании ионов Н + , что соответствует рН + >+ HCO3 —
В зависимости от величины pH может изменяться скорость протекания химических реакций, степень коррозионной агрессивности воды, токсичность загрязняющих веществ и многие другие ее характеристики.
Обычно уровень рН для воды, используемой в хозяйственных и питьевых целях, нормируется в пределах интервала 6-9.
Эта величина характеризует количество растворенных неорганических и органических веществ. В первую очередь это сказывается на органолептических свойствах воды. Установлено, что до 1000 мг/л вода может быть использована для водопотребления.
Величина сухого остатка влияет на вкусовые качества питьевой воды. Человек может без риска для своего здоровья употреблять воду с сухим остатком до 1000 мг/л. При большем значении вкус воды чаще всего становится неприятным горько-соленым. Следует также отметить, что у воды с низким уровнем сухого остатка вкус может отсутствовать и употреблять ее тоже не очень приятно.
Этот показатель характеризует свойство воды, связанное с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния (так называемых «солей жёсткости»).
Вода с большим содержанием таких солей называется жёсткой, с малым содержанием — мягкой.
Численное выражение жёсткости воды — это концентрация в ней катионов кальция и магния. По ГОСТ Р 52029-2003 жесткость выражается в градусах жесткости (°Ж), что соответствует концентрации щелочноземельного элемента, численно равной 1/2 его моля, выраженной в мг/дм³ (г/м³) (1 °Ж = 1 мг-экв/л).
Различают временную (карбонатную) жёсткость, обусловленную гидрокарбонатами кальция и магния (катионов Ca 2+ и Mg 2+ и анионов HCO3—).
При кипячении воды гидрокарбонатные анионы вступают в реакцию с этими катионами и образуют с ними малорастворимые карбонатные соли, которые осаждаются на нагревательных элементах в виде накипи белого цвета, называемой в простонародии известью.
Временную жесткость можно устранить кипячением — отсюда и ее название.
Постоянная (некарбонатная) жесткость воды вызвана присутствием солей, не выпадающих в осадок при кипячении. В основном, это сульфаты и хлориды кальция и магния (CaSO4, CaCl2, MgSO4, MgCl2). Следует отметить, что именно присутствие соли CaSO4, растворимость которой с повышением температуры воды понижается, приводит к образованию плотной накипи.
Вода с высокой жесткостью наносит большой вред бытовым электронагревательным приборам, образуя накипь и тем самым вызывая их перегрев и разрушение, образует неприятные матовые налеты на сантехнике; в ней плохо пенятся мыло и шампуни, а поэтому увеличивается их расход.
Жесткая вода сушит кожу и вредит волосам; отрицательно влияет на качество приготовленной пищи, полезные вещества которой могут образовывать с солями жесткости плохо усваиваемые организмом соединения.
Жесткая вода вредна и для организма человека: увеличивается риск развития мочекаменной болезни, нарушается водно-солевой обмен.
Иногда в качестве характеристики встречается показатель «полная жесткость» воды, равный сумме постоянной и переменной (карбонатной) жесткости.
Его токсичное влияние на организм человека незначительно, но все же употребление питьевой воды с повышенным содержанием железа может привести к отложению его соединений в органах и тканях человека.
В общем случае в воде железо может встречаться в свободной форме в виде двух- и трехвалентных ионов:
Fe 2+ , как правило, в артезианских скважинах при отсутствии растворенного кислорода. Вода с повышенным содержанием такого железа может быть первоначально прозрачна (Fe 2+ ), но при отстаивании или нагреве приобретает желтовато-бурую окраску. Это происходит в результате окисления растворенного железа до Fe 3+ с образованием нерастворимых солей трехвалентного железа:
Fe 3+ — содержится в поверхностных источниках водоснабжения в так называемом окисленном состоянии, и, как правило, в нерастворимом виде.
Существует еще одна форма присутствия железа в природной воде — это органическое железо. Оно встречается в воде в разных формах и в составе различных комплексных соединений трехвалентных ионов железа с растворенными неорганическими и органическими соединениями, и, главным образом, с солями гуминовых кислот — гуматами. Повышенное содержание такого железа наблюдается в болотных водах, и вода имеет бурое или коричневатое окрашивание.
Органические соединения железа, как правило, растворимы или имеют коллоидную структуру (коллоидное железо) и очень трудно поддаются удалению. Коллоидные частицы из-за своего малого размера и высокого поверхностного заряда, который не позволяет частицам сближаться и препятствует их укрупнению, предотвращая образование конгломератов, создают в воде суспензии и не осаждаются, находясь во взвешенном состоянии и, тем самым, обуславливают мутность исходной воды.
На вкус такая вода имеет характерный неприятный металлический привкус, образует ржавые подтеки. Присутствие в воде коллоидного железа способствует развитию железистых бактерий, что еще больше ухудшает вкусовые качества воды и вызывает отложение осадка на внутренней поверхности трубопроводов и санитарно-технического оборудования вплоть до их полного засорения.
Марганец входит в состав многих ферментов, гормонов и витаминов, которые влияют на процессы роста, кровообразование, формирование иммунитета. Однако, повышенное его содержание в воде может оказывать токсический и мутагенный эффект на организм человека.
Вода с повышенным содержанием марганца обладает металлическим привкусом. Его присутствие приводит к значительно более быстрому износу бытовой техники и систем отопления, поскольку он способен накапливаться в виде черного налета на внутренних поверхностях труб с последующим отслаиванием и образованием взвешенного в воде осадка черного цвета. Кроме того, повышенное содержание марганца приводит к образованию черных пятен на посуде, белом белье при стирке, окрашивает ногти и зубы в серовато-черный цвет.
Также существуют «марганцевые» бактерии, которые, как и «железистые» бактерии, могут развиваться в такой воде и становиться причиной зарастания и закупорки трубопроводов.
Показатель, чаще всего характеризующий наличие в воде органических веществ животного или промышленного происхождения. Источниками азота аммонийного являются: животноводческие фермы, хозяйственно бытовые сточные воды, сточные воды с сельскохозяйственных угодий, предприятий пищевой и химической промышленности.
Указанные соединения являются главным образом продуктами распада мочевины и белков. Лимитирующая величина показателя «аммонийный азот» — токсикологическая. По нормам СанПиН содержание в воде аммония не должно превышать 2,0 мг/л.
К микробиологическим показателям безопасности питьевой воды относят общее микробное число, содержание бактерий группы кишечной палочки (общие колиформные бактерии и колифаги), споры сульфитредуцирующих клостридий и цисты лямблий.
В зависимости от характеристик водного источника с целью безопасности воды могут проверяться и такие показатели, как паразитологические и радиологические.
Анализ качества питьевой воды производится исходя из норм показателей по требованиям нормативных документов государств.
В таблице представлены нормативы основных показателей качества по санитарным нормам СанПиН Российской Федерации, указанные в столбце 3 — СанПиН 2.1.4.1074-01 «Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения» и столбце 4 — СанПиН 2.1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников».
Именно по этим показателям следует проверить качество воды из вашего источника и оценить необходимость установки дополнительного оборудования для очистки воды.
Для сравнения приведены нормативы Всемирной организации здравоохранения (ВОЗ).
источник

Это характеристики, определяющие ее потребительские свойства и влияющие на органы чувств (обоняние, осязание, зрение). К ним относятся: запах, мутность, цвет, вкус.
Часть этих характеристик, такие как вкус и запах определяются, субъективно, — путем экспертизы. Другие характеристики определяются инструментально.
Запах воды оценивают по пятибалльной системе со следующими градациями:
- 1 балл — очень слабый запах (практически не различимый
- 2 балла — слабый запах, который заметен, лишь тогда, когда обращают внимание
- 3 балла — легко заметный запах
- 4 балла — отчетливо выраженный запах
- 5 баллов — сильный запах, делающий воду не пригодной для употребления.
- Ноль баллов это полное отсутствие каких-либо запахов.
Вкус воды характеризуется как: соленый, кислый, сладкий, горький. Вкусовые ощущения, не попадающие под вышеперечисленные, считаются привкусом. Оценка вкуса производится аналогично оценке запаха — по пятибалльной шкале. Оценки вкуса: 1 балл — очень слабый 2 балла — слабый 3 балла — заметный 4 балла — отчетливый 5 баллов — очень сильный. Цвет воды определяют фотометрическим способом.
Для информации. Фотометрический способ определения цвета воды заключается в сравнении проверяемой воды с эталонной, имеющей стандартный природный цвет.
Для оценки цвета существует специальная шкала цветности, имеющая градации от нуля до 14.
Мутность воды определяют аналогичным образом.

Минерализация. Минерализация показывает суммарное количество растворенных в воде химических веществ. Другое название минерализации – солесодержание, т.к. растворенные в воде вещества находятся в виде солей некоторых кислот.
К применению человеком рекомендуется вода, верхний предел минерализации которой не превышает 1000 мг/л. Вода с низким солесодержанием пресная и безвкусная. Величина минерализации влияет на величину отложений в резервуарах, осадков и накипи в бытовых и промышленных нагревательных приборах.
Жесткость — это свойство, приобретенное водой в результате растворения в ней солей кальция и магния. Различают:
- общую жесткость — сумму карбонатной (временной) и некарбонатной (постоянной) жесткости, т.е. содержание ионов кальция и магния
- карбонатную жесткость – показывающую наличие гидрокарбонатов и карбонатов (при рН>8.3) кальция и магния. Карбонатную жесткость можно устранить путем кипячения, поэтому ее называют временной жесткостью
- некарбонатную жесткость — показывающую наличие магниевых и кальциевых солей таких кислот, как серная, азотная и соляная.
При кипячении некарбонатная жесткость не устраняется, поэтому она и называется постоянной жесткостью. За единицу жесткости воды принят моль на кубический метр (моль/м3). Окисляемость перманганатная — это величина, показывающая наличие в воде органических и минеральных веществ, окисляемых сильным химическим окислителем. Единицей измерения перманганатной окисляемости служит количество (в миллиграммах) кислорода, израсходованного на окисление этих веществ, содержащихся в 1 дм3 воды.

Водородный показатель pH определяет количественное соотношение ионов H+ и гидроксила OH- в воде, при ее разделении. Значение водородного показателя для воды хозяйственно-питьевого назначения от 6,0 до 9,0 ед. При pH 7,0 вода щелочная, а при pH 11), приобретает неприятный запах, вызывает раздражение слизистой оболочки глаз и кожного покрова.
Для информации. Параметры воды, соответствующие нормам СанПиНа можно получить, только применяя приборы очистки воды.

Нормативы качества питьевой воды, поступающей как из наружных, так и внутренних водопроводных сетей, должны соответствовать санитарно — гигиеническим нормативам, утвержденным ГОСТом 2874-82 и СанПином 2.1.4.559-96.
источник
Требования, предъявляемые к качеству воды, могут быть самыми различными и определяются её целевым назначением. Для оценки качества пластовых, природных и сточных вод их образцы подвергают анализу. На основании результатов анализа делаются выводы о пригодности воды для конкретного вида потребления, возможности применения тех или иных методов очистки. Анализы подземных вод позволяют прогнозировать сопутствующие месторождения полезных ископаемых. При анализе вод для характеристики их свойств определяют химические, физические и бактериологические показатели. Основными показателями, определяющими пригодность воды для определенной отрасли народного хозяйства, являются химические, так как физические (содержание взвешенных частиц, температура, цвет, запах, плотность, сжимаемость, вязкость, поверхностное натяжение) и бактериологические (наличие бактерий) показатели зависят от химического состава воды.
К химическим показателям качества воды относятся:
состав растворенных газов.
Общее солесодержание характеризует присутствие в воде минеральных и органических примесей, количество этих примесей в виде общей минерализации, сухого и плотного остатков. Общая минерализация представляет собой сумму всех найденных в воде анализом катионов и анионов. Минерализацию выражают в миллиграмм-эквивалентах солей, находящихся в I л воды, или в процентах, то есть числом граммов растворенных веществ, содержащихся в 100 г раствора. Сухим остатком называется суммарное количество нелетучих веществ, присутствующих в воде во взвешенном, коллоидном и растворенном состоянии, выраженное в мг/л. Сухой остаток определяют путем выпаривания пробы воды, последующего высушивания при 105 о С и взвешивания. Плотный остаток – это сухой остаток, определенный из профильтрованной пробы воды. Следовательно, разница двух показателей соответствует содержанию взвешенных веществ пробы. Если сухой остаток прокалить при температуре 500-600 о С, то масса его уменьшится и получится остаток, называемый золой. Уменьшение массы происходит за счет сгорания органических веществ, удаления кристаллизационной воды, разложения карбонатов. Потери при прокаливании приближенно относят за счет органических примесей.
Жесткость воды обусловливается наличием в ней ионов Са 2+ и Mg 2+ . Для большинства производств жесткость воды является основным показателем её качества. В жесткой воде плохо пенится мыло. При нагревании и испарении жесткой воды образуется накипь на стенках паровых котлов, труб, теплообменных аппаратов, что ведет к перерасходу топлива, коррозии металлов и авариям.
Жесткость количественно выражается числом миллиграмм-эквивалентов ионов кальция и магния в 1 л воды (мг-экв/л); 1 мг-экв/л жесткости соответствует содержанию в воде 20,04 мг/л ионов Са 2+ или
12,16 мг/л ионов Mg 2 + . Различают жесткость общую, карбонатную и некарбонатную.
Карбонатная жесткость связана с присутствием в воде в основном гидрокарбонатов и карбонатов кальция и магния, которые при кипячении воды переходят в нерастворимые средние или основные соли и выпадают в виде плотного осадка:
Таким образом, при кипячении карбонатная жесткость устраняется. Поэтому она называется также временной жесткостью. Следует сказать, что при переходе HCO3 – в CO32 – и при выпадении карбонатов кальция и магния в воде остается некоторое количество ионов Са 2+ , Mg 2+ , CO32 – , соответствующее произведению растворимости СаСО3 и (MgOH)2CO3. В присутствии посторонних ионов растворимость этих соединений повышается.
Некарбонатная (постоянная) жесткость не разрушается кипячением. Она обусловливается присутствием в воде кальциевых и магниевых солей сильных кислот, главным образом сульфатов и хлоридов.
Общаяжесткость воды представляет собой сумму карбонатной и некарбонатной жесткости и обусловливается суммарным содержанием в воде растворенных солей кальция и магния. По величине общей жесткости принята следующая классификация природных вод:
Если известны концентрации (мг/л) в воде Ca 2+ , Mg 2+ и HCO3 – , то жесткость рассчитывается по следующим формулам:
Общая жесткость
Карбонатная жесткость равна концентрации (мг/л) [HCO3– ]; в случае, если содержание ионов кальция и магния в воде выше, чем количество гидрокарбонатов:
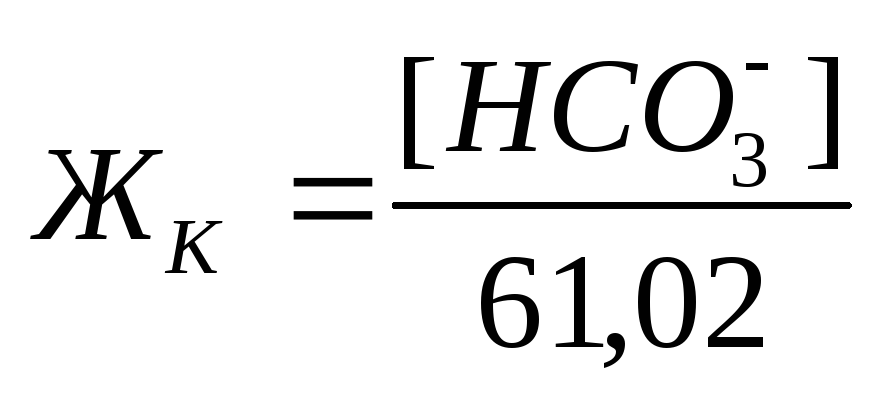
Если же количество гидрокарбонатов в воде превышает содержание ионов кальция и магния, то карбонатная жесткость соответствует общей жесткости. Разность между общей и карбонатной жесткостью составляет некарбонатную жесткость: ЖНК= ЖО– ЖК . Следовательно, ЖНК – это содержание Ca 2+ и Mg 2 + , эквивалентное концентрации всех остальных анионов, в том числе и некомпенсированных гидрокарбонатов.
Окисляемость характеризует содержание в воде восстановителей, к которым относятся органические и некоторые неорганические (сероводород, сульфиты, соединения двухвалентного железа и др.) вещества. Величина окисляемости определяется количеством затраченного окислителя и выражается числом миллиграммов кислорода, необходимого для окисления веществ, содержащихся в 1 л воды. Различают общую и частичную окисляемость. Общую окисляемость определяют обработкой воды сильным окислителем – бихроматом калия K2Cr2O7 или йодатом калия KIO3. Частичную окисляемость определяют по реакции с менее сильным окислителем – перманганатом калия КMnO4. По этой реакции окисляются только сравнительно легко окисляющиеся вещества.
Для полного окисления содержащихся в воде органических веществ, при котором происходят превращения по схеме
требуется количество кислорода (или окислителя в расчете на кислород), называемое химическим потреблением кислорода (ХПК) и выражаемое в мг/л.
При любом методе определения ХПК вместе с органическими веществами окисляются и неорганические восстановители, содержащиеся в пробе. Тогда содержание неорганических восстановителей в пробе определяют отдельно специальными методами и результаты этих определений вычитают из найденного значения ХПК.
Реакция среды характеризует степень кислотности или щелочности воды. Концентрация водородных ионов природных вод зависит главным образом от гидролиза солей, растворенных в воде, количества растворенных угольной кислоты и сероводорода, содержания различных органических кислот. Обычно для большинства природных вод величина рН изменяется в пределах 5,5-8,5. Постоянство рН природных вод обеспечивается наличием в ней буферных смесей. Изменение значения рН свидетельствует о загрязнении природной воды сточными водами.
Определение иона Cl – . В основу определения иона хлора положен аргентометрический метод Мора. Принцип анализа заключается в том, что при прибавлении к воде раствора AgNO3 образуется белый осадок хлорида серебра:
Определение хлорид-ионов ведут в интервале рН = 6,5 ÷ 10, чтобы одновременно с AgCl не выпадал осадок Ag2CO3. Проведению определения Сl – мешает наличие в воде ионов брома, йода, сероводорода, от которых освобождаются предварительной обработкой воды.
Определение иона SO42– . Метод определения сульфат-ионов основан на малой растворимости сульфата бария, количественно выпадающего в кислой среде при добавлении к воде раствора хлорида бария: Ba 2+ + SO42– = BaSO4↓
По массе образовавшегося осадка рассчитывают содержание иона SO42– .
Определение ионов CO32– и HCO3– . Эти ионы определяют титрованием пробы воды растворами серной или соляной кислот последовательно с индикаторами фенолфталеином и метилоранжем. Реакция нейтрализации протекает в две стадии.
Первые порции кислоты вступают в реакции с карбонат-ионом, образуя гидрокарбонат-ион:
Окраска фенолфталеина при рН = 8,4 переходит из розовой в бесцветную, что совпадает с таким состоянием раствора, когда в нем остаются лишь гидрокарбонаты. По количеству кислоты, пошедшей на титрование, рассчитывают содержание карбонат-иона. Расход кислот на титрование с фенолфталеином эквивалентен содержанию половины карбонатов, т.к. последние нейтрализуются только наполовину до HCO3 – . Поэтому общее количество CO32 – эквивалентно удвоенному количеству кислоты, затраченной на титрование. При дальнейшем титровании в присутствии метилоранжа происходит реакция нейтрализации гидрокарбонатов:
Метилоранж меняет окраску при pH = 4,3, т.е. в момент, когда в растворе остается только свободный диоксид углерода.
При расчете содержания ионов HCO3 – в воде следует из количества кислоты, пошедшей на титрование с метилоранжем, вычесть количество кислоты, идущей на титрование с фенолфталеином. Общее количество кислоты, затраченной на нейтрализацию ионов ОН – , СО32– и НСО3– , характеризует общую щелочность воды. Если рН воды ниже 4,3, то её щелочность равна нулю.
Определение ионов Ca 2+ , Mg 2+ . Имеется несколько методов обнаружения и определения содержания ионов Са 2+ и Mg 2+ . При добавлении в воду оксалата аммония (NH4)2C2O4 в случае присутствия ионов кальция образуется белый осадок оксалата кальция:
После отделения осадка оксалата кальция в воде можно определить ионы Mg 2+ с помощью раствора гидрофосфата натрия Na2HPO4 и аммиака. При наличии иона Mg 2 + образуется мелкокристаллический осадок соли магния:
Полученные осадки прокаливают и взвешивают. На основании полученных результатов вычисляется величина кальциевой и магниевой жесткости.
Наиболее быстрым и точным методом определения Са 2 + и Mg 2 + является комплексонометрический метод, основанный на способности двунатриевой соли этилендиаминотетрауксусной кислоты (трилон Б)
N
образовывать с ионами кальция и магния прочные комплексные соединения.
При титровании пробы воды трилоном Б происходит последовательное связывание в комплекс сначала ионов кальция, а затем ионов магния. Содержание ионов кальция определяют, титруя воду в присутствии индикатора — мурексида. Мурексид образует с ионами кальция малодиссоциированное комплексное соединение, окрашенное в малиновый цвет.
Ионы магния не дают комплекса с мурексидом. Трилон Б извлекает Са 2+ из его растворимого комплекса с мурексидом, вследствие чего окраска раствора, изменяется на сиреневую:
По количеству трилона Б, расходуемого на титрование, определяют содержание Са 2 + . Титрованием пробы воды трилоном Б в присутствии индикатора хромогена черного определяют суммарное содержание Са 2 + и Mg 2 + , то есть общую жесткость воды. Вода, содержащая Са 2 + и Mg 2 + , в присутствии хромогена черного окрашивается в красный цвет вследствие образования комплекса с Mg 2 + . При титровании воды в точке эквивалентности происходит изменение цвета на синий вследствие протекания следующей реакции:
Содержание Mg 2+ вычисляют по разности между общим содержанием (Са 2+ + Mg 2+ ) и содержанием Са 2 + . Трилонометрическое определение каждого иона производится при том значении рН, при котором этот ион образует с трилоном Б соединение более прочное, чем с индикатором. Для поддержания заданного значения рН к титруемому раствору добавляют буферные растворы. Кроме того, поддержание заданной величины рН обеспечивает определенную окраску индикатора. Общую жесткость воды определяют при рН > 9, кальциевую – при рН = 12.
Определение ионов Na + , K + . Производится вычислением по разности между суммой мг-экв найденных анионов и катионов, поскольку вода электронейтральна:
С достаточно высокой точностью все присутствующие в воде катионы можно определить эмиссионной спектроскопией сухого остатка.
Растворенные в воде газы определяют химическими методами или газовой хроматографией.
Определение диоксида углерода производят титрованием пробы воды щелочью в присутствии индикатора–фенолфталеина:
Определение растворенного кислорода производится йодометрическим методом.
Для анализа в пробу воды поcледовательно добавляют раствор хлорида марганца и щелочной раствор йодида калия. Метод основан на окислении свежеполученного гидроксида двухвалентного марганца содержащимся в воде кислородом:
Количество образовавшегося в воде бурого осадка гидроксида четырехвалентного марганца эквивалентно количеству растворенного кислорода. При последующем добавлении к пробе соляной или серной кислоты четырехвалентный марганец вновь восстанавливается до двухвалентного, окисляя при этом йодид калия. Это приводит к выделению свободного йода, эквивалентного содержанию четырехвалентного марганца, или, что то же самое, растворенного кислорода в пробе:
Выделившийся свободный йод определяется количественно путем титрования раствором тиосульфата натрия:
I2+ 2Na2S2O3
Йодометрический метод определения растворенного кислорода неприменим для вод, содержащих сероводород, так как сероводород вступает во взаимодействие с йодом и занижает результат. Во избежание этой ошибки предварительно связывают содержащийся в пробе сероводород в соединение, не препятствующее нормальному течению реакции. Для этой цели обычно используют хлорид ртути (II):
Определение H2S. Прежде чем приступить к количественному определению сероводорода, определяют его качественное присутствие по характерному запаху. Более объективным качественным показателем служат свинцовые индикаторные бумажки (фильтровальная бумага, пропитанная раствором ацетата свинца). При опускании в воду, содержащую сероводород, свинцовая бумага темнеет, принимая желтую (малое содержание), бурую (среднее содержание) или темно-коричневую (высокое содержание) окраску.
В водных растворах сероводород присутствует в трех формах: недиссоциированный H2S, в виде ионов HS – и S 2 – . Относительные концентрации этих форм в воде зависят от рН этой воды и в меньшей степени от температуры и общего солесодержания.
Если анализируемая вода не содержит веществ, реагирующих с иодом, то сероводород и его ионы можно определить следующим образом.
В основе количественного метода определения H2S лежит реакция окисления сероводорода йодом:
К точно отмеренному подкисленному раствору йода, взятого в избытке по отношению к ожидаемому содержанию сероводорода, прибавляют определенное количество воды. Количество йода, израсходованное на окисление сероводорода, определяется обратным титрованием остатка йода тиосульфатом. Разница между количеством раствора тиосульфата, соответствующим всему количеству взятого для анализа йода, и количеством этого же раствора, затраченного на титрование остатка йода в пробе, эквивалентна содержанию сероводорода в исследуемой пробе.
источник
О чём расскажут результаты анализа воды? Как читать химический анализ питьевой воды? Как понимать термины и сокращения в анализах воды. Разновидности химического анализа воды и его назначение. Расшифровка и предельно-допустимые значения исследуемых показателей согласно действующим нормативным документам. Для непосвящённого человека результаты анализа воды напоминают шифровку. Чтобы понять, как читать химический анализ питьевой воды, необходимо разобраться в значении и особенностях всех составляющих.
Обычно в результате анализов указывается не только количество найденных веществ, но и их предельно допустимая концентрация. Сокращённое название этого показателя ПДК. В данном случае имеют ввиду самый большой объём компонента, при котором он не будет оказывать негативное влияние на человеческий организм при условии, что поступление данного элемента будет продолжаться на протяжении всей жизни человека. Также данные компоненты в предельно-допустимой концентрации не будут ухудшать условия водопотребления.
Обычно все предельно-допустимые концентрации тех или иных веществ оговариваются действующими нормативными документами, а именно ГОСТ 2874-82 и СанПиН 2.1.4.1074-01. Кроме этого при расшифровке результатов анализов можно руководствоваться рекомендациями Всемирной Организации Здравоохранения. Также в результатах обычно оговаривается класс опасности искомого компонента. Так, выделяют следующие классы опасности:
1 К – чрезвычайно опасные элементы:
2 К – высоко опасные составляющие;
4 К – вещества умеренной опасности.
Различные химические соединения способны оказывать разную степень токсичности. Все эти вещества, попадая в водную среду, могут оказывать разное токсическое действие на наш организм. В связи с этим есть ещё один показатель вредности составляющих водной среды. По этому признаку все элементы могут подразделяться на такие группы:
- Группа санитарно-токсикологических признаков, обозначаемая «с-т».
- Группа органолептических признаков. В данной группе даётся расшифровка воздействия компонента на те или иные органолептические показатели (сокращение «зап» говорит о способности вещества изменят запах водной среды, «окр» указывает на возможное изменение окраски, «пен» говорит о способности вещества вызывать пенообразование, сокращение «привк» указывает на изменения во вкусовых качествах при присутствии данного элемента, «оп» — это способность вещества вызывать опалесценцию).
Результаты анализа воды могут содержать единицу измерения КОЕ. Расшифровывается данная аббревиатура как колониеобразующие единицы. Данный показатель указывает на единичные бактерии и дрожжевые грибки, которые в состоянии создавать целые колонии в благоприятной среде через определённый промежуток времени.
Любой анализ воды может проводиться для получения достоверного результата о чистоте и качестве воды, а также для выбора подходящих мероприятий по её очистке. Так может выполняться несколько видов анализов:
- Расширенный химический анализ по 25 показателям.
- Сокращённый химический анализ по 12 компонентам.
Результаты расширенного химического анализа воды могут понадобиться в следующем случае:
- если требуется провести анализ химических составляющих воды;
- в ситуации, когда необходимо правильно подобрать оборудование для фильтрации;
- для проверки состояния воды после проведённой фильтрации;
- такой анализ позволит сделать выводы об эффективности фильтрующих установок;
- если требуется проверить воду на присутствие в ней вредных микроорганизмов.
Сокращённый анализ может заказать потребитель для проверки качества питьевой воды, также данный анализ позволяет оценить качество работы фильтров. Для точности проведения анализа отбор проб воды должен выполняться с соблюдением следующих условий:
- Воду нужно набирать либо в специально подготовленные пробирки, либо в чистые пластиковые бутылки от питьевой столовой воды.
- Перед тем как делается забор жидкости, ёмкость ополаскивается набираемой водой и из неё удаляются остатки воздуха.
- При транспортировке образец с водой лучше скрыть от попадания солнечных лучей на него. Также не рекомендуется транспортировать воду в тёплом месте. Иначе результаты анализов будут недостоверными.
- Тара с водой для анализа должна быть доставлена в лабораторию не более чем за 2-3 часа.
Обычно результаты анализов питьевой воды указываются по каждому показателю в цифрах и единицах измерения. Зная нормы по каждому показателю, вы сами можете сделать выводы о пригодности воды для питья. Если все показатели не превышают норму, то воду можно считать чистой и качественной. При превышении каких-то значений требуется провести дополнительную фильтрацию.
Показатели чистоты воды, нормируемые регламентирующими документами РФ
| источник Экология потребления. Наука и техника: Рассказ пойдёт о том, что загрязняет воду, как её чистят и почему я спокойно пью из родника, содержащего много нитратов. Последние пять лет я занимаюсь химическим анализом воды и нахожусь в контакте с инженерами по водоподготовке. К нам приходят самые разные люди: для одних система очистки воды — очень дорогое, но жизненно необходимое приобретение, другие просто начитались страшилок в Интернете и хотят «живую воду». Но для нас, как и для врачей, все наши заказчики одинаковы. У них есть вода — скважинная, поступающая из городского или поселкового водопровода, колодезная, речная — и её необходимо очистить до установленных норм. О том, что загрязняет воду, как её чистят и почему я спокойно пью из родника, содержащего много нитратов, пойдёт этот рассказ. Но никакие названия фирм, географические привязки и другая индивидуализирующая информация указываться не будут — я просто хочу поделиться пятью годами своих наблюдений за процессом, потому что много владельцев коттеджей могли бы меньше нервничать, если бы озаботились водоочисткой ещё на этапе заливки фундамента.
Тщательность, с которой вы выполните отбор пробы воды, в конечном счёте может существенно повлиять на цену установки. Вот общие рекомендации.
Далее по анализу инженерами подбирается и рассчитывается система водоочистки, и если вас устраивает коммерческое предложение и вы его оплачиваете — к вам выезжают монтажники с оборудованием. Монтажникам от вас потребуются вход, выход и дренаж — откуда брать воду, куда её подавать и куда сливать. Особое внимание следует уделить именно канализации. Если у вас яма и вы её откачиваете — позаботьтесь о том, чтобы она могла одномоментно принять на себя 2-3 кубометра воды без последствий. Почему? Фильтры пропускают через себя грязную воду, грязь оседает на фильтрующем материале. Со временем ёмкость фильтрующего материала исчерпывается и он нуждается в обратной промывке — током воды снизу вверх вся грязь с него смывается в канализацию. На одну промывку может уходить от ста литров до полутора кубометров воды, в зависимости от типа фильтра и уровня загрязнения. И всё это количество сольётся в дренаж минут за 20 для кабинетных фильтров и где-то за час для засыпных колонного типа.
Между прочим, если в Вашем септике применяется биологическая очистка, дренажная вода может убить её. Также монтажники потребуют с вас электрическую розетку поблизости (фильтры оснащены контроллерами — электронными управляющими мозгами, которые сами знают, когда пора начинать промывку). И ещё учтите, что эксплуатироваться любые фильтры должны при температуре не ниже +5 °C, а места занимают — в зависимости от модели — до двух квадратных метров по площади и до двух метров в высоту (хотя самый маленький фильтр со всей обвязкой может поместиться в кубический метр). Да, не забудьте про давление воды на входе! Если оно меньше 2-3 атмосфер — без повысительного насоса не обойтись. Для сравнения, системы горводоканалов обычно подают в квартиры воду под давлением около 4 атмосфер. На входе перед фильтрами ставят грубую очистку — сетчатые фильтры, механику до 20 мкм — чтобы защитить более дорогое оборудование от проскоков песка, ржавчины и других крупных частиц. На выходе после установки рекомендуется монтировать финишную доочистку (обычно уголь — удаляет запахи, хлор и мелкие частицы). В самой дорогой комплектации ещё могут присутствовать ультрафиолетовая лампа для обеззараживания на выходе и защита от протечек на полу, но всё это опции. А вот если Ваша вода содержит много железа, то инженер может спроектировать водоочистку с применением баков, которые занимают значительное пространство. А много железа — это сколько? Вот теперь можно поговорить о вещах, более близких к моей профессии. И начнём мы с единиц измерения. В России и за рубежом, как ни парадоксально, применяются совершенно разные единицы измерения, хотя химия одна и та же. У нас приняты мг/л и мг-экв/л, у них — ppm. мг/л (читается: миллиграмм на литр) — это масса исследуемых частиц, содержащаяся в одном литре раствора (а не растворителя!). Если мы исследуем ионный состав воды, то под массой частиц будет подразумеваться масса атомов одного вида. Например, 10 мг/л железа означает, что в 1 литре раствора у вас содержится 10 мг атомарного железа — того самого, у которого молярная масса, согласно таблице Менделеева, 56 г/моль. И не важно, в какой форме это железо — двухвалентный ион или трёхвалентный. Просто некая абстракция — железо, как оно есть в таблице Менделеева. А если мы измеряем содержание какой-то соли, то под массой частиц будет подразумеваться масса молекулы этой соли. Например, 10 мг хлорида натрия NaCl в 1 литре раствора. мг-экв/л (читается: миллиграмм-эквивалент на литр) — с этого момента начинается особая чёрная магия. Иеремия Рихтер, немецкий химик, открыл закон эквивалентов (и попутно портал в ад) в 1792 году. Закон гласит: вещества реагируют в количествах, пропорциональных их эквивалентам, или m1Э2 = m2Э1. Попробуйте найти химика, который приходит в восторг, считая эквиваленты! Мне такие маньяки пока не встречались, хотя я занимаюсь химией уже 14 лет. Начнём издалека. Возьмём обычную реакцию между мелом и соляной кислотой: Улетевший углекислый газ и воду отбросим, как несущественное, и выделим в этой реакции самое важное: Ca 2+ + 2Cl — = CaCl2 (в ионной форме) Теперь возьмём каждый из ионов и заставим его вступить в гипотетическую реакцию гидрирования с катионом водорода, невзирая на знак заряда (да, мы, химики, любим всякие извращения; а на самом деле — масса катиона водорода принята за единицу, и теперь нам нужно найти количество других ионов, эквивалентное этой единице). 1/2Ca 2+ + H + = CaH (фактор эквивалентности = 0.5, а эквивалент водорода — частица 1/2Ca 2+ ) Cl — + H + = ClH (фактор эквивалентности = 1, а эквивалент водорода — частица Cl — ) Итак, с одним катионом водорода может (условно) прореагировать либо один анион хлора, либо половинка катиона кальция. Численное выражение доли вещества, эквивалентной одному катиону водорода, называется фактором эквивалентности. Теперь мы можем сделать простой вывод: 1/2Ca 2+ = Cl — (1 эквивалент кальция = 1 эквиваленту хлора) Представим, что мы титруем щёлочность соляной кислотой (об этих страшных словах — позже). С соляной кислотой могут реагировать самые разные соли (гидрокарбонаты, карбонаты, гидроксиды. ) самых разных ионов (кальция, магния, натрия. ). Как нам всё это выразить в одной единице измерения? Мы не имеем права использовать здесь уже знакомую нам единицу измерения мг/л, потому что просто непонятно — миллиграмм чего? Кальция? Магния? Их смеси? В каком соотношении? Зато с эквивалентами эта проблема снимается сама собой: Cl — = 1/2Ca 2+ = 1/2Mg 2+ = Na + = 1/3Al 3+ и т.д. Нам не важно, какой именно вид катиона или аниона мы оттитровали, но мы знаем, что одному эквиваленту потраченной соляной кислоты всегда будет соответствовать один эквивалент неведомой штуки, которая с этой кислотой способна прореагировать. Хорошо, с эквивалентом более-менее разобрались. А что же такое миллиграмм-эквивалент? Это масса одного эквивалента в миллиграммах. Грубо — считается по таблице Менделеева как молярная масса, умноженная на фактор эквивалентности. Для приведённого выше отношения это будет выглядеть так: 35.45 мг Cl — = 20.04 мг Ca 2+ = 12.15 мг Mg 2+ = 22.99 мг Na + = 8.99 мг Al 3+ Заметьте, молярная масса, например, кальция равна 40.08 г/моль, но с 1 граммом водорода может прореагировать только половинка кальция — 20.04 грамма. Вот эта цифра — 20.04 — и будет грамм-эквивалентом кальция. Или миллиграмм-эквивалентом. Или микрограмм-эквивалентом. Эта единица удобна тем, что если мы когда-нибудь выясним, какое именно соединение прореагировало в той реакции с соляной кислотой, мы всегда сможем умножить количество миллиграмм-эквивалентов на массу одного эквивалента — и перевести таким образом миллиграмм-эквиваленты в обычные миллиграммы для конкретного соединения. Итак, мг-экв/л — это количество миллиграмм-эквивалентов вещества в одном литре раствора. ppm (читается: пи-пи-эм, parts per million) — число частиц на миллион. Показывает, сколько исследуемых растворённых частиц находится в одном миллионе частиц раствора (не растворителя!). Единица измерения применяется на Западе почти повсеместно. Соответствует нашему мг/л (потому что миллиграмм — это, вроде как, тоже миллионная часть от литра, при условии, что плотность раствора равна 1.00, но при таком разбавлении изменением плотности всё равно можно пренебречь). мкСм/см (читается: микросименс на сантиметр) — единица измерения удельной электропроводности воды. Берут два электрода, погружают в воду. На один подают известное количество тока, на втором измеряют, сколько дошло. Поскольку в водном растворе носителями заряда являются ионы, то по количеству перенесённых с одного электрода на другой электрончиков можно сделать вывод об общей доле ионов в растворе. Сименс — единица, обратная сопротивлению (1 См = 1 Ом -1 ). Измерение удельной электропроводности иногда может дать достаточно точное представление об общем солесодержании воды. Если вода относительно чистая, то условно можно считать, что 1 мкСм/см ≈ 0.5 мг/л солей. И вот мы вплотную подошли к сущности анализа воды. Тут надо отвлечься и уточнить, что видов анализов воды — масса. Навскидку, есть химический и микробиологический. А ещё органолептический, радиометрический, несть им числа. Я занимаюсь непосредственно химическим анализом воды, о нём и поговорим. В России документ, регламентирующий качество воды для хозяйственно-бытовых нужд, называется «СанПиН 2.1.4.1074-01». И контролируемых параметров там — тьма тьмущая. Здесь уместно отметить, что такого понятия, как «техническая вода», ни в одном официальном документе не существует. Более того, то, что обычно в простонародье подразумевают под технической водой — это как раз вода, которую можно пить, но нельзя использовать в той самой технике. Подчас на производство или в паровой котёл нужно подавать полностью обессоленную (деионизованную) воду. Смотреть в лаборатории все параметры, подразумеваемые СанПиНом — сумасшествие. Во-первых, на анализ одной пробы уйдёт тогда неделя (тогда как анализ по 12 показателям делается за 2 часа). А во-вторых, существующие фильтрующие материалы всё равно очищают воду только от конечного числа загрязнителей. И, конечно, большая часть указанных в СанПиНе загрязнителей практически не встречается в обычных природных водах или встречается в таком количестве, что заведомо проходит по нормам. Пойдём по порядку со всеми комментариями (по какому именно порядку — я ещё не решил). Железо. Есть практически во всех подземных водах, а вот в поверхностных — реках, озёрах — обнаружить его можно нечасто. Бывает в двух формах: растворимое, или двухвалентное Fe 2+ и окисленное, или трёхвалентное Fe 3+ . Соли двухвалентного железа прекрасно растворяются в воде (железный купорос FeSO4 ∙ 7H2O многие садоводы найдут в профильных магазинах), однако кислородом воздуха очень быстро окисляются и переходят в соединения трёхвалентного железа. А вот соединения трёхвалентного железа в воде не растворимы — ржавчину все видели, а ржавчина это смесь Fe2O3 ∙ nH2O и Fe(OH)3.
Поэтому в поверхностных источниках железа мало: оно если и было изначально, то быстро окислилось при контакте с атмосферой и ушло в ил. Помимо атмосферы, естественным врагом двухвалентного железа являются железобактерии, которые живут за счёт энергии, выделяемой при окислении ими двухвалентного железа. Зато у него есть верный союзник в виде сероводорода. В подземных водах часто содержится сероводород в большом количестве, а он является сильным восстановителем и не даёт железу окисляться даже при контакте с атмосферой. Вообще, зависимость формы железа в растворе от окислительно-восстановительного потенциала и водородного показателя наглядно отображена в диаграммах Пурбе. Железо является одним из микроэлементов и необходимо организму человека (суточная потребность — 10 мг ), и усваивается, в том числе, из воды. Конечно, содержание железа сказывается на органолептических свойствах воды (если его больше 1-2 мг/л), а избыточное его поступление в организм может спровоцировать разные отклонения в здоровье. Ну, это всегда так. Всё есть лекарство и всё есть яд, всё дело в дозе, сказал Парацельс. ПДК железа общего в воде хозяйственно-бытового назначения составляет 0.3 мг/л. В городском водопроводе с труб при ржавлении летит примерно 0.10. 0.15 мг/л (там, где я живу). Удаляют железо просто: сначала окисляют, чтобы наверняка (напомню, окисленное железо в воде не растворимо), затем полученные частички коагулируют (укрупняют), и всю эту конструкцию ловят механическим способом — на слое загрузки. Существуют разные каталитические загрузки, на поверхности которых все указанные процессы и происходят. Представляют они собой песок, покрытый слоем оксида марганца — того самого катализатора окисления железа — и нуждаются в периодической реагентной промывке раствором перманганата калия (нет, соединения марганца не смываются с загрузки и не попадают в очищенную воду — ну, если, конечно, вы не захотите смешать каталитический материал с лимонной кислотой). Есть и безреагентные загрузки, но перед ними требуется предварительное окисление железа, а уж каким способом — атмосферным воздухом, озоном или хлором — решит инженер. Если в Вашей воде железа до 5 мг/л — считайте, что Вам крупно повезло: установка будет подешевле. Если железа 10 мг/л — уже дорого. А вот 30 мг/л и выше — можете распрощаться с планируемой поездкой в тёплые страны. Такая установка может стоить несколько сотен тысяч рублей. Вообще, основная стоимость большинства полупромышленных систем фильтрации как раз зависит от концентрации железа. Чем его больше — тем дороже. Поэтому так важно тщательно пролить воду перед отбором пробы — застоявшаяся в металлических трубах вода может набрать железа, и инженер предложит вам по анализу такую установку, на которую у Илона Маска денег не хватит. Но и это ещё не всё. Отдельно стоит упомянуть про так называемое органическое железо — комплексные органические соединения, содержащие в составе молекулы атом железа (как правило, гуматы — комплексы гуминовых кислот). Выбить железо из таких комплексов нелегко, и оно не окисляется на воздухе. Удаление из воды органического железа может быть затруднительным. Марганец. От марганца на сантехнике появляется серый налёт, поэтому нормируют его жёстко. Организму человека этот микроэлемент тоже необходим (суточная потребность 2 мг [1] ). Из воды легко усваивается. Ещё содержится в свёкле и половине овощей вообще. Валентностей у марганца целых семь, подробно рассматривать не имеет смысла. Двухвалентный марганец хорошо растворим, трёх- и четырёхвалентный обычно подвергается гидролизу и выпадает в виде нерастворимых гидроксидов. В отличие от железа, марганец в поверхностных водах встречается чаще. Особенно если это колодцы, и в подземной воде, питающей их, содержится какой-нибудь двухвалентный ион марганца. Дело в том, что марганец так вот запросто атмосферным воздухом не окисляется. Может захватываться осаждающимся железом и удаляться совместно с ним. Загрузки все те же самые, ибо принцип тот же: окисление, укрупнение и механическая фильтрация. ПДК 0.1 мг/л. Жёсткость. Жёсткость замыкает тройку параметров, на которые нацелены почти все полупромышленные системы очистки воды. Да-да, есть фильтры-обезжелезиватели (удаляют железо, марганец и некоторые другие тяжёлые металлы) и фильтры-умягчители (удаляют жёсткость). Безусловно, есть другие типы фильтров, которые работают, например, по окисляемости, но в конечном итоге для промышленных нужд вам предложат обратный осмос с предочисткой, тогда вода на выходе будет как по ГОСТу для лабораторий: 3. 5 мкСм/см. Но мы отвлеклись. В школе вам рассказывали, что жёсткость — это совокупность ионов кальция и магния. Именно они выпадают в виде накипи при кипячении воды. На самом деле, такое определение не совсем корректно. Да, значительную долю жёсткости составляют ионы кальция и магния, но вообще жёсткость — это сумма всех щелочноземельных ионов, а также некоторых двухвалентных ионов тяжёлых металлов. Цинк, барий, кадмий, даже двухвалентное железо — это всё жёсткость. Другое дело, что химик в лаборатории будет маскировать ионы двухвалентного железа при измерении жёсткости. Зато кадмий вполне себе на величине жёсткости отразится. Но поспешу вас успокоить: ионов кальция в составе жёсткости большинство — как правило, процентов 80, и ещё процентов 15 магния. Нормируют жёсткость исключительно для снижения количества накипи в чайниках, а особо рьяно — в отраслевых стандартах для всяких котельных, где жёсткости в воде быть не должно вообще. Иногда вы можете услышать, что использовать в хозяйстве нужно исключительно мягкую воду, а жёсткая, якобы, вредна. Жёсткая вода увеличивает затраты на мыло, уменьшает срок жизни стиральной машинки… Вас могут начать убеждать, аргументируя тем, что кальций из воды всё равно не усваивается, и организм получает его из молока и сыра. Это некорректно. Давайте отвлечёмся и кратко поговорим о процессе скисания молока. В молоке содержится казеинат кальция и молочный сахар лактоза. Микроорганизмы, попавшие в молоко, начинают сбраживать лактозу, постепенно превращая её в молочную кислоту. Молочная кислота выбивает из казеината кальция кальций и замещает его на ион водорода. Казеинат кальция при этом превращается в казеин — белок молока, из которого целиком состоит творог. А кальций остаётся в сыворотке в виде лактата кальция. Так что творог и сыр кальцием бедны. А в натуральном свежем молоке — да, кальций есть. Но, чтобы усвоиться, он сначала должен быть выбит из казеината соляной кислотой желудка. В воде же кальций уже готовый — сразу в ионной форме, и усваивается мгновенно. Поэтому, вода — один из важнейших источников кальция в организме, а нужно нам его немало — суточная потребность составляет не менее 1000 мг. ПДК по жёсткости — 7 мг-экв/л. Если переводить это в кальций, то в воде может содержаться (7 ∙ 20.04) 140 мг/л кальция. Так что вам потребуется выпить 7-8 литров воды, чтобы получить суточную норму. Однако накипь начинает заметно образовываться уже при содержании жёсткости порядка 4 мг-экв/л. Ручное кусковое мыло — смесь натриевых солей высших жирных кислот — при контакте с жёсткой водой превращается в смесь кальциевых солей высших жирных кислот, а кальциевые соли мыла в воде растворяются плохо. Но сейчас производители добавляют в мыло умягчающие агенты — например, трилон Б, которые нивелируют этот процесс. Синтетические же моющие средства — порошки, гели и прочие лаурилсульфаты — вообще жёсткости не боятся и никак ею не осаждаются. Вывод? Пить полезно жёсткую воду (7 мг-экв/л согласно СанПиН), руки с мылом мыть в воде с содержанием жёсткости 2. 4 мг-экв/л, на стиральную и посудомоечную машины подавать мягкую воду (
Водородный показатель. Он же pH. На нём и будем закругляться. Представляет собой отрицательный десятичный логарифм из концентрации ионов водорода, индицирует кислотность среды. Нормируется в диапазоне 6-9 ед. pH. Более кислый раствор растворит вам зубы, более щелочной начнёт раздражать слизистую желудка. Очень важный параметр для подбора оборудования — многие загрузки работают в определённом диапазоне pH. В природных водах почти всегда находится вблизи отметки 7 ед. pH, в каких-то экстраординарных случаях инженер может предложить дозировать в воду щёлочь или кислоту для достижения заданного значения кислотности. В конце хочу добавить пару слов о типах фильтров. Я упоминал в тексте кабинетные системы и фильтры колонного типа. В сущности, это одно и то же. Есть некий баллон, внутри которого располагаются дренажно-распределительная система и фильтрующий материал. Только в кабинетных системах это всё зажато в небольшой объём и помещено в корпус размером со стиральную машинку. Из плюсов — меньший расход воды и реагентов на промывку, из минусов — один фильтрующий материал на все параметры. Фильтры колонного типа более гибкие в настройке — например, если кабинетник сразу удалит вам железо, марганец и жёсткость в ноль, и вы ничего с этим не сделаете, то, поставив последовательно две колонны — одну по железу, вторую по жёсткости — вы сможете регулировать выходную жёсткость воды так, чтобы вам было комфортно принимать душ (чтобы не было ощущения, будто мыло не смывается), при этом железа и марганца в очищенной воде не будет. Помните, что типоразмер баллона зависит от вашего водопотребления, и нельзя ставить самый маленький баллончик на расход воды в два кубометра в час. Просто начнутся проскоки загрязнений, и в конце концов вы убьёте фильтрующий материал. Фильтрующие материалы, к слову, обычно служат 5-7 лет, после чего их необходимо заменять. Но прежде рекомендую провести анализ воды на выходе, потому что я лично щупал фильтр, который исправно работает 11 лет на одной загрузке. Материал получился большой, можно почитать на ночь, чтобы быстрее заснуть и крепче спать. Я попытался объять необъятное, рассказал самую суть и сейчас дополню, разве что, про бактериологическую очистку. Есть всего один метод убить живность в воде — окислить её. Для этого в простейшем случае в воду будут дозировать хлор в виде гипохлорита или на выходе поставят ультрафиолетовую лампу. Ультрафиолет ионизирует растворённый в воде кислород, а активный кислород как раз и убьёт бактерии. Оптимальный вариант — озонатор. УФ-лампа или озонатор ставятся на выходе после всей очистки, непосредственно перед подачей воды потребителю, а хлор — наоборот, в начале. Потому что хлор более медленный окислитель и ему нужно дать время, а потом излишки хлора нейтрализовать на угольном фильтре. В водоочистке ещё очень много нюансов и подводных камней. Но… «Это неописуемо!» — сказала Моська, глядя на баобаб. опубликовано econet.ru Если у вас возникли вопросы по этой теме, задайте их специалистам и читателям нашего проекта здесь. Понравилась статья? Тогда поддержи нас, жми: источник |