Предназначены для определения определенного типа ионов в воде (Z.B. измерение концентрации [H] + (рН),Cl — ,F — ,Ca 2+ ,Na + ,K + и др.)
Методы основаны на использовании соотношении Нернста: 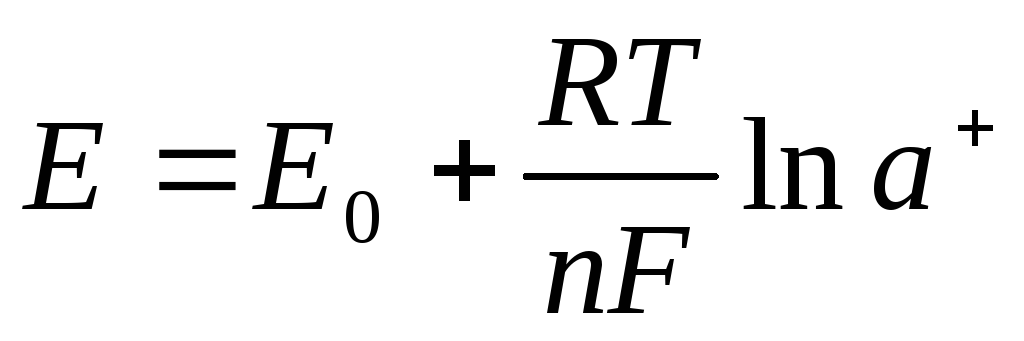
n– валентность иона, концентрация которого измеряется
f 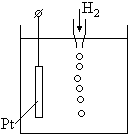
Потенциал нормального водородного электрода принят за ноль.
Платиновый электрод погружен в раствор с а = 1 (ионов Н + ) и подачей газообразного водорода к электроду. Считается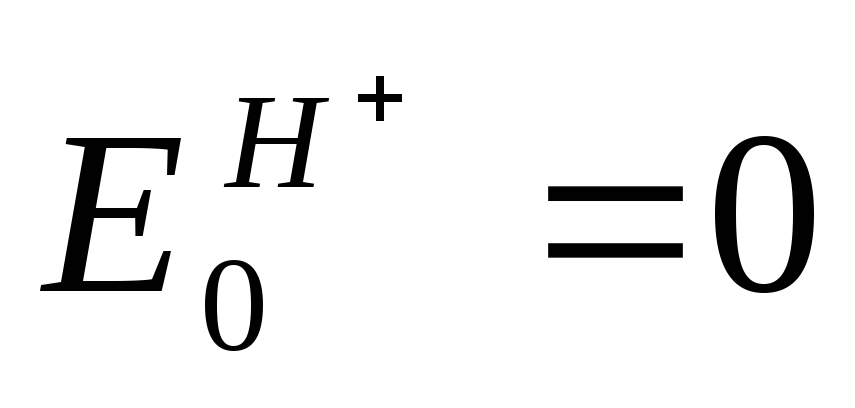
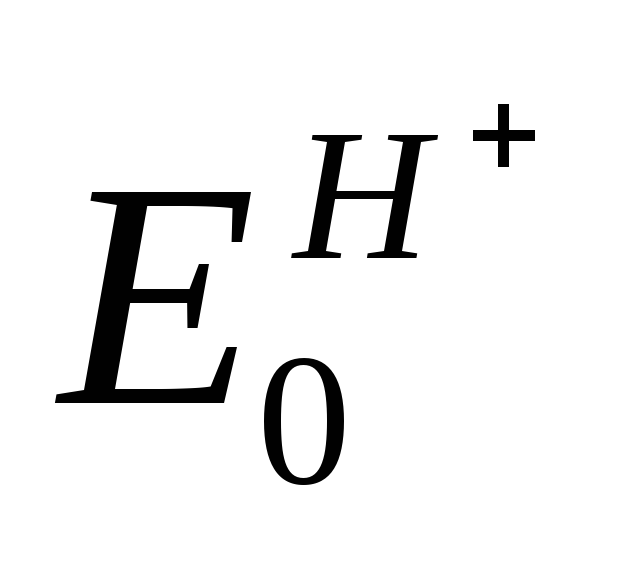
Уравнение Нернста справедливо для равновесных потенциалов. Равновесным считается потенциал электрода, когда скорости окисления и восстановления на нем равны.
В системе электродов равновесный потенциал, когда ток не протекает либо очень маленький (отсутствует поляризация).
I.ИЭ – измерительный электрод (стеклянный), потенциал которого являетсяf (рН)
ВЭ – вспомогательный хлор-серебряный электрод
Основным элементом ИЭ является чувствительная мембрана 1, которая выполнена из специального стекла
Е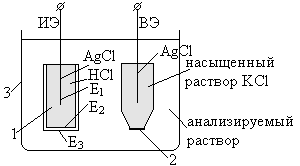
2 – полупроницаемая мембрана нужна для замыкания электрической цепи внутри анализируемого раствора, т.е. через нее пропускаются ионы К + иCl —
Практическое значение – координаты изопотенциальной точки используются в системе термокомпенсации рН-метров.
Зависимость потенциала ИЭ от рН называют водородной функцией:

2) сложная в обслуживании и эксплуатации конструкция стеклянного электрода
3) эти электроды не выдерживают измерение рН при высоких температурах.
I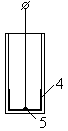
4 – амальгама на внутренней поверхности чувствительной мембраны
5 – точка контакта электрода
III.Полупроводниковая техника кампланарной технологии
1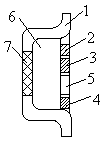
2 – измерительный электрод
3 – вспомогательный электрод
5 – аналогово-цифровой преобразователь (АЦП)
6 – область, заполненная хорошо проводящим гелем
7 –ионо-селективная мембрана (в данном случае к Н + )
: 1) невысокое внутренне сопротивление (
10 кОм) электродной системы
2) возможность передачи сигнала на значительное расстояние без существенных помех
Существует свыше 100 ионо-селективных электродов. Их селективность определяется типом или видом чувствительной мембраны.
Принцип действия такой же, как и определение рН.
Недостатки: 1) необходимость периодической очистки или смены чувствительной мембраны из-за загрязнений
2) достаточно высокая чувствительность к содержанию К + иNa + (только стеклянные электроды)
источник
Теоретические основы потенциометрического анализа окружающей среды. Электрохимические системы в равновесном состоянии. Аппаратурное оформление потенциометрии. Анализ методик лабораторных исследований, аппараты, реактивы и материалы для их проведения.
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Размещено на http://www.allbest.ru/
Министерство образования Российской Федерации
Саратовский государственный технический университет
Потенциометрический метод анализа состояния окружающей среды
Методические указания к выполнению лабораторных работ
по дисциплинам: «Технические средства и технологии контроля источников загрязнения» и «Экологический мониторинг»
для студентов специальности 280201.65
Составили: Собгайда Наталья Анатольевна
Ольшанская Любовь Николаевна
- 1.Теоретические основы потенциометрического анализа
- Сущность метода
- Электрохимические системы в равновесном состоянии
- Индикаторные электроды методов осаждения и комплексообразования
- Кривые потенциометрического титрования реакций осаждения и комплексообразования
- Индикаторные электроды метода окисления — восстановления
- Кривые потенциометрического титрования в окислительно-восстановительных реакциях
- 2. Аппаратурное оформление потенциометрии
- 3.Методики лабораторных исследований
- Исследование воздушной среды
- Анализ сточных вод производства пластификатора дибутилфталата методом потенциометрического титрования
- Определение непредельных соединений в сточных водах методом прямого потенциометрического титрования
- Определение меди в воде методом потенциометрического титрования
- Исследование полимеров
- Определение стирола в водных вытяжках из полимерных материалов методом прямого потенциометрического титрования
- Вопросы для самопроверки
- Литература
Применяется метод прямой потенциометрии и потенциометрическое титрование. Потенциометрический метод анализа используется для определения неорганических и органических соединений в различных объектах окружающей среды.
Потенциометрические методы анализа основаны на использовании зависимости электродвижущей силы электрохимической (потенциометрической) ячейки от концентрации (активности) определяемого вещества в анализируемом растворе. Простейшая потенциометрическая ячейка содержит два электрода: потенциал одного из них прямо или косвенно зависит от концентрации определяемого вещества — это индикаторный электрод (ИЭ); второй электрод (относительно которого измеряют потенциал (ИЭ) называют электродом сравнения.
Потенциометрические методы определения можно разделить на прямую потенциометрию (ионометрию) и потенциометрическое титрование. В ионометрии вначале по серии стандартных растворов строят калибровочную кривую или соответственно настраивают прибор (например, pH-метод), а затем по ЭДС потенциометрической ячейки с анализируемым раствором находят активность или концентрацию определяемого компонента. Наиболее часто метод прямой потенциометрии используется для определения pH-раствора. Для аналитических целей чаще используют потенциометрическое титрование.
Под потенциометрическим титрованием понимают любые потенциометрические методы определения веществ, использующих хотя бы однократное добавление к анализируемому раствору известного вещества (раствора), вне зависимости от того, происходит при этом химическая реакция или нет (методы добавок).
— использование электродноактивных титрантов позволяет определить вещества, для которых отсутствуют ионоселективные электроды.
потенциометрический анализ окружающая среда
Равновесный потенциал. Равновесный потенциал — величина электродного потенциала, возникшая на границе металл — раствор. Его зависимость от концентрации ионов металла в растворе выражается уравнением Нернста:
где Ex — потенциал металлического электрода при данной концентрации ионов металла в растворе; E — нормальный потенциал металлического электрода (при концентрации ионов, равной единице); CMe — концентрация ионов металла; R — газовая постоянная, R= 8,313 Дж; T — абсолютная температура; F — число Фарадея, F = 96500 K; n — заряд ионов металла. При потенциометрическом анализе используют уравнение (1), принимая температуру равной +25 0 C и подставляя соответствующие значения R и T с учетом коэффициента перехода от натуральных логарифмов к десятичным (2,3026). Тогда уравнение (1) будет иметь вид:
Окислительно-восстановительная система характеризуется определенным значением потенциала, фиксируемым платиновым электродом и зависящим от природы системы, от концентрации окисленной и восстановленной форм вещества:
где a, b и m ? соответствующие стехиометрические коэффициенты у окислителя, восстановителя и иона водорода из уравнения реакции; [H + ] — концентрация ионов водорода в анализируемом растворе.
Нормальные потенциалы. Для определения значения потенциала используют метод, основанный на сравнении потенциала одного электрода с потенциалом другого. В качестве эталона выбирают нормальный водородный электрод, представляющий собой платиновую пластинку, покрытую платиновой чернью, насыщенную водородом при нормальном атмосферном давлении и погруженную в раствор с активностью водородных ионов, равной 1 г-экв. Водород, адсорбированный платиной, ведет себя по отношению к водородным ионам в растворе так же, как металлический электрод по отношению к своим ионам. Установившееся равновесие соответствует уравнению
Потенциал водородного электрода условно принимают равным нулю, а любому другому электроду, измеренному по отношению к нему, приписывают потенциал, равный ЭДС гальванического элемента. Нормальным электродным потенциалом E называется потенциал электрода, погруженного в раствор соответствующей соли с активностью ионов в 1 г-экв, измеренный относительно нормального водородного электрода.
Заряд металлического электрода, стоящего в ряду активностей после водорода, будет отрицательным, до водорода — положительным.
Реальные потенциалы. В реальных условиях в ряде случаев значения нормальных потенциалов не могут служить для сравнения поведения систем. Обычно анализируемые растворы содержат кроме ионов, участвующих в окислительно-восстановительных реакциях, и ионы комплексообразователей, способных вступать во взаимодействие с окисленной или восстановленной формой вещества, оказывая влияние на величину окислительно-восстановительных потенциалов. Например, нормальный окислительно-восстановительный потенциал системы Fe 3+ /Fe 2+ равен +0,77 В; в присутствии цианид-ионов в результате комплексообразования электродный процесс окисления — восстановления осложняется:
и потенциал окислительно-восстановительной системы изменяется до +0,36 В.
Таким образом, реальный окислительно-восстановительный потенциал — потенциал, зависящий не только от свойств окислительно-восстановительной системы, но и от среды, в которой протекает реакция. В большинстве случаев его значение определяется экспериментально.
Электроды. Различают электроды первого и второго рода. Электроды первого рода — металл, погруженный в раствор соли этого же металла, образующий окислительно-восстановительную систему, в которой этот потенциал определяется только относительно концентрации катионов в растворе. К электродам первого рода относятся ртутные, серебряные, амальгамные, водородные и другие. Амальгамный электрод — металл, растворенный в ртути, обладает дополнительными преимуществами по сравнению с металлическим:
1) не реагирует с кислотами, так как водород на амальгаме выделяется с большим перенапряжением по сравнению с чистым металлом;
2) с ним быстрее устанавливается равновесие, чем с металлическим.
Электроды второго рода — металл, погруженный в раствор малорастворимой соли этого металла, содержащий избыток другой соли с одинаковым анионом, потенциал которого определяется концентрацией соответствующего аниона. К электродам второго рода относятся хлорсеребряный, каломельный и сурьмяный.
Электрод, реагирующий на изменение концентрации определяемого иона в растворе и заменяющий индикатор в условиях обычного титрования, называется индикаторным. Его потенциал определяется по отношению к неполяризуемому электроду, называемому стандартным, потенциал которого в процессе титрования постоянен и служит исключительно для определения потенциала индикаторного электрода. Последний выбирают в зависимости от типа реакций, лежащих в основе титрования, но во всех случаях его потенциал должен устанавливаться мгновенно соответственно концентрации титруемых ионов и не зависеть от наличия посторонних ионов.
Электроды, используемые для титрования кислот и оснований, являются индикаторными по отношению к концентрации ионов водорода. Мы рассмотрим два типа электродов: сурьмяный и стеклянный, которые, на наш взгляд, могут с успехом применяться в санитарно-химическом анализе для реакции нейтрализации и определения pH растворов.
Сурьмяный электрод Sb/Sb2O3 — электрод второго рода, составленный из металла и его малорастворимой окиси. Этот электрод используется для определения концентрации ионов водорода, так как металлический электрод в присутствии своего малорастворимого оксида выполняет функции водородного электрода.
Достоинства сурьмяного электрода:
— простота и удобство в обращении;
— возможность применения при анализе растворов кислот и щелочей;
— возможность применения при анализе растворов, содержащих электролитические яды — сульфиды, цианиды.
Недостаток сурьмяного электрода: не вполне обратимый электрод и измеряемые им потенциалы не вполне подчиняются уравнению Нернста.
Стеклянный электрод — стеклянный шарик диаметром 15 — 20 мм с толщиной стенок 0,06 — 0,1 мм, изготовленный из стекла, содержащего большое количество щелочных металлов — лития или натрия, и расположенный на конце стеклянной трубки. Если этот шарик заполнить раствором с определенным значением pH и опустить его в анализируемый раствор с другим значением pH, то на поверхности шарика возникает потенциал, величина которого изменяется соответственно разности pH между внутренним и внешним растворами. На поверхности стеклянного электрода устанавливается сложное равновесие, связанное со взаимной диффузией ионов водорода из раствора в стекло и ионов натрия или лития из стекла в раствор. Достоинства стеклянного электрода:
— на точность определения pH не влияет присутствие окислителей или восстановителей;
— на электрод не действуют яды, коллоиды и другие вещества, искажающие точность определений pH;
— позволяет работать с кислыми и щелочными растворами в широком диапазоне pH (от 0 до 12 — 13).
Недостатки стеклянного электрода:
1) нельзя использовать обычную потенциометрическую установку вследствие большого сопротивления электрода;
2) для усиления тока электродной пары со стеклянным электродом необходимо использовать струнные или зеркальные гальванометры или ламповые усилители;
3) при работе обнаруживается явление — «потенциал асимметрии стеклянного электрода».
Когда обе поверхности стеклянного электрода соприкасаются с растворами, концентрации водородных ионов в которых одинаковы, на внутренней и внешней поверхностях электрода возникают разные потенциалы. Это свидетельствует о различии в свойстве внутренней и внешней поверхностей стеклянного электрода из легкоплавкого стекла с большой электропроводностью, очень тонкими стенками и периодическим выдерживанием в воде, в слабощелочном буфере и в буфере с pH, равным pH внутреннего раствора стеклянного шарика. Чем больше потенциал асимметрии, тем менее устойчивы показания pH.
Кривые потенциометрического титрования реакции нейтрализации — изображение изменения pH раствора. Отдельные точки кривой титрования можно рассчитать по формулам для вычисления pH раствора соответствующих электролитов. При вычислении pH раствора сильных кислот или оснований, пренебрегая ионной силой раствора, концентрацию ионов H + или OH — можно приравнять к общей концентрации кислоты или щелочи.
Для вычисления pH слабых кислот и оснований, а также растворов их солей, подвергающихся гидролизу, необходимо учитывать соответствующие константы диссоциации:
для соли слабой кислоты и сильного основания
Электрод, опущенный в анализируемый раствор, должен быть индикаторным по отношению к концентрации ионов водорода. На поверхности такого электрода устанавливается равновесие (4).
Потенциометрическое титрование в методе нейтрализации находит ограниченное использование для целей санитарно-химического анализа. Ограничимся только изображением кривых потенциометрического титрования 0,1N раствора HCl 0,1N раствором NaOH с хингидронным электродом и кривых потенциометрического титрования 0,1М раствора Na2CO3 1N раствором HCl.
При этом изменением объема в процессе титрования пренебрегают, так как это не оказывает существенного влияния на значения потенциалов и характеристики кривых.
Другой тип электродов, используемых при осаждении и комплексообразовании, — это металлические электроды, покрытые труднорастворимой солью того же металла: хлористосеребряные, сернистортутные и т.п., образующие в системе следующие системы, определяющие их потенциалы:
источник
Потенциометрический (электрометрический) метод определения величины pH воды со стеклянным электродом более универсален и точен. Большинство серийных рН-метров позволяет производить измерения с точностью 0,05—0,02 единицы pH. Он пригоден для анализа вод с широким диапазоном минерализации и содержащих окрашенные и взвешенные вещества.[ . ]
Потенциометрический метод основан на определении изменения потенциала электрода, реагирующего на изменение концентрации ионов в исследуемом растворе. Потенциал электрода зависит и от типа электрода, выбор которого определяется областью применения потенциометрического титрования. Первоначально анализ заключался в получении кривых потенциометрического титрования, которые адекватно отражали процесс нейтрализации либо осаждения при больших концентрациях определяемых ионов. Затем потенциометрический метод получил новое развитие в направлении автоматизации измерений и обработки данных титрования с помощью ЭВМ. Применение методики накопления анализируемых элементов на пленочном ртутном электроде при заданном потенциале позволило резко снизить их предел обнаружения. Потенциометрический метод применяют для определения оксидов углерода, серы, аммиака, сероводорода, меркаптана, электроактивных элементов и галогенид-ионов.[ . ]
Анализ развивающихся инструментальных физико-химических методов определения ХПК приведен в работе [165]. Из него следует, что основная направленность физико-химических методов сводится к определению непрореагировавшего бихромата калия с помощью ИК-спектрометров, фотометрических и электрохимических анализаторов. Высокая чувствительность предлагаемых методов, безусловно, позволит внедрить их в практику определения ХПК при условии сокращения продолжительности определений. Чаще всего объектами контроля при исследовании буровых стоков являются мутные и окрашенные воды и фильтраты. Это накладывает ограничение на применение фотометрического метода определения вышеуказанного показателя. Наиболее применяемым является потенциометрический контроль за расходом окислителя, который в принципе дублирует унифицированную методику и дает хорошую корреляцию данных с теоретически рассчитанным значением окисляемости [99].[ . ]
Потенциометрические методы анализа (как и другие электрохимические методы) основаны на процессе электролиза анализируемых веществ в электрохимической ячейке. Однако, в отличие от рассмотренной выше полярографии (см. раздел 5), в основе потенциометрического метода анализа лежит измерение равновесного потенциала электрода, возникающего в анализируемом растворе, и определение его зависимости от активности (концентрации) определяемого иона [14, 16].[ . ]
При анализе относительно концентрированных сточных вод (а иногда и разбавленных) используют титриметрические методы анализа с применением как цветных индикаторов для фиксирования конца титрования, так и специальных приборов — электрохимических (потенциометрическое титрование, ампёрометрическое, кондуктометрическое и т. п.) и оптических (турбидиметрическое титрование, нефелометрическое, колориметрическое). Титриметрические методы часто применяют для определения анионов, особенно тогда, когда одновременно присутствуют разные анионы, мешающие определению друг друга (см. разд. 10).[ . ]
При анализе воздуха иногда необходимо установить pH и содержание солей в пробах, полученных с помощью поглощения исследуемой газовой фазы простейшей адсорбционной средой (водой), для того, чтобы определить, например, концентрацию некоторых кислот или щелочей в тумане или количество солей, таких, как хлористый натрий в суспензии. Потенциометрическое титрование применяется, например, для анализа воздуха, содержащего сульфиды или меркаптаны. В этом методе индикатор заменен электродвижущей силой, возникающей между стандартным и индикаторным электродом. Оба эти метода образуют часть того раздела аналитической химии, который в настоящее время называется «электро-аналитической химией».[ . ]
Идея потенциометрического анализа возникла в 90-х годах прошлого столетия. Однако наибольшее распространение эти методы получили приблизительно с 1920 г.[ . ]
Принцип анализа. Метод основан на изменении э.д.с. в зависимости от состава исследуемого раствора. Сумму сульфата и сульфита натрия определяют прямым потенциометрическим методом. Для определения сульфита натрия используют метод окислительно-восстановительного потенциометрического титрования.[ . ]
Химические анализы почв выполняли общепринятыми методами (Агрохимические методы исследования почв, 1965; Аринушкина, 1970).[ . ]
Фтор в аэрозольной форме собирают на стекловолокнистом фильтре, а в газообразной — путем пропускания воздуха (от 80 до 100 м3) через 1 л 2%-ного раствора NaOH. Фильтр обрабатывают 200 мл 2%-ного раствора NaOH, а затем объем экстракта доводят до 400 мл. Полученный экстракт (10 мл) смешивают с 10 мл буферного раствора и анализируют фторид-селективным электродом с мембраной из трифторид-лантана, имеющим мостиковый электрод сравнения из галогенида серебра, заполненный 3 М раствором КС1. Для заполнения мостика применяют 10%-ный раствор KN03. Если концентрация алюминия в анализируемом воздухе оказывается выше 20 мг/м3, раствор образца разбавляют. Результаты измерений показывают, что потенциометрический метод оказался менее дорогим при затратах времени на один анализ в 5 раз меньше по сравнению с методом ионной хроматографии.[ . ]
Эффективным методом определения фторид-ионов является потенциометрический метод с ионоселективным электродом. Его применяют в анализе природных вод. Однако рекомендовать его для анализа сточных вод, особенно сложного состава, пока нельзя.[ . ]
В связи с тем что методы осаждения и комплексообразования играют важную роль в санитарно-химическом анализе, мы сочли необходимым ознакомить читателя с двумя типами электродов: серебряными и ртутными, образующими в растворе солей серебра и ртути системы Н§/Нйз+; Ag/Ag+ . С помощью последних можно потенциометрически определить концентрацию ионов серебра и ртути, а также концентрации тех ионов, которые с серебряными и ртутными ионами образуют труднорастворимые соли и комплексы[ . ]
Физико-химические методы—фотоколориметрия, потенциометрическое титрование и другие все больше и больше приме няются в практике санитарно-промышленного анализа.[ . ]
Электрохимический метод газового анализа основан на использовании химических сенсорных датчиков, состоящих из двух чувствительных элементов и определенного химического покрытия, которое непосредственно контактирует с анализируемой средой и на котором происходит адсорбция анализируемого вещества. В зависимости от того, какие физические свойства, зависящие от количества адсорбированного вещества, измеряются, датчики делятся на потенциометрические, кулонометрические, полярографические и др.[ . ]
Среди электрических методов измерения с целью непрерывного анализа растворов потенциометрический способ отличается особой простотой и занимает важное место, например, при анализе воды (для характеристики концентрации ионов водорода и окислительно-восстановительного процесса). Однако при непрерывном анализе состава воздуха данный метод до сих пор имел весьма небольшое значение. Причина этого заключается в том, что измеряемые потенциалы мало специфичны по отношению к некоторым веществам, чтобы удовлетворять требованиям анализа состава воздуха. Другая трудность, которая, правда, имеет место и при колориметрическом анализе, заключается в логарифмической зависимости между измеренной разностью потенциалов и искомой концентрацией вредного вещества, что затрудняет обработку результатов измерений.[ . ]
Наряду с нефелометрическими методами анализа применяют элек-трофотометрический, потенциометрический, полярографический.[ . ]
Для питьевой воды и природных вод эти методы описаны в ГОСТе [0-2] и в ряде монографий [0-15; 0-16; 0-23; 0-69; 0-17]. Для определения металлов в водных растворах — в питьевой воде и сточных водах — наряду с химическими применяются физические и физико-химические методы: полярографический, спектрографический, спектрофотометрический, хроматографический, флуориметрический, атомно-абсорбционный, масс-спектрометрический, потенциометрический, амперометрический и многие другие в разных их модификациях [77, 0-10; 0-1; 0-24; 83]. Электрохимическими методами анализа-в водных растворах определяют металлы (по 150—200 проб в день с высокой чувствительностью) [0-50]. По данным [0-10], обычно используемые весовые и объемные методы определения неорганических веществ в водных растворах недостаточно чувствительны. Для определения каждого металла приходится его отделять от остальных металлов и различных примесей. Эти методы трудоемки и требуется много времени для анализов. Современные физические методы очень чувствительны и точны, не требуют удаления примесей, создают возможность быстрого определения и автоматизации анализа [0-33].[ . ]
Для агрономических целей химическому анализу подвергаются почвы, растения, удобрения, поливные и грунтовые воды. Исследуемый материал предварительно подготавливают к анализу — высушивают, растирают, просеивают. Иногда анализируют не все вещества, образующие данный материал, а лишь некоторые его составные части, извлекаемые тем или иным реагентом. Многие количественные определения проводят весовым или объемным методом. Но часто пользуются различными физико-химическими методами анализа: колориметрическими, пламенно-фото-метрическими, оптическими, потенциометрическими, кондуктометр ическими и др. В основе их лежит зависимость тех или иных физических свойств растворов от концентрации определяемых веществ.[ . ]
Описываемые в справочнике физико-химические методы исследования объектов окружающей среды классифицированы соответственно используемым свойствам системы: хроматографическим, электрохимическим и оптическим. К хроматографическим методам относятся хроматография на бумаге и в тонком слое, газовая и газожидкостная хроматография, к электрохимическим — полярографический, амперометрический, кондуктометрический, кулонометрический и потенциометрический методы анализов, а также ионометрия, к оптическим — фотоколориметрический, нефелометр ический, турбидиметрический, рефрактометрический и люминесцентный методы.[ . ]
Определение окисляемости природных буровых вод методом потенциометрии (446). Определение салициловой кислоты в сточных водах методом потенциометрического титрования (448). Анализ сточных вод производства пластификатора дибутилфталата методом потенциометрического титрования (448). Определение додекалак-тама (ДДЛ) в сточных водах методом потенциометрического титрования (449). Определение непредельных соединений в сточных водах методом прямого потенциометрического титрования (450). Определение меди в воде методом потенциометрического титрования (451).[ . ]
Для определения бора предложено два фотометрических метода— с карминовой кислотой и с куркумином. Описанный во многих руководствах метод непосредственного титрования комплекса борной кислоты с маннитом дает вполне удовлетворительные результаты только при анализе относительно чистых растворов. В анализе сточных вод он оказался малопригодным (как при титровании с индикатором, так и при потенциометрическом титровании) из-за большого числа различных мешающих веществ. Влияния эти могут быть устранены предварительной отгонкой бора в виде его борнометилового эфира, но в таком варианте метод слишком сложен в выполнении.[ . ]
Четвертый том содержит сведения по аналитической химии (методы разделения; весовой, объемный и газовый анализ; потенциометрический, полярографический, колориметрический и другие методы анализа), по эмиссионному спектральному анализу, фотометрии пламени, спектрам поглощения неорганических и органических соединений. Приводятся также данные о показателях преломления жидкостей и оптической активности органических соединений.[ . ]
Многие количественные определения проводят весовым или объемным методом. Но часто пользуются при этом различными физико-химическими методами анализа: колориметрическими, пламенно-фотометрическими, оптическими, потенциометрическими, кондуктометрическими, хроматографическими и др. В основе их лежит зависимость тех или иных физических свойств растворов от концентрации определяемых веществ.[ . ]
Важным аспектом прикладной электрохимии является использование электрохимических методов анализа природных и сточных вод (кулонометрия, полярография, амперометрическое и потенциометрическое титрование, изотахофорез и др.). Электрохимические методы анализа используют закономерности электрохимических явлений. Такие преимущества этих методов, как быстрота, высокая точность, надежность, экономичность, возможность полной автоматизации процессов отбора проб и проведения анализов в небольшом объеме жидкости, делают незаменимыми электрохимические методы анализа при осуществлении контроля за технологическими процессами водоочистки и наблюдении за состоянием поверхностных источников. Методами электрохимического анализа определяют отдельные элементы, ионы или вещества, некоторые общие характеристики воды, например такие, как удельная электропроводность, pH, ЕЙ, химическое поглощение кислорода (ХПК), биохимическое потребление кислорода (ВПК), жесткость воды и др.[ . ]
Настоящие методические указания устанавливают методику количественного химического анализа атмосферного воздуха для определения в нем содержания аминофенилуксусной кислоты в диапазоне концентраций 0,05—0,5 мг/м3 методом потенциометрического титрования.[ . ]
Для определения аммиака, пиридина, ионов аммония широко используют кондуктометрические и потенциометрические методы анализа.[ . ]
Для определения микроколичеств токсических веществ в воздухе наибольшее применение нашли оптические методы, особенно фотометрический метод в видимой области спектра. Из электрохимических методов применяют полярографический, реже кондуктометрический и потенциометрический. Для разделения и определения сложной смеси компонентов постепенно внедряются различные виды хроматографического анализа.[ . ]
Определение величины ХПК не требует специальных приборов, но занимает много времени. Были предложены различные ускоренные варианты метода, а также методы анализа очень мало загрязненных вод. В настоящей статье рассматривать подробности всех этих вариантов мы не будем, отметим лишь, что предлагаемые приемы (увеличение концентрации серной кислоты для ускорения реакции, переход на колориметрическое окончание взамен титриметрического, применяемого при определении малых величин ХПК) достигают цели. Однако при использовании сер-ной кислоты (больших концентраций) требуется периодическое сравнение получаемых результатов с результатами, которые дает стандартный метод, и введение необходимых поправочных коэффициентов. Разработаны и автоматические методы определения величин ХПК с различными окончаниями: потенциометрическим, газометрическим и др.[ . ]
В прямой потенциометрии определяют значение электродного потенциала, вычисляя затем концентрацию определяемого иона в растворе. В объемном методе анализа при потенциометрическом титровании цветной индикатор заменяют металлическим электродом. Окончание реакции определяется по резкому изменению электродного потенциала в эквивалентной точке — скачок потенциала.[ . ]
В том случае, когда надо определить количество отдельных сахаров или групп сахаров (гексозы и пентозы), отделив их от других редуцирующих веществ, применяют хроматографический метод. Анализ этим методом состоит из двух частей: 1) разделение редуцирующих веществ с помощью хроматографии на бумаге и 2) определение количества сахара, выделенного на бумажной хроматограмме, колориметрическим методом или эбу-лиостатическим потенциометрическим методом.[ . ]
Обязательные определения, которые следует выполнить на месте отбора проб, следующие: температура, pH, растворенный кислород, агрессивная С02. Определения, которые выполняют немедленно по получении проб сточных или речных вод в лаборатории, следующие: цвет, запах, прозрачность по стандартному шрифту, pH (по цветной шкале или потенциометрически, если почему-либо он не был определен на месте), кислотность или щелочность (титрованием с фенолфталеином и метиловым оранжевым), объем осадка (%), грубодисперсные примеси общие. Остальные определения, такие как солевой состав (сухой остаток общий), грубодисперсные примеси’прокаленные, ионы тяжелых металлов, хлориды, сульфаты и т. п., могут быть выполнены позже. Для определения цианидов и фенолов пробы в отдельных бутылках фиксируют щелочью из расчета 5 мл насыщенного раствора КОН на 0,5 л сточной воды. Методы химического анализа промышленных сточных вод опубликованы в специальной литературе [33, 78, 79].[ . ]
источник
58. Фотометрические методы анализа сточных вод. Потенциометрия и потенциометрическое титрование. Вольт амперометрические методы.
Фотометрический. Измеряет поглощение света анализируемым раствором обычно после введения в него реактива, реагирующего с определенным компонентом сточной воды с образованием интенсивно поглощающего свет соединения. Приборы: Источник света – светофильтр – кювета с раствором – детектор. Конструкция прибора зависит от области спектра применения. Излучение выбирают такое, что бы соединение имело max светопоглощение, а примеси – min. Достоинства – широкая область применения, высокая чувствительность. Недостатки: калибровка аппаратуры, посуды.
Потенциометрия и потенциометрическое титрование. Потенциометрия основана на измерении небольших равновесных напряжений между электродами гальванической ячейки. Метод можно применять для установления активности веществ в растворе (прямая потенциометрия) и для нахождения точки эквивалентности при титриметрических определениях (потенциометрическое титрование). Прямая ПМ находит применение при определении рН растворов, а также многих ионов с использованием ионоселективных электродов. В анализе природных вод и питьевой воды ионоселективные электроды применяют для определения кадмия, меди, свинца, серебра, щелочных металлов, бромид-, хлорид-, цианид-, фторид-, иодид- и сульфид-ионов.
Вольт амперометрические методы анализа. Это совокупность методов исследования кривых ток-потенциал и их зависимостей от электродных реакций и концентраций определяемых веществ. Один из основных ВАМ методов – полярография. Метод заключается в получении и анализе кривых ток-потенциал на ртутном капельном электроде. Методом полярографии можно определить любые вещества, способные к эл-хим превращениям на электродах. Качественная информация следует из значения потенциала полуволны (φ1/2), количественная – из определения высоты волны (id).
Типичная полярографическая волна, используемая для качественного и количественного определения электродно-активных веществ.
59. Методы очистки сточных вод: механические, физико-химические: фильтрация, адсорбционный метод, обратный осмос.
Механические методы: наиболее доступные приемы очистки от крупнодисперсных взвесей, применяются как первая стадия в общей схеме очистки сточных вод. Применяется для подготовки сточных вод к более глубокой очистки.
Физико-химические методы: флотация, коагуляция, ионный обмен, сорбция, электрохимические методы, магнитная обработка, экстракция. В большинстве случаев использование физико-химических методов выделения загрязняющих веществ из сточных вод позволяет в дальнейшем рекуперацию.
Фильтрация. Фильтрование – пропускание воды через слой различного зернистого материала (гранитный щебень, кварцевый песок) или сетчатые, барабанные фильтры и микрофильтры. Применение без добавления хим. реактивов. Фильтры – устройства, в которых очистка жидкости от частиц твердой фазы происходит в процессе протекания через перегородку, имеющую поры (разность значения давления по обе стороны перегородки. Сетчатые фильтры (из ткани или металлической сетки) – для механической задержки больших частиц. Волокнистые фильтры (из фильтровальной бумаги, специального картона), их действие сводится к инерциальному осаждению, прилипанию частиц к выступам, седиментации. Зернистые фильтры (кварцевый песок, дробленый шлак, гравий, антрацит), бывают однослойные и многослойные. Фильтрование под вакуумом – для очистки маловязких жидкостей.
Адсорбционные методы основаны на поглощении примесей твердыми телами с развитой поверхностью, адсорбентами. Поглощаемые молекулы удерживаются на поверхности твердых тел силами Ван-дер-Ваальса (физическая адсорбция) или химическими силами (хемосорбция). Стадии адсорбции: перенос молекул газа к внешней поверхности твердого тела; проникновение молекул газа в поры твердого тела; собственно адсорбция. Адсорбция рекомендуется для очистки газов с невысокой концентрацией вредных компонентов. Адсорбированные вещества удаляют из адсорбентов с помощью десорбции инертным газом или паром. Преимущество: высокая степень очистки. Недостатки: “чистые” (сухие и без пыли) газы, небольшая скорость. Адсорбенты – материалы высокоразвитой внутренней поверхностью (природные и синтетические) : активированные угли, силикагели, алюмогели, цеолиты, иониты. В качестве адсорбентов применяются активированные угли, силикагели, алюмогели, цеолиты, иониты.
Обратный осмос (гиперфильтрация) – непрерывный процесс молекулярного разделения растворов путем их фильтрования под давлением через полупроницаемые мембраны, задерживающие полностью или частично молекулы или ионы растворенного вещества.
источник
ТЕМА 7. Методическое обеспечение ЭАК: потенциометрические методы анализа природных вод.
7.1. Теоретические основы потенциометрических методов
7.2. Электроды в потенциометрическом анализе. Мембранные ионоселективные электроды (ИСЭ).
7.3. МВИ концентрации фторид-иона потенциометрическим методом с ионоселективным электродом.
Потенциометрические методы анализа основаны на измерении ЭДС гальванического элемента. Схема гальванического элемента:
Электрод, посылающий электроны во внешнюю цепь, называется отрицательным электродом (анодом). Электрод, принимающий электроны из внешней цепи, называется положительным электродом (катодом).
На одном из электродов (отрицательном) протекает процесс окислении, на другом (положительном) – процесс восстановления. При замыкании внешней цепи в результате протекания пространственно разделенной окислительно-восстановительной реакции (токообразующей реакции) возникает «поток электронов, переходящий по одному общему пути» – электрический ток. Если во внешнюю цепь включить измерительные устройства (амперметр или вольтметр), то можно измерить величину тока или разность потенциалов (ЭДС), возникающие в гальваническом элементе.
Поскольку общая токообразующая реакция распадается на две частные реакции, каждая из которых протекает на отдельном электроде, то ЭДС гальванического элемента можно представить в виде алгебраической суммы двух электродных потенциалов:

Экспериментально можно определить общее значение ЭДС, но не потенциалы каждого из электродов в отдельности. Для устранения неопределенности величин электродных потенциалов ввели дополнительное условие. В качестве такого дополнительного условия принимается, что потенциал какого-либо электрода равен нулю и к нему относят значения потенциалов всех других электродов. В настоящее время наибольшее распространение получила условная водородная шкала, в которой за нуль потенциала выбран потенциал водородного электрода с активностью водородных ионов, равной единице, и летучестью газообразного водорода 1 атм. В водородной шкале за нуль принят стандартный потенциал водородного электрода.
 |
Введение водородной шкалы позволило приписать потенциалам различных электродов определенные числовые значения и сравнивать их между собой. Стандартный электродный потенциал некоторого электрода – это ЭДС гальванического элемента, составленного из этого электрода и стандартного водородного электрода, электродный потенциал которого принят равным 0 (нулю).
Из общего уравнения для электродного потенциала (уравнение Нернста ):

следует, что при заданной температуре величина потенциала любого электрода 


Компонентами, участвующими в токообразующей реакции, могут быть ионы, молекулы растворителя, твердая фаза (металл, оксид металла, малорастворимое соединение металла). При этом в уравнение для электродного потенциала (2) не входят те компоненты, концентрация которых постоянна или равна 1 (твердая фаза, газообразное вещество при Р=1 атм, растворитель из-за его большой концентрации мало изменяющейся во время реакции). Величина стандартного потенциала представляет собой константу, характерную для данного электрода.
Потенциометрические методы, применяемые в лабораториях
Основные области применения
Определение рН природных вод, загрязненных сточных вод
Определение нитратов, нитритов, фторид-иона, катионов металлов
Определение кислотности и щелочности водных сред, анализ загрязненных сточных вод
Потенциометрические методы анализа основаны на определении зависимости потенциала индикаторного электрода от концентрации анализируемого компонента в растворе. Индикаторный ( рабочий ) электрод обратимо реагирует на изменение концентрации (активности) анализируемого компонента. Потенциал индикаторного электрода определяется относительно известного потенциала электрода сравнения.
Электроды, применяемые в лабораториях эколого-аналитического
1. Хлорсеребряный электрод — применяют как электрод сравнения. Электрод представляет собой стеклянный баллон с оттянутым полым кончиком, внутри канала которого находится пористый материал (асбестовое волокно), обеспечивающий контакт внутреннего раствора электрода с внешним раствором, в который электрод погружают. Внутри баллона находится серебряная проволочка, покрытая слоем нерастворимого хлорида серебра. Проволочка погружена в насыщенный раствор хлорида калия. Потенциал электрода зависит от активности хлорид-ионов, стандартный потенциал электрода равен 0,222 В.
Cl-½AgCl, Ag ; 

2. Каломельный электрод — применяют как электрод сравнения. Электрод представляет собой стеклянный баллон с оттянутым полым кончиком, внутри канала которого находится пористый материал (асбестовое волокно), обеспечивающий контакт внутреннего раствора электрода с внешним раствором, в который электрод погружают. Внутри баллона находится металлическая ртуть, каломель 
Cl-½Hg2Cl2,Hg; 
3. Стеклянный электрод относится к мембранным электродам, представляет собой тонкостенный стеклянный шарик, заполненный раствором соляной кислоты или каким-либо буферным раствором. Внутри шарика помещают хлорсеребряный электрод. Это устройство обычно закрывают защитной трубкой. Перед работой стеклянный электрод некоторое время вымачивают в 0,1 М растворе соляной кислоты.. При этом ионы водорода из раствора обмениваются на ионы натрия из стелянной мембраны и в системе устанавливается некоторое равновесие. Подготовленный таким образом электрод может быть использован для определения рН как индикаторный электрод.
H+ = Нст ;
Основными достоинствами стелянного электрода являются простота работы, применимость в широкой области рН, быстрое установление равновесия и возможность определения рН в окислительно-восстановительных системах. К недостаткам относятся хрупкость конструкции и усложнение работы при переходе к сильно щелочным и сильно кислым растворам.
4. Мембранные ионоселективные электроды (ИСЭ). Ионоселективные мембранные электроды функционируют по механизму переноса ионов, т. е. обладают ионной проводимостью. В твердых мембранных ИСЭ ионочувствительный элемент изготавливается из малорастворимого кристаллического вещества с ионным характером проводимости. Перенос заряда в таком кристалле происходит за счет дефектов кристаллической решетки. Вакансии кристаллической решетки могут заниматься только ионами определенного размера и заряда, что обусловливает высокую селективность кристаллических мембран.
2.
Конструктивно такие электроды сходны со стеклянными. Электрод сравнения – это обычно хлорсеребряный электрод. Если во внешний (анализируемый) и внутренний растворы поместить электроды сравнения, то можно измерить разность потенциалов, равную мембранному потенциалу. Величина мембранного потенциала пропорциональна активности определяемого иона во внешнем (анализируемом) растворе. Основные характеристики ИСЭ: интервал выполнения электродной функции, селективность, время отклика.
Интервал выполнения электродной функции – область концентраций анализируемого компонента, которая регистрируется данным электродом.
Интервал выполнения электродной функции
Интервал выполнения электродной
функции определяется протяженностью
линейного участка графика. Точка перегиба
характеризует предел обнаружения комонента
при помощи данного электрода
Интервал выполнения электродной функции определяется протяженность линейного участка графика. Точка перегиба характеризует предел обнаружения комонента при помощи данного электрода.
Потенциал электрода СВ постоянна
7 6 5 А
источник
анализа состояния окружающей среды
Потенциометрический метод основан на изменении потенциала электрода в зависимости от физико-химических процессов, протекающих в растворе. Величина потенциала зависит от природы электрода, концентрации и природы раствора, в который опущен электрод, от характера химических реакций, температуры и т. п.
Применяется метод прямой потенциометрии и потенциометрическое титрование. Потенциометрический метод анализа используется для определения неорганических и органических соединений в различных объектах окружающей среды.
Потенциометрические методы анализа основаны на использовании зависимости электродвижущей силы электрохимической (потенциометрической) ячейки от концентрации (активности) определяемого вещества в анализируемом растворе. Простейшая потенциометрическая ячейка содержит два электрода: потенциал одного из них прямо или косвенно зависит от концентрации определяемого вещества — это индикаторный электрод (ИЭ); второй электрод (относительно которого измеряют потенциал ИЭ), называют электродом сравнения.
Потенциометрические методы определения можно разделить на прямую потенциометрию (ионометрию) и потенциометрическое титрование. В ионометрии вначале по серии стандартных растворов строят калибровочную кривую или соответственно настраивают прибор (например, рН-метод), а затем по ЭДС потенциометрической ячейки с анализируемым раствором находят активность или концентрацию определяемого компонента. Наиболее часто метод прямой потенцио-метрии используется для определения рН-раствора. Для аналитических целей чаще используют потенциометрическое титрование.
Под потенциометрическим титрованием понимают любые потенциометрические методы определения веществ, использующих хотя бы однократное добавление к анализируемому раствору известного вещества (раствора), вне зависимости от того, происходит при этом химическая реакция или нет (методы добавок).
Потенциометрическое титрование имеет следующие преимущества перед прямой потенциометрией:
- • позволяет определять концентрацию веществ с большей правильностью и воспроизводимостью;
- • позволяет использовать для определения большое число индикаторных электродов;
- • позволяет вести измерения в присутствии мешающих веществ путем подбора селективного титранта;
- • использование электродно-активных титрантов позволяет определить вещества, для которых отсутствуют ионоселективные электроды.
С помощью потенциометрии можно определять фтороводород и пары кислорода в воздухе.
Электрохимические системы в равновесном состоянии
При потенциометрическом титровании используют пару электродов, составляющих гальванический элемент, ЭДС которого контролируется в процессе титрования. Электроды, применяемые в потенциометрии, должны быть обратимыми — их потенциал должен изменяться с изменением концентрации ионов в растворе в соответствии с уравнением Нернста. Реальные потенциалы необходимы при опре-
делении хода потенциометрического титрования. Вследствие недостаточной изученности реальных потенциалов применяют теоретически вычисленные равновесные потенциалы.
Равновесный потенциал — величина электродного потенциала, возникшая на границе металл — раствор. Его зависимость от концентрации ионов металла в растворе выражается уравнением Нернста:
где Ех — потенциал металлического электрода при данной концентрации ионов металла в растворе;
Е — нормальный потенциал металлического электрода (при концентрации ионов, равной единице);
СМе — концентрация ионов металла;
Я — газовая постоянная, Я = 8,313 Дж;
Т — абсолютная температура;
У 7 — число Фарадея, / г = 96 500 К;
При потенциометрическом анализе используют уравнение (10), принимая температуру равной +25 °С и подставляя соответствующие значения Я и Т с учетом коэффициента перехода от натуральных логарифмов к десятичным (2,3026). Тогда уравнение (10) будет иметь вид:
Окислительно-восстановительная система характеризуется определенным значением потенциала, фиксируемым платиновым электродом и зависящим от природы системы, от концентрации окисленной и восстановленной форма вещества:
где а, Ь и т — соответствующие стехиометрические коэффициенты у окислителя, восстановителя и иона водорода из уравнения реакции;
IН + — концентрация ионов водорода в анализируемом растворе.
Нормальные потенциалы. Для определения значения потенциала используют метод, основанный на сравнении потенциала одного электрода с потенциалом другого. В качестве эталона выбирают нормальный водородный электрод, представляющий собой платиновую пластинку, покрытую платиновой чернью, насыщенную водородом при нормальном атмосферном давлении и погруженную в раствор с активностью водородных ионов, равной 1 г-экв. Водород, адсорбированный платиной, ведет себя по отношению к водородным ионам в растворе так же, как металлический электрод по отношению к своим ионам. Установившееся равновесие соответствует уравнению
Потенциал водородного электрода условно принимают равным нулю, а любому другому электроду, измеренному по отношению к нему, приписывают потенциал, равный ЭДС гальванического элемента. Нормальным электродным потенциалом Е называется потенциал электрода, погруженного в раствор соответствующей соли с активностью ионов в 1 г-экв, измеренной относительно нормального водородного электрода.
Заряд металлического электрода, стоящего в ряду активностей после водорода, будет отрицательным, до водорода — положительным.
Реальные потенциалы. В реальных условиях в ряде случаев значения нормальных потенциалов не могут служить для сравнения поведения систем. Обычно анализируемые растворы содержат кроме ионов, участвующих в окислительно-восстановительных реакциях, и ионы комплексообразователей, способных вступать во взаимодействие с окисленной или восстановленной формой вещества, оказывая влияние на величину окислительно-восстановительных потенциалов. Например, нормальный окислительно-восстановительный потенциал системы Ре 3+ /Ре 2+ равен +0,77 В; в присутствии цианид-ионов в результате комплексообразования электродный процесс окисления-восстановления осложняется:
и потенциал окислительно-восстановительнои системы изменяется до +0,36 В.
Таким образом, реальный окислительно-восстановительный потенциал — потенциал, зависящий не только от свойств окислительно-восстановительной системы, но и от среды, в которой протекает реакция. В большинстве случаев его значение определяется экспериментально.
Электроды. Различают электроды первого и второго рода. Электроды первого рода — металл, погруженный в раствор соли этого же металла, образующий окислительно-восстановительную систему, в которой этот потенциал определяется только относительно концентрации катионов в растворе. К электродам первого рода относятся ртутные, серебряные, амальгамные, водородные и другие. Амальгамный электрод — металл, растворенный в ртути, обладает дополнительными преимуществами по сравнению с металлическим:
- • не реагирует с кислотами, так как водород на амальгаме выделяется с большим перенапряжением по сравнению с чистым металлом;
- • с ним быстрее устанавливается равновесие, чем с металлическим.
Электроды второго рода — металл, погруженный в раствор малорастворимой соли этого металла, содержащий избыток другой соли с одинаковым анионом, потенциал которого определяется концентрацией соответствующего аниона. К электродам второго рода относятся хлорсеребряный, каломельный и сурьмяный.
Электрод, реагирующий на изменение концентрации определяемого иона в растворе и заменяющий индикатор в условиях обычного титрования, называется индикаторным. Его потенциал определяется по отношению к неполяризуемому электроду, называемому стандартным, потенциал которого в процессе титрования постоянен и служит исключительно для определения потенциала индикаторного электрода. Последний выбирают в зависимости от типа реакций, лежащих в основе титрования, но во всех случаях его потенциал должен устанавливаться мгновенно соответственно концентрации титруемых ионов и не зависеть от наличия посторонних ионов.
Электроды, используемые для титрования кислот и оснований, являются индикаторными по отношению к концентрации ионов водорода. Мы рассмотрим два типа электродов: сурьмяный и стеклянный. Они могут с успехом применяться в санитарно-химическом анализе для реакции нейтрализации и определения pH растворов.
Сурьмяный электрод 5Ь/5Ь23 — электрод второго рода, составленный из металла и его малорастворимой окиси. Этот электрод используется для определения концентрации ионов водорода, так как металлический электрод в присутствии своего малорастворимого оксида выполняет функции водородного электрода. Достоинства сурьмяного электрода:
- • простота и удобство в обращении;
- • возможность применения при анализе растворов кислот и щелочей;
- • возможность применения при анализе растворов, содержащих
электролитические яды — сульфиды, цианиды.
Недостаток сурьмяного электрода: не вполне обратимый электрод и измеряемые им потенциалы не вполне подчиняются уравнению Нернста.
Стеклянный электрод — стеклянный шарик диаметром 15—20 мм с толщиной стенок 0,06—0,1 мм, изготовленный из стекла, содержащего большое количество щелочных металлов — лития или натрия и расположенный на конце стеклянной трубки. Если этот шарик заполнить раствором с определенным значением pH и опустить в анализируемый раствор с другим значением pH, то на поверхности шарика возникает потенциал, величина которого изменяется соответственно разности pH между внутренним и внешним растворами. На поверхности стеклянного электрода устанавливается сложное равновесие, связанное со взаимной диффузией ионов водорода из раствора в стекло и ионов натрия или лития из стекла в раствор. Достоинства стеклянного электрода:
- • на точность определения pH не влияет присутствие окислителей или восстановителей;
- • на электрод не действуют яды, коллоиды и другие вещества, искажающие точность определений pH;
- • позволяет работать с кислыми и щелочными растворами в широком диапазоне pH (от 0 до 12—13).
Недостатки стеклянного электрода:
- • нельзя использовать обычную потенциометрическую установку вследствие большого сопротивления электрода;
- • для усиления тока электродной пары со стеклянным электродом необходимо использовать струнные или зеркальные гальванометры или ламповые усилители;
- • при работе обнаруживается явление — «потенциал асимметрии стеклянного электрода».
Когда обе поверхности стеклянного электрода соприкасаются с растворами, концентрации водородных ионов в которых одинаковы, на внутренней и внешней поверхностях электрода возникают разные потенциалы. Это свидетельствует о различии в свойствах внутренней и внешней поверхностей стеклянного электрода из легкоплавкого стекла с большой электропроводностью, очень тонкими стенками и периодическим выдерживанием в воде, в слабощелочном буфере и в буфере с pH, равным pH внутреннего раствора стеклянного шарика. Чем больше потенциал асимметрии, тем менее устойчивы показания pH.
Кривые потенциометрического титрования реакции нейтрализации — изображение изменения pH раствора. Отдельные точки кривой титрования можно рассчитать по формулам для вычисления pH раствора соответствующих электролитов. При вычислении pH раствора сильных кислот или оснований, пренебрегая ионной силой раствора, концентрацию тонов Н + или ОН» можно приравнять к общей концентрации кислоты или щелочи.
Для вычисления pH слабых кислот и оснований, а также растворов их солей, подвергающихся гидролизу, необходимо учитывать соответствующие константы диссоциации: для слабой кислоты:
для соли слабой кислоты и сильного основания:
Электрод, опущенный в анализируемый раствор, должен быть индикаторным по отношению к концентрации ионов водорода. На поверхности такого электрода устанавливается равновесие (8).
Потенциометрическое титрование в методе нейтрализации находит ограниченное использование для целей санитарно-химического анализа. Ограничимся только изображением кривых потенциометрического титрования 0,1N раствора HCl 0,1N раствором NaOH с хин-
Рис. 4. Кривые потенциометрического титрования 0,1N раствора HCl 0,1N раствором NaOH с хингидронным электродом
Рис. 5. Кривые потенциометрического титрования 0,1М раствора N82003 Ж раствором НС1
гидронным электродом (рис. 4) и кривых потенциометрического титрования 0,1М раствора Na2C03 1N раствором НС1 (рис. 5).
При этом изменением объема в процессе титрования пренебрегают, так как это не оказывает существенного влияния на значения потенциалов и характеристики кривых.
Индикаторные электроды методов осаждения и комплексообразо-вания. В связи с тем что методы осаждения и комплексообразования играют важную роль в санитарно-химическом анализе, необходимо ознакомиться с двумя типами электродов: серебряными и ртутными, образующими в растворе солей серебра и ртути системы Hg/Hg 2 2; Ag/Ag + . С помощью последних можно потенциометрически определить концентрацию ионов серебра и ртути, а также концентрации тех ионов, которые с серебряными и ртутными ионами образуют труднорастворимые соли и комплексы.
Другой тип электродов, используемых при осаждении и комплек-сообразовании, — это металлические электроды, покрытые труднорастворимой солью того же металла: хлористосеребряные, сернистортутные и т. п., образующие в системе следующие системы, определяющие их потенциалы:
Значения последних зависят от концентрации катиона и аниона труднорастворимой соли в растворе, и поэтому эти электроды используются для определения концентрации ионов металлов анионов: СГ; ВГ; Г; Б 2 «.
Если раствор насыщен труднорастворимой солью, то концентрация ионов металла вычисляется из произведения растворимости (ПР):
В ряде случаев применяют и индифферентный электрод, вводя при этом в раствор окислительно-восстановительную систему: раствор, содержащий ионы какого-либо металла в двух степенях окисления. Рабочий раствор должен реагировать с одним из ионов окислительно-восстановительной системы, но так, чтобы это взаимодействие имело место только после завершения основной реакции между определяемым веществом и рабочим раствором. В качестве примера рассмотрим определение цинка путем его осаждения раствором ферроцианида калия с образованием труднорастворимого соединения:
При потенциометрическом титровании цинка ферроцианидом калия ионы цинка не участвуют в процессе установления потенциала платинового электрода. Чтобы сделать возможным процесс титрования, в раствор вводят некоторое количество ферроцианида калия К3[Ее(С1Ч)6]. При образовании малодиссоциированного соединения К27п3[Ее(СМ)6]2 в процессе титрования до эквивалентной точки концентрация анионов [Ее(СМ)б
] значительно ниже, чем концентрация анионов [Ге(СЫ)6] 3_ , и соответственно установившемуся соотношению концентраций этих ионов потенциал платинового электрода принимает определенное значение. По окончании реакции осаждения цинка в растворе обнаруживается избыток К41Ре(СМ)6], дающий резкое изменение потенциала системы [Ре(СМ)6] 3- / 1Ре(СМ)6] 4- , и соответственно скачок потенциала платинового электрода указывает на точку эквивалентности.
Выбор индикаторного электрода ограничивает область применения потенциометрического титрования для реакции осаждения и комплексообразования, так как многие металлические электроды не могут применяться в санитарно-химическом анализе вследствие ряда существенных недостатков:
- • пассивируются на воздухе слоем окиси;
- • вследствие вышеуказанного дают правильные показания потенциала только при больших концентрациях, не регистрируя малых концентраций и их изменений;
- • неприменимы для анализа растворов, в которых имеются ионы металла, расположенного в ряду напряжений за металлом индикаторного электрода, так как возможно вытеснение из раствора соли одного металла другим;
- • для анализа кислых растворов не могут в качестве индикаторных электродов использоваться металлы, растворимые в кислотах.
В последние годы нашли применение ионообменные мембраны, функционирующие как обратимые электроды к любому иону, например к ионам Н + , N(>3, СН3СОСГ, 1л + , М^ 2- , Ва 2 и др., и позволяющие использовать их в потенциометрическом титровании в качестве индикаторных электродов. Эти мембраны в будущем должны найти широкое применение в санитарно-химическом анализе.
Кривые потенциометрического титрования реакций осаждения и комплексообразования. Для вычисления потенциала электрода используют уравнение Нернста:
где С — концентрация определяемого иона, вычисляемая с учетом образования малодиссоциированных соединений.
Рассмотрим потенциометрическое титрование серебра по методу осаждения в виде хлорида серебра. Индикаторный электрод серебряный: Е(^ + /А?° = 0,80. При добавлении раствора №С1 к раствору AgNOз ионы серебра выпадают в осадок, концентрация же не выпавшего в осадок серебра зависит от количества добавленного раствора №С1. Если к 100 мл 0,1 N раствора AgNOз добавить 5 мл 1Ы раствора №С1, то концентрация серебра будет равна:
Если добавить 9 мл раствора хлорида натрия, то 10 мл — количество 1,014, №С1, необходимое для полного осаждения серебра.
Потенциалы электродов равны:
Около эквивалентной точки, когда почти все серебро находится в осадке, концентрация ионов серебра определяется растворимостью последнего и устанавливается из произведения растворимости ПР. Для бинарных электролитов типа АВ концентрация определяемого иона равна:
а для сложных электролитов типа АпВт вычисляется по формуле
[А8+| = [СГ| =71,7-КГ 10 = 1,3 ? 1(Г 5 (23)и потенциал электрода в эквивалентной точке равен:
?=0,80 +0,058 ^ 1,3 10″ 5 =0,516 В. (24)
За эквивалентной точкой концентрация ионов серебра зависит от избытка осадителя и вычисляется также из ПР. Если к титруемому раствору добавить 0,01 мл Ш хлорида, что соответствует [С1 ] = 10 4 , то концентрация серебра равна:
[ Аё + ] = = 1,710 = 1,7 • 10 ” 6 . (25)Тогда потенциал электрода будет равен:
Полученные по ходу титрования расчетные данные изменения потенциала серебряного электрода сводят в таблицу изменений потенциала серебряного электрода при титровании 100 мл 0,1 N раствора AgNOз 1И раствором ИаС1. При этом пренебрегают изменением объема.
Ниже приведены кривые потенциометрического титрования нитрита серебра раствором хлорида (рис. 6). В точке эквивалентности наблюдается резкий скачок потенциала, величина которого зависит от растворимости образующегося осадка. Чем меньше растворимость осадка и его ПР, тем больше скачок потенциала в точке эквивалентности.
Рис. 6. Кривые потенциометрического титрования 0, Ж раствора А§М03 Ш
Ионы серебра и другие ионы можно определить методом потенциометрического титрования, переведя их в малодиссоциированные комплексы. Примером подобного титрования служит реакция ком-плексообразования серебра с цианид-ионом lAg(CN)2] _ . Эта реакция обратима:
При титровании цианида калия нитратом серебра ионы последнего расходуются на образование комплексного иона |^(С1Ч)2Г. Концентрацию свободных ионов серебра в растворе вычисляют по уравнению константы нестойкости. Так, при добавлении к 100 мл 0, Ш раствора цианида калия 0,5 мл Ш раствора нитрата серебра концентрация образовавшегося комплексного иона будет равна
а концентрация цианид-иона уменьшается до [ОМ — ] = 0,09. Тогда
|Аё + ] = 3,8 • 10 -19 • 0,0 ° 5 , = 2,34 -10
Соответственно этому потенциал серебряного электрода равен:
Константа нестойкости этого комплекса равна:
При добавлении 2,5 мл раствора:
При добавлении 4,5 мл раствора:
При добавлении 4,95 мл раствора:
В точке эквивалентности все цианид-ионы будут связаны в комплекс, концентрация которого будет равна 0,0514. Из вышеприведенного уравнения образования комплекса видно, что между концентрацией ионов серебра и концентрацией цианид-ионов, образовавшихся за счет диссоциации комплекса, существует соотношение 21А? + ] = [ОМ»]. Подставляя это значение в уравнение константы равновесия, получаем:
?экв = 0,80 + 0,058 ^ 1,68- 10″ 7 = 0,407 В.
За точкой эквивалентности наблюдается образование малорастворимого осадка Ag2(CN)2, растворимостью которого определяется концентрация ионов серебра и, следовательно, значение электродного потенциала. Потенциал индикаторного электрода остается постоянным до тех пор, пока весь комплекс не превратится в осадок. Кривая потенциометрического титрования по описываемому методу, изображенная на рис. 7, показывает характерный скачок потенциала в точке эквивалентности и горизонтальный участок после окончания процесса комплексообразования.
Рис. 7. Кривая потенциометрического титрования 0,Ш раствора KCN Ш раствором AgNOз
Индикаторные электроды метода окисления-восстановления При окислительно-восстановительном титровании индикаторными электродами служат индифферентные металлы: платина, палладий, золото. Наиболее широкое использование в потенциометрии нашел платиновый электрод в виде проволоки, пластинки или сетки. В условиях окислительно-восстановительного процесса платиновый индикаторный электрод принимает потенциал, соответствующий окислительно-восстановительной системе. Рассмотрим титрование раствора железа бихроматом калия по схеме
Концентрация ионов Ре 2+ уменьшается, а концентрация ионов Ре 3+ увеличивается; при этом потенциал платинового электрода соответствует окислительно-восстановительной системе железа ?реЗ+/Ре2+-После эквивалентной точки ионы железа отсутствуют в растворе, а введенный избыток бихромата калия создает окислительно-восстановительную систему хрома , , 3+ . Соответственно этому пла-
тиновый электрод после эквивалентной точки принимает потенциал окислительно-восстановительной системы хрома. Переход потенциала платинового индикаторного электрода от одной окислительно-восстановительной системы к другой сопровождается скачком потенциала в точке эквивалентности, что указывает на конец титрования.
Кривые потенциометрического титрования в окислительно-восстановительных реакциях.
Потенциал платинового индикаторного электрода зависит от соотношения концентраций окисленной и восстановленной форм. Проследим изменение потенциала электрода при титровании соли железа перманганатом калия в кислой среде.
Нормальные потенциалы системы равны:
МпС>4 + 8Н + +5е — -э Мп 2+ +4Н20;
Суммарное ионное уравнение этой реакции:
МПО4 + 5Ре 2+ + 8Н + Мп 2+ + 5Ре 3+ +4Н20.
Вследствие обратимости реакции в любой момент титрования раствор всегда содержит две окислительно-восстановительные системы:
Соответственно этому для вычисления потенциала используются два уравнения:
уравнение системы окислителя:
уравнение системы восстановителя:
- ? = 1;52 + ад58|81МпОЛ1ьп!
- 5 [Мп 2+ ]
Можно пользоваться любым из этих уравнений, дающих одинаковые результаты. Однако для определения потенциала электрода до точки эквивалентности, когда еще не все железо оттитровано, лучше использовать уравнение (45), а после т. э., когда к раствору добавлен избыток перманганата калия, — уравнение (46).
Вычислим потенциал электрода для момента, когда к 100 мл 0,1 N раствора Ре804 прибавлено 50 мл 0, Ж раствора КМп04, при этом половина ионов железа Ре 2+ окислится до железа Ре 3+ . Как и ранее, пренебрегая изменением объема, запишем:
Рассмотрим точки на кривой титрования, определяющие значение скачка потенциала вблизи эквивалентной точки и соответствующие 0,1 мл недостатка и 0,1 мл избытка КМп04. Пусть к раствору прибавлено 99,9 мл КМп04; при этом 99,9 мл 0,1Ы раствора железа Ре 2+ окисляется до железа Ре 3+ и только 0,1 мл 0,^ раствора составляет железо Ре 2+ . Тогда концентрации окисленной и восстановленной форм железа равны:
Определим потенциал в конце скачка при затрате 100,1 мл раствора КМп04; из этого количества 100 мл 0,1 N раствора КМп04 восстанавливается до Мп 2+ , поэтому концентрация Мп 2+ в растворе равна 0,1 N из расчета на первоначальный объем 100 мл. Избыток 0,1 мл 0, Ш раствора для принятого объема даст концентрацию
Допустим, что концентрация тонов Н + в растворе равна 1 г-ион/л. Тогда получим:
Добавив избыток КМп04, будем считать, что ионы Ре 2+ полностью оттитрованы и число ионов Мп 2+ постоянно. Тогда значение потенциала будет зависеть исключительно от изменения концентрации ионов Мп04 , и для его определения в точке эквивалентности можно использовать уравнения (54) и (55).
С целью получения более удобного уравнения для вычисления потенциала электрода в точке эквивалентности, суммируем уравнения (54) и (55):
6? = 0,77 + 5 1,51 + 0,058 1§ |Ре ||Мп ° 41
Зависимость (47) — суммарное уравнение равновесия. В точке эквивалентности ионы МпС>4 вводят в раствор в количестве, соответствующем вышеприведенному суммарному ионному уравнению. Тогда при равновесии на каждый оставшийся ион приходится пять ионов Ре 2+ , т. е.
то уравнение (50) примет вид:
Рассмотрим уравнение окислительно-восстановительного про-
где [Окисл.]]; [Восст.]]; [Окисл.2]; [Восст.2] — концентрации окисленной и восстановленной форм одного и другого вещества;
а и Ь — соответствующие стехиометрические коэффициенты.
Тогда равновесный потенциал будет иметь вид:
где Е] и Е2 — нормальный потенциал окислителя и восстановителя соответственно.
Изменением объема при титровании пренебрегли:
а) до точки эквивалентности согласно уравнению:
б) в точке эквивалентности согласно уравнению:
- 5 = 1
- в) после точки эквивалентности:
Аппаратурное оформление потенциометрии
В практике потенциометрического анализа используются компенсационный и некомпенсационный методы определения ЭДС электронной пары, последняя представляет собой индикаторный электрод и электрод сравнения, погруженные в соответствующие растворы. В результате образуется гальванический элемент, в котором происходят химические и концентрационные изменения, вызывающие поляризацию электродов, что ведет к непрерывному уменьшению ЭДС.
Рассмотрим некомпенсационный метод, наиболее подходящий для практики санитарно-химического анализа.
Сущность метода. ЭДС гальванического элемента определяется непосредственно чувствительными измерительными приборами, последовательно с которыми включается большое и точно известное сопротивление. При включении измерительного прибора в сеть гальванического элемента необходимо, чтобы внешнее сопротивление сети было во много раз больше внутреннего. Тогда о напряжении между электродами можно будет судить по силе тока. Подобная схема позволяет определять изменения ЭДС испытуемого гальванического элемента. Шкала чувствительности прибора может быть отградуирована в милливольтах — милливольтметры; в амперах — гальванометры; в единицах измерениях анализа, например в значениях pH, т. е. эти измерительные приборы выступают в роли индикаторов.
Достоинства метода следующие:
- • не играет роли абсолютная величина ЭДС гальванического элемента;
- • изменение разности потенциалов индикаторного электрода и электрода сравнения в точке эквивалентности можно определить либо по резкому скачку стрелки индикаторного прибора, либо при последовательном движении стрелки прибора по различному размаху ее колебания при одинаковом добавлении рабочего раствора в процессе титрования;
- • метод прост по своему аппаратурному оформлению.
- • отсутствие четкого указания на приближение к точке эквивалентности;
- • выравнивание разности потенциалов между электродами во времени;
- • некоторое расхождение в значениях скачков потенциала при параллельных титрованиях.
Установка для некомпенсационного потенциометрического титрования состоит из следующих элементов:
- • электродной пары — платиновый индикаторный электрод и вольфрамовый электрод сравнения, опущенный в анализируемый раствор;
- • гальванометра, измеряющего ЭДС электродной пары;
- • механической мешалки для перемешивания раствора;
- • аккумулятора на 1,3 или 2,2 В;
- • сопротивления порядка 5000—20 000 Ом, устанавливаемого опытным путем; для этой цели рекомендуется использовать штепсельные или декадные магазины сопротивления.
Для некомпенсационного потенциометрического титрования отечественная промышленность изготавливает ламповые потенциометры, или ламповые рН-метры, и ламповые усилители.
Особый интерес для потенциометрии представляют рН-метры, ламповые схемы которых предназначены для усиления малых токов и позволяют измерять разность потенциалов в электрохимических ячейках с очень высоким сопротивлением.
Лабораторный рН-метр рН-340
В настоящее время большинство санитарно-химических лабораторий комплектуется рН-метрами модели 340. Это лабораторный прибор, предназначенный для определения pH, р№ и окислительно-восстановительных потенциалов, а также для использования в качестве высокоомного нуль-индикатора. В составе лабораторного автоматического титратора его можно применять для титрования и записи кривых титрования, а при работе с блоками автоматического титрования — для массового однотипного титрования.
Прибором рН-340 можно производить измерения как методом отбора проб с помощью входящего в комплект датчика ДЛ-02, так и непосредственно в лабораторных установках с помощью комплекта электродов. Переходная коробка, входящая в комплект прибора, позволяет одновременно в одной измерительной ячейке производить определение pH и окислительно-восстановительного потенциала.
Использование прибора как милливольтметра. Рассматриваемый прибор может быть применен для потенциометрических измерений с разнообразными измерительными электродами, в том числе и металлическими. Измерения могут проводиться как с помощью датчика ДЛ-02, так и со специально прилагаемыми к прибору электродами.
При измерениях с помощью датчика ДЛ-02 измерительный электрод (стеклянный или металлический) подключают к клемме «Изм.» датчика. В качестве электрода сравнения рекомендуется использовать проточный хлорсеребряный электрод, который применяется при измерениях pH, установленный в датчике и подключенный к клемме «Всп.». Для потенциометрических измерений в различных технологических аппаратах прибор укомплектовывают специальными электродами. В качестве измерительного электрода могут быть использованы стеклянный и платиновый, в качестве сравнительного — хлорсеребряный. Электроды подключают к прибору в соответствии с маркировкой на задней стенке корпуса.
В приборе предусмотрена возможность измерения ЭДС различной полярности. При отсчете показаний на участке шкалы от 0 до 1400 мВ знак, соответствующий положению ручки переключателя «Род работы» в момент измерения, соответствует знаку потенциала измерительного электрода. Отсчет показаний в широком диапазоне измерений необходимо производить по нижней шкале показывающего прибора с делениями от -1 до 14, при установке переключателя «Размах» в положение «1500 мВ».
Отсчет показаний в одном из узких диапазонов (-1—2; 2—5; 5—8; 8—11; 11 — 14) необходимо производить по верхней шкале показывающего прибора, руководствуясь делениями верхней шкалы и положением переключателя «Пределы измерений». Переключатель «Размах» устанавливается в положение «300 мВ».
Показания, отсчитанные на любом диапазоне измерения, необходимо умножить на 100. Рекомендуется следующее правило отсчета показаний:
где / — измеряемая величина;
Е — начальное значение ЭДС для данного диапазона (нижний предел измерений);
П — показание, отсчитанное по верхней шкале показывающего прибора.
Использование прибора для целей потенциометрического титрования. Титрование может производиться любым известным в аналитической химии методом с использованием зависимости от pH и окислительно-восстановительного потенциала.
В химический стакан с титруемым раствором добавляется реагент малыми порциями до достижения эквивалентной точки титрования, отмечаемой по прибору. Отсчет производится на бюретке. Индикатором при титровании ионов какого-либо вида может служить любой электрод, реагирующий на изменение концентрации определяемого иона в растворе.
Потенциометрическое титрование для окислительно-восстановительных реакций проводится с помощью платинового электрода ЭТПЛ-01 М. Для работы с блоком автоматического титрования прибор имеет выход по напряжению 0—2 В и может быть использован только в диапазоне -1 — 14.
При титровании до известного значения pH с помощью стеклянного электрода прибор настраивается по буферным растворам. После поверки по буферным растворам переключатель «Размах» устанавливается в положение «15 pH», соответствующее диапазону 1 — 14 pH. Визуальный контроль pH по прибору при окончании титрования может быть осуществлен по нижней шкале показывающего прибора с точностью 0,6 pH или по верхней шкале на соответствующем диапазоне с точностью 0,05 pH.
При титровании до известного значения окислительно-восстановительного потенциала с помощью платинового электрода переключатель «Размах» устанавливается в положение «1500 мВ». Визуальный контроль окислительно-восстановительного потенциала по окончании титрования может быть осуществлен по нижней шкале показывающего прибора с точностью ±60 мВ или по верхней шкале на соответствующем диапазоне с точностью ±5 мВ.
ОПРЕДЕЛЕНИЕ НЕПРЕДЕЛЬНЫХ СОЕДИНЕНИЙ В ВОЗДУХЕ ПРОИЗВОДСТВЕННЫХ ПОМЕЩЕНИЙ МЕТОДОМ ПРЯМОГО ПОТЕНЦИОМЕТРИЧЕСКОГО ТИТРОВАНИЯ
Цель работы: определить состояния воздуха потенциометрическим методом.
Оборудование и реактивы: рН-метр ЛПУ-01в системе платинового индикаторного и хлорсеребряного сравнительного электродов, магнитная мешалка, аспиратор Мигунова, поглотительные приборы с пористой пластиной, микробюретка на 5 мл (цена деления 0,01 мл), стаканы химические на 100 мл, колбы мерные на 50 мл, спирт этиловый, этиленгликоль, ч.д.а., непредельные соединения, ч.д.а., ацетат ртути, ч.д.а., 0,1М раствор, нитрат ртути, ч.д.а., 0,1М раствор, кислота хлорная, ч.д.а., 0,1М раствор.
Сущность метода. В основу метода положена способность солей двухвалентной ртути к реакции присоединения по месту двойных уг-лерод-углеродных связей непредельных соединений в водно-этилен-гликолевом растворителе, а также способность солей одновалентной ртути к реакции диспропорционирования.
Соли двухвалентной ртути более универсальны для определения ненасыщенное™ всех типов, в том числе и сопряженной с электроноакцепторными заместителями; соли одновалентной ртути обеспечивают большую точность при анализе ненасыщенных эфиров.
Стирол, аллилбензол, акриловую кислоту, метакриловую кислоту, коричную кислоту, 4-сульфокоричную кислоту, этиловый эфир коричной кислоты определяют прямым потенциометрическим титрованием раствором ацетата ртути, а винилбутират, аллилакрилат, пропиленовый эфир коричной кислоты, бутиловый эфир коричной кислоты, гексиловый эфир коричной кислоты, аллиловый эфир коричной кислоты и фенилацетилен — нитратом ртути. В качестве каталитической добавки для подавления сольволиза используют НС104.
Стандартизацию ацетата ртути проводят комплексонометриче-ски, нитрата ртути — раствором хлорида натрия с потенциометрической индикацией точки эквивалентности. Потенциометрическое титрование проводят на установке ЛПУ-01, включающей платиновый индикаторный и хлорсеребряный сравнительные электроды, магнитную мешалку, микробюретку емкостью 5 мл с ценой деления 0,01 мл и стакан для титрования емкостью 100 мл. Полученные скачки потенциала при титровании солью одновалентной ртути составляют 80—100 мВ, двухвалентной — 50—80 мВ, что позволяет проводить анализ ненасыщенных соединений с достаточной точностью.
Отбор пробы воздуха. Исследуемый воздух объемом 20 л, со скоростью 0,5 л/мин пропускают через поглотитель с пористой пластиной, содержащей 5 мл этилового спирта. Во время отбора поглотитель необходимо охлаждать льдом.
Ход анализа. Содержимое поглотителя помещают в стаканах для титрования, доливают 25 мл этиленгликоля и титруют потенциомет-рически 0,1М раствором ацетата двухвалентной ртути или нитрата одновалентной ртути, содержащим в качестве каталитической добавки 0,1М раствор НСЮ4. Количественное определение проводят путем титрования серии стандартных растворов исследуемых веществ в вышеописанных условиях.
Лабораторная работа 6 ИССЛЕДОВАНИЕ ВОДНОЙ СРЕДЫ ПОТЕНЦИОМЕТРИЧЕСКИМ МЕТОДОМ
Цель работы: определить содержание различных загрязняющих веществ потенциометрическим способом.
Задание 1. Определение окисляемости природных буровых вод методом потенциометрии.
Оборудование и реактивы: потенциометр М-1 № 50, нуль-инструмент, серная кислота, х.ч., 10%-ный раствор, перманганат калия, х.ч., 0,01N раствор.
Сущность метода. Методика основана на анализе изменения потенциала пары платиновый электрод и насыщенный каломельный электрод в зависимости от количества окислителя. Потенциал измеряют потенциометром М-1 № 50 и нуль-инструментом с ценой деления 3 • 10 -7 А. Размер платинового электрода 20×25 мм.
Ход анализа. К 100 мл буровой воды добавляют 19 мл 10 %-ной Н2504 и титруют 0,0Ж раствором КМп04. При этом наблюдается три скачка потенциала: первый — 400—500 мВ; второй — 550 мВ и третий — 680—700 мВ.
Общая окисляемость вычисляется по формуле
где В — количество 0,0Ж раствора КМп04, соответствующее второму скачку потенциала;
С — рассчитанное количество 0,01N раствора КМп04, необходимого для окисления йод-иона в 100 мл буровой воды.
Задание 2. Определение салициловой кислоты в сточных водах методом потенциометрического титрования.
Оборудование и реактивы: потенциометр, магнитная мешалка, электроды, стеклянный и каломельный, едкий калий, х.ч., 0,Ж раствор.
Сущность метода. Метод основан на потенциометрическом титровании салициловой кислоты (СК) раствором щелочи. Точность метода ±2,5.
Ход анализа. Аликвотную часть сточной жидкости (1 — 10 мл в зависимости от содержания салициловой кислоты) помещают в стакан для титрования, добавляют воду до 50 мл и титруют потенциометри-чески до резкого скачка потенциала.
Расчет. Содержание салициловой кислоты X, мг/л, находят по формуле
где а — объем 0,01 N раствора КОН, пошедшего на титрование, мл;
К — коэффициент для приведения концентрации КОН точно к ОДМ;
0,0138 — количество СК, соответствующее 1 мл точно 0,Ш раствора, КОН, мг;
Задание 3. Анализ сточных вод производства пластификатора дибу-тилфталата методом потенциометрического титрования.
Оборудование и реактивы: потенциометр ЛПМ-60М со стеклян-но-хлорсеребряной системой электродов, соляная кислота, 0,Ш раствор, этанол, ионообменная смола КУ-2 (вЯ± форме), хроматографическая колонка (Н- 240 мм; с/- 8 мм), ацетон, гидроокись калия, 0,114 этаноловый раствор.
Сущность метода. Сточные воды, образующиеся при производстве пластификатора дибутилфталата, содержат натриевую соль дибу-тилфталата, динатриевую соль фталевой кислоты, карбонат и бикарбонат натрия и бутиловый спирт. Концентрация каждого загрязнителя колеблется в пределах 5—100 г/л.
В качестве растворителей используются смеси этанола или ацетона с водой в соотношении 8:1, в качестве титранта — 0,1Ы раствор соляной кислоты. Титрование проводят на потенциометре ЛПМ-60М со стеклянно-хлорсеребряной системой электродов.
Кривая титрования приведена на рис. 8. Первый скачок потенциала соответствует нейтрализации первой основной группы Ыа2С03, второй — совместной нейтрализации ЫаНС03 и первой основной
Рис. 8. Кривые потенциометрического титрования смеси: а — 0,1N НС1; б — 0,1N этанольным раствором КОН после фильтрования
группы динатриевои соли, третий — совместной нейтрализации второй основной группы динатриевой соли фталевой кислоты и натриевой соли бутилфталата. Метод пригоден при концентрации каждого компонента не менее 0,5 г/л и соотношении относительных концентраций соды и натриевых солей фталевой кислоты и бутилфталата от 1:1 до 1:10.
Мешающие влияния. Определению мешает натриевая соль бензол-сульфокислоты и не мешают бутиловый спирт и следы дибутилфта-лата.
Ход анализа. Аликвотную пробу « 0,5—50 мл, содержащую 0,5—1,0 г-экв определяемых солей, тировали 0,1N раствором НС1 в среде этанол — вода (8:1). Содержание Na2C03 рассчитывали по первому скачку.
Для раздельного определения NaHC03, динатриевой соли фталевой кислоты и натриевой соли бутилфталата аликвотную пробу воды 0,5—50 мл пропускали через колонку, заполненную ионообменной смолой КУ-2. Сточную воду пропускали со скоростью 20—25 капель в минуту. Емкость катионита по натриевой соли бутилфтолата составляла 40 %. После фильтрования анализируемой воды через смолу катионит промывали 30 мл этанола и ацетона. Фильтрат нагревали до 50 °С и титровали 0,1N этаноловым раствором КОН. По полученной кривой, характеризующейся двумя скачками, рассчитывали содержание динатриевой соли фталевой кислоты (ФК) и натриевой соли бутилфталата (БФ). По второму скачку потенциала кривой 1 (рис. 9) рассчитывали содержание NaHC03
Рис. 9. Кривая потенциометрического титрования при определении додекалакта-
Задание 4. Определение додекалактама [ДДЛ] в сточных водах методом потенциометрического титрования.
Оборудование и реактивы: раствор НСЮ4 (0,00514) в ледяной уксусной кислоте, содержащей 20 % уксусного ангидрида, готовят разбавлением 0,1Н раствора НС104 в уксусной кислоте, который стандартизируют по бифталату калия.
Стандартный раствор ДДЛ (0,5—2 мг/мл) готовят из перекристал-лизованного технического препарата. В колбе на 25 мл растворяют 5—10 мг ДДЛ в 0,5—1 мл уксусного ангидрида и доводят до метки дистиллированной водой. Растворители: бензол перегнанный, осушенный натрием; уксусная кислота ледяная, х.ч., уксусный ангидрид, х.ч. Микробюретка на 5 мл с ценой деления 0,02 мл. Потенциометр ЛПМ-60 со стеклянным и каломельным электродами; последний заполняют насыщенным раствором 1лС1 в уксусной кислоте. Во избежание дегидрации стеклянного электрода между сериями титрования его следует погружать на 15—20 мин в дистиллированную воду.
Метод основан на потенциометрическом неводном титровании, позволяющем непосредственно титровать слабые органические основания хлорной кислотой в среде уксусной кислоты. Чувствительность определения 0,3 мг ДДЛ в титруемой пробе. Стандартное отклонение ±3.
Ход анализа. Сточную жидкость в количестве 2—3 разбавляют до 50 мл дистиллированной водой, переносят в делительную воронку, добавляют 10 мл бензола или хлороформа и встряхивают 3 мин. Бензольный слой отделяют в стаканчик для титрования (емкостью 15 мл) и упаривают до объема 5 мл. Далее добавляют 5 мл уксусного ангидрида и титруют раствором НС104 при перемешивании. Вводят поправку на холостой опыт. Время титрования 10 мин. Кривая титрования изображена на рис. 9.
Задание 5. Определение непредельных соединений в сточных водах методом прямого потенциометрического титрования.
Оборудование и реактивы: рН-метр ЛПУ-01в системе платинового индикаторного и хлорсеребряного сравнительного электродов, установка для отгона растворителей, магнитная мешалка, аспиратор Ми-гунова, микробюретка на 5 мл (цена деления 0,01 мл), колонка для колоночной хроматографии, стаканы химические на 100 мл, воронки делительные на 1000 мл, колбы мерные на 50 мл, кислота соляная, х.ч., концентрированная, хлороформ, х.ч., сульфат натрия, х.ч., све-жепрокаленый, гексан, х.ч., окись алюминия, спирт этиловый, этиленгликоль, ч.д.а., непредельные соединения, ч.д.а., ацетат ртути,
ч.д.а., 0,1М раствор, нитрат ртути, ч.д.а., 0,1М раствор, кислота хлорная, ч.д.а., 0,1М раствор.
Сущность метода. В основу метода положена способность солей двухвалентной ртути к реакции присоединения по месту двойных уг-лерод-углеродных связей непредельных соединений в водно-этилен-гликолевом растворителе, а также способность солей одновалентной ртути к реакции диспропорционирования. Стирол, аллилбензол, акриловую, метакриловую, коричную, 4-сульфокоричную кислоты и этиловый эфир коричной кислоты определяют прямым потенциометрическим титрованием раствором ацетата ртути; винилбутират, алли-лакрилат, пропиленовый, бутиловый , гексиловый, аллиловый эфиры коричной кислоты и фенилацетилен — нитратом ртути. В качестве каталитической добавки для подавления сольволиза используют НС104. Стандартизацию ацетата ртути проводят комплексонометри-чески, нитрата ртути — раствором хлорида натрия с потенциометрической индикацией точки эквивалентности.
Потенциометрическое титрование проводят на установке ЛПУ-01, включающей платиновый индикаторный и хлорсеребряный сравнительные электроды, магнитную мешалку, микробюретку емкостью 5 мл с ценой деления 0,01 мл и стакан для титрования емкостью 100 мл. Полученные скачки потенциала при титровании солью одновалентной ртути составляют 80—100 мВ, двухвалентной — 50—80 мВ, что позволяет проводить анализ ненасыщенных соединений с достаточной точностью.
Ход анализа. Пробу анализируемой сточной воды (500 мл) помещают в делительную воронку, подкисляют концентрированной НС1 (если pH > 5), и органические вещества экстрагируют трижды (порциями примерно по 20 мл) хлороформом. Хлороформные экстракты отделяют от водного слоя, объединяют, сушат над свежепрокаленным сульфатом натрия, фильтруют через вату, предварительно обработанную хлороформом. Далее хлороформ упаривают в вакууме, остаток растворяют в 20 мл гексана и последний элюируют через колонку, заполненную 6 г окиси алюминия.
Исследуемые соединения, являясь полярными веществами, адсорбируются на окиси алюминия. После прохождения всего гексанового раствора через слой сорбента исследуемые соединения десорбируют путем пропускания через колонку 5 мл этилового спирта. Полученный спиртовый раствор помещают в стакан для титрования, доливают 25 мл этиленгликоля и титруют потенциометрически 0,1М раствором ацетата двухвалентной ртути или нитрата одновалентной ртути, содержащим в качестве каталитической добавки 0,01 М раствор НСЮ4. Количественное определение проводят путем титрования серии стандартных растворов исследуемых веществ в вышеописанных условиях.
Задание 6. Определение меди в воде методом потенциометрического титрования.
Оборудование и реактивы: проточная электрохимическая ячейка, микробюретка, дозатор, милливольтметр самопишущий Н-39, низкоомный компенсатор, ротаметр, вентиль игольчатый, сульфид натрия, х.ч., 0,1М раствор, сульфат меди, х.ч., 0,01 М раствор, аппарат Кипа для получения сероводорода, сернистый цинк, х.ч., соляная кислота, х.ч., полиэтиленовая трубка, нитрат натрия, х.ч., 0,1М раствор.
Сущность метода. Особенно удобной для потенциометрического определения меди в воде является проточная электрохимическая ячейка (ПЭЯ) с одинаковыми пористыми электродами, содержащими смесь сульфидов серебра и меди, через пористые матрицы которых фильтруют раствор сравнения и стандартный раствор.
Основой электродов, специфичных к ионам меди, служит пористая матрица цилиндрической формы, полученная прессованием смеси серебряного порошка и бикарбоната аммония. Через пористое пространство матрицы фильтруют 0,1М раствор сульфида натрия и одновременно поляризуют ее анодным током 60—80 мА/см 2 в течение 15 мин. При этом поверхность матрицы покрывается сульфидом серебра. Не отмывая матрицу от избытка сульфида натрия, ее погружают в 0,01 М раствор сульфата меди и вакуумируют. Процесс вакуумирования повторяют 4—5 раз.
После такой обработки поверхность матрицы покрывают поли-кристаллической смесью сульфидов серебра и меди. Эта смесь, нанесенная на серебряную подложку матрицы, выполняет роль мембраны, специфичной к ионам меди. С целью гомогенизации смеси сульфидов матрицы электроды нагревают до 400—420 °С в атмосфере сероводорода.
Изготовленные электроды плотно вставляют в полиэтиленовую трубку на расстоянии 0,4—0,5 см друг от друга. Концы трубки оттягивают, а между электродами приваривают капилляр для слива растворов (рис. 10).
Рис. 10. Схема установки для потенциометрического определения меди
Ошибку определения оценивают по дисперсии девяти определений в исследованном интервале концентрированной меди в растворе, содержавшем 2,2 • 10“ 4 г-м/л сульфата меди, она составляет
Ионы К + , 1МН|, Ъп 2+ , Со 2+ , Ы, 2+ , Мп 2+ , РО4” в количестве до 2,5 х х 10 _3 г-м/л каждого не мешают определению, если концентрация сульфата меди изменяется от 10 -4 до 10 -2 г-м/л.
1. Определение концентрации меди в стандартном растворе. Через пористые электроды 1 и 2 (см. рис. 10), составляющие чувствительный элемент ПЭЯ 3, пропускают 0,1М раствор нитрата натрия (раствор сравнения) из емкости 4. При этом кран 5 находится в положении 1. Через 10—15 мин, когда изменение ЭДС ПЭЯ не превышает 0,05 мВ/мин, не прерывая поступления раствора сравнения к электроду, заполняют дозатор 6 до 150 мл этим же раствором. Одновременно из микробюретки 7 доливают определенный объем титрованного раствора меди или вводят навеску сульфата меди.
Приготовленный стандартный раствор из дозатора подают к электроду, повернув кран в положение II. Через 3—4 мин измеряют
ЭДС ПЭЯ самопишущим милливольтметром Н-39. При необходимости перед началом измерений корректируют нулевое положение пера самописца с помощью низкоомного компенсатора 8. Скорость фильтрации растворов через электроды ПЭЯ измеряют ротаметром 9 и поддерживают равной 0,05 мл/с игольчатым вентилем 10. Измерения повторяют 2—3 раза. После измерений кран 5 переводят в положение I, а оставшийся в дозаторе раствор сливают через кран 11.
2. Определение меди в исследуемой воде. После стандартизации систему тщательно промывают дистиллированной водой. В начале определения через электроды 1 и 2 пропускают из емкости 4 0,1М раствор нитрата натрия при положении I крана 5. Через 10—15 мин, когда изменение ЭДС ПЭЯ не превышает 0,05 мВ/мин, не прерывая поступления раствора нитрата натрия, заполняют дозатор 6 до 150 мл этим же раствором. Одновременно из микробюретки 7 доливают определенный объем исследуемой воды. Раствор из дозатора подают к электроду, повернув кран в положение II. Далее проводят анализ согласно вышеописанному.
Лабораторная работа 7 ИССЛЕДОВАНИЕ ПОЛИМЕРОВ
Цель работы: определение стирола в водных вытяжках из полимерных материалов методом прямого потенциометрического титрования.
Оборудование и реактивы: рН-метр ЛПУ-01 в системе платинового индикаторного и хлорсеребряного сравнительного электродов, магнитная мешалка, микробюретка на 5 мл (цена деления 0,01 мл), стакан химический на 100 мл, воронки делительные на 500 мл, чашки фарфоровые, стирол, ч.д.а., свежеперегнанный, четыреххлористый углерод, ч.д.а., спирт этиловый, этиленгликоль, ч.д.а., кислота хлорная, ч.д.а., 0,01М раствор, ацетат ртути, ч.д.а., 0,1М раствор.
Сущность метода. В основу метода положена способность солей двухвалентной ртути к реакции присоединения по месту двойных уг-лерод-углеродных связей, позволяющая использовать их для определения стирола в водно-этиленгликолевом растворителе.
Аналитическим реагентом служит водный 0,1М раствор ацетата ртути, содержащий в качестве каталитической добавки 0,01М раствор НС104, подавляющий сольволиз. Стандартизацию ацетата ртути проводят комплексонометрически. Потенциометрическое титрование выполняют на установке, состоящей из рН-метра ЛПУ-01, включающей платиновый индикаторный и хлорсеребряный сравнительные электроды, магнитную мешалку, микробюретку емкостью 5 мл с ценой деления 0,01 мл и стакан для титрования емкостью 100 мл.
Ход анализа. Испытуемую вытяжку в количестве 200 мл из исследуемого полимерного материала помещают в делительную воронку; прибавляют 10 мл СС14 и производят извлечение стирола. Операцию извлечения повторяют трижды, порциями по 10 мл. Хлороформные экстракты объединяют, помещают в фарфоровую чашку и испаряют при комнатной температуре до 2—3 капель. К остатку добавляют 5 мл этилового спирта; спиртовый раствор наливают в стакан для титрования, добавляют 25 мл этиленгликоля и титруют потенциометрически 0,1М раствором ацетата ртути, содержащим каталитическую добавку 0,01М раствора. Количественное определение проводят путем титрования серии стандартных растворов стирола в этиловом спирте в вышеописанных условиях анализа.
- 1. Равновесный потенциал. Нормальный потенциал. Реальный потенциал. Стандартный потенциал. Потенциал асимметрии.
- 2. Уравнение Нернста.
- 3. На чем основаны потенциометрические методы анализа? Потенциометрическое титрование. Прямая потенциометрия.
- 4. Электроды первого рода. Электроды второго рода. Индикаторный электрод.
- 5. Ионообменные мембраны. Стеклянный электрод. Сурьмяный электрод. Конструкция. Механизм работы.
- 6. Кривые потенциометрического титрования, реакция осаждения и ком-плексообразования.
- 7. Кривые потенциометрического титрования в окислительно-восстановительных реакциях.
- 8. Аппаратурное оформление потенциометрии.
- 9. Некомпенсационный метод оформления потенциометрии. Достоинства. Недостатки.
источник