Определение жесткости воды в современном мире – это обязательное условие для обеспечения работоспособности всей техники, работающей с ней. Тем не менее нельзя сказать, что такая жидкость действительно вредна для человека. Всего должно быть в меру, ведь излишне мягкая вода наносит не меньше ущерба здоровью, чем жесткая.
Начинать всегда следует с самых азов, чтобы было полное понимание проблемы. В нашем случае, прежде чем приступать к определению жесткости воды, сначала нужно понять, что она собой представляет. По результатам экспертизы, проведенной в 2011 на кафедре химии и экологии Новгородского университета им. Ярослава Мудрого, для природной натуральной воды жесткость является абсолютно нормальным явлением. Вплоть до момента появления современной техники этот вопрос вообще мало кого интересовал, тысячелетиями люди спокойно употребляли ее в том виде, в котором она есть. Придают воде жесткость растворенные в ней соли магния и кальция. Само понятие жесткости возникло по результатам ощущения людей, так как когда насыщенная этими солями и другими элементами вода вступает во взаимодействие с мылом, пена практически не образуется, затрудняя стирку или мытье.
Прежде чем понять, какую воду пить, следует учитывать тот факт, что жесткость не является однородной величиной. Есть как минимум две основные разновидности:
Зависят эти виды от типа растворенных солей, которые в любой жесткой воде присутствуют всегда вместе, составляя общую жесткость. Тем не менее разделять их можно и нужно. Временная жесткость напрямую зависит от наличия бикарбонатных и гидрокарбонатных анионов. Главная их особенность – разложение во время кипячения. В результате распада получается непосредственно сама вода, углекислый газ и карбонат кальция, который уже практически не растворяется. Получается, что от временной жесткости можно без особых проблем избавиться при помощи простого поднятия температуры воды до +100 градусов. В качестве примера можно привести любой чайник. После продолжительного использования можно обнаружить внутри осадок, который и является результатом описанного выше процесса распада. Все же, что не разлагается подобным образом, относится к постоянной жесткости, избавиться от которой без специальной обработки практически невозможно.
Это необходимо для того, чтобы понимать, какую воду пить можно без опаски, а также для того, чтобы любая техника, взаимодействующая с водой, не вышла из строя. Для человека излишне жесткая вода вредна. Но даже если этот параметр будет находиться на приемлемом для нашего организма уровне, все равно оборудование это не устроит. Аквариумы, кофейные, стиральные и посудомоечные машины, чайники, мультиварки и множество других вариантов техники требует воду строго определенной жесткости. Обычно справиться с этим помогают фильтры типа «Гейзер-3», однако зачастую такая мера может даже считаться излишней. Прежде чем тратить на них деньги, рекомендуется сначала провести тест на жесткость воды, ведь вполне возможно, что этот показатель и так на нормальном уровне.
Как уже было сказано выше, в первую очередь ущерб человеку наносит не какой-то определенный тип воды, а полное отсутствие баланса в организме.
- Плохое растворение пищевых продуктов (связано с катионами Ca 2 + и Mg 2 +).
- Кофе, чай и любые другие подобные напитки завариваются очень плохо.
- При длительном употреблении возможно расслабление желудка.
- Жесткая вода может стать причиной образования камней в почках.
- Насыщает организм требуемыми ему элементами.
- Улучшает состояние зубов, уменьшает вероятность возникновения кариеса.
- Жесткая вода является причиной поломки большинства видов техники.
- Выводит шлаки, но попутно вымывает полезные элементы (калий, магний и кальций). В результате кости становятся более хрупкими. Также не лучшим образом воздействует на сердечно-сосудистую систему.
- Негативно воздействует на гипофиз-адреналиновую систему.
- Оказывает плохое влияние на водно-солевой баланс организма.
Таким образом, определение жесткости воды должно производится не с целью избавиться от нее, а для того, чтобы свести негативное воздействие к минимуму и привести употребление такой жидкости к требуемому организмом балансу.
Согласно ГОСТу, питьевая вода должна проверяться на жесткость строго в лаборатории, посредством титриметрического анализа. Для этого сначала необходимо взять пробы, объем которых должен быть не менее 400 кубических сантиметров (0,4 литра). В качестве емкости, в которой будет производиться хранение, может использоваться любая тара, если она изготовлена из стекла или полимерного материала. Очень важно провести анализ не позднее чем через 24 часа после отбора пробы. В особых случаях, когда необходимо увеличить этот срок, производится подкисление жидкости посредством добавления соляной кислоты. В таком состоянии она может храниться уже около 1 месяца.
Среди всех методов определения жесткости воды данный вариант заслуженно считается самым достоверным и комплексным. В его основе лежит процесс образования соединений трилона вместе со щелочноземельными элементами ионов. Минимальный показатель жесткости, который поддается определению при помощи этого способа, – 0,1 о Ж (нормой считается 7-10 о Ж). В качестве пробы может быть использована обычная вода из-под крана. Лучшим выходом в ситуации с подозрением на повышенную жесткость является сразу же посетить соответствующую лабораторию, так как никакие домашние методы не смогут выдать точные данные. Но о них — ниже.
Полностью описывать весь процесс нет никакого смысла, так как воспроизвести его самостоятельно, без нужных навыков и химических элементов и оборудования невозможно. Тем не менее можно выделить несколько основных принципов реакции, которые сохраняются в любой ситуации и присущи абсолютно всем вариантам:
- Всегда должен быть способ, позволяющий зафиксировать эквивалентность реакции, которая и является основой для определения жесткости.
- Анализ проводится очень быстро.
- Должно выполняться требование стехиометричности процесса. Проще говоря, это значит, что в процессе проведения реакции не должны образовываться никакие побочные продукты.
- С момента начала реакции ее невозможно повернуть вспять или остановить.
Для определения жесткости воды в домашних условиях можно использовать специальные приспособления, купить которые не составит особого труда (они не запрещены и общедоступны). Выглядят они как стандартные тестовые полоски. Для использования достаточно погрузить одну из них в воду, требующую проверки, на указанный в инструкции период времени. В результате изделие изменит свой цвет. При использовании таких полосок для определения жесткости воды главной проблемой является определить, каков именно показатель жесткости. Чтобы это сделать, нужно сравнивать цвет на полосе и примеры с описанием на упаковке. К сожалению, далеко не всегда можно сразу же понять, что именно показывает приспособление, и даже в более четкой ситуации точность данных оставляет желать лучшего. В целом такие тест-полоски подходят только для общего понимания того, насколько жесткая или мягкая вода.
Проверить воду из-под крана на жесткость также можно при помощи подручных средств. Правда, это скорее занимательный опыт для детей, чем действительно вариант тестирования показаний жидкости.
- Банку емкостью 1 литр (или любую другую подобную емкость).
- Стакан в форме цилиндра.
- Любые весы (удобнее всего использовать электронные).
- Линейку.
- Мыло хозяйственное (72% или 60%).
- Дистиллированную воду.
Для проверки необходимо взять 1 грамм мыла, измельчить его и поместить в стакан. После этого следует подогреть дистиллированную воду, но не доводить до кипения. Ее следует налить в тот стакан, в котором уже лежит мыло. В итоге оно обязано растворится в воде. Следующий шаг – налить еще больше воды. После этого следует налить в банку обычной воды из-под крана и медленно вылить мыльную жидкость из стакана и перемешать (медленно). Если образуется пена, то это — показатель жесткости. К сожалению, более или менее четко сказать, каков именно ее уровень, при помощи такого метода практически невозможно.
Еще один вариант определения жесткости питьевой воды – воспользоваться специальным прибором – TDS-метром. В принципе, он предназначен для определения электропроводимости воды, на что влияют как непосредственно соли (создающие жесткость), так и множество других элементов, что не дает нужного уровня точности. Более того, показания прибора обычный человек, не умеющий их считывать, не поймет и скорее всего запутается. Попробуем упростить задачу. Подавляющее большинство таких устройств в качестве единиц измерения используется некие ppm. У нас же применяются другие варианты, основанные на эквиваленте миллиграмма на литр жидкости. В среднем, 1 наша единица (мг-экв/л) равняется 50,05 зарубежным ppm. По правилам, концентрация солей (т.е. жесткости) должна быть не более 350 ppm или же 7 мг-экв/л. На эти цифры и стоит ориентироваться. Если же прибор будет отечественным, все значительно облегчается. Хуже всего, когда подобное приспособление произведено где-то в Китае или другой подобной стране, где используются собственные единицы измерения. Тогда придется самостоятельно искать их эквивалент и переводить в привычные нам показания.
Из других приборов, способных определять жесткость воды, отдельно следует отметить уникальное устройство АКМС-1. Это достаточно большой стационарный агрегат, сходный по размерам с фильтрами «Гейзер-3». Просто так в домашних условиях с его помощью проверять жидкость не представляется возможным. Именно поэтому такие приспособления используются в первую очередь на производстве, где жесткость воды может повлиять на работу дорогостоящей техники или нанести другой подобный вред. В отличие от всех остальных аналогов, АКМС-1 действительно быстро и точно показывает текущий уровень жесткости, позволяя оператору своевременно реагировать. При помощи этого приспособления можно как пускать воду к рабочим агрегатам напрямую, если она не представляет для них угрозы, так и предварительно ее фильтровать. Это, конечно же, выльется в дополнительные затраты, но зато поможет сэкономить на ремонте техники, который обойдется значительно дороже.
Учитывая все указанное выше и требования ГОСТ, вода питьевая должна регулярно проверяться на уровень жесткости. Тем не менее принимать радикальные меры по ее умягчению не стоит, так как вредны оба состояния – слишком жесткая и слишком мягкая. Только в той ситуации, когда показатели действительно выше или ниже, стоит предпринимать какие-то действия. К слову, если с жесткостью регулярно борются, то про слишком мягкую воду практически не слышно, а ведь на это также нужно обращать не меньше внимания.
источник
Метод определения общей жесткости воды основан на том, что ионы кальция и магния связываются трилоном Б в комплексные соединения. О конце реакции судят по изменению цвета индикатора хромогена черного от розово-малинового до синевато-серого. Появление синевато-серого окрашивания свидетельствует об отсутствии ионов Са 2+ и Mg 2+ в растворе, т. е. о полном связывании их с трилоном Б.
В коническую колбу вместимостью 250 мл отмеривают 100 мл исследуемой воды, добавляют 5 мл аммиачного буферного раствора, индикатор хромоген (сухую смесь) и медленно титруют 0,1 н раствором трилона Б до перехода окраски в серовато-синюю.
Общую жесткость воды Жо, ммоль экв/л, вычисляют по формуле
где V1 – объем 0,1 н раствора трилона Б, израсходованный на титрование пробы, мл; К – коэффициент нормальности раствора трилона Б (К = Nфакт / 0,1); N1 – нормальность раствора трилона Б; V2 – объем исследуемой пробы воды, мл.
Определение карбонатной жесткости воды
Оттитровывают 100 мл воды 0,1 н раствором HCl в присутствии метилового оранжевого до перехода окраски от желтой к розовой. Карбонатную жесткость Жк, ммоль экв/л, вычисляют по формуле
где V3 – объем HCl, который пошел на титрование, мл; N2 – нормальность HCl, моль/л; V2 – объем воды, который взят для анализа, мл.
Некарбонатная жесткость определяется как разница между общей и карбонатной жесткостью
Определение количества диоксида углерода
В колбу поместите 200 мл исследуемой воды, добавьте 2 капли раствора фенолфталеина и взболтайте. Если вода окрасилась в интенсивный розовый цвет, это значит, что в ней нет растворенного диоксида углерода. Отсутствие окраски или очень слабая окраска свидетельствуют о присутствии растворенного диоксида углерода. В этом случае пробу титруют 0,1 н раствором NaOH до появления интенсивной окраски. Концентрацию диоксида углерода определяют по формуле
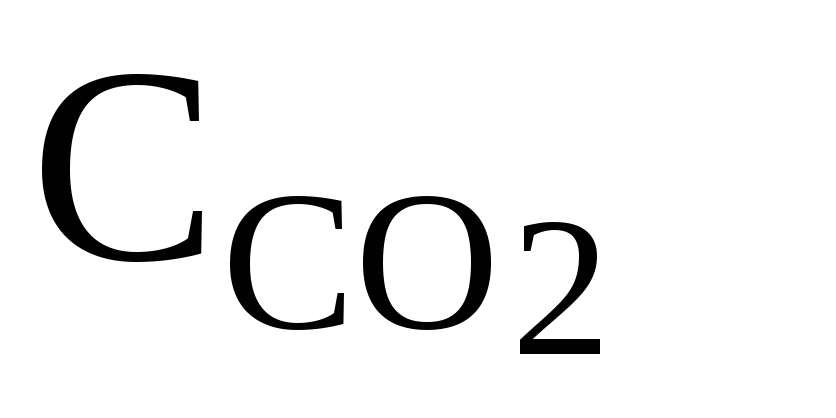
где N – нормальность NаОН, моль/л; V4 – его объем, мл.
Определение концентрации кальция и магния
К 100 мл воды добавляют 3 мл 10%-ного КОН до рН = 10–12, вносят примерно 0,2 г сухого индикатора мурексида, смешанного с сульфатом калия, и титруют трилоном Б до перехода окраски из розовой в фиолетовую.
Концентрацию кальция СК, ммоль экв/л, рассчитывают по формуле
где V5 – объем трилона Б, пошедший на титрование, мл.
Концентрацию магния См, ммоль экв/л, рассчитывают по формуле
После проведения полного обессоливания воды необходимо убедится в отсутствии в ней как катионов (Mg 2+ , Ca 2+ ), так и анионов (SO4 2– , NO3 – , Cl – ). Анализ на содержание указанных анионов в воде до ее обессоливания и после проводится качественно.
SO4 2– – раствор хлорида бария дает белый осадок сульфата бария;
Cl – – при добавлении раствора нитрата серебра образуется белый осадок хлорида серебра;
NO3 – – при добавлении раствора дифениламина в серной кислоте появляется характерное для ионов NO3 – синее окрашивание.
Определение содержания взвешенных частиц (мутность воды)
Мутность воды определяется фотоколориметрическим методом при длине волны 440 нм. Оптическую плотность измеряют в кюветах с толщиной поглощающего слоя 3 мм. Количество взвешенных частиц в воде находят по калибровочной кривой.
Регистрирующим прибором в фотоколориметре служит микроамперметр типа М907, оцифрованный в микроамперах и имеющий шкалу 0–100 делений, соответствующих шкале коэффициентов пропускания – и оптической плотности – D. При измерении со светофильтром 440 нм, отмеченным на лицевой панели колориметра черным цветом, ручку «Чувствительность» устанавливают в одно из положений 1, 2 или 3. Рабочие поверхности кювет перед каждым измерением необходимо тщательно протирать спирто-эфирной смесью, жидкость в кюветы наливать до метки на боковой поверхности кюветы. При установке кювет в кюветодержатель нельзя касаться пальцами участков поверхности кювет ниже уровня жидкости в них.
Колориметр включают в сеть за 15 мин до начала измерений. Во время прогрева кюветное отделение должно быть открыто (при этом шторка перед фотоприемником перекрывает световой пучок). В световой пучок помещают кювету со стандартным раствором, по отношению к которому производят измерения, и крышку кюветного отделения закрывают. Ручками «Чувствительность» и «Установка 100» устанавливают отсчет 100 по шкале колориметра. Затем поворотом ручки кювету со стандартным раствором заменяют кюветой с исследуемым раствором. После этого производят отсчет по шкале колориметра, соответствующий коэффициенту пропускания исследуемого раствора в процентах, или по шкале D в единицах оптической плотности. Измерения проводят 3–5 раз и окончательное значение измеряемой величины определяют как среднее арифметическое полученных значений.
источник
Для технической воды существуют свои нормы и требования по качеству, которые имеют непосредственное отношение к особенностям производственного процесса. Одной из сфер применения технической воды является покрытие нужд котельных. С их помощью организуются системы отопления в жилых домах и производственных цехах, обеспечивается нормальный ход технологического процесса на отдельных производствах. При этом оборудование, устанавливаемое для выполнения столь важной миссии, весьма чувствительно к качеству потребляемой воды.
Присутствие в воде хлора, железа, повышенная жесткость, щелочность, pH, наличие кислорода, углекислоты, солесодержание — все это способно стать причиной поломок, образования наростов накипи и отложений. Это портит оборудование, снижает эффективность его работы, а в ряде случаев может стать причиной выхода оборудования из строя и дорогостоящего ремонта. Чтобы избежать негативных последствий использования жидкости ненадлежащего качества, выполняется анализ котловой воды.
Поступление в котельные установки качественного теплоносителя влияет на эффективность функционирования всей системы и позволяет обеспечить:
- Безопасную работу установленного оборудования.
- Достаточную теплоотдачу.
- Уменьшение ремонтных и профилактических расходов.
- Длительный срок работы установок.
- Увеличение коэффициента сжигания топлива.
Образец протокола
лабораторного исследования
Поступающая в котлы вода влияет на ряд критериев работы установок:
Накипеобразование. Повышенная жесткость воды является фактором, вызывающим образование накипи на плоскостях теплообмена. Из-за этого будет снижаться теплоотдача, работа оборудования будет неэффективной. Приборы потребуют частой чистки и обслуживания, не исключается их перегрев. Как результат – поломка отдельных агрегатов котельных установок либо их полный выход из строя.
Появление ржавчины на оборудовании и трубах. Чрезмерное содержание в воде кислорода ускоряет процессы коррозии на металлических элементах. Низкая кислотность жидкости способствует распространению ржавчины на значительную площадь всего котла. Если в воде присутствует много щелочи, это приведет к излишнему пенообразованию, что становится причиной нарушения целостности стальных компонентов установок.
Анализ питательной воды котла может показать, что в ней присутствуют посторонние примеси, которые могут попасть в оборудование, в результате чего появляются такие проблемы, как:
- Загрязнение теплообменников
- Блокировка установок, отводящих конденсат
- Засорение регулирующих преград.
Всех вышеназванных негативных последствий можно избежать, если предварительно провести лабораторные анализы технических вод, обратившись в компанию «Русватер». Подобная процедура выступает неотъемлемой частью химводоподготовки котельных, позволяющей наладить верный водно-химический режим котлов.
| № п/п | Вариант №1 | Вариант №2 | Вариант №3 |
|---|---|---|---|
| 1 | Ph | Ph | Ph |
| 2 | Прозрачность | Прозрачность | Прозрачность |
| 3 | Жесткость общая | Жесткость общая | Жесткость общая |
| 4 | Щелочность общая | Щелочность общая | Щелочность общая |
| 5 | Щелочность по ф/ф | Щелочность по ф/ф | Щелочность по ф/ф |
| 6 | Хлориды | Хлориды | Хлориды |
| 7 | Железо общее | Железо общее | Железо общее |
| 8 | Сухой остаток | Сухой остаток | Сухой остаток |
| 9 | Растворенный кислород | Растворенный кислород | Растворенный кислород |
| 10 | Сульфаты | Нефтепродукты | Сульфаты/Нефтепродукты |
| 11 | Углекислота свободная | ||
| СРОК ВЫПОЛНЕНИЯ | 3 рабочих дня | ||
| ЦЕНА | 2 500 рублей | 2 750 рублей | 3 000/3 250 рублей |
| Стоимость выезда для отбора пробы | 2 000 рублей в пределах КАД, 30 руб./км начиная от КАД | ||
Паровые и водогрейные котлы не терпят чрезмерного образования пены, так как она становится причиной утечки жидкости и дает неточные данные по уровню воды, блокирует горелки и активирует аварийное оборудование. По этой причине к качеству воды для котлов предъявляются высокие требования, благодаря которым пенообразование берется под контроль именно в процессе анализа сетевой воды.
Выполнить контроль концентрации растворенных элементов можно с помощью TDS-метра. Кроме того разработан целый ряд методов, направленных на определение таких параметров котловой воды, как:
- прозрачность;
- щелочность;
- жесткость;
- содержание хлоридов, нитратов, фосфатов, растворенного кислорода, аммиака, соединений железа,
- свободной углекислоты;
- сухого остатка и солесодержания;
- значения pH.
Качество котловой воды регламентируется следующими документами:
- ГОСТ Р 55682.12-2013/ЕН 12952-12:2003 Котлы водотрубные и котельно-вспомогательное оборудование. Часть 12. Требования к качеству питательной и котельной воды
- РД 24.031.120-91 Методические указания. Нормы качества сетевой и подпиточной воды водогрейных котлов, организация водно-химического режима и химического контроля
- РД 24.032.01-91. Нормы качества питательной воды и пара, организация водно-химического режима и химического контроля паровых стационарных котлов-утилизаторов и энерготехнологических котлов
- СНиП II-35-76 «Котельные установки».
- ГОСТ 20995-75. Котлы паровые стационарные давлением до 3,9 МПа. Показатели качества питательной воды и пара.
Жесткая вода не образует пену, однако из-за нее в котле образуется накипь. Умягчение воды решает проблему жесткости, но не справляется с образованием пены. В случае загрязнения жидкости взвешенными коллоидными частицами на воде также будет появляться пена, при этом подобные компоненты трудно поддаются фильтрации из-за малого диаметра – фильтры не могут их задержать.
Если проблема заключается в излишней пене, добавление в воду составов, снижающих ее интенсивность, будет малоэффективным, если причиной ее образования будет чрезмерная концентрация взвешенных коллоидных частиц. Для этого требуется контролировать концентрацию растворенных элементов и подобрать равновесный режим солесодержания в воде, в том числе и посредством анализа воды на жесткость в котельной. В результате пенообразование будет снижено, а установка продолжит работу в экономичном режиме.
Для поддержания надлежащего качества котловой воды изначально требуется установление исходных параметров. С этой целью проводится анализ воды для котельной, позволяющий определить отклонения от нормы. В зависимости от результатов выбирается конкретный метод водоподготовки, который приведет качество воды к нормам, указанным в инструкции завода-изготовителя, а также в нормативных документах.
Специалисты компании «Русватер» выполняют анализ промышленной воды с использованием современных систем и оборудования. Мы предлагаем полный комплекс услуг, сопутствующих правильной водоподготовке промышленного оборудования любых типов и назначения.
источник
Жесткость — свойство воды, обусловленное присутствием в ней растворенных солей щелочно-земельных металлов (преимущественно кальция и магния). Различают жесткость кальциевую и магниевую, связанную с присутствием в воде соответственно ионов кальция и магния. Суммарное содержание ионов этих металлов в воде называется общей жесткостью.
Общая жёсткость подразделяется на карбонатную, обусловленную присутствием в воде гидрокарбонатов и карбонатов кальция и магния, и некарбонатную, обусловленную наличием кальциевых и магниевых солей сильных кислот.
Карбонатную жёсткость также называют временной (устранимой), а некарбонатную — постоянной. Гидрокарбонаты кальция и магния при длительном кипячении воды разлагаются с выделением диоксида углерода и выпадающих в осадок карбонатов кальция и магния (при дальнейшем кипячении карбонат магния гидролизуется с образованием гидроксида); жесткость воды при этом уменьшается:
Жесткость, оставшаяся после кипячения воды в течение определенного времени, достаточного для полного разложения гидрокарбонатов и удаления диоксида углерода (обычно 1 — 1,5 ч), называется постоянной жесткостью. Постоянная жесткость является важной характеристикой качества воды, используемой для технических целей. Она преимущественно зависит от содержания ионов кальция и магния, которые после кипячения уравновешиваются сульфатами и хлоридами. Эту часть постоянной жесткости, называемую также остаточной жесткостью, можно найти по разности между общей жесткостью и концентрацией гидрокарбонатов, выраженной в миллимолях на кубический дециметр. Однако кроме остаточной жесткости в воде после кипячения остается небольшое количество ионов кальция и магния, обусловленное растворимостью карбоната кальция и гидроксида магния. Эта часть постоянной жесткости называется неустранимой жесткостью. Поскольку растворимость карбоната кальция и гидроксида магния в присутствии ионов кальция и магния в растворе весьма незначительна, обычно некарбонатную (остаточную) жесткость отождествляют с постоянной жесткостью. Способ расчета постоянной жесткости и составляющих ее остаточной и неустранимой жесткости на основе результатов определения компонентов солевого состава воды приведен в «Руководстве по химическому анализу вод суши». Л.: Гидрометеоиздат. 1973.
Жесткость воды в настоящее время выражают в миллимолях количества вещества эквивалентов (КВЭ) Са 2+ и Mg 2+ , содержащихся в 1 дм 3 воды — ммоль/дм 3 КВЭ (ранее эту единицу обозначали мг-экв/л или мг-экв/дм 3 ). Миллимоль КВЭ Са 2+ и Mg 2+ равны соответственно 20,04 мг/ммоль и 12,15 мг/ммоль.
В естественных условиях ионы кальция и магния поступают в воду в результате взаимодействия растворенного диоксида углерода с карбонатными минералами и при других процессах растворения и химического выветривания горных пород. Источником этих ионов являются также микробиальные процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий: силикатной, металлургической, стекольной, химической промышленности, стоки с сельскохозяйственных угодий.
Общая жесткость поверхностных вод колеблется в основном от единиц до десятков миллимолей КВЭ в кубическом дециметре, причем карбонатная жесткость часто составляет 70 — 80 % от общей жесткости. Она подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период паводка. Жесткость подземных вод более постоянна.
Вода с жесткостью менее 4 ммоль/дм 3 КВЭ характеризуется как мягкая; от 4 до 8 ммоль/дм 3 КВЭ — средней жесткости; от 8 до 12 ммоль/дм 3 КВЭ — жесткая; более 12 ммоль/дм 3 КВЭ — очень жесткая.
Обычно преобладает (иногда в несколько раз) жесткость, обусловленная ионами кальция, однако в отдельных случаях, магниевая жесткость может достигать 50 — 60 % общей жесткости и более (часто магниевая жесткость превосходит кальциевую в морских и океанических водах, либо в поверхностных водах суши с высоким содержанием сульфат-ионов).
Высокая жесткость оказывает отрицательное влияние на свойства воды используемой в промышленности и для хозяйственно-бытовых целей. Жесткие требования в отношении величины жесткости предъявляются к воде, питающей паросиловые установки, поскольку в присутствии сульфатов и карбонатов кальций и магний образуют прочную накипь, уменьшающую теплопроводность металла и приводящую к перерасходу топлива и перегреву котлов. Для устранения жесткости применяют различные способы — осаждение труднорастворимых солей кальция и магния химическим или термическим путем, умягчение с помощью ионитов.
Высокая жесткость, особенно, обусловленная превышением солей магния, ухудшает органолептические свойства воды, придавая ей горьковатый вкус и оказывая отрицательное воздействие на органы пищеварения. Предельно допустимая величина жесткости в питьевых водах 7 ммоль/дм 3 КВЭ, но в некоторых случаях допускается использовать для питьевых целей воду с жесткостью 10 ммоль/дм 3 КВЭ.
ЖЕСТКОСТЬ ВОДЫ.
МЕТОДИКА ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ
ТИТРИМЕТРИЧЕСКИМ МЕТОДОМ С ТРИЛОНОМ Б
1.1 Настоящий руководящий документ устанавливает методику выполнения измерений (далее — методика) общей и некарбонатной жесткости в пробах природных и очищенных сточных вод в диапазоне от 0,060 до 13,00 ммоль/дм 3 КВЭ (далее — ммоль/дм 3 ) титриметрическим методом с трилоном Б.
При анализе проб воды с величиной жесткости, превышающей 13,00 ммоль/дм 3 , допускается выполнение измерений после соответствующего разбавления пробы дистиллированной водой.
1.2 Настоящий руководящий документ предназначен для использования в лабораториях, осуществляющих анализ природных и очищенных сточных вод.
В настоящем руководящем документе использованы ссылки на следующие нормативные документы:
ГОСТ 12.1.005-88 ССБТ. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 ССБТ. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 17.1.5.04-81 Охрана природы. Гидросфера. Приборы и устройства для отбора, первичной обработки и хранения проб природных вод. Общие технические условия
ГОСТ 17.1.5.05-85 Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков
ГОСТ Р ИСО 5725-6-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике
ГОСТ Р 51592-2000 Вода. Общие требования к отбору проб
МИ 2881-2004 Рекомендация. ГСИ. Методики количественного химического анализа. Процедуры проверки приемлемости результатов анализа
РД 52.24.403-2007. Массовая концентрация кальция в водах. Методика выполнения измерений титриметрическим методом с трилоном Б
Примечание — Ссылки на остальные нормативные документы приведены в разделах 4, В.3 и В.4.
3.1 При соблюдении всех регламентируемых методикой условий проведения измерений характеристики погрешности результата измерения с вероятностью 0,95 не должны превышать значений, приведенных в таблице 1.
Таблица 1 — Диапазон измерений, значения характеристик погрешности и ее составляющих (Р = 0,95)
Показатель повторяемости (среднеквадратическое отклонение повторяемости) s r, ммоль/дм 3
Показатель воспроизводимости (среднеквадратическое отклонение воспроизводимости) s R, ммоль/дм 3
Показатель правильности (границы систематической погрешности при вероятности Р = 0,95) ± D с, ммоль/дм 3
Показатель точности (границы погрешности при вероятности Р = 0,95) ± D , ммоль/дм 3
источник
Как выполняется контроль жёсткости воды. Понятие жёсткости, от чего она зависит. Анализ воды на жёсткость дома. Лабораторные методы контроля общей и временной жёсткости жидкости. Приборы для выполнения анализа. Методы борьбы с повышенной жёсткостью в быту. Контроль жёсткость воды или анализ воды на жёсткость нужен для определения концентрации солей в жидкости. Этот анализ можно проводить в лабораторных условиях и дома.
Жёсткость воды – термин, говорящий о процентном соотношении солевых частиц магния и калия в жидкости. Она подразделяется на две разновидности:
- Временная (такая жидкость называется карбонатная);
- Общая жёсткость (данная вода относится к некарбонатной).
Первый тип жёсткости характеризуется присутствием гидрокарбонатных солевых частиц магния и калия. Если такую воду закипятить, то элементы распадутся на карбонаты и гидроксиды и выпадут в осадок. Именно этот белый налёт часто покрывает наши чайники изнутри и собирается на других нагревательных элементах.
Для жидкости с общей жёсткостью характерно наличие других химических элементов (различных нитратов, хлоридов и тп.п). Обычно жёсткость питьевой воды связана с особенностями вашего региона, составом грунтов. Чем больше известковых пород находится в почве, тем выше жёсткость воды. Но важно не только понимать суть понятия, но и знать, как проверить жёсткость воды. Выполнить это легко как в быту, так и на заводе.
Для проверки жёсткости водопроводной воды дома можно использовать следующие способы:
- Постарайтесь обильно вспенить мыльный брусок или порошок для стирки. Если у вас образуется мало пены, то ваша вода имеет повышенную жёсткость. Это возникает по той причине, что солевые частицы калия и магния не позволяют мылу пениться. При обильной пышной пене от любого моющего средства можно утверждать, что вода нежёсткая. Но этот метод не позволят точно определить степень жёсткости.
- На вкус также можно отличить жёсткую воду от мягкой. Она более горькая. Но не все могут точно уловить горьковатый привкус солей магния и калия.
- Белый осадок в чайниках, накипь на нагревательных элементах других бытовых приборов – признак жёсткой воды. Осадок возникает из-за распада солей и выпадения их на дно. Данная особенность жёсткой воды очень вредит бытовым приборам и отопительному трубопроводу.
- От жёсткости воды зависит скорость заваривания чайного напитка. При мягкой воде на эту процедуру уйдёт от 3 до 6 мин., в жёсткой воде чай будет завариваться от 8 до 12 мин. Кстати, на вкус оба напитка будут существенно отличаться.
- Благодаря нехитрому компактному измерительному прибору можно очень легко определить жёсткость любой жидкости. Он называется TDS-метр. Агрегат измерят электропроводность жидкости. Чем выше показатель, тем больше уровень солесодержания жидкости. Обычно его ещё называют солемер. Чаще такой анализ воды на жёсткость делают владельцы аквариумов и цветоводы.
- Проверить жёсткость воды в быту можно, используя тест-полоски, продающейся в аптеках медтехники.
Для этого анализа можно использовать колориметрическую методику и принцип титрования. Процедура анализа выполняется так: порция воды смешивается с метилоранжем (индикатором), ёмкость устанавливается на светлом фоне. Во вторую тару с водой добавляют соляную кислоту, пока не получится красно-оранжевый цвет воды.
Временную жёсткость жидкости находят в процессе расчёта требуемого количества соляной кислоты по формуле: Нвр = NHCl * VHCL* 1000/ V1, где N-насыщенность раствора, V-его количество, V1-количество пробы.
Этот анализ проводят в лаборатории. Для него используют комплексонометрическую методику. Она базируется на принципе возникновения соединений ионов, подвергающихся анализу, с природными реагентами. Сначала воду в пробирке разводят раствором индикатора на спирту (чёрного этиохрома «Т»). Также для этих целей может использоваться сухая смесь кальциевых и натриевых хлоридов. В итоге полученная смесь окрашивается в насыщенный рубиновый цвет. Затем в пробирку капается вещество, называемое Трилон.
Расчёт общей жёсткости производится по уравнению: Жо=Nx*Vx*1000/V1, где N-насыщенность вещества Трилон, V-его количество, V1-количество пробы.
Как мы уже говорили выше, прибор контроля жёсткости воды называется солемер или TDS-метр. Точность проверки составляет 2%. Основной принцип работы данного агрегата построен на зависимости электропроводности жидкости от общего числа примесей солей магния и калия. То есть чем больше данных солей в воде, тем больше будут показания прибора, а следовательно, тем выше жёсткость воды.
На некоторых предприятиях и заводах наблюдается прямая зависимость между жёсткостью используемой воды и исправностью работы оборудования. Поэтому для обеспечения бесперебойной работы технологического оборудования требуется осуществлять постоянный автоматический контроль жёсткости воды.
Для этих целей используется специальное оборудование, например, анализатор «АКМС-1». Этот прибор непрерывно контролирует содержание солевых частиц кальция и магния в жидкости, поступающей в технологическое оборудование. То есть он подсчитывает общую жёсткость в пределах 0,005-25,0 мг-экв/л.
Как понять, что ваша водопроводная вода жёсткая, мы писали выше. Теперь перечислим ряд мер, позволяющих снизить жёсткость воды в домашних условиях:
- Самый простой способ – кипячение воды.
- Фильтрация воды через системы обратного осмоса (специальные мембраны).
- Использование смягчающих солей.
- Применение фильтрующих картриджей.
- Магнитное фильтрующее устройство.
- Использование ионообменной смолы в комплексе с солевым раствором.
Хотите провести контроль жёсткости воды? Заказать такую услугу вы можете у наших специалистов, для этого вам достаточно связаться с нами по указанным телефонам.
источник
Методы определения жесткости
Drinking water. Methods of hardness determination
____________________________________________________________________
Текст Сравнения ГОСТ 31954-2012 с ГОСТ Р 52407-2005 см. по ссылке.
— Примечание изготовителя базы данных.
____________________________________________________________________
МКС 13.060.50
ТН ВЭД 220100000
220100000
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены в ГОСТ 1.0-2015 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2-2015 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Обществом с ограниченной ответственностью «Протектор» совместно с Закрытым акционерным обществом «Центр исследования и контроля воды»
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (по переписке, протокол от 3 декабря 2012 г. N 54)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97
Сокращенное наименование национального органа по стандартизации
Минэкономики Республики Армения
Госстандарт Республики Беларусь
Госстандарт Республики Казахстан
4 Приказом Федерального агентства по техническому регулированию и метрологии от 12 декабря 2012 г. N 1899-ст межгосударственный стандарт ГОСТ 31954-2012 введен в действие в качестве национального стандарта Российской Федерации с 1 января 2014 г.
5 В настоящем стандарте учтены основные нормативные положения международных стандартов:
— ISO 6059:1984 «Качество воды. Определение суммарного содержания кальция и магния. Титриметрический метод с применением ЭДТА» («Water quality — Determination of the sum of calcium and magnesium — EDTA titrimetric method», NEQ);
— ISO 7980:1986 «Качество воды. Определение кальция и магния. Атомно-абсорбционный спектрометрический метод» («Water quality — determination of calcium and magnesium — Atomic absorption spectrometric method», NEQ).
Стандарт подготовлен на основе применения ГОСТ Р 52407-2005
7 Издание (июль 2018 г.) с Поправкой (ИУС 1-2017)
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе «Национальные стандарты», а текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
Жесткость воды является одним из основных показателей, характеризующим применение воды в различных отраслях.
Жесткостью воды называется совокупность свойств, обусловленных содержанием в ней щелочноземельных элементов, преимущественно ионов кальция и магния.
В зависимости от рН и щелочности воды жесткость выше 10 °Ж может вызывать образование шлаков в распределительной системе водоснабжения и накипи при нагревании. Вода жесткостью менее 5 °Ж может оказывать коррозионное воздействие на водопроводные трубы. Жесткость воды может влиять и на применяемость для потребления человеком с точки зрения ее вкусовых свойств.
При комплексонометрическом (титриметрическом) определении жесткости ионы алюминия, кадмия, свинца, железа, кобальта, меди, марганца, олова и цинка влияют на установление эквивалентной точки и мешают определению. Ионы ортофосфата и карбоната могут осаждать кальций в условиях титрования. Определению могут также мешать некоторые органические вещества. Если мешающее влияние невозможно устранить, определение жесткости рекомендуется проводить методами атомной спектрометрии.
Настоящий стандарт предусматривает использование различных методов определения жесткости воды с учетом приведения количественной характеристики жесткости воды (единицы жесткости) через градусы жесткости (°Ж) по ГОСТ 31865.
Настоящий стандарт распространяется на природные (поверхностные и подземные) воды, в том числе воды источников питьевого водоснабжения, а также на питьевую воду, в том числе расфасованную в емкости, и устанавливает следующие методы определения жесткости воды:
— комплексонометрический метод (метод А);
— методы атомной спектрометрии (методы Б и В).
Метод Б применяют для определения массовой концентрации ионов кальция и магния.
Метод В является арбитражным по отношению к другим методам определения жесткости.
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:
ГОСТ ИСО/МЭК 17025-2009 Общие требования к компетентности испытательных и калибровочных лабораторий
ГОСТ 17.1.5.05-85 Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков
ГОСТ 1770-74 (ISO 1042-83, ISO 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Технические условия
ГОСТ 2053-77 Реактивы. Натрий сернистый 9-водный. Технические условия
ГОСТ 3118-77 Реактивы. Кислота соляная. Технические условия
ГОСТ 3760-79 Реактивы. Аммиак водный. Технические условия
ГОСТ 3773-72 Реактивы. Аммоний хлористый. Технические условия
ГОСТ 4233-77 Реактивы. Натрий хлористый. Технические условия
ГОСТ 4328-77 Реактивы. Натрия гидроокись. Технические условия
ГОСТ 4461-77 Реактивы. Кислота азотная. Технические условия
ГОСТ 5456-79 Реактивы. Гидроксиламина гидрохлорид. Технические условия
ГОСТ 5457-75 Ацетилен растворенный и газообразный технический. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 10652-73 Реактивы. Соль динатриевая этилендиамин-N,N,N’,N’-тетрауксусной кислоты 2-водная (трилон Б). Технические условия
ГОСТ 17433-80 Промышленная чистота. Сжатый воздух. Классы загрязненности
ГОСТ 18300-87 Спирт этиловый ректификованный технический. Технические условия
ГОСТ 23950-88 Вода питьевая. Метод определения массовой концентрации стронция
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 29169-91 (ИСО 648-77) Посуда лабораторная стеклянная. Пипетки с одной отметкой
ГОСТ 29227-91 (ИСО 835-1-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
ГОСТ 29251-91 (ИСО 385-1-84) Посуда лабораторная стеклянная. Бюретки. Часть 1. Общие требования
ГОСТ 31861-2012 Вода. Общие требования к отбору проб
ГОСТ 31862-2012 Вода питьевая. Отбор проб
ГОСТ 31865-2012 Вода. Единица жесткости
ГОСТ 31870-2012 Вода питьевая. Определение содержания элементов методами атомной спектрометрии
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя «Национальные стандарты» за текущий год. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
Общие требования к отбору проб — по ГОСТ 31861, ГОСТ 31862 и ГОСТ 17.1.5.05.
Пробу отбирают объемом не менее 400 см для анализа по методу А и не менее 200 см для анализа по методам Б и В в емкость, изготовленную из полимерных материалов или стекла.
Срок хранения пробы воды — не более 24 ч.
Для увеличения срока хранения пробы и для предотвращения осаждения из воды карбонатов кальция (что характерно для подземных или бутилированных вод) пробу подкисляют кислотой до рН
Для воды, расфасованной в емкости, сроки и температурные условия хранения должны соответствовать требованиям, указанным в нормативной документации* на готовую продукцию.
_______________
* В Российской Федерации — требованиям ГОСТ Р 52109-2003 «Вода питьевая, расфасованная в емкости. Общие технические условия» — переоформляется в межгосударственный стандарт.
4.1 Сущность метода
Метод основан на образовании комплексных соединений трилона Б с ионами щелочноземельных элементов. Определение проводят титрованием пробы раствором трилона Б при рН=10 в присутствии индикатора. Наименьшая определяемая жесткость воды — 0,1 °Ж.
Если исследуемая проба была подкислена для консервации или проба имеет кислую среду, то в аликвоту пробы добавляют раствор гидроксида натрия (см. 4.3.8) до рН=6-7. Если проба воды имеет сильнощелочную среду, то в аликвоту пробы добавляют раствор соляной кислоты (см. 4.3.7) до рН=6-7. Контроль рН проводят по универсальной индикаторной бумаге или с использованием рН-метра. Для удаления из воды карбонат и бикарбонат ионов (что характерно для подземных или бутилированных вод) после добавления к аликвоте пробы раствора соляной кислоты до рН=6-7 проводят ее кипячение или продувание воздухом или любым инертным газом в течение не менее пяти минут для удаления углекислого газа. Критерием наличия в воде значительного количества карбонатов может служить щелочная реакция воды.
Присутствие в воде более 10 мг/дм ионов железа; более 0,05 мг/дм каждого из ионов меди, кадмия, кобальта, свинца; свыше 0,1 мг/дм каждого из ионов марганца (II), алюминия, цинка, кобальта, никеля, олова, а также цветность более 200 °Ж и повышенная мутность вызывают при титровании нечеткое изменение окраски в точке эквивалентности и приводят к завышению результатов определения жесткости. Ортофосфат- и карбонат-ионы могут осаждать кальций в условиях титрования при рН=10.
Для уменьшения влияния содержащихся в воде цинка до 200 мг/дм , алюминия, кадмия, свинца до 20 мг/дм , железа до 5 мг/дм , марганца, кобальта, меди, никеля до 1 мг/дм к аликвоте пробы до введения индикатора добавляют 2 см раствора сульфида натрия (см. 4.3.6); для уменьшения влияния марганца до 1 мг/дм , железа, алюминия до 20 мг/дм , меди до 0,3 мг/дм добавляют от 5 до 10 капель раствора гидроксиламина гидрохлорида (см. 4.3.5). Мутность (взвешенные вещества) пробы устраняют фильтрованием через мембранные фильтры с диаметром пор 0,45 мкм или бумажные обеззоленные фильтры «синяя лента». Влияние цветности и других факторов устраняют разбавлением пробы в ходе анализа по 4.5, если это позволяет определяемое значение жесткости воды.
Примечание — Фильтрование пробы может привести к занижению результатов определения жесткости воды, особенно воды с щелочной реакцией.
Если мешающие влияния устранить невозможно, то определение жесткости проводят методами атомной спектрометрии.
4.2 Средства измерения, вспомогательное оборудование, реактивы, материалы
Государственный (межгосударственный) стандартный образец (ГСО) состава жесткости (общей жесткости) воды с относительной погрешностью аттестованного значения при доверительной вероятности 0,95 не более ±1,5%.
Весы лабораторные* с наибольшим пределом взвешивания 220 г, обеспечивающие точность взвешивания с пределом допускаемой абсолютной погрешности не более ±0,75 мг.
_______________
* В Российской Федерации действует ГОСТ Р 53228-2008 «Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания».
рН-метр любого типа.
Колбы мерные по ГОСТ 1770 2-го класса точности.
Пипетки градуированные по ГОСТ 29227 2-го класса точности или пипетки с одной отметкой по ГОСТ 29169 2-го класса точности.
Бюретки по ГОСТ 29251 2-го класса точности вместимостью 25 см и (или) 10 см или полуавтоматический цифровой титратор (цифровая бюретка) вместимостью 30 или 50 см с шагом дозирования не более 0,05 см .
4.3 Приготовление растворов и индикаторов
4.3.1 Раствор трилона Б молярной концентрации 25 ммоль/дм
Трилон Б высушивают при 80°С в течение двух часов, отвешивают 9,31 г, помещают в мерную колбу вместимостью 1000 см , растворяют в теплой от 40°С до 60°С бидистиллированной воде и после охлаждения раствора до комнатной температуры доводят до метки бидистиллированной водой. Установку поправочного коэффициента к концентрации раствора трилона Б (см. 4.4), приготовленного из навески, проводят по раствору сульфата магния (см. 4.3.2). Раствор из ГСО состава трилона Б или стандарт-титра (фиксанала) трилона Б готовят в соответствии с инструкцией по применению, разбавляя его до требуемой концентрации.
Раствор трилона Б пригоден для использования в течение 6 мес. Рекомендуется не реже одного раза в месяц проверять значение поправочного коэффициента.
4.3.2 Раствор ионов магния молярной концентрации 25 ммоль/дм
Раствор готовят из ГСО состава водного раствора ионов магния или стандарт-титра (фиксанала) сульфата (сернокислого) магния в соответствии с инструкцией по его применению, при необходимости разбавляя до требуемой концентрации.
Примечание — Если в используемых стандарт-титрах (фиксаналах) или ГСО состава водных растворов концентрация вещества выражена в нормальностях (н), мг/дм , г/м и т.п., необходимо провести пересчет концентрации вещества в моль/дм .
4.3.3 Буферный раствор рН=(10±0,1)
Для приготовления 500 см буферного раствора в мерную колбу вместимостью 500 см помещают 10 г хлорида аммония, добавляют 100 см бидистиллированной воды для его растворения и 50 см 25%-ного водного аммиака, тщательно перемешивают и доводят до метки бидистиллированной водой.
Буферный раствор пригоден для использования в течение 2 мес при его хранении в плотно закрытой емкости, изготовленной из полимерного материала. Рекомендуется периодически перед применением буферного раствора проверять его рН с использованием рН-метра. Если значение рН изменилось более чем на 0,2 единицы рН, то готовят новый буферный раствор.
4.3.4.1 Раствор индикатора
Для приготовления 100 см раствора индикатора в стакан вместимостью не менее 100 см помещают 0,5 г индикатора эриохром черный Т, добавляют 20 см буферного раствора, тщательно перемешивают и добавляют 80 см этилового спирта. Раствор пригоден для использования в течение 10 сут при хранении в темной стеклянной емкости.
Допускается вместо индикатора эриохром черный Т использовать индикатор хромовый темно-синий кислотный, раствор которого готовят аналогичным способом. Срок хранения этого раствора — не более 3 мес.
4.3.4.2 Сухая смесь индикатора
Сухую смесь индикатора готовят в следующей последовательности: 0,25 г эриохрома черного Т смешивают с 50 г хлорида натрия в фарфоровой ступке и тщательно растирают. Смесь пригодна для использования в течение одного года при хранении в темной стеклянной емкости.
4.3.5 Раствор гидроксиламина гидрохлорида
Для приготовления 100 см раствора 1 г гидроксиламина гидрохлорида ( ) растворяют в 100 см бидистиллированной воды. Раствор пригоден для использования в течение 2 мес.
4.3.6 Раствор сульфида натрия
Для приготовления 100 см раствора 5 г сульфида натрия или 3,5 г растворяют в 100 см бидистиллированной воды. Раствор готовят в день проведения определений.
4.3.7 Раствор соляной кислоты молярной концентрации 0,1 моль/дм
В мерную колбу вместимостью 1000 см , наполовину заполненную бидистиллированной водой, наливают 8 см соляной кислоты и доводят до метки бидистиллированной водой. Срок хранения раствора — не более 6 мес.
Приготовление раствора кислоты из стандарт-титра (фиксанала) проводят в соответствии с инструкцией по его приготовлению.
4.3.8 Раствор гидроксида натрия молярной концентрации 0,2 моль/дм
Для приготовления 1000 см раствора в стакан помещают 8 г гидроксида натрия, растворяют в бидистиллированной воде, после остывания раствор переносят в мерную колбу вместимостью 1000 см и доводят до метки бидистиллированной водой. Срок хранения раствора в емкости из полимерного материала — не более 6 мес.
4.4 Установление коэффициента поправки к концентрации раствора трилона Б
В коническую колбу вместимостью 250 см вносят 10,0 см раствора ионов магния (см. 4.3.2), добавляют 90 см бидистиллированной воды, 5 см буферного раствора (см. 4.3.3), от 5 до 7 капель раствора индикатора (см. 4.3.4.1) или от 0,05 до 0,1 г сухой смеси индикатора (см. 4.3.4.2) и сразу титруют раствором трилона Б (см. 4.3.1) до изменения окраски в эквивалентной точке от винно-красной (красно-фиолетовой) до синей (с зеленоватым оттенком) при использовании индикатора эриохром черный Т, а при использовании индикатора хромовый темно-синий кислотный до синей (сине-фиолетовой).
Раствор трилона Б в начале титрования добавляют довольно быстро при постоянном перемешивании. Затем, когда цвет раствора начинает меняться, раствор трилона Б добавляют медленно. Эквивалентной точки достигают при изменении окрашивания, когда цвет раствора перестает меняться при добавлении капель раствора трилона Б.
Титрование проводят на фоне титрованной контрольной пробы. В качестве контрольной пробы можно использовать немного перетитрованную анализируемую пробу. За результат принимают среднеарифметическое значение результатов не менее двух определений. Значение коэффициента поправки должно быть равным 1,00±0,03.
Коэффициент поправки к концентрации раствора трилона Б рассчитывают по формуле
где — объем раствора трилона Б, израсходованный на титрование, см ,
10 — объем раствора ионов магния (см. 4.3.2), см .
Примечание — При приготовлении растворов по 4.3-4.4 допускается вместо бидистиллированной воды использовать дистиллированную воду, если определяемое значение жесткости более 1 °Ж.
4.5 Порядок проведения определений
4.5.1 Выполняют два определения, для чего пробу анализируемой воды делят на две части.
4.5.2 В колбу вместимостью 250 см помещают первую часть аликвоты пробы анализируемой воды объемом 100 см , 5 см буферного раствора (см. 4.3.3), от 5 до 7 капель раствора индикатора (см. 4.3.4.1) или от 0,05 до 0,1 г сухой смеси индикатора (см. 4.3.4.2) и титруют раствором трилона Б (см. 4.3.1), как описано в 4.4.
4.5.3 Вторую часть аликвоты пробы объемом 100 см помещают в колбу вместимостью 250 см , добавляют 5 см буферного раствора, от 5 до 7 капель раствора индикатора или от 0,05 до 0,1 г сухой смеси индикатора, добавляют раствор трилона Б, которого берут на 0,5 см меньше, чем пошло на первое титрование (см. 4.5.2), быстро и тщательно перемешивают и титруют (дотитровывают), как описано в 4.4.
Примечания
1 Нечеткое изменение окраски индикатора в эквивалентной точке или изменение окраски на серый цвет указывает на присутствие мешающих веществ. Устранение мешающих влияний — по 4.1. Если мешающие влияния устранить невозможно, определение жесткости проводят методами атомной спектрометрии (см. раздел 5).
2 Если расход раствора трилона Б превышает 20 см — при использовании бюретки вместимостью 25 см или 9 см — при использовании бюретки вместимостью 10 см , то объем анализируемой пробы уменьшают, добавляя в нее бидистиллированную воду до объема 100 см . Аликвоту пробы уменьшают и для устранения влияния цветности воды.
3 Если расход раствора трилона Б менее 1 см — при использовании бюретки вместимостью 25 см или менее 0,5 см — при использовании бюретки вместимостью 10 см , то рекомендуется использовать раствор трилона Б молярной концентрацией 5 ммоль/дм или 2,5 ммоль/дм соответственно. Раствор трилона Б по 4.3.1 разбавляют в 5 или 10 раз.
4.6 Обработка результатов определения
где — коэффициент пересчета, равный 2 ,
где — концентрация раствора трилона Б, моль/м (ммоль/дм ), (как правило 50);
— множитель разбавления исходной пробы воды при консервировании (как правило 1);
— коэффициент поправки к концентрации раствора трилона Б, рассчитанный по формуле (1);
— объем раствора трилона Б, израсходованный на титрование, см ;
— объем пробы воды, взятой для анализа, см .
4.6.2 За результат измерения принимают среднеарифметическое значение результатов двух определений. Приемлемость результатов определений оценивают исходя из условия:
где — предел повторяемости (см. таблицу 1);
и — результаты определений по 4.5.2 и 4.5.3, °Ж.
Если расхождение между двумя результатами превышает установленное значение, то определение жесткости воды повторяют. Проверку приемлемости в этом случае проводят по [1, раздел 5].
источник
Са2+ + Na2MgТр.→ Mg2+ + Na2СаТр.
и ионы кальция будут заменены в анализируемой воде ионами магния в эквивалентном отношении.
Устойчивость комплекса существенно зависит от рН раствора. Поэтому комплексонометрическое титрование ведут в заданном интервале рН, используя различные буферные растворы.
Методом комплексонометрии можно определить катионы магния, кальция, цинка, алюминия, бария, свинца и многие другие – более 40 различных катионов. Этот метод широко применяется для определения жесткости воды.
1.6. Методика определения жесткости воды комплексонометрическим
Метод основан на образовании при рН=10±0,2 прочного бесцветного комплексного соединения трилона Б с ионами кальция и магния. В эквивалентной точке титрования все ионы кальция и магния связываются в комплексное соединение трилоном Б, в результате чего происходит изменение окраски индикатора от красной до голубой.
Чувствительность метода составляет 0,5 мг – экв/л при титровании 0,1н
Отбор проб является важной частью анализа, необходимым условием правильности получаемых результатов.
Главные принципы, которые требуется соблюдать при отборе проб воды, состоят в следующем:
1. Проба воды, взятая для анализа, должна отражать условия и место ее отбора. При отборе поверхностных вод необходимо изучить окружающую местность и брать пробы воды выше и ниже спуска сточных вод. Пробы из трубопроводов при наличии штуцера отбирают так, чтобы скорость вытекания воды из трубопровода совпадала со скоростью отбора. Соответственно цели анализа отбирают разовые и смешанные (средние) пробы за определенный период, сливая разовые, взятые из одного и того же места, через равные промежутки времени. Иногда средние пробы
отбирают одновременно из разных мест исследуемого объекта и сливают вместе. Окончательный объем средней пробы должен быть пропорционален расходу воды и определяется из условия заданного перечня определений.
2.Объем пробы должен быть достаточным и соответствовать применяемой методике анализа. Для неполного анализа, при котором определяют только несколько компонентов, достаточно отобрать 1 л воды. Для более подробного анализа следует брать 2 л воды.
3. Пробы воды отбирают в стеклянные или полиэтиленовые бутыли с хорошо подобранной пробкой, а при наличии крупных примесей – в жестяные бидоны или банки с широким горлом. Посуду, используемую для отбора проб, необходимо вымыть хромовой смесью и тщательно промыть водопроводной, а затем дистиллированной водой. Перед отбором пробы посуду ополаскивают несколько раз исследуемой водой.
4. Отбор пробы, условия транспортирования и сроки хранения определяются из условий отсутствия изменений в содержании определяемых компонентов или в свойствах воды. Необходимо учесть, что ни консервация, ни фиксация не обеспечивают постоянного состава пробы на продолжительное время.
Целью этих операций является сохранение содержания соответствующего
компонента без изменения на время, необходимое для доставки и обработки пробы воды. К анализу следует приступать в кратчайший срок после отбора пробы.
1.6.3. Реактивы и оборудование
· трилон Б (фиксанал 0,1н) по ТУ 6-09-2540-87;
· серно – кислый магний MgSO4 (фиксанал 0,1н) ТУ 6-09-2540-87;
· аммиачный буферный раствор;
· индикатор эриохром черный Т или кислотный хром темно – синий ч.д.а. ТУ 6-09-3870-87Е;
· сернистый натрий 9 – водный ч.д.а., Na2S ГОСТ 2053-77.
· Трилон Б 0,05н: раствор готовят из 0,1н трилона Б, приготовленного из фиксанала, разбавлением его в 20 раз. Для этого 50 мл трилона Б 0,1н переносят в мерную колбу на 100 мл и доводят до метки обессоленной воды. При отсутствии фиксанала берут навеску 18,613 г. трилона Б и растворяют в мерной колбе на 1000 мл. Устанавливают титр трилона Б по фиксаналу 0,1н MgSO4. Пипеткой отбирают 10 мл 0,1н MgSO4 в коническую колбу, добавляют 90 мл обессоленной воды, 5 мл аммиачно – буферного раствора, 5 – 7 капель индикатора кислотного хром темно – синего (эриохром черного, хромогена) и титруют раствором трилона Б до голубого цвета. Должно пойти 20 мл трилона Б
· Аммиачный буферный раствор: 20 г NH4Cl растворить в 500 мл воды, добавить 80 мл концентрированного аммиака NH4OH и довести объем до 1000 мл.
· Индикаторы кислотный хром темно – синий или эриохром черный Т: 0,5 г индикатора растворяют в 20 мл аммиачно – буферного раствора и доводят объем до 100 мл этиловым спиртом.
Отобрав определенный объем анализируемой воды (обычно 100мл) в коническую колбу, вводят в нее 5 мл аммиачной буферной смеси, несколько капель
индикатора и титруют окрашенную в розовый или фиолетово – розовый цвет жидкость раствором трилона Б. Титрование ведут медленно, по каплям, так как образование трилонатных комплексов происходит не мгновенно.
ибавление титранта, т.е. раствора трилона Б, ведут до наиболее четкого изменения цвета. Здесь необходима, как говорят, «ститровка» всего коллектива данной лаборатории. Дело в том, что резкое «от одной капли» изменение окраски титруемой жидкости происходит только при работе с 0,1н и 0,01н растворами трилона Б. Применение более разбавленных растворов создает не резкое, а постепенное изменение окраски; на это требуется, например, от трех до пяти капель 0,002н раствора трилона Б. Вследствии этого необходимо выработать по возможности единое мнение о той окраски, при которой следует считать титрование законченным. Для этого в ряд конических колб вливают по 100 мл дистиллированной обессоленной воды, добавляют в каждую колбу по 2 мл раствора сернокислого магния (MgSO4) конц.
1 мг-экв/л и по 5 мл аммиачной буферной смеси. Затем в первую колбу вводят 0,95 мл 0,002н раствора трилона Б, т.е. с явным недостатком, а в каждую следующую на одну каплю больше, чем в предыдущую. Например, 0,95; 0,98; 1,01; 1,04; 1,07; 1,10 мл (если объем капли 0,03мл). Жидкость в последней колбе будет явно перетитрована, т.к. 1 мл 0,002н раствора трилона Б содержит 2 мкг – экв вещества, т.е. такое же количество, что и 2 мл магнезиального раствора. Составив все колбы в ряд, решают, где возникает наиболее четко визуально – определенная разница окрасок. До этого изменение цвета в дальнейшем и ведут титрование. Следует лишь иметь ввиду, что переход окраски отмечается несколько различно в зависимости от освещения. Наиболее четко этот переход заметен при естественном дневном освещении, менее отчетливо при обычном электрическом и хуже всего при лампах «дневного света». Из индикаторов четче всего переход окраски при работе с эриохром черным ЕТ00, но этот индикатор, к сожалению, и наименее чувствителен.
Так как в анализируемой воде могут присутствовать, кроме кальция и магния, также и другие катионы, взаимодействующие с Трилоном Б, например железо,
цинк, медь, марганец, то принимают меры против их влияния на результаты титрования. Влияние меди и цинка устраняют добавлением к воде нескольких капель 10% — го раствора сульфида натрия. Образующиеся сернистые медь и цинк столь малорастворимы, что уже не дают трилонаты. Влияние железа может быть предотвращено окислением его до трехвалентного, которое выпадает в щелочной воде в осадок, также очень малорастворимый. Иногда предпочитают закомплексовывать железо лимонной или винной кислотами, добавленными с большим избытком. Марганец в щелочной среде окисляется до марганцовистой кислоты. Жидкость при этом приобретает серый цвет, мешающий титрованию. Введением гидроксиламина или гидрозина сохраняют марганец в двухвалентном состоянии. При этом он оттитровывается вместе с кальцием и магнием, несколько завышая, следовательно, величину жесткости. В водах электростанций марганца
обычно так мало, что этим завышением пренебрегают.
Следует заметить, что иногда в водах (чаще всего в котловых) оказываются
вещества, образуют с индикаторами прочные, окрашенные в красный цвет, соединения. Они лишь очень медленно, иногда в течение часа, разлагаются трилоном Б, причем для этого необходим обычно значительный его избыток. При титровании вод, содержащих такие вещества, розовая окраска или оттенок не устраняются даже после добавления значительных избытков трилона Б. Проба остается неоттитрованной, однако по истечении некоторого времени, иногда 10 – 20 минут, иногда 1 часа, розовый оттенок исчезает и жидкость приобретает явно сильно «перетитрованный» вид. Специальные опыты показывают, что такие прочные соединения с индикаторами, медленно разрушающиеся лишь избытками трилона Б, образуют катионы металлов, расположенных в правой нижней части таблицы Д.И. Менделеева, а также, по – видимому, некоторые органические амины. Устранить мешающее влияние этих агентов иногда удается выпариванием порции воды досуха, прокаливанием сухого остатка при 700 – 8000С и последующим растворением кальциевых и магниевых соединений слабой соляной кислотой. Можно также применить для определения жесткости таких вод олеатный способ.
1.6.5. Обработка результатов
Жесткость анализируемой воды вычисляют по формулам:


где а – расход трилона Б, пошедшее на титрование, см3
N – нормальность раствора трилона Б
К – поправочный коэффициент к номинальной нормальности
1.7. Экспериментальные данные
Проведя анализ, получили показания жесткости исходной воды, которые представлены в таблице 1.2
Vсредний, см3 Трилон Б 0,05н
6,60 + 6,57 + 6,74 + 6,59 + 6,45 + 6,51 + 6,52 + 6,41 + 6,59 + 6,57


Выполнив расчеты по формулам, получили жесткость воды 3,275 мг-экв/л, что соответствует предъявляемым требования к качеству исходной воды.
Полная себестоимость промышленной продукции — это выраженные в денежной форме затраты предприятия на ее производство и реализацию. Планирование и учет себестоимости продукции ведут по элементам затрат и калькуляционным статьям расходов.
Элементы затрат: материальные затраты (МЗ), трудовые затраты (ТЗ), амортизация, прочие затраты.
Статьи калькуляции: сырье и материалы, топливо и энергия на технологические цели, основная и дополнительная зарплата, отчисления в различные фонды, общепроизводственные расходы (ОПР), общехозяйственные расходы (ОХР), коммерческие расходы (КР), прочие расходы.
Калькуляция себестоимости промышленной продукции состоит из трех частей:
2. накладные расходы (ОПР, ОХР и КР)
3. плановые накопления (прибыль и торговые надбавки)
В состав ОПР входят: расходы на содержание и эксплуатацию оборудования (амортизация производственного оборудования и транспорта, расход энергии на приведение в действие оборудования, ремонт оборудования, расходы по внутризаводскому перемещению грузов, износ инструментов) и цеховые расходы (зарплата цехового персонала, амортизация, содержание и ремонт основных фондов, расходы на ОТ и ТБ, недостачи и потери от порчи и простоев).
В состав ОХР входят: расходы по содержанию аппарата управления (зарплата руководителей, амортизация и содержание непроизводственных зданий и сооружении и легковых автомобилей, расходы на содержание вычислительных
центров, почтово-телеграфные расходы) и прочие общехозяйственные расходы (зарплата служащих, расходы на подготовку кадров и другие).
Коммерческие расходы включают расходы на анализ рынка, рекламу и прочие.
Калькуляция себестоимости промышленной продукции
Основная заработная плата производственных рабочих (Зосн)
Дополнительная заработная плата производственных рабочих (Здоп)
Отчисления во внебюджетные фонды (Овбф)
Итого трудовые затраты (ТЗ)
Общепроизводственные расходы (ОПР)
Общехозяйственные расходы (ОХР)
Итого производственная себестоимость (С/Спр)
Итого полная себестоимость (С/Сполн)
Рыночная цена продукции (Црын)
Расчет статей калькуляции.
1. Определяем трудовые затраты:
ТЗ = Зосн + Здоп + Овбф = 450 + 45 + 126 = 621
Здоп = 10% от Зосн = 450 ∙ 0,1 = 45
Овбф ≈ 28% от Зосн = 450 ∙ 0,28 = 126
2. Определяем общехозяйственные расходы: ОХР = Зосн · Кохр = 450 ∙ 1,3 = 585
3. Определяем производственную себестоимость: С/Спр = ПЗ + ОПР + ОХР = 711 + 135 + 585 = 1431
4. Определяем коммерческие расходы:
КР = С/Спр · Ккр = 1431 ∙ 0,02 = 28,6
5. Определяем полную себестоимость:
С/Сполн = С/Спр + КР = 1431 + 28,62 = 1459,6
П = С/Сполн · 0,3 = 1459,6 ∙ 0,3 = 437,9
7. Определяем оптовую цену:
Цопт = С/Сполн + П = 1459,6 + 437,9 = 1897,5
8.Определяем налог на добавленную стоимость: НДС = Цопт · 0,18 = 1897,5 ∙ 0,18 = 341,5
9. Определяем отпускную цену:
Цотп = Цопт + НДС = 1897,5 + 341,5 = 2239
10. Определяем торговую надбавку:
ТН = Цотп · 0,25 = 2239 ∙ 0,25 = 559,75
11. Определяем рыночную цену:
Црын = Цотп + ТН = 2239 + 559,75 = 2798,75
3. ОХРАНА ТРУДА И ТЕХНИКА БЕЗОПАСОСТИ
Лабораторные, складские и вспомогательные помещения снабжаются средствами пожаротушения в соответствии с разработанными на предприятии нормами.
К первичным огнетушащим средствам относятся различные огнетушители, асбестовое полотно, а также водопроводная вода. В условиях лаборатории, при чрезвычайном обилии различных горючих веществ с различными свойствами, особенно важно правильное и своевременное применение первичных средств тушения огня. Успешная борьба с возгораниями не возможна без четкого знания возможностей и областей применения каждого из имеющихся в лаборатории огнетушащих средств.
В химической лаборатории рекомендуется использовать углекислотные, порошковые, пенные и воздушно-пенные огнетушители.
Углекислотный огнетушитель должен быть в каждом лабораторном помещении, независимо от наличия других средств огнетушения.
Лабораторные помещения должны быть оснащены средствами индивидуальной защиты (СИЗ): защитными очками, резиновыми перчатками, фартуком, аптечкой для оказания первой помощи; на рабочих местах надлежит иметь достаточное количество нейтрализующих средств (3% содовый и 2% кислотный растворы).
Подавляющая часть работ в химической лаборатории связана с использованием стеклянной посуды, аппаратов и приборов. Поэтому технике безопасности при работе со стеклом необходимо уделять самое серьезное внимание:
· нельзя нагревать не термостойкие стаканы и колбы на открытом огне или непосредственно электроплитке, а также резко охлаждать нагретые сосуды;
В данной работе представлено описание использования воды в промышленности, основные показатели качества воды и ее свойства, такие как щелочность, жесткость, прозрачность, реакция воды и другие.
Подробно рассмотрены способы водоподготовки.
Изложены возможные методы определения жесткости воды, подробно рассмотрен комплексонометрический метод.
Представлены методика анализа, правила отбора проб воды для анализа, правила приготовления реактивов и выполнения анализа. Также представлена таблица экспериментальных данных, из которой следует, что жесткость воды составляет 3,275 мг-экв/л, что соответствует предъявляемым требования к качеству исходной воды.
Дан экономический расчет статей калькуляции.
Дана техника безопасности при работе в химических лабораториях. Описаны правила работы со стеклом, средства пожаротушения, а также средства личной защиты и спецодежда сотрудников химических лабораторий.
1. Алексеев В.Н. Количественный анализ. – М.: Химия, 1972
2. Васильев В.П.Аналитическая химия. Кн. 1: Титриметрические и гравиметрические методы анализа. – М.: Дрофа, 2005.
3.Временное методическое руководство по анализу технологических и сточных вод предприятий черной металлургии. – М.: Металлургия, 1981.
4.Глинка Н.Л. Общая химия. – М.: Химия, 1980.
5.Гурвич С.М., Кострикин Ю.М. Оператор водоподготовки. – М.: Энергия, 1967.
6. Инструкция о порядке проведения химического анализа воды и пара в Паросиловом цехе ОАО «ММК» ЭИ-ПСЦ-3-44-2008
7.Кострикин Ю.М. Инструкция. – М.: 1967.
8. Крешков А.П., Ярославцева А.А. Курс аналитической химии. Количественный анализ. – М.: Химия, 1982.
9. Посыпайко В.И., Васина Н.А. Аналитическая химия и технический анализ. – М.: Высшая школа, 1979.
10.Сороко В.Е., Вечная С.В., Попова Н.Н. Основы химической технологии. – СПб.: 1986.
· стеклянная посуда не предназначена для работы на повышенном давлении;
· нельзя допускать нагревание жидкостей в закрытых колбах или приборах, не имеющих сообщения с атмосферой;
· категорически запрещается использовать посуду, имеющую трещины или отбитые края;
· осколки разбитой посуды убирают только с помощью щетки и совка, но ни в коем случае не руками;
· стеклянные приборы и посуду больших размеров можно переносить только двумя руками. Поднимать крупные бутыли за горло запрещается.
Транспортировка до рабочего места химических реактивов (до 2 – х литров) должна осуществляться в специальных металлических контейнерах (ведрах).
Бутылки, реактивные склянки и колбы с химическими реактивами должны иметь надпись этикетку, бирку с названием. Хранить на рабочих местах вещества неизвестного происхождения запрещено!
При разведении концентрированных реактивов их приливают тонкой струей в воду при одновременном перемешивании раствора. Приливать воду к концентрированным кислотам и щелочам запрещено!
Нейтрализовать разрешается лишь разбавленные кислоты разбавленными щелочами и наоборот. При смешивании, нейтрализации или разбавлении растворов, сопровождающихся выделением тепла, необходимо пользоваться термостойкой посудой.
Нельзя засасывать концентрированные кислоты и щелочи ртом в пипетку, необходимо пользоваться резиновыми грушами.
Дозировка кислот, щелочей и других химических реактивов производится с помощью мензурок, цилиндров и другой мерной посуды в реактивную склянку.
Все работы должны проводиться в СИЗ: резиновых перчатках, очках, фартуке и спецодежде (халате).
После каждого пользования концентрированными реактивами необходимо тщательно мыть руки.При разливе концентрированных химических веществ,
После проведения полного обессоливания воды необходимо убедится в отсутствии в ней как катионов (Mg 2+ , Ca 2+ ), так и анионов (SO4 2– , NO3 – , Cl – ). Анализ на содержание указанных анионов в воде до ее обессоливания и после проводится качественно.
SO4 2– – раствор хлорида бария дает белый осадок сульфата бария;
Cl – – при добавлении раствора нитрата серебра образуется белый осадок хлорида серебра;
NO3 – – при добавлении раствора дифениламина в серной кислоте появляется характерное для ионов NO3 – синее окрашивание.
Определение содержания взвешенных частиц (мутность воды)
Мутность воды определяется фотоколориметрическим методом при длине волны 440 нм. Оптическую плотность измеряют в кюветах с толщиной поглощающего слоя 3 мм. Количество взвешенных частиц в воде находят по калибровочной кривой.
Регистрирующим прибором в фотоколориметре служит микроамперметр типа М907, оцифрованный в микроамперах и имеющий шкалу 0–100 делений, соответствующих шкале коэффициентов пропускания – и оптической плотности – D. При измерении со светофильтром 440 нм, отмеченным на лицевой панели колориметра черным цветом, ручку «Чувствительность» устанавливают в одно из положений 1, 2 или 3. Рабочие поверхности кювет перед каждым измерением необходимо тщательно протирать спирто-эфирной смесью, жидкость в кюветы наливать до метки на боковой поверхности кюветы. При установке кювет в кюветодержатель нельзя касаться пальцами участков поверхности кювет ниже уровня жидкости в них.
Колориметр включают в сеть за 15 мин до начала измерений. Во время прогрева кюветное отделение должно быть открыто (при этом шторка перед фотоприемником перекрывает световой пучок). В световой пучок помещают кювету со стандартным раствором, по отношению к которому производят измерения, и крышку кюветного отделения закрывают. Ручками «Чувствительность» и «Установка 100» устанавливают отсчет 100 по шкале колориметра. Затем поворотом ручки кювету со стандартным раствором заменяют кюветой с исследуемым раствором. После этого производят отсчет по шкале колориметра, соответствующий коэффициенту пропускания исследуемого раствора в процентах, или по шкале D в единицах оптической плотности. Измерения проводят 3–5 раз и окончательное значение измеряемой величины определяют как среднее арифметическое полученных значений.
Для определения общей жесткости воды в лабораторных условиях используют комплексонометрический метод, основанный на образовании сложных соединений анализируемых ионов с органическими реагентами (комплексонами) (1). Перед началом работы пробу разбавляют спиртовым раствором индикатора эриохрома черного Т или сухой смесью хлорида натрия и кальция. К окрашенному в вино-красный цвет раствору добавляется по каплям Трилон Б. Величину общей жесткости вычисляют по формуле:
Жо=Nx*Vx*1000/V1
(N-нормальность раствора Трилона Б, V-объем раствора Трилона Б, V1-объем пробы).
Для справки: Титрование (титриметирческий анализ) – метод количественного расчета содержания вещества, реагирующего с реактивом известной концентрации.
При помощи титрования и колориметрического метода можно узнать не только величину общей, но и временной жесткости. Для этого исследуемые пробы соединяют с индикатором (метилоранж), после чего эталонный образец переставляют на белый фон, а вторую пробирку титруют раствором соляной кислоты до появления оранжево-красного оттенка. Рассчитывая необходимое количество «солянки», определяют временную жесткость воды.
Нвр = NHCl * VHCL* 1000/ V1
(N-нормальность раствора соляной кислоты, V-объем раствора соляной кислоты, V1-объем пробы)
Уравнение реакции:
Титрование – один из самых распространенных и простых методов определения концентрации ионов кальция и магния. К минусам традиционных методик следует отнести невысокую точность.
О том, как проверить жесткость воды с минимальными погрешностями, знает обслуживающий персонал высокоточных приборов. Ярким примером одного из самых надежных инструментов определения концентрации ионов кальция и магния является АКМС-1. По результатам сравнения разности электродных потенциалов с эталонными значениями, прибор автоматически выводит результаты анализа на дисплей.
Метод атомной спектрометрии основывается на резонансном поглощении света атомами исследуемых химических элементов. К преимуществам подобного метода относится высокая точность. Недостатком атомной спектрометрии считают высокую стоимость требуемых приборов.
Для определения жесткости воды можно воспользоваться приборами и инструментами, используемыми в аквариумистике. С точностью до 2% снимают показания TDS-метры.
Принцип действия подобного прибора основан на прямой зависимости электропроводности и количества растворенных солей кальция и магния.
На заводах и предприятиях, а также в лабораторных условиях очистных сооружений наиболее точными считаются результаты нескольких опытов, различающихся методикой вычисления концентрации «целевых» компонентов или частиц загрязнителя.
Выделяют три вида жёсткости:
- временная (карбонатная), обусловленная содержанием гидрокарбонатов кальция и магния – солей слабой угольной кислоты. При кипячении соли распадаются, в результате образуется нерастворимый осадок из карбоната кальция (СаСО3) и гидроокиси магния (Мg(OH)2;
- постоянная (некарбонатная), от которой невозможно избавиться кипячением. В воде находят соли двухвалентных металлов (кальция, магния, бария и стронция), образованных сильными кислотами: соляной (HCl), серной (H2 SO4), азотной (HNO3). Соли бария и стронция для расчета степени жёсткости воды не учитывают, поскольку их количества незначительны;
- общая – определяется как суммарная концентрация ионов кальция и магния в воде.
В России воду классифицируют в зависимости от величины показателя общей жёсткости:
- до 2°Ж – мягкая;
- от 2 до 10°Ж – средней жёсткости;
- более 10°Ж – жёсткая.

Слишком жёсткая или слишком мягкая вода может нанести непоправимый вред как бытовым приборам, так и здоровью людей. Мягкая вода вымывает из организма кальций, из-за чего разрушаются кости и зубы. В такой воде активно коррозируют металлические поверхности. Чтобы этого избежать, используют ингибитор коррозии.
- создает слишком большую солевую нагрузку для мочеполовой системы. Возможно появление мочекаменной болезни, ухудшение состояния волос и кожи;
неблагоприятно действует на теплотехнические и сантехнические системы, приносит немалый вред бытовой технике; - приходится тратить больше тепла на нагрев воды: слой накипи (осадок из солей жесткости), появившийся на ТЭНах, обладает низкой теплопроводностью. Из-за недостаточного отвода тепла нагревательные элементы часто сгорают;
- увеличивается расход моющих средств из-за того, что поверхностно-активные вещества (ПАВ), входящие в состав, дают с солями кальция и магния нерастворимые соединения и не образуют достаточного для удаления загрязнений количества пены;
- стенки трубопроводов быстро зарастают известковыми отложениями, поэтому в водопроводной системе снижается напор, трубы приходится менять.
Следите за показателями жёсткости воды, поступающей из водопровода или местного источника. Если пользоваться доступными средствами смягчения воды, водопроводная система, нагреватели, стиральная и посудомоечная машины прослужат намного дольше.
Прежде чем покупать дорогие устройства и реагенты, выясните, какие соли и в каком количестве присутствуют в водопроводной воде. Показатель общей жёсткости меняется в зависимости от количества осадков, таяния снега и других явлений, влияющих на концентрацию солей. Чтобы правильно выбрать умягчители, сначала сделайте анализ на определение жёсткости воды.
Для бытовых целей: умывания, стирки и уборки, – достаточно выяснить показатель жесткости воды один раз и в случае необходимости использовать подходящие средства. Для приготовления пищи, если водопроводная слишком вода жёсткая, целесообразно использовать бутилированную воду хорошего качества, которую периодически проверять портативным и несложным в обращении прибором для определения общей и карбонатной жёсткости.
Предположить, что вода содержит большое количество солей щелочноземельных металлов, можно по следующим признакам:
- плохо пенится мыло и стиральный порошок;
- на поверхности нагревательных приборов образуется известковый налет;
- вода имеет горьковатый вкус и дольше обычного заваривается чай;
- при кипячении на поверхности воды образуется характерная пленка;
- плохо развариваются мясные продукты.
1. Полоски жесткости воды. Продаются в аптечных магазинах «Медтехника», показывают результат измерения с точностью 1-2°Ж.
Инструкция: опустить полоску жесткости в стакан с водой, подождать, пока индикатор, которым она пропитана, изменит цвет, затем сравнить с эталонной шкалой.
2. Экспресс-тесты для аквариумов. Этот способ основан на методе титрования.

Инструкция: в пробирку налить 5 мл воды и по каплям добавить реагент, содержащий индикатор. Число капель реагента, необходимых для того, чтобы раствор из жёлтого стал синим, равно количеству градусов жёсткости, каких именно – указано в инструкции к тесту.
3. Специальные приборы. Самый простой и точный метод определения жёсткости воды – титрование. Основан на реакции индикаторов, их способности менять цвет при достижении той или иной концентрации в строго определенном количестве воды, содержащей соли. В лабораториях результаты титрования обрабатывают с помощью фотоколориметра.
Существуют приборы, принцип действия которых заключается в измерении электропроводности воды. Уровень проводимости прямо пропорционально зависит от концентрации солей кальция и магния, растворённых в воде. В продаже есть приборы типа TDS-метр (total dissolved solids, или «солемер») и EC-метр (кондуктометр).

TDS-метр выдаёт результат в ppm. Устройство показывает общее содержание солей и удельную электропроводность воды. EC-метр дополнительно показывает и удельное сопротивление раствора в мкСм/см (микро Сименс). Результат TDS = k * EC, где коэффициент k в пределах 0,55–0,80 (среднее значение 0,67).

С помощью таких приборов удобно следить и поддерживать требуемое качество воды в аквариумах или для полива растений, чувствительных к повышенной жёсткости.
Жёсткость воды – термин, говорящий о процентном соотношении солевых частиц магния и калия в жидкости. Она подразделяется на две разновидности:
- Временная (такая жидкость называется карбонатная);
- Общая жёсткость (данная вода относится к некарбонатной).
Первый тип жёсткости характеризуется присутствием гидрокарбонатных солевых частиц магния и калия. Если такую воду закипятить, то элементы распадутся на карбонаты и гидроксиды и выпадут в осадок. Именно этот белый налёт часто покрывает наши чайники изнутри и собирается на других нагревательных элементах.
Для жидкости с общей жёсткостью характерно наличие других химических элементов (различных нитратов, хлоридов и тп.п). Обычно жёсткость питьевой воды связана с особенностями вашего региона, составом грунтов. Чем больше известковых пород находится в почве, тем выше жёсткость воды. Но важно не только понимать суть понятия, но и знать, как проверить жёсткость воды. Выполнить это легко как в быту, так и на заводе.
Для проверки жёсткости водопроводной воды дома можно использовать следующие способы:
- Постарайтесь обильно вспенить мыльный брусок или порошок для стирки. Если у вас образуется мало пены, то ваша вода имеет повышенную жёсткость. Это возникает по той причине, что солевые частицы калия и магния не позволяют мылу пениться. При обильной пышной пене от любого моющего средства можно утверждать, что вода нежёсткая. Но этот метод не позволят точно определить степень жёсткости.
- На вкус также можно отличить жёсткую воду от мягкой. Она более горькая. Но не все могут точно уловить горьковатый привкус солей магния и калия.
- Белый осадок в чайниках, накипь на нагревательных элементах других бытовых приборов – признак жёсткой воды. Осадок возникает из-за распада солей и выпадения их на дно. Данная особенность жёсткой воды очень вредит бытовым приборам и отопительному трубопроводу.
- От жёсткости воды зависит скорость заваривания чайного напитка. При мягкой воде на эту процедуру уйдёт от 3 до 6 мин., в жёсткой воде чай будет завариваться от 8 до 12 мин. Кстати, на вкус оба напитка будут существенно отличаться.
- Благодаря нехитрому компактному измерительному прибору можно очень легко определить жёсткость любой жидкости. Он называется TDS-метр. Агрегат измерят электропроводность жидкости. Чем выше показатель, тем больше уровень солесодержания жидкости. Обычно его ещё называют солемер. Чаще такой анализ воды на жёсткость делают владельцы аквариумов и цветоводы.
- Проверить жёсткость воды в быту можно, используя тест-полоски, продающейся в аптеках медтехники.
Для этого анализа можно использовать колориметрическую методику и принцип титрования. Процедура анализа выполняется так: порция воды смешивается с метилоранжем (индикатором), ёмкость устанавливается на светлом фоне. Во вторую тару с водой добавляют соляную кислоту, пока не получится красно-оранжевый цвет воды.
Временную жёсткость жидкости находят в процессе расчёта требуемого количества соляной кислоты по формуле: Нвр = NHCl * VHCL* 1000/ V1, где N-насыщенность раствора, V-его количество, V1-количество пробы.
Этот анализ проводят в лаборатории. Для него используют комплексонометрическую методику. Она базируется на принципе возникновения соединений ионов, подвергающихся анализу, с природными реагентами. Сначала воду в пробирке разводят раствором индикатора на спирту (чёрного этиохрома «Т»). Также для этих целей может использоваться сухая смесь кальциевых и натриевых хлоридов. В итоге полученная смесь окрашивается в насыщенный рубиновый цвет. Затем в пробирку капается вещество, называемое Трилон.
Расчёт общей жёсткости производится по уравнению: Жо=Nx*Vx*1000/V1, где N-насыщенность вещества Трилон, V-его количество, V1-количество пробы.
Как мы уже говорили выше, прибор контроля жёсткости воды называется солемер или TDS-метр. Точность проверки составляет 2%. Основной принцип работы данного агрегата построен на зависимости электропроводности жидкости от общего числа примесей солей магния и калия. То есть чем больше данных солей в воде, тем больше будут показания прибора, а следовательно, тем выше жёсткость воды.
На некоторых предприятиях и заводах наблюдается прямая зависимость между жёсткостью используемой воды и исправностью работы оборудования. Поэтому для обеспечения бесперебойной работы технологического оборудования требуется осуществлять постоянный автоматический контроль жёсткости воды.
Для этих целей используется специальное оборудование, например, анализатор «АКМС-1». Этот прибор непрерывно контролирует содержание солевых частиц кальция и магния в жидкости, поступающей в технологическое оборудование. То есть он подсчитывает общую жёсткость в пределах 0,005-25,0 мг-экв/л.
Как понять, что ваша водопроводная вода жёсткая, мы писали выше. Теперь перечислим ряд мер, позволяющих снизить жёсткость воды в домашних условиях:
- Самый простой способ – кипячение воды.
- Фильтрация воды через системы обратного осмоса (специальные мембраны).
- Использование смягчающих солей.
- Применение фильтрующих картриджей.
- Магнитное фильтрующее устройство.
- Использование ионообменной смолы в комплексе с солевым раствором.
Хотите провести контроль жёсткости воды? Заказать такую услугу вы можете у наших специалистов, для этого вам достаточно связаться с нами по указанным телефонам.
Самый простой способ узнать, можно пить воду или нет – это оценить её органолептические свойства, простыми словами, осуществить экспресс-анализ воды на запах, вкус и цвет. По сути, такие действия человек выполняет практически всегда, прежде чем что-то съесть или выпить. Причём делает он это подсознательно, не задумываясь.
Проверка воды выполняется следующим образом: если у неё приемлемый цвет, то нужно понюхать, при допустимом запахе нужно попробовать и оценить вкус. Решение о пригодности к употреблению принимается по совокупности параметров.
Важно! На вкус воду рекомендуется пробовать после ее кипячения в течение 10 минут.
Естественно, точность органолептического анализа невысокая и полагаться исключительно на него не стоит. Такая мера эффективна в том случае, когда под рукой отсутствуют прочие средства, а органы чувств постоянно при вас.
Экспресс-анализ воды этим методом позволяет однозначно выявить проблемный состав. Но если какой-либо показатель окажется подозрительным — это повод сдать жидкость на лабораторную проверку.
В отличие от вкусовых качеств, неприятный запах является более точным показателем имеющейся проблемы. Самыми распространёнными причинами его возникновения являются:
- попадание продуктов нефтепереработки или химикатов в воду;
- происходящие в воде химические реакции, в первую очередь окисление;
- активная жизнедеятельность микробов и бактерий в воде.
Чтобы справиться с двумя первыми причинами, необходимо провести механическую и сорбционную очистку, только в отдельных случаях потребуется более тщательная фильтрация. К примеру, обратноосмотическая система.
Если в воде активно развиваются микроэлементы, необходимо обезвредить их путём обеззараживания. Можно применить хлорирование или обрабатывание ультрафиолетом.
Кроме того, причинами неприятного запаха воды могут служить такие обстоятельства, как повышенная жёсткость или температурный режим окружающей среды. Для понижения жёсткости можно воспользоваться умягчителями.
Хорошо справляются с задачей полифосфатные фильтры. Важно! Нельзя применять их для очистки питьевой воды, только для жидкости, использующейся в технических целях.
Абсолютная прозрачность – признак идеальной воды. Экспресс-анализ по цветовым характеристикам можно провести следующими способами:
- Наберите воду в просвечивающий стакан либо колбу и рассмотрите содержимое на фоне белоснежного листка бумаги. Если жидкость имеет тёмный оттенок — в ней, скорее всего, содержится огромное количество активно разлагающихся органических элементов.
- Налейте в прозрачный сосуд воду и попытайтесь прочесть через него какой-нибудь текст, написанный на белой бумаге. Бокал должен быть абсолютно гладким, иначе символы будут искажаться. Воды в стакане должно быть на уровне 20 см, не меньше. Если все напечатанные знаки отчётливо видны, то жидкость в достаточной степени прозрачна, в ином случае стоит задуматься о её качестве.
Мутность воды свидетельствует о большой численности мелкодисперсной взвеси либо других растворённых составляющих. К ним относятся как органические, так и неорганические сочетания. Не нужно забывать, что такая вода представляет собой идеальную среду для распространения различного рода микроорганизмов.
Чтобы осуществить экспресс-анализ питьевой воды на наличие механических соединений, достаточно наполнить ею ёмкость и дать отстояться. Если образовался осадок, это означает что жидкость необходимо пропустить сквозь фильтр тонкой механической очистки.
Для определения жёсткости достаточно что-нибудь намылить. Вода с высоким уровнем жёсткости трудно намыливается и практически не образовывает пены. А вот показатель Ph рекомендуется проверять экспресс-анализом (тестом) воды с помощью особых индикаторов, таких как лакмусовая бумага.
Такие наборы чаще всего используются для проведения проверки в домашних условиях. Тестовые полоски бывают разными, в зависимости от того, на какое количество компонентов рассчитано исследование. В продаже представлены в широком ассортименте виды наборов для экспресс-анализа воды:
- Тестовые системы вида ИТ. Исследование проводится с использованием индикаторных трубочек. Степень скопления активного вещества оказывает влияние на окрашивание тестера. Этот способ отличается высоким уровнем достоверности, простоты и хорошей чувствительностью.
- Тестовые наборы вида РС. Проверка осуществляется при помощи готовых составов либо смесей реагентов. Цвет раствора указывает на концентрацию того или иного вещества в воде. Такие наборы отлично подходят для колориметрического и спектрофотометрического анализа.
- Наборы тестеров вида ИП. В процессе проверки участвуют индикаторные пигменты. В зависимости от концентрации составляющих цвет пигмента изменяется. Экспресс-анализ воды таким набором проводить достаточно просто, а результат получается точным и быстрым.
- Специальные наборы для определения качественных показателей воды. С их помощью можно проводить анализ концентрации конкретного вещества: хлора, циановой кислоты и прочих.
Приборы экспресс-анализа воды очень компактны по размеру и просты в применении, понять процесс проверки сможет каждый. Большая их часть пригодна для использования в домашних условиях. В комплекте к каждому набору идёт инструкция по применению, где подробно описан процесс исследования. Приемлемая стоимость таких тестеров является преимуществом для простого человека.
Чтобы получить максимально точный результат, крайне важно предотвратить попадание в образец чужеродных элементов извне. К примеру, плохо очищенная ёмкость для набора воды на пробу может отрицательно повлиять и исказить результаты проверки. Итак, при отборе воды необходимо придерживаться следующих правил:
- Наливать жидкость для исследования нужно в чистую ёмкость либо специальный пакетик. Лучшим вариантом является приобретение стерильной тары из пластика в аптеке.
- Прежде чем набирать воду, следует протереть кран или вентиль медицинским спиртом, а также обработать им руки либо надеть стерильные перчатки.
- Перед набором воды для тестирования её необходимо спустить в течение 5–10 минут при полном напоре, в зависимости от вида источника.
- В зависимости от предполагаемого количества исследований набрать одну или несколько ёмкостей объёмом от 0,5–1,0 литра.
- Теперь можно приступать к тестированию реагентами, порошками, трубочками, лакмусовыми бумажками и прочими подручными средствами.
Важно! Если вы собираетесь использовать несколько тестеров, то для каждого из них следует приготовить отдельную ёмкость. То же правило распространяется на лакмусовые бумажки и прочие тесты.
Не забывайте, что своевременно проведённый анализ воды способен предотвратить многие заболевания организма.
Экология потребления. Наука и техника: Рассказ пойдёт о том, что загрязняет воду, как её чистят и почему я спокойно пью из родника, содержащего много нитратов.
Последние пять лет я занимаюсь химическим анализом воды и нахожусь в контакте с инженерами по водоподготовке. К нам приходят самые разные люди: для одних система очистки воды — очень дорогое, но жизненно необходимое приобретение, другие просто начитались страшилок в Интернете и хотят «живую воду». Но для нас, как и для врачей, все наши заказчики одинаковы. У них есть вода — скважинная, поступающая из городского или поселкового водопровода, колодезная, речная — и её необходимо очистить до установленных норм. О том, что загрязняет воду, как её чистят и почему я спокойно пью из родника, содержащего много нитратов, пойдёт этот рассказ. Но никакие названия фирм, географические привязки и другая индивидуализирующая информация указываться не будут — я просто хочу поделиться пятью годами своих наблюдений за процессом, потому что много владельцев коттеджей могли бы меньше нервничать, если бы озаботились водоочисткой ещё на этапе заливки фундамента.
Но для начала давайте определимся со структурой процесса и терминологией, чтобы общаться на одном языке. Строго говоря, без анализа воды ни одна нормальная организация, занимающаяся водоочисткой, даже на порог вас не пустит. Всё начинается с анализа воды.
Как правильно отобрать воду на анализ?
Тщательность, с которой вы выполните отбор пробы воды, в конечном счёте может существенно повлиять на цену установки. Вот общие рекомендации.
- Возьмите чистую пластиковую бутылку объёмом 1.5 л. Ни в коем случае не используйте бутылки, в которых ранее находились содержащие органические вещества жидкости (квас, пиво, кефирчик, уайт-спирит) или высокоминерализованные воды. Подойдут бутылки из-под питьевой воды. Идеальный вариант — купить новую бутылку там, где торгуют напитками на розлив.
- Если у вас скважина — пролейте её до постоянного состава. Рекомендации, как это сделать, должны предоставить ваши скваженщики. Некоторые наши заказчики рассказывали, что их скважина работала на излив по две-три недели.
- Откройте ближайший к скважине кран до любых существующих фильтров, баков и других устройств, могущих оказывать влияние на состав воды, и пролейте несколько минут, чтобы обновить воду в трубах.
- На два раза ополосните бутылку отбираемой водой, после чего налейте воду под самое горлышко, навинтите крышку, слегка сожмите бутылку с боков, чтобы вода потекла через край, и завинтите крышку до конца. Цель: набрать воду без воздушного пузыря.
- Доставьте воду в лабораторию в тот же день. Если нет такой возможности — храните воду в холодильнике не более двух суток.
Далее по анализу инженерами подбирается и рассчитывается система водоочистки, и если вас устраивает коммерческое предложение и вы его оплачиваете — к вам выезжают монтажники с оборудованием. Монтажникам от вас потребуются вход, выход и дренаж — откуда брать воду, куда её подавать и куда сливать. Особое внимание следует уделить именно канализации. Если у вас яма и вы её откачиваете — позаботьтесь о том, чтобы она могла одномоментно принять на себя 2-3 кубометра воды без последствий. Почему? Фильтры пропускают через себя грязную воду, грязь оседает на фильтрующем материале. Со временем ёмкость фильтрующего материала исчерпывается и он нуждается в обратной промывке — током воды снизу вверх вся грязь с него смывается в канализацию. На одну промывку может уходить от ста литров до полутора кубометров воды, в зависимости от типа фильтра и уровня загрязнения. И всё это количество сольётся в дренаж минут за 20 для кабинетных фильтров и где-то за час для засыпных колонного типа.
Примечание. Здесь и далее я буду приводить значения в масштабах частного домовладения.
Между прочим, если в Вашем септике применяется биологическая очистка, дренажная вода может убить её. Также монтажники потребуют с вас электрическую розетку поблизости (фильтры оснащены контроллерами — электронными управляющими мозгами, которые сами знают, когда пора начинать промывку). И ещё учтите, что эксплуатироваться любые фильтры должны при температуре не ниже +5 °C, а места занимают — в зависимости от модели — до двух квадратных метров по площади и до двух метров в высоту (хотя самый маленький фильтр со всей обвязкой может поместиться в кубический метр). Да, не забудьте про давление воды на входе! Если оно меньше 2-3 атмосфер — без повысительного насоса не обойтись. Для сравнения, системы горводоканалов обычно подают в квартиры воду под давлением около 4 атмосфер.
На входе перед фильтрами ставят грубую очистку — сетчатые фильтры, механику до 20 мкм — чтобы защитить более дорогое оборудование от проскоков песка, ржавчины и других крупных частиц. На выходе после установки рекомендуется монтировать финишную доочистку (обычно уголь — удаляет запахи, хлор и мелкие частицы). В самой дорогой комплектации ещё могут присутствовать ультрафиолетовая лампа для обеззараживания на выходе и защита от протечек на полу, но всё это опции. А вот если Ваша вода содержит много железа, то инженер может спроектировать водоочистку с применением баков, которые занимают значительное пространство.
А много железа — это сколько?
Вот теперь можно поговорить о вещах, более близких к моей профессии. И начнём мы с единиц измерения. В России и за рубежом, как ни парадоксально, применяются совершенно разные единицы измерения, хотя химия одна и та же. У нас приняты мг/л и мг-экв/л, у них — ppm.
мг/л (читается: миллиграмм на литр) — это масса исследуемых частиц, содержащаяся в одном литре раствора (а не растворителя!). Если мы исследуем ионный состав воды, то под массой частиц будет подразумеваться масса атомов одного вида. Например, 10 мг/л железа означает, что в 1 литре раствора у вас содержится 10 мг атомарного железа — того самого, у которого молярная масса, согласно таблице Менделеева, 56 г/моль. И не важно, в какой форме это железо — двухвалентный ион или трёхвалентный. Просто некая абстракция — железо, как оно есть в таблице Менделеева. А если мы измеряем содержание какой-то соли, то под массой частиц будет подразумеваться масса молекулы этой соли. Например, 10 мг хлорида натрия NaCl в 1 литре раствора.
мг-экв/л (читается: миллиграмм-эквивалент на литр) — с этого момента начинается особая чёрная магия. Иеремия Рихтер, немецкий химик, открыл закон эквивалентов (и попутно портал в ад) в 1792 году. Закон гласит: вещества реагируют в количествах, пропорциональных их эквивалентам, или m1Э2 = m2Э1. Попробуйте найти химика, который приходит в восторг, считая эквиваленты! Мне такие маньяки пока не встречались, хотя я занимаюсь химией уже 14 лет. Начнём издалека. Возьмём обычную реакцию между мелом и соляной кислотой:
Улетевший углекислый газ и воду отбросим, как несущественное, и выделим в этой реакции самое важное:
Ca 2+ + 2Cl — = CaCl2 (в ионной форме)
Теперь возьмём каждый из ионов и заставим его вступить в гипотетическую реакцию гидрирования с катионом водорода, невзирая на знак заряда (да, мы, химики, любим всякие извращения; а на самом деле — масса катиона водорода принята за единицу, и теперь нам нужно найти количество других ионов, эквивалентное этой единице).
1/2Ca 2+ + H + = CaH (фактор эквивалентности = 0.5, а эквивалент водорода — частица 1/2Ca 2+ )
Cl — + H + = ClH (фактор эквивалентности = 1, а эквивалент водорода — частица Cl — )
Итак, с одним катионом водорода может (условно) прореагировать либо один анион хлора, либо половинка катиона кальция. Численное выражение доли вещества, эквивалентной одному катиону водорода, называется фактором эквивалентности. Теперь мы можем сделать простой вывод:
1/2Ca 2+ = Cl — (1 эквивалент кальция = 1 эквиваленту хлора)
Представим, что мы титруем щёлочность соляной кислотой (об этих страшных словах — позже). С соляной кислотой могут реагировать самые разные соли (гидрокарбонаты, карбонаты, гидроксиды…) самых разных ионов (кальция, магния, натрия…). Как нам всё это выразить в одной единице измерения? Мы не имеем права использовать здесь уже знакомую нам единицу измерения мг/л, потому что просто непонятно — миллиграмм чего? Кальция? Магния? Их смеси? В каком соотношении? Зато с эквивалентами эта проблема снимается сама собой:
Cl — = 1/2Ca 2+ = 1/2Mg 2+ = Na + = 1/3Al 3+ и т.д.
Нам не важно, какой именно вид катиона или аниона мы оттитровали, но мы знаем, что одному эквиваленту потраченной соляной кислоты всегда будет соответствовать один эквивалент неведомой штуки, которая с этой кислотой способна прореагировать. Хорошо, с эквивалентом более-менее разобрались. А что же такое миллиграмм-эквивалент? Это масса одного эквивалента в миллиграммах. Грубо — считается по таблице Менделеева как молярная масса, умноженная на фактор эквивалентности. Для приведённого выше отношения это будет выглядеть так:
35.45 мг Cl — = 20.04 мг Ca 2+ = 12.15 мг Mg 2+ = 22.99 мг Na + = 8.99 мг Al 3+
Заметьте, молярная масса, например, кальция равна 40.08 г/моль, но с 1 граммом водорода может прореагировать только половинка кальция — 20.04 грамма. Вот эта цифра — 20.04 — и будет грамм-эквивалентом кальция. Или миллиграмм-эквивалентом. Или микрограмм-эквивалентом. Эта единица удобна тем, что если мы когда-нибудь выясним, какое именно соединение прореагировало в той реакции с соляной кислотой, мы всегда сможем умножить количество миллиграмм-эквивалентов на массу одного эквивалента — и перевести таким образом миллиграмм-эквиваленты в обычные миллиграммы для конкретного соединения. Итак, мг-экв/л — это количество миллиграмм-эквивалентов вещества в одном литре раствора.
ppm (читается: пи-пи-эм, parts per million) — число частиц на миллион. Показывает, сколько исследуемых растворённых частиц находится в одном миллионе частиц раствора (не растворителя!). Единица измерения применяется на Западе почти повсеместно. Соответствует нашему мг/л (потому что миллиграмм — это, вроде как, тоже миллионная часть от литра, при условии, что плотность раствора равна 1.00, но при таком разбавлении изменением плотности всё равно можно пренебречь).
мкСм/см (читается: микросименс на сантиметр) — единица измерения удельной электропроводности воды. Берут два электрода, погружают в воду. На один подают известное количество тока, на втором измеряют, сколько дошло. Поскольку в водном растворе носителями заряда являются ионы, то по количеству перенесённых с одного электрода на другой электрончиков можно сделать вывод об общей доле ионов в растворе. Сименс — единица, обратная сопротивлению (1 См = 1 Ом -1 ). Измерение удельной электропроводности иногда может дать достаточно точное представление об общем солесодержании воды. Если вода относительно чистая, то условно можно считать, что 1 мкСм/см ≈ 0.5 мг/л солей. И вот мы вплотную подошли к сущности анализа воды.
Тут надо отвлечься и уточнить, что видов анализов воды — масса. Навскидку, есть химический и микробиологический. А ещё органолептический, радиометрический, несть им числа. Я занимаюсь непосредственно химическим анализом воды, о нём и поговорим. В России документ, регламентирующий качество воды для хозяйственно-бытовых нужд, называется «СанПиН 2.1.4.1074-01». И контролируемых параметров там — тьма тьмущая. Здесь уместно отметить, что такого понятия, как «техническая вода», ни в одном официальном документе не существует. Более того, то, что обычно в простонародье подразумевают под технической водой — это как раз вода, которую можно пить, но нельзя использовать в той самой технике. Подчас на производство или в паровой котёл нужно подавать полностью обессоленную (деионизованную) воду.
Смотреть в лаборатории все параметры, подразумеваемые СанПиНом — сумасшествие. Во-первых, на анализ одной пробы уйдёт тогда неделя (тогда как анализ по 12 показателям делается за 2 часа). А во-вторых, существующие фильтрующие материалы всё равно очищают воду только от конечного числа загрязнителей. И, конечно, большая часть указанных в СанПиНе загрязнителей практически не встречается в обычных природных водах или встречается в таком количестве, что заведомо проходит по нормам. Пойдём по порядку со всеми комментариями (по какому именно порядку — я ещё не решил).
Железо. Есть практически во всех подземных водах, а вот в поверхностных — реках, озёрах — обнаружить его можно нечасто. Бывает в двух формах: растворимое, или двухвалентное Fe 2+ и окисленное, или трёхвалентное Fe 3+ . Соли двухвалентного железа прекрасно растворяются в воде (железный купорос FeSO4 ∙ 7H2O многие садоводы найдут в профильных магазинах), однако кислородом воздуха очень быстро окисляются и переходят в соединения трёхвалентного железа. А вот соединения трёхвалентного железа в воде не растворимы — ржавчину все видели, а ржавчина это смесь Fe2O3 ∙ nH2O и Fe(OH)3.
FeCl3 прекрасно в воде растворяется, после чего гидролизуется до оксихлорида и выпадает в осадок. То же самое касается других растворимых соединений трёхвалентного железа — они подвержены гидролизу в водном растворе с образованием нерастворимых продуктов.
Поэтому в поверхностных источниках железа мало: оно если и было изначально, то быстро окислилось при контакте с атмосферой и ушло в ил. Помимо атмосферы, естественным врагом двухвалентного железа являются железобактерии, которые живут за счёт энергии, выделяемой при окислении ими двухвалентного железа. Зато у него есть верный союзник в виде сероводорода. В подземных водах часто содержится сероводород в большом количестве, а он является сильным восстановителем и не даёт железу окисляться даже при контакте с атмосферой. Вообще, зависимость формы железа в растворе от окислительно-восстановительного потенциала и водородного показателя наглядно отображена в диаграммах Пурбе. Железо является одним из микроэлементов и необходимо организму человека (суточная потребность — 10 мг ), и усваивается, в том числе, из воды. Конечно, содержание железа сказывается на органолептических свойствах воды (если его больше 1-2 мг/л), а избыточное его поступление в организм может спровоцировать разные отклонения в здоровье. Ну, это всегда так. Всё есть лекарство и всё есть яд, всё дело в дозе, сказал Парацельс.
ПДК железа общего в воде хозяйственно-бытового назначения составляет 0.3 мг/л. В городском водопроводе с труб при ржавлении летит примерно 0.10…0.15 мг/л (там, где я живу). Удаляют железо просто: сначала окисляют, чтобы наверняка (напомню, окисленное железо в воде не растворимо), затем полученные частички коагулируют (укрупняют), и всю эту конструкцию ловят механическим способом — на слое загрузки. Существуют разные каталитические загрузки, на поверхности которых все указанные процессы и происходят. Представляют они собой песок, покрытый слоем оксида марганца — того самого катализатора окисления железа — и нуждаются в периодической реагентной промывке раствором перманганата калия (нет, соединения марганца не смываются с загрузки и не попадают в очищенную воду — ну, если, конечно, вы не захотите смешать каталитический материал с лимонной кислотой). Есть и безреагентные загрузки, но перед ними требуется предварительное окисление железа, а уж каким способом — атмосферным воздухом, озоном или хлором — решит инженер. Если в Вашей воде железа до 5 мг/л — считайте, что Вам крупно повезло: установка будет подешевле. Если железа 10 мг/л — уже дорого. А вот 30 мг/л и выше — можете распрощаться с планируемой поездкой в тёплые страны. Такая установка может стоить несколько сотен тысяч рублей. Вообще, основная стоимость большинства полупромышленных систем фильтрации как раз зависит от концентрации железа. Чем его больше — тем дороже. Поэтому так важно тщательно пролить воду перед отбором пробы — застоявшаяся в металлических трубах вода может набрать железа, и инженер предложит вам по анализу такую установку, на которую у Илона Маска денег не хватит. Но и это ещё не всё. Отдельно стоит упомянуть про так называемое органическое железо — комплексные органические соединения, содержащие в составе молекулы атом железа (как правило, гуматы — комплексы гуминовых кислот). Выбить железо из таких комплексов нелегко, и оно не окисляется на воздухе. Удаление из воды органического железа может быть затруднительным.
Марганец. От марганца на сантехнике появляется серый налёт, поэтому нормируют его жёстко. Организму человека этот микроэлемент тоже необходим (суточная потребность 2 мг [1] ). Из воды легко усваивается. Ещё содержится в свёкле и половине овощей вообще. Валентностей у марганца целых семь, подробно рассматривать не имеет смысла. Двухвалентный марганец хорошо растворим, трёх- и четырёхвалентный обычно подвергается гидролизу и выпадает в виде нерастворимых гидроксидов. В отличие от железа, марганец в поверхностных водах встречается чаще. Особенно если это колодцы, и в подземной воде, питающей их, содержится какой-нибудь двухвалентный ион марганца. Дело в том, что марганец так вот запросто атмосферным воздухом не окисляется. Может захватываться осаждающимся железом и удаляться совместно с ним. Загрузки все те же самые, ибо принцип тот же: окисление, укрупнение и механическая фильтрация. ПДК 0.1 мг/л.
Жёсткость. Жёсткость замыкает тройку параметров, на которые нацелены почти все полупромышленные системы очистки воды. Да-да, есть фильтры-обезжелезиватели (удаляют железо, марганец и некоторые другие тяжёлые металлы) и фильтры-умягчители (удаляют жёсткость). Безусловно, есть другие типы фильтров, которые работают, например, по окисляемости, но в конечном итоге для промышленных нужд вам предложат обратный осмос с предочисткой, тогда вода на выходе будет как по ГОСТу для лабораторий: 3…5 мкСм/см. Но мы отвлеклись. В школе вам рассказывали, что жёсткость — это совокупность ионов кальция и магния. Именно они выпадают в виде накипи при кипячении воды. На самом деле, такое определение не совсем корректно. Да, значительную долю жёсткости составляют ионы кальция и магния, но вообще жёсткость — это сумма всех щелочноземельных ионов, а также некоторых двухвалентных ионов тяжёлых металлов. Цинк, барий, кадмий, даже двухвалентное железо — это всё жёсткость. Другое дело, что химик в лаборатории будет маскировать ионы двухвалентного железа при измерении жёсткости. Зато кадмий вполне себе на величине жёсткости отразится. Но поспешу вас успокоить: ионов кальция в составе жёсткости большинство — как правило, процентов 80, и ещё процентов 15 магния. Нормируют жёсткость исключительно для снижения количества накипи в чайниках, а особо рьяно — в отраслевых стандартах для всяких котельных, где жёсткости в воде быть не должно вообще. Иногда вы можете услышать, что использовать в хозяйстве нужно исключительно мягкую воду, а жёсткая, якобы, вредна. Жёсткая вода увеличивает затраты на мыло, уменьшает срок жизни стиральной машинки… Вас могут начать убеждать, аргументируя тем, что кальций из воды всё равно не усваивается, и организм получает его из молока и сыра. Это некорректно.
источник


