Основная задача химического контроля в аптеке – оценка качества изготовления лекарственных средств. Различают два вида химического контроля: качественный и полный анализ (количественный + качественный). При проведении качественного анализа лекарственные средства оцениваются по двум показателям: «Подлинность» и «Испытания на чистоту и допустимые пределы примесей». Полный контроль включает качественный анализ и «Количественное определение ЛС, входящих в состав».
В обязательном порядке качественному анализу подвергаются:
- Вода для инъекций и очищенная вода: ежедневно. Проверяется отсутствие хлоридов, сульфатов и солей кальция. Воду для изготовления стерильных растворов дополнительно проверяют на отсутствие восстанавливающих веществ, солей аммония и углерода диоксида.
- Лекарственные средства, концентраты и полуфабрикаты, поступающие из помещений хранения в ассистентскую комнату, а в случае сомнения — лекарственные средства, поступающие в аптеку со склада.
- Концентраты, полуфабрикаты и жидкие лекарственные средства в бюреточной установке и в штангласах с пипетками в ассистентской комнате при заполнении.
- Лекарственные средства промышленного производства, расфасованные в аптеке, а изготовленная и расфасованная в аптечном учреждении внутриаптечная заготовка.
Выборочному качественному анализу подвергаются:
- Изготовленные в аптеке лекарственные формы: у каждого фармацевта в течение рабочего дня, но не менее 10% от общего количества изготовленных лекарственных форм.
- Гомеопатические разведения четвертого десятичного разведения, содержащие ядовитые и сильнодействующие биологически активные вещества или ядовитые и сильнодействующие неорганические и органические соединения.
- Результаты качественного анализа регистрируются в журналах по установленным формам.
В обязательном порядке полному химическому контролю подвергаются:
- Все растворы для инъекций и инфузий до стерилизации, включая определение величины рН, изотонирующих и стабилизирующих веществ. После стерилизации данные растворы проходят проверку на рН, подлинность и количественное содержание действующих веществ.
- Стерильные растворы для наружного применения (офтальмологические растворы для орошений, растворы для лечения ожоговых поверхностей и открытых ран и др.).
- Глазные капли и мази, в состав которых входят наркотические и ядовитые вещества.
- Все лекарственные формы для новорожденных детей.
- Растворы атропина сульфата и кислоты хлористоводородной (для внутреннего употребления), растворы ртути дихлорида и серебра нитрата.
- Все концентраты, полуфабрикаты, тритурации, в том числе жидкие гомеопатические разведения неорганических и органических лекарственных веществ и их тритурации до третьего десятичного разведения.
- Каждая серия всей внутриаптечной заготовки.
- Стабилизаторы, применяемые при изготовлении растворов для инъекций и буферные растворы, применяемые при изготовлении глазных капель.
- Концентрация этилового спирта при разведении в аптеке, а в случае необходимости — при приеме со склада.
- Концентрация этилового спирта в водно-спиртовых гомеопатических растворах, разведениях и каплях.
- Каждая серия гомеопатических гранул на распадаемость.
Выборочному качественному и количественному анализу в выборочном порядке подвергаются лекарственные формы, изготовленные в аптеке, они проверяются в количестве не менее трех лекарственных форм при работе в одну смену с учетом различных видов лекарственных форм.
Результаты полного химического контроля регистрируются в журнале по установленной форме. В журнале обязательно регистрируются все случаи неудовлетворительного изготовления лекарственных средств.
источник
Проводится согласно требованиям ФС 42-2619-97. Согласно приказу
№ 214 от 16 июля 1997 года «. вода очищенная ежедневно на каждом рабочем месте проверяется на отсутствие хлоридов, сульфатов и солей кальция. Вода, предназначенная для изготовления растворов для инъекций, для новорожденных и глазных капель, кроме указанных выше испытаний, должна быть проверена дополнительно на отсутствие восстанавливающих веществ, аммиака и углекислоты в соответствии с требованиями Государственной фармакопеи. Ежеквартально вода направляется в контрольно-аналитическую лабораторию для полного химического анализа».
Анализ воды очищенной
| Определяемая примесь | Методика | Результат анализа |
| 1. Хлориды (недопустимая примесь) | I пробирка: 10 мл воды + 0,5 мл разведенной азотной кислоты, делят на 2 равные части; II пробирка: ко 2 части + 0,25 мл AgNO3 (HNO3) Cl – + AgNO3 ¾® AgCl¯ + NO3 – | Через 5 мин содержимое пробирок сравнивают. |
| 2. Сульфаты (недопустимая примесь) | I пробирка: 10 мл воды + 0,5 мл разведенной HCl, делят на 2 равные части; II пробирка: ко 2 части + 0,5 мл BaCl2 (HCl) SO4 2– + BaCl2 ¾® BaSO4¯ + 2Cl – | Через 10 мин содержимое пробирок сравнивают. |
| 3. Соли кальция (недопустимая примесь) | I пробирка: 10 мл воды + 1 мл NH4Cl + 1 мл раствора NH3, делят на 2 равные части; II пробирка: ко 2 части +0,5 мл (NH4)2C2O4 (NH4Cl, NH4OH) Ca 2+ +(NH4)2C2O4¾¾¾¾®CaC2O4¯+2NH4 + | Через 10 мин содержимое пробирок сравнивают. |
Анализ воды для инъекций
| Определяемая примесь | Методика | Результат анализа |
| 1. Хлориды | см. выше | |
| 2. Сульфаты | см. выше | |
| 3. Соли кальция | см. выше | |
| 4. Аммиак (не более 0,00002%) | I пробирка: 10 мл воды + 0,15 мл реактива Несслера; II пробирка: к 1 мл эталонного раствора аммиака + 9 мл воды, не содержащей NH3 + 0,15 мл реактива Несслера. NH3 + 2K2[HgI4] + 3KOH ® ® [O á 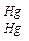 ñ NH2] I – + 7KI + 2H2O ñ NH2] I – + 7KI + 2H2O | Через 5 мин обе пробирки сравнивают. Окраска, появившаяся в испытуемой воде, не должна превышать окраски в эталоне. |
| 5. Восстанавли- вающие вещества | 100 мл воды нагревают до кипения, добавляют 1 мл раствора KmnO4 (0,01 моль/л), УЧ (1/5 KmnO4) 2 мл разведенной серной кислоты и кипятят 10 мин. 5Na2SO3 + 2KmnO4 + 3H2SO4 ® ® 2MnSO4 + K2SO4 + 5Na2SO4 + 3H2O | Розовое окрашивание должно сохраниться. |
| 6. Углекислота | К 5 мл воды добавляют 5 мл известковой воды, закрывают пробкой, взбалтывают. CO2 + Ca(OH)2 ® CaCO3 ¯ + H2O | Через 1 час не должно появиться мути. |
Недопустимые примеси определяют по следующей схеме: К 10 мл испытуемого раствора прибавляют применяемые для каждой реакции реактивы, кроме основного реактива. Затем раствор делят на 2 равные части: к одной из них прибавляют основной реактив и оба раствора сравнивают между собой, между ними не должно быть заметной разницы.
Вопросы для подготовки студентов к лабораторным занятиям № 1-2 и контроля усвоения темы
1. Назовите внешние факторы, которые могут неблагоприятно влиять на лекарственные вещества при их хранении.
2. Назовите источники и причины примесей в лекарственных веществах.
3. Напишите уравнения химических реакций взаимодействия калия перманганата с соединениями, которые могут изменить его окраску.
4. Какая реакция применяется для обнаружения примеси солей кальция? Можно ли провести эту реакцию при рН раствора 2-3?
5. С каким реактивом определяют примесь солей аммония в сравнении с эталоном? На чем основана реакция?
6. Из какого вещества готовят эталонный раствор аммоний-иона?
7. Какие условия необходимо соблюдать при определении примесей с помощью эталонных растворов?
8. Какие жидкости считаются бесцветными?
9. Из какого вещества готовят эталонный раствор цинк-иона? Особенности приготовления раствора. Приведите уравнение фармакопейной реакции на цинк-ион.
10. Как проводят испытание на чистоту, если в ФС указано, что в данной концентрации раствора не должно обнаруживаться той или иной примеси?
11. Из какого вещества готовят эталонный раствор железо (III)-иона? Чем стабилизируют раствор? С каким реактивом и в какой среде определяют примесь солей железа?
12. Какой раствор, согласно требованиям ГФ Х1, считают прозрачным? Из каких веществ готовят эталоны мутности?
13. Из какого вещества готовят эталонный раствор для определения примеси тяжелых металлов? С какими реактивами проводят испытания?
14. Из каких веществ готовят эталонные растворы хлор-иона и сульфат-иона? С какими реактивами и в какой среде проводят определение этих примесей?
15. Какими методами, согласно ГФ Х1, проводится испытание на мышьяк в лекарственных веществах?
16. Какие требования предъявляются к реакциям, применяемым для определения примесей в лекарственных веществах?
17. Перечислите способы выражения растворимости, принятые ГФ Х1 для характеристики лекарственных веществ.
18. Какие факторы могут влиять на изменение растворимости лекарственных веществ?
19. Каким образом ГФ Х1 регламентирует допустимые примеси, обусловливающие: а) изменение цвета лекарственных веществ; б) изменение растворимости?
20. Приведите принцип расчета навески для приготовления эталонных растворов.
21. Решите задачи 1-8 из «Сборника ситуационных задач по фармацевтической химии» (для студентов 3 курса) – Пермь, 2001, с.3 [9].
22. Какие требования предъявляют ФС к воде очищенной и воде для инъекций?
23. Какие примеси в воде очищенной и воде для инъекций ФС допускают в определенных пределах и каких примесей не должно быть? Различия в проведении методик анализа. Уравнения реакций.
24. Как необходимо хранить воду очищенную и воду для инъекций? Какие факторы внешней среды могут влиять на их качество?
25. На каких свойствах нитратов и нитритов основана реакция их обнаружения с дифениламином? Напишите уравнения реакций, назовите продукты.
26. Как проводится определение восстанавливающих веществ в воде очищенной? Как проявляется внешний эффект данной реакции при наличии в воде очищенной восстанавливающих веществ?
27. Сроки хранения в аптеках воды очищенной и воды для инъекций.
28. Как часто и где должен проводиться полный химический анализ воды очищенной и воды для инъекций?
29. Какому обязательному качественному анализу должна подвергаться вода очищенная при внутриаптечном контроле?
30. Каким дополнительным испытаниям должна подвергаться вода, предназначенная для изготовления стерильных растворов, в условиях аптеки?
Тема: Титрованные растворы в ГФ Х1 издания. Приготовление.
4. Установка преподавателя о порядке проведения занятия.
5. Самостоятельная работа студентов.
5.1. Расчет навески для приготовления определенного объема титрованного раствора.
5.2. Установка поправочного коэффициента к молярной концентрации титрованных растворов (К) по методикам ГФ Х1.
5.3. Укрепление и разбавление титрованного раствора (теоретический расчет).
3. Оформление протоколов и отчет преподавателю.
источник
5. Дайте сравнительную характеристику методам очистки, применяемым при получении воды очищенной и воды для инъекций в условиях крупного фармацевтического производства.
Укажите технологические приемы, применяемые для депирогенизации воды для инъекций.
Предложите технологическую и аппаратурную схему участка хранения воды.
Основной способ получения воды для инъекций — дистилляция. Оборудование для данного способа — аквадистилляторы. Основными узлами их являются: испаритель, конденсатор и сборник. Чтобы получить апирогенную воду необходимо отделить капли воды от паровой фазы. Для этой цели служат специальные приспособления разной концентрации — сепараторы они бывают центробежные, плёночные, объёмные, комбинированные. Следует учитывать, что при кипении воды происходит пузырьковое и поверхностное парообразование. Пузырьки пара вырываются из жидкости, увлекают её за собой и превращаются в маленькие капельки, в которых могут быть пирогенные вещества, так как в сущности какая-то часть капель воды остаётся неперегнанной.
Согласно ФС-42-2620-97 вода для инъекций должна удовлетворять всем требованиям, предъявляемым в ФС-42-2619-97 к воде очищенной и быть апирогенной.
Апирогенность- это отсутствие пирогенных веществ, которые вызывают лихорадочное состояние организма при внутрисосудистом введении. Пирогенны являются клеточно-тканевыми продуктами или содержатся в микроорганизмах и выделяются в процессе их жизнедеятельности.
В химическом отношении пирогенны вещества представляют собой липополисахаридные или липополисахаридно-протеиновые комплексы наружных мембран микроорганизмов. Фосфолипидная часть придаёт им отрицательный заряд, поэтому они могут адсорбироваться на положительно-заряженных фильтрующих перегородках. Пирогены не летучие вещества, с водяным паром не перегоняются, поэтому основным методом получения апирогенной воды является дистилляция очищенного пара от попадания капель воды. Пирогены — вещества очень устойчивые, термостойки и разрушаются только при температуре 250-300°С в течение 1-2 часов.
Для удаления пирогенов из растворов лекарственных веществ используют адсорбцию на оксиде аммония, крахмале, активированном угле, целлюлозе, а также на ионообменных смолах, но одновременно адсорбируются лекарственные вещества и, кроме того, сами растворы требуют очистки от механических включений, что является существенным недостатком.
Новым эффективным путём освобождения раствором от пирогенов является ультрафильтрация -это разделение и фракционирование растворов, при котором макромолекулы (от 1000 до 100000 Да) отделяются от раствора низкомолекулярных веществ фильтрацией через мембраны. Например, в настоящее время мембранным фильтром является фильтр «Владипор» с размером пор, способных задерживать более 99% пирогенных веществ.
В условиях крупного фармацевтического производства для получения воды для инъекций используется метод дистилляции и метод обратного осмоса.
Аппарат — термокомпрессионный аквадистиллятор позволяет получить воду для инъекций за счёт сепарации пара и поверхностного парообразования. Он более технически совершенен и производителен, но сложен в эксплуатации.
Дистиллятор Финн-Аква. В этом аппарате получается высококачественная вода для инъекций за счёт сепарации пара и поверхностного парообразования. Обладает высокой производительностью.
Таким образом, получение воды для инъекций методом дистилляции имеет положительные качества:
Возможность получения горячей воды
Возможность обработки оборудования горячим паром
Неэкономичность(из-за большого потребления электроэнергии и воды)
Метод обратного осмоса (гиперфильтрация) — это процесс, основанный на переходе воды из раствора через полупроницаемую мембрану под действием внешнего давления. Разность давления является движущей силой обратного осмоса. Под действием избыточного давления диффундируют молекулы воды, соли и почти все химические соединения проникнуть не могут (задерживаются).
Высокая производительность Отрицательные:
Возможность микробной контаминации
Необходимость замены мембран 24 раза в год
Невозможность обработки оборудования паром
Необходимость обработки оборудования формальдегидом
Хранение воды для инъекций.
Использовать следует свежеприготовленную воду. Максимальный срок хранения воды для инъекций 24 часа в асептических условиях: в специальных системах неинертного материала, где вода находится в постоянном движении при высокой температуре(80-95 С), то есть циркулирует из одной ёмкости в другую с постоянной скоростью.
Оценка качества воды для инъекций производится по следующим показателям:
наличие восстанавливающих примесей;
6. Какие требования предъявляются к воде, используемой в биотехнологическом процессе при выращивании посевного материала и проведения микробиологического синтеза? Проведите сравнение с фармакопейными статьями.
Незаменимым элементом питательных сред является вода, которая составляет единую систему с элементами клетки. Вода-растворитель способствует проникновению в клетку необходимых веществ и выводу из нее продуктов обмена. В клетках вода находится и в виде соединений с углеводами, белками и другими веществами, тесно взаимодействуя с макромолекулами клетки. Гидратирование и дегидратирование органических молекул — важнейший этап в превращении химических компонентов цитоплазмы. Вода участвует в реакциях гидролиза и конденсации, поддерживает объёмную структуру клетки при наличии гидростатического давления.
Для питательных сред используют специально подготовленную воду.
Очистка воды проходит 4 стадии:
1) удаление механических загрязнений на префильтре (пористое стекло, электрокоагуляция);
2) очистка от органических загрязнений (активированный уголь);
3) деионизация с использованием ионообменных смол (катиониты, аниониты);
4) стерилизация на мембранных фильтрах с размером пор от 0,22 до 0,45 мкм.
Анализ воды очищенной и воды для инъекций в условиях аптек проводится согласно требованиям ФС 42-2619-97. Согласно приказу № 214 от 16 июля 1997 г. «… вода очищенная ежедневно на каждом рабочем столе проверяется на отсутствие хлоридов, сульфатов и солей кальция. Вода, предназначенная для изготовления растворов для инъекций, для новорожденных и глазных капель, кроме указанных выше испытаний должна быть проверена на отсутствие восстанавливающих веществ, аммиака и углекислоты в соответствии с требованиями Государственной фармакопеи. Ежеквартально вода направляется в контрольно-аналитическую лабораторию для полного химического анализа.
Анализ воды очищенной и воды для инъекций в условиях аптек
1. Хлориды (недопустимая примесь)
I пробирка: 10 мл воды + 0,5 мл разведенной азотной кислоты, делят на 2 равные части;
II пробирка: ко 2 части + 0,25 мл AgNO3
Через 5 мин содержимое пробирок сравнивают
2. Сульфаты (недопустимая примесь)
I пробирка: 10 мл воды + 0,5 мл разведенной HCl, делят на 2 равные части;
II пробирка: ко 2 части + 0,5 мл BaCl2
Через 10 мин содержимое пробирок сравнивают
3. Соли кальция (недопустимая примесь)
I пробирка: 10 мл воды + 1 мл NH4Cl + 1 мл раствора NH3, делят на 2 равные части;
Через 10 мин содержимое пробирок сравнивают
I пробирка: 10 мл воды + 0,15 мл реактива Несслера,
II пробирка: к 1 мл эталонного раствора аммиака + 9 мл воды, не содержащей NH3 + 0,15 мл реактива Несслера
Через 5 мин обе пробирки сравнивают. Окраска, появившаяся в испытуемой воде, не должна превышать окраски в эталоне
5. Восстанавливающие вещества
100 мл воды нагревают до кипения, добавляют 1 мл раствора KMnO4 (0,01 моль/л), УЧ (1/5 KMnO4), 2 мл разведенной серной кислоты и кипятят 10 мин.
Розовое окрашивание должно сохраняться
К 5 мл воды добавляют 5 мл известковой воды, закрывают пробкой, взбалтывают.
Через 1 час не должно появиться мути
Примечание. Недопустимые примеси определяют по следующей схеме: К 10 мл испытуемого раствора прибавляют применяемые для каждой реакции реактивы, кроме основного реактива. Затем раствор делят на 2 равные части: к одной из них прибавляют основной реактив и оба раствора сравнивают между собой, между ними не должно быть заметной разницы.
Нитраты и нитриты (недопустимая примесь). К 5 мл воды прибавляют 1 мл раствора дифениламина в кислоте серной концентрированной; не должно появиться голубого окрашивания. В присутствии нитратов и нитритов дифениламин окисляется до окрашенного дифенилдифенохинондиимина гидросульфата.
Определение сухого остатка (представляет собой нелетучие примеси). Выпаривают 100 мл воды на водяной бане, затем высушивают при 100-105 0 С до постоянной массы и взвешивают. Остаток не должен превышать 0,001%.
Для обнаружения солей тяжелых металлов (недопустимая примесь) проводят реакцию с раствором натрия сульфида в присутствии кислоты уксусной разведенной:
Не должно быть бурого окрашивания. Наблюдение окраски проводят по оси пробирок диаметром около 1,5 см, помещенных на белую поверхность.
Микробиологическая чистота соответствует требованиям к питьевой воде – не более 100 микроорганизмов в 1 мл и не более 3 бактерий группы кишечной палочки в 1 литре. При отсутствии бактерий сем. Enterobacteriaceae, Staphylococcus aureus, Pseudomonas aeruginosa. Испытания проводят по ФС “Испытание на микробиологическую чистоту”. На воде очищенной готовят микстуры и жидкости для наружного применения.
Хранение: вода очищенная простерилизованная в течение 8 мин при 120 о С имеет срок годности 30 сут. при 25 о С.
Aqua pro injectionibus. Вода для инъекций
Должна отвечать требованиям, предъявляемым к воде очищенной. Вода для инъекций также должна быть апирогенной, не содержать антимикробных веществ и других добавок. Для определения пирогенности инъекционных препаратов и, в том числе воды для инъекций в настоящее время используют ЛАЛ-реактив, наряду с испытаниями на кроликах. Имеется ФС «Бактериальные эндотоксины» в которой описаны требования к ЛАЛ-реактиву, процедура анализа, расчеты предельного содержания бактериальных эндотоксинов.
ЛАЛ-тест может быть использован в медицине для ранней диагностики заболеваний, вызванных грамотрицательными бактериями. С его помощью можно быстро обнаружить бактериальные эндотоксины. Основан тест на способности лизатов амебоцитов (клеток крови) мечехвоста Limulus polyphemus (Лизат Амебоцитов Лимулюс – ЛАЛ-реактив) специфически реагировать с эндотоксинами бактерий (липополисахаридами). Реакция между эндотоксинами и лизатом дает помутнение реакционной смеси и увеличение ее вязкости вплоть до образования плотного геля. Такой результат является доказательством присутствия эндотоксинов. Анализ называется гель-тромб-тест. Метод используется для качественного и количественного определения реального содержания бактериальных эндотоксинов в испытуемом препарате.
Основным методом проведения анализа на соответствие показателю «Бактериальные эндотоксины» является качественный анализ. Если в частной статье ГФ нет других указаний, проводится качественный анализ. Этот метод является также арбитражным.
ЛАЛ-реактив представляет собой лиофилизированный препарат. Вода для ЛАЛ- теста должна соответствовать требованиям, предъявляемым к «Воде для инъекций». Она не должна содержать бактериальные эндотоксины в количестве, определяемым используемым ЛАЛ-реактивом в данном тесте.
Преимуществом данного реактива перед тестом на кроликах заключается в его высокой чувствительности. Кроме того, определение не требует много времени, результат может быть получен через 30-60 мин.
Для производства ЛАЛ-реактивов используют кровь мечехвостов.
Используют воду для инъекций свежеприготовленную или хранящуюся не более 24 часов при температуре 5-10 0 С или 80-95 0 С в закрытых ёмкостях из материала, не изменяющего свойства воды, защищающего от пыли и микробной обсеменённости. Воду для инъекций в ампулах выпускают в ампулах из нейтрального стекла по 1,2,3,5,10,20 мл, которые стерилизуют при 120 0 С в течение 20 минут. Контроль стерильности проводят по ГФ XI (Т. 2 стр. 187).
источник
Внедрение международных отраслевых стандартов в фармацевтической отрасли является актуальной задачей. Требования перехода аптечных организаций на стандарты GPP (Good Pharmacy Practice) с 1 марта 2017 г. законодательно закреплены в приказе МЗ РФ № 647н от 31.08.2016 г. «Об утверждении Правил надлежащей аптечной практики лекарственных препаратов для медицинского применения». В связи с этим одной из основных проблем для аптек, осуществляющих изготовление лекарственных препаратов, является разработка стандартных операционных процедур (СОПов) – внутренних нормативных документов, регламентирующих все виды деятельности аптечной организации. Основной задачей СОПов является предупреждение совершения ошибок при выполнении той или иной манипуляции. Созданная в аптеке СОП должна быть подробной и четкой пошаговой инструкцией, реально отражающей все виды деятельности сотрудника аптеки в конкретной ситуации. СОПы могут быть дополнены инструкциями, расположенными рядом с рабочими местами сотрудников, и помочь конкретизировать каждый этап той или иной процедуры. СОП может быть составлена в виде обычного текста или в виде таблицы, схемы последовательных процедур [1].
Таким образом, стандартная операционная процедура (СОП) – это документально оформленные локальные нормативные правовые акты аптечной организации, содержащие детальное описание стадий процедуры (способа или процесса), которые должны быть выполнены с соблюдением требований действующего законодательства, регулирующего осуществление фармацевтической деятельности, а также мер предосторожности, прямо или косвенно относящихся к изготовлению, контролю качества и (или) реализации лекарственных средств [2].
Производственная деятельность аптеки невозможна без использования воды очищенной. Вода в аптеках применяется для разных целей: в качестве растворителя при производстве лекарственных средств, вспомогательного вещества в составе лекарственных препаратов, для мойки, обработки и очистки оборудования и т.д. Поэтому контролю качества воды в аптеках уделяется особое внимание, и, соответственно, одной из основных профессиональных задач провизора-аналитика является контроль качества воды очищенной.
В связи с этим целью данного исследования явилась разработка алгоритма составления стандартной операционной процедуры (СОП) – контроль качества воды очищенной в условиях аптечных организаций, осуществляющих изготовление и отпуск лекарственных препаратов для медицинского применения.
Материалы и методы исследования
Алгоритм составления СОП по контролю качества воды очищенной разработан согласно требованиям ФС.2.2.0020.18 «Вода очищенная» ГФ РФ XIV издания и в соответствии с действующей нормативной документацией, регламентирующей деятельность аптечных организаций [3].
Результаты исследования и их обсуждение
Разработанный алгоритм составления стандартной операционной процедуры по контролю качества воды очищенной в условиях производственных аптек включает несколько разделов (рисунок).
Содержание разделов СОП по контролю качества воды очищенной
Титульный лист документа может содержать графы, представленные в табл. 1.
Титульный лист СОП по контролю качества воды очищенной
Название СОП: Контроль качества воды очищенной
Наименование аптечной организации ____________________________________________
Руководитель ___________________ __________
Документ введен в действие: «___» _____ 20___г
Документ актуализирован: «___» _____ 20___г
Определения и сокращения, принятые в документе
1. ГФ – Государственная фармакопея.
2. ФС – Фармакопейная статья.
3. ОФС – Общая фармакопейная статья.
4. СОП – Стандартная операционная процедура.
Цель: стандартизация процедуры контроля качества воды очищенной.
Область применения: настоящая стандартная операционная процедура определяет порядок анализа воды очищенной и форму отчетности.
Ответственность: положения, изложенные в данной стандартной операционной процедуре (СОП) обязательны для провизора-аналитика.
Подготовительные мероприятия и общие замечания к проведению контроля качества воды очищенной:
1. Подготовка приборов и оборудования:
В качестве прибора для потенциометрического определения рН используют иономеры или рН-метры с чувствительностью не менее 0,05 единиц рН или 3 мВ [4].
2. Подготовка реактивов для контроля качества одной пробы воды очищенной [5]:
1) насыщенный раствор калия хлорида 0,3 мл;
2) раствор кислоты азотной 0,5 мл;
3) 2 % раствор серебра нитрата 0,5 мл;
4) 7,3 % раствор кислоты хлористоводородной разведенной 0,1 мл;
5) 6,1 % раствор бария хлорида 0,1 мл;
6) 10 % раствор аммония хлорида 1 мл;
7) 10 % раствор аммиака 1 мл;
8) 4 % раствор аммония оксалата 1 мл.
3. Подготовка лабораторной посуды, необходимой для контроля качества одной пробы воды очищенной:
1) стакан лабораторный 100 мл.
2) пробирки бесцветные, прозрачные, из нейтрального стекла с плоским дном, одинакового диаметра (около 1,5 см), 6 штук;
3) пипетки мерные градуированные 1 мл, 6 штук;
4) микропипетки мерные градуированные, 2 штуки;
5) пробоотборник, изготовленный из материала, который не загрязняет воду и не реагирует с ней. Вместимость пробоотборника должна быть достаточной для отбора всей точечной пробы, а его конструкция должна быть доступна для очистки. Используемые пробоотборники должны быть чистыми и сухими.
4. Процедура отбора проб воды очищенной [6]:
Отбор проб осуществляет провизор-аналитик ежедневно из каждого баллона в количестве 130 мл (для контроля качества одной пробы); при подаче воды по трубопроводу – на каждом рабочем месте в количестве 130 мл (для контроля качества одной пробы).
Отбор точечных проб проводят пробоотборником с разных уровней: верхнего, среднего и нижнего слоев каждого баллона (крана трубопровода). Для отбора проб воды очищенной ее сначала тщательно перемешивают; в случае, если перемешивание затруднено (большие емкости), точечные пробы отбирают без перемешивания из разных слоев.
Согласно требованиям приказа Мин- здрава РФ № 751н от 26.10.2015 «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность», разделу VII, п.130 вода очищенная ежедневно из каждого баллона проверяется на отсутствие хлоридов, сульфатов и солей кальция в соответствии с требованиями действующей Государственной фармакопеи XIV издания и ФС.2.2.0020.18 «Вода очищенная».
Ежеквартально вода очищенная должна направляться в аккредитованную в установленном порядке испытательную лабораторию (центр) для полного анализа в соответствии с требованиями Государственной фармакопеи и иных, утвержденных в установленном порядке нормативных правовых актов. Отбор проб и их предоставление на анализ в сторонние лаборатории, а также получение результатов анализа осуществляет провизор-аналитик.
Раздел 2. Проведение контроля качества воды очищенной
1. Методика определения рН в воде очищенной:
Определение проводят потенциометрически в соответствии с требованиями ОФС.1.2.1.0004.15 «Ионометрия». В ФС.2.2.0020.18 «Вода очищенная» ГФ РФ XIV отсутствует значение показателя рН, однако согласно требованиям приказа Минздрава РФ № 751н от 26.10.2015 провизор-аналитик при заполнении журнала регистрации контроля качества воды очищенной должен внести результаты определения рН в соответствующую графу. В связи с этим необходимо определить значение этого показателя. Подготовка приборов к работе и проведение измерений производят согласно прилагаемым инструкциям. Измерения проводят при температуре в интервале от 20 до 25 °С. К 100 мл испытуемой воды очищенной прибавляют 0,3 мл насыщенного раствора калия хлорида. Электроды прибора погружают в испытуемый раствор и измеряют рН. Полученные результаты провизор-аналитик вносит в журнал регистрации результатов контроля воды очищенной.
2. Методика проведения испытания на недопустимые примеси в воде очищенной [7].
Методика: к 10 мл испытуемой воды очищенной прибавляют 0,5 мл азотной кислоты, раствор делят на две равные части (пробирки одинакового стекла и диаметра). В одну из пробирок прибавляют 0,5 мл 2 % раствора серебра нитрата, перемешивают и через 5 мин пробирки просматривают на темном фоне в проходящем свете. Между пробирками не должно быть заметной разницы.
Наблюдаемый результат _____________.
Вывод: вода очищенная соответствует/не соответствует требованиям по содержанию хлоридов.
Методика: к 10 мл испытуемой воды очищенной прибавляют 0,1 мл 7,3 % раствора кислоты хлористоводородной разведенной, раствор делят на две равные части (пробирки одинакового стекла и диаметра). В одну из пробирок прибавляют 0,1 мл 6,1 % раствора бария хлорида, перемешивают и через 1 час пробирки просматривают на темном фоне в проходящем свете. Между пробирками не должно быть заметной разницы.
Наблюдаемый результат _____________.
Вывод: вода очищенная соответствует/не соответствует требованиям по содержанию сульфатов.
Методика: к 10 мл испытуемой воды очищенной прибавляют 1 мл 10 % раствора аммония хлорида, 1 мл 10 % раствора аммиака, раствор делят на две равные части (пробирки одинакового стекла и диаметра). В одну из пробирок прибавляют 1 мл 4 % раствора аммония оксалата, перемешивают и через 10 мин пробирки просматривают на темном фоне в проходящем свете. Между пробирками не должно быть заметной разницы.
Наблюдаемый результат _____________.
Вывод: вода очищенная соответствует/не соответствует требованиям по содержанию ионов кальция.
Раздел 3. Обработка результатов анализа
По результатам проведенных испытаний провизор-аналитик заполняет журнал регистрации результатов контроля воды очищенной согласно требованиям приказа Минздрава РФ № 751н от 26.10.2015 г. Графы журнала представлены в табл. 2.
Форма журнала контроля качества воды очищенной
дата получения (отгонки) воды
номер проведенного химического анализа
номер баллона или бюретки, из которых взята на анализ вода
результаты контроля на отсутствие примесей
заключение о результатах анализа воды (удовлетворяет/не удовлетворяет)
подпись лица, проводившего анализ
Журнал регистрации результатов контроля воды очищенной должен быть пронумерован, прошнурован и скреплен подписью руководителя учреждения и печатью вышестоящей организации.
При получении результатов анализа воды очищенной, не соответствующих требованиям ФС, получают новую партию воды очищенной и проводят контроль качества полученной воды.
Раздел 4. Нормативная база, используемая при создании СОП
1. Государственная фармакопея Российской Федерации XIV издания. Том 3. – М., 2018. – ФС.2.2.0020.18. «Вода очищенная».
2. Приказ МЗ РФ от 26.10.2015 г. № 751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность». – М., 107 с.
Раздел 5. Приложения к СОП
Приложения содержат рабочую инструкцию, содержащую краткое изложение проводимых испытаний (табл. 3). Рабочая инструкция размещается непосредственно на рабочем месте провизора-аналитика.
Рабочая инструкция по контролю качества воды очищенной
Методика проведения испытания
К 100 мл испытуемой воды очищенной + 0,3 мл насыщенного раствора калия хлорида, измеряют рН потенциометрически
В пробирку 10 мл испытуемой воды очищенной + 0,5 мл азотной кислоты, раствор делят на две равные части (пробирки одинакового стекла и диаметра). В одну из пробирок + 0,5 мл 2 % раствора серебра нитрата, перемешивают и через 5 мин пробирки просматривают на темном фоне в проходящем свете
Различий между пробирками быть не должно
В пробирку 10 мл испытуемой воды очищенной + 0,1 мл 7,3 % раствора кислоты хлористоводородной разведенной, раствор делят на две равные части (пробирки одинакового стекла и диаметра). В одну из пробирок + 0,1 мл 6,1 % раствора бария хлорида, перемешивают и через 1 час пробирки просматривают на темном фоне в проходящем свете
Различий между пробирками быть не должно
В пробирку 10 мл испытуемой воды очищенной + 1 мл 10 % раствора аммония хлорида, 1 мл 10 % раствора аммиака, раствор делят на две равные части (пробирки одинакового стекла и диаметра). В одну из пробирок + 1 мл 4 % раствора аммония оксалата, перемешивают и через 10 мин пробирки просматривают на темном фоне в проходящем свете
Различий между пробирками быть не должно
Заполняют журнал регистрации результатов контроля воды очищенной
удовлетворяет/ не удовлетворяет
Таким образом, разработанный алгоритм составления СОП по контролю качества воды очищенной может быть использован сотрудниками производственных аптек в качестве шаблона при разработке собственных СОПов.
источник
ВОДА ОЧИЩЕННАЯ — AQUAPURIFICATA
Вода очищенная — вода для приготовления ЛС, кроме тех, которые д/б стерильными и апирогенными, если нет других указаний и разрешений компетентного уполномоченного органа.
Качество воды очищенной определяется ФС ГФ РБ «Aquapurificata» (Т. II, С. 99). Воду очищенную производят из воды питьевой методами дистилляции, ионным обменом, обратным осмосом, комбинацией этих методов или другим способом.
В соответствии с приказом МЗ РБ №130 от 6.06.94 г, воду очищенную получают в асептических условиях в специальном помещении, в котором создаются условия, препятствующие микробной контаминации воды. При совмещении помещения водоподготовки со стерилизационной сборник воды должен помещаться в плотно закрываемый шкаф, изготовленный из материалов, допускающих влажную уборку и дезинфекцию. Получение воды очищенной осуществляется с помощью аквадистиллятора. Вода очищенная должна собираться в стерильные стеклянные баллоны или др. сборники промышленного производства. Сборники д/иметь четкую маркировку: «Вода очищенная». Сборники д/б закрыты стерильными плотно прилегающими пробками (крышками) с двумя отверстиями. Одно отверстие предназначено для трубки, по которой поступает вода, а другое отверстие — для стеклянной трубки, в которую вставляется тампон из стерильной ваты. Сборники устанавливаются на поддоны или баллонопрокидыватели. Полученную воду очищенную хранят в асептических условиях не более 3-х суток.
Ежедневно из каждого баллона воду очищенную подвергают анализу на отсутствие Cl — , сульфатов и солей кальция. Один раз в квартал воду направляют в контрольно-аналит. лабораторию для полного хим. анализа; два раза в квартал – в Центр гигиены и эпидемиологии для бактериолог. анализа.
Вода очищенная«inbulk»
Описание: прозрачная бесцветная жидкость.
Во время производства и дальнейшего хранения соотв-м образом контролируют и отслеживают суммарное количество жизнеспособных аэробов. Чтобы предупредить неблагоприятные тенденции, устанавливаются соотв-щие предупреждающие и нормативные пределы.
Обычно соответствующий нормативный предел суммарного количества жизнеспособных аэробов, определенный методом мембранной фильтрации с использованием агаровой среды S (# № 1), равен 100 микроорганизмам в 1 мл. Инкубирование проводят при температуре от 30°С до 35°С в течение 5 дней. Количество образца для испытаний подбирают в зависимости от предполагаемого результата.
Определяют содержание общего органического углерода: не более 0,5 мг/л; или проводят испытания на «Восстанавливающие вещества»: к 100 мл ИО прибавляют 10 мл кислоты серной разведенной Р; 0,1 мл 0,02 М р-ра KMO4 и кипятят в течение 5 мин. Р-р должен оставаться слабо-розовым.
Удельная электропроводность. Измеряют электропроводность без температурной компенсации, одновременно регистрируя T. Измерения на приборе с температурным компенсатором м/проводиться после соотв-щей валидации. Испытуемая вода отвечает требованиям, если измеренная удельная электропроводность при измеренной температуре не превышает табличное значение (таблица 1).
Если значение Т не указано в таблице, то рассчитывают максимально возможную удельную электропроводность методом интерполяции м/ду наименьшим и наибольшим табличными значениями.
Воду очищенную «inbulk» хранят и используют в условиях, позволяющих избежать роста микроорганизмов и проникновения каких-либо других загрязнений.
Другие испытания.
Нитраты. Не более 0,00002 % (0,2 ppm).
Алюминий. 0,000001 % (10 мкг/л), если ВО предназ. для производства р-ров для диализа.
Тяжелые металлы. Не более 0,00001 % (0,1 ppm).
Бактериальные эндотоксины. Менее 0,25 МЕ/мл, если вода очищенная предназначена для производства растворов для диализа без дальнейшей процедуры удаления бактериальных эндотоксинов.
Маркировка. При необходимости указывают: «Вода очищенная пригодна для производства растворов для диализа»
Вода очищенная в контейнерах — вода очищенная «in bulk», расфасованная в подходящие контейнеры, которые хранятся в условиях, обеспечивающих микробиологическую чистоту. Вода очищенная в контейнерах не должна содержать никаких дополнительных веществ.
Испытания. Вода очищенная в контейнерах должна выдерживать требования раздела «Испытания» для воды очищенной «in bulk», а также испытания, приведенные ниже.
Кислотность или щелочность. К 10 мл ИО, свежепрокипяченного в колбе из боросиликатного стекла и охлажденного, прибавляют 0,05 мл раствора метилового красного Р. Раствор не должен окрашиваться в красный цвет. К 10 мл ИО прибавляют 0,1 мл раствора бромтимолового синего Р1. Раствор не должен окрашиваться в синий цвет.
В кислой среде МК приобретает красный цвет, в нейтральной и щелочной — желтый.
БС регистрирует изменения pH в диапазоне значений от 5,8 до 7,6, изменяя свой цвет с жёлтого на синий через оттенки зелёного.
Восстанавливающие вещества. К 100 мл ИО прибавляют 10 мл кислоты серной разведенной Р, доводят до кипения, прибавляют 0,2 мл 0,02 М раствора калия перманганата и кипятят в течение 5 мин. Раствор должен сохранять слабо-розовое окрашивание.
Хлориды. К 10 мл ИО прибавляют 1 мл кислоты азотной разведенной Р, 0,1 мл раствора серебра нитрата Р2. В течение 15 мин не должно быть видимых изменений раствора.
Сульфаты. К 10 мл ИО прибавляют 0,1 мл кислоты хлористоводородной разведенной Р и 0,1 мл раствора бария хлорида Р1. В течение 1 ч не должно быть видимых изменений раствора.
Соли аммония. Не более 0,00002 % (0,2 ppm). К 20 мл ИО прибавляют 1 мл раствора калия тетрайодомеркурата щелочного Р. Через 5 мин окраска полученного раствора д/б не интенсивнее окраски эталона, приготовленного одновременно с испытуемым р-ром прибавлением 1 мл р-ра калия тетрайодомеркурата щелочного Р к смеси 4 мл эталонного р-ра аммония (1 ppm NН4) Р и 16 мл воды, свободной от аммиака, Р. Наблюдение проводят вдоль вертикальной оси пробирки.
Кальций и магний. К 100 мл ИО прибавляют 2 мл аммиачного буферного раствора рН 10,0 Р, 50 мг протравного черного 11 индикаторной смеси Р и 0,5 мл 0,01 М р-ра натрия эдетата. Появляется слабо-синее окрашивание.
Остаток после выпаривания. Не более 0,001%. 100 мл испытуемого образца выпаривают досуха на водяной бане и сушат при температуре от 100°С до 105°С. Масса остатка не должна превышать 1 мг.
Микробиологическая чистота. Суммарное кол-во жизнеспособных аэробов д/б не более 102 в 1 мл. Определение проводят методом мембранной фильтрации, используя агаровую питат. среду В.
Маркировка. При необходимости: «Вода очищ. пригодна для производства р-ров для диализа»
+ вода очищенная в контейнерах: остаток после выпаривания.
Постановление МЗ РБ от 17.04.2015 г. № 49 «Об утверждении Инструкции о порядке и условиях контроля качества лекарственных средств, изготовленных в аптеках»
ГЛАВА 5. ХИМИЧЕСКИЙ КОНТРОЛЬ КАЧЕСТВА. Качественному анализу по показателю «Примеси» подвергаются:
— вода очищенная из каждого сборника или водоотвода на каждом рабочем месте фарм. работника на содержание хлоридов, сульфатов, кальция и магния;
— вода для инъекций из каждого сборника на содержание хлоридов, сульфатов, кальция и магния, восстанавливающих веществ и солей аммония.
ГЛАВА 6. МИКРОБИОЛОГИЧЕСКИЙ КОНТРОЛЬ КАЧЕСТВА. Подвергаются:
— по показателю «Стерильность» — вода для инъекций, растворы для инъекций и инфузий, капли глазные (выборочно по 3 наименованиям (сериям);
— по показателю «Микробиологическая чистота» — вода очищенная, а также нестерильные лекарственные средства (выборочно по 3 наименованиям).
Дата добавления: 2018-10-15 ; просмотров: 489 | Нарушение авторских прав
источник
Согласно приказу № 214 вода очищенная ежедневно из каждого баллона или на каждом рабочем месте подвергается качественному контролю на отсутствие хлоридов, сульфатов,кальция.
Вода очищенная для приготовления растворов для инъекций, глазных капель и лекарственных форм для новорожденных, кроме этих примесей проверяются на отсутствие восстанавливающих веществ, аммиака и углекислоты.
ВОССТАНАВЛИВАЮЩИЕ ВЕЩЕСТВА. 100 мл. воды доводят до кипения, прибавляют 1 мл. 0,01 Н раствора калия перманганата и 2 мл. разведенной серной кислоты, кипятят 10 минут, розовая окраска должна сохранится.
ДИОКСИД УГЛЕРОДА. При взбалтывании с равным количеством известковой воды в наполненном доверху и хорошо закрытом сосуде не должно быть помутнения в течение часа.
АММИАК. К 10 мл. воды прибавляют 0,15 мл. реактива Несслера, перемешивают и через 5 минут сравнивают с эталоном, состоящим из 0,0002% раствора аммиака и такого же количества реактива. Окраска используемого образцане должна превышать эталон.
ХЛОРИДЫ. К 10 мл. воды прибавляют 0,5 мл. раствора азотной кислоты, прибавляют 0,5 мл. раствора серебра нитрата. В растворе не должно быть изменений.
СУЛЬФАТЫ. К 10 мл воды прибавляют 0,5 мл. разведенной хлористоводородной кислоты, прибавляют 1 мл. раствора хлорида бария. В растворе не должно быть изменений.
СОЛИ КАЛЬЦИЯ. К 10 мл воды прибавляют 1 мл раствора хлорида аммония и 1 мл. раствора аммиака. Раствор делят на две равные части, к одной из них прибавляют 1 мл раствора оксалата аммония. Между растворами не должно быть заметных различий
Полный химический анализ воды очищенной и воды для инъекций по ВФС производятся ежеквартально в центре по контролю качества лекарственных средств.
Кроме химического анализа, вода очищенная и вода для инъекций подвергается бактериологическому контролю (не реже 2-х раз в квартал) и контролю на отсутствие пирогенных веществ (ежеквартально).
Капли глазные — лекарственная форма, предназначенная для инстилляции в глаз.
Глазные капли представляют собой водные или масляные растворы или тончайшие суспензии лекарственных веществ.
К глазным каплям предъявляются следующие требования: стерильность, стабильность, изотоничность, изогидричность, отсутствие видимых невооруженным глазом механических загрязнений.
Глазные капли и концентрированные растворы лекарственных веществ для их приготовления, должны изготавливаться в асептических условиях .
Осмотическое давление глазных капель должно соответствовать осмотическому давлению раствора натрия хлорида 0.9+0.2%. Для изотонирования можно использовать хлорид натрия, сульфат натрия, нитрит натрия в необходимом количестве, с учетом совместимости с лекарственными веществами.
Капли глазные должны быть изотоничны со слезной жидкостью. В отдельных случаях допускается применение гипертонических или гипотонических растворов, о чем должно быть указано в частных статьях.
Для приготовления капель глазных применяют растворители и вспомогательные вещества, разрешенные к медицинскому применению и указанные в частных статьях.
Для приготовления капель глазных используют стерильные растворители: воду дистиллированную, изотонические буферные растворы, масла и др.
В качестве стабилизаторов, консервантов, пролонгаторов и других вспомогательных веществ используют: натрия хлорид, натрия сульфат, натрия нитрат, натрия метабисульфит, натрия тиосульфат, натрия фосфорнокислые соли одно- и двузамещенные, кислоту борную, кислоту сорбиновую, нипагин, производные целлюлозы и др.
Капли глазные должны приготавливаться в асептических условиях и быть стерильными.
Стерилизацию капель глазных осуществляют методами, указанными в частных статьях в соответствии со статьей «Стерилизация».
Проверку капель глазных на стерильность проводят в соответствии со статьей «Испытание на стерильность» (с. 187).
Капли глазные должны выдерживать испытания на механические включения.
Испытания на механические включения проводят в соответствии с инструкцией, утвержденной Министерством здравоохранения СССР. Настоящая Инструкция устанавливает порядок визуального контроля глазных капель, изготовленных в аптеках, на отсутствие механических включений. Под механическими включениями подразумеваются посторонние подвижные нерастворимые вещества, кроме пузырьков газа, случайно присутствующие в растворах. В процессе изготовления растворы подвергаются первичному и вторичному контролю.
Первичный контроль осуществляется после фильтрования и фасовки раствора. При этом просматривается каждая флакон с раствором. При обнаружении механических включений раствор повторно фильтруют, вновь просматривают, укупоривают, маркируют и стерилизуют. Растворы, изготовленные асептически, просматривают один раз после розлива или стерилизующего фильтрования.
Вторичному контролю подлежат также 100% флаконов с растворами, прошедших стадию стерилизации перед их оформлением и упаковкой.
Контроль растворов на отсутствие механических включений осуществляется провизором — технологом с соблюдением условий и техники контроля.
Упаковка. Упаковка должна обеспечивать стабильность и стерильность препарата при хранении и транспортировании и иметь, как правило, устройство для закапывания.
Хранение. В прохладном, защищенном от света месте, если нет других указаний в частных статьях.
Отклонения, допустимые в общем объеме жидких лекарственных форм при изготовлении массо-объемным способом*(2.5.)
1. Отклонения, допустимые в массе навески отдельных лекарственных веществ в жидких лекарственных формах при изготовлении способом по массе или массо-объемным способом, а также в мазях, определяются не на концентрацию в процентах, а на массу навески каждого вещества, входящего в эти лекарственные формы (приложение 2, пп. 2.7 и 2.9.).
Например, при изготовлении 10 мл 2% раствора пилокарпина гидрохлорида берут массу навески 0,2 г, для которой допускается отклонение +- 10 %. При анализе достаточно установить, что было взято не менее 0,18 г и не более 0,22 г пилокарпина гидрохлорида.
Возьми: Раствора пилокарпина гидрохлорида 1% — 10 мл
По 2 капли 3 раза в день в оба глаза.
Rp.: Sol. Pilocarpini hydrochloridi 1% — 10 ml
Da. Signa. По 2 капли З раза в день в оба глаза.
Pilocarpini hydrochloridum — бесцветные кристаллы или белый кристаллический порошок без запаха. Гигроскопичен. Очень легко растворим в воде. Список А.
В прописи выписано одно лекарственное вещество, поэтому заключение о совместимости ингредиентов нецелесообразно.
Характеристика лекарственной формы.
Выписана жидкая лекарственная форма — глазные капли, представляющие собой раствор легкорастворимого вещества
Проверка доз веществ списка А и Б и норм одноразового отпуска.
В глазных каплях проверка доз не проводится.
Паспорт письменного контроля.
Лицевая сторона Оборотная сторона
Выдал: Pilocarpini hydrochloridi 0,1 Пилокарпина гидрохлорида 0,1
Дата. Подпись. Натрия хлорида 0,09 — (0,1 х 0,22)=
Получил: Pilocarpini hydrochlor >
Дата. Подпись. эквивалент пилокарпина гидро-
Дата. № рецепта хлорида по натрия хлориду.
Aquae pro injectionibus 10 ml Воды очищенной 10 мл
Pilocarpini hydrochloridi 0,1
Рассчитаем осмолярность раствора:
Rp.: Solutionis Natrii chloridi 0,9 %
В настоящее время для выражения осмотической активности оф- тальмологических, инъекционных и инфузионных растворов используют понятия «осмоляльность» и «осмолярность». Молярная концентрация — количество вещества в молях, содержащееся в 1 л раствора. Моляльная концентрация — это количество вещества в молях, содержащееся в 1 кг раствора. Осмоляльность или осмолярность указывает на содержание в моляльном или молярном растворе активных частиц (молекул, ионов), создающих определенное осмотическое давление. Офтальмологические и инъекционные растворы изготавливают в массо-объемной концентрации, поэтому более удобной в использовании является характеристика осмолярности.
Если количество осмотически активных частиц в осмолярном растворе таково, что создаваемое ими давление соответствует физиологическому, такие растворы называют изоосмолярными. Единицей измерения осмолярности является миллиосмоль (тысячная доля осмолярной концентрации). Теоретическую осмолярность рассчитывают по формуле
где С — миллиосмолярность раствора, мосмоль/л;
m — масса вещества в растворе, г/л;
n — число оомотически активных частиц в растворе, образовавшихся в результате диссоциации при растворении (n = 1, если вещество в растворе не диссоциирует; n = 2, если вещество при диссоциации образует два иона; n — 3, если — три и т.д.); М — молекулярная масса вещества, находящегося в растворе. В нашем примере.
Известно, что 0,9 % раствор натрия хлорида является изотоничным слезной жидкости и плазме крови, следовательно, концентрация 308 мОсм является изоосмолярной.
источник
Общая характеристика воды очищенной, методы и технология ее получения, а также принципы проведения внутриаптечного контроля. Особенности отражения главных требований к данному продукту в соответствующих стандартах, действующих на современном этапе.
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Размещено на http://www.allbest.ru/
Метод получения и внутриаптечный контроль воды очищенной
Самое привычное и самое невероятное вещество на Земле — вода. Значение воды невозможно переоценить в жизни всего живого на планете, она присутствует в каждом мгновении нашего существования. Являясь преобладающим элементом в составе любого организма, вода руководит и его жизнедеятельностью.
В процессе приготовления жидких лекарственных форм всегда применяется растворитель, который способен растворять различные вещества, то есть образовывать с ними растворы. Одним из растворителей в медицинской практике является вода очищенная.
Получение воды очищенной является самостоятельным разделом фармацевтической технологии.
Актуальность исследования: необходимость получения воды очищенной в асептических условиях вызвана особым способом ее применения. Наличие в ней малейших частиц или микроорганизмов может привести к губительным последствиям для организма и жизни человека.
Цель — изучить современные подходы технологии приготовления и внутриаптечного контроля качества воды очищенной
Объект исследования — воды очищенной
Предмет исследования — технология изготовления и внутриаптечный контроль водных извлечений
1. Изучить устройства для получения воды очищенной.
2. Провести внутриаптечный контроль воды очищенной.
1. Теоретическая часть по теме «Метод получения и внутриаптечный контроль воды очищенной»
вода очищенный внутриаптечный
Настоящая фармакопейная статья распространяется на Воду очищенную, получаемую из воды питьевой методами дистилляции, ионного обмена, обратного осмоса, комбинацией этих методов или другим способом и применяемую для приготовления нестерильных лекарственных средств, воды для инъекций, а также для проведения испытаний лекарственных средств.
Вода очищенная не должна содержать антимикробных консервантов или других добавок.
Описание. Бесцветная прозрачная жидкость без запаха.
рН. От 5,0 до 7,0. К 100 мл воды очищенной прибавляют 0,3 мл насыщенного раствора калия хлорида и определяют рН полученного раствора потенциометрически. (согласно ГОСУДАРСТВЕННОЙ ФАРМАКОПИИ XII)
Согласно ГФ XI издания вода — универсальный и самый доступный растворитель. Это свойство позволяет использовать воду как растворитель и дисперсионную среду при приготовлении жидких лекарственных форм. В фармацевтической практике принято, что если в прописи рецепта не указан растворитель, применяют воду очищенную. Вода для фармацевтических целей относится к одному из самых важных элементов, обеспечивающих безопасность и качество производимых лекарственных средств.
1.2 Санитарные требования к получению воды очищенной
Согласно приказу Министерства здравоохранения Российской Федерации №309 от 21 октября 1997 года «Об утверждении инструкции по санитарному режиму аптечных организаций», для изготовления неинъекционных стерильных и нестерильных лекарственных средств используют воду очищенную, которая может быть получена дистилляцией, обратным осмосом, ионным обменом и другими разрешенными способами.
Получение воды очищенной должно производиться в специально оборудованном для этой цели помещении, отвечающем следующим требованиям:
— Помещения асептического блока должны размещаться в изолированном отсеке и исключать перекрещивание «чистых» и «грязных» потоков. Асептический блок должен иметь отдельный вход или отделяться от других помещений производства шлюзами.
— Перед входом в асептический блок должны лежать резиновые коврики или коврики из пористого материала, смоченные дезинфицирующими средствами.
— В шлюзе должны быть предусмотрены: скамья для переобувания с ячейками для спецобуви, шкаф для халата и биксов с комплектами стерильной одежды; раковина (кран с локтевым приводом), воздушная электросушилка и зеркало; гигиенический набор для обработки рук; инструкции о порядке переодевания и обработке рук, правила поведения в асептическом блоке.
— В ассистентской-асептической не допускается подводка воды и канализации. Трубопроводы для воды очищенной следует прокладывать таким образом, чтобы можно было легко проводить уборку.
— Для защиты стен от повреждений при транспортировке материалов или продукции (тележки и др.) необходимо предусмотреть специальные уголки или другие приспособления.
— Для исключения поступления воздуха из коридоров и производственных помещений в асептический блок в последнем необходимо предусмотреть приточно-вытяжную вентиляцию, при которой движение воздушных потоков должно быть направлено из асептического блока в прилегающие к нему помещения, с преобладанием притока воздуха над вытяжкой.
— Для дезинфекции воздуха и различных поверхностей в асептических помещениях устанавливают бактерицидные лампы (стационарные и передвижные облучатели) с открытыми или экранированными лампами. Количество и мощность бактерицидных ламп должны подбираться из расчета не менее 2 — 2,5 Вт мощности неэкранированного излучателя на 1 куб. м объема помещения. При экранированных бактерицидных лампах 1 Вт на 1 куб. м. Настенные бактерицидные облучатели ОБН-150 устанавливают из расчета 1 облучатель на 30 куб. м помещения; потолочные ОБП-300 — из расчета 1 на 60 куб. м; передвижной ОБП-450 с открытыми лампами используют для быстрого обеззараживания воздуха в помещениях объемом до 100 куб. м. Оптимальный эффект наблюдается на расстоянии 5 м от облучаемого объекта.
Получение воды очищенной производится с помощью аквадистилляторов или других разрешенных для этой цели установок.
При получении воды с помощью аквадистиллятора ежедневно перед началом работы необходимо в течение 10-15 мин проводить пропаривание при закрытых вентилях подачи воды в аквадистиллятор и холодильник. Первые порции полученной воды в течение 15-20 мин сливают. После этого времени начинают сбор воды.
Полученную воду очищенную собирают в чистые простерилизованные или обработанные паром сборники промышленного производства (в порядке исключения — в стеклянные баллоны). Сборники должны иметь четкую надпись: «Вода очищенная». Если одновременно используют несколько сборников, их нумеруют.
Стеклянные сборники плотно закрывают пробками с двумя отверстиями: одно для трубки, по которой поступает вода, другое для стеклянной трубки, в которую вставляется тампон из стерильной ваты (меняют ежедневно). Сборники устанавливают на баллоно-опрокидыватели.
Сборники соединяют с аквадистиллятором с помощью стеклянных трубок, шлангов из силиконовой резины или другого индифферентного к воде очищенной материала, разрешенного к применению в медицине и выдерживающего обработку паром.
Подачу воды на рабочие места осуществляют по трубопроводам или в баллонах. Трубопроводы должны быть изготовлены из материалов, разрешенных к применению в медицине и не изменяющих свойств воды. При значительной длине трубопровода для удобства мойки, дезинфекции и отбора проб воды очищенной на микробиологический анализ через каждые 5-7 метров следует предусматривать тройники с внешним выводом и краном.
Мытье и дезинфекцию трубопровода производят перед сборкой, в процессе эксплуатации не реже 1 раза в 14 дней, а также при неудовлетворительных результатах микробиологических анализов.
Для обеззараживания трубопроводов из термостойких материалов через них пропускают острый пар из парогенератора или автоклава. Отсчет времени обработки ведут с момента выхода пара с концевого участка трубопровода. Обработку проводят в течение 30 минут.
Трубопроводы из полимерных материалов и стекла можно стерилизовать 6% раствором перекиси водорода в течение 6 часов с последующим тщательным промыванием водой очищенной. После чего осуществляют проверку на отсутствие восстанавливающих веществ. Регистрацию обработки трубопровода ведут в специальном журнале.
Для очистки от пирогенных веществ стеклянные трубки и сосуды обрабатывают подкисленным раствором калия перманганата в течение 25-30 минут. Для приготовления раствора к 10 частям 1% раствора После обработки сосуды и трубки тщательно промывают свежеприготовленной водой для инъекций.
Руководителем аптеки назначается лицо, ответственное за получение воды очищенной.
1.3 Внутриаптечный контроль воды очищенной
Внутриаптечный контроль проводится в соответствии с приказом Министерства здравоохранения РФ №751 н от 26.10.2015 г. «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность».
Вода очищенная подвергается следующим видам контроля:
1. Органолептический контроль — является обязательным видом контроля и заключается в проверке лекарственной формы по показателям: цветность, прозрачность, запах и отсутствие механических примесей. Флакон плавным движением переворачивают в положение «вверх донышком» и просматривают на черном и белом фонах. Затем плавным движением, без встряхивания переворачивают в первоначальное положение «вниз донышком» и также просматривают на черном и белом фонах. Поверхность просматриваемых флаконов должна быть снаружи чистой и сухой. Данный вид контроля осуществляется согласно ГФ и приказу 751н.
2. Химический контроль-заключается в оценке качества изготовления лекарственных препаратов по показателям:
· Качественный анализ: подлинность лекарственных средств;
· Количественный анализ: количественное определение лекарственных средств.
Для проведения химического контроля оборудуется специальное рабочее место, оснащенное необходимым оборудованием, приборами и реактивами, обеспеченное документами в области контроля качества и справочной литературой.
Результаты контроля очищенной воды в аптеке регистрируют в специальном журнале (Приказ №751н).
Таблица 1. Журнал регистрации контроля воды очищенной
источник