Анализ питьевой воды позволяет точно понять, пригодна ли она для употребления человеком или может быть опасна для здоровья. Лабораторные исследования могут проводиться в разных вариантах, все зависит от поставленной задачи (от простого анализа на жёсткость до многоступенчатого исследования пробы на включение в состав редких элементов). Выбор методики зависит от типа пробы (из водопровода или забор на природе) и цели исследования. Есть контроль качества, соответствие нормам, степень превышения включения в состав примесей относительно ПДК. Стоит подробнее изучить вопросы о том, что включает в себя анализ, как проводится и какова его стоимость.
Основа в осуществлении анализов – полная качественная оценка качества воды из скважины, пробы из природного источника, осадков атмосферы, а также вод из стоков. Сегодня многие компании предоставляют квалифицированные услуги по определению физических и химических показателей качества и пригодности для употребления воды.
Благодаря анализу воды можно определить, пригодна ли она для употребления или нет
Обычно проводится проверка вод:
- Для питья центрального и нецентрального трубопровода снабжения водой. Эта жидкость, нужная для употребления людьми внутрь, в бытовых целях, для применения в процессе перерабатывания продовольствия и производства пищи. Регламент — СанПиН 2.1.4.1074-01.
- Из природных источников (поверхностная, подземная), осадки атмосферы. Задача охраны вод на поверхности от загрязнения актуальны для России, особенно для регионов вдоль реки Волги. Исследования поверхностных вод в лаборатории выполняются с целью выявления качества жидкости для питья и бытовых нужд, контроля за загрязнением производством, стоками в быту, а также для выявления качества объектов рыбно-хозяйственного назначения.
- Вода сточная.
При сбрасывании сточных вод в канализационную сеть необходимо проводить проверку результативности очищения и соответствия стоков прописанным в законе нормам. Проверка должна проводиться регулярно, сроки также указаны в законодательных документах.
Первостепенно нужно определение элементарного состава воды (30 самых распространенных химических элементов). Второй момент — выявление присутствия в нем дополнительных химических веществ, если это нужно или если проба имеет особенности (забор воды из грязных водоносных горизонтов или стоки промышленного предприятия).
В целом мощности хороших лабораторий дают возможность выполнять анализ проб на выявление 72 химических элементов разного рода.
Залог успеха и правильного исследования жидкости – это качественно взятая проба. Важно обращать внимание на требования к забору проб для исследования.\
Для проведения анализа воды нужно обладать специальными знаниями и оборудованием
Требования к таре и объёму воды следующие:
- Применение стерильной емкости из пластика или тары из-под дистиллированной воды. Запрещается использовать в качестве тары емкости из-под газировки, бутылки, в которых находились агрессивные среды.
- Минимум воды для исследования, взятой из скважины, колодца, крана – не меньше 0,5 л.
- Перед тем как забирать пробу для исследований, нужно, чтобы вода протекла в течение 5 минут, следует предварительно ополоснуть тару водой из этого источника.
Период, на протяжении которого взятая проба должна быть отправлена на исследование, не может быть больше 2 суток. Взятую пробу необходимо хранить в холодильнике. Также на каждой емкости должны быть нанесены данные о времени, дате и месте забора, а также о виде источника.
Исследование обычно состоит из 30 самых распространенных элементов. Образец следует передать на анализ в лабораторию не позже 48 часов с момента забора жидкости. Промаркированный образец нельзя оставлять без присмотра.
Цена исследования высчитывается в зависимости от его сложности.
Если это стандартная услуга (на выявление 30 веществ), то стоимость классическая (комплекс, примерно 60 руб./вещество). За каждый дополнительный элемент берется дополнительная сумма, все зависит от типа пробы. Однако в лабораториях для постоянных клиентов, а также при больших объёмах заказа на исследования предоставляются скидки.
Хорошая лаборатория должна иметь аттестат аккредитации на выполнение исследований воды из разных источников, а именно:
- Водопроводной воды;
- Питьевой;
- Минеральной;
- Из скважины;
- Колодезной.
Анализ воды выполняется достаточно быстро и стоит это недорого
Лабораторный анализ воды в хорошем центре основан на инновационной методике исследования – масс-спектрометрии, которая дает возможность выявлять присутствие в пробе элементов даже в микроскопических дозах. Аккредитованная лаборатория гарантирует качественный результат проведенных исследований.
Химический анализ воды направлен на определение органики и неорганики, а также степени жёсткости, мутности и прочих важных показателей пригодности и качества. Сегодня разработано больше 100 разнообразных методов, часть которых применяется на практике только в единичных лабораториях.
В перечне самых актуальных методик находятся:
- Спектрофотометрия;
- Биотестирование;
- Кондуктометрия;
- Фотометрия;
- Капиллярный электрофорез;
- Турбидиметрия;
- Газовая хроматография;
- Гравиметрия;
- Нефелометрия.
После выполнения анализа воды результаты будут перенесены на листок в виде таблицы
Обычно центры, которые специализируются на диагностировании качества воды, предлагают сокращенное и полное химическое исследование пробы. Первая методика включает диагностирование по 25 пунктам и выявляет соответствие на нормы: присутствие посторонних запахов, жесткость, мутность, общая минерализация, окисляемость, присутствие железа и магния. Сокращенный метод можно применять при переезде на новое место и для выбора фильтра в домах с централизованным снабжением водой.
Полное исследование дает возможность с высочайшей точностью выявить процент включения в состав образца следующих веществ: металлов, газов, нефтепродуктов, щелочей, мочевины, нитритов, аммиака.
Расширенное диагностирование предполагает тест по 100 и больше пунктам. Эта методика должна быть выбрана владельцами частных скважин и колодцев ещё во время стройки. Для тех, кто не может обратиться в лабораторию, выпускают уникальные наборы для химического диагностирования воды из источника своими руками дома.
Наборы для анализа в домашних условиях дают возможность в общих чертах понять, какова жёсткость воды, увеличен ли уровень солей и металлов:
Можно найти дешевые тесты, созданные специально для водопроводной системы, скважин, природных источников и колодцев. Это могут быть наборы для выявления одного или нескольких видов веществ. Тесты реализуются с описанием, оно поможет выполнить экспресс-анализ жидкости дома, понять результат и правильно подобрать устройство для фильтрации воды.
Исследование проб воды требует профессионализма, поэтому для своей же безопасности правильно будет доверить дело экспертам.
источник
1 Анализ химического состава воды
Анализ воды позволяет судить не только о качестве вод, но и о необходимой системе водоподготовки.
Качество воды в природном источнике определяется по данным анализа, при этом проба должна отражать действительный средний состав воды. Для полного анализа берут 3-4 л воды, для сокращенного анализа — 1 л.
Помимо общих сведений о роде источника, месте и времени отбора пробы приводятся данные о физических и химических свойствах воды. Однако этих данных недостаточно для выбора рациональной системы очистки воды, поскольку она не характеризуют ее технологических свойств. Так, величина цветности не позволяет составить представление о потребной для этого дозе коагулянта. Поэтому, чтобы подобрать и запроектировать сооружение для осветления воды необходимо знать кинетику осаждения взвеси. Знание способности отобранной в пробе воды к фильтрованию позволяет более обоснованно подойти к выбору типа фильтра.
Таким образом, для выяснения технологических свойств воды конкретного источника водоснабжения выполняют пробное коагулирование и пробное обесцвечивание. Наличие этих данных позволяет более правильно обосновать выбор метода очистки воды и назначение расчетных параметров.
Качество природной воды характеризуется ее физическими и химическими свойствами и бактериологическими загрязнениями. К физическим показателям относятся: температура, мутность, цветность, запах, вкус. Химические свойства воды зависят от содержания и концентрации в ней растворенных химических веществ.
Химический состав исходной воды представлен в таблице 1. Для анализа показателей качества воды, классификации ее состава, определения отдельных расчетных характеристик, необходимо концентрацию, входящих в нее химических элементов, выразить в мг-экв/дм 3 .
Таблица 1 – Химический состав исходной воды
Помимо представленных химических показателей исходная вода характеризуется следующими дополнительными показателями:
Плотный (сухой) остаток – 370,0 мг/ дм 3
1.2 Классификация исходной воды
В соответствии со СНиП 2.04.02 -84* воды источников водоснабжения подразделяются:
а) в зависимости от расчетной максимальной мутности (ориентировочно количество взвешенных веществ) на:
маломутные — до 50 мг/ дм 3 ;
средней мутности — свыше 50 до 250 мг/ дм 3 ;
мутные — выше 250 до 1500 мг/ дм 3 ;
высокомутные — свыше 1500 мг/ дм 3 ;
б) в зависимости от расчетного максимального содержания гумусовых веществ, обусловливающих цветность воды, на:
средней цветности — свыше 35 до 120°;
высокой цветности — свыше 120°.
В соответствии с исходными показателями мутности и цветности исходная вода характеризуется как средней мутности, высокой цветности.
Химический состав исходной воды характеризуется по классификации, предложенной О.А. Алекиным. Согласно, этой классификации природные воды подразделяются по:
1. Преобладающему аниону на три класса:
2. Каждый класс подразделяется на три группы по преобладающему катиону:
3. Каждая группа подразделяется на четыре типа по соотношению между ионами::
первая — HCO3 — > Ca 2+ + Mg 2+ ;
третья — HCO3 + SO4 2- 2+ + Mg 2+ или Cl — + ;
Согласно этой классификации исходная вода относится по преобладающему аниону к карбонатному классу, по преобладающему катиону к натриевой группе, и по соотношению между ионами – к первой группе.
По общей минерализации, определяемой по сухому остатку равному 370,0 мг/ дм 3 , исходная вода характеризуется как средней минерализации (диапазон для этого типа вод 200 — 500 мг/ дм 3 ).
Жесткость воды определяется содержанием в ней растворенных солей кальция и магния. Жесткость воды выражают в мг-экв/ дм 3 . Различают карбонатную, некарбонатную и общую жесткость.
Карбонатная жесткость обусловлена содержанием в воде карбонатных и бикарбонатных солей кальция и магния. Она определяется концентрацией ионов кальция [Ca 2+ ]+ и магния [Mg 2+ ] эквивалентной иону гидрокарбоната [HCO3 — ].
При длительном кипячении воды, обладающей карбонатной жесткостью, в ней появляется осадок, состоящий главным образом из CaCO3, и одновременно выделяется углекислый газ СО 2 .. Оба эти вещества появляются вследствие разложения гидрокарбоната кальция. Именно поэтому карбонатную жесткость называют временной жесткостью.
Некарбонатная (постоянная) жесткость обусловлена кальциевыми и магниевыми солями сильных кислот (серной, соляной, кремниевой и азотной). Некарбонатная жесткость определяется суммой катионов [Ca 2+ ]+ [Mg 2+ ], нескомпенсированных ионами гидрокарбоната [HCO3 — ]. Эта жесткость остается после кипячения.
Сумма карбонатной и некарбонатной жесткости сотавляет общую жесткость воды.
По исходному составу воды определяем характеристики жесткости.
1. Карбонатная Жкар= [Ca 2+ ]+ [Mg 2+ ] = 2,4+1,1 = 3,5 мг-экв/дм 3
2. Некарбонатная Жнек– ее нет, поскольку [HCO3 — ] > [Ca 2+ ]+ [Mg 2+ ].
3.Общая жесткость — Жобщ = Жкар= 3,5 мг-экв/дм 3 .
Присутствие в воде значительного количества солей кальция и магния делает воду непригодной для многих технических целей. Жесткой водой нельзя пользоваться при проведении некоторых технологических операций, например при крашении водорастворимыми красками.
В действующих нормах САнПиН 2.1.4.1074 -0, общая жесткость воды, используемой для питьевых и хозяйственно-бытовых нужд, нормируется. Допустимое максимальное содержание солей жесткости в воде по суммарному содержанию в ней ионов кальция и магния составляет должно составлять до 7(10) ммоль/л. Величина, указанная в скобках, может быть установлена по постановлению государственного санитарного врача для конкретной системы водоснабжения.
1. 4 Проверка точности выполнения анализа
Вода электронейтральна, поэтому сумма концентраций катионов и анионов, выраженные в мг-экв/ дм 3 , равны. Учитывая преобладание в природных водах катионовCa 2+ ,Mg 2+ ,Na + , К + и анионовHCO3 — , SO4 2- , Cl — можно записать:
[Ca 2+ ] + [Mg 2+ ] + [Na + ] + [К + ] = [HCO3 — ]+ [SO4 2- ] + [Cl — ], [мг-экв/дм 3 ]По этому уравнению проверяется правильность выполнения химического анализа воды. При правильном определении концентрации химических элементов, погрешность не должна превышать 5%.
Выполним проверку для исходного состава воды:
2,4+1,1+3,2+0,05 = 4,7+1,4+0,5; 6,75 мг-экв/дм 3 и 6,6 мг-экв/дм 3 .
Погрешность результата составляет 2% и можно сказать, что он выполнен удовлетворительно.
*Причиной расхождения может быть как ошибка в подсчете, так и недостаточным количеством определяемых показателей химических элементов.
Для проверки качества выполненного анализа сравнивают величину плотного остатка с суммарной массой всех ионов. При этом количество бикарбонатов следует принять равным половине концентрации, найденной анализом, так как при определении плотного остатка бикарбонаты переходят в карбонаты.
[Ca 2+ ] + [Mg 2+ ] + [Na + ] + [К + ] +0,5[HCO3 — ]+ [SO4 2- ] + [Cl — ]=Р, [мг /дм 3 ]Тогда: 49+12,6+73,3+2,1+0,5·292+65,4+21,1 = 369,5 мг/ дм 3 . Величина сухого остатка 370,0 мг/ дм 3 . Разница составляет 1 %.
Вывод. Результаты химического анализа выполнены удовлетворительно.
1.5 Определение общего солесодержания
Данные анализов ионного состава воды удобно изображать графически. Для этого в выбранном масштабе на двух параллельных соприкасающихся полосках в определенном порядке откладывают концентрации катионов и анионов в мг-экв/ дм 3 . Графическое изображение результата позволяет представить гипотетический состав солей в воде. Анионы на диаграмме располагаются в порядке увеличения их кислотных свойств. Расположение катионов обусловлено тем порядком в котором они будут образовывать малорастворимые соединения при постепенном увеличении рН , то есть увеличения щелочности среды.
Зная масштаб можно определить концентрацию всех солей, которые присутствуют в составе воды. На рисунке 1 представлена диаграмма, построенная для заданного состава воды.
1.6 Определение содержания свободной углекислоты
Находящиеся в воде ионы CO3 2- HCO3 — и углекислый газCO2, связаны углекислотным равновесием. Часть свободной углекислоты, находящаяся в равновесии с бикарбонатами, называется равновесной и не вступает в химические реакции. Избыточная свободная (или агрессивная) углекислота в отличие от равновесной весьма активна. Наличие ее в воде вызывает коррозию бетонных сооружений и металлических труб.
Содержание свободной углекислоты определяем согласно рекомендаций [3] по формуле:
[СО2]таб – содержание свободной углекислоты определенное по таблице 69 [3]для заданного значения рН и общей щелочности Щ, равной карбонатной жесткости;
τ – поправка на температуру, вводится в формулу если температура исходной воды не равна 10ºС;
β — поправка на фактическое солесодержание.
По показателям исходной воды: рН=8.5 и Щ = 0,98 мг-экв/дм 3 по таблице 69 [3] определяем [СО2]таб= 1,0 мг/ дм 3 . По таблицам 70, 71 [3] определяем поправки τ = 0,99; β = 0,95. Тогда фактическое содержание свободной углекислоты будет равно [СО2]фак= 1·0,99·0,95 = 0,9 мг/дм 3 .
источник
Долгосрочная энергетическая политика в России представлена в документе «Энергетическая стратегия РФ на период до 2020г.», имеет цели:
— устойчиво обеспечивать страну энергоносителями, повышать эффективность использования топливно-энергетических ресурсов;
— создать надежную сырьевую базу;
— уменьшить негативное влияние топливно-энергетического комплекса на окружающую среду;
— расширить экспорт продукции, сохранить энергетическую независимость и энергетическую безопасность России.
Приоритетными названы энергетическая эффективность, энергосбережения и экологическая безопасность. По этим направлениям разработаны Федеральные целевые программы.
Одним из путей решения поставленной задачи по снижению энергоемкости ВВП примерно в 2 раза является внедрение малозатратных энергосберегающих мероприятий, а именно: устранение потерь энергоносителей, соблюдение энергоэкономических технологических режимов, совершенствование учета и контроля энергопотребления. Широкое популяризация среди населения экономии энергии будет стимулировать эффективное использование энергии.
Потенциал энергосбережения составляет примерно 40% всего энергопотребления в стране. Между энергосбережением и качеством подготовки воды для энергообъектов существует тесная связь, так как предотвращает появление накипи, уменьшаются процессы коррозии, что приводит к экономии денежных средств.
Применение энергосберегающих технологий уменьшает расход воды на технологические нужды.
В данном курсовом проекте рассматриваются ВПУ ГРЭС 3200 МВт на реке Волга в городе Ярославль, предназначенная для обеспечения нужд города и района в энергии.
Определение производительности водоподготовительной установки
Техническая характеристика турбины К-800-240-5
Завод изготовитель ПО «Турбоатом»
Номинальная мощность, МВт 800
Максимальная мощность, МВт 850
Давление свежего пара, МПа 23,54
Температура свежего пара, о С 540
Давления пара после промежуточного перегревателя, МПа 3,3
Температура после промежуточного перегревателя, о С 540
Число отборов пара регенерации 8
Давление отработавшего пара, МПа 0,00343
Температура охлаждающей воды, о С 12
Расход охлаждающей воды, м 3 /ч 73
Максимальный расход пара, т/ч: 2650
Общая масса турбины, т 625
Температура питательной воды, о С 274
Выбор котла и его техническая характеристика
Для того чтобы удовлетворить расход пара на турбину (Дк=1000 т/ч), а также исходя из параметров пара для турбины (Ро= МПа и t= о С), с учетом заданного топлива (Бурый уголь) выбираю котел марки Пп-2650-25 ГМ (ТГМП-344СО). Таганрогский котельный завод «Красный котельщик»
Привожу его техническую характеристику
Температура свежего пара, о С 545/542
Топливо Березовский бурый уголь
Компоновка котла Т-образная
Газовый тракт Разряженный

0,03-3% от паропроизводительности котла — включает внутристанционные потери пара и конденсата; собственные нужды блочной обессоливающей установки (БОУ); на приготовление растворов для консервации, химических промывок и т.п.
Дк – паропроизводительность котла, т/ч
Характеристика источника водоснабжения
Источник водоснабжения р. Волга
Место отбора проб г. Ярославль
Взвешенные вещества 13 мг/дм 3
Минеральный остаток 101,54 мг/дм 3
Сухой остаток ―
| Жесткость мг-э/дм 3 | Содержание ионов и оксидов, мг/дм 3 | ||||||||||
| Жо | Жк | Ca 2+ | Mg 2+ | K + ,Na + | HCO3 ¯ | SO4 2- | NO3 ¯ | SiO3 2- | Fe | CO2 | Cl |
| 2,46 | 1,95 | 34,4 | 9,1 | 2,2 | 119 | 23,1 | — | 8,7 | — | — | 5,8 |
Проверка правильности результатов анализа воды
источник
Систематические погрешности и их виды. Как было указано в разделе 2.2, систематическую погрешность q оценивают по разности между средним результатом анализа ( 
Как правило, величина q приблизительно одинакова во всех повторных измерениях данной величины (постоянная систематическая погрешность). Однако этот термин не совсем точен. При повторении небольшой серии измерений за счет случайных погрешностей аналитик всегда получит несколько другое значение 
Иногда величина q закономерно меняется в ходе повторных измерений, например, каждый последующий анализ того же материала дает все меньшее и меньшее содержание определяемого компонента. Такую систематическую погрешность называют прогрессирующей, или дрейфом. Появление дрейфа объясняется протеканием побочных процессов, например, окислением определяемого компонента пробы кислородом воздуха. При наличии дрейфа, как и при наличии постоянной систематической погрешности, результат каждого следующего анализа можно предвидеть, зная результаты прошлых анализов. Поэтому статистическую обработку «дрейфующих» результатов анализа не проводят. Необходимо заранее исключить те факторы, которые могут привести к появлению дрейфа. При дальнейшем изложении материала предполагается, что дрейф отсутствует.
Величина q может зависеть (или не зависеть) от самой измеряемой величины. Если абсолютная систематическая погрешность химического анализа не зависит от содержания компонента в пробе, она называется аддитивной, если же она растет прямо пропорционально содержанию компонента – мультипликативной. В большинстве же методик анализа q зависит от содержания определяемого компонента довольно сложным образом, нелинейно.
Систематические погрешности анализа вызываются разными факторами. Одни из них ведут к аддитивным, другие – к мультипликативным, третьи – к нелинейным погрешностям. Знание того, какая погрешность характерна для конкретной методики, позволяет исправлять полученные результаты анализа.
а) Допустим, основным источником систематической погрешности является неправильная настройка прибора, смещение нулевой точки на шкале прибора. Это – аддитивная погрешность, в отсутствие статистически значимых случайных погрешностей ее можно заранее найти и исключить. Для этого используют поправочные слагаемые. Ход рассуждений можно проиллюстрировать следующим примером: «Без нагрузки эти весы всегда показывают 50 мг, а с данной нагрузкой они показали 800 мг, значит, масса нагрузки в действительности составляет 750 мг». Другим примером могут быть погрешности анализа, связанные с примесями определяемого компонента в реактивах и растворителе. Величина этой погрешности не зависит от содержания определяемого компонента в пробе и может быть заранее определена с помощью контрольного («холостого»)опыта. Так называют анализ, в котором вместо пробы через все предусмотренные методикой стадии анализа проводят другой материал, заведомо не содержащий определяемый компонент, например чистый растворитель. Полученный в холостом (нулевом, глухом) опыте аналитический сигнал вычитают из сигнала, полученного при анализе реальной пробы. Таким же способом можно учесть и уменьшить влияние некоторых других факторов, ведущих к завышенным результатам анализа. В частности, холостой опыт позволяет учесть лишний расход титранта на его химическое взаимодействие с индикатором. Конечно, лучше не вводить поправки к неправильному результату, а заранее уточнить настройку прибора, очистить реактивы от примесей, вводить как можно меньше индикатора и т. п., после чего получать правильные результаты анализов.
б) Примером мультипликативной погрешности может быть погрешность титриметрического анализа, связанная с неверно установленной концентрацией титранта. В этом случае величина q будет прямо пропорциональна объему затраченного титранта, а значит, содержанию определяемого компонента в пробе. Влияние мультипликативной систематической погрешности можно исключить, умножив результат измерения на некоторый заранее определенный поправочный коэффициент.
в) Влияние нелинейных погрешностей исключить гораздо труднее. Для этого заранее составляют таблицу поправок для разных значений измеряемой величины или находят эмпирическую формулу, связывающую q и 
Проверка правильности результатов анализа. Результат анализа считают правильным, если не удается выявить его значимую систематическую погрешность. Существуют три основных способа выявления систематических погрешностей:
· анализ стандартных образцов (с известным химическим составом);
· сравнение с результатами анализа, полученными по стандартной методике;
· способ «введено-найдено» (его иногда называют методом добавок).
Применение любого из них может привести к обнаружению (с некоторой заданной надежностью) систематической погрешности, либо к ее необнаружению. Строго говоря, необнаружение погрешности не доказывает ее отсутствия. Однако при отрицательном результате проверки, особенно при проведении ее несколькими разными независимыми способами, считают, что проверяемая методика дает правильные результаты анализа.
Первый способ проверки основан на применении стандартных образцов с известным химическим составом (см. следующий раздел). Это наиболее надежный способ. Чтобы проверить правильность некоторой методики, с ее помощью анализируют стандартный образец (СО), причем анализ повторяют несколько раз. Рассчитывают средний результат анализа и сопоставляют его с известным (аттестованным, «паспортным») содержанием соответствующего компонента в СО (m). Если 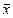
Результат анализа стандартного образца выражают в виде доверительного интервала (см. раздел 2.5). Если m попадает в границы доверительного интервала, рассчитанного для вероятности 0,95, считают, что систематическая погрешность не выявлена. Если же m не попадает в границы доверительного интервала, считают, что данная методика содержит значимую систематическую погрешность.
Второй способ проверки – сопоставление с результатами анализа, полученными с применением стандартной методики. Этот способ более доступен для аналитических лабораторий. Анализ исследуемого материала проводят параллельно по двум методикам – проверяемой и стандартной. Получают две выборки результатов анализа. Средний результат, полученный по стандартной методике, считают равным действительному содержанию компонента в материале (m). Данные, полученные с помощью проверяемой методики, используют для расчета доверительного интервала. Как и в предыдущем случае, считают, что проверяемая методика дает значимую систематическую погрешность, если m не попадает в границы доверительного интервала. Особую ценность для выявления систематических погрешностей имеют стандартные методики, в которых используется принципиально иной метод определения. Например, для проверки любой методики спектрального анализа используют стандартные методики гравиметрического или титриметрического анализа, которые гораздо точнее, чем спектральный анализ. К сожалению, для многих химико-аналитических задач не существует стандартных методик (аттестованных и официально утвержденных). Бывает и так, что стандартная методика существует, но требует уникального оборудования, и это делает ее недоступной для данной лаборатории.
Третий способ проверки – метод «введено-найдено» – применяют тогда, когда в распоряжении аналитика нет ни стандартных образцов, ни стандартных методик. Требуется только иметь определяемый компонент (Х) в виде чистого химического реактива. Проверку ведут, сопоставляя результаты анализа двух проб исследуемого материала, в одну из которых добавляют реактив, содержащий известное количество (Dm) определяемого компонента, в той же форме, что и в анализируемом объекте. В другую пробу ничего не добавляют. Надо правильно выбрать размер добавки: она должна приводить к достоверному (надежно фиксируемому), но не слишком сильному увеличению аналитического сигнала. Часто рекомендуют вводить такую добавку, чтобы масса Х в пробе увеличилась на 30–50 %. Затем проводят анализ обеих проб, находят массу Х в пробе с добавкой и в пробе без добавки, массу добавки находят по разности. Такие операции проводят несколько раз, результат анализа выражают в виде доверительного интервала. Если Dm не попадает в границы этого интервала, проверяемую методику считают непригодной, приводящей к неправильным результатам. Чтобы вывод был более обоснованным, анализируют не одну, а несколько проб с разными добавками.
Пример 2.3. Для проверкиправильностиопределения серы в нефти взяли две пробы одной и той же нефти, масса каждой пробы – 1000 мг. В одну из них до начала анализа добавили 10,0 мг серы. Анализ обеих проб вели по проверяемой методике, выполняя все операции одновременно и одинаковым образом. Результат анализа первой пробы (с добавкой) – 34,0 мг серы, второй – 24,1 мг. Таким образом, различие результатов анализа – 9,9 мг – оказалось почти равным массе серы во введенной добавке. Это свидетельствует о правильности анализа, хотя и не доказывает окончательно отсутствия систематической погрешности. Все зависит от того, в какой форме находилась сера в нефти и в добавке. Так, если в нефти сера содержалась в виде сульфидных органических соединений, а мы добавили серу в свободном виде или в виде сульфата натрия, может случиться, что добавленную серу определят правильно, а «исходную» – неправильно. Возможен и обратный случай.
Кроме трех вышеизложенных, существуют и другие способы проверки правильности результатов анализа. Это косвенные способы, пригодные лишь в некоторых случаях. Так, если полный анализ некоторой пробы дает суммарное содержание компонентов, большее 100 %, наличие систематической погрешности очевидно. Однако обратное умозаключение было бы неверным. Суммарное содержание всех компонентов может оказаться равным 100 %, но все или некоторые компоненты пробы при этом могут быть определены неправильно! Полезно также сопоставлять результаты анализа проб разной величины. Закономерное снижение или повышение результатов по мере перехода к меньшим навескам пробы или по мере уменьшения объема анализируемого раствора свидетельствует о наличии систематической погрешности (аддитивной). Обратное умозаключение неверно и в этом случае. Отсутствие связи результатов анализа с массой пробы возможно и тогда, когда результаты анализа ошибочны (например, при наличии мультипликативной погрешности).
Стандартные образцы и химические реактивы. Химический анализ, как и любая другая измерительная процедура, требует использования эталонов. Правда, в некоторых методах анализа эталоны химического состава не используют. Например, в методе кулонометрии содержание компонента часто рассчитывают по уравнению Фарадея, исходя из количества электричества, пошедшего на окисление или восстановление пробы. Такие методы называют абсолютными или безэталонными. Однако название условно: в соответствующих методах не используют эталоны состава, но применяют другие эталоны и меры (массы, силы тока, времени и т. п.). Нередко в таких методах применяют константы, установленные с применением чистых химических веществ (в кулонометрии – число Фарадея, в гравиметрии – молярные массы или эквиваленты и т. п.).
Эталонами химического состава служат стандартные образцы и химические реактивы.
Стандартный образец (СО) – это специально приготовленный материал, состав (элементный, молекулярный, реже изотопный) или свойства которого точно установлены и официально удостоверены.
В официальной аттестации каждого СО обычно участвуют несколько независимых лабораторий, которые определяют его состав разными методами. Затем результаты анализов усредняют, а действительное содержание компонента рассчитывают в виде доверительного интервала (см. раздел 2.5). Например, содержание железа в некотором СО железной руды выразили как (56,645 ± 0,003) %. В указанный интервал попали результаты всех лабораторий, аттестовавших этот стандартный образец.
Качество СО определяется однородностью и стабильностью его состава и свойств. СО может быть твердым веществом, жидким (в том числе раствором с известными концентрациями компонентов) или газообразным. Обычно СО готовят, измельчая природные вещества, либо смешивая чистые компоненты (так готовят растворы и газовые смеси), либо путем специального синтеза. Вся информация, необходимая для использования данного СО, в частности его химический состав, указывается в официальном документе – свидетельстве («паспорте»). В нем приводятся аттестованные содержания компонентов. Например, раствор нитрата кадмия с аттестованным значением концентрации ионов кадмия – 1,000 мг/дм 3 . Если СО предназначен для проверки правильности определения нескольких компонентов, то указывают содержание каждого из них. Так, для СО «Бронза оловянистая» в паспорте указывают содержания меди, олова, цинка, железа и других элементов. Обязательно приводится погрешность каждой оценки, она должна быть меньше, чем допустимая погрешность анализа, который будет проводиться или проверяться с применением этого СО. Так, если надо определять медь в бронзе с точностью до 0,1 %, то потребуется стандартный образец бронзы, где содержание меди известно с точностью до 0,01 или даже до 0,001 %.
Стандартные образцы бывают разного уровня. Наиболее надежны международные СО. Более распространенными являются национальные, в России это государственные стандартные образцы (ГСО). Выпускается свыше 3 000 видов ГСО, их производят в небольших количествах, отдельными партиями. Бывают и отраслевые СО (например, утвержденные Минздравом РФ для применения в клинических лабораториях), а также стандартные образцы, выпускаемые и используемые на одном предприятии. Чем больше лабораторий участвовало в аттестации СО, чем большее число методов было при этом использовано, чем больше повторных анализов проведено в каждой лаборатории, тем выше надежность данного СО.
Очевидно, стандартные образцы химического состава целесообразно создавать не для всех объектов анализа и не для всех определяемых компонентов. Незачем выпускать СО, если анализ не является массовым (скажем, выпускать СО лунного грунта явно нецелесообразно). В некоторых случаях СО в принципе нельзя изготовить и аттестовать – из-за нестабильности соответствующих объектов (например, для проверки методики определения фенолов в сточных водах, гемоглобина в крови и т. п.).
СО применяют для контроля правильности результатов количественного химического анализа, при создании и аттестации методик анализа, а также для градуировки приборов. Иногда СО используют и непосредственно при проведении анализов, как образцы сравнения, но так поступают редко: стандартные образцы слишком дороги.
Химические реактивы выпускаются в гораздо больших количествах, чем стандартные образцы. Эти реактивы аналитики используют в ходе каждого анализа, в частности, при пробоподготовке, при измерении сигнала (титранты, образцы сравнения), а также при проверке правильности анализа по методу «введено-найдено». Реактивы представляют собой материалы известного состава; но, в отличие от СО, это индивидуальные химические вещества – соли, кислоты, основания, свободные металлы и неметаллы, органические вещества и т. п. Другое отличие: в паспорте химического реактива указывается не точное содержание каждого компонента и погрешность этой оценки, а лишь максимально возможное содержание некоторых примесей.
Существует несколько квалификаций чистоты реактивов. В России это технические (техн.), чистые (ч.), чистые для анализа (ч.д.а.), химически чистые (х.ч.) и особо чистые (ос.ч.) реактивы. В приведенном ряду степень чистоты, а следовательно, и стоимость реактивов возрастают. При переходе к следующему классу допустимые содержания примесей снижаются в несколько раз, а иногда даже на несколько порядков. Суммарное содержание примесей также снижается: если у технических реактивов оно может составлять 10–15 %, то у реактивов х.ч. обычно не превышает 0,1 %. Квалификацию применяемых реактивов надо выбирать в соответствии с требуемой в том или ином случае точностью анализа. Использование недостаточно чистых реактивов приводит к систематическим погрешностям анализа, а «избыточная чистота» – к удорожанию анализа. Особо чистые реактивы предназначены для использования лишь в редких случаях.
Следует помнить, что каждый раз, когда откупоривается банка с реактивом, туда могут попадать нежелательные примеси (например, реактив может поглощать какие-то вещества из воздуха). Реальная степень чистоты реактива быстро снижается после начала его использования. Поэтому в лабораториях строго соблюдается комплекс мер предосторожности, направленных на сохранение чистоты реактивов и их растворов. Еще более тщательно оберегают чистоту стандартных образцов.
Дата добавления: 2015-10-01 ; просмотров: 3146 | Нарушение авторских прав
источник
В каких ситуациях нужна проверка анализа воды (тест проверки на честность)? Что нужно делать, чтобы максимально обезопасить себя от недостоверных результатов? Какие группы показателей водной среды обязательно должны проходить проверку при анализе. Разновидности анализов и их назначение. Ситуации, когда требуется проверка анализа воды, возникают редко. Но иногда нужно провести тест проверки на честность. В каких случаях это нужно делать и на что в анализах стоит обратить особое внимание, мы расскажем в нашей статье.
Если вы заказывали анализ жидкости в независимой лаборатории и заплатили за это деньги, то, скорее всего, он был проведён по всем правилам и проверке не подлежит, но есть ситуации, когда всё же может потребоваться проверка уже сделанных анализов воды. Проверка анализа воды может проводиться повторно в таких случаях:
- Если неправильно собрали пробу или хранили её до момента сдачи в лабораторию, то результаты анализов могут быть недостоверными. Например, при попадании на пробу прямых солнечных лучей в ней могут начать развиваться бактерии и микроорганизмы.
- Если у вас есть сомнения в надёжности лаборатории, проводившей анализы, то лучше их повторить. При этом анализ может получиться неправильным, если в месте, где он проводился, не соблюдаются нормативные требования к окружению или используется неисправное оборудование, а также просроченные реактивы.
- Проверять анализ на честность нужно и в том случае, если его проводила организация, заинтересованная в сокрытии достоверных данных. Например, завод, выбрасывающий неочищенные стоки в водоём, может скрывать или изменять правдивые результаты анализов.
- Также анализ нужно перепроверить в случае забора пробы воды в неподходящий период. Это связано с тем, что состав и концентрация тех или иных веществ в воде может постоянно меняться под действием внешних факторов. Иногда такие колебания могут наблюдаться даже в течение одних суток.
Сейчас существует множество независимых лабораторий, проводящих всевозможные анализы. Естественно лучше обращаться в те организации, которые прошли проверку и получили лицензию. Если вы сомневаетесь в законности какого-то аналитического центра, лучше обратиться в государственные контролирующие органы.
Иногда заказчик анализа сам может сделать многое для получения достоверных результатов. В итоге вам не придётся сомневаться в их правильности и делать повторную проверку. Учтите наши советы:
- Лучше всего забор и транспортировку пробы поручить самой лаборатории, где будет проводиться анализ. Они точно знают, в каких условиях нужно выполнять забор проб и как их хранить.
- Если же вы решили сделать забор пробы сами, то используйте для этого чистую стеклянную или пластиковую тару. После забора указанного количества воды плотно укупорьте бутылку. Запомните: нельзя использовать бутылки от сладких и алкогольных напитков. Перед забором пробы ополосните ёмкость этой же водой. Образец жидкости нужно привезти в лабораторию в течение двух часов. При этом нельзя транспортировать тару в слишком жарком месте или на солнце.
- При заборе жидкости из скважины сначала нужно слить часть воды. Её объём зависит от глубины скважины. На каждые 10 м глубины нужно слить 2-2,5 л воды. Только после этого можно брать пробу.
- Обращайтесь только в аккредитованные проверенные организации или государственные лаборатории. Так вы застрахуете себя от некачественной проверки.
- Если вы будете делать анализ воды из скважины, то отбирать пробы лучше ранней весной или поздней осенью, ведь именно в это время все проблемы наиболее заметны.
Перед тем как проверить анализ воды, удостоверьтесь, что он был проведён по всем группам исследуемых показателей, а именно:
- По группе химических компонентов. Сюда входит анализ состава и концентрации химических веществ, находящихся в жидкости до подачи в трубопроводы. При этом также учитываются остаточные содержания веществ после подготовительных мероприятий, а именно серебро, хлор, хлороформ.
- По группе органолептических показателей. Здесь должны быть описаны вкусовые качества воды, её цветность, описана степень мутности, а также запах жидкости.
- По токсикологическим показателям. В этой группе должна быть проведена проверка на токсичные вещества, которые могут причинить вред человеку. Здесь важно не только их наличие, но и концентрация, поскольку в небольшом допустимом объёме эти вещества не могут причинить вред человеку. В эту группу входят свинец, мышьяк, пестициды, алюминий, фенол.
- По группе микробиологических показателей. Здесь проверяется наличие в воде опасных микроорганизмов и бактерий.
- Также обязательно оцениваются общие показатели воды, а именно её жёсткость, кислотность. В общую группу входят такие вещества, как железо, марганец, нитраты, сульфиды, магний, калий, а также частицы нефтепродуктов.
Порой тест проверки воды может казаться неполным. Скорее всего, это связано не с неправильной проверкой, а с тем, что вы заказали не тот вид анализа, ведь существует несколько разновидностей анализа воды:
- Ускоренный анализ (экспресс-анализ). Такая проверка позволяет проанализировать базовые характеристики жидкости, а именно её органолептические, физические и химические показатели.
- Полный химический анализ позволяет выявить все компоненты воды и определить их концентрацию. Этот анализ нужен, если вы хотите иметь полную картину.
- Углублённый анализ по отдельным показателям, позволяет досконально изучить определённую группу характеристик. Такой вид проверки нужен в том случае, если у вас есть подозрения на присутствие определённых веществ в составе воды.
Если вы хотите проверить результаты ранее проведённого анализа воды, то можете обратиться в нашу лабораторию. Мы гарантируем достоверность всех результатов, поскольку используем только эффективное и исправное оборудование, с которым работают высококвалифицированные специалисты.
источник
Департамент образования Ивановской области
областное государственное бюджетное профессиональное образовательное учреждение
«Ивановский энергетический колледж»
высшей квалификационной категории
Смирнова Александра Юрьевна
Специальность: 13.02.01 Тепловые электрические станции
ПМ.02 Обслуживание турбинного оборудования на тепловых электрических станциях
Раздел ПМ.02.01. Применение турбинного, вспомогательного и водоподготовительного оборудования на тепловых электрических станциях
МДК 02.01. Техническое обслуживание турбинного оборудования на тепловых электрических станциях
Тема 2.3. Водоподготовительное оборудование тепловых электростанций
Тема урока: Проверка анализов воды
1. Показатели качества воды, используемые на ТЭС.
2. Нормы качества технологических сред на ТЭС.
3. Требования к анализам воды, используемым при проектировании ВПУ, взятых из разных источников.
4. Алгоритм проверки анализа воды.
ОК 4. Осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития.
ОК 5. Использовать информационно-коммуникационные технологии в профессиональной деятельности.
ПК 2.2 Обеспечивать водный режим электрической станции.
— контроля за водным режимом электрической станции;
— рассчитывать и выбирать основное оборудование водоподготовительных установок;
— показатели качества воды, используемые на тепловой электростанции (ТЭС);
Систематизация и закрепление знаний о показателях качества воды, используемых на тепловой электростанции (ТЭС).
Формирование умений по расчету и выбору основного оборудование водоподготовительных установок;
Совершенствование навыков по поиску и использование информации, необходимой для эффективного выполнения профессиональных задач.
ОК 2. Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их эффективность и качество.
ОК 3. Принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность.
Развитие и совершенствование:
умений по актуализации полученных ранее знаний и опыта;
внимания, памяти, наблюдательности, логического мышления (анализ, синтез, сравнение, установление причинно-следственных связей, выделение существенных признаков, умение правильно обобщать данные и делать выводы);
функций целеполагания, мотивации, самоорганизации, самокоррекции и взаимоконтроля;
умения обосновывать и аргументировать свои действия и решения;
умений применять полученные знания при выполнении нестандартных заданий.
ОК 1. Понимать сущность и социальную значимость своей будущей профессии, проявлять к ней устойчивый интерес.
ОК 6. Работать в коллективе и в команде, эффективно общаться с коллегами, руководством, потребителями.
ОК 7. Брать на себя ответственность за работу членов команды (подчиненных), за результат выполнения заданий.
Развитие творческой инициативы, самостоятельности, ответственности и организованности, коммуникативных умений
Тип урока: комбинированный
Вид урока: практическое занятие
Компьютер, мультимедийное оборудование, презентация, раздаточный материал, нормативно-техническая документация, представление информации на доске
Информационно-рецептивный (объяснение, инструктаж);
Репродуктивный ((воспроизведение понятий, выполнение расчетов, типовых действий);
Частично-поисковый (решение проблемных задач, самостоятельная работа с информацией).
1. Организационная часть урока
Приветствие. Контроль отсутствующих. Контроль готовности студентов к занятию.
Приветствие. Проверка и подготовка необходимого к занятию.
Положительный настрой на совместную работу.
2. Целеполагание и мотивация.
1. Что является рабочей средой на установках ТЭС?
2. Можно ли использовать природную воду на ТЭС без предварительной обработки? Почему?
3. Как определить качество воды, то есть ее пригодность для использования в теплоэнергетике?
4. Для чего еще нужен анализ воды?
5. Можно ли использовать данные анализа сразу?
Организует совместное целеполагание на основе репродуктивного и частично-поискового методов с использованием производственной ситуации.
Управляет познавательной деятельностью студентов с помощью наводящих вопросов, уточняет ответы студентов, помогает грамотно сформулировать тему урока
Воспринимают и анализируют информацию, высказывают суждения, осознают и принимают цели.
Совместное формулирование темы.
Осознают и озвучивают цели урока.
3. Актуализация опорных знаний и умений
1.Назовите виды примесей, которые присутствуют в природной воде? Используйте классификацию по степени дисперсности.
2. Объясните причины, почему нужно удалить из воды ГДП?
3. Какие примеси относятся к истинно-растворенным?
К каким эксплуатационным осложнениям они ведут?
4. По каким показателям мы можем судить о наличии в воде истинно-растворенных примесей?
7. Объясните почему отдельно выделяют такие показатели как щелочность и жесткость? В каких единицах они измеряются?
8. До каких значений показателей качества воды очищают воду? От чего это зависит?
Каким документом определяются нормы качества технологических сред?
Организует фронтальную работу на основе репродуктивного метода
Актуализируют полученные ранее знания и опыт, воспроизводят информацию, озвучивают свои варианты ответов, аргументируют, обосновывают выводы. Дополняют ответы друг друга.
Воспроизведение студентами знаний, умений и навыков, необходимых для «открытия» нового знания
4.1. Объяснение порядка проверки анализа. Выдача задания.
Задание студентам №1: произвести проверку правильности анализа по стандартной методике.
Организует работу студентов на основе информационно-рецептивного (объяснение, инструктаж) и репродуктивного (выполнение расчетов, типовых действий) методов, координирует работу, консультирует.
Выполняют предложенное задание. Изучают и осмысливают информацию, выполняют расчеты, используют справочные данные, высказывают суждения, делают выводы. Осуществляют самоконтроль.
компьютерная презентация, раздаточный материал, информационные источники
Правильное выполнение задания.
Умение проводить проверку анализов воды.
Умение работать с новой информацией и нормативно- технической документацией, самостоятельно находить ответы на поставленные вопросы.
ОК2, ОК3, ОК 4, ОК 5, ОК6, ПК 2.2
4.2. Задание студентам №2: используя исходные данные, предлагаемый тип котельного оборудования и ПТЭ определить величину снижения жесткости питательной воды. Сделать выводы.
Организует работу в микрогруппах на основе частично-поискового метода (решение проблемных задач, работа с информацией).
Организует работу по представлению и защите проблемной задачи с привлечением одного представителя микрогруппы.
Выполняют предложенное задание. Изучают и осмысливают информацию, выполняют расчеты, используют справочные данные, высказывают суждения, делают выводы.
информационные источники, презентация,
Правильное выполнение задания.
Умение применять полученные знания при выполнении нестандартных заданий.
Правильное выполнение задания.
ОК 2 ОК 4, ОК 6, ОК 7, ПК 2.2
5. Подведение итогов занятия и оценка его результативности (рефлексия)
1. Задание на проверку полученных знаний и умений. Задание студентам №3.
2. Какие цели стояли перед нами?
3. Справились ли вы с ними?
4. Как вы оцениваете результаты своей работы?
4. Какие встречались трудности?
5. Какое значения имеют приобретенные знания и умения для Вашей профессиональной деятельности?
Организует фронтальную работу по обсуждению итогов урока, его результативность.
Привлекает студентов к оценке работы, предлагает им выделить то, что вызвало затруднения, высказать пожелания.
Оценивает работу обучающихся на уроке.
Выполняют предложенное задание. Осуществляют рефлексию процесса и результата.
Оценка собственной работы исходя из ранее поставленных целей.
6. Информация о домашнем задании, инструктаж по его выполнению
Сообщает домашнее задание проводит инструктаж по его выполнению
Записывают домашнее задание и его осмысливают.
Завершение оформления отчета. Повторение пройденного.
По исходным данным таблицы 1 произвести проверку правильности результатов анализа исходной воды. По результатам расчета сделать вывод о правильности анализа и заполнить таблицу 2.
Т а б л и ц а 1. Исходные данные
Таблица 2. Химический анализ исходной воды и его проверка
По исходным данным таблицы 1 произвести проверку правильности результатов анализа исходной воды. По результатам расчета сделать вывод о правильности анализа и заполнить таблицу 2.
Т а б л и ц а 1. Исходные данные
Таблица 2. Химический анализ исходной воды и его проверка
Проверка правильности анализа исходной воды проводится следующим образом:
1. Сумма концентраций всех катионов 

Рассчитывается сумма концентраций катионов:

где Ca 2+ , Mg 2+ , Na + и т. д . – массовые концентрации соответствующих катионов, мг/дм 3
20,04; 12,16; 23,0 и т.д. – эквиваленты соответствующих катионов.
Рассчитывается сумма концентраций анионов:

где 


61,02; 48,08; 35,45; 62,01 и т. д. – эквиваленты соответствующих анионов.
Определяется погрешность анализа: 
Если 


В уравнении концентрации катионов и анионов выражены в мг-экв/ дм 3 .
Если корректировка не требуется, то концентрация ионов N а +

2 Аналитически определенная общая жесткость исходной воды Ж о должна равняться сумме концентраций катионов 


3 В большинстве природных вод концентрация бикарбонат-ионов преобладает над концентрациями анионов других слабых кислот, поэтому общая щелочность обычно численно совпадает с концентрацией бикарбонатов, выраженной в мг-экв/дм 3 .
Определяется концентрация бикарбонат-иона в исходной воде:

По соотношению между общей жесткостью воды Ж о и концентрацией в ней бикарбонат-ионов 
при Ж о > Щ о (нещелочные воды) 

при Ж оо (щелочные воды) 


где Щ о – щелочность исходной воды, мг-экв/дм 3 ;
Ж о , Ж к , Ж нк – соответственно жесткость общая, карбонатная и некарбонатная, мг-экв/дм 3 .
Необходимо, пользуясь вышеприведенными в пункте уравнениями:
– определить, к какой группе относится исходная вода;
– сравнить полученную расчетом концентрацию бикарбонат-ионов 
4 По результатам расчета сделать вывод о правильности анализа.
Общая жесткость природной воды Жо = 5 мг-экв/дм 3 .
Во сколько раз нужно уменьшить жесткость воды для питания котла с естественной циркуляцией с номинальным давлением за котлом 3,9 МПа?
Как связано давление котла с требованиями к жесткости питательной воды?
Общая жесткость природной воды Жо = 5 мг-экв/дм 3 .
Во сколько раз нужно уменьшить жесткость воды для питания котла с естественной циркуляцией с номинальным давлением за котлом 13,8 МПа?
Почему чем выше давление в котле, тем меньше должна быть жесткость питательной воды?
Общая жесткость природной воды Жо = 5 мг-экв/дм 3 .
Во сколько раз нужно уменьшить жесткость воды для питания прямоточного котла на давление пара 13,8 МПа?
Почему требования к питательной воде прямоточных котлов жестче, чем для котлов с естественной циркуляцией с тем же давлением?
источник


