ПЦР в реальном времени (Real-Time PCR) — В настоящее время на смену визуальной оценке результатов ПЦР методом электрофореза уверенно приходят флуоресцентные методы детекции продуктов амплификации. Получать и интерпретировать результаты ПЦР становится проще, быстрее и надежнее.
Одним из флуоресцентных методов является метод ПЦР в режиме реального времени. В его основе лежит принцип флуоресцентной детекции продуктов ПЦР непосредственно в ходе амплификации. Детекция продуктов амплификации проводится прямо в реакционной среде через стенки или крышку закрытой пробирки.
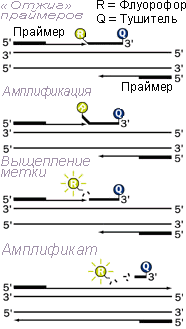
1. В состав реакционной смеси наряду с праймерами и остальными компонентами реакции добавлены специальные флуоресцентные метки (зонды). Флуоресцентный зонд представляет собой олигонуклеотид, комплементарный внутренней последовательности амплифицируемого фрагмента ДНК возбудителя. На 3’-конце зонда находится флуоресцентная молекула – флуорофор, а на 5’-конце расположена молекула-“гаситель” флуоресценции. За счет близости флуорофора и “гасителя” вся энергия, поглощенная флуорофором, переходит на “гаситель” по принципу флуоресцентно-резонансного переноса энергии. При этом сигнал флуоресценции отсутствует.
2. В ходе ПЦР при повышении температуры происходит денатурация ДНК возбудителя, и зонд наряду с праймерами гибридизуется с комплементарным участком ДНК.
3. В процессе синтеза новой цепи ДНК, фермент ДНК-полимераза расщепляет этот зонд. При расщеплении зонда флуорофор отделяется от “гасителя”, расстояние между ними увеличивается, процесс тушения флуоресценции становится невозможным. В этот момент можно зарегистрировать флуоресцентный сигнал от флуорофора.
В результате такого принципа неспецифическая амплификация не обнаруживается.
ПЦР “в реальном времени” имеет ряд значительных преимуществ:
- Объединение этапов амплификации и детекции результатов. Появляется возможность оценить кинетику процесса, которая зависит от начального количества исследуемого материала
- Существенное снижение риска контаминации и ошибок при анализе результатов
- Высокая специфичность реакции за счет использования высокоспецифичных флуоресцентных зондов.
- Высокая производительность
- Упрощение требований к организации ПЦР-лаборатории
- Возможность количественной оценки исходной ДНК матрицы
- Регистрация и учет данных в электронном формате
ПЦР “в реальном времени” характеризуется возможностью проведения качественного и количественного анализа. Регистрируемое в процессе амплификации нарастание сигнала от отделенного флуорофора прямо пропорционально увеличению концентрации синтезированных специфических продуктов и отражает концентрацию ДНК в исходной матрице.
Для проведения анализа необходим специальный прибор — амплификатор для ПЦР в реальном времени, который совмещает в себе функции термоциклера и флуоресцентного детектора (iCycler iQ5, CFX96 (Bio-Rad); ДТ-322, ДТ-96 (ДНК-Технология); Rotor-Gene 3000, Rotor-Gene 6000, Rotor-Gene Q ( Corbett Research/Qiagen); Cobas TagMan48 (Roche)и др.
Программное обеспечение таких приборов позволяет сопоставлять кинетику реакции в исследуемых и стандартных образцах и вычислять концентрацию исходной матрицы ДНК (в присутствии стандартных образцов с известной концентрацией анализируемой ДНК). При выявлении ДНК возбудителей инфекционных заболеваний целесообразно использовать данный метод в количественной оценке только тех инфекционных агентов, количественное содержание которых в анализируемом образце действительно имеет клиническую значимость. Определение количественных характеристик инфекции позволяет судить о динамике и стадии заболевания, а также об эффективности проводимой терапии.
источник
Екимов А.Н., Шипулин Г.А., Бочкарев Е.Г. Рюмин Д.В.
Принципиальной особенностью полимеразной цепной реакции в реальном времени является возможность детекции накопления продуктов амплификации непосредственно во время проведения амплификации. Так как кинетика накопления ампликонов напрямую зависит от числа копий исследуемой матрицы, это позволяет проводить количественные измерения ДНК и РНК инфекционных агентов. Полученная информация может быть использована для проведения мониторинга эффективности проводимой терапии, оценки клинического прогноза. В отличие от других методов количественного определения ДНК матрицы в пробе, ПЦР в реальном времени не требует дополнительных манипуляций, связанных с раститровкой ДНК исследуемой пробы или полученных в ходе ПЦР ампликонов, которые усложняют постановку анализа и могут приводить к появлению ложноположительных результатов. Подобный подход позволяет отказаться от стадии электрофореза, что ведет к резкому уменьшению вероятности контаминации исследуемых проб продуктами амплификации, а также позволяет снизить требования, предъявляемые к ПЦР лаборатории.
Широкое внедрение в область практического здравоохранения полимеразной цепной реакции (ПЦР) обусловлено простотой ее выполнения, низкой себестоимостью и надежностью. Вместе с тем, сегодня уже очевидно, что дальнейшее развитие ПЦР получит в области количественного определения нуклеиновых кислот (ДНК и РНК) инфекционных агентов.
Количественное определение ДНК инфекционных агентов в ходе лечения позволяет получать информацию о правильности или безрезультатности проводимой терапии, помогает предсказывать периоды обострения заболевания и принимать адекватные меры для скорейшего излечения больного без нанесения ущерба для его здоровья, связанного с неэффективной терапией.
Существует большое количество способов получить данные о концентрации нуклеиновых кислот в пробе методом ПЦР, но все они требуют дополнительных трудоемких этапов работы, связанных с предварительной раститровкой выделенной из анализируемой пробы ДНК, или полученных в ходе ПЦР ампликонов, что приводит к увеличению времени, необходимого для постановки анализа и сложности интерпретации полученных результатов [2,5]. Также, наличие дополнительных этапов работы увеличивает вероятность ошибки и получения недостоверного результата.
На сегодня существует метод, лишенный вышеперечисленных недостатков — это метод ПЦР в реальном времени (Real-Time PCR) [4]. Сущность метода заключается в исследовании накопления продуктов амплификации с помощью специального прибора без последующего электрофореза. Так как кинетика накопления продуктов амплификации связана с исходным количеством матрицы, это дает возможность точно оценить её количество [3].
Отличительными чертами данного метода, в отличие от классической ПЦР, является возможность количественного определения ДНК/РНК инфекционных агентов в исследуемом материале, отсутствие стадии электрофореза, менее строгие требования к организации ПЦР-лаборатории и автоматическая регистрация и интерпретация полученных результатов.
Отсутствие стадии электрофореза позволяет минимизировать риск контаминации продуктами ПЦР и таким образом резко уменьшить число ложноположительных результатов. Поскольку регистрация результатов проводится непосредственно в процессе ПЦР, весь анализ можно проводить в одной-двух комнатах лаборатории и нет необходимости в отдельном помещении для детекции продуктов реакции.
Данная методика в течение последних пяти лет успешно применяется в крупнейших диагностических и научно-исследовательских центрах развитых стран мира и в ближайшее время станет так же широко распространена, как и ПЦР в ее сегодняшнем формате, благодаря экономии производственных площадей, уменьшению количества персонала и востребованности количественного определения ДНК/РНК.
Использование математических методов анализа позволяет проводить автоматическую интерпретацию полученных результатов и снимает проблему субъективной оценки электрофореграмм.
Для постановки ПЦР в реальном времени необходим специальный амплификатор, отличительной особенностью которого является возможность возбуждать и детектировать флуоресценцию, отражающую накопление ампликонов, на каждом цикле амплификации.
Детекция продуктов амплификации.
Для выявления продуктов амплификации в режиме реального времени используют следующие наиболее распространенные подходы:
1. Выщепление 5′ концевой метки (TaqMan Assay).
Данная методика основана на использовании 5′-экзонуклеазной активности полимеразы. В реакционную смесь добавляют ДНК-зонды, в состав которых входит флуоресцентная метка в 5′-положении и гаситель флуоресценции в 3′-положении, а также фосфатная группа в 3′-положении. Эти зонды имеют места посадки внутри амплифицируемой области. Гаситель поглощает испускаемое флуоресцентной меткой излучение, а фосфатная группа в 3′-положении блокирует полимеразу.
В ходе ПЦР во время стадии отжига праймеров происходит присоединение ДНК-зонда к комплементарной цепи ДНК, причем чем больше продуктов амплификации образуется в ходе ПЦР, тем больше молекул зондов свяжется с соответствующими ампликонами. Во время стадии элонгации полимераза синтезирует комплементарную цепь ДНК и при достижении зонда начинает его расщеплять благодаря наличию 5′-экзонуклеазной активности. Таким образом происходит разъединение флуоресцентной метки и гасителя, что приводит к увеличению детектируемого свечения [3]. Очевидно, что чем больше ампликонов было наработано в ходе ПЦР на данный момент времени, тем интенсивнее будет свечение.
2. Использование зондов с комплементарными концевыми последовательностями (molecular beacons).
Данная методика отличается от описанной выше тем, что концевые последовательности зонда представляют собой взаимно комплементарные области, поэтому при температуре отжига праймеров они схлопываются и образуют шпильки [6]. Внутренняя область зондов содержит нуклеотидную последовательность, комплементарную амплифицируемой области. При отжиге праймеров зонды, не присоединившиеся к ДНК матрице, остаются в «схлопнутом» состоянии, так что происходит тушение флуоресценции.
Те же зонды, которые отжигаются на матрицу, разворачиваются, и флуоресцентная метка и гаситель расходятся в разные стороны. Таким образом, увеличивается интенсивность свечения.
3. Применение 2-х зондов с резонансным переносом энергии (LightCycler assay).
Данный способ детекции накопления продуктов амплификации отличается повышенной специфичностью, так как увеличение флуоресценции происходит при комплементарном связывании с ампликонами сразу 2-х ДНК зондов [1]. Принцип метода заключается в переносе энергии от одного флуорофора, находящегося на 3` конце первого зонда, ко второму флуорофору, находящемуся на 5` конце второго зонда, причем расстояние между флуорофорами составляет 1-3 нуклеотида.
При одновременном связывании обоих зондов с ДНК матрицей испускаемое первым флуорофором излучение передается на второй флуорофор, а его излучение детектируется прибором. Таким образом, возрастает специфичность анализа.
4. Использование интеркалирующих агентов.
Этот способ детекции основан на том факте, что флуоресценция бромистого этидия и SYBR Green I значительно возрастает при их внедрении в двухцепочечные молекулы ДНК [4]. Таким образом, можно наблюдать за накоплением продуктов амплификации.
Очень важно отметить то, что увеличение флуоресценции может быть связано как с накоплением специфического продукта, так и неспецифического (праймеры-димеры, шмер). Для получения корректных результатов необходимо дополнительное изучение полученных ампликонов с помощью построения так называемых «кривых плавления» (melting curves).
Для этого после окончания ПЦР реакционную смесь нагревают и непрерывно измеряют флуоресценцию. По достижении температуры плавления продукта амплификации флуоресценция резко снижается.
Каждое резкое уменьшение флуоресценции на графике соответствует числу полосок, получаемых на электрофорезе, то есть числу разных типов ампликонов. Для облегчения работы с полученной информацией проводят дифференциальный анализ кривой плавления. Такой способ визуализации полученных данных гораздо удобнее для понимания и анализа.
Применение кривых плавления не ограничивается только детекцией продуктов амплификации с помощью бромистого этидия и SYBR Green I. При использовании кривых плавления в системах с ДНК-зондами (Taq-man assay, beacons) возможно различать точечные мутации, расположенные внутри областей связывания ДНК-матрицы и зонда. Наличие таких мутаций способно привести к изменению температуры плавления зонда и к изменениям в графике кривой плавления [1]. Использование кривых плавления не требует от оператора амплификатора никаких дополнительных манипуляций с пробирками, а интерпретация полученных данных автоматизирована и формализована.
Подводя итоги стоит отметить следующее: использование ДНК-зондов в том или ином варианте является наиболее предпочтительным в свете повышения специфичности анализа. Однако к недостаткам зондов относится высокая стоимость, что делает работу по подбору зондов, праймеров и условий амплификации дорогостоящей. Вместе с тем, использование интеркалирующих агентов является очень простым и дешевым. Отпадает необходимость подбора специальных праймеров, зондов, так как можно пользоваться уже используемыми праймерами, эффективность работы которых уже проверена. Эти обстоятельства делают применение интеркалирующих агентов весьма привлекательным.
В настоящее время создана научная и материально-техническая база для широкого внедрения в клиническую лабораторную диагностику новой генодиагностической технологии — количественного определения ДНК/РНК инфекционных агентов — ПЦР в реальном времени (Real-Time PCR). В ближайшие годы данная технология будет применяться в гепатологии (вирусные гепатиты В и С), в клинике ВИЧ и ВИЧ-ассоциированных инфекций (в первую очередь герпетическая и цитомегаловирусная инфекции), в дерматовенерологии, фтизиатрии, гастроэнтерологии, пульмонологии. С помощью ПЦР в реальном времени будет оцениваться эффективность проводимой терапии и клинический прогноз заболевания.
источник
Сегодня ДНК-анализы активно используются с целью диагностирования инфекций и могут выявить даже единичных возбудителей. Самый известный способ исследования ДНК — полимеразная цепная реакция. Сегодня в медицинской практике активно внедряется новый метод — ПЦР в реальном времени. Суть его заключается в наблюдении и численной оценке накапливания продуктов полимеразной цепной реакции при автоматической фиксации и расшифровке результатов.
Применение этого метода анализа исключает стадию электрофореза. Это дает возможность предотвратить ложноположительные результаты и существенно сократить время для получения результата. ПЦР в реальном времени дает возможность исследовать материал за 20-60 минут и обнаружить даже одну молекулу дезоксирибонуклеиновой кислоты в пробе.
Полимеразный метод цепной реакции создал Кэри Мюллис в 1983 г. За свое изобретение, ставшее одним из самых выдающихся в конце 20 века в сфере молекулярной биологии, он удостоился Нобелевской премии по химии (1993).
Принцип анализа методом ПЦР real time базируется на выявлении в биоматериале малой части ДНК провокатора подозреваемой инфекции. Дезоксирибонуклеиновая кислота состоит из множества оснований, поэтому для распознавания заболевания хватит минимального фрагмента молекулы. В период проведения ПЦР-анализа выискивается такой элемент ДНК, который характерен только для конкретного возбудителя инфекции.
Полимеразная цепная реакция непосредственно применяется с целью, чтобы обнаруженный фрагмент расплодить. К концу исследования фрагментов должно накопиться не меньше 1012.
Преимущества ПЦР в реальном времени:
- высокая достоверность анализа;
- определение численности фрагментов ДНК в материале;
- минимальный риск получения ошибочного результата при диагностике;
- короткий срок осуществления ПЦР анализа;
- возможность обнаружения нескольких возбудителей одновременно;
- фиксация процедуры и результатов в электронном виде.
В реальном времени ПЦР используется в медицинской практике для определения вирусной, бактериальной нагрузки (количества агентов), для установления числа внутриклеточных возбудителей инфекций, для анализа результативности лечения, для выявления устойчивости к лекарственным препаратам.
Заболевания, которые можно выявить с помощью ПЦР:
- ВИЧ-инфекция;
- инфекции, которые передаются половым путем;
- вирусные гепатиты;
- папилломавирус человека;
- мононуклеоз;
- цитомегаловирусная инфекция;
- герпес;
- туберкулез;
- клещевой энцефалит;
- кандидоз;
- хеликобактерная инфекция.
Противопоказаний для данного исследования нет — все могут проводить ПЦР. Для изучения берут биоматериал человека:
- соскоб клеток эпителия (из уретры у мужчин, из половых путей у женщин);
- кровь и ее компоненты;
- жидкости (плевры, суставов и др.);
- слизь;
- слюна;
- моча;
- мазок спермы у мужчин.
Материал помещают в амплификатор — прибор для ПЦР реал тайм.
Точность результатов, которые дает ПЦР диагностика, в большей степени зависит от соблюдения человеком рекомендаций по подготовке к анализу. Перед исследованием нужно придерживаться таких рекомендаций:
- За 10 дней до проб нужно прервать прием антибактериальных препаратов и терапевтические процедуры (если это не противоречит рекомендациям врача). Мужчинам не желательно мочиться за 4-5 часов до осуществления процедуры ПЦР в реальном виде.
- Полимеразная цепная реакция у женщин проводится до месячных или спустя 1-4 дня после их окончания.
- Перед забором крови нельзя есть и пить.
- Моча собирается утром в стерильную емкость.
Непосредственно перед сдачей анализа:
- Не проводить туалет половых органов с помощью антибактериальных средств.
- Не мочиться минимум за 3 часа до ПЦР анализа.
- Исключить спринцевание женщинам, не применять вагинальные свечи.
- Положительный исход диагностики зависит также от чистоты материала — очень важно исключить его контаминацию, которая ставит под сомнение достоверность результата.
- Рекомендуется приходить на обследование в период обострения заболевания. Если был незащищенный половой акт, должно пройти минимум 3 недели, прежде чем может проводиться диагностика.
Существуют определенные стандартные правила сбора биологического материала. Образцы материала берут в процедурном кабинете с помощью специального стерильного одноразового инструмента. После этого образцы помещаются в стерильные пробирки, которые перед этим обрабатываются хромовой смесью и подвергаются воздействию высокой температуры.
Венозная кровь собирается на голодный желудок. Перед исследованием необходимо исключить употребление жирной и аллергенной пищи. Для сбора мочи необходимо помыть половые органы чистой водой, собрать мочу в стерильную емкость и отнести в лабораторию. Если берется мазок из влагалища, врач использует специальный инструмент, когда пациентка располагается на гинекологическом кресле. Соскоб у мужчин берут из внешней части уретры. Когда материал взят, пробу направляют на исследование.
Итоговый результат будет готов через сутки после сбора биоматериала. Иногда полимеразная цепная реакция может дать результат через час. Если в исходном материале не выявлено следов молекул возбудителей инфекций, то считается, что анализ ПЦР отрицательный.
Если выявлены следы инфекции в диагностируемом биоматериале, то результат положительный. Он свидетельствует о присутствии возбудителя в момент времени, когда сдавалась проба. Бывает, что полимеразная цепная реакция дает положительный результат, но нет видимых симптомов заболевания, то есть человек является носителем инфекции без демонстрации клинических признаков. В этом случае лечение не требуется, но необходимо постоянное наблюдение специалиста.
Инфекция от носителя может передаваться здоровому человеку. Также болезнь может переходить в хроническую форму. Если анализ дает положительный результат в крови, то это подтверждает факт, что человек уже не является носителем, и требуется лечение. Для каждого конкретного носителя инфекции количественный результат ПЦР может оценить врач индивидуально.
Расшифровка анализа дает возможность определить меру активности заболевания и его стадию. Этот фактор влияет на дозу назначенных препаратов, на курс лечения.
Полимеразная цепная реакция в реальном времени практически не дает ложноположительного результата, когда при отсутствии инфекции диагностика дает положительную пробу. Ложный результат ПЦР отрицательный прослеживается редко. Обычно это связано с тем, что в данный момент отсутствует активность инфекции.
На сегодняшний день полимеразная цепная реакция в реальном времени — одно из самых безошибочных исследований. Но при подозрении на любое заболевание не обязательно прибегать только к этому виду исследования. Есть определенная группа инфекций, для которых предпочтительны другие методы. Для каждого конкретного случая следует проконсультироваться со специалистом.
источник
Полимеразно-цепная реакция (ПЦР) – это одно из самых ярких достижений в сфере молекулярной биологии. Метод получил широчайшее распространение в разных областях науки. Благодаря очень высокой специфичности и чувствительности, метод ПЦР применяется в медицине, биологии, ветеринарии, криминалистике, санитарной службе и других отраслях деятельности человека.
Для анализа методом ПЦР можно использовать любые биологические материалы, которые содержат нуклеиновые кислоты (молекулу ДНК или РНК).
У каждого живого существа, по крайней мере, на нашей планете, есть уникальный «отпечаток» — ДНК (дезоксирибонуклеиновая кислота), которая отвечает за передачу наследственных факторов от предков к потомкам. Структурно эта молекула представляет собой две нити из молекул-азотитых оснований, удерживаемые рядом друг с другом химическими связями и скрученные в спираль (считается, что для компактности). Из курса биологии вы можете помнить такие названия, как аденин (А), гуанин (Г), тимидин (Т) и цитозин (ц). Это 4 нуклеотида, которые и создают последовательность ДНК. Вирусы хранят свою генетическую информацию в другой нуклеиновой кислоте – РНК.
Информация об уже изученных ДНК и РНК хранится в научных базах лабораторий. После того, как был изобретен метод ПЦР, для многих возбудителей различных заболеваний (бактерии, грибки и вирусы) были созданы свои специфические генетические детекторы (праймеры) — уникальные последовательности нуклеотидов, характерных только для конкретного возбудителя. И если поместить их в пробирку с исследуемым материалом, при наличии в нем ДНК или РНК «живых» возбудителей, праймеры запускают реакцию репликации – создания огромного числа копий, которое можно идентифицировать визуально. Т.е. они начинают копировать свою ДНК/РНК десятки раз.
И при подсчете результатов сотрудники лаборатории могут понять, есть ли искомые бактерии и вирусы в исследуемом образце, или нет, именно поэтому результаты ПЦР чаще всего качественные, т.е. «обнаружено» или «не обнаружено».
Со слов американского биохимика Керри Мюллиса (Kary Mullis), идея идентифицировать живые организмы по короткому участку их генетического кода (ДНК) пришла ему в голову в 1983 году, по пути с работы домой. А в основе этой идеи, лежала работа другого американского биохимика, Артура Корнберга (Arthur Kornberg), которая в свое время не нашла отклика у научного сообщества.
Керри допустил возможность того, чтобы взять молекулу ДНК какого-либо организма, с помощью высокой температуры «распустить» ее спираль на две нити, специфическими маркерами-праймеры пометить уникальные для этого микроорганизма участки ДНК и затем, применив фермент ДНК-полимеразу, создать из двух нитей две новые молекулы ДНК. Но уже содержащие в себе меченные праймеры. И потом останется просто искать эти участки в диагностическом материале.
В итоге, корпорация CETUS, в которой работал Мюлис, выделила ему команду ученых. И в 1985 году, в издании Американского общества генетики человека, появилась публикация с теоретическим обоснованием ПЦР, как метода идентификации генетического материала живых организмов.
Сначала пробу биологического материала подготавливают: центрифугируют, осаждают и т.д. Затем лаборантам необходимо выделить ДНК из полученного биологического концентрата.
Амплификация (увеличение числа копий ДНК)
Важнейший этап исследования. Проводится в термоциклере и именно здесь проходят все процессы, подпадающие под определение полимеразно-цепная реакция: денатурация, отжиг, элонгация.
Денатурация
Самый первый этап – развернуть (денатурировать) нуклеиновые кислоты, чтоб сделать их доступными для дальнейшей работы. Осуществляется путем нагрева реакционной смеси до 80-90 °C.
Отжиг
Денатурированные (распущенные) ДНК/РНК обрабатывают праймерами — изготовленными в лабораторных условиях коротенькими цепочками нуклеиновых кислот. Благодаря запрограммированному участку, праймеры прикрепляются только к тем нуклеиновым кислотам, для которых были созданы. Например, праймер для вируса простого герпеса 1 типа, никогда не свяжется с ДНК другого вируса, микроорганизма или клетки.
Именно праймеры обусловливают крайне высокую специфичность ПЦР – способность реагировать только на нуклеиновые молекулы конкретных типов, видов классов и даже штаммов микроорганизмов. Или отдельные виды клеток живых организмов.
Или синтез. После завершения процесса отжига, в реакционной смеси создают условия для активности полимеразы. Фермент, ориентируясь на молекулы праймеров (а не исходных нуклеиновых кислот), начинает синтез новых ниток ДНК/РНК. Которые становятся копиями исходных, искомых молекул нуклеиновых кислот.
Такой температурный цикл проводится 30 и более раз. В результате, даже при изначально небольшом количестве искомого генетического материала, в реакционной смеси накапливается значительное число «помеченных» праймерами нуклеиновых кислот (растет экспоненциально, с удвоением при каждом цикле).Обнаружить большие количества ДНК/РНК намного проще, за счет чего реализуется еще одно преимущество ПЦР – высочайшая чувствительность.
Оценка результатов ПЦР проводится несколькими путями:
1. Электрофорез в вязкой среде. Суть в том, что ДНК/РНК заряжены электрически и движутся к одному из электродов. В среду (агар или полиакридный гель) добавляют краситель ДНК (например – бромистый этидий). В процессе сеанса электрофореза, молекулы нуклеиновых кислот движутся и формируют скопления, подкрашенные этидием. Под ультрафиолетом, это выглядит в виде полосок разной толщины и яркости.
2. Метод гибридизации. Используются праймеры, заранее помеченные люминофором (флуорофором). После нужного числа температурных циклов, применяют специальный прибор – детектор флюоресценции. За счет того, что в образец можно добавлять флуорофоры для разных мишеней (они будут и светиться под ультрафиолетом разным цветом), метод гибридизации подходит для диагностики сразу нескольких мишеней в одном образце.
3. ПЦР диагностика в реальном времени (real-time PCR). Отличается тем, что детекция проводится прямо в процессе амплификации. Для этого нужны зонды-люминофоры (из предыдущего пункта) и специальные приборы ДНК-амплификаторы. Эти устройства оценивают нарастание яркости люминофора после каждого температурного цикла и впоследствии, вычисляют исходное число искомых нуклеиновых кислот в образце.
Электрофорез и гибридизация подходят только для качественной оценки, то есть дают ответ на вопрос, есть ли в образце искомый материал. ПЦР в реальном времени – единственный доступный метод количественной оценки.
Если мишеней для праймеров в образце не окажется, то температурные циклы пройдут в холостую и при детекции будет получен отрицательный результат.
Всего разработано более 10 разных методик амплификации, применяемых лабораториями в зависимости от исходных условий и поставленных целей.
Общим для них есть высокая чувствительность (для положительного результата достаточно 40 (!) или менее искомых копий ДНК в 1 мл образца, то есть вероятность ложноотрицательного ответа ничтожно мала. И очень высокая специфичность: вероятность ложноположительного ответа составляет менее 1%.
Но точность результатов сильно зависит от качества сбора диагностического материала, тщательного соблюдения всех технических требований к каждому этапу и качеству оборудования, расходных материалов (буфера, праймеров, раствора для отмывки и т.д.).
В дерматовенерологии ПЦР используют для выявления венерических заболеваний: микоплазменной, хламидийной инфекций, сифилиса, генитального герпеса и др.
Инфекционисты активно используют ПЦР для диагностики туберкулеза, ВИЧ, вирусных гепатитов, герпеса, мононуклеоза, вируса Эпштейн-Барр и др.). А с помощью ПЦР в реальном времени, оценивая вирусную нагрузку, врачи могут составить мнение о динамике заболевания, отклике на лечение, что особенно актуально для пациентов с ВИЧ, принимающих терапию.
Также благодаря ПЦР врачи могут в течение нескольких дней с уверенностью идентифицировать коклюш и паракоклюш, выявить возбудителей эпидемии ОРВИ. Уточняются типы вируса гриппа, циркулирующие на определенной территории, на основании чего появляется возможность разработать эффективную вакцину для каждого сезона гриппа.
В течение суток или быстрее можно установить вид возбудителя кишечной инфекции, а значит – назначить адекватное лечение и обнаружить вероятный источник заражения.
Летом, ПЦР актуальна для диагностики заболеваний, передаваемых иксодовыми клещами: боррелиоза (болезни Лайма), клещевых энцефалитов.
Метод позволяет работать с любым биологическим материалом. Гемотрансмиссивные инфекции (сифилис, ВИЧ, гепатиты, боррелиоз) исследуются по пробе венозной крови или спинномозговой жидкости. Кожные болезни (герпес, грибки) – по соскобу с пораженного участка. Венерические и урологические – по образцу мочи, спермы, влагалищного отделяемого.
Так что в медицине, ПЦР применяется везде, где нужна высокая точность и быстрота получения результатов.
Лабораторные исследования, выполняющиеся методом ПЦР:
источник

Чтобы понять суть Real-time PCR, необходимо имеет представление о том, какие процессы проходят в пробирке во время «обычной» ПЦР.
ПЦР представляет собой реакцию амплификации молекул ДНК. Рассмотрим два случая, когда в исследовательской практике возникает необходимость амплифицировать (то есть увеличить во много раз) количество ДНК в образце. Например, для судмедэксперта важно размножить небольшое количество ДНК, которая была найдена на месте преступления. Либо исследователю нужно сравнить два образца и узнать, в каком из них больше ДНК. Для такого рода анализа необходимо, чтобы в образце было достаточно ДНК для ее детекции. Если ДНК слишком мало, в сравниваемых образцах проводят ПЦР при одних и тех же условиях, и по количеству амплифицированного продукта определяется, в каком из образцов было больше ДНК изначально.
Главным веществом, благодаря которому происходит ПЦР, является термостабильная ДНК-зависимая ДНК-полимераза. Этот фермент синтезирует цепочку ДНК из свободных нуклеотидов, содержащихся в реакционной смеси (dNTPs), по принципу комплементарности. Матрицами для создания новых цепочек являются исследуемые молекулы ДНК. Важный момент – ДНК-полимераза «работает» на одноцепочечной ДНК, при этом «точка старта» для нее может быть только на двухцепочечной ДНК.
Именно эта особенность данного фермента позволяет амплифицировать только те фрагменты ДНК, которые интересны исследователю, а не весь геном организма сразу. Для этого в реакционную смесь добавляют небольшие фрагменты ДНК (олигонуклеотиды), называемые праймерами (англ. primer, то есть «первичные»). Они присоединяются (отжигаются) на матричную молекулу ДНК вокруг исследуемого гена, запуская работу полимеразы в нужном направлении.
Контроль ПЦР обеспечивается благодаря смене температуры образцов – за счет этого обеспечивается регуляция активности фермента и присоединения праймеров.
Для того, чтобы начать реакцию, температуру повышают до 95°C. При такой температуре двухцепочечная ДНК денатурирует до одноцепочечной.
Потом температуру понижают до
60°C. Это позволяет праймерам присоединиться вокруг исследуемого фрагмента.
Таким образом, у полимеразы появляется точка старта, от которой она может начинать синтез новой цепочки ДНК:
Оптимальная температура для работы ДНК-полимеразы составляет 72°C, поэтому на этом этапе цикла (он называется элонгацией) температура образца повышается до 72°C, для того, чтобы фермент работал с максимальной скоростью.
По окончанию цикла мы получаем в 2 раза больше ДНК, чем было в начале.
Такие температурные изменения повторяются по кругу в течение 40 «циклов». То есть, из одной копии ДНК получаются две, из двух – четыре, из четырех – восемь и так далее, пока их количество не будет исчисляться миллиардами.
После амплификации полученную ДНК можно разделить на агарозном геле и окрасить (визуализировать). Чем ярче будет полоса на геле, тем большее количество копий нужных нам генов получилось в результате реакции.
Точно такие же принципы лежат в основе ПЦР в реальном времени. Но вместо того, чтобы оценивать продукты амплификации на геле после проведения реакции, за этим процессом можно наблюдать «онлайн». Обеспечивается это тем, что образец, помещенный в амплификатор, на протяжении всего процесса находится под наблюдением специальной камеры, которая называется детектором.
Существует множество технологий мониторинга процесса ампификации, но суть у них одна: при синтезе каждой новой копии ДНК возникает флуоресцентный сигнал, который улавливается детектором. Чем интенсивней флуоресценция, тем больше продуктов амплификации находится в образце.
ПЦР в реальном времени имеет множество преимуществ перед обычной ПЦР:
- Во-первых, за реакцией возможно наблюдать с самого начала и сразу увидеть, в каких образцах реакция запустилась успешно, а в каких – нет.
- Можно очень точно рассчитать эффективность реакции.
- Нет необходимости проводить гель-электрофорез, так как все показатели реакции будут четко показаны на амплификационной кривой.
- Самым большим преимуществом является возможность проводить полноценно количественную оценку экспрессии генов. Обычная ПЦР является, в лучшем случае, полуколичественным методом анализа.
Приступая к планированию ПЦР-анализа, важно определить систему визуализации продуктов реакции. В общем случае, существуют две системы: интеркалирующие красители (напр. SYBR® Green) и растворы, основанные на линейно разрушаемых зондах (напр. TaqMan®). В основе обоих систем состоит принцип генерирования флуоресцентных сигналов при синтезе новых копий ДНК и детекции этих сигналов прибором в режиме реального времени.
SYBR® Green (или любой другой интеркалирующий краситель)
SYBR® Green является наиболее используемым интеркалирующим красителем в современной практике. Кроме него существует множество других красителей подобного класса, но наверняка вы слышали именно о SYBR® Green. Принцип действия у них один: сам краситель имеет собственный флуоресцентный фон, но связываясь с двухцепочечной ДНК, он встраивается между ее цепочками. Это приводит к изменению конфигурации молекулы красителя, заставляя ее флуоресцировать горазда сильнее. Все просто – чем больше ДНК образуется в процессе ПЦР, тем сильнее происходит флуоресценция в образце.
ДНК-зонды представляют собой меченые флуоресцентными красителями олигонуклеотиды (короткие фрагменты ДНК). Их нуклеотидная последовательность такова, что они гибридизируются на матричной молекуле ДНК рядом с праймером и дают флуоресцентный сигнал. 5’-конец зонда мечен репортерным флуоресцентным красителем. Чаще всего используется зеленый краситель FAM, но также могут использоваться VIC, ROX, CY5 и другие, которые флуоресцируют на другой длине волны, благодаря чему возможно проводить одновременный анализ по разным каналам детектора. На 3’-конце зонда располагается молекула гасителя – она обеспечивает подавление флуоресценции метки. Таким образом, когда репортерный краситель и его гаситель находятся на физически близком расстоянии друг от друга, общий уровень флуоресценции низкий.
В процессе ПЦР зонд прикрепляется к матричной молекуле ДНК сразу после праймера. Далее, зонд расщепляется полимеразой во время реакции. За счет этого молекула гасителя оказывается далеко от репортера, его флуоресценция возрастает, и так происходит на каждом цикле ПЦР.
Оценка стоимости является неотъемлемой частью планирования исследований. Использование линейно разрушаемых зондов обходится дороже, чем интеркалирующих красителей. То есть, если вас интересует большое количество генов, интеркалирующий краситель будет наилучшим выбором. Если же у вас есть небольшой набор генов и вам надо сосредоточится исключительно на них, следует использовать зонды.
Зонды: В общем случае, линейно разрушаемые зонды дают более точные результаты. Объясняется это их высокой специфичностью. Если вы получаете флуоресцентный сигнал от зонда, то можно быть уверенным, что он гибридизировался именно с целевым участком генома – гибридизация происходит исключительно в ограниченом праймерами пространстве. Благодаря этому нет необходимости проводить постамплификационных анализов для того, чтобы убедиться, что все прошло правильно.
Интеркалирующие красители: Слабым местом интеркалирующих красителей является то, что они неспецифичны. Если во время ПЦР поисходит амплификация не того участка ДНК, либо вовсе нескольких разных участков, вы все равно получаете кривую амплификации, которая идентична кривой при амплификации целевых генов. Интеркалирующие красители генерируют флуоресцентный сигнал при связывании с любой двухцепочечной ДНК, независимо от ее нуклеотидной последовательности. То есть, необходимо проводить дополнительные анализы, которые подтверждают наличие специфичных продуктов амплификации, например, оценку графика температуры плавления ампликонов. Подобные виды анализов требуют высокого уровня квалификации оператора, но только благодаря им можно рассчитывать на достоверность полученных данных.
Так как интеркалирующие красители обладают малой специфичностью, их эффективность при низкой концентрации ДНК в образце крайне мала. При таких условиях праймеры часто образуют между собой димеры или отжигаются на нецелевых участках ДНК. При этом образуется двухцепочечная ДНК и интрекалирующие красители все равно будут давать сигнал.
Можно взять за правило: если количество ДНК в ваших образцах малое (значение Cq>30), то использование интеркалирующих красителей будет сопряжено с трудностями и рекомендуется применять линейно разрушаемые зонды. Если ДНК много (значение Cq
источник
В настоящее время в практическое здравоохранение внедряется новая технология ПЦР — ПЦР в реальном времени (ПЦР-РВ, Real-Time PCR). Ее принципиальной особенностью является мониторинг и количественный анализ накопления продуктов полимеразной цепной реакции, а также автоматическая регистрация и интерпретация полученных результатов. Этот метод не требует стадии электрофореза, что позволяет снизить требования, предъявляемые к ПЦР лаборатории. Благодаря экономии производственных площадей, уменьшению количества персонала и востребованности количественного определения ДНК/РНК этот метод в последние годы успешно применяется в крупнейших санитарно-эпидемических, диагностических и научно-исследовательских центрах развитых стран мира, замещая ПЦР в ее сегодняшнем («классическом») формате.
Детекция продуктов амплификации возможна за счет увеличения флуоресценции интеркалирующего красителя при образовании комплекса с двуцепочечной ДНК. Самый популярный краситель на сегодняшний день — SYBR Green I. Это чувствительный флуоресцентный индикатор двухцепочечной ДНК. Максимум флуоресценции в комплексе с ДНК составляет 521 нм, максимум возбуждения — 497 нм (второй максимум около 254 нм). Хорошо возбуждается стандартным 488-нм лазером. Квантовый выход флуоресценции — около 0.8 (что в 5 раз превышает квантовый выход комплекса этидий-ДНК).
Реже применяются красители EVA Green, LCGreen, Cyto9. Низкая специфичность детекции результатов ПЦР-РВ при использовании интеркалирующих красителей обусловлена тем, что флуореценция раствора вызывается накоплением любой двуцепочечной ДНК в реакционной смеси, в том числе и неспецифической! Следовательно, остается вероятность регистрации ложноположительного результата.
Более высокой специфичности детекции результатов ПЦР в режиме реального времени можно достигнуть за счет наличия в реакционной смеси дополнительного олигонуклеотида — гибридизационного зонда. Такой зонд «отжигается» (комплементарно соединяется с ДНК) на участке ампликона меджу прямым и обратным праймером. На разных концах зонда расположены флуорофор и тушитель флуоресценции этого красителя. Когда флуорофор и тушитель связаны с олигонуклеотидным зондом, наблюдается лишь незначительная флуоресцентная эмиссия. Во время процесса амплификации за счет 5`-экзонуклеазной активности Taq-полимеразы флуоресцентная метка переходит в раствор, освобождаясь от соседства с тушителем и генерирует флуоресцентный сигнал, усиливающийся в реальном времени пропорционально накоплению амплификата.
источник
Исследование для выявления возбудителя урогенитального хламидиоза (Chlamydia trachomatis), в ходе которого с помощью метода полимеразной цепной реакции в реальном времени (РТ-ПЦР) определяется генетический материал (ДНК) хламидий в образце, полученном из урогенитального тракта.
Хламидия, возбудитель хламидиоза.
Синонимы английские
Ch. trachomatis, DNA (qPCR, Real-time PCR, RT-PCR), Chlamydia trachomatis by Amplified Detection.
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Мазок урогенитальный (с секретом предстательной железы), первую порцию утренней мочи, эякулят, ректальный мазок, мазок из десневого кармана, мазок с конъюнктивы.
Как правильно подготовиться к исследованию?
- Женщинам рекомендуется сдавать анализ до менструации или через 2 дня после её окончания.
- Мужчинам нельзя мочиться в течение 3 часов до взятия урогенитального мазка или мочи.
Общая информация об исследовании
Chlamydia trachomatis – бактерия, внутриклеточный паразит, возбудитель нескольких заболеваний человека. В частности, некоторые серовары этого вида вызывают трахому и венерическую лимфогранулёму. В России наиболее распространена хламидийная инфекция мочеполовой системы (урогенитальный хламидиоз). Она передаётся половым путем, а также от матери к ребёнку при родах. Возможен и контактно-бытовой путь передачи. Chlamydia trachomatis – самый частый возбудитель негонококкового уретрита. У женщин хламидиоз встречается чаще, чем у мужчин.
Инкубационный период составляет от 2 недель до 1 месяца. Часто (примерно в половине случаев) хламидиоз протекает бессимптомно.
Начальные симптомы инфекции: жжение и боль при мочеиспускании, слизистые выделения, помутнение мочи, слабость, немного повышенная температура, у мужчин – воспаление мочеиспускательного канала, которое длится долгое время, у женщин – слизистые или гнойные выделения из влагалища. В дальнейшем могут возникать различные осложнения: эпидидимит, эндометрит, конъюнктивит, артрит и др.
Считается, что хламидийная инфекция опасна при беременности, так как может привести к преждевременным родам, выкидышу, сниженному весу новорождённых и даже гибели плода.
Кроме того, новорождённый ребенок иногда заражается хламидиозом от матери при прохождении через родовой канал, из-за чего у него развивается конъюнктивит либо пневмония.
Для диагностики хламидиоза применяют серологические методы (например, ИФА), посев хламидий, а также выявление ДНК бактерий (например, ПЦР).
У серологических методов и посева есть ряд ограничений, так что тесты на основе ПЦР считаются самыми удобными и чувствительными.
ПЦР в реальном времени (РТ-ПЦР) – это лабораторный метод, который позволяет найти в пробе ДНК возбудителя: если в образце присутствует Chlamydia trachomatis, то реал-тайм ПЦР обнаружит ДНК этой бактерии. Принцип заключается в том, что ДНК возбудителя, которого хотят выявить, много раз копируется с помощью специальных ферментов (ДНК-полимераз). Обычно проходит несколько десятков циклов и в ходе каждого нужная ДНК удваивается. В результате количество исследуемой ДНК увеличивается в миллионы раз и её можно детектировать с помощью флуоресцентного красителя.
При ПЦР в реальном времени количество ДНК выявляется в процессе копирования, после каждого цикла. Но при этом с помощью РТ-ПЦР нельзя различить формы инфекции (например, свежеприобретённое или давнее заражение).
Наилучшим материалом для анализа считается утренняя моча (у мужчин) или мазок из влагалища.
Для чего используется исследование?
Для диагностики инфекции, вызванной Chlamydia trachomatis, и мониторинга ее лечения.
Когда назначается исследование?
- Для диагностики урогенитального хламидиоза при следующих симптамах:
- жжение и боль при мочеиспускании,
- покраснение в области наружного отверстия уретры у мужчин,
- слизистые выделения из половых путей,
- помутнение мочи,
- слабость,
- субфебрильная температура.
- Для исключения хламидиоза при планировании беременности (и во время неё).
- После случайных половых контактов.
- Если половой партнёр заражен хламидиями.
Референсные значения: отрицательно.
- Хламидийная инфекция отсутствует. Воспаление вызвано другим возбудителем.
- Хламидийная инфекция присутствует. Если есть воспаление, то оно, вероятно, вызвано хламидиями. В этом случае содержание ДНК в пробе высокое.
- Хламидии присутствуют, однако воспаление может быть вызвано другим возбудителем. В этом случае ДНК хламидий выявлена в небольшом количестве.
Кто назначает исследование?
Врач общей практики, терапевт, инфекционист, гинеколог.
- Goldman’s Cecil Medicine. 24 th ed. Goldman L, Schafer A.I., eds. Saunders Elsevier; 2011.
- Howie S. E. Chlamydia trachomatis infection during pregnancy: known unknowns. Discov Med. 2011; 12(62): 57 – 64.
Оставьте ваш E-mail и получайте новости, а также эксклюзивные предложения от лаборатории KDLmed
источник
В последнее время широкое распространение получили различные модификации метода полимеразной цепной реакции (ПЦР). Активно внедряется высокочувствительный и высокоспецифичный метод ПЦР «в реальном времени» (или количественная ПЦР, англ. Real-time PCR, qPCR), основанный на регистрации результатов ПЦР во время реакции. Метод ПЦР «в реальном времени» включает в себя одновременную детекцию и количественное определение (измерение непосредственно количества копий, либо измерение копий относительно внесенной ДНК или дополнительных калибровочных генов) специфической последовательности ДНК в образце.
Метод использует общие принципы ПЦР, его основным отличием является мониторинг и количественный анализ накопления продуктов полимеразной цепной реакции, автоматическая регистрация и интерпретация полученных результатов. Часто ПЦР «в реальном времени» комбинируют с ОТ-ПЦР (обратная транскрипция) для измерения малых количеств мРНК, что позволяет исследователю получать количественную информацию о содержании данной мРНК в клетке и, соответственно, позволяет судить об уровне экспрессии данного гена в отдельной клетке или ткани.
ПЦР «в реальном времени» использует флуоресцентно меченые олигонуклеотидные зонды для детекции ДНК в процессе ее амплификации. ПЦР «в реальном времени» позволяет провести полный анализ пробы в течение 20-60 мин и теоретически способен детектировать даже одну молекулу ДНК или РНК в пробе.
Для количественного определения используют два метода — флюоресцентные красители, интеркалирующие в двуцепочечные молекулы ДНК и модифицированные дезоксинуклеотиды, которые флюоресцируют после гибридизации с комплементарными участками ДНК.
Для проведения ПЦР «в реальном времени» используют детектирующие ПЦР–амплификаторы, способные регистрировать уровень флуоресценции внутри реакционной пробирки через прозрачную крышку или дно пробирки.
Принципы ПЦР в «реальном времени»
ПЦР «в реальном времени» — это семейство методик количественного ПЦР со следующими чертами:
1. Определение выхода продукта реакции после каждого цикла амплификации.
2. Построение по этим данным кинетической кривой ПЦР.
3. Определение относительной концентрации субстрата на основании анализа этой кривой.
4. Автоматическая регистрация и интерпретация полученных результатов.
Отсутствие стадии электрофореза позволяет минимизировать риск контаминации продуктами ПЦР, использование математических методов анализа позволяет проводить автоматическую интерпретацию полученных результатов и снимает проблему субъективной оценки электрофореграмм.
Для детекции ПЦР-продукта используются флуоресцентные красители, обеспечивающие флуоресценцию, прямо пропорциональную количеству ПЦР-продукта — репортерную флуоресценцию. Механизмы генерации репортерной флуоресценции различаются в зависимости от типа ПЦР «в реальном времени».
Кинетическая кривая ПЦР в координатах «Уровень репортерной флуоресценции — цикл амплификации» имеет сигмоидную форму (Рис. 5). В ней можно выделить три стадии:
1. Стадию инициации (когда ПЦР-продукты еще не детектируются флуоресцентной меткой).
2. Экспоненциальную стадию (в которой наблюдается экспоненциальная зависимость количества флуоресценции от цикла ПЦР).
Экспоненциальная стадия PCR описывается уравнением:
где Pn — количество молекул продукта/репортерной флуоресценции к циклу n, P — исходное количество молекул, содержащих амплифицируемый фрагмент (template), E — эффективность амплификации. В идеальных условиях E = 2, т.е. на каждом цикле цепной реакции происходит удвоение количества продукта.
Рис. 5. Кинетические кривые ПЦР «в реальном времени»
Прологарифмируем обе части уравнения 1 и преобразуем его к виду:
Назовем пороговым циклом (threshold cycle, C(T)) такой цикл n, на котором достигается некий заданный уровень репортерной флуоресценции — пороговая флуоресценция PC(T)=const. Для n=C(T) уравнение 2 принимает вид:
Т.е. значение С(T) прямо пропорционально логарифму количества субстрата. Таким образом, ПЦР «в реальном времени» позволяет сравнивать количества субстрата при условии, что эффективность реакции и заданный уровень пороговой флуоресценции одинаковы для каждой из сравниваемых реакций.
Различные типы ПЦР «в реальном времени»
Типы ПЦР «в реальном времени» различаются по способам генерации репортерной флуоресценции. Существует два основных способа визуализации накопления ДНК в ходе ПЦР. Оба способа основаны на использовании флуорофоров – молекул, обладающих способностью к флуоресценции (поглощению энергии света определенной длины волны и переизлучению ее на длине волны с меньшей энергией).
1. Применение интеркалирующих флуоресцентных агентов, флуоресценция которых значительно возрастает при связывании с двуцепочечной ДНК.
2. Использование меченых флуоресцентными агентами олигонуклеотидных проб, комплементарных участку ПЦР-продукта. В качестве интеркалирующего красителя наиболее часто используют SYBR Green. В технологиях TaqMan, Molecular Beacons и LightCycler используют меченые олигонуклеотидные пробы.
Дата добавления: 2017-02-28 ; просмотров: 1759 | Нарушение авторских прав
источник
Опубликовано 9 Май 2009 пользователем egorushkin
ДНК-диагностика- это один из наиболее современных высокотехнологичных методов исследования. ДНК-анализы широко применяются в диагностике инфекционных заболеваний, позволяя обнаруживать даже единичные микроорганизмы в организме человека.
ДНК-диагностика объединяет несколько методов исследования, самый распространенный из них — метод ПЦР (полимеразной цепной реакции).
Что такое ПЦР
ПЦР — (Polymerase chain reaction, PCR diagnostics) — расшифровывается как полимеразная цепная реакция.
ПЦР-диагностика — это метод лабораторной диагностики инфекционных заболеваний, в частности, этот метод широко применяется и для диагностики ИППП- инфекций, передающихся половым путем.
Анализ методом ПЦР основан на обнаружении в материале исследования небольшого фрагмента ДНК возбудителя той инфекции, которую подозревает врач. «Небольшой фрагмент ДНК» — это несколько сотен пар оснований ДНК – кирпичиков, расположенных в строго определенной последовательности, и потому образующих неповторимый узор. Для ПЦР-диагностики инфекций достаточно небольшого фрагмента, поскольку любая ДНК включает в себя не менее нескольких тысяч оснований.
При проведении ПЦР-анализа ведется поиск такого фрагмента ДНК инфекции, который специфичен только для данного микроорганизма. Это значит, что этот фрагмент ДНК «особенный» — он встречается только у этого микроба (или группы родственных микробов), но не встречается ни у одного другого микроба.
Сама полимеразная цепная реакция используется для того, чтобы найденный фрагмент размножить, клонировать: чтобы однозначно «увидеть» эти фрагменты ДНК, к окончанию реакции их должно быть не мене 10 12 штук.
История открытия ДНК и разработки метода ПЦР
Первоначально сам принцип метода полимеразной цепной реакции (ПЦР) был разработан Кэри Мюллисом в 1983г. Открытие ПЦР стало одним из наиболее выдающихся событий в области молекулярной биологии за последние 20 лет, и за разработку ПЦР-анализа Кэрри Мюллис уже в 1993 г. был удостоен Нобелевской премии в области химии.
Появлению метода проведения полимеразной цепной реакции предшествовали определенные достижения молекулярной генетики: к тому времени уже были расшифрованы нуклеотидной последовательности геномов ряда микроорганизмов и выделены специфические.
Также появлению ПЦР много способствовало открытие уникального фермента ДНК-полимеразы (или taq-полимеразы). Именно этот фермент катализирует и «контролирует» все процессы во время проведения анализа методом ПЦР. Особенность этого фермента — он термостабилен, исключительно термостоек: он выдерживает нагревание до температуры кипения без потери активности, а «любимый» его температурный режим во время работы — 72 о С. Многие реакции при проведении ПЦР идут почти исключительно при повышенной температуре.
С момента появления метода, ПЦР-исследования завоевывают все большую и большую популярность. В настоящее время в практическое здравоохранение внедрена новая технология ПЦР — ПЦР в реальном времени (Real-Time PCR). Ее принципиальной особенностью является мониторинг и количественный анализ накопления продуктов полимеразной цепной реакции и автоматическая регистрация и интерпретация полученных результатов. Этот метод не требует стадии электрофореза, что позволяет избежать ошибок и ложноположительных результатов, связанных с контаминацией и значительно ускорить получение результата. ПЦР в реальном времени использует флуоресцентно меченые олигонуклеотидные зонды для детекции ДНК в процессе ее амплификации. ПЦР в реальном времени позволяет провести полный анализ пробы в течение 20-60 мин и теоретически способен детектировать даже одну молекулу ДНК или РНК в пробе.
КДЛ «ОЛИМП» выполняет ПЦР-исследования на единственном в Казахстане 6-ти канальном анализаторе Rotor-Gene™ 6000 (Германия). Уникальными особенностями этого прибора является то, что он позволяет проводить одномоментную детекцию 5-ти различных возбудителей! Подобных возможностей пока нет у других лабораторий в Астане и ближайших регионах.
Материал для сдачи ПЦР-анализа
Материалом для проведения ПЦР-диагностики может служить:
- соскоб эпителиальных клеток (соскоб из уретры у мужчин и у женщин, соскоб из цервикального канала)
- кровь, плазма, сыворотка
- крови
- биологические
- жидкости (сок простаты, плевральная, спинномозговая, околоплодная, суставная жидкости, слюна)
- моча (используется первая порция утренней мочи)
- мокрота
- слизь
- и другие биологические выделения
Как правильно подготовиться к ПЦР-анализу (ДНК-диагностике)
Достоверность результатов лабораторной диагностики зависит не только от опыта и профессионализма врача-лаборанта, возможностей данной лаборатории, но и от того, соблюдал ли пациент рекомендации врача, насколько правильной была его подготовка к проведению анализа. На самом деле ничего сложного в правильной подготовке нет. При сдаче анализа методом ПЦР врачи рекомендуют соблюдать следующие правила:
- Для проведения ПЦР-исследований на инфекции, передаваемые половым путем, за месяц до взятия материала желательно воздержаться от приема антибиотиков и лечебных процедур (если иное не предписано Вашим лечащим врачом).
- У мужчин исследование проводят утром или в течение дня до мочеиспускания, рекомендуют не мочиться в течение 4-5 часов до взятия пробы.
- Женщины сдают соскоб на ПЦР-исследование до менструации или через 1-4 дня после ее окончания. Непосредственно перед сдачей соскоба необходимо воздержаться от половой жизни, а перед взятием материала из уретры — от мочеиспускания в течении 1-2 часов. Накануне обследования женщины не должны проводить спринцевание.
Где можно сдать анализы на ПЦР
Анализы на ПЦР Вы можете сдать в медицинских центрах, являющихся партнерами КДЛ «ОЛИМП»:
Медцентр «Шахар», пр.Абылай-хана, 6/2, тел.: 35-94-71;
Медцентр «ДаНель», ул.Ауэзова, 22, тел.: 39-16-75, 39-16-22;
По всем интересующим вопросам Вы также можете получить необходимую информацию у квалифицированного врача-консультанта по телефонам: 8 (7172) 444-111
источник
