Поставить точно диагноз «онкология» без проведения специальных исследований практически невозможно. В настоящее время медицина обладает такими возможностями. Поэтому если имеется подозрение на рак, то проводится иммуногистохимическое исследование. Рассмотрим, что собой представляет данный анализ, в каких случаях назначается и что позволяет выявить.
Под данным исследованием подразумевается изучение образца тканей под микроскопом. Их получают при помощи биопсии и предварительно обрабатывают специфическими антителами.
Онкологические заболевания давно находятся в поле зрения врачей и ученых. В ходе многочисленных исследований было установлено, что злокачественные клетки в процессе жизнедеятельности продуцируют специфические белки, которые называют антигенами. Они связываются с антителами, именно на этом основано иммуногистохимическое исследование, когда ткань пациента, взятая для изучения, после обработки тщательно изучается при помощи микроскопии.
Когда антитела взаимодействуют с раковыми клетками, то можно наблюдать явление флуоресценции. Это дает основания практически на 100 % быть уверенным, что имеет место онкология.
Сейчас уже разработаны и активно внедрены в медицинскую практику антитела практически ко всем новообразованиям.
Иммуногистохимическое исследование при раке позволяет:
- Распознать новообразование и определить его разновидность.
- Выяснить распространенность первичного очага по организму.
- При взятии биологического материала из вторичных очагов можно определить источник распространения метастазов.
- Исследование позволяет оценить эффективность терапии.
- При помощи анализа можно выяснить, на какой стадии развития находится раковая опухоль.
- Иммуногистохимическое исследование позволяет также выяснить скорость роста новообразований.
Данный метод исследования считается более информативным по сравнению с обычным гистологическим. Если использовать оба метода исследования, то можно получить полнейшую картину, поэтому на практике чаще всего врачи так и поступают.
Исследовать при помощи этого метода можно практически все ткани человеческого организма, но чаще всего такой анализ назначают при подозрении на онкологию.
- Для определения первичных новообразований.
- Для выявления метастазов.
- Данный анализ помогает определить прогноз развития и протекания патологии.
- Анализ служит одним из методов исследования рецепторов к ряду гормонов.
- ИГХ-исследование позволяет обнаружить микроорганизмы.
- Метод исследования применяют для выяснения чувствительности раковых клеток к химиотерапии и радиотерапии.
Иммуногистохимическое исследование проводится в несколько этапов, первым из них является сбор биологического материала. Его получают путем биопсии или изъятия материала во время проведения операции.
Кусочек ткани помещают в формалин и направляют в лабораторию, где его подвергают изменениям:
- Материал обезжиривают специальными составами и заливают парафином. В таком состоянии он может храниться практически вечно, поэтому при необходимости исследование можно повторять.
- На следующем этапе получают тончайшие срезы — проводят микротомирование. Их размещают на специальных стеклах.
- Приготовленные срезы обрабатывают растворами антител определенной концентрации. Использовать для обработки могут составы, содержащие разное количество антител. Какие из них вступят во взаимодействие с раковыми клетками, будет зависеть от разновидности опухоли.
Такой анализ просто незаменим, если есть подозрение на наличие раковых клеток в груди. Обязательно определение количества рецепторов эстрогена и прогестерона. При их повышении активизируется процесс роста злокачественных клеток.
ИГХ-исследование позволяет не только распознать онкологическое заболевание, но и определить его стадию. При помощи исследования врачи выясняют, показана ли гормональная терапия.
Опухоли, имеющие большую концентрацию гормонов, чаще всего вполне эффективно лечатся антигормональными препаратами.
Во время проведения анализа обязательно определяют показатель Ki-67, он помогает определить злокачественность процесса. Если иммуногистохимическое исследование молочной железы показывает Ki-67 до 15 %, то исход заболевания считается благоприятным. Если показатель доходит до 30 %, то без химиотерапии не обойтись, потому что опухоль растет довольно быстро. Отметка в 90 % чаще всего свидетельствует о неизбежности летального исхода.
Данный анализ назначается не только при подозрении на онкологию груди, но еще он оказывается довольно информативным, если:
- Имеется бесплодие.
- Обнаружены злокачественные образования матки.
- Наблюдаются патологические изменения в репродуктивной системе.
Такой анализ проводится, если:
- Часто наблюдаются выкидыши.
- У женщины было несколько неудачных попыток ЭКО.
- Диагностирована хроническая форма эндометрита.
Данное исследование помогает выяснить, имеются ли клетки, мешающие зачатию естественным путем.
ИГХ-исследование тканей эндометрия назначается женщинам, у которых уже было несколько неудачных попыток искусственного оплодотворения.
Взятие тканей эндометрия проводится в разные дни цикла, которые назначает врач.
Необходимо иметь в виду, что исследовать подготовленные образцы тканей имеет право только врач, имеющий сертификат, подтверждающий специальную подготовку по проведению анализов по методу ИГХ.
В заключении должно быть указано:
- Показатели антител, к которым определена тропность исследуемой ткани.
- Указывается разновидность раковых клеток и их количество.
- Указываются выявленные антигены, которые помогают установить вид онкологии.
По результатам исследования нельзя ставить окончательный диагноз. Врач-онколог имеет право это сделать только после получения интерпретации всех диагностических процедур.
Таким образом, можно сделать вывод, что эффективно иммуногистохимическое исследование при раке молочной или других желез и других видах онкологии. Анализ дает исчерпывающую информацию и позволяет распознать начинающийся патологический процесс на клеточном уровне.
источник
Гепатоцеллюлярная карцинома (ГЦК) входит в группу наиболее распространенных злокачественных опухолей с высокими показателями летальности. Самые высокие показатели заболеваемости отмечаются в странах Азии и Африки. В России на конец 2015 года на учете находилось 7360 пациентов, страдающих ГЦК, при этом летальность составила 43,6 % [1]. Единственным методом, позволяющим сделать объективное заключение, определяющее тактику лечения и прогноз заболевания, является гистологическое изучение биопсийного или операционного материала. Существенную, а в ряде случаев и ведущую, роль в диагностике и дифференциальной диагностике играют иммуногистохимические методы исследования [2].
Цель работы: анализ возможностей применения иммуногистохимических маркеров для диагностики и дифференциальной диагностики гепатоцеллюлярной карциномы.
Одним из первых маркеров, внедренных в практику иммуногистохимического ис-следования препаратов ткани печени, был альфа-фетопротеин. Последний представляет собой гликопротеин, который образуется в тканях (преимущественно в печени, кишечнике и желточном мешке) при развитии эмбриона и плода. В этой связи в нормальной ткани печени взрослого человека альфа-фетопротеин не определяется. Наряду с этим альфа-фетопротеин является достаточно специфичным маркером гепатоцеллюлярной карциномы (ГЦК). По данным литературы [16], положительная цитоплазматическая иммуногистохимическая реакция с альфа-фетопротеином отмечается в 25–40 % наблюдений ГЦК, имея нередко при этом очаговый характер. То есть данный иммуногистохимический маркер характеризуется относительно низкой чувствительностью, особенно при низкодифференцированных формах ГЦР. Вместе с тем, определение уровня альфа-фетопротеина в сыворотке крови считается эффективным методом для диагностики и контроля эффективности лечения ГЦК.
Большинство опухолевых клеток, представляющих аденокарциномы, характеризуются диффузной цитоплазматической реакцией с поликлональным раково-эмбриональным антигеном (пРЭА). Поскольку в состав пРЭА наряду с белками входит и билиарный гликопротеин, то иммуногистохимическая картина пРЭА в ткани ГЦК носит специфический характер в виде так называемой мелкой проволочной сетки курятника («chicken-wire fence»). Такая типичная картина канальцев отмечается в 60–90 % наблюдений высоко- и умереннодифференцированных ГЦК и в 25–50 % – низкодифференцированных форм [16, 21]. К сожалению, примерно в половине анализируемых препаратов наблюдается и цитоплазматическое окрашивание опухолевых клеток, что затрудняет проведение дифференциальной диагностики с метастатическими аденокарциномами. При этом моноклональный РЭА в ткани ГЦК не выявляется.
Для подтверждения эпителиальной природы новообразования используются различные цитокератины (ЦК). При этом нормальные и опухолевые гепатоциты характеризуются положительной реакцией на ЦK 8 и 18, в то время как реакция на ЦК 7, 19 и 20 – отрицательная [16, 19]. В этой связи реакция на цитокератины используется для дифференциальной диагностики ГЦГ как от метастазов, так и предопухолевых гепатоцеллюлярных поражений [9]. Действительно, в качестве дифференциально-диагностического признака диспластических узелков высокой степени и ранней ГЦК на фоне цирроза печени используется оценка стромальной инвазии, характерная для ГЦК. В качестве уточняющего метода рекомендуется иммуногистохимическое выявление ЦК 7 и 19: наличие положительной реакции в протоках свидетельствует о псевдоинвазии и не требует верификации ГЦК [10].
Высокочувствительным и высокоспецифичным маркером печеночно-клеточной дифференцировки является антитело HepPar-1, реагирующее с ферментом цикла мочевины карбамил фосфат-синтазой митохондрий печени. В этой связи на иммуногистохимических препаратах положительная реакция проявляется в виде зерен в цитоплазме нормальных и опухолевых гепатоцитов. К сожалению, HepPar-1 не является патогномоничным показателем гепатоцитов, поскольку он также реагирует с митохондриями эпителия канальцев почек и кишечного эпителия. Тем не менее, HepPar-1 признан наиболее адекватным маркером ГЦК печени, так как его экспрессия определяется у 80–90 % больных. При этом интенсивность окрашивания ослабевает по мере снижения степени дифференцировки карциномы, а в ткани низкодифференцированной и скиррозной ГЦК может даже не определяться [16]. Кроме того, положительная очаговая реакция HepPar-1 может наблюдаться при карциноме легкого, пищевода, желудка, толстой кишки, желчного пузыря, шейки матки, надпочечника, а также в ткани меланомы и параганглиомы [17],
Другим маркером печеночно-клеточной дифференцировки является аргиназа (ARG1), катализирующая расщепление аргинина на орнитин и мочевину. Иммуногистохимическими методами определяется в ядре и цитоплазме клеток. По мнению B.C. Yan с соавт. [24], ARG1 обладает большей чувствительностью и специфичностью по сравнению с HepPar-1, особенно при анализе низкодифференцированной ГЦК. Однако имеются указания, что ARG1 может также выявляться в клетках протоковой аденокарциномы поджелудочной железы.
В последнее время для дифференциальной диагностики ГЦК все чаще стали использовать глипикан-3 (GPC3), представителя семейства гепаран-сульфат протеогликанов, сцепленных с клеточной поверхностью при помощи фосфатидилинозитолового якоря. Глипикан-3 определяется в плаценте и печени плода, участвуя в регуляции процессов пролиферации, дифференцировки и апоптоза клеток. В нормальных гепатоцитах печени взрослого человека не определяется. В то же время в ткани ГЦК глипикан-3 выявляется преимущественно в виде цитоплазматического и иногда мембранного или канальцевого окрашивания: в 69 % наблюдений высоко дифференцированных и в 81 % – умеренно дифференцированных форм [13]. Важным моментом является то, что глипикан-3 характеризуется большей чувствительностью по сравнению с HepPar-1 в ткани низкодифференцированной ГЦК [16]. По данным D. Baumhoer с соавт. [11], положительная экспрессия глипикана-3 наблюдается и в отдельных диспластических узелках высокой степени, что свидетельствует об их предопухолевой природе. Наряду с этим, реакция на глипикан-3 отсутствует в ткани гепатоцеллюлярной аденомы, очаговой узловой гиперплазии и при циррозе печени. К отрицательным моментам следует отнести отдельные случаи отрицательной реакции в наблюдениях высоко дифференцированной ГЦК и, наоборот, положительной реакции в ткани меланомы, карциномы желудка, плоскоклеточной карциномы легкого и герминогенных опухолей (хориокарциномы и опухолей желточного мешка) [16].
Еще одним маркером ГЦК является так называемый белок теплового шока 70 (HSP70), входящий в семейство белков теплового шока и имеющий молекулярную массу 70 кДа. Данные белки действуют как внутриклеточные шапероны, а также обладают выраженным антиапоптотическим эффектом [15]. При иммуногистохимическом исследовании HSP70 характеризуется ядерной и цитоплазматической реакцией и отмечается в 78 % наблюдений высоко дифференцированной и в 67 % – умеренно и низкодифференцированной ГЦК. Кроме того, он обнаруживался в 5 % диспластических узелков высокой степени и отсутствовал в диспластических узелках низкой степени [13]. E. Shin с соавт. [23] показали высокую корреляцию выраженной экспрессией HSP70 с размерами ГЦК, степенью гистологической дифференцировки и наличием сосудистой инвазии. Примечательно, что положительная реакция с HSP70 наблюдается и в эпителии желчных протоков, что рекомендуется использовать в качестве внутреннего контроля постановки реакций [13].
Основной функцией глутаминсинтетазы считается участие в детоксикации аммиака. В то же время ген глутаминсинтетазы активируется в результате ядерной транслокации бета-катенина. Видимо, именно поэтому в клетках бета-катенин-активированной гепатоцеллюлярной аденомы отмечается диффузная реакция глутаминсинтетазы. И это, видимо, также является основным фактором повышенного риска злокачественной трансформации данного типа гепатоцеллюлярных аденом. В нормальной же ткани печени положительная реакция глутаминсинтетазы наблюдается лишь в первом и втором слое гепатоцитов, окружающих терминальную печеночную венулу [12]. Развитие и прогрессирование ГЦК сопровождается увеличением частоты иммуногистохимического выявления глутаминсинтетазы в виде диффузной цитоплазматической окраски. Так, глутаминсинтетаза определяется в 14 % диспластических узелков высокой степени, в 59 % наблюдений высоко дифференцированной и в 86 % умеренно дифференцированной ГЦК [13].
Особую роль среди иммуногистохимических показателей ГЦК занимают маркеры кровеносных сосудов, поскольку наряду с диагностическими возможностями они могут использоваться и в качестве факторов прогноза. Действительно, многошаговый гепатоканцерогенез от предракового поражения до инвазивной формы опухоли сопровождается изменениями, как в структуре сосудов, так и ее кровоснабжении [6]. Так, по данным иммуногистохимического исследования эндотелиоциты нормальных синусоидов и при циррозе печени характеризуются отрицательной реакцией с антителами CD31 и CD34, в то время как эндотелиальные клетки сосудов в ткани диспластических узелков и ГЦК имеют положительную экспрессию данных маркеров. То есть реакцию с CD34 не рекомендуется использовать для дифференциальной диагностики диспластических узелков и ранней ГЦК.
Прогрессирующие процессы капилляризации синусоидов взаимосвязаны и со степенью злокачественности новообразования. В участках высокодифференцированной ГЦК встречаются как обычные синусоиды, так и микрососуды капиллярного типа, а при низкодифференцированной форме – только капилляры [7]. При этом синусоиды в высокодифференцированной ГЦК характеризуются неполной капилляризацией: положительные реакции на CD34 и ламинин являются слабыми и только местами. В процессе дедифференцировки отмечается увеличение площади участков с CD34-положительной реакцией и развитие признаков полной капилляризации, как это отмечается в умеренно-дифференцированном ГЦК. Согласно проведенным нами исследованиям [8], морфологические показатели васкуляризации ткани ГЦК зависят от размера узлов и степени гистологической дифференцировки. Максимальные значения количества и суммарной площади сечения CD34 положительных сосудов установлены в новообразованиях диаметром не более 5 см, а наименьшие – в опухолях размером более 10 см. Наибольшие значения показателя васкуляризации выявлены в ткани высоко дифференцированной ГЦК, а наименьшие – в наблюдениях низкодифференцированных карцином.
Следует также добавить, что изменения неоангиогенеза отражаются и на лучевых характеристиках образований: диспластические узелки обычно выглядят как изо- или гиповаскулярные участки, ГЦК же имеет характеристики гиперваскулярности в артериальную фазу исследования [14]. При этом лучевые характеристики выраженной ГЦК зависят также от размеров опухолевого узла [5] и степени гистологической дифференцировки [3, 4].
Важным моментом морфологического изучения ткани опухоли является оценка степени пролиферации ее клеток. К основным иммуногистохимическим маркерам, используемым для определения индексов пролиферации, относятся PCNA (ядерный антиген пролиферирующих клеток) и Ki-67, которые определяются в ядрах пролиферирующих клеток. При этом Ki-67 не экспрессируется в фазу G0. При иммуногистохимическом анализе PCNA положительных клеток было показано прогрессирующее увеличение их количества в ряду, отражающим этапы гепатоканцерогенеза: регенеративные узелки (2,6 ± 1,35), диспластические узелки низкой степени (15,3 ± 10,5), диспластические узелки высокой степени (25,4 ± 5,25), маленькая ГЦК (34,9 ± 15,7) [22]. Дальнейшее прогрессирование ГЦК (стадия I – IV) тоже сопровождается с увеличением количества Ki-67 положительных клеток [20]. При этом на основании проведенного мета-анализа Y. Luo с соавт. [18] установили, что более высокие значения индекса пролиферации клеток (по Ki-67) сочетаются не только с более высокой степенью злокачественности, но и с бoльшими размерами и количеством узлов, наличием сосудистой инвазии и метастазов.
Характеризуя иммуногистохимические маркеры, применяемые для верификации ГЦК, необходимо добавить, что эффективность такой диагностики повышается при использовании несколько антител. Как мы уже указывали, чувствительность и специфичность глутаминсинтетазы при диагностике высоко дифференцированной ГЦК составляет 59 % и 86 % соответственно, глипикана-3 – 69 % и 91 %, белка теплового шока 70–78 % и 95 % соответственно. Использование же двух из трех этих антител повышало чувствительность до 72 % и специфичность до 100 %. Наиболее эффективным, по мнению [13], является применение белка теплового шока 70 и глипикана-3.
Таким образом, иммуногистохимическое исследование закономерно считается эффективным методом патогистологического исследования, позволяющим проводить объективную диагностику гепатоцеллюлярной карциномы, дифференциальную ее диагностику с опухолеподобными изменениями и метастазами других новообразований, а также определять прогноз заболевания.
источник
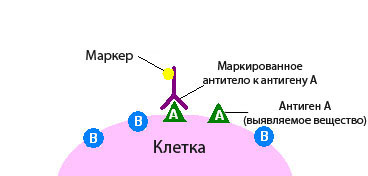
Иммуногистохимическое исследование в онкологии – это разновидность исследования ткани с помощью специальных реактивов по принципу антиген-антитело.
При иммуногистохимическом исследовании используются реактивы, которые содержат антитела, отмеченные специальными веществами.
Антитело – это белок, который связывается в тканях с определенными молекулами — антигенами, после чего возникает реакция. Если же таких молекул нет, то и реакции не будет.
По этому признаку можно судить, присутствует в ткани интересная нам молекула или нет. Это похоже на то, если нанести на белый стол бесцветный клей. Невооруженным глазом на белом фоне он практически незаметен, но стоит насыпать на стол мелкого песка, как клей становится виден за счет прилипших песчинок.
По правилам иммуногистохимическое исследование при раке всегда проводится в специализированной лаборатории. Для его проведения необходима опухолевая ткань, полученная в результате биопсии или операции.
Иммуногистохимическое исследование проводится для определения наличия в опухолевых клетках различных точек приложения, например, наличие рецепторов эстрогенов (ER) и прогестеронов (PR). Также иммуногистохимия выполняется для определения показателя Ki-67 (индекс пролиферативной активности опухолевых клеток), гиперэкспрессии белка Her2neu, VEGF (сосудистый фактор роста), р53.
Иммуногистохимическое исследование при раке выполняется для того, чтобы понять, какими препаратами можно лечить злокачественную опухоль, и к каким видам препаратов она чувствительна.
Самый распространённый анализ, определяемый при иммуногистохимическом исследовании, это наличие рецепторной чувствительности к гормонам у опухоли.
ER и PR — протеиновые рецепторы на поверхности опухолевых клеток.
В организме человека постоянно вырабатываются гормоны — эстроген и прогестерон. Эти гормоны воздействуют на ER и PR рецепторы, что приводит к стимуляции роста опухолевых клеток.
Определение Эстрогеновых и Прогетестероновых рецепторов является одним из важнейших моментов, определяющих чувствительность опухоли к терапии гормональными препаратами.
Чаще всего наличие рецепторов ER/PR определяют при раке молочной железы. Их наличие дает возможность, помимо стандартных методов лечения, применить гормональную терапию.
При гормон позитивном раке молочной железы, назначаются препараты: Тамосксифен, Экземестан (Аромазин), Летрозол (Фемара), Анастразол (Аримидекс), Гексэстрол (Синестрол) и другие.Также, считается, что гормонально-зависимый рак молочной железы отличается спокойным течением и редким метастазированием.
Чувствительность опухолевых клеток к гормональной терапии выражается в баллах от до 10. Опухоль считается гормонозависимой, начиная с 2-х баллов. и требует добавления к лечению гормональной терапии.
Her2Neu — это рецептор эпидермального фактора роста раковой клетки. Это — ген, который воздействует на мембранные рецепторы клетки, и стимулирует её к усиленному делению.
В некоторых опухолях (чаще всего рак молочной железы, рак пищевода, рак желудка) присутствует гиперэкспрессия (повышенная активность) Her2Neu, что вызывает быстрое деление опухолевой клетки и её повышенную активность.
Также снижается эффективность химиотерапии, лучевой терапии, гормональной терапии. Из-за этого опухоли с Her2neu позитивным статусом отличаются агрессивным течением.
Существует две методики определения наличия у опухоли гена Her2neu:
Результаты иммуногистохимического исследования выражаются в баллах:
- 0-1 означает, что опухоль без гиперэкспрессии Her2neu.
- 3 означает, что опухоль с гиперэкспрессией Her2neu.
2. Метод FISH (Флуоресцентная гибридизация in situ)
В отличие от иммуногистохимического исследования, при котором определяются белки, при методе FISH определяется наличие генов, кодирующих протеины Her2neu. В зависимости от их наличия, определяется гиперэкспрессия Her2neu.
Определение гиперэкспрессии рецептора Her2neu в опухоли молочной железы является очень важным для дальнейшего назначения лечения.
В современной онкологии гиперэкспрессию Her2neu определяют, чтобы понять, необходимо ли добавление к лечению ингибиторов Her2neu. Для лечения опухолей с гиперэкспрессией рецептора Her2Neu активно и успешно используются таргетные препараты Трастузумаб (Герцептин), Пертузумаб (Перьета), Трастузумаб-эмтанзин (Кадсила), Бейодайм (Трастузумаб+Пертузумаб). Эти препараты прицельно блокируют рецепторы Her2neu, тем самым останавливая активный рост опухолевых клеток и повышая их чувствительность к химиопрепаратам. Добавление таргетной терапии к стандартной химиотерапии при лечении Her2neu позитивных опухолей, серьезно увеличивает общую выживаемость и результат противоопухолевого лечения.
Ki-67 — это маркер пролиферативной активности опухолевой клетки. Данный параметр оценивается в процентах и показывает, сколько процентов опухолевых клеток активно делятся.
Если Ki-67 меньше 15%, опухоль считается слабоагрессивной, при показателе Ki-67 от 30 до 50% опухоль считается агрессивной, а при показателе Ki-67 выше 50% опухоль является высокоагрессивной.
Также Ki-67 является фактором прогноза течения опухолевого заболевания и ответа опухоли на химиотерапевтическое лечение. Определяется это простым способом: чем ниже показатель Ki-67, тем хуже опухоль реагирует на химиотерапевтическое лечение. И наоборот — чем выше показатель Ki-67, тем лучше опухоль будет отвечать на химиотерапию.
Белок p53 — это транскрипционный фактор, регулирующий клеточный цикл. В быстро делящихся клетках обнаружено увеличение концентрации белка р53 по сравнению с клетками, делящимися медленно, что обусловлено высоким риском их онкогенности.
Белок p53 предотвращает образование злокачественных опухолей в нашем организме. В норме, антионкоген р53 находится в неактивном состоянии, а при появлении повреждений ДНК в здоровой клетке — активируется.
Функция белка р53 состоит в удалении тех клеток, которые являются потенциально онкогенными. Это называется — индуцированный апоптоз, уничтожение потенциально опасной клетки.
При иммуногистохимическом исследовании, повышенное содержание белка p53 обнаруживается в 50% злокачественных клеток, что позволяет им беспрепятственно делиться и избегать апоптоза (уничтожения).
Количество белка p53, определяют в дополнение к показателю Кi67, для того, чтобы понять насколько агрессивна опухоль и определить дальнейшее течение болезни. Если уровень белка p53 высокий, значит опухоль не агрессивная и не склонна к метастазированию и быстрому росту. Если же, показатель белка p53 низкий, то значит опухоль агрессивна и склонна к быстрому росту в окружающие ткани и метастазированию.
VEGF – это сигнальный белок, вырабатываемый клетками для активного роста новых сосудов в уже существующей сосудистой системе.
Есть несколько видов белка VEGF, и каждый воздействует на определенный рецептор VEGFR (Vascular endothelial growth factor receptor). Для того чтобы активно делиться, опухоли нужно питание, а для этого нужны сосуды, по которым это питание будет поступать. Именно по этой причине в опухолевых клетках содержится повышенное содержание белка VEGF — для того, чтобы в короткие сроки строить сосудистые сети.
Наличие белка VEGF в опухоли говорит о возможности применения таргетной терапии такими препаратами, как Бевацизумаб (Авастин), Рамуцирумаб (Цирамза), Афлиберцепт (Залтрап). Они перестраивают сосудистую сеть опухоли, тем самым лишая её питания.
Иммунотерапия в онкологии появилась сравнительно недавно, но уже успела показать удивительные результаты в лечении опухолей. Механизм иммунотерапии рака заключается в том, что препарат позволяет иммунитету увидеть опухоль и уничтожить её. Ответственные за «видимость» опухоли белки PD-1, PDL-1 и PDL-2 в достаточном количестве присутствуют не во всех опухолях. Именно поэтому одним пациентам иммунотерапия помогает, а другим нет.
Чаще всего определение гиперэкспрессии белка PD-1 и его лиганд PDL-1 и PDL-2 необходимо при меланоме, немелкоклеточном раке легкого, раке желудка и раке почки.
Для того чтобы отобрать пациентов, которым показана иммунотерапия, проводится определение наличия экспрессии PD-1 и его лиганд PDL-1 и PDL-2, при помощи флюоресцентной гибридизации in situ (FISH). При наличии экспрессии PD-1 и его лиганд PDL-1 и PDL-2, показано применение иммунотерапии препаратами Пембролизумаб (Кейтруда), Ниволумаб (Опдиво), Атезолизумаб (Тецентрик).
В современной онкологии иммуногистохимическое исследование играет очень важную роль, так как при помощи этого исследования онкологи определяют наличие тех или иных факторов в опухоли, которые позволяют грамотно и адекватно составить дальнейшее лечение пациента и говорить о прогнозах заболевания.
источник
Гепатоцеллюлярный рак – злокачественное новообразование, которое развивается из клеток печени. Рак печени составляет до 7,2% всех злокачественных опухолей у мужчин и 3,8% у женщин, и является одной из важных проблем здравоохранения.
Причиной развития гепатоцеллюлюрного рака чаще всего являются гепатиты B и C, высокое поступление в пищу афлатоксина В1 (содержится в большом количестве в пораженных грибами рода Aspergillus растениях, особенно в арахисе), злоупотребление алкоголем. Также среди факторов, приводящих к развитию рака печени, рассматриваются избыточное поступление железа, длительное использование оральных контрацептивов и высоких доз анаболических стероидов.
Наиболее распространенная злокачественная опухоль печени — это печеночно–клеточный рак (гепатоцеллюлярная карцинома – ГЦК, или гепатоцеллюлярный рак – ГЦР) – опухоль, исходящая из гепатоцита. Реже встречаются холангиокарциномы (ХК, или холангиоцеллюлярный рак, ХЦР) — опухоли из эпителия внутрипеченочных желчных протоков, смешанные гепатохолангио-карциномы, а также фиброламеллярная карцинома (ФЛК), которая формально классифицируется как вариант ГЦК.
Диагностика рака печени включает в себя следующие процедуры:
— Анамнез и физикальный осмотр
— КТ/МРТ брюшной полости. Предпочтение – МРТ с гепатотропным контрастом
— Рентгенография/КТ органов грудной клетки
— Развернутый клинический и биохимический анализ крови
— Онкомаркеры (АФП, РЭА, СА 19-9)
Дополнительные исследования при наличии показаний: эластометрия, сканирование костей (по показаниям), лапароскопия, ПЭТ/КТ с холином, консультация гепатолога-вирусолога.
Ультразвуковая компьютерная томография (УЗКТ) применяется на этапе скрининга, для чрескожной биопсии и интервенционных вмешательств и, иногда, мониторинга эффективности лечения. Чувствительность метода невысока для обнаружения узлов малого размера.
Для дифференциальной диагностики, оценки распространенности процесса, стадирования заболевания выполняется компьютерная и/или магнитно-резонансная томография. Методы объективной визуализации (мультифазная контрастная КТ, динамическая контрастная МРТ или УЗКТ с контрастным усилением) позволяют оценить сосудистый профиль объемного образования, выявить признаки типичной для ГЦР картины васкуляризации: усиление в артериальную фазу и «вымывание» в портальную фазу. В международных (АASLD и EASL) руководствах диагноз печеночно-клеточного рака считается обоснованным, если оба метода (динамическая КТ и МРТ) независимо выявляют типичную васкуляризацию в опухоли.
Наиболее часто для уточненной диагностики ГЦР используют РКТ или МРТ с обязательным внутривенным контрастированием и оценкой особенностей васкуляризации новообразования в различные (в артериальную, венозную и отсроченную) фазы исследования при рекомендуемой скорости введения контрастного препарата 2-4-8 мл/сек (при РКТ).
В отличие от окружающей неизмененной паренхимы печени, которая питается из системы портальной вены, гепатоцеллюлярные опухоли кровоснабжаются преимущественно из системы печеночной артерии, поэтому в типичных случаях они характеризуются диффузным, гетерогенным «усилением» в артериальную (как при РКТ, так и при МРТ) фазу с последующим вымыванием контрастного препарата в венозную и отсроченные фазы, что считается классическим отображением ГЦР.
Пункционная биопсия выявленного образования рекомендуется при атипичных проявлениях ГЦР, в частности, при гипо- или изоваскулярных его вариантах, т.к. их РКТ/МРТ диагностика может быть значительно затруднена.
Особенности отображения гепатоцеллюлярных опухолей зависят как от их размеров, так и от степени их дифференцировки.
При диффузионно-взвешенной МРТ (ДВ-МРТ = DWI) показатели истинного коэффициента диффузии (ИКД) не коррелируют со степенью злокачественности ГЦР, хотя и создается впечатление о некотором повышении сигнала на ДВ-изображениях по мере возрастания упомянутой степени, однако предсказывать уровень дифференцировки опухолей дооперационно — невозможно (вследствие значительного разброса значений ИКД). Гепатоспецифичные (гепатобилиарные) МР-контрастные вещества1 обеспечивают 2–этапное контрастное «усиление» паренхимы печени: на I этапе – в артериальную, венозную и отсроченные фазы; на II этапе – гадоксетовая кислота интенсивно поглощается гепатоцитами, что приводит к последовательному нарастанию интенсивности отображения паренхимы и усилению степени контрастности между тканью печени и негепатоцеллюлярными новообразованиями. Другими словами, очаги в печени, не содержащие гепатоцитов, не накапливают контрастный препарат, т.е. не «усиливаются», но лучше различимы на фоне контрастированной паренхимы. Гепатоспецифическая (гепатобилиарная) фаза после введения гадоксетовой кислоты обычно наступает (при нормальной функции печени) через 10-20 мин и длится как минимум 60 мин. У пациентов с циррозом и нарушенной функцией печени пик контрастирования паренхимы трудно предсказуем. Он наступает значительно позже – более чем через 30-40 мин.
Показания к применению МР-контрастного препарата гадоксетовой кислоты:
— первично выявленные новообразования печени неустановленной природы (для уточнения их характера и количества).
— при циррозе печени – для уточненной оценки состояния паренхимы и дифференциальной диагностики регенераторных узлов и ГЦР.
— при первичном или метастатическом ГЦР на фоне цирроза – оценка эффективности химио- и локорегиональной терапии.
— при гепатоцеллюлярных аденомах – динамическая оценка выявленных опухолевых узлов.
Позитронно-эмиссионная томография (ПЭТ/КТ) с глюкозой не рекомендуется для рутинной диагностики и стадирования ГЦК. ПЭТ/КТ с холином может быть полезен для выявления внепеченочных метастазов.
Биопсия позволяет получить морфологическое подтверждение ГЦР. В руках опытного хирурга частота осложнений пункции печени (чаще кровотечение) не превышает 1-2%. Пункционная биопсия с получением столбика ткани (кор- биопсия) предпочтительнее аспирационной тонкоигольной биопсии. При выявлении (мультифазная КТ) в цирротической печени опухоли с характерной для ГЦК васкуляризацией и подтверждении диагноза контрастной МРТ морфологическая верификация не обязательна.
Биопсия опухоли в печени необходима при:
1. малом размере опухоли ( 2 см,
3. расхождениях в описании и трактовке контрастных динамических исследований в сочетании с нормальным или незначительно повышенным уровнем АФП,
4. выявлении любого опухолевого образования в нецирротической печени.
При тромбоцитопении ( таргетной терапией ГЦР. Уже выделяются различные подклассы печеночноклеточного рака (Wnt, пролиферативный и воспалительный).
источник
Важнейшим пунктом при диагностике раковых заболеваний является иммуногистохимическое исследование. Ежедневно в организм человека проникают микроорганизмы, способные запустить развитие патологического процесса. Защитные силы противостоят этому, образуя антитела. Эта реакция и легла в основу создания ИГХ-исследования.
Данный способ диагностики раковых заболеваний является наиболее современным и достоверным. В процессе развития опухолевого процесса образуются чужеродные организму белки – антигены. В это же время иммунная система вырабатывает антитела, главная цель которых – предотвращение размножения патогенных микроорганизмов.
Задачей иммуногистохимического исследования является своевременное выявление раковых клеток. Для этого биологический материал пациента обрабатывается множеством антител, после чего тщательно изучается под микроскопом. Если данные белковые соединения свяжутся с опухолевыми клетками, будет визуализироваться их свечение. Возникновение эффекта флюоресценции и свидетельствует о наличии в организме раковых клеток.
На сегодняшний день в распоряжении специалистов, осуществляющих ИГХ-исследование, имеются практически все антитела к различным видам опухолей, что служит залогом получения достоверных результатов.
Современный вид диагностики позволяет определить:
- распространение опухолевого процесса;
- скорость роста злокачественных новообразований;
- вид опухоли;
- источник метастазов;
- уровень злокачественности.
Кроме того, с помощью иммуногистохимического исследования может оцениваться степень эффективности лечения раковых заболеваний.
С помощью данного способа существует возможность изучения любых тканей человеческого организма. Главным основанием для назначения иммуногистохимического исследования является подозрение о наличии злокачественного образования.
В этом случае метод используется для:
- определения вида опухоли и области её локализации;
- обнаружения метастазов;
- оценки активности опухолевого процесса;
- выявления патологических микроорганизмов.
Также анализ эффективен при проблемах с зачатием.
Иммуногистохимическое исследование эндометрия показано при:
- бесплодии;
- заболеваниях матки;
- наличии патологий в органах репродуктивной системы;
- невынашивании беременности;
- хронических заболеваниях эндометрия.
Кроме того, ИГХ-исследование назначается пациенткам, у которых не наступает беременность даже после нескольких попыток экстракорпорального оплодотворения. Метод позволяет определить, имеются ли в организме клетки, снижающие вероятность зачатия.
Противопоказаний к ИГХ-исследованию не существует. Единственным фактором, из-за которого невозможно провести анализ, является непреодолимая сложность при заборе биоматериала пациента.
В первую очередь методом биопсии получают образец ткани больного. Реже забор материала осуществляется в процессе эндоскопического обследования или хирургического вмешательства. Способ получения образца зависит от вида опухоли и её локализации.
Важным нюансом является то, что забор материала при первичном обследовании должен осуществляться до начала лечения. В противном случае результаты исследования могут быть искажены.
После забора биоматериала его помещают в формалин и отправляют в лабораторию, где он подвергается следующей обработке:
- Образец ткани обезжиривается и заливается парафином. В данном виде биологический материал может храниться очень долго, за счёт чего ИГХ-исследование может быть проведено повторно.
- С образца собирают несколько тонких срезов и перемещают их на специальные стёкла.
- На них биоматериал окрашивается растворами различных антител. На данном этапе может применяться как малая панель, так и большая. В первом случае изучаются реакции после использования 5 видов антител, во втором – до нескольких десятков.
- В процессе иммуногистохимического исследования при раке любого органа появляется эффект флюоресценции, что даёт возможность специалисту определить вид злокачественных клеток.
Как правило, заключение готово через 7–15 дней. Срок зависит от вида используемой панели (малой или большой). Расширенный способ занимает больше времени.
Изучением срезов биоматериала занимается патологоанатом, имеющий знания и навыки (подтверждённые официальным документом), необходимые для проведения анализа.
При интерпретации результатов особое внимание обращается на показатель Ki-67. Именно он предоставляет информацию о степени злокачественности процесса. Например, если результат показателя после проведения иммуногистохимического исследования при раке молочной железы составляет не более 15%, считается, что прогноз более чем благоприятный. Уровень в 30% свидетельствует об активности опухолевого процесса, т.е. о быстрой скорости его развития. Как правило, она останавливается после курса химиотерапии.
По некоторым статистическим данным, если Ki-67 составляет менее 10%, итог заболевания будет благоприятным (в 95% случаев). Отметка в 90% и выше означает почти 100%-ный летальный исход.
Кроме показателя злокачественности, в заключении указываются:
- антитела, к которым выявлено сходство (тропность);
- вид раковых клеток, их количественное значение.
Важно понимать, что точный диагноз ставится после получения и изучения информации, собранной посредством всех проведённых диагностических процедур. Несмотря на то, что ИГХ-анализ считается наиболее информативным методом по сравнению с гистологией, иногда необходимо использовать оба способа. Расшифровкой иммуногистохимического исследования занимается исключительно онколог.
В современной медицине особое внимание уделяется диагностике раковых заболеваний. Наиболее современным и информативным методом считается иммуногистохимическое исследование. С его помощью выявляется не только наличие раковых клеток, но и определяется их вид и скорость развития злокачественного процесса. Кроме того, на основании результатов производится оценка эффективности назначенного лечения.
источник
Иммуногистохимия, или иммуногистохимический анализ — исследование, во время которого в образцах ткани с помощью антител выявляют определенные молекулы. Этот метод диагностики нашел широкое применение в онкологии.
Немного теории и истории. Для того чтобы обнаруживать и уничтожать чужеродные вещества, иммунная система использует особые молекулы — антитела. Они отличаются специфичностью: каждое антитело может связываться строго с определенным антигеном.
В 1941 году американский иммунолог Альберт Кунс впервые решил использовать антитела в лаборатории, чтобы «распознавать» с помощью них белки бактерий. В 1984 году биохимик из Аргентины Сезар Мильштейн получил Нобелевскую премию за то, что создал гибрид опухолевой клетки с лимфоцитом, которая могла синтезировать моноклональные антитела. После этого началось производство моноклональных антител для диагностических и лечебных целей.
В 1994 г. С. Тэйлор применил иммуногистохимический анализ, чтобы проверить 20 000 опухолей, и обнаружил, что диагнозы в половине случаев были ошибочными. Иммуногистохимия зарекомендовала себя как эффективный метод диагностики.
Иммуногистохимический анализ помогает врачам-онкологам:
- Отнести злокачественную опухоль к тому или иному типу.
- Выяснить, в каких генах опухолевых клеток произошли мутации, какие белки способствуют прогрессированию рака.
- Выявить первичную опухоль и ее метастазы.
- Определить, произошла ли злокачественная трансформация клеток.
- Определить прогноз для пациента.
- Разобраться, поможет ли в данном случае таргетная терапия.
- Определить, чувствительны ли опухолевые клетки к химиотерапии, лучевой терапии.
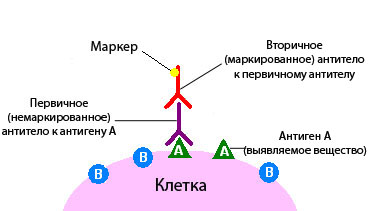
Иммуногистохимия бывает прямой и непрямой. В первом случае используют один вид антител, которые должны вступить в связь с определенной молекулой-мишенью. Если молекула-мишень присутствует в ткани, и реакция произошла, опухолевая ткань окрашивается:
- Чаще всего к антителу присоединяют фермент, например, пероксидазу. Этот фермент катализирует химическую реакцию, которая приводит к изменению цвета.
- Иногда к антителу присоединяют флюоресцин или родамин, при этом окрашивание выявляют с помощью флюоресцентной микроскопии.
- всего применяют непрямую иммуногистохимию. При этом используют два антитела. Одно соединяется с антигеном, второе — с полученным комплексом антиген-антитело. Маркер, который вызовет изменение цвета, связывают со вторым антителом.
Непрямой метод имеет некоторые преимущества:
- Он обладает более высокой чувствительностью, потому что с одним первичным антителом (тем, которое связывается с белком-мишенью) может связаться несколько вторичных антител.
- Исследование занимает немного времени: для того, чтобы произошла реакция, нужно примерно 3 часа.
- Непрямая иммуногистохимия требует небольшого количества антител. Например, вторичное антитело, направленное на иммуноглобулины кролика, будет реагировать на любое первичное антитело «кроличьего» происхождения. Не нужно создавать много разных видов вторичных антител с окрашивающей или флуоресцентной меткой.
Для того чтобы выполнить иммуногистохимический анализ, нужно получить опухолевую ткань, то есть провести биопсию. В качестве материала можно использовать столбик ткани, полученный во время трепан-биопсии, фрагмент тканей или даже целый орган, удаленный во время операции.
Образец ткани фиксируют с помощью формальдегида (иногда используют метанол, ацетон и другие фиксаторы — это зависит от того, какой антиген нужно выявить, и реагирует ли он с теми или иными фиксаторами) и погружают в парафин. Парафинизация помогает законсервировать ткань, сохранить ее структуру на длительное время.
Затем ткань, помещенную в парафин, нарезают с помощью специального инструмента — микротома — на слои толщиной 3–5 мкм. Эти тонкие срезы помещают на стекло, покрытое, специальным клеем.
Некоторые образцы слишком чувствительны к реагентам, которые применяют во время вышеописанной процедуры. Их нельзя помещать в парафин. Такие ткани замораживают жидким азотом. Этим альтернативным методом пользуются редко, только в случае необходимости, так как у заморозки есть некоторые недостатки: она делает изображение под микроскопом не таким четким, требует специальных условий хранения образцов. Фиксацию ткани в таких случаях проводят уже после нанесения на стекло и размораживания, ацетоном или формальдегидом.
После того как срезы нанесены на стекло, из них нужно удалить весь парафин, иначе антитела не прореагируют с антигеном. Эта процедура называется депарафинизацией. Ее проводят с помощью ксилола. Затем выполняют еще некоторые подготовительные процедуры, чтобы антитела могли успешно прореагировать с нужными антигенами, и, наконец, проводят непосредственно иммуногистохимический анализ. Обработанную антителами ткань рассматривают под микроскопом, чтобы проверить, окрасилась ли она.
Количество возможных мишеней измеряется сотнями. Перед исследованием врач должен понимать, что он ищет, и использовать соответствующие антитела. В онкологии мишенями являются опухолевые маркеры — вещества, которые в здоровых клетках отсутствуют вообще или присутствуют в значительно меньшем количестве. Вот некоторые примеры:
- Рецепторы к эстрогенам и прогестерону помогают идентифицировать гормонально-позитивный рак молочной железы и разобраться, помогут ли женщине гормональные препараты.
- Простатспецифический антиген (ПСА) имеет значение в диагностике рака простаты.
- Альфа-фетопротеин — присутствует в гепатоцеллюлярной карциноме (рак печени).
- Цитокератины помогают в диагностике рака и некоторых сарком (злокачественных опухолей соединительной ткани).
- Фермент CD10 (CALLA) связан с карциномой почек, лимфобластным лейкозом.
Иммуногистохимический анализ помогает изучить характеристики злокачественной опухоли, которые не могут выявить другие методы диагностики. Зачастую это играет важную роль в уточнении диагноза и назначении правильного лечения. Врач может определить, какие комбинации препаратов будут наиболее эффективны для конкретного больного, иными словами, реализуется принцип персонализированного лечения. Зачастую это помогает улучшить результаты, подобрать эффективное лечение для пациентов, которым не помогает стандартная терапия.
источник
Экспертное заключение – доктор медицинских наук, профессор кафедры патологической анатомии лечебного факультета РГМУ М.В. Самойлов
Учебное пособие выполнено в рамках инновационной образовательной программы Российского университета дружбы народов, направление «Комплекс экспортоориентированных инновационных образовательных программ по приоритетным направлениям науки и технологий»
ПРИКЛАДНЫЕ ВОПРОСЫ ИММУНОГИСТОХИМИИ Тема № 4. Значение клеточных белков в оценке гистогенеза опухолей Тема № 5. Рецепторные белки в неизмененных и опухолевых клетках Тема № 6. Белки – маркеры клеточного цикла Тема № 7. Факторы апоптоза и пролиферации
- Бабиченко И.И., Костанян И.А., Липкин В.М. HLDF – новый маркер анапластических процессов в предстательной железе человека // В кн.: Рак предстательной железы. / Под ред. Н.Е. Кушлинского, Ю.Н. Соловьева, М.Д. Трапезниковой. – М: Изд. РАМН, 2002. – С. 289-305.
- Георгиев Г.П. Молекулярно-генетические механизмы прогрессии опухолей // Соросовский образовательный журнал. – 2000. –Т. 6, № 11. –C. 1-7.
- Епифанова О.И. Лекции о клеточном цикле. – Изд. КМК, 2003. – 160 с.
- Копнин Б.П. Основные свойства неопластической клетки и базовые механизмы их возникновения. Российский онкологический сервер. (www.rosoncoweb.ru/library/01/02.htm).
- Костанян И.А., Осипова М.В., Старовойтова Е.В., Драницына С.М. Выделение и изучение механизма действия пептидно-белковых факторов дифференцировки, вырабатываемых активированными клетками HL-60 // Цитология. – 1994. – Т. 36, № 6. – С. 525.
- Лушников Е.Ф., Абросимов А.Ю. Гибель клетки (апоптоз). – М.: Медицина, 2001. – 192 с.
- Лысенко О.Н., Ашхаб М.Х., Стрижова Н.В., Бабиченко И.И. Иммуногистохимические исследования экспрессии рецепторов к стероидным гормонам при гиперпластических процессах в эндометрии // Архив патологии. – 2004. – Т. 66, № 2. – С. 7-10.
- Мазуров В.И., Криволапов Ю.А. Классификация лимфом, морфология, иммунофенотип, молекулярная генетика неходжкинских лимфом // Практическая онкология. – 2004. – Т. 5. – C. 169-175.
- Побединский Н.М., Балтуцкая О.И., Омельяненко А.И. Стероидные рецепторы нормального эндометрия // Акушерство и гинекология. – 2000 . – №3. – С. 5-8.
- Полак Дж., Ван Норден С. Введение в иммуногистохимию: современные методы и проблемы. – М.: Мир, 1987. – С. 9-22.
- Райхлин Н.Т., Петров С.В., Чаиркин И.Н. История иммуногистохимии // В кн. Руководство по иммуногистохимической диагностике опухолей человека. / Под ред. С.В. Петрова, Н.Т. Райхлина. – Казань, 2000. – С. 12-14.
- Самуилов В.Д. Биохимия программируемой клеточной смерти (апоптоза) у животных // Соросовский образовательный журнал. – 2001. – Т. 7, № 10. – С. 18-25.
- Семиглазов В.Ф., Нургазиев К.Ш., Арзуманов А.С. Опухоли молочной железы (лечение и профилактика). – Алматы, 2001. –345 с.
- Сергеев П.В., Шимановский Н.Л., Петров В.И. Рецепторы физиологически активных веществ. – Волгоград: Семь ветров, 1999. – 538 с.
- Угрюмов М.В. Современные методы иммуноцитохимии и гистохимии. «Итоги науки и техники» ВИНИТИ, серия «Морфология». – 1991. – вып. 15. – 115 с.
- Франк Г.А. Проблемы морфологической классификации и диагностики опухолей мягких тканей // Практическая онкология. – 2004. – Т. 5. – C. 231-236.
- Фролова И.И., Бабиченко И.И., Местергази Г.М. Цервикальные интраэпителиальные неоплазии и дискератозы шейки матки. – М.: Издательский дом «Династия», 2004. – 88 с.
- Хансон К.П., Имянитов Е.Н. Эпидемиология и биология неходжкинских лимфом // Практическая онкология. – 2004. –Т. 5. – C. 163-169.
- Coons A.H., Kaplan M.H. Localization of antigen in tissue cells // J. Exp. Med. – 1950. – V.91. – P. 1-13.
- Coons A.H., Creech H.J., Jones R.N. Immunological properties of an antibody containing a fluorescent group // Proc. Soc. Exp. Biol. Med. – 1941. – V. 47. – P. 200-202.
- Coons A.H., Leduc E.H., Connolly J.M. Studies on antibody production. I. A method for the histochemical demonstration of specific antibody and its application to a study of the hyperimmune rabbit // J. Exp. Med. – 1955. – V. 102. – P. 49-60.
- Dabbs D.J. Diagnostic Immunohistochemistry. 2-nd ed. – Elsevier, 2006. – 828 p.
- De Miguel M.P., Royuela M., Bethencourt F.R., Ruiz A., Fraile B., Paniagua R. Immunohistohemical comparative analysis of transforming grows factor alpha, epidermal growth factor and epidermal grows factor receptor in normal, hyperplastic and neoplastic human prostates // Cytokine. – 1999. – V.11, N9. – P. 722-727.
- Graham R.C., Karnovsky M.J. The early stages of absorption of injected horseradish peroxidase in the proximal tubules of mouse kidney: ultrastructural cytochemistry by a new technique // J. Histochem. Cytochem. – 1966. – V. 14. – P. 291-302.
- Guesdon J.L., Ternynck T., Avrameas S. The use of avidin-biotin interaction in immunoenzymatic techniques // J. Histochem. Cytochem. – 1979. – V.27. – P. 1131-1139.
- Guesdon J.L., Ternynck T., Avrameas S. The use of avidin-biotin interaction in immunoenzymatic techniques // J. Histochem. Cytochem. – 1979. – V. 27. – P. 1131-1139.
- Harris N.L., Stein H., Coupland S.E. et al. New approaches to lymphoma diagnosis // Hematology 2001. – V.1. –P. 194-220.
- Kerr J.F.R., Wyllie F.N., Currie A.R. Apoptosis: a basic biological phenomenon with wide ranging implications in tissue kinetics // Brit. J. Cancer. – 1972. – V. 26, № 2. – P. 239-257.
- Mar K.C. et al. Cell proliferation marker MCM2, but not Ki 67, is helpful for distinguishing between minimally invasive follicular carcinoma and follicular adenoma of the thyroid // Histopathology. – 2006. – V. 48, N 7. – P. 801-807.
- Marrack J.R. Nature of antibodies // Nature. – 1934. – V. 133. – P. 292-293.
- Marshall J.M. Localization of adrenocorticotropic hormone by histochemical and immunochemical methods // J. Exp. Med. – 1951. – V. 94. – P. 21–30.
- Moll R. Subcellular Biochemistry. Vol 31: Intermediate Filaments/ Ed. Herrmann and Harris. Plenum Press, New York, 1998. – P. 205-262.
- Nakane P.K., Pierce G.B.Jr. Enzyme-labeled antibodies: preparation and application for the localization of antigen // J. Histochem. Cytochem. – 1966. – V. 14. – P. 929.
- Pathology and Genetics of Tumours of Soft Tissue and Bone. WHO Classification of Tumours. – 2006 . – V.5. – 427 p.
- Royuela M., De Miguel M.P., Bethencourt F.R., Sanchez-Chapado M., Fraile B., Paniagua R. Transforming growth factor beta 1 and its receptor types I and II. Comparison in human normal prostate, benign prostatic hyperplasia and prostatic carcinoma // Growth Factors. – 1998. –V. 16, N 2. – P. 101-110.
- Sternberger L.A. The unlabelled antibody peroxidase-antiperoxidase (PAP) method. In: Sternberger, L.A., Ed Immunocytochemistry. John Wiley, New York, 1979.-p. 104-169.
- Thornton A.D., Ravn P., Winslet M., Chester K. Блокада ангиогенеза с помощью бевацизумаба и хирургическое лечение колоректального рака // Современная онкология. – 2007. – Т. 9, № 1. (www.consilium-medicum.com/media/onkology/07_01/49.shtml).
- Van Aken E., De Wever О., da Rocha A.S.C., Mareel M. Defective Ecadherin/catenin complexes in human cancer // Virchows Arch. – 2001. – V. 439. – P. 725-751.
- Wood G.S., Warnke R. Suppression of endogenous avidin-binding activity in tissues and its relevance to biotin-avidin detection systems // J. Histochem. Cytochem. – 1981. – V. 29. – P. 1196-1204.
ПРАКТИЧЕСКИЕ ВОПРОСЫ ОНКОМОРФОЛОГИИ
В настоящее время иммуногистохимический метод исследования широко применяется для выявления неизвестной локализации первичной опухоли при наличии её метастазов. От 10 до 15% раковых опухолей характеризуются метастазами в различных органах, полостях и лимфатических узлах.
При морфологической диагностике метастатические опухоли, согласно рекомендациям Европейского общества медицинской онкологии (ESMO, 2004), целесообразно разделять на пять крупных категорий: аденокарцинома, плоскоклеточный рак, нейроэндокринный рак, недифференцированный рак, недифференцированная опухоль. Эти морфологические категории наряду с данными о распространённости процесса во многих случаях позволяют определить адекватный план обследования и лечения.
Частота случаев, когда заболевание сопровождалось развитием метастазов, а локализация первичной опухоли на момент морфологического исследования неизвестна, составляет 3-15% от всех онкологических заболеваний. При этом локализация первичного очага определяется при жизни в среднем у 30-40% пациентов, на аутопсии – у 60-70%.
Иммуногистохимическое исследование в зависимости от морфологического типа новообразования позволяет уточнить гистогенез опухоли и/или высказаться о вероятной локализации первичного очага. Большинство из этих опухолей представляют аденокарциномы молочной железы, толстого кишечника, легких, яичников, поджелудочной железы, предстательной железы и желудка.
В случае метастазов аденокарциномы задача иммуногистохимического исследования состоит в выявлении вероятного источника метастазирования.
Для этих целей в настоящее время используется целый ряд маркеров включая цитокератины 7 и 20, тиреоидный фактор транскрипции (TTF-1), CA125, CDX2, рецепторы к эстрогенам, GCDFP-15, лизоцим, мезотелин, простат-специфический антиген.
Цитокератин 7 (CK7) относится к семейству белков промежуточных филаментов, имеет молекулярную массу 54 кДа, выявляется в различных видах железистого эпителия. Антитела клона OV-TL (Dako) окрашивают цитоплазму различных видов клеток нормального и неопластического железистого эпителия, включая эпителий протоков. CK7 выявляется в клетках цилиндрического и железистого эпителия легких, шейки матки, молочной железы, желчевыводящих путей и собирательных трубочек почек. CK7 окрашивает переходный эпителий мочевого пузыря, эпителий яичников и легких. Иногда можно встретить положительное окрашивание эндотелия сосудов. В свою очередь, CK7 не экспрессируется в эпителиальных клетках желудочно-кишечного тракта, предстательной железы. Практически не выявляется CK7 в гепатоцитах, эпителии проксимальных и дистальных извитых канальцев почек, миоэпителиальных клетках, многослойном эпителии кожи, языка, пищевода и эктоцервикса. Моноклональные антитела OV-TL выявляют отдельные виды аденокарцином и могут быть использованы для проведения дифференциальной диагностики между CK7-позитивными тканями (такими как рак яичников и переходноклеточный рак) и CK7-негативными тканями (такими как аденокарциномы желудочно-кишечного тракта и рак предстательной железы).
Цитокератин 20 (CK20) является представителем кератина I типа, который непосредственно экспрессируется в эпителии желудка и тонкого кишечника, уротелии и клетках Меркеля кожи. Антитела (клон Ks 20.8, Dako) реагируют с соответствующим белком молекулярной массой 46 кДа. CK 20 – это основной белок зрелых энтероцитов и бокаловидных клеток; он специфически экспрессируется в эпителиальных клетках слизистой оболочки желудка и тонкого кишечника. Его также можно выявить в аденокарциномах толстого кишечника, желудка, поджелудочной железы, желчных капилляров, в муцинозных опухолях яичников, переходноклеточном раке мочевого пузыря и раке из клеток Меркеля. В свою очередь, в плоскоклеточных раках, аденокарциномах молочной железы, легких, эндометрия, не муцинозных опухолях яичников и мелкоклеточных карциномах легких CK 20 не экспрессируется.
TTF-1 – ядерный фактор транскрипции, представляющий собой гомеодоменный белок семейства NKX2 (молекулярная масса 40 кДа); экспрессируемый эмбриональной и зрелой тканью легкого и щитовидной железы. В ядрах клеток большинства других органов – печени, желудка, поджелудочной железы, тонкого и толстого кишечника, почек, молочной железы, кожи, яичек, гипофиза, предстательной железы и надпочечников данный фактор не содержится. TTF-1 выявлен в первичных легочных аденокарциномах и не экспрессируется в аденокарциномах толстого кишечника и молочной железы. Антитела к TTF-1 являются ценным маркером при дифференциальной диагностике аденокарциномы легких с метастазами рака молочной железы и мезотелиомы. При выявлении аденокарцином легких с помощью TTF-1 окраска является более специфичной, чем при использовании антисурфактантных антител.
Лизоцим катализирует гидролиз отдельных мукополисахаридов клеточной оболочки бактерий. Используется для выявления опухолей из гистиоцитов и лейкозных клеток миелоидного ряда. Он выявлен в клетках селезенки, легких, почек, лейкоцитах крови, плазматических клетках, слюне, молоке и слезной жидкости.
Мезотелин – клеточный гликопротеин (молекулярная масса 40 кДа), располагается на поверхности мезотелиальных клеток и связан с механизмами клеточной адгезии. Он также выявляется в мезотелиомах, эпителиальных раках яичников и некоторых плоскоклеточных раках. Клон 5В2 (Novocastra) окрашивает эпителиоидные мезотелиомы и аденокарциномы легких, яичников, опухоли брюшины, эндометрия, поджелудочной железы, желудка и толстого кишечника. Антитела не реагируют с тканью почек, печени, плаценты, кожи и щитовидной железы. Мезотелина много в обычных мезотелиальных клетках, из которых формируются злокачественные мезотелиомы и цистаденокарциномы яичников. Эти антитела вместе с антителами к калретинину могут быть использованы для выявления мезотелиом.
CDX2 – рекомбинантный белок прокариотов, соответствующий аминокислотному N-терминальному участку молекулы CDX2 человека. Является специфическим транскрипционным фактором клеток тонкого кишечника. Ген cdx2 кодирует интестинально-специфический транскрипционный фактор, его белок экспрессируется на ранних стадиях развития тонкого кишечника и может иметь значение в регулировании пролиферации и дифференцировки эпителиальных клеток тонкого кишечника. Играет важную роль в инициации дифференцировки клеток в зрелые энтероциты. Клон AMT28 (Novocastra) реагирует с 40кДа белком, расположенным в ядрах клеток. Он экспрессируется в ядрах эпителиальных клеток кишечника от двенадцатиперстной кишки до прямой кишки. Белок CDX2 экспрессируется также в первичных и метастатических опухолях толстого кишечника, а также выявляется при кишечной метаплазии желудка и кишечном типе рака желудка, в свою очередь, в нормальных эпителиальных клетках желудка он не встречается. Данный белок обнаруживается в ядрах только цилиндрического эпителия и раковых клетках колоректальных аденокарцином, таким образом с его помощью можно идентифицировать метастазы рака толстого кишечника.
CA125 – белок ракового антигена яичников. Моноклональные антитела (клон Ov185:1, Novocastra) распознают муциноподобный гликопротеин молекулярной массой около 200 кДа. Антитела окрашивают различные опухоли, такие как аденокарциномы толстого кишечника, аденокарциномы молочной железы, опухоли матки, бронхо-альвеолярные раки, эндометриоидные и серозные аденокарциномы яичников.
ER – рецепторы к эстрогенам. Клон 6F11 (Novocastra) взаимодействует с эстрогеновым рецептором альфа. Антитела окрашивают ядра с рецепторами к эстрогенам в эпителиальных и гладкомышечных клетках матки, а также ядра эпителия молочных желез. Выявление рецепторов к стероидным гормонам широко применяется при лечении гормонально-зависимых опухолей. Наличие рецепторов к эстрогенам является маркером рака молочной железы, а также может свидетельствовать о прогнозе заболевания и эффективности эндокринной терапии.
Простат-специфический антиген (ПСА) – представляет собой гликопротеин. Клон ER-PR8 (Dako) получен к белку молекулярной массой 35 кДа. ПСА биохимически и иммуногистохимически отличается от другого широко используемого маркера опухоли предстательной железы – кислой простатической фосфатазы. Он располагается в цитоплазме клеток ацинарного и протокового эпителия нормальной ткани, выявляется при доброкачественной гиперплазии предстательной железы и аденокарциноме. Эти антитела можно использовать для выявления метастазов рака предстательной железы, поскольку ПСА выделяется опухолевыми клетками простаты и определяется в плазме крови у больных с раком простаты.
GCDFP-15 – белок, который встречается при диффузной кистозной мастопатии, для которой характерны макро- и микрокисты, протоковая и дольковая гиперплазия и др. патология молочных желез. Кисты формируются за счет апокриновой секреции эпителиальными клетками. Жидкость кист содержит гликопротеины, включая уникальный 15 кДа мономер. В нормальной ткани подобный белок встречается в эпителии слезных, подъязычных и мелких слюнных желез, в клетках серозных оболочек, трахеальных и бронхиальных желез.
GCDFP-15 и PSA одновременно экспрессируются в опухолях молочных желез с положительной реакцией на рецепторы к андрогенам. Данный маркер может быть использован для выявления аденокарциномы молочной железы, протоковых раков слюнных желез и апокринового эпителия.
Часть маркеров, такие как ПСА для рака предстательной железы, TTF-1 для рака легких, работают моноспецифично. Другая часть маркеров этой панели характерна для нескольких опухолей: так, рецепторы к эстрогенам могут быть выявлены при раке молочной железы или яичников, CDX2 – при опухолях желудочно-кишечного тракта. Часть маркеров может характеризовать источник метастаза только комплексно: рецепторы к эстрогенам, мезотелин и CA125 характеризуют опухоли яичников.
J.L Dennis с соавт. (2005) предложили алгоритм для выявления локализации первичных опухолей по иммуногистохимической характеристике метастазов с использованием данного набора маркеров:
- ПСА-позитивные опухоли, как правило, в 99% случаев представляют собой рак предстательной железы.
- TTF1-позитивные опухоли, в 98% случаев — рак легких.
- GCDFP-15-позитивные опухоли могут быть либо аденокарциномой толстого кишечника, либо аденокарциномой молочной железы. В данном случае для дифференциальной диагностики используется маркер CDX2. Опухоли CDX2(+) составляют аденокарциномы толстого кишечника, CDX2(–) – аденокарциному молочной железы.
- Положительная реакция с маркерами CDX2 и CK20 наблюдается в метастазах из опухолей желудка, поджелудочной железы и толстого кишечника. Применение дополнительного маркера CK7 позволяет дифференцировать эти опухоли. CK7(+) характерен для аденокарциномы желудка и поджелудочной железы; CK7(–) – характеризует аденокарциному толстого кишечника.
- Рецепторы к эстрогенам встречаются как в опухолях яичников, так и при раке молочной железы. В дифференциальной диагностике этих опухолей помогает маркер мезотелин(+), фенотип характерен для рака яичников; фенотип мезотелин(–) наблюдается при раке молочной железы.
- CA125 является маркером аденокарциномы поджелудочной железы.
- Мезотелин(+) характерен для опухолей желудка или поджелудочной железы.
- Лизоцим(+) выявляет опухоли желудка и поджелудочной железы.
Метастазы плоскоклеточного и нейроэндокринного рака без выявленного
первичного очага (Савелов Н.А., Петровичев Н.Н., 2006)
При метастазах плоскоклеточного рака проводить иммуногистохимическое исследование нецелесообразно, так как возможности метода не позволяют уточнить вероятный источник метастазирования. Это относится и к метастазам низкодифференцированного нейроэндокринного рака. Однако при метастазах высокодифференцированного нейроэндокринного рака (синоним – атипичный карциноид) коэкспрессия CK7 и TTF1 может свидетельствовать о локализации первичного очага в легком, а коэкспрессия CK20 и CDX2 – в органах ЖКТ.
Метастазы недифференцированного рака без выявленного первичного
очага (Савелов Н.А., Петровичев Н.Н., 2006)
У пациентов с метастазами без четких морфологических признаков железистой (аденогенной), нейроэндокринной или плоскоклеточной дифференцировки главной задачей дополнительных методов исследования является уточнение гистогенеза опухоли (точнее, установление направления дифференцировки опухолевых клеток). Для этого применяется следующая панель антител: р63, CК5, CK14 или CК5/CK6, CК18, СD56 (N-CAM).
Антитела к белку Р63 (клон 4А4, Dako). Белок Р63 принадлежит к семейству Р53 опухолевых супрессорных генов, которые также включают белок Р73. Эти белки регулируют процессы клеточной транскрипции и запускают процессы апоптоза в ответ на повреждение ДНК и развитие гипоксии. Р63 экспрессируется в ядрах базальных клеток различных видов эпителия. Белок Р63 выявляется в пролиферирующих клетках эпителия шейки матки, уротелия и предстательной железы. Он также экспрессируется в большинстве низкодифференцированных плоскоклеточных раков. Антитела к Р63 помогают дифференцировать доброкачественные и злокачественные опухоли предстательной железы.
Антитела к белку CD56 (клон МОС-1, Dako). Белок CD56 является антигеном клеток натуральных киллеров. Реагирует с CD4+ и CD8+, Т-клетками в периферической крови. CD56 можно выявить в нейробластоме и мелкоклеточном раке легких, а также некоторых других опухолях.
Цитокератины CK5/CK6 (клон D6/16 B4, Dako). Цитокератины относятся к семейству промежуточных филаментов и выявлены практически во всех клетках. Типы цитокератинов CK5/CK6 выявляются в мезотелиальных клетках и не встречаются в аденокарциномах. CK5/CK6 применяются как маркеры мезотелиомы и плоскоклеточного рака легких, болезни Боуэна (разновидности карциномы, поражающей чешуйчатые клетки эпидермиса кожи, но не распространяющейся на ее базальные слои). Они не встречаются в аденокарциномах легких, но окрашивают мезотелиому и базальные клетки желез простаты. Данные антитела не реагируют с тканями мезодермального происхождения, такими как мышцы и соединительная ткань. Цитокератины CK5/CK6 экспрессируются в низкодифференцированных аденокарциномах и выявляются в эпителиоидных мезотелиомах.
Цитокератин CK14 (клон LL002, BioGenex), молекулярная масса 50 кДа, – это кислый цитокератин первого типа, с помощью которого можно отличить многослойный плоский эпителий от простого эпителия. Цитокератин CK14 равномерно экспрессируется в цитоплазме всех клеток многослойного плоского ороговевающего эпителия. Моноклональные антитела к цитокератину CK14 помогают дифференцировать типы клеток в молочных железах при развитии аденокарциномы.
Цитокератин CK18 (клон DC10, Dako) – белок с молекулярной массой 45 кДа. Антитела реагируют с большинством видов простого эпителия, включая эпителий протоков и ацинусов желез. Данный белок экспрессируется в эпителии щитовидной железы, молочной железы, желудочно-кишечного тракта и дыхательной системы. Антитела используют для выявления аденокарцином легких, при этом они окрашивают цитоплазму опухолевых клеток из эпителия и не окрашивают опухолевые неэпителиальные клетки (глиомы, меланомы, остеосаркомы).
Для дифференциальной диагностики низкодифференцированных опухолей используется следующий алгоритм:
- СК18(+) – аденокарцинома;
- СК5/14(+) и р63(+) – плоскоклеточный рак;
- СК5/CK14(+), СК18(+), р63(+) – переходноклеточный рак, плоскоклеточный рак, тимома;
- СК18(+), CD56(+) – нейроэндокринный рак.
- При выявлении экспрессии СК5/14, СК18 и р63 дифференцировать переходноклеточный рак от плоскоклеточного в ряде случаев возможно, исследуя коэкспрессию СК7 и СК20, которая наблюдается приблизительно в 60% метастазов переходноклеточного рака.
источник