Когда говорят о генетически наследуемых видах рака, чаще всего упоминают рак кишечника, и не только потому, что данное заболевание входит в первую тройку наиболее распространенных видов раковых заболеваний. Известно, что, примерно, 25 процентов из всех людей, страдающих от рака кишечника, вполне могли приобрести данное заболевание наследственным путем, если эта болезнь встречалась и у их более ранних поколений в семье. Эта внушительная цифра послужила причиной многочисленных исследований генетической составляющей данного заболевания. В результате, ученые выделили два основных вида наследуемого рака толстого кишечника.
Данный вид заболевания, который называют еще семейным полипозом толстой кишки, является крайне редким явлением. У тех, у кого развилось данное состояние, появляется буквально тысячи полипов – маленьких наростов ткани на стенках толстой кишки. Эти полипы образованы редчайшим типом клеток, которые называют аденоматозными клетками. Само заболевание передается по наследству посредством доминантного гена, хотя встречаются еще более редкие, приобретенные случаи данного вида рака прямой кишки, которые являются результатом мутировавшего (изменившегося) гена.
Считается, что семейный полипоз толстой кишки обусловлен потерей генетического материала одной из хромосом. Этот утраченный генетический материал может содержать гены, выполнявшие функцию так называемых супрессоров рака, благодаря чему, большинство людей застраховано от развития данного заболевания. В случае же наличия данного заболевания, полипы, большей частью, обнаруживаются, примерно, в возрасте 25-ти лет. В более редких случаях они появляются еще до наступления пубертатного периода. На самом деле, полипы считаются предраковым состоянием, которое, если его не лечить, приводит к развитию рака прямой кишки практически у всех пациентов, примерно, к сорокалетнему возрасту.
Существуют люди с наследственной предрасположенностью к развитию рака кишечника, у которых отсутствуют полипы в толстой кишке. Фактически, речь идет о внушительной группе людей, риск развития рака кишечника у которых составляет 50 процентов. В их случае болезнь возникает в определенной части кишечника, развиваясь крайне быстро. Как правило, в таких семьях можно встретить достаточно много случаев различных раковых заболеваний среди многих предыдущих поколений. Ученым удалось обнаружить особенно явную связь между колоректальным раком и раком матки (рак эндометрия) у женщин. И снова причиной появления данного заболевания у индивидуума является доминантный ген, полученный по наследству. Средний возраст пациентов, у которых обнаруживает рак кишечника, в этом случае не превышает пятидесяти лет, что на 10-15 лет меньше, чем у всей остальной мужской популяции планеты, страдающей от рака толстой кишки.
Генетический скрининг и рак кишечника.
Генетический скрининг рака кишечника действительно дает возможность выявить потенциальный риск развития данного заболевания. Однако, специалисты уверены, что людям, у которых кто-то из предыдущих поколений страдал от полипозного или неполипозного колоректального рака, имеет смысл проходить регулярное и тщательное визуальное обследование на предмет выявления данного заболевания. Рекомендуется начинать обследования с двадцатилетнего возраста и делать их регулярно, сообразно рекомендациям специалистов. Визуальное обследование с помощью метода эндоскопии считается гораздо более надежным и эффективным мероприятием для обнаружения заболевания, нежели чем другие тесты по выявлению опухоли толстой кишки.
источник
Откуда берется и как начинается рак толстой кишки? Этот вопрос часто задают пациенты, и возможно именно сейчас Вы задаетесь этой проблемой. Давайте попробуем ответить на этот вопрос, изучив развитие колоректального рака и установив, кто находится в группе риска.
Рак – это заболевание, которое характеризуется неконтролируемым делением и ростом клеток. При нормальных условиях клетки Вашего организма постоянно воспроизводят сами себя, новые клетки замещают старые, которые со временем отмирают. Этот процесс обязательной и запланированной смерти клеток называется «апоптоз». Когда этот процесс проходит так, как должен, в организме поддерживается баланс между новыми и старыми клетками, и Вы остаетесь здоровым человеком.
Управляют процессом апоптоза гены, которые находятся в ядрах всех клеток. Они состоят из цепей ДНК (дезоксирибонуклеиновой кислоты), с которых считывается информация по функционированию всех процессов организма – от цвета глаз до роста человека. Гены также производят белки, которые служат сигнальными агентами для клеток, передавая им информацию о том, когда и как расти, делиться и умирать.
Рак может образоваться, когда определенный набор этих генов в определенной клетке подвергается постоянному нарушению (это называется мутацией) в течение всей жизни. Мутации могут быть результатом наследственных факторов, образа жизни (курение, диета) или их комбинации.
После мутации гены начинают функционировать ненормально. Они производят избыточное количество белков, стимулирующих рост клеток, и в некоторых случаях, нарушается их способность подавлять опухолевый рост. В результате процесс апоптоза, который сдерживает рост опухоли, перестает работать и клетки не подвергаются саморазрушению, как это происходит в обычных условиях. Эти ненормальные клетки начинают очень быстро делиться, формируя опухоль. Это быстрое деление продолжается, и раковая опухоль увеличивается и распространяется вдаль от места, где она зародилась. Этот процесс называется метастазированием.
К генам, которые участвуют в образовании раковых опухолей толстой кишки, относят:
АРС или р53 (гены, подавляющие опухоль). В норме эти гены подавляют процесс деления клеток и ответственны за сдерживание образования опухолей путем контролирования скорости деления клеток. Утрата или нарушение функции этих генов можно сравнить с поломкой тормозной системы автомобиля: когда не работает ген, наступает неконтролируемый рост клеток, как машина, которая несется без остановки и контроля.
k-RAS онкоген. Обычно онкогены и гены-супрессоры работают вместе и регулируют нормальное деление клеток. Гены супрессоры отвечают за выключение процессов роста клеток, онкогены отвечают за включение этого процесса. Но когда онкоген подвергается мутации и изменяет свою структуру, или случайно удваивается во время деления клеток, он может спровоцировать быстрое деление клеток, которое приводит к образованию раковой опухоли. Если результат мутации гена-супрессора можно сравнить с поломкой тормоза в автомобиле, то мутацию онкогена обычно сравнивают с вжатой в пол педалью газа. Он заставляет клетки делиться без конца, и процесс ненормального деления клеток ускоряется и ускоряется.
Гены hMSH2 и hMLH1. Эти гены производят сигнальные белки, которые ответственны за восстановление или «ремонт» ДНК, в которой могут произойти ошибки при ее удвоении в процессе деления клеток. Мутации этих генов приводят к нарушению процессов восстановления. Считается, что эти ошибки могут накапливаться и приводить к изменению других генов, ответственных за регуляцию клеточного роста.
Последовательность превращений полип-рак.
Считается, что большинство опухолей ободочной и прямой кишок образуются из доброкачественных полипов. Начиная с 1980-х годов важность полипов в образовании раковых опухолей кишечника стала очень актуальной в широких массах после того, как у президента США Рональда Рейгана был обнаружен рак ободочной кишки. Президенту выполнили тест на скрытую кровь в стуле, после которого обнаружили полипы в кишечнике, и один из них оказался злокачественным. Полипы представляют собой округлые образования, которые появляются в результате утолщения внутренней выстилки толстой кишки и выдаются в ее просвет. Полипы могут иметь разную форму: плоскую, или грибовидную (иметь так называемую ножку).
Хотя большинство полипов так и остаются доброкачественными, некоторые, если их не удалить, могут переродиться или трансформироваться в злокачественные (раковые) опухоли. Процесс трансформации полипов скорее всего обусловлен генетическими мутациями в клетках. Бывают разные виды полипов, но считается, что только один вид способен превратиться в раковую опухоль. Этот тип полипов называется аденоматозные полипы.
Пока Вы не сделаете специальное обследование (колоноскопию), Вы не можете быть уверены в том, что в Вашем кишечнике нет полипов, потому что полипы не вызывают никаких симптомов. Большие полипы или опухоли могут приводить к возникновению симптомов – кровотечение, кровь в стуле, анемия или нарушение проходимости кишечника. Эти симптомы достаточно редки и начинают появляться только тогда, когда полипы становятся очень большими или злокачественными.
Рак толстой кишки не развивается за один день, считается, что для перерождения полипа в злокачественную опухоль требуется 5-10 лет. Если в течение многих лет в Вашем кишечнике существует аденоматозный полип, и Вы об этом не знаете, так как не делаете специального обследования, рано или поздно он может превратиться в опухоль. Когда опухоль растет, она увеличивается в размере, врастает глубже в стенку кишки и даже может прорасти в соседние органы. Если опухолевые клетки попадут в лимфоузлы или в кровеносные сосуды, они разносятся по организму и образуют метастазы опухоли в других органах – печени, легких, головном мозге. На этой стадии заболевания лечение становится очень сложным.
В заключение: Почти все раковые опухоли ободочной и прямой кишки развиваются из-за мутации генов. Многие из мутаций, которые приводят к образованию колоректального рака, включают нарушение или потерю генов, подавляющих образование опухоли, или поддерживающих нормальный режим роста и деления клеток. Распространено мнение, что внешние факторы не вызывают напрямую образование рака, а лишь запускают генетические мутации, которые приводят к его появлению. Говоря другими словами, если гены сравнить с лампочкой, которую можно включить, то внешние факторы – это выключатель, при нажатии которого включаются эти гены. Но даже в том случае, если Вы унаследовали «плохие» гены, вы можете уменьшить риск заболевания, проходя регулярное обследование и ведя здоровый образ жизни. Таким образом, необходимо понимать Ваши персональные факторы риска колоректального рака – те условия, которые повышают или понижают вероятность заболевания
Миф первый. Рак толстой кишки бывает только у пожилых людей, молодые люди им не болеют.
Согласно статистике, частота возникновения колоректального рака увеличивается с возрастом, но даже несмотря на это, у молодых людей в 20-30 лет может развиться рак толстой кишки. Известно, что около 7% случаев заболеваемости колоректальным раком приходится на людей моложе 50 лет. У молодых людей, уже перенесших колоректальный рак, риск образования второй злокачественной опухоли кишечника значительно выше. Поэтому, несмотря на то, что рак толстой кишки чаще всего поражает людей старше 50 лет, это заболевание может случиться и с молодыми людьми. И следует всегда помнить, что если эта болезнь выявляется на ранней стадии, ее можно полностью излечить в более, чем 90% случаев.
Миф второй. Колоректальным раком болеют в основном мужчины.
Не верьте этому. Хотя существуют заболевания, которыми преимущественно болеют мужчины или женщины, колоректальный рак не из их числа. Эта болезнь, которая одинаково часто случается как у мужчин, так и у женщин. Дорогие женщины – думать, что раком толстой кишки болеют только мужчины, опасно. Вам необходимо знать и уметь выявить основные симптомы этого заболевания так же, как знаете возможные проявления рака груди или шейки матки. Необходимо включать в регулярные обследования, наряду с маммографией и мазками из влагалища, также и специальные исследования для диагностики колоректального рака.
Миф третий. В моей семье ни у кого не было рака толстой кишки, поэтому я не вхожу в группу риска.
Столько много людей считают именно так, и это так печально! Действительно, если у человека несколько членов семьи предыдущих поколений имели рак толстой кишки, это приводит к значительному увеличению риска заболевания у последующих поколений. Тем не менее, необходимо понять, что около 80% больных колоректальным раком не имели случаев этого заболевания в семье. Давайте на время забудем о статистике, и поговорим о реальной жизни. Любой хирург колопроктолог подтвердит, что очень большое количество людей, у которых никто в семье никогда не болел раком толстой кишки, заболевают этим недугом и часто обращаются к врачу уже на запущенной стадии. Они не обследовались, думая, что это обследование им не нужно, так как никто в их семье не имел такого заболевания. Однако, если бы удалось диагностировать болезнь на ранней стадии, ее можно было бы вылечить без следа.
Миф четвертый. Если я чувствую себя хорошо, мне не надо волноваться, что у меня может быть рак кишечника.
Это самый ужасный миф из всех. Как Вы думаете, какой самый частый симптом рака толстой кишки на ранней стадии? Думаете, это кровь в стуле или запор? Нет. На самом деле, рак ранней стадии никак себя не проявляет, у него нет особенных симптомов. Люди с колоректальным раком ранней стадии чувствуют себя хорошо, их состояние никак не меняется по сравнению с обычным самочувствием. Только когда опухоль увеличивается, она может давать о себе знать. Сейчас считается, что у обычного человека рак кишечника развивается из полипов, которые в течение длительного времени перерождаются в опухоль. Пока эта опухоль небольшая, она не приводит к появлению боли или других симптомов. Если обнаружить опухоль на ранней стадии, человека можно вылечить от рака. Не надо дожидаться симптомов заболевания, лучше проходить регулярные обследования, пока Вы чувствуете себя хорошо.
Миф пятый. Рак всегда начинается с появления крови в стуле.
В основе этого мифа лежит доля правды. У всех людей появление крови в стуле вызывает страх. В большинстве случаев выделение крови из прямой кишки связано с геморроем. Да, раковые опухоли кишечника могут приводить к выделению крови из прямой кишки. Однако ее количество может быть небольшим и даже невидимым без микроскопа. В некоторых случаях при опухолях кишечника может совсем не быть крови в стуле. Если же кровотечение есть, но оно незаметное, то его проявлениями могут повышенная усталость, которая связана с анемией и недостатком железа в крови. Выявить анемию можно только, сделав общий анализ крови, при котором подсчитывается количество эритроцитов, содержание гемоглобина и гематокрит. Появление крови в стуле – это только один из возможных симптомов большой раковой опухоли толстой кишки. Помните, что небольшие опухоли на ранней стадии могут никак себя не проявлять (см. миф четвертый). При большой опухоли могут появляться характерные симптомы (см. таблицу). Могут произойти нарушения эвакуации стула из-за того, что опухоль суживает просвет кишечника, и стул не может пройти через место сужения. При этом человек может страдать от запоров, тошноты, вздутия живота, может меняться форма стула – становиться лентообразной, может быть ощущение неполного опорожнения кишечника. При более запущенных стадиях могут быть снижение аппетита, необъяснимая потеря веса. Эти симптомы возникают из-за того. что, увеличиваясь и распространяясь, опухоль выбрасывает в кровь особые вещества. Поэтому, если у Вас есть какие-либо из перечисленных симптомов, следует немедленно обратиться к врачу.
Пожалуйста, не давайте возможности этим мифам встать на пути возможного спасения Вашей или другой жизни!
Лист оценки симптомов колоректального рака.
Как и большинству людей, возможно, Вам неудобно обсуждать функционирование своего кишечника. Тем не менее, Вам придется изменить свои взгляды. Если Вы сами не скажете доктору о необычных симптомах, например, изменение формы стула, он или она никогда об этом не узнают и скорее всего даже не спросят! Вот краткое перечисление того, на что нужно обращать внимание.
Пожалуйста, не пугайтесь! Большинство из этих симптомов встречаются у многих людей и не связаны с раком. Тем не менее, позвольте это решить Вашему доктору.
* Изменение режима и характера опорожнения кишки – единовременные или хронические поносы или запоры, неприятные ощущения при опорожнении кишки, изменение формы стула (тонкий, как карандаш, или тоньше, чем обычно), ощущение неполного опорожнения кишки.
* Необычные ощущение, связанные с кишечником, такие как – повышенное газообразование, боль, тошнота, вздутие живота, ощущение переполнения кишечника.
* Кровотечение (светло-красная или очень темная кровь в стуле).
* Необъяснимый дефицит железа.
На предоперационном этапе выполняются необходимые исследования для подготовки к операции, консультации со специалистами, а также подготовительное лечение (внутривенные инфузии, специальное питание, лечение сопутствующих заболеваний). Второй этап – операция. И третий (послеоперационный) этап – восстановление после операции и выписка домой.
Длительность нахождения больного в клинике зависит от вида заболевания и его тяжести, от количества необходимых обследований, типа операции, а также от течения послеоперационного периода.
В связи со стремлением клиник снизить расходы, связанные с нахождением больных в стационаре в предоперационном периоде, в настоящее время имеется тенденция к выполнению многих обследований в амбулаторном порядке. Это означает, что до операции пациент приходит в клинику только для выполнения назначенных исследований, и после этого возвращается домой. После того, как все исследований выполнены, врач назначает день операции, и пациент госпитализируется в клинику накануне (за 1-2 дня до назначенного срока). Во многих странах Европы и США пациенты, которым планируются хирургическое вмешательство, приезжают в клинику рано утром в день операции, проходят небольшую подготовку в специальной предоперационной палате и через 2-3 часа отправляются в операционную. Нахождение больного дома среди близких людей вплоть до дня операции позволяет снизить стресс, связанный с необходимостью хирургического вмешательства. Однако в нашей стране в связи с особенностями юридического оформления истории болезни подобная практика затруднена, и для выполнения большой колоректальной операции больному необходимо госпитализироваться накануне или за несколько дней до хирургического вмешательства.
Предоперационное обследование.
После того, как у пациента заподозрен рак толстой кишки, и планируется выполнение операции, требуются еще несколько важных обследований, которые необходимо сделать перед хирургическим вмешательством.
Это обследование ставит перед собой две основные цели. Во-первых, при выполнении нескольких исследований можно определить стадию опухоли и степень ее распространения. Определение стадии опухоли в предоперационном периоде поможет правильно выбрать тактику лечения. Очевидно, что лечение рака ободочной кишки, при котором имеются метастазы в печень, будет сильно отличаться от лечения небольшой опухоли, которая не выходит за пределы кишечной стенки. Во-вторых, дополнительные исследования помогут оценить общее состояние здоровья и переносимость операции. Так как хирургическое вмешательство является сильным стрессом для организма и способно спровоцировать ухудшение существующих проблем с легкими, сердцем, почками и другими органами, выполнение специальных исследований поможет определить тех пациентов, у которых повышен риск возникновения осложнений со стороны этих органов во время и после операции.
Рентгенография грудной клетки . Основной целью этого исследования является оценка наличия метастазов рака в легкие. Это стандартное исследование, которое с достаточно большой точностью может определить, есть ли в легких опухолевые узлы. Кроме того, с помощью рентгенографии грудной клетки можно выявить признаки заболевания сердца и легких. Поэтому это исследование выполняется стандартно всем пациентам перед большими операциями.
Компьютерная томография (КТ) брюшной полости и грудной клетки. С помощью этого исследования можно оценить состояние печени и брюшной полости на наличие очагов метастазирования опухоли. Если выполняется КТ грудной клетки вместе с исследованием брюшной полости, тогда выполнения обычной рентгенографии грудной клетки не требуется.
Магнитно-резонансная томография (МРТ) малого таза . Это исследование позволяет получить четкие изображения органов малого таза, оценить степень распространения опухоли прямой кишки, поражение лимфатических узлов, вовлечение в опухоль мышц анального канала. В отличие от рентгенографии и КТ при МРТ пациенты не подвергаются действию ионизирующего излучения.
Позитронно-эмиссионная томография (ПЭТ). При этом виде обследования используется контрастное вещество, содержащее радиоактивную форму глюкозы, которая помогает определять места в теле человека, где находится опухоль. Хотя этот метод позволяет с большой точностью определить «скрытые» метастазы опухоли, которые нельзя выявить с помощью КТ или МРТ, в настоящее время ПЭТ не является методом выбора при предоперационном обследовании пациентов колоректальным раком.
Ультразвуковое исследование (УЗИ) брюшной полости . С помощью этого метода можно определить состояние практически всех органов брюшной полости, заподозрить наличие метастазов опухоли в других органах, чаще всего в печени. Также можно оценить состояние почек, поджелудочной железы, желчного пузыря. При невозможности выполнения КТ органов брюшной полости данное исследование является методом выбора для оценки наличия или отсутствия отдаленных метастазов.
Трансректальное ультразвуковое исследование (ТРУЗИ). Это исследование выполняется с помощью специального датчика, который заводится в прямую кишку через анальный канал. Этот метод позволяет выявить степень прорастания опухолью стенки прямой кишки, оценить состояние близлежащих лимфатических узлов и сфинктеров прямой кишки. При невозможности выполнения МРТ органов малого таза является методом выбора для оценки распространения опухоли прямой кишки.
Анализы крови . Стандартный набор анализов крови включает: общий анализ крови, биохимический анализ крови и исследование свертываемости крови.
В общем анализе крови оценивается общее количество эритроцитов (красных кровяных клеток), гемоглобина, лейкоцитов (белых кровяных клеток) и тромбоцитов. Эти клетки играют решающую роль в жизнедеятельности организма. Эритроциты, с помощью содержащегося в них гемоглобина, являются переносчиком кислорода и ответственны за снабжение кислородом всех тканей и органов. При раке ободочной кишки из опухоли может происходить кровотечение, поэтому количество эритроцитов у таких пациентов может быть снижено. В тяжелых случаях после операции, а иногда и до операции может потребоваться переливание крови. Так как тромбоциты играют важную роль в нормальном свертывании крови (образовании тромбов), подсчет этих кровяных телец является необходимым исследованием. Если у больного не было в течение жизни эпизодов ненормального кровотечения, такого как обильное носовое кровотечения или кровотечение из десен зубов, скорее всего отклонений в этом анализе не будет. Тем не менее, изучение количества тромбоцитов очень важно для определения возможных рисков кровотечения во время операции.
В составе биохимического анализа крови оцениваются электролиты плазмы, такие как ионы калия и натрия. Уровень этих ионов может быть сильно низким или наоборот высоким у пациентов, принимающих лекарства от повышенного артериального давления или другие препараты. Перед операцией необходимо восстановить нормальный уровень этих ионов в плазме крови.
Профиль свертываемости крови оценивает эффективность образования тромбов, это необходимо знать, так как свертываемость крови может быть нарушена у пациентов с гемофилией или нарушениями других факторов свертывания крови.
Также обязательными анализами, которые делают всем пациентам перед операцией, являются определение группы крови и резус-фактора . так как эти данные могут потребоваться для переливания крови, и определение маркеров инфекционных заболеваний – вирусных гепатитов (В и С), сифилиса, ВИЧ-инфекции. При отсутствии всех этих анализов выполнение операции невозможно.
Электрокардиография (ЭКГ) . Это простой скрининговый тест, который позволяет определить функцию сердца. С помощью него можно определить признаки атеросклеротической болезни сердца (сужение артерий сердца), которая является серьезным риском при выполнении операции. ЭКГ-признаки перенесенного инфаркта миокарда или ишемии сердца (недостаток кровоснабжения его отдельных участков из-за недостаточного притока крови) являются признаками атеросклеротического поражения коронарных артерий (артерий сердца). При получении ненормальной картины на ЭКГ может потребоваться выполнение дополнительных исследований, которые назначит Ваш врач или кардиолог.
Что взять с собой в больницу.
Вы должны быть готовы к тому, что Вам придется оставаться в клинике на протяжении нескольких дней. Будьте практичными и руководствуйтесь здравым смыслом. Не берите с собой ценные вещи, модную одежду или большое количество денег. Возьмите с собой небольшую сумку с самыми необходимыми вещами. Вам потребуется компрессионный трикотаж для ног, который помогает снизить риск образования тромбов во время продолжительной операции. Это могут эластичные бинты или специальные компрессионные чулки. Сразу после операции для защиты швов передней брюшной стенки Вам необходимо будет постоянно носить бандаж – это специальный широкий эластичный пояс, который помогает поддерживать мышцы передней брюшной стенки в моменты, когда на нее оказывается сильное давление – когда Вы встаете, кашляете, садитесь или наклоняетесь. Вы будете находиться в постели только в течение одного или двух дней после операции, после этого Вам будет предложено вставать и ходить. Вам может быть удобно носить халат или удобную пижаму, а также тапочки с нескользкими подошвами. После операции в течение какого-то времени из швов может выделяться небольшое количество раневого отделяемого, которое даже через стерильную повязку может испачкать одежду. Поэтому приготовьте два комплекта одежды и не берите дорогие или любимые вещи, так как в больнице они могут испортиться.
Не забывайте такие туалетные принадлежности, как зубная щетка, зубная паста, расческа, дезодорант, духи или одеколон, они помогут Вам почувствовать себя «человеком» после операции. Во время операции пациентам нельзя находиться в контактных линзах, поэтому в день операции не надевайте их, вместо этого лучше одеть очки, а контактные линзы оставьте на время после операции. Перед операцией отдайте ценные вещи и кошелек членам своей семьи, оставьте небольшое количество денег для оплаты за телевидение или телефон. Вам также может пригодиться хорошая книга, несколько журналов или набор для рукоделия, которые помогут Вам скоротать время во время последних дней нахождения в клинике, когда Вы будете чувствовать себя лучше.
Если Вы постоянно принимаете какие-то лекарства (например, против высокого артериального давления или диабета) обязательно возьмите их с собой. Очень важно, чтобы Вы продолжали принимать эти лекарства вплоть до дня операции, если Ваш доктор не назначит Вам что-то другое.
источник
Рак толстой кишки занимает 2-е место по смертности от злокачественных новообразований. По мере старения общества показатель летальности от рака этой локализации будет увеличиваться. Это неудивительно, если вспомнить об этиологии заболевания и особенностях патоморфологических изменений толстой кишки: ее слизистая оболочка представлена одноклеточным эпителием с быстрым периодом полного обновления и постоянной экспозицией к воздействию канцерогенных факторов.
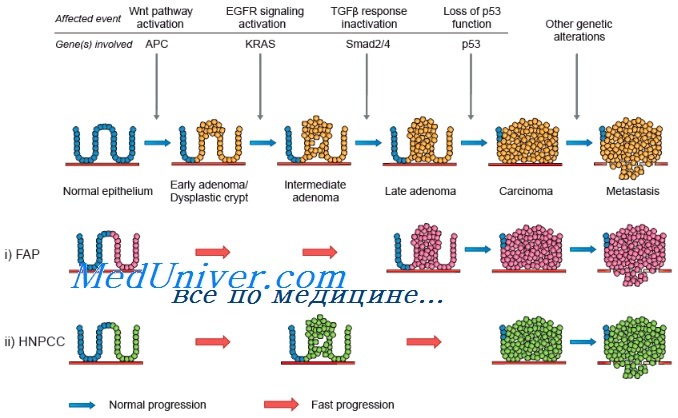
Следовательно, ДНК этих клеток постоянно и быстро делится и реплицируется. В результате вероятность накопления ошибок и злокачественной трансформации со временем увеличивается. Модель рака толстой кишки, разработанная Vogelstein и соавт., иллюстрирует эти механизмы. Мутации гена-супрессора аденоматозного полипоза толстой кишки (adenomatous polyposis coli, АРС) ведут к разрастанию полипов толстой кишки в раннем возрасте. Для уточнения характера любого заболевания толстой кишки можно легко получить образец ткани путем биопсии. По мере роста полипа он становится доступен для обследования гастроэнтерологом с использованием ряда исследований. Рак толстой кишки хорошо изучен также потому, что существуют семьи, члены которых подвержены редкому заболеванию — семейному аденоматозному полипозу толстой кишки. У этих больных толстая кишка покрывается сотнями и тысячами полипов, один или несколько из которых, как правило, малигнизируются в зрелом возрасте.
Именно у этой категории больных впервые был обнаружен ген АРС. В большинстве спорадических опухолей толстой кишки выявляют соматические мутации гена АРС. В более редких семейных случаях отмечается мутация гена АРС, передающаяся по наследству и в связи с этим присутствующая во всех эпителиальных клетках кишечника, что и предрасполагает к развитию полипов. Соматическая мутация ведет к активации онкогена ras и ускорению роста полипа, который, тем не менее, еще остается доброкачественным. Однако с годами полип может приобрести мутации генов-супрессоров DCC и ТР53, которые ведут к автономному неконтролируемому росту злокачественных клеток рака толстой кишки.
Семейная предрасположенность к раку толстой кишки достаточно широко распространена и делится на две группы: с образованием полипов и без них. Полипозы включают семейный аденоматозный полипоз толстой кишки, синдром Пейтца— Егерса, семейный ювенильный полипоз и гиперпластический полипоз. Риск рака толстой кишки у всех больных с названными синдромами повышен. Например, медиана возраста появления рака толстой кишки при семейном аденоматозном полипозе составляет 40 лет.
К синдромам без полипоза относится наследственный неполипозный колоректальный рак (ННПКРР). У этих пациентов злокачественную опухоль толстой или прямой кишки выявляют в возрасте около 40 лет. У большинства больных ННПКРР идентифицируют генетические дефекты в системе репарации ДНК. Мутации происходят в основном в гене MLH1, однако результаты последних исследований свидетельствуют о частом поражении таких генов, как MSH2 и MSH6. ННПКРР сопровождается и другими онкологическими заболеваниями: раком эндометрия (РЭ), раком яичника (РЯ), раком молочной железы (РМЖ) и опухолями нервной системы.
Семейный рак толстой кишки составляет примерно 3—5 % всех случаев рака этой локализации. Однако риск рака толстой кишки также повышен у родственников больных любой формой этого заболевания. Поэтому в большинстве случаев рака толстой кишки можно наблюдать, по крайней мере отчасти, наследственный компонент. Факторы окружающей среды играют важную роль в развитии заболевания; полученные данные указывают, что диета с высоким содержанием клетчатки может снижать вероятность развития рака толстой кишки. Фактор риска — рацион питания с высоким содержанием жира и красного мяса.
Молекулярные изменения, происходящие при раке толстой кишки, хорошо исследованы Vogelstein и соавт., подробно описавшими прогрессию нормального эпителия в рак. Первыми генами, для которых была установлена связь с раком толстой кишки, стали гены семейства ras, изначально выявленные в вирусах саркомы крыс. Эти гены наиболее часто обнаруживают в промежуточных полипах толстой кишки без дисплазии. В аденомах на ранних стадиях мутации ras встречаются редко, но в промежуточных полипах — регулярно, что свидетельствует о важной роли этих генов в раннем развитии рака толстой кишки.
Опухолевый ген-супрессор АРС принимает участие на самых первых этапах канцерогенеза при раке толстой кишки и был выявлен в исследованиях по изучению утраты гетерозиготности, показавших часто встречающуюся утрату длинного плеча хромосомы 5 (5q). Еще один ген, связанный с развитием рака толстой кишки, — ген-супрессор ТР53, расположенный на коротком плече хромосомы 17 (17р). Мутация этого гена — относительно позднее событие при раке толстой кишки. ТР53 — важный ген в контроле клеточного цикла и апоптоза. Утрата гена-супрессора DCC на длинном плече хромосомы 18 (18q) происходит на промежуточных и поздних этапах канцерогенеза при раке толстой кишки. Этот ген кодирует белок, ответственный за клеточную адгезию.
Ген DPC4, также расположенный на длинном плече хромосомы 18, вовлечен в сигнальную систему, связанную с трансформирующим фактором роста b.
При развитии рака толстой кишки происходит последовательное приобретение ряда мутаций. Для развития злокачественной опухоли обязательного прохождения всех этапов не требуется, однако предполагается, что необходимо по меньшей мере 6 или 7 генетических событий. У больных наследственным неполипозным колоректальным раком (ННПКРР) эти мутации развиваются вследствие неспособности эпителиальных клеток слизистой оболочки кишечника выявлять и устранять ошибки, происходящие во время нормального клеточного деления. Исследования Vogelstein и соавт. продемонстрировали модель, которая может быть применена и к другим опухолям.
Эта работа подробно иллюстрирует поэтапную природу канцерогенеза и взаимодействие генов-супрессоров и онкогенов, однако не объясняет поздних механизмов прогрессии опухоли, в частности приобретения ею инвазивности и способности к метастазированию. Данные свойства опухолевых клеток могут быть объяснены мутациями в других генах, которые еще только предстоит выявить. Тем не менее рак толстой кишки представляет удобную модель для исследователей, изучающих различные опухоли. Цель исследований — описать естественное течение опухолевого заболевания как ряд генетических событий, происходящих в определенной относительно небольшой группе генов. Такая «генетическая история» даст четкие представления всех молекулярных изменений, необходимых для трансформации нормальной клетки в опухолевую, и, в свою очередь, определит мишени для будущих диагностических и терапевтических методов.
С недавних пор для исследования генетических изменений при широком спектре злокачественных новообразований используют технологию биочипов. Определение «молекулярной» стадии онкологического заболевания позволяет выявлять генетические нарушения, связанные с прогрессированием опухоли. Информацию о типах этих молекулярных изменений (на генном или белковом уровне) можно использовать для определения прогноза заболевания и его лечения. Биочипы применяют при раке толстой кишки для получения полных сведений о генетических изменениях, связанных с заболеванием. Сообщение Eschrich и соавт. свидетельствует о том, что в скором будущем исследование молекулярных особенностей рака толстой кишки приобретет клиническое значение.
источник
Ваш семейный анамнез дает почву для подозрений на вероятность развития наследственного рака толстой кишки? В этом случае наши специалисты рекомендуют пройти генетический тест.
Колоректальный рак (CRC) затрагивает 1 из 20 человек. Приблизительно 25% всех случаев колоректального рака являются, назовем их «наследственными», предполагающими сильное влияние генетического фактора, разумеется, в совокупности с остальными факторами. Но лишь примерно 5% от всех случаев колоректального рака являются чисто наследственными.
Наследственный неполипозный колоректальный рак, также известный как синдром Линча (LS) составляет большинство этих наследственных случаев колоректального рака (2-3% от общего объема случаев).
Как происходит обследование?
- Этап 1: Знакомство с пациентом, обсуждение персональной и семейной медицинской истории. Разъяснение вариантов генетического тестирования
- Этап 2: Взятие генетического образца для анализа и отправка его в лабораторию
- Этап 3: Генетическое тестирование. В лаборатории, генетическое тестирование для большинства генов включает в себя секвенирование следующего поколения и / или анализ экзона Арай
- Этап 4: Обсуждение результатов генетических тестов и доступных вариантов медицинского управления с пациентом
- Этап 5: Обсуждение результатов теста, медицинских способов управления, а так же последствий для членов семьи пациента.
Клинические показания для прохождения генетического теста :
Сдать панель генетических маркеров на колоректальный рак рекомендуется пациенту, чей диагноз и / или семейная история дает повод предполагать возможность наследственного колоректального рака. К таким показаниям относят :
Ранний возраст начала рака:
• Колоректальный рак или рак эндометрия в возрасте до 50 лет
• Диагноз колоректальный рак в возрасте до 60 и MSI-H (высокочастотная нестабильность микросателлита) в гистологии
Множественные кумулятивные полипы у пациента :
• Более 10 колоректальных аденоматозных полипов
• Многочисленные желудочно-кишечные гамартомные полипы
Пациент с несколькими связанными первичными случаями колотерального рака или синдромом Линча
Последняя редакция норм Bethesda, отвечающих критериям, принятым на конгрессе Амстердам II
Семейная история :
• Пациент с семейной историей наследственного колоректального рака, с или без мутации.
• Несколько близких членов семьи с этим заболеванием или с ассоциированным Синдром Линча.
Преимущества испытаний и управления рисками
Обнаружение патогенной мутации поможет связать клинический фенотип с точным типом наследственного колоректального рака или связанным с ним синдромом, для определения правильной стратегии наблюдения /управления болезнью.
Стратегия наблюдения включает в себя:
Для синдрома Lynch
Наблюдение
- Толстая и прямая кишка: колоноскопия через каждые 1-2 года, начиная с 20-25 лет
- Эндометрий и яичники: Гинекологический скрининг рака
- Другие методы:
> Эзофагогастродуоденоскопия (ЭГДС), включая боковой обзор каждые 1-2 года, начиная с возраста 30-35
> Ежегодный анализ мочи, начиная с 30-35 лет
> Ежегодный медицинский осмотр, включая осмотр на рак кожи
Профилактические хирургические меры :
- Профилактическая колэктомия у молодых пациентов с колоректальным раком
- Профилактическая гистерэктомия и / или двустороннее удаление придатков матки, после рождения ребенка и если больше рождение детей не планируется
Семейный аденоматозный полипоз (FAP)
Наблюдение :
- Толстая & и прямая кишка: Колоноскопия каждые 1-2 года, начиная с возраста 10-12 лет
- Другие методы:
› Эзофагогастродуоденоскопия (ЭГДС), включая боковой обзор каждые 1-3 года, начиная с момента, когда колоректальный полипоз диагностирован в возрасте 20-25
› Ежегодный осмотр включая УЗИ шейки матки, начиная с возраста 25-30 лет
Профилактические хирургические меры :
- Профилактическая колэктомия, если полипы становятся неуправляемы
Для аттенуированного семейного аденоматозного полипоза (aFAP)
Наблюдение
Толстая & и прямая кишка: Колоноскопия каждые 2 года, начиная с возраста 18-20 лет
- Другие методы:
› Эзофагогастродуоденоскопия (ЭГДС), включая боковой обзор каждые 1-3 года, начиная с момента, когда колоректальный полипоз диагностирован в возрасте 20-25
› Ежегодный осмотр включая УЗИ шейки матки, начиная с возраста 25-30 лет
Профилактические хирургические меры :
Профилактическая колэктомия, если полипы становятся неуправляемы
Для MUTYH-Ассоциированного полипоза
Наблюдение
Толстая & и прямая кишка: Колоноскопия каждые 2 года, начиная с возраста 18-20 лет
- Другие методы:
› Эзофагогастродуоденоскопия (ЭГДС), включая боковой обзор каждые 1-3 года, начиная с возраста 20-25
Профилактические хирургические меры :
Профилактическая колэктомия, если полипы становятся неуправляемы
При синдроме Пейтца-Егерса
Наблюдение
- Толстая & и прямая кишка: Колоноскопия каждые 2-3 года, начиная с момента появления симптомов или самое позднее в подрастковом возрасте
- Другие методы:
› Эзофагогастродуоденоскопия (ЭГДС), включая боковой обзор каждые 2-3 года, начиная с возраста 10 лет - Магнитный резонансная холангиопанкреатография и/или УЗИ поджелудочной железы каждые 1-2 года, начиная с 30 лет
- Ежегодная маммография и МРТ молочных желез, начиная с 25 лет
- Клинические анализы молочной железы, начиная с 25 лет
- Ежегодное обследование органов малого таза, PAP тест и интравагинальное УЗИ, начиная с возраста 18 лет
- Ежегодный тестикулярный анализ, начиная с 10 лет
Для синдрома юношеского полипоза
- Толстая & и прямая кишка: Колоноскопия каждые 2-3 года, начиная с момента появления симптомов или самое позднее в подрастковом возрасте
- Другие методы:
› Эзофагогастродуоденоскопия (ЭГДС) каждые 1-3
Что исследуем ?
| Ген | Каталог фенетических маркеров человека | Связанное с ним заболевание / Фенотип | Фенотип по каталогу фенетических маркеров человека |
| APC | 611731 | Семейный аденоматозный полипоз 1 (FAP1) / Атенуированный аденоматозный полипоз FAP | 175100 |
| BMPR1A | 601299 | Синдром юношеского полипоза | 174900 |
| MLH1 | 120436 | Синдром Линча (HNPCC), синдром Мюир-Торра | 609310, 158320 |
| MSH2 | 609309 | Синдром Линча (HNPCC), синдром Мюир-Торра | 120435, 158320 |
| MSH6 | 600678 | Синдром Линча (HNPCC), Рак эндометрия, семейный | 614350, 608089 |
| MUTYH | 604933 | Аденоматоз, множественный колотеральный (FAP2) | 608456 |
| PMS2 | 600259 | СиндромЛинча(HNPCC) | 614337 |
| PTEN | 601728 | Синдром Каудена | 158350 |
| SMAD4 | 600993 | Юношеский полипозный синдром | 174900 |
| STK11 | 602216 | Синдром Пейтца Йегерса | 175200 |
| TP53 | 191170 | Колотеральный рак | 114500 |
Технические детали
Методология
- Прицельное изучение всех кодирующих экзонов и экзон-интронов с последующей расшифровкой генетических последовательностей.
- Деление и дупликация по методу MLPA (Мультиплексная амплификация лигированных зондов)
Сроки ожидания результата
В среднем 6 недель. Срочное тестирование возможно по запросу
источник
Генетическое исследование, которое позволяет выявить общую наследственную предрасположенность к колоректальному раку и к предраковым аденоматозным полипам толстой кишки. Оно заключается в исследовании генетического маркера LOC727677 (Location:8q24.21), связанного с повышенным риском развития колоректального рака.
Какой биоматериал можно использовать для исследования?
Буккальный (щечный) эпителий, венозную кровь.
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Колоректальный рак (рак толстой и прямой кишок) – одно из самых распространенных онкологических заболеваний в мире. Около 10 % населения имеет генетическую предрасположенность к нему. Прежде всего в группу риска входят люди, в семье которых были онкопатологии.
Симптомы колоректального рака многочисленны и неспецифичны. Зачастую он развивается из образовавшихся ранее аденоматозных полипов. Своевременное выявление и удаление полипов толстой кишки может предотвратить развитие рака и характеризуется благоприятным прогнозом, поэтому регулярное обследование так важно. Из диагностических инструментальных исследований используются ирригоскопия или колоноскопия с биопсией для подтверждения ткани опухоли. Лечение колоректального рака зависит от его расположения, размера и степени распространения, а также возраста и состояния здоровья пациента. Хирургическая операция является распространенным методом лечения колоректального рака.
Генетическое исследование заключается в анализе состояния генетического маркера LOC727677 G(g.41686854)T, характеризующего риск колоректального рака. Анализ выявляет общую предрасположенность и не связан с диагностикой редких форм раннего семейного рака прямой кишки, ассоциированных с генами MSH2 и MLH1 (наследственный неполипозный рак толстого кишечника, синдром Линча). Локус LOC727677 (8q24) – это область, непосредственно взаимодействующая с геном MYC, который часто играет ведущую роль в развитии злокачественных новообразований, вследствие нарушения регуляции синтеза протоонкогенов (они кодируют белки, участвующие в контроле роста, деления и дифференцировки клеток).
Внутренняя поверхность толстой кишки контактирует с большим количеством факторов, способных приводить к повреждению клеток. Поэтому клетки, выстилающие стенку кишечника, постоянно обновляются. Мутация, которая затрагивает ген, контролирующий рост клеток, может привести к их неконтролируемому делению, что, как правило, вызывает предраковую опухоль (аденоматозный полип). Если вовремя не начать лечение, в конечном итоге она может перерасти в рак.
При выявлении генетического риска при отсутствии патологии основным методом профилактики является длительное диспансерное наблюдение, своевременное лечение всех предопухолевых состояний и устранение факторов, повышающих риск рака.
Факторы, способствующие развитию колоректального рака:
- особенности питания (высокое содержание в рационе мяса и продуктов, богатых животными жирами, и низкое содержание растительной пищи);
- чрезмерное употребление алкоголя;
- курение;
- возраст старше 55 лет;
- малоподвижный образ жизни;
- наследственность (возможность наследственной передачи болезни доказывает наличие семейных полипозных синдромов; отмечается возрастание риска развития колоректального рака приблизительно в 3 раза среди родственников первой степени родства больных раком или полипами толстой кишки);
- воспалительные заболевания кишечника (неспецифический язвенный колит, болезнь Крона, панколит с давностью заболевания более 10 лет);
- аденома толстой кишки в анамнезе;
- диффузный семейный полипоз, одиночные и множественные полипы, ворсинчатые опухоли;
- рак внутренних половых органов или молочной железы в анамнезе у женщин;
- синдромы семейного рака;
- иммунодефицитные состояния;
- работа на вредном производстве (высокая частота колоректального рака среди работников асбестных производств).
Когда назначается исследование?
- При семейном анамнезе по заболеванию (наличие у близких родственников диагностированного колоректального рака или аденоматозного полипоза).
- При первичных опухолях, локализованных как в пределах толстой кишки, так и в других органах (молочных железах, матке, простате).
G/G
G/T
T/T
Клинически значимые генотипы, связанные с увеличением риска развития колоректального рака: G/G, G/T. У пациентов с такими вариантами генотипа риск повышен в 1,5-2 раза по сравнению с общепопуляционным.
Отсутствие мутации по исследованному генетическому маркеру не исключает колоректального рака вследствие других причин, в том числе наследственных онкологических синдромов.
Генетические маркеры
- CA 242
- Раковый эмбриональный антиген (РЭА)
- Анализ кала на скрытую кровь
- Цитологическое исследование материала, полученного при эндоскопии (ФГДС, бронхоскопия, ларингоскопия, цистоскопия, ректороманоскопия, колоноскопия)
- Гистологическое исследование операционного материала
- Tomlinson et al., A genome-w >17618284]
- Tuupanen S et al., The common colorectal cancer predisposition SNP rs6983267 at chromosome 8q24 confers potential to enhanced Wnt signaling., Nat. Genet., 2009 Aug;41(8):885-90. [PM >19561604]
- Zanke et al., Genome-w >18268117]
- Tuupanen S. et al., Allelic imbalance at rs6983267 suggests selection of the risk allele in somatic colorectal tumor evolution, Cancer Res. 2008 Jan 1;68(1):14-7. [PMID: 18172290]
- Matsuo K., Association between an 8q24 locus and the risk of colorectal cancer in Japanese, BMC Cancer. 2009 Oct 26;9:379. [PMID: 19857256]
источник
Высокая заболеваемость раком заставляет онкологов ежедневно трудиться над вопросами ранней диагностики и эффективного лечения. Генетический анализ на рак – это один из современных способов профилактики онкозаболеваний. Однако, так ли достоверно это исследование и всем ли оно должно назначаться? – вопрос, который беспокоит и ученых, и врачей, и пациентов.
Сегодня генетический анализ на рак позволяет выявить риск развития онкопатологий:
- молочной железы;
- яичников;
- шейки матки;
- простаты;
- легких;
- кишечника и толстой кишки в частности.
Также, существует генетическая диагностика на некоторые врожденные синдромы, существование которых повышает вероятность развития рака нескольких органов. Например, синдром Ли-Фраумени говорит о риске рака мозга, надпочечников, поджелудочной железы и крови, а синдром Пейтца-Егерса говорит о вероятности онкопатологий пищеварительной системы (пищевод, желудок, кишечник, печень, поджелудочная железа).
На сегодня ученые обнаружили ряд генов, изменения в которых в большинстве случаев приводят к развитию онкологии. Ежедневно в нашем организме развиваются десятки злокачественных клеток, но иммунная система, благодаря особым генам, способна с ними справиться. А при поломках в тех или иных структурах ДНК, эти гены работают неправильно, что дает шанс развитию онкологии.
Так, гены BRCA1 и BRCA2 защищают женщин от развития рака яичников и молочных желез, а мужчин – от рака предстательной железы. Поломки в этих генах напротив показывают, что имеется риск развития карциномы данной локализации. Анализ на генетическую предрасположенность к раку как раз дает информацию об изменениях в этих и других генах.
Поломки в этих генах передаются по наследству. Всем известен случай Анджелины Джоли. В ее семье был случай рака молочной железы, поэтому актриса решила пройти генетическую диагностику, которая и выявила мутации в генах BRCA1 и BRCA2. Правда, единственное, чем смогли помочь врачи в этом случае – провести операцию по удалению груди и яичников, чтобы не было точки приложения для мутировавших генов.
Противопоказаний к сдаче данного анализа не существует. Однако, не стоит его делать в качестве рутинного обследования и приравнивать к анализу крови. Ведь не известно, как результат диагностики повлияет на психологическое состояние пациента. Поэтому назначаться анализ должен только при наличии строгих к тому показаний, а именно зарегистрированных случаев рака у кровных родственников или при имеющемся у пациента предраковом состоянии (например, доброкачественное образование молочной железы).
Генетический анализ достаточно прост для пациента, так как проводится путем одного забора крови. После кровь подвергается молекулярно-генетическому исследованию, что позволяет определить мутации в генах.
В лаборатории имеется несколько реактивов, специфичных для той или иной структуры. За один забор крови может проводиться обследование на поломки в нескольких генах.
Специальной подготовки исследование не требует, однако следовать общепринятым правилам при сдаче крови не помешает. К таким требованиям относится:
- Исключение алкоголя за неделю до диагностики.
- Не курить в течение 3-5 дней перед сдачей крови.
- За 10 часов до обследования не есть.
- В течение 3-5 дней до сдачи крови придерживаться диеты с исключением жирных, острых и копченых продуктов.
Наиболее изученным является обнаружение поломок в генах BRCA1 и BRCA2. Однако, с течением времени врачи стали замечать, что годы генетического исследования значительно не повлияли на смертность женщин от рака молочной железы и яичников. Поэтому в качестве скринингового метода диагностики (проводимого каждому человеку) метод не годиться. А как обследование групп риска генетическая диагностика имеет место.
Основной акцент анализа на генетическую предрасположенность к раку состоит в том, что при поломке в определенном гене человек имеет риск развития рака или же риск передачи этого гена своим детям.
Доверять или нет полученным результатам – личное дело каждого пациента. Возможно, не следует при отрицательном результате проводить превентивное лечение (удаление органа). Однако, если поломки в генах обнаружены, то пристально следить за своим здоровьем и регулярно проводить профилактическую диагностику определенно стоит.
Чувствительность и специфичность – это понятия, которые показывают достоверность теста. Чувствительность говорит о том, сколько процентов пациентов с дефектным геном будет выявлено данным тестом. А показатель специфичности говорит о том, что с помощью данного теста будет обнаружена именно та поломка гена, которая кодирует предрасположенность к онкологии, а не к другим заболеваниям.
Определить процентные показатели для генетической диагностики рака достаточно сложно, так как исследовать нужно много случаев положительных и отрицательных результатов. Возможно, позже ученые смогут дать ответ на данный вопрос, но уже сегодня можно с точностью утверждать, что обследование имеет высокую чувствительность и специфичность, и на его результаты можно полагаться.
Полученный ответ не может на 100% уверить пациента в том, что он заболеет или не заболеет раком. Отрицательный результат генетического тестирования говорит о том, что риск развития рака не превышает средних цифр в популяции. Положительный ответ дает более точную информацию. Так, у женщин с мутациями в генах BRCA1 и BRCA2 риск карциномы груди составляет 60-90%, а карциномой яичников – 40-60%.
Данный анализ не имеет четких показаний к сдаче, будь то определенный возраст или состояние здоровья больного. Если у матери 20-ти летней девушки был обнаружен рак молочной железы, то ей не стоит ждать 10 или 20 лет чтобы обследоваться. Рекомендовано тут же пройти генетическое исследование на рак, чтобы подтвердить или исключить мутацию генов, кодирующих развитие онкопатологий.
Касательно опухолей предстательной железы, каждому мужчине после 50 лет с аденомой простаты или хроническим простатитом полезно будет провести генетическую диагностику, чтобы так же оценить риск. А вот выполнять диагностику лицам, в семье которых не было случаев злокачественной болезни, скорее всего неуместно.
Вы не уверены в правильности поставленного диагноза и назначенного Вам лечения? Ваши сомнения поможет развеять видеоконсультация специалиста мирового уровня. Это реальная возможность воспользоваться квалифицированной помощью лучших из лучших и при этом ни за что не переплачивать.
Показанием к проведению генетического анализа на рак являются случаи выявления злокачественных новообразований у кровных родственников. А назначаться обследование должно врачом-генетиком, который после и оценит результат. Возраст пациента для сдачи теста не имеет никакого значения, так как поломка в генах заложена с рождения, поэтому если в 20 лет гены BRCA1 и BRCA2 в норме, то выполнять то же исследование через 10 и более лет смысла нет.
При правильном проведении диагностики каких-либо экзогенных факторов, которые могут повлиять на результат нет. Однако, у небольшого количества пациентов в ходе обследования могут обнаруживаться генетические поломки, интерпретация которых невозможна по причине недостаточной изученности. И в сочетании неизвестных изменений с мутациями в раковых генах, могут повлиять на результат тестирования (т.е. снижается специфичность метода).
Генетический анализ на рак – это не исследование с четкими нормами, не стоит надеяться, что пациент получит на руки результат, где будет четко написано “низкий”, “средний” или “высокий” риск развития рака. Результаты обследования могут оцениваться только врачом-генетиком. На окончательный вывод влияет история семьи пациента:
- Развитие злокачественных патологий у родственников до 50 лет.
- Возникновение опухолей одной и той же локализации в нескольких поколениях.
- Повторные случаи рака у одного и того же человека.
Сегодня подобная диагностика не оплачивается страховыми компаниями и фондами, поэтому все расходы пациент вынужден брать на себя.
В Украине исследование одной мутации стоит около 250 грн. Однако, для достоверности данных должно быть исследовано несколько мутаций. Например, для рака молочной железы и яичников исследуется 7 мутаций (1750 грн.), для рака легких – 4 мутации (1000 грн.).
В России генетический анализ на рак молочной железы и яичников стоит порядка 4500 руб.
источник
Научный руководитель проекта ГЕНОМЕД
Геномед – это инновационная компания с командой врачей-генетиков и неврологов, акушеров гинекологов и онкологов, биоинформатиков и лабораторных специалистов, представляющая комплексную и высокоточную диагностику наследственных заболеваний, нарушений репродуктивной функции, подбор индивидуальной терапии в онкологии.
В сотрудничестве с мировыми лидерами в области молекулярной диагностики мы предлагаем более 200 молекулярно-генетических исследований, основаных на самых современных технологиях.
Использование секвенирования нового поколения, микроматричного анализа с мощными методами биоинформационного анализа позволяют быстро поставить диагноз и подобрать правильное лечение даже в самых сложных случаях.
Наша миссия заключается в предоставлении врачам и пациентам комплексных и экономически эффективных генетических исследований, информационную и консультационную поддержку 24 часа в сутки.
Окончила педиатрический факультет Воронежского государственного медицинского университета им. Н.Н. Бурденко в 2014 году.
2015 — интернатура по терапии на базе кафедры факультетской терапии ВГМУ им. Н.Н. Бурденко.
2015 — сертификационный курс по специальности «Гематология» на базе Гематологического научного центра г. Москвы.
2015-2016 – врач терапевт ВГКБСМП №1.
2016 — утверждена тема диссертации на соискание ученой степени кандидата медицинских наук «изучение клинического течения заболевания и прогноза у больных хронической обструктивной болезнью легких с анемическим синдромом». Соавтор более 10 печатных работ. Участник научно-практических конференций по генетике и онкологии.
2017 — курс повышения квалификации по теме: «интерпретация результатов генетических исследований у больных с наследственными заболеваниями».
С 2017 года ординатура по специальности «Генетика» на базе РМАНПО.
Канивец Илья Вячеславович, врач-генетик, кандидат медицинских наук, руководитель отдела генетики медико-генетического центра Геномед. Ассистент кафедры медицинской генетики Российской медицинской академии непрерывного профессионального образования.
Окончил лечебный факультет Московского государственного медико-стоматологического университета в 2009 году, а в 2011 – ординатуру по специальности «Генетика» на кафедре Медицинской генетики того же университета. В 2017 году защитил диссертацию на соискание ученой степени кандидата медицинских наук на тему: Молекулярная диагностика вариаций числа копий участков ДНК (CNVs) у детей с врожденными пороками развития, аномалиями фенотипа и/или умственной отсталостью при использовании SNP олигонуклеотидных микроматриц высокой плотности»
C 2011-2017 работал врачом-генетиком в Детской клинической больнице им. Н.Ф. Филатова, научно-консультативном отделе ФГБНУ «Медико-генетический научный центр». С 2014 года по настоящее время руководит отделом генетики МГЦ Геномед.
Основные направления деятельности: диагностика и ведение пациентов с наследственными заболеваниями и врожденными пороками развития, эпилепсией, медико-генетическое консультирование семей, в которых родился ребенок с наследственной патологией или пороками развития, пренатальная диагностика. В процессе консультации проводится анализ клинических данных и генеалогии для определения клинической гипотезы и необходимого объема генетического тестирования. По результатам обследования проводится интерпретация данных и разъяснение полученной информации консультирующимся.
Является одним из основателей проекта «Школа Генетики». Регулярно выступает с докладами на конференциях. Читает лекции для врачей генетиков, неврологов и акушеров-гинекологов, а также для родителей пациентов с наследственными заболеваниями. Является автором и соавтором более 20 статей и обзоров в российских и зарубежных журналах.
Область профессиональных интересов – внедрение современных полногеномных исследований в клиническую практику, интерпретация их результатов.
Прием врачей осуществляется по предварительной записи.
Шарков Артём Алексеевич – врач-невролог, эпилептолог
В 2012 году обучался по международной программе “Oriental medicine” в университете Daegu Haanu в Южной Корее.
С 2012 года — участие в организации базы данных и алгоритма для интерпретации генетических тестов xGenCloud (http://www.xgencloud.com/, Руководитель проекта — Игорь Угаров)
В 2013 году окончил Педиатрический факультет Российского национального исследовательского медицинского университета имени Н.И. Пирогова.
C 2013 по 2015 год обучался в клинической ординатуре по неврологии в ФГБНУ «Научный центр неврологии».
С 2015 года работает неврологом, научным сотрудником в Научно- исследовательском клиническом институте педиатрии имени академика Ю.Е. Вельтищева ГБОУ ВПО РНИМУ им. Н.И. Пирогова. Также работает врачом- неврологом и врачом лаборатории видео-ЭЭГ мониторинга в клиниках «Центр эпилептологии и неврологии им. А.А.Казаряна» и «Эпилепси-центр».
В 2015 году прошел обучение в Италии на школе «2nd International Residential Course on Drug Resistant Epilepsies, ILAE, 2015».
В 2015 году повышение квалификации — «Клиническая и молекулярная генетика для практикующих врачей», РДКБ, РОСНАНО.
В 2016 году повышение квалификации — «Основы молекулярной генетики» под руководством биоинформатика, к.б.н. Коновалова Ф.А.
С 2016 года — руководитель неврологического направления лаборатории «Геномед».
В 2016 году прошел обучение в Италии на школе «San Servolo international advanced course: Brain Exploration and Epilepsy Surger, ILAE, 2016».
В 2016 году повышение квалификации — «Инновационные генетические технологии для врачей», «Институт лабораторной медицины».
В 2017 году – школа «NGS в медицинской генетике 2017», МГНЦ
В настоящее время проводит научные исследования в области генетики эпилепсии под руководством профессора, д.м.н. Белоусовой Е.Д. и профессора, д.м.н. Дадали Е.Л.
Утверждена тема диссертации на соискание ученой степени кандидата медицинских наук «Клинико-генетические характеристики моногенных вариантов ранних эпилептических энцефалопатий».
Основные направления деятельности – диагностика и лечение эпилепсии у детей и взрослых. Узкая специализация – хирургическое лечение эпилепсии, генетика эпилепсий. Нейрогенетика.
Шарков А., Шаркова И., Головтеев А., Угаров И. «Оптимизация дифференциальной диагностики и интерпретации результатов генетического тестирования экспертной системой XGenCloud при некоторых формах эпилепсий». Медицинская генетика, № 4, 2015, с. 41.
*
Шарков А.А., Воробьев А.Н., Троицкий А.А., Савкина И.С., Дорофеева М.Ю., Меликян А.Г., Головтеев А.Л. «Хирургия эпилепсии при многоочаговом поражении головного мозга у детей с туберозным склерозом.» Тезисы XIV Российского Конгресса «ИННОВАЦИОННЫЕ ТЕХНОЛОГИИ В ПЕДИАТРИИ И ДЕТСКОЙ ХИРУРГИИ». Российский Вестник Перинатологии и Педиатрии, 4, 2015. — с.226-227.
*
Дадали Е.Л., Белоусова Е.Д., Шарков А.А. «Молекулярно-генетические подходы к диагностике моногенных идиопатических и симптоматических эпилепсий». Тезис XIV Российского Конгресса «ИННОВАЦИОННЫЕ ТЕХНОЛОГИИ В ПЕДИАТРИИ И ДЕТСКОЙ ХИРУРГИИ». Российский Вестник Перинатологии и Педиатрии, 4, 2015. — с.221.
*
Шарков А.А., Дадали Е.Л., Шаркова И.В. «Редкий вариант ранней эпилептической энцефалопатии 2 типа, обусловленной мутациями в гене CDKL5 у больного мужского пола». Конференция «Эпилептология в системе нейронаук». Сборник материалов конференции: / Под редакцией: проф. Незнанова Н.Г., проф. Михайлова В.А. СПб.: 2015. – с. 210-212.
*
Дадали Е.Л., Шарков А.А., Канивец И.В., Гундорова П., Фоминых В.В., Шаркова И,В,. Троицкий А.А., Головтеев А.Л., Поляков А.В. Новый аллельный вариант миоклонус-эпилепсии 3 типа, обусловленный мутациями в гене KCTD7// Медицинская генетика .-2015.- т.14.-№9.- с.44-47
*
Дадали Е.Л., Шаркова И.В., Шарков А.А., Акимова И.А. «Клинико-генетические особенности и современные способы диагностики наследственных эпилепсий». Сборник материалов «Молекулярно-биологические технологии в медицинской практике» / Под ред. чл.-корр. РАЕН А.Б. Масленникова.- Вып. 24.- Новосибирск: Академиздат, 2016.- 262: с. 52-63
*
Белоусова Е.Д., Дорофеева М.Ю., Шарков А.А. Эпилепсия при туберозном склерозе. В «Болезни мозга, медицинские и социальные аспекты» под редакцией Гусева Е.И., Гехт А.Б., Москва; 2016; стр.391-399
*
Дадали Е.Л., Шарков А.А., Шаркова И.В., Канивец И.В., Коновалов Ф.А., Акимова И.А. Наследственные заболевания и синдромы, сопровождающиеся фебрильными судорогами: клинико-генетические характеристики и способы диагностики. //Русский Журнал Детской Неврологии.- Т. 11.- №2, с. 33- 41. doi: 10.17650/ 2073-8803- 2016-11- 2-33- 41
*
Шарков А.А., Коновалов Ф.А., Шаркова И.В., Белоусова Е.Д., Дадали Е.Л. Молекулярно-генетические подходы к диагностике эпилептических энцефалопатий. Сборник тезисов «VI БАЛТИЙСКИЙ КОНГРЕСС ПО ДЕТСКОЙ НЕВРОЛОГИИ» / Под редакцией профессора Гузевой В.И. Санкт- Петербург, 2016, с. 391
*
Гемисферотомии при фармакорезистентной эпилепсии у детей с билатеральным поражением головного мозга Зубкова Н.С., Алтунина Г.Е., Землянский М.Ю., Троицкий А.А., Шарков А.А., Головтеев А.Л. Сборник тезисов «VI БАЛТИЙСКИЙ КОНГРЕСС ПО ДЕТСКОЙ НЕВРОЛОГИИ» / Под редакцией профессора Гузевой В.И. Санкт-Петербург, 2016, с. 157.
*
Головтеев А.Л., Шарков А.А., Троицкий А.А., Алтунина Г.Е., Землянский М.Ю., Копачев Д.Н., Дорофеева М.Ю. «Хирургическое лечение эпилепсии при туберозном склерозе» под редакцией Дорофеевой М.Ю., Москва; 2017; стр.274
*
Статья: Генетика и дифференцированное лечение ранних эпилептических энцефалопатий. А.А. Шарков*, И.В. Шаркова , Е.Д. Белоусова , Е.Л. Дадали. Журнал неврологии и психиатрии, 9, 2016; Вып. 2doi: 10.17116/jnevro 20161169267-73
*
Головтеев А.Л., Шарков А.А., Троицкий А.А., Алтунина Г.Е., Землянский М.Ю., Копачев Д.Н., Дорофеева М.Ю. «Хирургическое лечение эпилепсии при туберозном склерозе» под редакцией Дорофеевой М.Ю., Москва; 2017; стр.274
*
Новые международные классификации эпилепсий и эпилептических приступов Международной Лиги по борьбе с эпилепсией. Журнал неврологии и психиатрии им. C.C. Корсакова. 2017. Т. 117. № 7. С. 99-106
В 2011 году Окончила Московский Государственный Медико-Стоматологический Университет им. А.И. Евдокимова по специальности «Лечебное дело» Обучалась в ординатуре на кафедре Медицинской генетики того же университета по специальности «Генетика»
В 2015 году окончила интернатуру по специальности Акушерство и Гинекология в Медицинском институте усовершенствования врачей ФГБОУ ВПО «МГУПП»
С 2013 года ведет консультативный прием в ГБУЗ «Центр Планирования Семьи и Репродукции» ДЗМ
С 2017 года является руководителем направления «Пренатальная Диагностика» лаборатории Геномед
Регулярно выступает с докладами на конференциях и семинарах. Читает лекции для врачей различных специальной в области репродуции и пренатальной диагностики
Проводит медико-генетическое консультирование беременных по вопросам пренатальной диагностики с целью предупреждения рождения детей с врождёнными пороками развития, а так же семей с предположительно наследственной или врожденной патологией. Проводит интерпретацию полученных результатов ДНК-диагностики.
Латыпов Артур Шамилевич – врач генетик высшей квалификационной категории.
После окончания в 1976 году лечебного факультета Казанского государственного медицинского института в течение многих работал сначала врачом кабинета медицинской генетики, затем заведующим медико-генетическим центром Республиканской больницы Татарстана, главным специалистом министерства здравоохранения Республики Татарстан, преподавателем кафедр Казанского медуниверситета.
Автор более 20 научных работ по проблемам репродукционной и биохимической генетики, участник многих отечественных и международных съездов и конференций по проблемам медицинской генетики. Внедрил в практическую работу центра методы массового скрининга беременных и новорожденных на наследственные заболевания, провел тысячи инвазивных процедур при подозрении на наследственные заболевания плода на разных сроках беременности.
С 2012 года работает на кафедре медицинской генетики с курсом пренатальной диагностики Российской академии последипломного образования.
Область научных интересов – метаболические болезни у детей, дородовая диагностика.
Время приема: СР 12-15, СБ 10-14
Прием врачей осуществляется по предварительной записи.
В 2009 году закончил лечебный факультет КГМУ им. С. В. Курашова (специальность «Лечебное дело»).
Интернатура в Санкт-Петербургской медицинской академии последипломного образования Федерального агентства по здравоохранению и социальному развитию (специальность «Генетика»).
Интернатура по терапии. Первичная переподготовка по специальности «Ультразвуковая диагностика». С 2016 года является сотрудником кафедры кафедры фундаментальных основ клинической медицины института фундаментальной медицины и биологии.
Сфера профессиональных интересов: пренатальная диагностика, применение современных скрининговых и диагностических методов для выявления генетической патологии плода. Определение риска повторного возникновения наследственных болезней в семье.
Участник научно-практических конференций по генетике и акушерству и гинекологии.
Консультация по предварительной записи
Прием врачей осуществляется по предварительной записи.
Окончила в 2015 году Московский Государственный Медико-Стоматологический Университет по специальности «Лечебное дело». В том же году поступила в ординатуру по специальности 30.08.30 «Генетика» в ФГБНУ «Медико-генетический научный центр».
Принята на работу в лабораторию молекулярной генетики сложно наследуемых заболеваний (заведующий – д.б.н. Карпухин А.В.) в марте 2015 года на должность лаборанта-исследователя. С сентября 2015 года переведена на должность научного сотрудника. Является автором и соавтором более 10 статей и тезисов по клинической генетике, онкогенетике и молекулярной онкологии в российских и зарубежных журналах. Постоянный участник конференций по медицинской генетике.
Область научно-практических интересов: медико-генетическое консультирование больных с наследственной синдромальной и мультифакториальной патологией.
Консультация врача-генетика позволяет ответить на вопросы:
являются ли симптомы у ребенка признаками наследственного заболевания какое исследование необходимо для выявления причины определение точного прогноза рекомендации по проведению и оценка результатов пренатальной диагностики все, что нужно знать при планировании семьи консультация при планировании ЭКО выездные и онлайн консультации
Является выпускницей медико-биологического факультета Российского Национального Исследовательского Медицинского Университета имени Н.И. Пирогова 2015 года, защитила дипломную работу на тему «Клинико-морфологическая корреляция витальных показателей состояния организма и морфофункциональных характеристик мононуклеаров крови при тяжелых отравлениях». Окончила клиническую ординатуру по специальности «Генетика» на кафедре молекулярной и клеточной генетики вышеупомянутого университета.
ринимала участие в научно-практической школе «Инновационные генетические технологии для врачей: применение в клинической практике», конференции Европейского общества генетики человека (ESHG) и других конференциях, посвященных генетике человека.
Проводит медико-генетическое консультирование семей с предположительно наследственной или врожденной патологией, включая моногенные заболевания и хромосомные аномалии, определяет показания к проведению лабораторных генетических исследований, проводит интерпретацию полученных результатов ДНК-диагностики. Консультирует беременных по вопросам пренатальной диагностики с целью предупреждения рождения детей с врождёнными пороками развития.
Врач-генетик, врач акушер-гинеколог, кандидат медицинских наук.
Специалист в области репродуктивного консультирования и наследственной патологии.
Окончила Уральскую государственную медицинскую академию в 2005 году.
Ординатура по специальности «Акушерство и гинекология»
Интернатура по специальности «Генетика»
Профессиональная переподготовка по специальности «Ультразвуковая диагностика»
- Бесплодие и невынашивание беременности
- Планирование беременности
- Беременность высокого риска
- Генетическая тромбофилия
- Вопросы пренатальной диагностики
- Наследственная патология в семье
Помимо консультирования пациентов, занимается научной и преподавательской деятельностью – работает в должности доцента на кафедре акушерства и гинекологии факультета повышения квалификации УГМУ.
Регулярно участвует в научных конференциях и симпозиумах.
Является автором ряда статей и методических рекомендаций.
Работает в МЦ «Геномед» с 2015 года
Общий стаж работы – 11 лет
Является выпускницей Нижегородской государственной медицинской академии, лечебного факультета (специальность «Лечебное дело»). Окончила клиническую ординатуру ФБГНУ «МГНЦ» по специальности «Генетика». В 2014 году проходила стажировку в клинике материнства и детства (IRCCS materno infantile Burlo Garofolo, Trieste, Italy).
С 2016 года работает на должности врача-консультанта в ООО «Геномед».
Регулярно участвует в научно-практических конференциях по генетике.
Основные направления деятельности: Консультирование по вопросам клинической и лабораторной диагностики генетических заболеваний и интерпретация результатов. Ведение пациентов и их семей с предположительно наследственной патологией. Консультирование при планировании беременности, а также при наступившей беременности по вопросам пренатальной диагностики с целью предупреждения рождения детей с врожденной патологией.
источник