Карциномы ЖКТ
Колоректальный рак является третьим по частоте диагностируемым раком в Соединенных Штатах (за исключением рака кожи) среди мужского и женского населения. Показатели заболеваемости колоректальным раком снижаются на протяжении последних двух десятилетий (с 66,3 случаев на 100000 человек в 1985 году до 45,5 случаев в 2006 году). Это связывают с увеличением использования колоректальных скрининг-тестов, которые позволяют обнаруживать и удалять полипы ЖКТ до их перерождения в рак. В отличие от общего сокращения, среди взрослого молодого населения в возрасте до 50 лет, для которого скрининг не рекомендуется из-за средней степени риска, заболеваемость раком ободочной и прямой кишки увеличивались с 1994 года примерно на 2% в год у мужчин и женщин.
В 2016 году США смертность от колоректального рака ожидается на уровне 49500 случаев. Смертность от колоректального рака снизились в обоих группах мужчин и женщин за последние несколько десятилетий, с более крутым снижением в последний период времени. Это снижение отражает снижение показателей заболеваемости и улучшение ранней диагностики и лечения.
Признаки и симптомы
Ранние стадии рака ободочной и прямой кишки обычно не имеют симптомов, поэтому, чтобы выявить заболевание на этой ранней стадии часто необходим скрининг. Прогрессирование болезни может вызвать кровотечение из прямой кишки, появление крови в кале, изменение в опорожнении кишечника, схваткообразные боли в нижней части живота.
Иммуногистохимия (ИГХ) при раке толстой кишки
Применение ИГХ при раках толстого кишечника рассматривается на нескольких уровнях: для характеристики опухолей (эндокринный или эпителиальный тип), наследственной предрасположенности и для целей прогноза. Преобладающее использование ИГХ это определение возможных или предполагаемых метастазов, в которых толстой кишки является возможным первичным. Типичной локализацией для метастазов толстой кишки являются печень и легкие, оба органа, которые могут производить морфологию рака идентичную метастазам из толстой кишки. ИГХ, ( класс I правил регулирования FDA), используется после первичной диагностики опухоли путем гистопатологического исследования и не включается для клиницистов как независимое исследование.
Метастатическая карцинома
Наиболее часто применение иммуногистохимии в изучени опухолей печени – это определение источника метастаза, когда первичная локализация опухоли не известна. Развитие и применение панели для иммунных окрашиваний может помочь решить почти все диагностические проблемы. 2-6 Цитокератины (CK) 7 и CK 20 – первая ступень в идентификации многих опухолей и с дополнительными иммунными реакциями относительно специфичными для опухолей женского и мужского полового тракта, нередко дает возможность идентифицировать первичную локализацию метастатической опухоли.
Иммуногистохимические исследования (ИГХ) , как правило, не требуются для оценки доброкачественных и злокачественных эпителиальных опухолей желудка, так как гистопатология, как правило, обеспечивает диагностику, но ИГХ нужна при изучении метастатического рака желудка, когда источник происхождения опухоли не ясен, или когда макроскопические / рентгенологическое проявления опухоли сбивают с толку (например, рак желудка напрямую и широко прорастает в печень и гистологически неотличим от холангиокарциномой). К тому же, ИГХ может быть полезна для идентификации некоторых вариантов желудочных карцином, включая гепатоидную аденокарциному, в которой печеночная дифференцировка может быть подтверждена позитивной реакцией на альфа-фетопротеин AFP.
Аденокарцинома
Нейроэндокринная карцинома
Нейроэндокринная карцинома характеризуется положительным окрашиванием на синаптофизин, хромогранин, виллин и CD57.17-18 В отличие от аденокарциномы желудка, раки, происходящие во второй части двенадца-типерстной кишки могут быть отрицательными для обоих маркеров- синаптофизина и хромогранина, но часто вступают в реакцию с антителами против соматостатина. Маркер пролиферации Ki-67 и молекула адгезии Е-кадгерин, были использованы для оценки агрессивности нейроэндокринных carcinoma.19 Увеличение индекса пролиферации Ki-67 ( 20% для G1, G2, G3 и поражений соответственно) 20 предсказывает агрессивное поведение, и потеря Е-кадгерина может предсказать развитие метастазов в лимфатических узлах.
Желудочно-кишечная аденокарцинома с нейроэндокринной дифференцировкой
Аденокарцинома желудка, как кишечного типа, так и типа перстневидноклеточной карциномы, могут иметь нейроэндокринную дифференцировку и что может быть не очевидно по гистологической картине, но проявляться по окрашиванию хромогранином и /или синаптофизином.
ГИСТ — гастроинтестинальные стромальные опухоли
Антитело против CD117 окрашивает большинство случаев гастроинтестинальных стромальных опухолей (ГИСТ), в том числе метастазов.21-25 Хотя могут быть вариации в распределении CD117(+) клеток в пределах данной опухоли, в большинстве случаев окрашивание является диффузным. Когда реакция на CD117 положительна в опухолях отличных от ГИСТ, окрашивание почти всегда неоднородно. Окрашивание на CD34 также можно увидеть в ГИСТ. ГИСТ негативны на CD117 в 10 -15% случаев. Антитело Dog1, как было показано, маркирует большинство CD117 отрицательных ГИСТ.26 Кроме того, потеря SDHB, как было доказано, — постоянный признак ГИСТ с дефицитом SDHB, что ,таким образом, может быть полезным для выявления особого варианта этого заболевания.
Толстый кишечник. Аденома и аденокарцинома.
Аденомы (трубчатые аденомы, тубулярные аденомы, аденомы ворсинок) демонстрируют те же иммуногистохимические реакции, что и аденокарцинома кишки. Почти все они реагируют с антителами, направленными против CK 20 и меньшинство также окрашивается очагово с CK 7, в отличие от панкреатических аденокарцином, большинство из которых являются CK 20 отрицательными и положительными по СК 7. Дифференциальная диагностика метастатической колоректальногй аденокарциномы и аденокарциномы, возникающей в других местах зачастую представляет из себя сложную задачу.
Легочная аденокарцинома может напоминать колоректальную. CK 7 и CK 20 могут быть полезными в этой ситуации, поскольку CK 7, как правило, сильно положителен в аденокарциноме легкого, а CK 20 обычно отрицателен; обратная картина наблюдается с колоректальными аденокарциномами. Кроме того, транскрипционный фактор щитовидной железы 1 (TTF-1) обычно положителен в раковых заболеваниях легких, а CDX-2 и бета-катенин как правило положительны в колоректальном раке. Карциномы эндометриоидного типа могут также гистологически быть неотличимы от колоректальной карциномы. Здесь, опять же, CK 7 положителен почти во всех эндометриоидных аденокарциномах и лишь слегка реактивен в колоректальной аденокарциноме. CK 20, как правило, негативен для первичных опухолей легких, но дает положительный результат на ободочной и прямой кишке.
Аденокарцинома аппендикса
Аденокарциномы аппендикса, как правило, показывают окрашивание на MUC5AC, в отличие от аденокарциномы ободочной кишки, в которой данное антитело редко реактивно. Это особенно полезно при изучении муцинозных аденокарцином, которые образуют метастазы в брюшной полости. Бета-катенин является еще одной мишенью дифференцировочных антител, положительных почти во всех ободочных аденокарциномах и отрицательных в аденокарциноме аппендикса.
У женщин с абдоминальным муцинозным карциноматозом, различие ободочной и аппендикулярной аденокарциномы из яичников играет важную роль. В ободочной опухоли, часто экспрессируются виллин и бета-катенин; в метастазах в аппендиксе часто экспрессирован виллин, но бета-катенин является редким и в овариальных муцинозных аденокарциномах ни виллин, ни бета-катенин не выявляются.
Подобно поражениям аппендикса, аденокарциномы экспрессируют MUC5AC и подобно колоректальным аденокарциномам, яичниковые муцинозные аденокарциномы экспрессируют CDX-2. Полезными добавками к основным панелям для неизвестных первичных опухолей, в которых подозреваются аппендикулярные или муцинозные опухоли яичников, являются MUC5AC и бета-катенин. Виллин также может быть полезным, поскольку он обычно имеет “brush-border” картину окрашивания и в ободочной и в аппендикулярной аденокарциномах и, как правило, цитоплазматическую в поражениях яичников и поджелудочной железы.
Инвазивная аденокарцинома протоков
Аденокарциномы поджелудочной железы, как правило, происходят из предшествующих стадий дисплазии протока поджелудочной железы. Иммуногистохимический паттерн высокодифференцированных панкреатических интраэпителиальных неоплазий такой же, как у инвазивной аденокарциномы поджелудочной железы и не может быть использован для их дифференциальной диагностики.
Аденокарцинома протока поджелудочной железы напоминают аденокарциному желчных протоков и желчного пузыря по картине световой микроскопии, а также по иммунофенотипическим проявлениям. Панкреатические аденокарциномы реагируют с антителами к различным цитокератинам, в том числе CK 8, CK 17, CK 18, CK 19, CAM 5.2 и AE1 & AE3.5,32. Аденокарциномы поджелудочной железы, как правило, являются CK 7 и CK 20 положительными. Поджелудочная аденокарцинома также может быть слабо позитивной по CDX-2.
Почти все аденокарциномы поджелудочной железы являются CEA и СА-125 положительными. Они также могут иметь незначительную составляющую нейроэндокринных клеток, которые будут реагировать с антителами к соматостатину, синаптофизину, хромогранину или другим нейроэндокринным маркерам. Терапия также может быть предсказана при положительном окрашивании на фактор роста эндотелия сосудов и отрицательном — на SMAD4 (DPC4). Потеря экспрессии SMAD4 в эпителии желчных протоков также была показана в случае хронической желчнокаменной болезни. Хорошо дифференцированные метастатические аденокарциномы поджелудочной железы в печени могут быть сложно отличимы от доброкачественных поражений желчных протоков при исследовании биопсийного материала. Тем не менее, в отличие от доброкачественных поражений, они как правило, экспрессируют р53, цитоплазматический mCEA, и другие маркеры, включая CA-125.
Нейроэндокринные опухоли и опухоли из эндокринных клеток, низкодифференцированные и высокодифференцированные.
Низко- и высокого дифференцированные нейроэндокринные опухоли, как правило, оцениваются по иммунофенотипическим проявлениям, однако в целом, интенсивность окрашивания меньше у полноценных опухолей.
Они могут быть сгруппированы по преобладанию секретируется гормона (например: соматостатин, гастрин), но, как правило, также окрашиваются антителами к синаптофизину и хромогранину, а также к различным кератинам, в том числе CK 8, CK 18, CK и 35betaH11. CK 7 и CK 20, как правило, негативны. CD56 и CD57, как правило, окрашиваются более интенсивно в высокодифференцированных нейроэндокринных опухолях, чем в низкодифференцированных; в мембранном рисунке CD56 также будет положительным в большей степени, нежели SATB2. Поэтому SATB2 является хорошим маркером идентификации рака ободочного происхождения при работе с опухолью неизвестного происхождения. Другим потенциальным полезным свойством полезность SATB2 является выявление нейроэндокринных опухолей и карцином левой толстой и прямой кишки, так как SATB2 как правило, отрицателен в других нейроэндокринных новообразованиях ЖКТ, поджелудочной железы и легких.
2003–2018 © ООО «Микротесты в биологии, медицине и ветеринарии». Официальный дистрибьютор ведущих производителей.
+7 (495) 969-98-26
источник
Опубликовано: 21 мая 2015 в 16:14
GIST являет собой определенный тип опухолей, которые появляются в желудочно-кишечном тракте и наделены особым клиническим развитием. Как правило, среди стромальных (гастроинтестинальных) опухолей желудка преобладают злокачественные, метастазирующие гематогенным образом. Их способность развиваться поражает. Они могут образоваться на любом участке пищеварительного тракта. Вероятность образования ГИСТ-опухоли в желудке больше всего и составляет шестьдесят процентов от общих показателей. Её можно сравнить со своеобразным узлом, что образовывается в просвете органа.
Симптоматика у этих новообразований практически отсутствует, что не дает возможности в нужное время выявить их и предотвратить дальнейшее образование. Человек, имеющий GIST, может и не подозревать об этом даже в тот момент, когда гастроинтестинальная опухоль желудка достигает значительных размеров.
Зачастую человек узнает об этой опасной болезни, обратившись к доктору с жалобами на ощущение дискомфорта в области живота, временной тошноты, быстрого похудения и утомляемости.
Выявленная стромальная опухоль представлена в виде узла. Над узлом, который расположенный на слизистой оболочке в скором времени появляются язвочки, которые способны спровоцировать кровотечение разных масштабов.
Более двадцати процентов ГИСТ обнаруживаются в результате проведения обследований желудка. При диагностике стромальной гастроинтестинальной опухоли обязательным процессом является тонкоигольная биопсия для того что бы в ближайшее время можно было провести гистологический, иммуногистохимический и молекулярногенетический анализы. После того как было обнаружено новообразование схожее с данным потребуется проведение компьютерной томографии всей полости брюшной. После проведения данных анализов появляется возможность установления того относится образованная опухоль желудка к GIST или нет.
На сегодняшний день самым оптимальным и действенным методом борьбы с стромальной опухолью обязательным процессом является тонкоигольная биопсия для того что бы в ближайшее является хирургическое вмешательство. Во время проведения операции задачей хирурга является максимально полное удаление образовавшегося узла. Человек, который перенес радикальную операцию по удалению узла, наблюдается докторами на протяжении нескольких лет, за которые обязан дважды в год проходить обследования.
В случаях образования стромальной опухоли желудка, от которой можно избавиться, избежав операции можно прибегнуть к помощи консервативных способов лечения данной проблемы. Лечение может быть проведено с помощью химиотерапевтических препаратов. Так же разрабатывается комплекс лечения, который в скором времени сможет давать лучшие результаты по лечению гастроинтестинальной онкологии, нежели оперирование или препараты. В данном комплексе будет предусмотрено на хирургическое вмешательство так и прием препаратов.
Лечение для каждого случая образования ГИСТ подбирается индивидуально с учетом многих факторов. В случаях образования стромальной опухоли желудка и достижения ею размеров до двух сантиметров пациент обязан дважды в год проходить эндоскопическое обследование. Если же опухоль имеет размеры, превышающие два сантиметра, то в таких случаях требуется оперативное хирургическое вмешательство.
Резекция, которая проводится на тканях желудка, что являются здоровыми. В этом процессе учитывается определенный отступ в размере двух сантиметров от краев пораженных участков. Гастрэктомия предусмотрена для удаление гастроинтестинальных стромальных опухолей больших размеров.
Следовательно, для того что бы обезопасить себя от возникновения GIST необходимо регулярно обследоваться и бережно относиться к своему здоровью. После удаления стромальной опухоли желудка не стоит пренебрегать рекомендациями докторов и посещать медицинское учреждение в указанные сроки.
Язвенные заболевания желудка и двенадцатиперстной кишки, а также их последствия представляют собой открытые небольшие ранки, которые располагаются на слизистой и верхней части органов желудочно-кишечного тракта. Уже при незначительных проявлениях болезни стоит обратиться к врачу, так как последствия и период лечения может затянуться на длительное время с серьезными осложнениями. Изначально может появиться тошнота, рвота после каждого приема пищи, а также боли в области подреберья с левой стороны.
Согласно статистике каждый десятый житель планеты имеет язвенную болезнь в той или иной его степени развития, а треть из них даже не подозревает о наличии у них заболевания.
Клиническая картина заболевания зависит от сложности язвенных «бляшек», их размера, глубины, а также возраста пациента. К сожалению, часто встречаются случаи бессимптомного развития язвы желудка и 12-и перстной кишки. Самым действенным методом для диагностики язвы считается ФГДС.
Язва желудка и двенадцатиперстной кишки — одно из самых распространенных заболеваний современности. Экология, неправильный образ жизни, постоянные перекусы, стрессы и изнурительные физические нагрузки непосредственно влияют на работоспособность органов желудочно-кишечного тракта.
Язвенные бляшки могут быть размером от 0,1 до 1, 5 см и попасть в группу риска может каждый, но согласно статистике, у мужчин заболевание встречается в два раза чаще, чем у женщин. Пик заболевания проявляется у людей в возрасте 55-65 лет.
На каждой стадии развития заболевания метод диагностики и лечения свой. Если язва переходит в хроническую форму, то пациенту придется на протяжении всей жизни придерживаться определенной диеты и соблюдать медикаментозное лечение.
Главная причина, по которой возникает язва желудка и 12-и перстной кишки – это бактерия Helicobacter pylori. Эта спиралевидная бактерия способна приспосабливаться и нейтрализовать кислотность желудка образовывая язвенные воспаления на слизистой.
Помимо бактерии есть еще и ряд факторов пагубно влияющих на работу желудка и двенадцатиперстной кишки. К основным таким факторам можно отнести следующие:
- курение и употребление алкоголя;
- газированные напитки;
- неправильный рацион и частые перекусы всухомятку;
- очень холодные или слишком горячие блюда могут повредить стенки желудка;
- частое использование таких медикаментов как аспирин, ибупрофен, индометацин и их аналоги;
- постоянное пребывание в стрессовых ситуациях.
Медики утверждают, что заболевание развивается интенсивнее, если человек употребляет в больших количествах сладости и сдобную продукцию.
О симптомах предъявленного эрозивного гастрита читайте в публикации.
Уже при первых проявлениях и даже самых незначительных симптомах надо посетить врача для полной диагностики.
Диагностировать язву желудка рекомендуется при первых ее проявлениях. Даже при наличии незначительных симптомов стоит обратиться к врачу и перестраховаться, иначе заболевание будет прогрессировать, а это приведет к серьезным осложнениям.
Прежде чем проводить диагностику пациента, врач должен максимально точно выяснить у больного все жалобы, которые могут быть связанны с работой желудка и двенадцатиперстной кишки.
Уже на первом приеме врач должен провести пальпацию брюшной полости на выявление болезненных ощущений в области левого подреберья и подложечной области.
После обращения к специалисту составляется план обследования 12-и перстной кишки и желудка. К обязательным лабораторным исследованиям относятся такие:
- общие анализы крови, мочи и кала;
- анализ кала на скрытую кровь;
- сдача крови на белок, альбумин, холестерин, глюкозу и общий уровень железа;
- определение группы крови пациента;
- фракционное обследование желудочной секреции.
Помимо лабораторных исследований проводятся и инструментальные, а именно:
- ФГДС — при этой процедуре берутся несколько биоптатов дна и края язвенной бляшки на гистологическое исследование;
- УЗИ поджелудочной, желчного пузыря и печени.
Кроме основных исследований могут быть назначены дополнительные:
- определение уровня инфицирования Helicobacter pylori при помощи эндоскопического уреазного теста;
- определение уровня сывороточного гастрина.
При определенных показаниях могут быть назначены:
- внутрижелудочная рН-метрия;
- эндоскопическая ультрасонография;
- рентгенологическое исследование желудка;
- компьютерная томография.
Диагностика язвенной болезни и их последствий проводится в несколько этапов и при необходимости могут быть назначены дополнительные обследования.
Инструментальная диагностика язвы двенадцатиперстной кишки назначается для подтверждения заболевания.
- ФГДС – этот метод способен точно диагностировать язву желудка и 12-и перстной кишки и описать все их дефекты. Также ФГДС способен контролировать процесс заживления язвенных воспалений в период лечения. Проводится цитологическая и гистологическая оценка морфологической составляющей слизистой желудка и возможные их последствия. В процессе исключается злокачественная форма язвы.
- Рентгенологическое обследование верхней части желудочно-кишечного тракта поможет обнаружить дефекты язвенных бляшек. Этот метод сравнивают с эндоскопическим.
- При помощи внутрижелудочной рН-метрии можно выявить высокую кислотность желудка.
- УЗИ желудка и двенадцатиперстной кишки помогут исключить сопутствующие возможные патологии органов.
Стоит заметить, что фиброгастродуоденоскопия (ФГДС) – это метод, который способен не только вывить язву на первых ее стадиях, но и диагностировать даже самые незначительные опухолевые образования и своевременно провести хирургическое лечение, при таковой необходимости.
Морфологический способ диагностирования подразумевает окрас бактерий в гистологическом срезе слизистой желудка.
- Цитологический способ – бактерии язвы окрашиваются в мазке –отпечатке биоптатов на слизистой, по Романовскому-Гимзе и Грамму. К сожалению, на данный момент эти данные не настолько информативны, насколько это необходимо.
- Гистологический способ – срез окрашивается по Романовскому-Гимзе, Вартин–Старри и т.д.
- Биохимический способ – такой метод определяет активность биоптаты слизистой желудка и двенадцатиперстной кишки при помощи быстрого теста, который помещается в мочевину. Если в жидкости есть бактерии H. Pylori то она превратиться в аммиак и поменяет цвет.
- Бактериологический способ встречается очень редко.
- Иммуногистохимический способ — подразумевает использование моноклональных антител и имеет большую чувствительность к бактериям.
По мнению медиков, самый информационный метод диагностики — это ФГДС. Несмотря на то, что это не совсем приятная процедура для пациента, врач получает максимальную информацию о состоянии здоровья больного, наглядно видит, в каком состоянии находятся воспаленные органы. При проведении ФГДС специалист видит, насколько повреждены органы, а также размеры язвенных бляшек и в каком состоянии они находятся.
Лечение язвы желудка проводится только согласно полученным результатам диагностики! После определения степени заболевания врач назначает медикаментозное лечение, которое сопровождается постоянной диетой и в некоторых случаях допускается использование народной медицины.
Стоит заметить, что если у пациента обнаруживаются язвенные дефекты желудка, то врачом будет назначено дополнительное дифференциальное обследование на злокачественность или доброкачественность язвочек, которые могут быть первичными признаками рака желудка. К сожалению, первично-язвенная форма раковой опухоли изначально может протекать под видом доброкачественной язвы, их симптомы схожи. Выявить злокачественность заболевания можно по большому размеру воспалений, особенно это касается молодых пациентов и высокое СОЭ. Окончательный диагноз ставится только после проведения гистологического обследования.
Биопсию рекомендовано проводить постоянно, на протяжении всего курса лечения, это поможет избежать непредвиденного течения заболевания и их непредвиденных последствий.
В зависимости от того какие результаты показала диагностика язвы желудка у пациента, врач назначает медикаментозное лечение и диету. Язва желудка, двенадцатиперстной кишки и их последствия могут существенно повлиять на самочувствие человека и его общее состояние здоровья. Лекарственные препараты способны уменьшить кислотность желудочной жидкости, вызванную заболеванием.
Самым главным в лечении является правильный подбор препаратов и их дозировка. Неправильно подобранные медикаменты могут вызвать дисбактериоз кишечника, что в свою очередь повлечет к нарушению усваиваемости пищи. В случае нехватки необходимого количества препарата пациент не получит желаемый результат в лечении. Очень важно правильно высчитать нужную дозировку медикамента. В процессе лечения врачом может быть назначено повторное проведение ФГДС для определения правильности назначенных препаратов и контроле язвенных бляшек.
В период лечения не стоит забывать и о соблюдении диеты, ведь именно правильное питание и отказ от определенных продуктов будет способствовать хорошему пищеварению и заживлению язвенных бляшек в органах желудочно-кишечного тракта.
В первую очередь пациент должен отказаться от острой, соленой, жаренной и кислой пищи. Из рациона следует исключить алкоголь.
Осложнения, которые могут возникнуть при несвоевременной диагностике язвы, приводят к существенным осложнениям.
- Перфорация – разрыв места, на котором была язвочка, после чего там остается отверстие. В таком случае вся употребляемая пища попадает в брюшную полость. В медицине такая форма называется прободной и проявляется резки ми болями в животе и требует срочного хирургического вмешательства.
- Пенетрация – в этом случае происходит прорастание язвы в органы располагающиеся вблизи воспаленного участка и проявляется оно нарушением его работоспособности. Чаще всего воспаляются поджелудочная и большой сальник.
- Кровоизлияние – происходит в случае, когда язва переходит на крупные сосуды поврежденных органов. Может возникнуть перерыв в болевых ощущениях, который может перейти в рвотные позывы. Лечение такой формы проходит только хирургическим путем.
- Малигнизация – это процесс когда язва переходит на следующую стадию – злокачественную опухоль.
- Стеноз – происходит уменьшение пилорической части желудка и выходного отверстия.
Стоит помнить, что при возникновении хотя бы малейших признаков язвенной болезни больному надо обратиться к врачу для диагностики желудочно-кишечного тракта и провести ФГДС. Это поможет выявить возможное заболевание на первых его стадиях и предотвратить осложнения. Не стоит пренебрегать собственным здоровьем и по возможности регулярно проходить медицинское обследование.
источник
HER2: биомаркер, меняющий подходы к терапии распространенного рака желудка и пищеводно–желудочного перехода
Рецептор эпидермального фактора роста 2-го типа (HER2) имеет важную прогностическую ценность при лечении распространенного рака желудка и пищеводно-желудочного перехода
- В настоящее время существует колоссальная потребность в повышении эффективности терапии распространенного рака желудка и пищеводно-желудочного перехода. Существующие стандартные методы лечения не позволяют увеличить медиану общей выживаемости пациентов более, чем на 1 год (по данным крупных международных исследований)
- В исследовании ToGA впервые было продемонстрировано беспрецедентное увеличение медианы общей выживаемости больных HER2-положительным распространенным раком желудка и пищеводно-желудочного перехода. Исследование ToGA было разработано для оценки эффективности и безопасности Герцептина в комбинации со стандартной химиотерапией в 1-й линии лечения HER2-положительного распространенного рака желудка и пищеводно-желудочного перехода
Рандомизированное исследование III фазы: дизайн исследования ToGA (n=594)
† ИГХ3+ и/или FISH+
* Кселода или в/в введение 5-ФУ на усмотрение исследователя;
ИГХ – иммуногистохимия; FISH – флуоресцентная гибридизация in situ;
РЖ – рак желудка; ПЖ переход – пищеводно-желудочный переход
- В общей популяции больных метастатическим раком желудка и пищеводно-желудочного перехода 22% опухолей являются HER2-положительными (ИГХ3+ и/или FISH+). В 16% случаев определяется гиперэкспрессия HER2 (ИГХ3+ или ИГХ2+ /FISH+)³
Герцептин увеличивает медиану общей выживаемости (ОВ) больных с гиперэкспрессией HER2 (ИГХ3+ или ИГХ2+/FISH+) до 16 месяцев
- Герцептин в сочетании с химиотерапией достоверно увеличивает общую выживаемость всех пациентов с HER2-положительным статусом опухоли (ИГХ3+ и/или FISH+)³
| Медиана | |||||
| Количество пациентов | ОВ | ОР | 95%-ный ДИ | p | |
| Химиотерапия + Герцептин | 167 | 13.8 | 0.74 | 0.60, 0.91 | 0.0046 |
| Химиотерапия | 182 | 11.1 | |||
- Наибольшее увеличение медианы общей выживаемости (ОВ) (до 16 месяцев) выявлено в подгруппе пациентов с гиперэкспрессией HER2 (ИГХ3+ или ИГХ2+/FISH+)³
| Медиана | ||||
| Количество пациентов | ОВ | ОР | 95%-ный ДИ | |
| Химиотерапия + Герцептин | 120 | 16.0 | 0.65 | 0.5, 0.83 |
| Химиотерапия | 136 | 11.8 | ||
Иммуногистохимические критерии оценки статуса HER2 при раке молочной железы не могут применяться при распространенном раке желудка и пищеводно- желудочного перехода
- Иммуногистохимические критерии оценки статуса HER2 при раке молочной железы не могут применяться при распространенном раке желудка и пищеводно- желудочного перехода 4
 |  |
| Гетерогенное окрашивание клеток опухоли желудка, экспрессирующих HER2 | Полное, базолатеральное или латеральное мембранное окрашивание |
Стандартизированные тесты для оценки статуса HER2 при распространенном раке желудка и пищеводно- желудочного перехода
Иммуногистохимический анализ (ИГХ)
- Анти HER-2/neu (4B5) (Ventana)
- HercepTest™ (Dako)
Гибридизация in situ (in situ hybridization)
- Флуоресцентная гибридизация in situ HER2 pharmDx™ (HER2 FISH pharmDx™ (Dako))
- Усиленная серебром гибридизация in situ (SISH) (INFORM™ HER2 SISH (Ventana))
- Тестовые системы CONFIRM™ anti-HER2/neu (4B5, Ventana) и INFORM™ HER2 SISH (Ventana) так же достоверно выявляют гиперэкспрессию HER2/neu и/или амплификацию гена HER2/ neu, как и тестовые системы HercepTest™ (Dako) и HER2 FISH pharmDx™ (Dako), применявшиеся для оценки HER2 статуса в исследовании ToGA 5
| Шкала | Образец, полученный при операции – характер окрашивания | Образец, полученный при биопсии – характер окрашивания | Оценка гиперэкспрессии HER2 | |
 | Нет окрашивания или мембранное окрашивание менее чем в 10% опухолевых клеток | Нет окрашивания или полное отсутствие мембранного окрашивания | Результат отрицательный | |
 | 1+ | Слабое/едва различимое частичное мембранное окрашивание в ≥10%опухолевых клеток | Слабое/едва различимое мембранное окрашивание вне зависимости от доли окрашенных опухолевых клеток | Результат отрицательный |
 | 2+ | Слабое/умеренное полное, базолатеральное или латеральное мембранное окрашивание в ≥10% опухолевых клеток | Слабое/умеренное полное, базолатеральное или латеральное мембранное окрашивание вне зависимости от доли окрашенных опухолевых клеток | Результат сомнительный (требуется подтверждение ISH) |
 | 3+ | Выраженное полное, базолатеральное или латеральное мембранное окрашивание в ≥10% опухолевых клеток | Выраженное полное, базолатеральное или латеральное мембранное окрашивание вне зависимости от доли окрашенных опухолевых клеток | Результат положительный |
Алгоритм определения статуса HER2 при распространенном раке желудка и пищеводно- желудочного перехода 3,4
- Все образцы опухолей больных раком желудка и пищеводно- желудочного перехода следует исследовать на статус HER2 ИГХ является методом выбора для первоначальной оценки статуса HER2
- Пациенты с уровнем экспрессии HER2 в опухоли 3+ (методом ИГХ) расцениваются как HER2-положительные. Им может быть назначен Герцептин
- Образцы с уровнем экспрессии HER2 (ИГХ2+) должны исследоваться методом гибридизации in situ (ISH) для подтверждения статуса HER2
- Пациенты с уровнем экспрессии ИГХ 2+/ISH+ в опухоли расцениваются как HER2-положительные. Им может быть назначен Герцептин
Список сокращений: ИГХ — иммуногистохимический анализ; SISH — усиленная серебром гибридизация in situ; ISH — гибридизация in situ; ОР — относительный риск; ХТ — химиотерапия
Ссылки: 1. Gravalos C, et al. Ann Oncol 2008; 19: 1523-29; 2. Tanner M, et al. Ann Oncol 2005; 16: 273-78; 3. Bang Y-J, Cutsem E, et al. The Lancet 2010; 376: 687-697; 4. — Hoffman M, et al. Histopathology 2008; 52: 797-805; 5. Powell et al. poster presented at ASCO GI 2010
Показание при раке желудка. Распространенная аденокарцинома желудка или ПЖ перехода с опухолевой гиперэкспрессией HER2 в комбинации с капецитабином или в/в введением 5-ФУ и препаратом платины в случае отсутствия предшествующей противоопухолевой терапии по по- воду метастатической болезни. Противопоказания. Повышенная чувствительность к трасту- зумабу или любому другому компоненту препарата. Побочное действие со стороны организма в целом: боли в животе, слабость, боли в грудной клетке, озноб, лихорадка, головные боли, боли; со стороны системы пищеварения: диарея, тошнота, рвота; со стороны костно-мышечной системы: артралгия, миалгия; со стороны кожи и подкожно-жировой клетчатки: сыпь. Полная информация о препарате представлена в инструкции по медицинскому применению.
источник
Иммуногистохимическое исследование в онкологии – это разновидность исследования ткани с помощью специальных реактивов по принципу антиген-антитело.
При иммуногистохимическом исследовании используются реактивы, которые содержат антитела, отмеченные специальными веществами.
Антитело – это белок, который связывается в тканях с определенными молекулами — антигенами, после чего возникает реакция. Если же таких молекул нет, то и реакции не будет.
По этому признаку можно судить, присутствует в ткани интересная нам молекула или нет. Это похоже на то, если нанести на белый стол бесцветный клей. Невооруженным глазом на белом фоне он практически незаметен, но стоит насыпать на стол мелкого песка, как клей становится виден за счет прилипших песчинок.
По правилам иммуногистохимическое исследование при раке всегда проводится в специализированной лаборатории. Для его проведения необходима опухолевая ткань, полученная в результате биопсии или операции.
Иммуногистохимическое исследование проводится для определения наличия в опухолевых клетках различных точек приложения, например, наличие рецепторов эстрогенов (ER) и прогестеронов (PR). Также иммуногистохимия выполняется для определения показателя Ki-67 (индекс пролиферативной активности опухолевых клеток), гиперэкспрессии белка Her2neu, VEGF (сосудистый фактор роста), р53.
Иммуногистохимическое исследование при раке выполняется для того, чтобы понять, какими препаратами можно лечить злокачественную опухоль, и к каким видам препаратов она чувствительна.
Самый распространённый анализ, определяемый при иммуногистохимическом исследовании, это наличие рецепторной чувствительности к гормонам у опухоли.
ER и PR — протеиновые рецепторы на поверхности опухолевых клеток.
В организме человека постоянно вырабатываются гормоны — эстроген и прогестерон. Эти гормоны воздействуют на ER и PR рецепторы, что приводит к стимуляции роста опухолевых клеток.
Определение Эстрогеновых и Прогетестероновых рецепторов является одним из важнейших моментов, определяющих чувствительность опухоли к терапии гормональными препаратами.
Чаще всего наличие рецепторов ER/PR определяют при раке молочной железы. Их наличие дает возможность, помимо стандартных методов лечения, применить гормональную терапию.
При гормон позитивном раке молочной железы, назначаются препараты: Тамосксифен, Экземестан (Аромазин), Летрозол (Фемара), Анастразол (Аримидекс), Гексэстрол (Синестрол) и другие.Также, считается, что гормонально-зависимый рак молочной железы отличается спокойным течением и редким метастазированием.
Чувствительность опухолевых клеток к гормональной терапии выражается в баллах от до 10. Опухоль считается гормонозависимой, начиная с 2-х баллов. и требует добавления к лечению гормональной терапии.
Her2Neu — это рецептор эпидермального фактора роста раковой клетки. Это — ген, который воздействует на мембранные рецепторы клетки, и стимулирует её к усиленному делению.
В некоторых опухолях (чаще всего рак молочной железы, рак пищевода, рак желудка) присутствует гиперэкспрессия (повышенная активность) Her2Neu, что вызывает быстрое деление опухолевой клетки и её повышенную активность.
Также снижается эффективность химиотерапии, лучевой терапии, гормональной терапии. Из-за этого опухоли с Her2neu позитивным статусом отличаются агрессивным течением.
Существует две методики определения наличия у опухоли гена Her2neu:
Результаты иммуногистохимического исследования выражаются в баллах:
- 0-1 означает, что опухоль без гиперэкспрессии Her2neu.
- 3 означает, что опухоль с гиперэкспрессией Her2neu.
2. Метод FISH (Флуоресцентная гибридизация in situ)
В отличие от иммуногистохимического исследования, при котором определяются белки, при методе FISH определяется наличие генов, кодирующих протеины Her2neu. В зависимости от их наличия, определяется гиперэкспрессия Her2neu.
Определение гиперэкспрессии рецептора Her2neu в опухоли молочной железы является очень важным для дальнейшего назначения лечения.
В современной онкологии гиперэкспрессию Her2neu определяют, чтобы понять, необходимо ли добавление к лечению ингибиторов Her2neu. Для лечения опухолей с гиперэкспрессией рецептора Her2Neu активно и успешно используются таргетные препараты Трастузумаб (Герцептин), Пертузумаб (Перьета), Трастузумаб-эмтанзин (Кадсила), Бейодайм (Трастузумаб+Пертузумаб). Эти препараты прицельно блокируют рецепторы Her2neu, тем самым останавливая активный рост опухолевых клеток и повышая их чувствительность к химиопрепаратам. Добавление таргетной терапии к стандартной химиотерапии при лечении Her2neu позитивных опухолей, серьезно увеличивает общую выживаемость и результат противоопухолевого лечения.
Ki-67 — это маркер пролиферативной активности опухолевой клетки. Данный параметр оценивается в процентах и показывает, сколько процентов опухолевых клеток активно делятся.
Если Ki-67 меньше 15%, опухоль считается слабоагрессивной, при показателе Ki-67 от 30 до 50% опухоль считается агрессивной, а при показателе Ki-67 выше 50% опухоль является высокоагрессивной.
Также Ki-67 является фактором прогноза течения опухолевого заболевания и ответа опухоли на химиотерапевтическое лечение. Определяется это простым способом: чем ниже показатель Ki-67, тем хуже опухоль реагирует на химиотерапевтическое лечение. И наоборот — чем выше показатель Ki-67, тем лучше опухоль будет отвечать на химиотерапию.
Белок p53 — это транскрипционный фактор, регулирующий клеточный цикл. В быстро делящихся клетках обнаружено увеличение концентрации белка р53 по сравнению с клетками, делящимися медленно, что обусловлено высоким риском их онкогенности.
Белок p53 предотвращает образование злокачественных опухолей в нашем организме. В норме, антионкоген р53 находится в неактивном состоянии, а при появлении повреждений ДНК в здоровой клетке — активируется.
Функция белка р53 состоит в удалении тех клеток, которые являются потенциально онкогенными. Это называется — индуцированный апоптоз, уничтожение потенциально опасной клетки.
При иммуногистохимическом исследовании, повышенное содержание белка p53 обнаруживается в 50% злокачественных клеток, что позволяет им беспрепятственно делиться и избегать апоптоза (уничтожения).
Количество белка p53, определяют в дополнение к показателю Кi67, для того, чтобы понять насколько агрессивна опухоль и определить дальнейшее течение болезни. Если уровень белка p53 высокий, значит опухоль не агрессивная и не склонна к метастазированию и быстрому росту. Если же, показатель белка p53 низкий, то значит опухоль агрессивна и склонна к быстрому росту в окружающие ткани и метастазированию.
VEGF – это сигнальный белок, вырабатываемый клетками для активного роста новых сосудов в уже существующей сосудистой системе.
Есть несколько видов белка VEGF, и каждый воздействует на определенный рецептор VEGFR (Vascular endothelial growth factor receptor). Для того чтобы активно делиться, опухоли нужно питание, а для этого нужны сосуды, по которым это питание будет поступать. Именно по этой причине в опухолевых клетках содержится повышенное содержание белка VEGF — для того, чтобы в короткие сроки строить сосудистые сети.
Наличие белка VEGF в опухоли говорит о возможности применения таргетной терапии такими препаратами, как Бевацизумаб (Авастин), Рамуцирумаб (Цирамза), Афлиберцепт (Залтрап). Они перестраивают сосудистую сеть опухоли, тем самым лишая её питания.
Иммунотерапия в онкологии появилась сравнительно недавно, но уже успела показать удивительные результаты в лечении опухолей. Механизм иммунотерапии рака заключается в том, что препарат позволяет иммунитету увидеть опухоль и уничтожить её. Ответственные за «видимость» опухоли белки PD-1, PDL-1 и PDL-2 в достаточном количестве присутствуют не во всех опухолях. Именно поэтому одним пациентам иммунотерапия помогает, а другим нет.
Чаще всего определение гиперэкспрессии белка PD-1 и его лиганд PDL-1 и PDL-2 необходимо при меланоме, немелкоклеточном раке легкого, раке желудка и раке почки.
Для того чтобы отобрать пациентов, которым показана иммунотерапия, проводится определение наличия экспрессии PD-1 и его лиганд PDL-1 и PDL-2, при помощи флюоресцентной гибридизации in situ (FISH). При наличии экспрессии PD-1 и его лиганд PDL-1 и PDL-2, показано применение иммунотерапии препаратами Пембролизумаб (Кейтруда), Ниволумаб (Опдиво), Атезолизумаб (Тецентрик).
В современной онкологии иммуногистохимическое исследование играет очень важную роль, так как при помощи этого исследования онкологи определяют наличие тех или иных факторов в опухоли, которые позволяют грамотно и адекватно составить дальнейшее лечение пациента и говорить о прогнозах заболевания.
источник
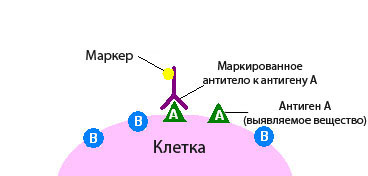
Иммуногистохимия, или иммуногистохимический анализ — исследование, во время которого в образцах ткани с помощью антител выявляют определенные молекулы. Этот метод диагностики нашел широкое применение в онкологии.
Немного теории и истории. Для того чтобы обнаруживать и уничтожать чужеродные вещества, иммунная система использует особые молекулы — антитела. Они отличаются специфичностью: каждое антитело может связываться строго с определенным антигеном.
В 1941 году американский иммунолог Альберт Кунс впервые решил использовать антитела в лаборатории, чтобы «распознавать» с помощью них белки бактерий. В 1984 году биохимик из Аргентины Сезар Мильштейн получил Нобелевскую премию за то, что создал гибрид опухолевой клетки с лимфоцитом, которая могла синтезировать моноклональные антитела. После этого началось производство моноклональных антител для диагностических и лечебных целей.
В 1994 г. С. Тэйлор применил иммуногистохимический анализ, чтобы проверить 20 000 опухолей, и обнаружил, что диагнозы в половине случаев были ошибочными. Иммуногистохимия зарекомендовала себя как эффективный метод диагностики.
Иммуногистохимический анализ помогает врачам-онкологам:
- Отнести злокачественную опухоль к тому или иному типу.
- Выяснить, в каких генах опухолевых клеток произошли мутации, какие белки способствуют прогрессированию рака.
- Выявить первичную опухоль и ее метастазы.
- Определить, произошла ли злокачественная трансформация клеток.
- Определить прогноз для пациента.
- Разобраться, поможет ли в данном случае таргетная терапия.
- Определить, чувствительны ли опухолевые клетки к химиотерапии, лучевой терапии.
Иммуногистохимия бывает прямой и непрямой. В первом случае используют один вид антител, которые должны вступить в связь с определенной молекулой-мишенью. Если молекула-мишень присутствует в ткани, и реакция произошла, опухолевая ткань окрашивается:
- Чаще всего к антителу присоединяют фермент, например, пероксидазу. Этот фермент катализирует химическую реакцию, которая приводит к изменению цвета.
- Иногда к антителу присоединяют флюоресцин или родамин, при этом окрашивание выявляют с помощью флюоресцентной микроскопии.
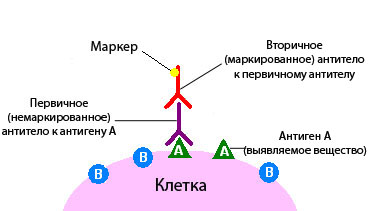
- всего применяют непрямую иммуногистохимию. При этом используют два антитела. Одно соединяется с антигеном, второе — с полученным комплексом антиген-антитело. Маркер, который вызовет изменение цвета, связывают со вторым антителом.
Непрямой метод имеет некоторые преимущества:
- Он обладает более высокой чувствительностью, потому что с одним первичным антителом (тем, которое связывается с белком-мишенью) может связаться несколько вторичных антител.
- Исследование занимает немного времени: для того, чтобы произошла реакция, нужно примерно 3 часа.
- Непрямая иммуногистохимия требует небольшого количества антител. Например, вторичное антитело, направленное на иммуноглобулины кролика, будет реагировать на любое первичное антитело «кроличьего» происхождения. Не нужно создавать много разных видов вторичных антител с окрашивающей или флуоресцентной меткой.
Для того чтобы выполнить иммуногистохимический анализ, нужно получить опухолевую ткань, то есть провести биопсию. В качестве материала можно использовать столбик ткани, полученный во время трепан-биопсии, фрагмент тканей или даже целый орган, удаленный во время операции.
Образец ткани фиксируют с помощью формальдегида (иногда используют метанол, ацетон и другие фиксаторы — это зависит от того, какой антиген нужно выявить, и реагирует ли он с теми или иными фиксаторами) и погружают в парафин. Парафинизация помогает законсервировать ткань, сохранить ее структуру на длительное время.
Затем ткань, помещенную в парафин, нарезают с помощью специального инструмента — микротома — на слои толщиной 3–5 мкм. Эти тонкие срезы помещают на стекло, покрытое, специальным клеем.
Некоторые образцы слишком чувствительны к реагентам, которые применяют во время вышеописанной процедуры. Их нельзя помещать в парафин. Такие ткани замораживают жидким азотом. Этим альтернативным методом пользуются редко, только в случае необходимости, так как у заморозки есть некоторые недостатки: она делает изображение под микроскопом не таким четким, требует специальных условий хранения образцов. Фиксацию ткани в таких случаях проводят уже после нанесения на стекло и размораживания, ацетоном или формальдегидом.
После того как срезы нанесены на стекло, из них нужно удалить весь парафин, иначе антитела не прореагируют с антигеном. Эта процедура называется депарафинизацией. Ее проводят с помощью ксилола. Затем выполняют еще некоторые подготовительные процедуры, чтобы антитела могли успешно прореагировать с нужными антигенами, и, наконец, проводят непосредственно иммуногистохимический анализ. Обработанную антителами ткань рассматривают под микроскопом, чтобы проверить, окрасилась ли она.
Количество возможных мишеней измеряется сотнями. Перед исследованием врач должен понимать, что он ищет, и использовать соответствующие антитела. В онкологии мишенями являются опухолевые маркеры — вещества, которые в здоровых клетках отсутствуют вообще или присутствуют в значительно меньшем количестве. Вот некоторые примеры:
- Рецепторы к эстрогенам и прогестерону помогают идентифицировать гормонально-позитивный рак молочной железы и разобраться, помогут ли женщине гормональные препараты.
- Простатспецифический антиген (ПСА) имеет значение в диагностике рака простаты.
- Альфа-фетопротеин — присутствует в гепатоцеллюлярной карциноме (рак печени).
- Цитокератины помогают в диагностике рака и некоторых сарком (злокачественных опухолей соединительной ткани).
- Фермент CD10 (CALLA) связан с карциномой почек, лимфобластным лейкозом.
Иммуногистохимический анализ помогает изучить характеристики злокачественной опухоли, которые не могут выявить другие методы диагностики. Зачастую это играет важную роль в уточнении диагноза и назначении правильного лечения. Врач может определить, какие комбинации препаратов будут наиболее эффективны для конкретного больного, иными словами, реализуется принцип персонализированного лечения. Зачастую это помогает улучшить результаты, подобрать эффективное лечение для пациентов, которым не помогает стандартная терапия.
источник
Иммуногистохимия – это методика выявления наличия онкологического процесса в организме посредствам оценки содержания антигенов. С ее помощью можно не только диагностировать раковое заболевание на ранней стадии, но и спрогнозировать дальнейшее течение. Используется в качестве диагностики рака и оценки эффективности выбранного метода лечения
При наличии в организме онкологического процесса, в кровь попадают антигены. Их наличие указывает на патологию, а конкретный тип на место локализации новообразования. С его помощью можно более точно поставить диагноз и определиться с эффективностью лечения.
Суть исследования заключается в выявлении антигенов, что возможно посредствам проведения ряда тестов. Используются реактивы, в состав которых входят «меченые» антитела. Эти белковые структуры имеют определенный цвет, который придают им специализированные красители.
Антитела способны выискивать антигены и вступать с ними в связи. Подобная реакция называется «антиген-антитело», когда с помощью меченых клеток удается определить наличие антигенов, указывающих на наличие злокачественного опухолевого процесса.
С помощью иммуногистохимического исследования можно выявить не только наличие онкогенных маркеров, но и определить некоторые рецепторы к гормонам, что эффективно при гормонозависящем типе опухоли или прогрессирующих эндокринных заболеваниях.
Результаты исследования показывают:
- Гистологическую принадлежность опухоли, что подтверждает или опровергает наличие рака.
- Локализацию опухолевого процесса и органы-мишени, которые в дальнейшем пострадают – это позволяет максимально направить все методы лечения на подавление патологического процесса именно в конкретном участке тела.
- Возможную методику лечения и резистентность клеток к определенным видам медикаментов. Врач может прогнозировать, насколько эффективным будет тот или иной препарат для конкретного пациента. Это минимизирует риски развития побочных воздействий и отсутствие терапевтического эффекта.
Иммуногистохимия является самым достоверным исследованием, которое помогает определить тип раковых клеток. Уровень погрешности минимален, что указывает на высокую точность результатов.

Неоспоримым преимуществом иммуногистохимии является точное выявление типа рака и места его локализации (очага). Выявить это никакими другими сверхточными методиками невозможно. Именно окрашивание образца биоматериала показывает, какие клетки имеются в опухоли, как они себя ведут, и как будет вести себя при воздействии на них определенных способов лечения.
Диагностика, основанная на химической реакции, помогает выявить опухолевый процесс на самых ранних стадиях. Это увеличивает шансы на благоприятный исход.
На точность результатов влияют некоторые внешние факторы, в том числе и прием гормональных препаратов. За несколько дней до проведения биопсии показан отказ от всех лекарств, диета и отсутствие физических нагрузок. Невыполнение этих рекомендаций увеличивает риск появления неточностей в результатах исследования. При желании анализ можно сдавать в двух лабораториях одновременно, что снизит вероятность погрешности.
Исследование необходимо в следующих ситуациях:
- При наличии опухоли, которая подает нечеткие эхо-признаки, что требует установления ее природы.
- Если имеются метастазы для выявления мест их локализации, что помогает поставить стадию рака.
- Составление прогноза и скорости распространения опухолевого процесса.
- При необходимости исследования чувствительности рецепторов к определенным видам гормонов, если у человека имеются нарушения в работе эндокринной системы.
- Если врач сомневается в методике проведения выбранного типа медикаментозного лечения или отсутствует какой-либо терапевтический эффект.
Показанием служит выраженный опухолевый процесс в любых частях тела. Иммуногистохимия показывает степень его злокачественности, возможный прогноз и толерантность к медикаментам.
Исследование эффективно в диагностике патологий репродуктивной системы при невозможности забеременеть и выносить ребенка. Показанием являются:
- хронические заболевания матки и яичников;
- бесплодие и самопроизвольные выкидыши на ранних сроках;
- патологическое разрастание эндометрия.

Методика помогает определить, имеются ли в организме женщины клетки, которые препятствуют наступлению беременности.
Исследование проходит в четыре этапа:
- Долабораторная подготовка образца – получение нужного образца осуществляют с помощью биопсии. Выбор метода зависит от места локализации опухоли, ее формы и распространенности опухолевого процесса. Часть иссеченных тканей помещают в раствор формалина, после чего образец передают в лабораторию. Еще одним преимуществом иммуногистохимии является возможность исследования через определенное время. Нет необходимости обрабатывать образец сразу, как только произведена биопсия. Образцы хорошо хранятся и показывают результаты не хуже, чем в день их забора.
- Подготовка образца к исследованию – биоматериал вводят в парафин, что необходимо для полной фиксации образца. Из полученных элементов тканей готовят тончайшие срезы, что возможно с помощью высокоточного оборудования. Чем тоньше срез, тем проще проследить химическую реакцию. Срезы укладывают на специальную панель, на которую в дальнейшем будет наноситься реагент.
- Окрашивание срезов посредствам введения антигенов – готовят несколько образцов, на которые воздействуют различными антителами. Полученный результат фиксируют по степени окрашенности конкретного участка среза. Одновременно можно выявлять до 10 типов антигенов, что позволяет установить точную природу опухоли.
- Оценка результатов – по истечению определенного времени (7-10 дней) с помощью высокоточного оборудования оценивают степень окраски образцов, делая заключение. Все полученные данные вносят в специальный бланк-расшифровку, который помогает при постановке точного диагноза. Его передают лечащему врачу, после чего подбирается соответствующее лечение.

Забор биоматериала осуществляют до начала лечения, чтобы оценить истинное положение вещей. Если использовались медикаменты, данные результатов будут несколько отличаться от истинных.
Для исследования используют часть биоматериала. Вторая часть может храниться в лаборатории. Это позволит снизить количество вмешательств в организм, особенно при выборе метода лечения. Нет необходимости сдавать биопсию повторно, чтобы установить, какой именно медикамент будет эффективен в той или иной ситуации.
Преимущество отдают тем лабораториям, в которых окрашивание образцов осуществляется автоматически. Минимизация человеческого вмешательства в процесс позволяет получать наиболее точные результаты.
Не существует противопоказаний к иммуногистохимии в принципе. Невозможность исследования обусловлена невозможностью забора биоптата, что возможно при расположении опухоли в глубоких слоях тканей и органов, при внедрении в которые есть риски развития смертельно опасных осложнений. Это касается опухолей головного мозга, внутренних частей органов.
В ходе проведенного исследования выявляется тип онкогенных клеток и их количество, что в дальнейшем способствует составлению точного прогноза. Внимание обращают на показатель Ki-67. Именно этот маркер показывает степень злокачественности процесса. Если его процентное содержание более 85%, то это указывает на запущенный онкологический процесс с наличием метастаз, что в конечном итоге спровоцирует скоропостижную смерть.
Чем выше процент онкогенности, тем неблагоприятнее прогноз и меньше шансов на жизнь.
Полученную расшифровку передают лечащему врачу-онкологу, под руководством которого будет проводиться лечение. Развернутый ответ на интересующий вопрос позволит подобрать наиболее оптимальные медикаменты, что увеличит шансы на полное выздоровление.
После проведения курса лечения иммуногистохимию производят повторно. На основании оценки количественного и качественного состава клеток можно прослеживать динамику и эффективность лечения. Отсутствие терапевтического эффекта может быть поводом для повторного проведения исследования, но в другой лаборатории.
Несмотря на высокую точность полученных результатов, диагноз ставится на основании комплексного обследования. Очень редко бывают случаи, когда данные иммуногистохимиии и гистологического исследования одного и того же образца давали разные значения.
источник