Представить себе жизнь без воды сегодня невозможно. Любой человек использует ее каждый день, не обходится без воды и производство. Во многих технологических процессах воду используют постоянно. Производство микросхем, даже абразивные чистки применяют воду с завидным постоянством. И можно смело утверждать, что без качественной воды сегодня не продержаться на рынке. Что касается обычных потребителей, то вода плохого качества влияет на здоровье. Негативно влияет. Снижает качество обработки продуктов и многое-многое другое.
В чем причина плохого качества воды? Что делает ее жесткой? Сразу нужно уточнить, что варианты загрязнения могут быть самыми разными. От банальной грязи и твердых примесей, до невидимых органических примесей, которые могут сделать воду вирусоносной, жесткой или железистой.
Способов смягчения жесткой воды на сегодня идентифицировано несколько. Что вообще понимают под термином «жесткость»? Это такая характеристика воды, которая подразумевает под собой наличие в воде определенного размера включений солей кальция и магния.
Карбонатная жесткость воды подразумевает наличие в воде карбонатных солей. Это как раз и есть соли кальция и магния. Жесткость может быть и сульфатной. Но в большинстве случаев встречается именно карбонатная. А это практически 98 процентов случаев. Потому и будем уделять карбонатной жесткости воды больше всего внимания.
Итоговое содержание солей в воде именуют жесткостью. Даже если быть совсем точной, то это общая жесткость. Для жизни это один из самых важных факторов. Для производства также есть большое значение в этом показателе. Для тех, кто держит аквариум, карбонатная жесткость воды также является важным показателем. Т.к. в очень некачественной воде рыбы жить не смогут. Данный показатель подвергается постоянному контролю. Даже пресную воду следует различать по жесткости.
Общую жесткость делят на два подвида постоянную и временную. Эти виды также могут называться карбонатной, то есть временной и некарбонатной, то есть постоянной.
Карбонатную жесткость воды образуют гидрокарбонаты и карбонаты кальция и магния, о которых говорилось выше, при показателе кислотно-щелочного баланса, равного 8,3. Некарбонатную жесткость образуют кальциевые и магниевые соли сильнодействующих кислот.
Соли, образующие жесткость, ведут себя по-разному в воде. Одни при нагреве выпадают в осадок, другие полностью растворяются. Это и послужило признаком иерархии. Соли, которые создавали малорастворимый осадок, создали временную жесткость, то есть устранимую. Те же соли, которые растворялись в воде, образовали постоянную жесткость.
Более или менее с начальными понятиями определились. Теперь рассмотрим более подробно про снижение жесткости воды и узнаем, какие вещества и как образуют столь нужную нам для рассмотрения карбонатную жесткость воды.
Временная жесткость воды присутствует вместе с двухвалентными катионами кальция, магния и железа, а также бикарбонатных и гидрокарбонатных анионов. Стоит такую воду нагреть, и гидрокарбонаты разлагаются. На смену им приходят – малорастворимый карбонатный осадок, вода и углекислый газ.
Когда говорят об устранении жесткости в воде, то имеют в виду именно карбонатную жесткость воды. Ее можно устранить из воды, т.к. ее составляющие вступают в реакцию. Это временное явление и даже прокипятив воду, жесткость можно убрать, правда, тогда все прелести такой воды в виде накипи осядут на стенках оборудования.
Ну и постоянная жесткость остается в воде и после кипячения. Источники ее создания, это сульфаты, силикаты, хлориды и нитраты. На постоянную жесткость нельзя повлиять. Правда, при устранении карбонатной жесткости воды уменьшается количество и постоянной.
Что понимают под временной и постоянной жесткостью мы разобрались. Какие же на сегодня существуют варианты устранения карбонатной жесткости? Можно ли без лишних расходов сделать это в домашних условиях? И почему так вредная некачественная вода?
О накипи можно слагать легенды. Каждый из нас лицезрел ее на стенках чайника, кастрюль, не знал как с ней справится, когда она покрывает прочным слоем сеточку крана. Чего и говорить, но жесткая вода в домашних условиях, одна из самых больших проблем любой хозяйки. Времени на устранение уходит очень много, денег при этом не меньше, и бытовые приборы страдают от устранения налета не меньше, чем от самой накипи.
Но кроме бытовых проблем, данные методы устранения жесткости воды доставляют огромное количество неприятностей промышленности. Котельные, металлургия, микроэлектроника, химическая промышленность, теплоэнергетика. Все эти отрасли обойтись без качественной воды не могут. Качественная вода предполагает в дальнейшем производство качественной продукции.
И естественно очистка воды является главным производственным элементом в пищевой промышленности. Нельзя произвести вкусную и полезную воду, когда ее плохо очистили. Поэтому что дома в своей квартире, что на промышленном производстве умягчению воды следует уделять достаточно внимания.
Кроме умягчения можно бороться просто с накипью. Для этого достаточно устранять налет своевременно. Но проводить такие процедуры нужно постоянно и использовать для этого агрессивные средства или специальные механические приборы, которые позволят очистить даже самый толстый слой накипи.
Как и у каждой чистки, у очищения накипи есть масса недостатков. Мало того, что расходы на приобретение средств становятся постоянными и не малыми, так еще и бытовые приборы не так просто чистить. Да и поверхности никогда уже не будут по-прежнему гладкими. И естественно с каждым устранением накипи, поверхность будет становиться все более испорченной, а новые отложения будут образовываться быстрее. Может начать развиваться коррозия. Чтобы этого не произошло, давайте узнаем какие применяются способы для определения карбонатной жесткости воды.
Что у самой воды, что у накипи есть несколько особенностей, делающих их образование крайне неприятным. Некачественная вода плохо растворяет моющие средства. И это притом, что мы все моем в воде. Такая особенность вызывает резкое увеличение расходов и мыла с порошком и воды. Вода сегодня стоит немало, чтобы постоянно платить за определение карбонатной жесткости воды.
Что же касается непосредственно накипи, то она почти не проводит тепло. И из-за этого все беды. Образовываясь на топливных поверхностях и элементах, она просто полностью блокирует нормальную работу любого нагревательного прибора. В результате происходят необратимые вещи. Если не убирать такой налет своевременно.
Таблица. Виды и способы определения жесткости воды
| Состав исходной воды | Вид жесткости | Способ определения жесткости воды | |
| катионы кальция | анионы магния | ||
| Са | С плюсом | Карбонатная или некарбонатная | Химический анализ |
| Са | Постоянная или временная | Тест-полоска для определения жесткости | |
| Са Временная, карбонатная и в малой | Специализированная лаборатория | ||
Если вы пренебрегли каким либо способом, приведённым в таблице, вы можете лишиться своего дорогостоящего оборудования. Каждый из приведенных в таблице способов определения карбонатной жесткости воды крайне важен!
Во-первых, ухудшается работа любого оборудования или бытового прибора. КПД резко идет вниз. Из-за того, что накипь плохо нагревается, приходится расходовать в разы больше топлива, электричества, мощности с целью хоть как то нагреть воду. Для промышленности такая особенность накипи выливается в огромные расходы. Прибор постепенно покрывается накипью, пока поверхность практически полностью прекращает передавать тепло воде. Тогда срабатывает система защиты. Прибор самопроизвольно отключается, с целью защитить себя от перегрева. Получив такой сигнал, приступить к очистке поверхностей следует немедленно.
Накипи ведь много не надо. Из стадии легкий известковый налет она быстро переходит в стадию твердый известковый камень, который так легко не уберешь. И когда поверхности покрыты вот таким камнем и происходит перегорание прибора. Иногда это может выглядеть как взрыв или трещина, в чем тоже мало приятного. Трубы в водопроводе разрывает и протирает по этой причине.
Возиться с постоянным устранением налета, особенно в промышленности чрезвычайно накладно. Существует ряд способов, как справиться с повышенной жесткостью воды не повредив всю систему. Средства от накипи не дешевые. Как и вызов бригады для очистки. Подвергать таким нагрузкам поверхности постоянно тоже нельзя. Какой же путь избрать? Как наиболее эффективно бороться с карбонатной жесткостью воды?
Сразу скажу, что определение карбонатной жесткости воды в домашних условиях невозможно. Единственный, так сказать, кустарный вариант доступен только для очищения очень малого количества воды. И это вода будет скорее лечебной, чем просто умягченной. Многие ведь считают, что умягчители воды – дорогое удовольствие. Сегодня, к счастью это не так. Грамотность населения и просвященность в сфере очистки воды с каждым годом растет и потому между производителями фильтров для воды увеличивается конкуренция. И в ценах на подобные очистительные приборы наметилась положительная динамика к снижению.
Но вернемся к определению карбонатной жесткости воды в домашних условиях. Единственный материал, который позволит вам действительно получить качественную воду, это кремний. Все, что вам для этого нужно, это купить кусочек кремния и настоять на нем воду в течении недели. Вода получается мягкой, еще и снабженной всевозможными полезными веществами. Все полезные свойства кремния еще не изучены до конца, в будущем его планирует плотно использовать медицина. Но для очищения воды в домашних условиях, его достаточно, только для небольших обьемов.
Если же вы хотите поставить определение жесткости воды на поток, то вам нужен не просто умягчитель, вам нужна водоподготовка. Обойтись одним фильтром проблематично. Вода для быта и вода для потребления несколько разные инстанции и требования к качеству немного отличаются.
Для максимальной защиты предприятия или семьи дома потребуется, как минимум два умягчителя воды. Причем один должен чистить всю воду, априори. Другой будет проводить дополнительную очистку, которая поможет получить качественную питьевую воду. Для общих целей больше всего подходят, да и их чаще всего, и используют ионообменный фильтр для воды и электромагнитный умягчитель воды АкваЩит. Для получения вкусной питьевой воды лучше всего подойдет обратный осмос или фильтр-кувшин. Если уж совсем экономично.
Для специальной очистки, которая нужна в той же фармакологии или микроэлектронике используют микро или нанофильтрацию. Из последовательного соединения всех этих приборов и складывается водоподготовка. Часто, когда обрабатывают первичную воду, такую систему дополнительно оснащают механическими фильтрами, обеззараживателями, кондиционерами и обезжелезивателями. Тогда чистка идет сто процентная. От А до Я.
В быту из всех фильтров больше всего сегодня помогают избавиться от карбонатной жесткости воды электромагнитные приборы АкваЩит. Еще совсем недавно самыми прогрессивными очистителями считались магнитные устройства. Но в процессе эксплуатации было выявлена уйма недостатков, которые очень быстро привели к закату «звезды» магнитного устройства. Тогда собственно и изобрели электромагнитный прибор, как улучшенный вариант магнита.
Ионообменный фильтр хоть и считается одним из самых старых способов понижения жесткости воды, но тем не менее сегодня по прежнему занимает лидирующие позиции. Хотя в работе он довольно затратный. Его фильтрующая смола после полного забивания солями жесткости требует замены или восстановления. Стоит сменный картридж не то, чтобы дорого, но и не дешево. Менять при этом фильтр приходится раз в квартал.
Теперь зададимся вопросом: как вычислить карбонатную жесткость воды? Вот лишь несколько способов, как это можно сделать:
- Сделать химический анализ на жесткость;
- Отдать исходную воду в лабораторию;
- Купить специальный тест-полоску, которая покажет точную жесткость питьевой воды;
- Обратиться к специалистам за помощью в определении жесткости воды.
Если это крупное промышленное предприятие, вычислить жесткость воды можно и иными способами. Смолу придется восстанавливать путем постоянных промывок с помощью сильносоленого раствора. Потом появляются проблемы с устранением отходов, которые к тому же сильно соленные и требуют доочистки для утилизации. Но умягчает воду такой прибор намного лучше любых других. Как эконом вариант, этот прибор для вычисления карбонатной жесткости необходим и незаменим.
Электромагнитный прибор заслужил море комплиментов при использовании в быту, а также на предприятиях теплоэнергетики. У него масса плюсов, которые выгодно выделяют его из основной массы умягчителей.
Вычислить карбонатную и некарбонатную жесткость воды можно по следующей формуле Ca 2+ + 2HCO 3 — = CaCO 3 ↓ + H 2 O + CO 2 ↑ или же такой H + + HCO 3 — H 2 CO 3 CO 2 + H 2 O
При всей компактности и удобстве, электромагнитный прибор в состоянии не просто связать карбонатную жесткость воды, он отлично поможет избавиться от старой накипи, застрявшей на стенках. И сделает это крайне осторожно и очень качественно. Достаточно проработать прибору месяц, как слой накипи на стенках уменьшиться значительно. Вам даже достаточно будет замерить слой накипи перед установкой прибора и спустя месяц. Разница будет ощутимой. И при этом за месяц, вам к прибору даже не придется притрагиваться. Полное отсутствие обслуживания также является немаловажным плюсом данного прибора для вычисления жесткости воды. И никакого привыкания к влиянию электромагнитных волн.
Акващит прекрасно сотрудничает с любыми поверхностями, ему не важно, из чего сделаны трубы, а также все равно с какой скоростью течет вода и холодная она, или горячая. Не работает такой прибор только с неподвижной водой. АкваЩит прекрасно уменьшает жесткость воды не меняя химический состав жидкости. Но поскольку он сам устраняет осадок, то стоячая вода ему не страшна.
При монтаже прибора следует помнить, что ставить его нужно только на чистую внутри трубу. С остатками старой накипи прибор справится, а вот сразу пробиться через нее не сможет. Поэтому место установки следует обязательно чистить.
Мы рассмотрели все варианты классификаций карбонатной жесткости воды, а также узнали как вычислить и как определить карбонатную жесткость. С нею сегодня есть масса возможностей справится. При этом достаточно недорогих. Так, что с целью защитить себя от вредного влияния некачественной воды лучше продумайте варианты установки системы подготовки воды заранее.
источник
Как отмечалось выше (разд. «Щелочность и кислотность») щелочность природной воды определяет, содержание карбонатов и гидрокарбонатов. Содержание этих компонентов в воде обусловлено процессами растворения атмосферного СОг, взаимодействия воды с находящимися в прилегающих грунтах известняками и, конечно, протекающими в воде жизненными процессами дыхания всех водных организмов.
Карбонат- и гидрокарбонат-анионы определяют титриметрическим методом, основанным на измерении водородого показателя (pH) по фенолфталеину (определение карбонат-анионов) или по метиловому оранжевому (определение гидрокарбонат-анионов) в качестве индикаторов. Используя эти два индикатора, удается наблюдать две точки эквивалентности: в первой точке (pH 8,0—8,2) в присутствии фенолфталеина полностью завершается титрование карбонат-анионов, а во второй (pH 4,1—4,5) — гидрокарбонат-анионов. По результатам титрования можно определить концентрации в анализируемом растворе основных ионных форм, обусловливающих связывание водородных ионов (гидроксил-, карбонат- и гидрокарбонат-анионов), а также свободной и общей щелочности воды, величины которой находятся в стехиометрической зависимости от содержания гидроксил-, карбонат- и гидрокарбонат-анио- нов. Для титрования обычно используют титрованные растворы соляной кислоты с точно известным значением концентрации — 0,05 либо 0,1 моль/л.
Определение карбонат-анионов основано на реакции
Присутствие карбонат-аниона в концентрациях, определяемых аналитически, возможно лишь в водах, pH которых более 8,0—8,2. В случае присутствия в анализируемой воде гидроксил-анионов при определении карбонатов протекает также реакция нейтрализации:
Определение гидрокарбонат-анионов основано на реакции
Таким образом, при титровании по фенолфталеину в реакции с кислотой участвуют анионы ОН — и СОз 2- , а при титровании по метиловому оранжевому — ОН — , СОз 2- и НСОз — .
Величина карбонатной жесткости рассчитывается с учетом эквивалентных масс участвующих в реакциях карбонат- и гидрокарбонат-анионов.
При анализе карбонатных природных вод результаты рассчитывают по расходу кислоты на титрование по фенолфталеину и метилоранжу. Если титрование в присутствии фенолфталеина обычно не вызывает затруднений, так как происходит изменение окраски от розовой до бесцветной, то в присутствии метилового оранжевого при изменении окраски от желтой до оранжевой определить момент окончания титрования иногда довольно сложно. Это может привести к значительной ошибке при определении объема кислоты, израсходованной на титрование. В этих случаях для более четкого выявления момента окончания титрования определение полезно проводить в присутствии контрольной пробы, для чего рядом с титруемой пробой помещают такую же порцию воды (во второй склянке), к которой добавлено такое же количество индикатора.
В результате титрования карбоната и гидрокарбоната, которое может выполняться как параллельно в разных пробах, так и последовательно в одной и той же пробе, для расчета значений концентраций необходимо определить общее количество кислоты в миллилитрах, израсходованной на титрование карбоната (Ук) и гидрокарбоната (Кгк). Следует иметь в виду, что при определении расхода кислоты на титрование по метилоранжу (Емо) происходит последовательное титрование и карбонатов, и гидрокарбонатов. По этой причине расходуемый на титрование объем кислоты Кмо обусловлен присутствием в исходной пробе карбонатов, перешедших после реакции с катионом водорода в гидрокарбонаты, и не характеризует только концентрацию гидрокарбонатов в исходной пробе. Следовательно, при расчете концентраций основных ионных форм, обусловливающих расход кислоты, необходимо учесть расход кислоты при титровании по фенолфталеину (Кф) и метилоранжу (Кмо)- Рассмотрим несколько возможных вариантов, сопоставляя величины Уф и Кмо.
- 1. Уф = 0. Карбонаты, а также гидроксил-анионы в пробе отсутствуют, и при титровании по метилоранжу объем кислоты связан только с присутствием гидрокарбонатов.
- 2. Кф*0, причем 2 УфУмо- В данном случае в исходной пробе гидрокарбонаты отсутствуют, но присутствуют не только карбонаты, но и другие потребляющие кислоту анионы, а именно гидроксил-анионы. При этом содержание последних эквивалентно Кон = 2 Уф — Кмо- Содержание карбонатов можно рассчитать, решив систему уравнений
5. Уф = Умо- В исходной пробе отсутствуют и карбонаты, и гидрокарбонаты, и потребление кислоты обусловлено присутствием сильных щелочей, содержащих гидроксил-анионы.
Присутствие свободных гидроксил-анионов в заметных количествах (случаи 4 и 5) возможно только в сточных или загрязненных водах.
Массовые концентрации анионов (не солей!) рассчитываются на основании уравнений реакций потребления кислоты карбонатами (Ск) и гидрокарбонатами (Срк.) в мг/л по формулам
где Ук и У к — объемы раствора соляной кислоты, израсходованные на титрование карбоната и гидрокарбоната соответственно, мл; Н — точная концентрация титрованного раствора соляной кислоты (нормальность), моль/л экв.; УА — объем пробы воды, взятой для анализа, мл; 60 и 61 — эквивалентная масса карбонат- и гидрокарбонат-аниона соответственно в соответствующих реакциях; 1000 — коэффициент пересчета единиц измерений. Результаты титрования по фенолфталеину и метилоранжу позволяют рассчитать показатель щелочности воды, который численно равен количеству эквивалентов кислоты, израсходованной на титрование пробы объемом 1 л. При этом потребление кислоты при титровании по фенолфталеину характеризует свободную щелочность, а по метилоранжу — общую щелочность (в ммоль/л). Показатель щелочности используется в России, как правило, при исследовании сточных вод. В некоторых странах (США, Канаде, Швеции и др.) щелочность определяется при оценке качества природных вод и выражается массовой концентрацией в пересчете на СаС03.
Следует иметь в виду, что при анализе сточных и загрязненных природных вод получаемые результаты не всегда корректно отражают свободную и общую щелочности, так как в анализируемых пробах воды наряду с карбонатами и гидрокарбонатами, могут присутствовать другие соединения (см. «Щелочность и кислотность»).
Пипетка на 2 мл или на 5 мл, мерный шприц с наконечником и соединительной трубкой; пипетка-капельница; склянка с меткой «10 мл».
Раствор индикатора метилового оранжевого (0,1%) водный; раствор индикатора фенолфталеина; раствор соляной кислоты титрованный (0,05 моль/л).
Приготовление растворов см. приложение 3.
А. Титрование карбонат-аниона
1. В склянку налейте до метки (10 мл) анализируемую воду.
2. Добавьте пипеткой 3—4 капли раствора фенолфталеина.
Примечание. При отсутствии окрашивания раствора либо при слабо-розовом окрашивании считают, что карбонат-анион в пробе отсутствует (pH пробы менее 8,0—8,2).
3. Постепенно титруйте пробу с помощью мерного шприца с наконечником либо мерной пипетки раствором соляной кислоты (0,05 моль/л) до тех пор, пока окраска побледнеет до слабо-розовой (практически бесцветной), и определите объем раствора соляной кислоты, израсходованный на титрование по фенолфталеину (Уф, мл).
Раствор после титрования карбонат-аниона оставьте для дальнейшего определения в нем массовой концентрации гидрокарбонат-аниона.
Б. Титрование гидрокарбонат-аниона
4. В склянку налейте до метки (10 мл) анализируемую воду либо используйте раствор после определения карбонат-аниона.
5. Добавьте пипеткой 1 каплю раствора метилового оранжевого.
Примечание. Для более четкого определения момента окончания титрования определение полезно проводить в присутствии контрольной пробы, для чего рядом с титруемой пробой помещают такую же порцию анализируемой воды (во второй склянке), к которой добавлено такое же количество индикатора.
6. Постепенно титруйте пробу с помощью мерного шприца с наконечником раствором соляной кислоты (0,05 моль/л) при перемешивании до перехода желтой окраски в оранжевую, определяя общий объем раствора, израсходованного на титрование по метилоранжу (Ую, мл). При использовании раствора после определения карбонат-аниона необходимо определить суммарный объем, израсходованный на титрование карбоната и гидрокарбоната.
Примечание. При титровании обязательно перемешивайте раствор ! Момент окончания титрования определяйте по контрольной пробе.
В. Определение ионных форм, обусловливающих потребление кислоты на титрование В зависимости от соотношения между количествами кислоты, израсходованными на титрование по фенолфталеину (Уф) и метилоранжу (КМо), по табл. IV. 12 выберите подходящий вариант для вычисления ионных форм, обусловливающих потребление кислоты при титровании.
Таблица IV. 12. Определение ионных форм, обусловливающих потребление кислоты на титрование
источник
Для определения карбонатной жёсткости титруют некоторый объем исследуемой воды стандартным раствором соляной кислоты в присутствии индикатора метилового оранжевого. При этом протекают реакции с гидрокарбонатами:
При достижении точки эквивалентности, когда прореагируют все карбонаты и гидрокарбонаты, индикатор меняет окраску с желтой на оранжевую.
Поскольку содержание карбонатов обычно во много раз меньше, чем содержание гидрокарбонатов, а именно присутствие последних определяет наличие у воды временной жёсткости, такое определение иногда называют определением временной жёсткости. При этом предполагают, что содержание карбонатов настолько мало, что их вкладом в постоянную жёсткость можно пренебречь.
При определении общей жёсткости используют метод титрования, который называется комплексонометрическим методом, так как в нем используются вещества с общим названием комплексоны. Один из комплексонов, наиболее широко применяемый — трилон Б (это торговая марка, под которой впервые был выпущен этот химический продукт). Он представляет производное органической кислоты, в составе молекулы которого присутствуют два атома водорода, способные замещаться на атомы металла. Не рассматривая строения молекулы трилона Б, используем ее общепринятое условное обозначение: H2Y.
Определение основано на том, что ионы кальция и магния образуют растворимые комплексные соединения с Трилоном Б:
В качестве индикаторов используют реактивы, которые дают с определяемыми ионами характерно окрашенные соединения. При достижении точки эквивалентности, когда почти все ионы Ca 2+ и Mg 2+ связываются с трилоном Б в комплексы и их концентрация в растворе резко уменьшается, окраска раствора меняется. Титрование необходимо проводить в слабощелочной среде (для связывания образующихся ионов водорода), поэтому к титруемому раствору кроме индикатора добавляют так называемый буферный раствор, который обеспечивает постоянство величины pH (при осуществлении данного титрования добавляют аммиачный буферный раствор, который поддерживает постоянство pH в пределах 8…10 единиц).
1. Методом кислотно-основного титрования определить карбонатную жёсткость водопроводной воды.
2. Методом комплексонометрического титрования определить общую жёсткость водопроводной воды.
3. По экспериментальным данным сделать вывод об уровне жёсткости исследованной воды и рассчитать величину постоянной жёсткости.
Опыт 1. Определение карбонатной жёсткости
В две конические колбы налить по 100 мл исследуемой (водопроводной) воды (отмерив ее мерным цилиндром), добавить 5-6 капель раствора индикатора метилового оранжевого. Одна из колб является контрольной, т.е. используется, чтобы заметить изменение окраски раствора в другой колбе при титровании. Записать начальный уровень титранта в бюретке.
Перед титрованием убеждаются, что в бюретке достаточно раствора, а стеклянный носик полностью заполнен жидкостью. Пузырьки воздуха из носика выдавливают потоком жидкости, повернув трубку носика вверх под углом около 45°. Выпускное устройство бюретки представляет резиновую трубку со стеклянным шариком внутри. Для вытекания жидкости слегка оттягивают большим и указательным пальцем стенку трубки от шарика, чтобы между ними образовался просвет. Наполняют бюретку через воронку, после чего воронку вынимают из верхнего отверстия; если этого не сделать, во время титрования с воронки может стечь оставшийся в ней раствор, и измерение объема окажется неточным.
При необходимости долить раствор титранта в бюретку, доведя уровень до нулевого деления. Во вторую колбу из бюретки прибавлять 0,1 н. раствор соляной кислоты до перехода окраски индикатора из желтой в оранжевую (получаемый цвет, скорее, можно назвать персиковым).
Поверхность жидкости в бюретке представляется широкой вогнутой полосой (мени́ск). Отсчет значений по шкале производят по нижнему краю мениска, глаз наблюдателя должен находиться на уровне мениска. Титрант из бюретки сначала приливают достаточно быстро, непрерывно перемешивая содержимое колбы вращательными движениями. На шарик надавливают левой рукой, а колбу держат и перемешивают правой рукой. Титрование проводят стоя! За окраской раствора наблюдают, подложив под колбу лист белой бумаги для лучших условий наблюдения. По мере приближения к концу титрования, о чем можно судить по появлению в центре колбы «облачка» розовой окраски, тут же исчезающего при дальнейшем перемешивании, титрант приливают уже по каплям. Раствор должен изменить цвет от прибавления одной определенной капли; в этот момент розовое «облачко» не исчезнет, а распространится по всему раствору.
Чтобы убедиться в отсутствии значительных случайных ошибок при выполнении титрования и при отмеривании объема титруемого раствора, титрование повторяют два-три раза и рассчитывают среднюю величину Vстанд, которую в дальнейшем используют для расчетов.
Записать уровень раствора в бюретке и вычислить объем титранта, пошедший на титрование, как разность конечного и начального отсчетов. Титрование повторить (можно использовать «контрольную колбу»). Рассчитать объем стандартного раствора как среднее по результатам двух титрований. Вычислить карбонатную жёсткость Жкарб исследуемой воды (в ммоль экв/л) по формуле:
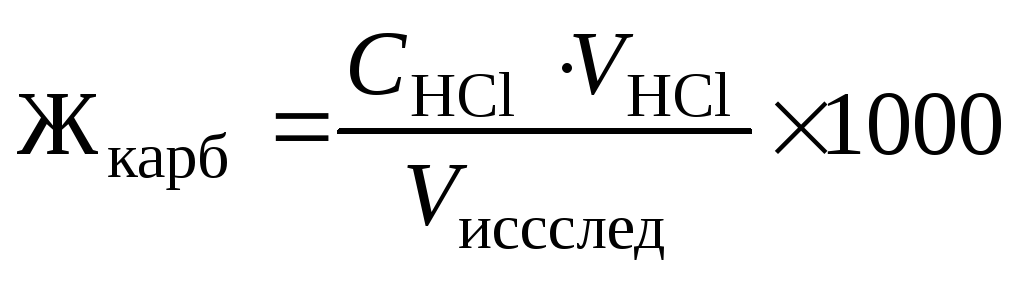
где СHCl — молярная концентрация эквивалента (нормальность) раствора соляной кислоты; VHCl — объем соляной кислоты, пошедший на титрование; Vисслед — объем исследуемой воды; 1000 — коэффициент перехода от моль экв/л к ммоль экв/л.
Опыт 2. Определение общей жёсткости
Титрование проводят в присутствии индикатора «хром темно-синий». В коническую колбу налить 25 мл исследуемой воды и добавить дистиллированной воды до общего объема 100 мл (отмерять цилиндром). Добавить 5 мл аммиачного буферного раствора и 5-7 капель раствора индикатора хрома темно-синего; при этом раствор приобретает винно-красную окраску.
Записать начальный уровень титранта в бюретке. При необходимости долить раствор титранта в бюретку, доведя уровень до нулевого деления. Из бюретки по каплям прибавлять 0,1 н. раствор трилона Б до изменения окраски раствора от винно-красной до синевато-сиреневой.
В отличие от титрования в первом опыте, где реакция протекает практически мгновенно, взаимодействие трилона Б с кальцием и магнием требует некоторого заметного промежутка времени. Чтобы не пропустить момент достижения точки эквивалентности, титрант с самого начала титрования добавляют отдельными каплями с интервалом в две-три секунды, внимательно наблюдая, не меняется ли окраска титруемого раствора. Если приливать титрант быстрее, то некоторое количество его попадет в уже оттитрованный раствор, который еще не успел поменять окраску; в результате раствор будет перетитрован, а объем пошедший на титрование — завышен.
Записать уровень раствора в бюретке и вычислить объем титранта, пошедший на титрование, как разность конечного и начального отсчетов. Титрование повторить. Рассчитать объем стандартного раствора как среднее по результатам двух титрований. Вычислить общую жёсткость Жобщ исследуемой воды (в ммоль экв/л) по формуле:
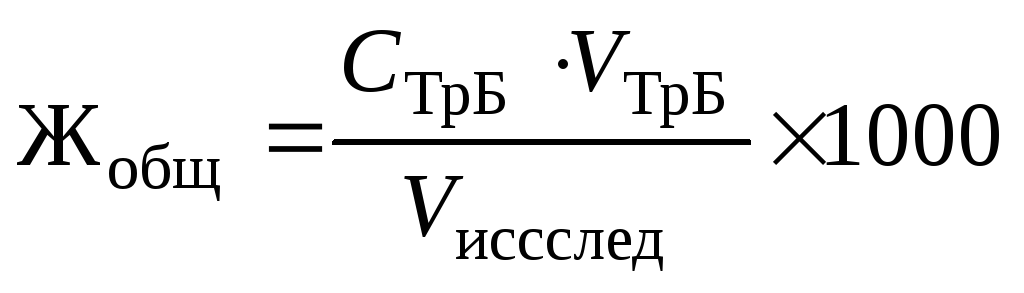
где СТрБ — молярная концентрация эквивалента (нормальность) раствора трилона Б; VТрБ — объем трилона Б, пошедший на титрование; Vисслед — объем исследуемой воды; 1000 — коэффициент перехода от моль экв/л к ммоль экв/л.
По полученным данным сделать вывод об уровне жёсткости исследованной воды.
Пренебрегая вкладом карбонатов в величину постоянной жёсткости и считая, что в данном случае временная жёсткость воды совпадает с карбонатной жёсткостью, т.е. Жкарб = Жвр, рассчитать постоянную жёсткость воды по разности между общей и временной жёсткостью.
источник
Жесткость воды. Мягкая вода. Жесткая вода. Перевод единиц (градусов) жесткости воды. Нормы жесткости воды. Таблицы значений жесткости воды.
Жесткость воды. Мягкая вода. Жесткая вода. Перевод единиц (градусов) жесткости воды. Нормы жесткости воды. Таблицы значений жесткости воды.
- жёсткой называется вода с большим содержанием солей ,
- мягкой с малым содержанием
«Жёсткая» вода — исторически: ткань, постиранная с использованием мыла на основе жирных кислот в жёсткой воде — более жёсткая на ощупь. Этот факт объясняется, с одной стороны, отложением на ткани кальциевых и магниевых солей жирных кислот, образующихся в процессе стирки. С другой стороны, волокна ткани обладают ионообменными свойствами, и, как следствие, свойством сорбировать многовалентные катионы — на молекулярном уровне.
- временная (карбонатная) жёсткость, — обусловлена гидрокарбонатами кальция и магния Са(НСО3)2; Mg(НСО3)2,
- постоянная (некарбонатная) жёсткость — вызванную присутствием других солей, не выделяющихся при кипячении воды: в основном, сульфатов и хлоридов Са и Mg (CaSO4, CaCl2, MgSO4, MgCl2).
С 1 января 2014 года в России введен межгосударственный стандарт ГОСТ 31865-2012 «Вода. Единица жесткости». По новому ГОСТу жесткость выражается в градусах жесткости (°Ж). 1 °Ж соответствует концентрации щелочноземельного элемента, численно равной 1/2 его миллимоля на литр (1 °Ж = 1 мг-экв/л). В разных странах использовались (иногда используются до сих пор) различные внесистемные единицы — градусы жёсткости.
| Жесткость, °Ж | Кальций, мг/л | Магний, мг/л | |
|---|---|---|---|
| Москва | 2,0-5,5 | 46 | 11 |
| Париж | 5,0-6,0 | 90 | 6 |
| Берлин | 5,0-8,8 | 121 | 12 |
| Нью-Йорк | 0,3-0,4 | 6 | 1 |
| Сидней | 0,2-1,3 | 15 | 4 |
- Рекомендации всемирной организации здравоохранения (ВОЗ) для питьевой воды:
- кальций – 20-80 мг/л; магний – 10-30 мг/л. Для жесткости какой-либо рекомендуемой величины не предлагается. Московская питьевая вода по данным показателям соответствует рекомендациям ВОЗ.
- Российские нормативные документы (СанПиН 2.1.4.1074-01 и ГН 2.1.5.1315-03) для питьевой воды регламентируют:
- кальций – норматив не установлен; магний – не более 50 мг/л; жесткость — не более 7°Ж.
- Норматив физиологической полноценности бутилированной воды (СанПиН 2.1.4.1116-02):
- кальций – 25-130 мг/л; магний – 5-65 мг/л; жесткость – 1,5-7°Ж.
- По содержанию кальция и магния бутилированная вода высшей категории официально ничем не лучше воды из-под крана
| °Ж = 1 мг-экв/л | mmol/L | ppm, mg/L | dGH, °dH | gpg | °e, °Clark | °fH | |
| 1 русский °Ж = 1 мг-экв/л это: | 1 | 0,5 | 50,05 | 2,804 | 2,924 | 3,511 | 5,005 |
|---|---|---|---|---|---|---|---|
| 1 ммоль/л = mmol/L это: | 2 | 1 | 100.1 | 5.608 | 5.847 | 7.022 | 10.01 |
| 1 американский° ppmw = mg/L = American degre: | 0,01998 | 0.009991 | 1 | 0.05603 | 0.05842 | 0.07016 | 0.1 |
| 1 немецкий° dGH, °dH это: | 0,3566 | 0.1783 | 17.85 | 1 | 1.043 | 1.252 | 1.785 |
| 1 американская популярная ед. gpg это: | 0,342 | 0.171 | 17.12 | 0.9591 | 1 | 1.201 | 1.712 |
| 1 английский °e, °Clark это: | 0,2848 | 0.1424 | 14.25 | 0.7986 | 0.8327 | 1 | 1.425 |
| 1 французский °fH это: | 0,1998 | 0.09991 | 10 | 0.5603 | 0.5842 | 0.7016 | 1 |
| Пример: 1 °Ж = 50,05 ppm | |||||||
- американские градусы жесткости воды, внимание тут два пункта:
- gpg = Grains per Gallon: 1 гран (0.0648 г) CaCO3 в 1 американском галлоне (3.785 л) воды. Поделив граммы на литры получаем: 17.12 мг/л СаСО3 — это не «американский градус», но очень употребляемая в штатах величина жесткости воды.
- американский градус = ppmw = mg/L = American degre: 1 часть CaCO3 в 1000000 частей воды 1мг/л CaCO3
- английские градусы жесткости воды = °e = °Clark: 1 гран (0.0648 г) в 1 английском галлоне (4.546) л воды = 14.254 мг/л CaCO3
- французские градусы жесткости воды (°fH or °f) (fh): 1 часть CaCO3 в 100000 частей воды, или 10 мг/л CaCO3
- немецкие градусы жесткости воды = °dH (deutsche Härte = «немецкая жесткость» может быть °dGH (общая жесткость) или °dKH (для карбонатной жёсткости)): 1 часть оксида кальция – СаО в 100000 частей воды, или 0.719 частей оксида магния – MgO в 100000 частей воды, что дает 10 мг/л СаО или 7.194 мг/л MgO
- русский (РФ) градус жесткости воды °Ж = 1 мг-экв/л: соответствует концентрации щелочноземельного элемента, численно равной 1/2 его миллимоля на литр, что дает 50,05 мг/л CaCO3 or 20.04 мг/л Ca2+
- ммоль/л = mmol/L: соответствует концентрации щелочноземельного элемента, численно равной 100.09 мг/л CaCO3 or 40.08 мг/л Ca2+
- Термоумягчение. Основан на кипячении воды, в результате термически нестойкие гидрокарбонаты кальция и магния разлагаются с образованием накипи:
- Ca(HCO3)2 → CaCO3↓ + CO2 + H2O.
- Кипячение устраняет только временную (карбонатную) жёсткость. Находит применение в быту.
- Реагентное умягчение. Метод основан на добавлении в воду кальцинированной соды Na2CO3 или гашёной извести Ca(OH)2. При этом соли кальция и магния переходят в нерастворимые соединения и, как следствие, выпадают в осадок. Например, добавление гашёной извести приводит к переводу солей кальция в нерастворимый карбонат:
- Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
- Лучшим реагентом для устранения общей жесткости воды является ортофосфат натрия Na3PO4, входящий в состав большинства препаратов бытового и промышленного назначения:
- 3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaHCO3
- 3MgSO4 + 2Na3PO4 → Mg3(PO4)2↓ + 3Na2SO4
- Ортофосфаты кальция и магния очень плохо растворимы в воде, поэтому легко отделяются механическим фильтрованием. Этот метод оправдан при относительно больших расходах воды, поскольку связан с решением ряда специфических проблем: фильтрации осадка, точной дозировки реагента.
- Катионирование. Метод основан на использовании ионообменной гранулированной загрузки (чаще всего ионообменные смолы). Такая загрузка при контакте с водой поглощает катионы солей жёсткости (кальций и магний, железо и марганец). Взамен, в зависимости от ионной формы, отдаёт ионы натрия или водорода. Эти методы соответственно называются Na-катионирование и Н-катионирование.
- При правильно подобранной ионообменной загрузке жёсткость воды снижается при одноступенчатом натрий-катионировании до 0,05-0,1 °Ж, при двухступенчатом — до 0,01 °Ж.
- В промышленности с помощью ионообменных фильтров заменяют ионы кальция и магния на ионы натрия и калия, получая мягкую воду.
- Обратный осмос. Метод основан на прохождении воды через полупроницаемые мембраны (как правило, полиамидные). Вместе с солями жёсткости удаляется и большинство других солей. Эффективность очистки может достигать 99,9 %.
- Различают нанофильтрацию (условный диаметр отверстий мембраны равен единицам нанометров) и пикофильтрацию (условный диаметр отверстий мембраны равен единицам пикометров).
- В качестве недостатков данного метода следует отметить:
- — необходимость предварительной подготовки воды, подаваемой на обратноосмотическую мембрану;
- — относительно высокая стоимость 1 л получаемой воды (дорогое оборудование, дорогие мембраны);
- — низкую минерализацию получаемой воды (особенно при пикофильтрации). Вода становится практически дистиллированной.
- Электродиализ. Основан на удалении из воды солей под действием электрического поля. Удаление ионов растворенных веществ происходит за счёт специальных мембран. Так же как и при использовании технологии обратного осмоса, происходит удаление и других солей, помимо ионов жёсткости.
источник
Карбонатная временная жесткость определяется по содержанию. Определение карбонатной жесткости воды. Жесткость воды, методы ее определения
О том, что такое «жесткость аквариумной воды, и в чем её выражают » мы уже писали. Но напомню вкратце, что жесткость подразделяют на постоянную и временную. Временная , она же карбонатная , она же устранимая жесткость связана с присутствием в воде наряду с катионами Ca 2+ и Mg 2+ гидрокарбонатных, или бикарбонатных анионов (HCO 3 — ) . При кипячении воды, гидрокарбонатные анионы вступают в реакцию с этими катионами и образуют с ними очень мало растворимые карбонатные соли, которые выпадают в осадок.
Твердость воды является традиционной мерой способности воды реагировать с мылом. Для жесткой воды требуется значительное количество мыла для получения пены, что также приводит к уменьшению количества труб горячей воды, котлов и других бытовых приборов. Жесткость воды вызвана растворенными поливалентными металлическими ионами. В пресных водах основными вызывающими твердость ионами являются кальций и магний; ионов стронция, железа, бария и марганца. Твердость может быть измерена реакцией поливалентных металлических ионов в образце воды с хелатирующим агентом, таким как этилендиаминтетрауксусная кислота, и обычно выражается как эквивалентная концентрация карбоната кальция. Твердость также может быть оценена путем определения концентраций отдельных компонентов твердости и выражения их суммы в терминах эквивалентного количества карбоната кальция.
Ca 2+ + 2HCO 3 — = CaCO 3 ↓ + H 2 O + CO 2
Временную жесткость можно устранить кипячением — отсюда и ее название. Аквариумисту невредно знать карбонатную жесткость воды в своих аквариумах. Это важный гидрохимический показатель, который часто приводится в справочной литературе, касающейся условий содержания и нереста рыб. Важно учитывать этот показатель и при выращивании многих аквариумных растений. Большинство аквариумистов уверенно, что с помощью продающихся в магазинах капельных тестов на карбонатную жесткость (КН) они определяют именно её. Но это забавное НЕДОРАЗУМЕНИЕ! Капельные тесты для аквариумистов-любителей, как в прочем и классический метод определения карбонатной жесткости путем титрования пробы воды соляной кислотой, измеряют вовсе не жесткость как таковую, то есть не концентрацию ионов кальция и магния, а щелочность — концентрацию в растворе гидрокарбонатных ионов . Гидрокарбонатные ионы могли оказаться в воде не только при растворении солей кальция и магния, поэтому судить о наличии ионов Ca 2+ и Mg 2+ по содержанию гидрокарбонатных ионов можно далеко не всегда. Но, обо всем по порядку…
Степень твердости питьевой воды может быть классифицирована по концентрации ее карбоната кальция следующим образом: мягкая, от 0 до. Хотя твердость вызвана катионами, ее часто обсуждают в терминах карбонатной и некарбонатной жесткости. Твердость карбоната относится к количеству карбонатов и бикарбонатов, которые могут быть удалены или осаждены из раствора кипячением. Этот тип твердости отвечает за отложение окалины в трубах горячей воды и чайных чайниках. Некарбонатная жесткость обусловлена ассоциацией катионов, вызывающих твердость, с сульфатами, хлоридами и нитратами.
Если строго следовать определению карбонатной жесткости, то ее корректное измерение должно быть основано на кипячении заданного объема воды с последующим взвешиванием образовавшегося осадка (накипи). На практике это трудно выполнимо. Поэтому поступают иначе. Вот как определяют «карбонатную жесткость» с помощью общепринятой лабораторной методики.
Определение карбонатной жесткости воды проводится путем её титрования соляной кислотой. Титрование — это добавление в исследуемую пробу раствора реагента, концентрация которого заранее известна. По расходу этого реагента — он взаимодействует с тем веществом, содержание которого хотят определить, рассчитывают концентрацию определяемого вещества. В данном тесте принято пользоваться 0.05М раствором соляной кислоты (о том, что означает сокращение «М» можно прочитать ). Кроме этого, понадобится индикатор метиловый оранжевый , который необходим для того, чтобы установить момент окончания титрования по резкому изменению цвета пробы. Для приготовления раствора индикатора небольшое его количество, 0.1 г растворяют в 100 мл дистиллированной воды. Точность здесь не требуется, можно все сделать на глазок.
Как правило, эти реактивы есть в любой химической лаборатории.
Он также упоминается как «постоянная твердость», потому что его нельзя удалить кипячением. Щелочность, показатель буферной способности воды, тесно связана с твердостью. По большей части щелочность образуется анионами или молекулярными видами слабых кислот, главным образом гидроксидом, бикарбонатом и карбонатом; другие виды, такие как бораты, фосфаты, силикаты и органические кислоты, также могут вносить небольшой вклад. Хотя многочисленные виды растворенных веществ могут способствовать щелочности воды, щелочность выражается в эквивалентном количестве карбоната кальция.
Проведение лабораторного теста на карбонатную жесткость:
Точно отмеряют 50 мл исследуемой воды. Добавляют несколько капель раствора метилового оранжевого, столько, чтобы окраска пробы получилось такой как в левом стаканчике на приведенном ниже рисунке:
При титровании в растворе произойдут следующие реакции:
Поскольку щелочность большинства канадских поверхностных вод обусловлена наличием карбонатов и бикарбонатов, их щелочность близка к их твердости. Основными природными источниками твердости в воде являются осадочные породы, просачивание и сток из почв. В общем, твердые воды происходят в районах с толстыми слоями почвы и известняка. Грунтовые воды обычно сложнее поверхностных вод. Грунтовые воды, богатые углекислотой и растворенным кислородом, обычно обладают высокой сольватирующей способностью; в контакте с почвой или породами, содержащими значительное количество минералов, таких как кальцит, гипс и доломит, могут иметь место уровни твердости до нескольких тысяч миллиграммов на литр.
H + + HCO 3 — H 2 CO 3 CO 2 + H 2 O
Давайте сравним это и приведенное выше уравнение, которое показывало, что происходит с гидрокарбонатом кальция при кипячении. Как и при кипячении, конечными продуктами этих реакций являются вода и углекислый газ. Только вот кальций никак тут не участвует. Это и понятно, ведь ионы водорода, которые поступают в тестируемую воду при добавлении туда соляной кислоты, вступают в реакцию не с ионами кальция, а именно с гидрокарбонатными ионами.
Кислоту удобно набрать в шприц до отмеченного заранее деления и из него дозировано добавлять в раствор. Сначала порции кислоты могут быть относительно большими, но к концу титрования надо быть аккуратным и осторожным, цвет может поменяться буквально от одной капли. Способность тестируемой воды реагировать с ионами водорода по мере добавления кислоты будет постепенно уменьшаться и, наконец, окажется почти совсем исчерпанной — кончатся гидрокарбонатные ионы и последняя капля кислоты резко сместит в сторону кислых значений, так как связывать возникающие при ее диссоциации в воде ионы водорода уже будет «некому». При величине рН меньшей чем 4.3 гидрокарбонатных ионов в растворе уже нет (подробнее об этом рассказано ). Индикатор при этом значении рН изменит цвет раствора с желтого на оранжевый. Тут титрование надо будет прекратить. Титровать надо не торопясь, аккуратно перебалтывая воду в стаканчике. Лучше проделать эту процедуру несколько раз, точно засекая какой объем кислоты был израсходован. Затем вычислить СРЕДНИЙ ОБЪЕМ пошедшей на титрование кислоты. Зная этот объем рассчитывают карбонатную жесткость по формуле:
Двумя основными промышленными источниками твердости являются неорганическая химическая и горнодобывающая промышленность. Промышленные источники кальция и магния были кратко обсуждены в обзорах кальция и магния. Уровни твердости в Приморских провинциях не контролировались. В обзоре национального качества воды в качестве представителя канадских вод было выбрано 41 место.
Эти города были в Онтарио и Саскачеване. Катионы, которые являются основными факторами, влияющими на твердость — кальций и магний, не являются непосредственной проблемой общественного здравоохранения. Эти параметры обсуждаются далее в отдельных обзорах.
Жесткость карбонатная (мг-экв/л) = (1000*С кислоты *V кислоты ):V воды
Где С кислоты — концентрация кислоты в молях (М/л), V кислоты — объем раствора кислоты использованный при титровании (мл), V воды — объем пробы воды, взятой для титрования (мл).
Если С кислоты = 0.05 М , а V воды = 50 мл , то
Жесткость карбонатная (мг-экв/л) = (1000*0.05*V кислоты ):50 = V кислоты
Ряд эпидемиологических исследований, в том числе в Канаде, Англия, Австралия и Соединенные Штаты, предположили, что существует обратная статистическая корреляция между жесткостью питьевой воды и некоторыми типами сердечно-сосудистых заболеваний. Другие работники, — сообщили, что существенные корреляции не могут быть продемонстрированы. Поэтому нельзя сделать никаких выводов.
Был проведен ряд других исследований, чтобы определить, существуют ли какие-либо связи между жесткостью питьевой воды и другими заболеваниями, включая рак., Опять же, обратные корреляции не было, но значение этих данных является дискуссионным. Внутреннее водоснабжение часто смягчается добавлением извести и кальцинированной соды или использованием ионообменной цеолитов. Умягчение воды может привести к добавлению в воду высоких уровней натрия, особенно в тех случаях, когда используются некоторые процессы ионного обмена.
То есть если вы титровали 50 мл воды 0.05 М соляной кислотой, то в этом случае карбонатная жесткость в мг-экв/л будет численно равна объему кислоты (в мл), израсходованному для титрования. Например, если на титрование ушло 1.5 мл раствора кислоты, то карбонатная жесткость воды равна 1.5 мг-экв/л. Для перевода в градусы KH значение в мг-экв/л надо умножить на 2.804: 1.5*2.804=4.2°KH.
Хочу еще раз обратить ваше внимание на то, что описанный здесь метод анализа воды, обычно называют методом определения «карбонатной жесткости» . На самом деле этим методом мы определили ЩЕЛОЧНОСТЬ воды , то есть ее способность связывать ионы водорода, которые образуются при диссоциации в воде сильной кислоты. Покупные капельные тесты для аквариумной воды (KH-test, или тест на КН) также основаны на титровании воды кислотой и так же, как и описанный выше лабораторный тест, определяют щелочность. Надо полагать, что указанные в справочной литературе величины КН отражают не содержание в воде бикарбонатов кальция и магния, как об этом принято писать во всех аквариумных книжках, а именно щелочность, то есть любых бикарбонатов и других анионов, способных реагировать с ионами водорода. Хорошо это, или плохо? Скорее — хорошо. Для аквариумиста как раз важно знать насколько вода в его аквариуме способна противостоять закислению (нейтрализовывать поступающие в нее ионы водорода ). А сколько осадка такая вода даст на стенках труб в системе отопления, снизив при этом теплоотдачу, волнует его не сильно, если конечно он не теплотехник. Вспомним, что жесткость воды понятие не научное, а чисто утилитарное, но об этом уже было написано ранее .
Хотя прямая связь между натрием и гипертонией не установлена у людей, считается целесообразным избегать ненужного добавления натрия в питьевую воду. Недавно рабочая группа Всемирной организации здравоохранения по проблемам потребления натрия в питьевой воде рекомендовала «не поощрять тенденции к излишнему потреблению натрия в водоснабжении». Поэтому рекомендуется, чтобы, когда считается, что смягчение воды путем ионного обмена является необходимым, отдельное несдержанное водоснабжение должно быть сохранено для питьевых и кулинарных целей.
Как мы уже отмечали, гидрокарбонатный ион может поступать в воду не только при растворении карбонатов кальция и магния, но и при растворении иных солей. Всем известная питьевая сода являет собой пример такого соединения: NaHCO 3 . Если внести питьевую соду в аквариум, то растворившись она даст ионы натрия и гидрокарбоната (о том, как растворяются соли в воде рассказано в статье о минерализации воды). Гидрокарбонатные ионы, как мы уже знаем, присоединяют к себе ионы водорода, поэтому вода в аквариуме от внесения питьевой соды становится менее кислой или приобретает щелочную реакцию — тут все зависит от дозы. Вот Вам и средство рН+! Питьевой содой и на самом деле пользуются многие аквариумисты. Небольшие ее добавки действительно застрахуют от неожиданных скачков рН. Решить достаточно соды внесено или нет можно измерив щелочность. Зная щелочность, вы можете оценить насколько вода в вашем аквариуме способна противостоять закислению — как говорят оценить БУФЕРНОСТЬ. Если щелочность пресной воды низкая (менее 1 мг-экв/л, или 2.804 о КН ), то и буферность ее невелика. Такая вода может резко скиснуть, например при пропуске очередной или при выключении аэрации на ночь. Интервал значений щелочности 1.2-1.8 мг-экв/л, или 3 — 5 о КН пригоден для большинства рыб и растений. Буферность воды при этом будет вполне достаточной для поддержания стабильной активной реакции воды — рН. Обычно щелочность аквариумной воды как раз и оказывается в указанном интервале или даже имеет еще большие значения — 2.5 мг-экв/л, или 7 о КН и выше (в этом случае возможны проблемы с выращиванием многих растений и нашествия водорослей). Но в регионах с мягкой слабокислой водой она может быть очень низкой. Так, в большинстве районов Петербурга водопроводная вода имеет щелочность 0.5 мг-экв/л. Поэтому многие любители африканских цихлид, для которых кислая вода — это нож острый, искусственно ее поднимают с помощью питьевой соды. Но! Если вы вносили в аквариум соду, чтобы поднять и стабилизировать рН, то вам не надо удивляться, если «карбонатная жесткость» вдруг превысит общую. Кстати, есть и природные воды с карбонатной жесткостью, превышающей общую, например, вода озера Танганьика. Этот результат может удивить, если не знать, что на самом деле определяет тест на карбонатную жесткость. Если вы вносили в воду аквариума NaHCO 3 , то есть не связанные с кальцием и магнием гидрокарбонатные ионы, то, естественно, их будет больше, чем ионов Са 2+ и Мg 2+ . Вот в этом и состоит суть парадокса, когда вполне логичная формула:
В районах с жесткой водой бытовые трубы могут забиваться с помощью шкалы; жесткие воды также вызывают инкрустации на кухонную утварь и увеличивают потребление мыла. Таким образом, жесткая вода является и неприятностью, и экономическим бременем для потребителя.
Одновременное определение общей некарбонатной и карбонатной жесткости воды с помощью прямой потенциометрии. Качество поверхностных вод в Канаде — обзор. Отдел качества воды, Управление внутренних вод. Химия для инженеров-сантехников. 2-е издание. Промышленные водные ресурсы Канады. Сфера применения, процедура и интерпретация обследований. Принцесса королевы, Оттава.
Общая жесткость = Постоянная жесткость + Временная жесткость
не выполняется из-за того, что временная больше общей .
Понимание сути вещей порой позволяет творить чудеса, по крайней мере в глазах человека несведущего. Приносят нам как-то аквариумную воду на анализ. Надо мол разобраться рыбки всё дохнут и дохнут. На вопрос, измеряли ли рН? Нас заверили, что с рН совершенно точно все нормально. Ладно. Начали с измерения общей жесткости, потом карбонатную определили. Получилось, что карбонатная в несколько раз общую превосходит. Тут все уже ясно. Спрашиваем — зачем столько соды в аквариум насыпаете? Очень удивились, как мы про соду узнали. Оказывается добавление соды при каждой подмене воды — это де секретный и особо эффективный метод подсказанный по знакомству одним знатоком. Он, мол, гарантирует неизменно замечательный и оптимальный рН. Даже если чистить аквариумы редко, то вода не закиснет. Закиснуть-то она не закиснет. Но каково значение рН? Вы измеряли? Он же у вас больше 8 будет. А рыбки не только от кислой воды мрут . Нет отвечают, мы не измеряли. Сделали тест на рН. Он и в самом деле показал значение больше 8!
Определения и классификация естественно мягких и естественно жестких вод. Химические и физические характеристики воды в некоторых государствах-членах Европейского сообщества. В: Твердость питьевой воды и общественного здоровья. Труды Европейского научного коллоквиума, Люксембурга.
Качество потока в Аппалачии, связанное с дренажом угольных шахт, В: Качество воды в напряженной среде: показания в гидрологии окружающей среды. Национальный банк данных о качестве воды. Директорат по внутренним водам, Отдел качества воды, Окружающая среда Канады.
А Вы измеряете рН в своем аквариуме, или он у Вас и так «хороший»?
* Здесь мы несколько упростили ситуацию. Все сказанное верно, если рН аквариумной воды 8.3 и ниже. Если же этот показатель выше значения 8.3, то в воде возможно присутствие не только гидрокарбонатов, но еще и карбонатов и даже гидроксидов щелочных металлов. В этом случае при добавлении кислоты в воду будут последовательно происходить следующие реакции:
OH — + H + -> H 2 O
CO 3 2 — + H + -> HCO 3 —
HCO 3 — + H +
Воды озера Гурон и озеро Верхнее. Доклад Международной совместной комиссии. Онтарио Министерство окружающей среды. Данные о качестве воды, озер и рек Онтарио. Отдел водных ресурсов. Связь между смертностью и жесткостью воды в Канаде. Краткое описание работы, системы водоснабжения Городская и частная секция, Отдел контроля загрязнения. Бюро эпидемиологии, здравоохранения и социального обеспечения Канады.
Ишемическая болезнь сердца, жесткость воды и миокардиальный магний. Внезапная смерть и ишемическая болезнь сердца. Распространенность и патологические изменения ишемической болезни сердца в жесткой воде и в области мягкой воды. Твердость водоснабжения и сердечно-сосудистых заболеваний. К. цитируется в справочнике. Жесткость воды и сердечно-сосудистые заболевания.
Жесткость воды, методы ее определения
Цель работы: познакомиться с понятием жесткости воды; овладеть методиками определения общей, временной (карбонатной) и постоянной (некарбонатной) жесткости воды методами потенциометрического и кислотно-основного титрования.
Твердость питьевой воды и сердечно-сосудистых заболеваний. Соотношение качества питьевой воды и сосудистых заболеваний. Эпидемиологическое исследование внезапной смерти в труднодоступных и мягких акваториях. Смертность и жесткость местных водоснабжения.
Клинические и биохимические показатели среди мужчин, живущих в труднодоступных и мягких акваториях. Записи о потреблении воды в Брисбене и сезонности при местной смерти. Связь между смертностью от сердечно-сосудистых заболеваний и обработанной водой. Изменение в штатах и 163 крупнейших муниципалитетах.
Оборудование и реактивы: 0,1н. соляная кислота; 0,1н. раствор трилона Б; индикаторы: эриохром черный кристаллический, фенолфталеин, метиловый оранжевый; аммиачный буфер; рН-метр; магнитная мешалка; бюретки; пипетки на 100 мл или мерные цилиндры; колбы на 250 мл и 500 мл; стаканы на 200 – 250 мл; мерные колбы на 200 мл; бумажные фильтры.
8.1 Теоретические пояснения
Муниципальная питьевая вода и смертность от сердечно-сосудистых заболеваний. Минералы в городской воде и атеросклеротическая сердечная смерть. Взаимосвязь между содержанием микроэлементов питьевой воды и хроническими заболеваниями, наблюдаемым влиянием микроэлементов в питьевой воде на здоровье человека.
Здоровье и экономические аспекты жесткости воды и коррозионной активности. Смертность и жесткость воды в трех сопоставленных сообществах в Лос-Анджелесе. Фатальная артериосклеротическая болезнь сердца, жесткость воды у себя дома и социально-экономические характеристики.
Природная вода в своем составе всегда содержит различные примеси: соли и газы, механические примеси, находящиеся во взвешенном состоянии, эмульсии, гидрозоли и другие образования. Некоторые соли, присутствующие в воде, вызывают ее жесткость.
Жесткость воды – это совокупность свойств воды, обусловленных присутствием в ней катионов Ca 2+ и Mg 2+ , реже Fe 2+ .
Объяснение вариаций смертности от сердечно-сосудистых заболеваний в районе мягкой воды. Водные составляющие и микроэлементы в связи с сердечно-сосудистыми заболеваниями. Проблемы, связанные с металлами в питьевой воде. Обзор и последствия текущих и прогнозируемых исследований за пределами европейских сообществ.
Контроль коррозии питьевой воды. Потенциальные аспекты общественного здравоохранения в отношении микроэлементов и качества питьевой воды. Цели качества питьевой воды.
В жесткой воде ухудшается пенообразование и увеличивается расход мыла при стирке, так как часть содержащихся в нем растворимых солей жирных кислот переходит в нерастворимое состояние:
При этом также ухудшается качество тканей вследствие осаждения на них нерастворимых кальциевых и магниевых солей высших жирных кислот.
Позвоните в отдел общественных работ в мэрии и попросите копию, они обычно отправят вам одну бесплатную версию. Отчеты о качестве воды в основном ориентированы на законы о безопасной питьевой воде, касающиеся загрязнений, таких как пестициды, бактерии и токсичные металлы.
В качестве пивоваров нас интересуют вторичные или эстетические стандарты, которые имеют отношение к вкусу и рН. При оценке пивоваренной воды необходимо учитывать несколько важных ионов. Основными ионами являются кальций, магний, бикарбонат и сульфат. Натрий, хлорид и сульфат могут влиять на вкус воды и пива, но не влияют на рН затора, как и другие. Концентрации ионов в воде обычно обсуждаются как части на миллион, что эквивалентно миллиграмму вещества на литр воды. Описания этих ионов следуют за докладом о воде.
В воде с повышенной жесткостью плохо развариваются овощи и мясо, так как катионы кальция образуют с белками нерастворимые соединения. Большая магниевая жесткость придает воде горький вкус.
Жесткость воды хозяйственно-питьевых водопроводов не должна превышать 7 ммоль экв./л . По величине жесткости воду условно подразделяют на мягкую (до 4 ммоль экв./л ), средней жесткости (4 – 8 ммоль экв./л ), жесткую (8 – 12 ммоль экв./л ) и очень жесткую (более 12 ммоль экв./л ).
Таблица 12 — Отчет по качеству воды в столице штата Лос-Анджелес. Кальций является основным ионом, который определяет жесткость воды и имеет 2 заряда. Как и в наших собственных телах, кальций играет важную роль во многих дрожжевых, ферментных и белковых реакциях, как в пюре, так и в кипячении. Это способствует ясности, вкусу и стабильности в готовом пиве. Добавки кальция могут потребоваться для обеспечения достаточной активности фермента для некоторых сливок в воде с низким содержанием кальция. Кальций, который сочетается с бикарбонатами в воде, называется «временная твердость».
Общая жесткость складывается из карбонатной (временной) и некарбонатной (постоянной). Карбонатная жесткость обусловлена присутствием в воде гидрокарбонатов кальция, магния, а иногда также и гидрокарбоната железа (II). Этот вид жесткости можно устранить кипячением:
При кипячении воды растворенные в ней гидрокарбонаты разлагаются, и карбонатная жесткость сильно снижается, однако полного устранения карбонатной жесткости не происходит вследствие того, что карбонаты кальция и магния несколько растворим в воде.
Наряду с понятием карбонатная жесткость, используется термин устранимая жесткость. Это та величина, на которую понижается жесткость при десятиминутном кипячении воды. Жесткость, оставшаяся после кипячения воды, называется постоянной жесткостью.
Для уменьшения карбонатной жесткости применяют также метод известкования:
Некарбонатная жесткость обусловлена присутствием в воде растворимых, устойчивых к нагреванию солей кальция и магния. Чаще всего это сульфаты и хлориды.
Некарбонатную жесткость можно устранить обработкой воды карбонатом или фосфатом натрия:
Для устранения жесткости применяют также катиониты. Это ионообменные смолы и алюмосиликаты, содержащие в своем составе подвижные катионы, например, Na + , H + , способные обмениваться на катионы среды. Если пропускать воду через слои катионита, то его подвижные катионы будут обмениваться на катионы кальция и магния, при этом катионы жесткости остаются в катионите, а подвижные ионы катионита переходят в раствор. При помощи Н + -катионирования умягчают воду с преобладанием карбонатной жесткости, а при помощи Na + -катионирования – с преобладанием некарбонатной жесткости.
Для умягчения воды можно также использовать и физические методы: электродиализ, ультразвуковую, магнитную и магнитно-ионизационную обработку воды.
Жесткость воды определяется аналитически.
Карбонатную (устранимую или временную) жесткость воды определяют титрованием воды соляной кислотой:
Точку эквивалентности можно определить либо потенциометрическим титрованием с помощью рН-метра (определение объема раствора соляной кислоты в точке скачка рН), либо титрованием в присутствии кислотно-основных индикаторов (чаще всего метилового оранжевого).
Для выбора соответствующего кислотно-основного индикатора необходимо построить интегральную кривую титрования на основании данных потенциометрического титрования, а затем выбрать такой индикатор, интервал перехода окраски которого попадает в область скачка рН на кривой титрования. В таблице 8.1 приводятся интервалы перехода окраски для некоторых индикаторов.
Таблица 8.1 – Характеристики наиболее часто применяемых кислотно-основных индикаторов
Интервал перехода окраски,
Изменение окраски раствора при возрастании рН
источник