Определение жесткости воды в современном мире – это обязательное условие для обеспечения работоспособности всей техники, работающей с ней. Тем не менее нельзя сказать, что такая жидкость действительно вредна для человека. Всего должно быть в меру, ведь излишне мягкая вода наносит не меньше ущерба здоровью, чем жесткая.
Начинать всегда следует с самых азов, чтобы было полное понимание проблемы. В нашем случае, прежде чем приступать к определению жесткости воды, сначала нужно понять, что она собой представляет. По результатам экспертизы, проведенной в 2011 на кафедре химии и экологии Новгородского университета им. Ярослава Мудрого, для природной натуральной воды жесткость является абсолютно нормальным явлением. Вплоть до момента появления современной техники этот вопрос вообще мало кого интересовал, тысячелетиями люди спокойно употребляли ее в том виде, в котором она есть. Придают воде жесткость растворенные в ней соли магния и кальция. Само понятие жесткости возникло по результатам ощущения людей, так как когда насыщенная этими солями и другими элементами вода вступает во взаимодействие с мылом, пена практически не образуется, затрудняя стирку или мытье.
Прежде чем понять, какую воду пить, следует учитывать тот факт, что жесткость не является однородной величиной. Есть как минимум две основные разновидности:
Зависят эти виды от типа растворенных солей, которые в любой жесткой воде присутствуют всегда вместе, составляя общую жесткость. Тем не менее разделять их можно и нужно. Временная жесткость напрямую зависит от наличия бикарбонатных и гидрокарбонатных анионов. Главная их особенность – разложение во время кипячения. В результате распада получается непосредственно сама вода, углекислый газ и карбонат кальция, который уже практически не растворяется. Получается, что от временной жесткости можно без особых проблем избавиться при помощи простого поднятия температуры воды до +100 градусов. В качестве примера можно привести любой чайник. После продолжительного использования можно обнаружить внутри осадок, который и является результатом описанного выше процесса распада. Все же, что не разлагается подобным образом, относится к постоянной жесткости, избавиться от которой без специальной обработки практически невозможно.
Это необходимо для того, чтобы понимать, какую воду пить можно без опаски, а также для того, чтобы любая техника, взаимодействующая с водой, не вышла из строя. Для человека излишне жесткая вода вредна. Но даже если этот параметр будет находиться на приемлемом для нашего организма уровне, все равно оборудование это не устроит. Аквариумы, кофейные, стиральные и посудомоечные машины, чайники, мультиварки и множество других вариантов техники требует воду строго определенной жесткости. Обычно справиться с этим помогают фильтры типа «Гейзер-3», однако зачастую такая мера может даже считаться излишней. Прежде чем тратить на них деньги, рекомендуется сначала провести тест на жесткость воды, ведь вполне возможно, что этот показатель и так на нормальном уровне.
Как уже было сказано выше, в первую очередь ущерб человеку наносит не какой-то определенный тип воды, а полное отсутствие баланса в организме.
- Плохое растворение пищевых продуктов (связано с катионами Ca 2 + и Mg 2 +).
- Кофе, чай и любые другие подобные напитки завариваются очень плохо.
- При длительном употреблении возможно расслабление желудка.
- Жесткая вода может стать причиной образования камней в почках.
- Насыщает организм требуемыми ему элементами.
- Улучшает состояние зубов, уменьшает вероятность возникновения кариеса.
- Жесткая вода является причиной поломки большинства видов техники.
- Выводит шлаки, но попутно вымывает полезные элементы (калий, магний и кальций). В результате кости становятся более хрупкими. Также не лучшим образом воздействует на сердечно-сосудистую систему.
- Негативно воздействует на гипофиз-адреналиновую систему.
- Оказывает плохое влияние на водно-солевой баланс организма.
Таким образом, определение жесткости воды должно производится не с целью избавиться от нее, а для того, чтобы свести негативное воздействие к минимуму и привести употребление такой жидкости к требуемому организмом балансу.
Согласно ГОСТу, питьевая вода должна проверяться на жесткость строго в лаборатории, посредством титриметрического анализа. Для этого сначала необходимо взять пробы, объем которых должен быть не менее 400 кубических сантиметров (0,4 литра). В качестве емкости, в которой будет производиться хранение, может использоваться любая тара, если она изготовлена из стекла или полимерного материала. Очень важно провести анализ не позднее чем через 24 часа после отбора пробы. В особых случаях, когда необходимо увеличить этот срок, производится подкисление жидкости посредством добавления соляной кислоты. В таком состоянии она может храниться уже около 1 месяца.
Среди всех методов определения жесткости воды данный вариант заслуженно считается самым достоверным и комплексным. В его основе лежит процесс образования соединений трилона вместе со щелочноземельными элементами ионов. Минимальный показатель жесткости, который поддается определению при помощи этого способа, – 0,1 о Ж (нормой считается 7-10 о Ж). В качестве пробы может быть использована обычная вода из-под крана. Лучшим выходом в ситуации с подозрением на повышенную жесткость является сразу же посетить соответствующую лабораторию, так как никакие домашние методы не смогут выдать точные данные. Но о них — ниже.
Полностью описывать весь процесс нет никакого смысла, так как воспроизвести его самостоятельно, без нужных навыков и химических элементов и оборудования невозможно. Тем не менее можно выделить несколько основных принципов реакции, которые сохраняются в любой ситуации и присущи абсолютно всем вариантам:
- Всегда должен быть способ, позволяющий зафиксировать эквивалентность реакции, которая и является основой для определения жесткости.
- Анализ проводится очень быстро.
- Должно выполняться требование стехиометричности процесса. Проще говоря, это значит, что в процессе проведения реакции не должны образовываться никакие побочные продукты.
- С момента начала реакции ее невозможно повернуть вспять или остановить.
Для определения жесткости воды в домашних условиях можно использовать специальные приспособления, купить которые не составит особого труда (они не запрещены и общедоступны). Выглядят они как стандартные тестовые полоски. Для использования достаточно погрузить одну из них в воду, требующую проверки, на указанный в инструкции период времени. В результате изделие изменит свой цвет. При использовании таких полосок для определения жесткости воды главной проблемой является определить, каков именно показатель жесткости. Чтобы это сделать, нужно сравнивать цвет на полосе и примеры с описанием на упаковке. К сожалению, далеко не всегда можно сразу же понять, что именно показывает приспособление, и даже в более четкой ситуации точность данных оставляет желать лучшего. В целом такие тест-полоски подходят только для общего понимания того, насколько жесткая или мягкая вода.
Проверить воду из-под крана на жесткость также можно при помощи подручных средств. Правда, это скорее занимательный опыт для детей, чем действительно вариант тестирования показаний жидкости.
- Банку емкостью 1 литр (или любую другую подобную емкость).
- Стакан в форме цилиндра.
- Любые весы (удобнее всего использовать электронные).
- Линейку.
- Мыло хозяйственное (72% или 60%).
- Дистиллированную воду.
Для проверки необходимо взять 1 грамм мыла, измельчить его и поместить в стакан. После этого следует подогреть дистиллированную воду, но не доводить до кипения. Ее следует налить в тот стакан, в котором уже лежит мыло. В итоге оно обязано растворится в воде. Следующий шаг – налить еще больше воды. После этого следует налить в банку обычной воды из-под крана и медленно вылить мыльную жидкость из стакана и перемешать (медленно). Если образуется пена, то это — показатель жесткости. К сожалению, более или менее четко сказать, каков именно ее уровень, при помощи такого метода практически невозможно.
Еще один вариант определения жесткости питьевой воды – воспользоваться специальным прибором – TDS-метром. В принципе, он предназначен для определения электропроводимости воды, на что влияют как непосредственно соли (создающие жесткость), так и множество других элементов, что не дает нужного уровня точности. Более того, показания прибора обычный человек, не умеющий их считывать, не поймет и скорее всего запутается. Попробуем упростить задачу. Подавляющее большинство таких устройств в качестве единиц измерения используется некие ppm. У нас же применяются другие варианты, основанные на эквиваленте миллиграмма на литр жидкости. В среднем, 1 наша единица (мг-экв/л) равняется 50,05 зарубежным ppm. По правилам, концентрация солей (т.е. жесткости) должна быть не более 350 ppm или же 7 мг-экв/л. На эти цифры и стоит ориентироваться. Если же прибор будет отечественным, все значительно облегчается. Хуже всего, когда подобное приспособление произведено где-то в Китае или другой подобной стране, где используются собственные единицы измерения. Тогда придется самостоятельно искать их эквивалент и переводить в привычные нам показания.
Из других приборов, способных определять жесткость воды, отдельно следует отметить уникальное устройство АКМС-1. Это достаточно большой стационарный агрегат, сходный по размерам с фильтрами «Гейзер-3». Просто так в домашних условиях с его помощью проверять жидкость не представляется возможным. Именно поэтому такие приспособления используются в первую очередь на производстве, где жесткость воды может повлиять на работу дорогостоящей техники или нанести другой подобный вред. В отличие от всех остальных аналогов, АКМС-1 действительно быстро и точно показывает текущий уровень жесткости, позволяя оператору своевременно реагировать. При помощи этого приспособления можно как пускать воду к рабочим агрегатам напрямую, если она не представляет для них угрозы, так и предварительно ее фильтровать. Это, конечно же, выльется в дополнительные затраты, но зато поможет сэкономить на ремонте техники, который обойдется значительно дороже.
Учитывая все указанное выше и требования ГОСТ, вода питьевая должна регулярно проверяться на уровень жесткости. Тем не менее принимать радикальные меры по ее умягчению не стоит, так как вредны оба состояния – слишком жесткая и слишком мягкая. Только в той ситуации, когда показатели действительно выше или ниже, стоит предпринимать какие-то действия. К слову, если с жесткостью регулярно борются, то про слишком мягкую воду практически не слышно, а ведь на это также нужно обращать не меньше внимания.
источник
Цель работы: овладение методом количественного анализа питьевой воды по показателям постоянной и временной жесткости.
ХИМИЧЕСКИЙ ЭКВИВАЛЕНТ — это массовое количество химического элемента, которое присоединяет или замещает 1,008 массовых частей (м.ч.) водорода или 8 м.ч. кислорода. В ходе реакций элементы соединяются в количествах, соответствующих их химическим эквивалентам.
Численно химический эквивалент выражается в любых массовых единицах, соответствующих массовости данной реакции. Например, массовость лабораторных опытов — граммы и миллиграммы, а количества реагирующих веществ запишем как г .э кв или мг.экв . В океанах, атмосфере, в Земном ядре происходят реакции с массовостью т .э кв и Мт.экв .
ПРОИЗВЕДЕНИЕ ХИМИЧЕСКОГО ЭКВИВАЛЕНТА НА ВАЛЕНТНОСТЬ ВЕЩЕСТВА РАВНО АТОМНОЙ МАССЕ ЭЛЕМЕНТА .
Исходя из этого правила производятся все расчеты химических реакций с помощью Периодической системы элементов Менделеева.
НОРМАЛЬНЫЙ РАСТВОР содержит в 1 кубическом дециметре (литре) один г .э кв растворенного вещества. Для наглядности сравнения нормальной и процентной концентраций рассмотрим подсчет процентности децинормального раствора соляной кислоты. ( 0,1N НCl ), который используется при титровании в данной работе.
Для подсчетов возьмем массовые числа Н(1,008) и С l (35,45), сложим их (36,458), округлим (36), вычислим 0,1 (3,6). Значит, один литр 0,1N раствора H С l содержит 3,6 г кислоты, а в 100 г этого раствора — 0,36г HCl . Округленно процентность такого раствора — 0,4 %.
ТИТР — в объемном химическом анализе — концентрация раствора реактива, число граммов вещества в 1 мл раствора.
ТИТРОВАНИЕ — это метод объемного химического анализа, состоящий в постепенном струйно-капельном приливании реактива известной концентрации к известному объему другого реактива, концентрацию которого нужно установить в ходе опыта.
ИНДИКАТОР МЕТИЛОВЫЙ ОРАНЖЕВЫЙ , цветовой определитель рН среды.
рН = 5,5 нормальная — оранжевый
рН > 7 щелочная — желтый (светло-желтый)
Титрование происходит в присутствии индикатора рН среды, по изменению цвета которого и прекращают титрование. Установка для титрования приведена на рисунке 1. Она состоит из металлического штатива, на котором закреплена стеклянная бюретка с кислотой и колбы с анализируемой жидкостью.
Существует пропорция для вычисления неизвестной концентрации примесей в анализируемой жидкости. Выведем ее из уравнения:
где известна нормальность (0,1) и количество кислоты, пошедшей на титрование. Количество анализируемой жидкости задано условием опыта, но может быть любое. Зная эквивалент Са (20,04), эквивалент соляной кислоты HCl (36,5) и считая, что 1 литр нормального раствора НСl прореагирует с 20,04 г Са 2 + , принимаем, что 1 мл 0,1N HCl соответствует 2,004 мг Са 2+ . Установив опытным путем объем кислоты V HCl , пошедший на титрование 50 мл жесткой воды, можно определить количество мг Са 2+ , содержащегося в этом объеме исследуемой воды, а затем и в литре такой воды, умножив полученную величину на 1000:50=20
Рисунок 2 иллюстрирует как правильно проводить отсчет объема жидкости в бюретки: а – правильный отсчет; б – завышенный отсчет; в – заниженный отсчет.
Рис. 2. Способ отсчета по мениску жидкости
Меры предостороженности при проведении работ с химическими реактивами:
1. Работайте всегда на одном и том же месте.
2. Не загромождайте рабочий стол свертками, папками, книгами.
3. Запрещается приносить в лабораторию съестное, напитки, использовать жевательную резинку во время работы.
4. Соблюдать в лаборатории тишину и чистоту.
5. Перед каждой лабораторной работой внимательно изучить теоретический материал по указанной теме.
6. Приступить к опыту только после того, как уяснена его цель и порядок выполнения.
7. Особая осторожность требуется при работе со стеклянной посудой и приборами.
8. При нагревании стеклянных колб на плитке подложите асбестовую ткань.
9. Децинормальные растворы солей, кислот и щелочей имеют низкую процентную концентрацию, но при работе с ними не следует забывать общие правила предосторожности при работе с химическими веществами.
10. Особого внимания требует фильтрация горячего раствора. При переливании его из колбы в воронку с фильтром следует сложить салфетку углом и сделать защитный выступ под рукой из ткани.
Соли кальция и магния, растворенные в воде, вызывают ее жесткость. Показатель жесткости выражается в мг .э кв /литр. Один мг .э кв жесткости соответствует содержанию в литре воды 20,04 мг Са 2+ или 12,16 мг Мg 2+ .
Различают жесткость постоянную и временную.
Временная жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния С а ( НСО3)2 и Мg (НСО3)2, она устраняется длительным кипячением
Эта реакция обратима (равновесна), так как при контакте СО 2 с раствором можно снова получить кислую соль. Только при кипячении СО 2 улетучивается и равновесие смещается в сторону нерастворимой соли.
Постоянная жесткость — это жесткость кипяченой воды, вызывается присутствием в воде хлоридов и сульфатов кальция и магния двухвалентных. Большие значения жесткости опасны отложениями внутри водопроводных и особенно водонагревательных систем нерастворимого осадка, выводящего из строя оборудование. Борьба с этим явлением сводится к связыван ию ио нов кальция и магния в нерастворимые соли до подачи такой воды в системы водоснабжения
Общая жесткость воды — это сумма постоянной и временной жесткости. Обычно показатели временной жесткости в несколько раз превышают индексы постоянной.
Фактор жесткости питьевой воды определяет региональные особенности состояния здоровья населения наряду с характерными для данного пункта, местности вредными примесями в воздухе, воде и почвах.
Принято считать воду с общей жесткостью:
до 3,5 мг .э кв /литр — мягкой;
от 3,5 до 7 мг .э кв /литр — средней;
от 7 до 10 мг .э кв /литр — жесткой;
свыше 10 мг .э кв /литр — очень жесткой.
Большие значения жесткости, характерные для артезианских вод солонцовых почв, придают воде неприятный вкус и небезопасны при ежедневном применении в пищу, так как провоцируют отложения солей в суставах (полиартриты, остеохондрозы), общее нарушение обменных процессов в организме. Ионы кальция и магния омыляют жиры, нарушая процессы всасывания питательных веществ в кишечнике, вызывая дерматиты. Повышенное содержание кальция в питьевой воде на фоне йодной недостаточности вызывает заболевания щитовидной железы. Повышенное содержание магния снижает моторику кишечника, препятствуя пищеварительному процессу.
Пониженное содержание солей жесткости (ВОЗ ограничивает нижний допустимый предел 1,5 мг .э кв /л) также опасно и вызывает у населения кариес и ослабление костей скелета, так как организм в этом случае восполняет недостаток кальция засчет внутренних ресурсов.
Таким образом, жесткость питьевой воды нормируется, исходя из ее гигиенического значения на уровне 7 мг .э кв /литр.(ГОСТ 2874-82).
Допустимая жесткость промышленных вод различна для разных производств. Например, для банно-прачечного хозяйства предпочтительна мягкая вода, так как сульфаты кальция и магния дают реакцию с моющими средствами с образованием нерастворимого трудноудаляемого осадка. Для пищевой промышленности опасны как повышенные, так и пониженные значения жесткости, поэтому здесь предпочитается интервал от 5 до 7 единиц.
Жесткость воды может быть устранена следующими способами.
Гидрокарбонаты кальция и магния могут находиться в растворе только при наличии в нем свободного углекислого газа. Такой раствор можно рассматривать как равновесную систему.
Растворимость газов падает при повышении температуры, при кипячении воды из нее устраняется углекислый газ. Поэтому понижение концентрации углекислого газа смещает равновесие в сторону нерастворимых карбонатов.
На практике карбонатная жесткость устраняется не кипячением, а добавкой такого химреагента , который переведет ион кальция или магния в труднорастворимые соединения. Например,
Катионным способом — пропустить через слой природного минерала цеолита или его синтетического аналога — пермутита (алюмосиликата Na2Al2Si2O6 × H2O.) При этом происходит обменная реакция
CaCl2 + Na2 П . = 2NaCl + Ca П ,
где П — пермутитовая группа без натрия, замещаемого кальцием жесткой воды. На этом принципе действуют фильтры доочистки воды , в т.ч. бытовые.
Жесткость можно устранить с помощью ионообменных смол, представляющих собой высокомолекулярные органические вещества, содержащие кислотные или основные функциональные группы. Смолы — катиониты содержат карбоксильную группу СООН или сульфогруппу ОS3H, смолы- аниониты аминогруппу NH2-. Если остаток смолы обозначить R, то катионит запишется как R-COOH, анионит как R-NH2.
Реакция деминерализации пойдет так:
2RCOOH + CaCl2 = (RCOO )2Ca + 2HCl
Рассмотренные процессы снижения содержания солей жесткости называются умягчением воды. Чаще всего эти процессы применяются для воды, идущей на питание котлоагрегатов с целью предотвращения образования накипи. В быту устранение жесткости предпочтительно сочетать с другими способами очистки. Такой компле кс вкл ючают в себя всем известные бытовые фильтры промышленного производства. Обычно в них использованы сорбенты (поглотители) двух-трех типов, расположенные каскадно один за другим: против взвешенных частиц, против химически активных и микробиологических примесей.
Представьте ситуацию, когда повышенное содержание частиц почвы, нередкое для российских условий, выводит из строя первый каскад. Тогда два остальных механизма очистки, не рассчитанные на поглощение механических примесей, также не сработают и, более того, вскоре сами станут источником дополнительного загрязнения.
По мнению многих ученых-экологов, разработка бытовых фильтров для условий России должна учитывать прежде всего состояние исходного продукта очистки, даже формулировка которого — сложная научная проблема.
– цилиндр мерный емкостью 100-1000 мл, ГОСТ 1770
– цилиндр мерный емкостью 10-20 мл, ГОСТ 1770
– колбы конические плоскодонные емкостью 150-250 мл, ГОСТ 25336
– бюретка стеклянная мерная с краном 5-25 мл, ГОСТ 1770
– воронка стеклянная фильтровальная, ГОСТ 23932
– фильтры бумажные диаметром 7 см
– кислота соляная децинормальной концентрации;
– натрий едкий, децинормальный раствор;
– натрия карбонат, децинормальный раствор;
– индикатор метиловый оранжевый.
ОПЫТ 1. Определение временной жесткости
Замечание. Подготовить 6 конических колб емкостью 250 мл и отмерить во все по 50 мл исследуемой водопроводной воды для опытов 1 и 2.
Способ основан на реакции между соляной кислотой и гидрокарбонатами.
Аналогично уравнение для магния.
Титрование контролируется индикатором метиловым оранжевым.
Методика проведения эксперимента следующая.
1. Поместить в три конические колбы по 50 мл исследуемой воды.
2. Добавить в каждую колбу по две-три капли индикатора метилового оранжевого.
3. Заполнить бюретку 0,1N раствором соляной кислоты до верхней нулевой отметки.
По каплям добавлять в колбу децинормальный раствор соляной кислоты из бюретки, осторожно размешивая реагенты покачиванием колбы. Титрование прекратить, как только окраска жидкости в колбе перейдет в розовую .
4. Оценить изменение цвета раствора.
5. Подсчитать по шкале бюретки и записать расход кислоты на титрование в табл. 1 Vk1 в мл.
6. Слить в сток оттитрованную пробу и трижды ополоснуть колбу водопроводной водой.
7. Снова c помощью мерного цилиндра отмерить в колбу 50 мл испытуемой воды и добавить 2-3 капли индикатора метилового оранжевого.
8. Повторить пункты 3-7, определив Vk2 и Vk3. Результаты занести в таблицу расхода кислоты в соответствующие графы.
9. Вычислить из полученных данных Vk среднее. Использовать это среднее значение для расчетов временной жесткости по формуле:
(1)
где Жвр — временная жесткость воды , ;
V к — объем кислоты, использованной на титрование одной пробы исследуемой водопроводной воды, средний из трехпроб , мл;
Ск — нормальная концентрация раствора кислоты (0,1 N );
Результаты вычисления временной жесткости занести в табл. 2.
ОПЫТ 2. Определение общей жесткости воды
Способ основан на осажден ии ио нов двухвалентного кальция и магния растворами щелочной смеси, состоящей из децинормальных растворов едкого натрия и карбоната натрия.
Для магния уравнения аналогичны.
Взяв щелочную смесь в избытке, определим не прореагировавшую часть титрованием децинормальным раствором соляной кислоты.
Подсчитав расход кислоты на титрование, вычислим общую жесткость.
1. С помощью мерного цилиндра отмерить в коническую колбу 50 мл испытуемой на содержание солей жесткости воды.
2. Мерным цилиндром емкостью 10 мл отмерить и добавить в колбу с исследуемой водой по 10 мл децинормальных растворов NaOH и Na2CO3 (итого 20 мл), что достаточно для создания избытка щелочи в пробе.
3. Прокипятить колбу с раствором, состоящим из смеси исследуемой воды со щелочью, в течение 3-5 минут, чтобы добиться необратимого разложения солей жесткости.
4. Остудить колбу и профильтровать раствор, учитывая требования раздела «Меры предосторожности».
5. В отфильтрованную воду добавить 2-3 капли индикатора метилового оранжевого до создания светло-желтой окраски раствора.
6. Выполнить титрование децинормальным раствором соляной кислоты, как указано в пункте 3 и 4 опыта 1 настоящей работы.
7. Расход децинормального раствора соляной кислоты отсчитать по шкале бюретки и записать в табл.1 в соответствующей графе.
8. Опыт проделать трижды и вычислить среднее значение Vк в табл. 1.
9. Вычислить общую жесткость Жо испытуемой воды по формуле
(2)
где — объем растворов щелочной смеси, мл;
— нормальность концентрации щелочи;
— объем раствора кислоты, использованной на титрование подщелоченной воды (из пункта 8 опыта 2 настоящей работы);
— нормальность концентрации раствора кислоты;
— объем пробы воды (в нашем опыте 50 мл).
Результаты вычисления занести в табл. 2.
Вычислив опытным путем величины временной и общей жесткости, можно определить и постоянную жесткость по известной формуле
, (3)
источник
Как выполняется контроль жёсткости воды. Понятие жёсткости, от чего она зависит. Анализ воды на жёсткость дома. Лабораторные методы контроля общей и временной жёсткости жидкости. Приборы для выполнения анализа. Методы борьбы с повышенной жёсткостью в быту. Контроль жёсткость воды или анализ воды на жёсткость нужен для определения концентрации солей в жидкости. Этот анализ можно проводить в лабораторных условиях и дома.
Жёсткость воды – термин, говорящий о процентном соотношении солевых частиц магния и калия в жидкости. Она подразделяется на две разновидности:
- Временная (такая жидкость называется карбонатная);
- Общая жёсткость (данная вода относится к некарбонатной).
Первый тип жёсткости характеризуется присутствием гидрокарбонатных солевых частиц магния и калия. Если такую воду закипятить, то элементы распадутся на карбонаты и гидроксиды и выпадут в осадок. Именно этот белый налёт часто покрывает наши чайники изнутри и собирается на других нагревательных элементах.
Для жидкости с общей жёсткостью характерно наличие других химических элементов (различных нитратов, хлоридов и тп.п). Обычно жёсткость питьевой воды связана с особенностями вашего региона, составом грунтов. Чем больше известковых пород находится в почве, тем выше жёсткость воды. Но важно не только понимать суть понятия, но и знать, как проверить жёсткость воды. Выполнить это легко как в быту, так и на заводе.
Для проверки жёсткости водопроводной воды дома можно использовать следующие способы:
- Постарайтесь обильно вспенить мыльный брусок или порошок для стирки. Если у вас образуется мало пены, то ваша вода имеет повышенную жёсткость. Это возникает по той причине, что солевые частицы калия и магния не позволяют мылу пениться. При обильной пышной пене от любого моющего средства можно утверждать, что вода нежёсткая. Но этот метод не позволят точно определить степень жёсткости.
- На вкус также можно отличить жёсткую воду от мягкой. Она более горькая. Но не все могут точно уловить горьковатый привкус солей магния и калия.
- Белый осадок в чайниках, накипь на нагревательных элементах других бытовых приборов – признак жёсткой воды. Осадок возникает из-за распада солей и выпадения их на дно. Данная особенность жёсткой воды очень вредит бытовым приборам и отопительному трубопроводу.
- От жёсткости воды зависит скорость заваривания чайного напитка. При мягкой воде на эту процедуру уйдёт от 3 до 6 мин., в жёсткой воде чай будет завариваться от 8 до 12 мин. Кстати, на вкус оба напитка будут существенно отличаться.
- Благодаря нехитрому компактному измерительному прибору можно очень легко определить жёсткость любой жидкости. Он называется TDS-метр. Агрегат измерят электропроводность жидкости. Чем выше показатель, тем больше уровень солесодержания жидкости. Обычно его ещё называют солемер. Чаще такой анализ воды на жёсткость делают владельцы аквариумов и цветоводы.
- Проверить жёсткость воды в быту можно, используя тест-полоски, продающейся в аптеках медтехники.
Для этого анализа можно использовать колориметрическую методику и принцип титрования. Процедура анализа выполняется так: порция воды смешивается с метилоранжем (индикатором), ёмкость устанавливается на светлом фоне. Во вторую тару с водой добавляют соляную кислоту, пока не получится красно-оранжевый цвет воды.
Временную жёсткость жидкости находят в процессе расчёта требуемого количества соляной кислоты по формуле: Нвр = NHCl * VHCL* 1000/ V1, где N-насыщенность раствора, V-его количество, V1-количество пробы.
Этот анализ проводят в лаборатории. Для него используют комплексонометрическую методику. Она базируется на принципе возникновения соединений ионов, подвергающихся анализу, с природными реагентами. Сначала воду в пробирке разводят раствором индикатора на спирту (чёрного этиохрома «Т»). Также для этих целей может использоваться сухая смесь кальциевых и натриевых хлоридов. В итоге полученная смесь окрашивается в насыщенный рубиновый цвет. Затем в пробирку капается вещество, называемое Трилон.
Расчёт общей жёсткости производится по уравнению: Жо=Nx*Vx*1000/V1, где N-насыщенность вещества Трилон, V-его количество, V1-количество пробы.
Как мы уже говорили выше, прибор контроля жёсткости воды называется солемер или TDS-метр. Точность проверки составляет 2%. Основной принцип работы данного агрегата построен на зависимости электропроводности жидкости от общего числа примесей солей магния и калия. То есть чем больше данных солей в воде, тем больше будут показания прибора, а следовательно, тем выше жёсткость воды.
На некоторых предприятиях и заводах наблюдается прямая зависимость между жёсткостью используемой воды и исправностью работы оборудования. Поэтому для обеспечения бесперебойной работы технологического оборудования требуется осуществлять постоянный автоматический контроль жёсткости воды.
Для этих целей используется специальное оборудование, например, анализатор «АКМС-1». Этот прибор непрерывно контролирует содержание солевых частиц кальция и магния в жидкости, поступающей в технологическое оборудование. То есть он подсчитывает общую жёсткость в пределах 0,005-25,0 мг-экв/л.
Как понять, что ваша водопроводная вода жёсткая, мы писали выше. Теперь перечислим ряд мер, позволяющих снизить жёсткость воды в домашних условиях:
- Самый простой способ – кипячение воды.
- Фильтрация воды через системы обратного осмоса (специальные мембраны).
- Использование смягчающих солей.
- Применение фильтрующих картриджей.
- Магнитное фильтрующее устройство.
- Использование ионообменной смолы в комплексе с солевым раствором.
Хотите провести контроль жёсткости воды? Заказать такую услугу вы можете у наших специалистов, для этого вам достаточно связаться с нами по указанным телефонам.
источник
Экология потребления. Наука и техника: Рассказ пойдёт о том, что загрязняет воду, как её чистят и почему я спокойно пью из родника, содержащего много нитратов.
Последние пять лет я занимаюсь химическим анализом воды и нахожусь в контакте с инженерами по водоподготовке. К нам приходят самые разные люди: для одних система очистки воды — очень дорогое, но жизненно необходимое приобретение, другие просто начитались страшилок в Интернете и хотят «живую воду». Но для нас, как и для врачей, все наши заказчики одинаковы. У них есть вода — скважинная, поступающая из городского или поселкового водопровода, колодезная, речная — и её необходимо очистить до установленных норм. О том, что загрязняет воду, как её чистят и почему я спокойно пью из родника, содержащего много нитратов, пойдёт этот рассказ. Но никакие названия фирм, географические привязки и другая индивидуализирующая информация указываться не будут — я просто хочу поделиться пятью годами своих наблюдений за процессом, потому что много владельцев коттеджей могли бы меньше нервничать, если бы озаботились водоочисткой ещё на этапе заливки фундамента.
Но для начала давайте определимся со структурой процесса и терминологией, чтобы общаться на одном языке. Строго говоря, без анализа воды ни одна нормальная организация, занимающаяся водоочисткой, даже на порог вас не пустит. Всё начинается с анализа воды.
Как правильно отобрать воду на анализ?
Тщательность, с которой вы выполните отбор пробы воды, в конечном счёте может существенно повлиять на цену установки. Вот общие рекомендации.
- Возьмите чистую пластиковую бутылку объёмом 1.5 л. Ни в коем случае не используйте бутылки, в которых ранее находились содержащие органические вещества жидкости (квас, пиво, кефирчик, уайт-спирит) или высокоминерализованные воды. Подойдут бутылки из-под питьевой воды. Идеальный вариант — купить новую бутылку там, где торгуют напитками на розлив.
- Если у вас скважина — пролейте её до постоянного состава. Рекомендации, как это сделать, должны предоставить ваши скваженщики. Некоторые наши заказчики рассказывали, что их скважина работала на излив по две-три недели.
- Откройте ближайший к скважине кран до любых существующих фильтров, баков и других устройств, могущих оказывать влияние на состав воды, и пролейте несколько минут, чтобы обновить воду в трубах.
- На два раза ополосните бутылку отбираемой водой, после чего налейте воду под самое горлышко, навинтите крышку, слегка сожмите бутылку с боков, чтобы вода потекла через край, и завинтите крышку до конца. Цель: набрать воду без воздушного пузыря.
- Доставьте воду в лабораторию в тот же день. Если нет такой возможности — храните воду в холодильнике не более двух суток.
Далее по анализу инженерами подбирается и рассчитывается система водоочистки, и если вас устраивает коммерческое предложение и вы его оплачиваете — к вам выезжают монтажники с оборудованием. Монтажникам от вас потребуются вход, выход и дренаж — откуда брать воду, куда её подавать и куда сливать. Особое внимание следует уделить именно канализации. Если у вас яма и вы её откачиваете — позаботьтесь о том, чтобы она могла одномоментно принять на себя 2-3 кубометра воды без последствий. Почему? Фильтры пропускают через себя грязную воду, грязь оседает на фильтрующем материале. Со временем ёмкость фильтрующего материала исчерпывается и он нуждается в обратной промывке — током воды снизу вверх вся грязь с него смывается в канализацию. На одну промывку может уходить от ста литров до полутора кубометров воды, в зависимости от типа фильтра и уровня загрязнения. И всё это количество сольётся в дренаж минут за 20 для кабинетных фильтров и где-то за час для засыпных колонного типа.
Примечание. Здесь и далее я буду приводить значения в масштабах частного домовладения.
Между прочим, если в Вашем септике применяется биологическая очистка, дренажная вода может убить её. Также монтажники потребуют с вас электрическую розетку поблизости (фильтры оснащены контроллерами — электронными управляющими мозгами, которые сами знают, когда пора начинать промывку). И ещё учтите, что эксплуатироваться любые фильтры должны при температуре не ниже +5 °C, а места занимают — в зависимости от модели — до двух квадратных метров по площади и до двух метров в высоту (хотя самый маленький фильтр со всей обвязкой может поместиться в кубический метр). Да, не забудьте про давление воды на входе! Если оно меньше 2-3 атмосфер — без повысительного насоса не обойтись. Для сравнения, системы горводоканалов обычно подают в квартиры воду под давлением около 4 атмосфер.
На входе перед фильтрами ставят грубую очистку — сетчатые фильтры, механику до 20 мкм — чтобы защитить более дорогое оборудование от проскоков песка, ржавчины и других крупных частиц. На выходе после установки рекомендуется монтировать финишную доочистку (обычно уголь — удаляет запахи, хлор и мелкие частицы). В самой дорогой комплектации ещё могут присутствовать ультрафиолетовая лампа для обеззараживания на выходе и защита от протечек на полу, но всё это опции. А вот если Ваша вода содержит много железа, то инженер может спроектировать водоочистку с применением баков, которые занимают значительное пространство.
А много железа — это сколько?
Вот теперь можно поговорить о вещах, более близких к моей профессии. И начнём мы с единиц измерения. В России и за рубежом, как ни парадоксально, применяются совершенно разные единицы измерения, хотя химия одна и та же. У нас приняты мг/л и мг-экв/л, у них — ppm.
мг/л (читается: миллиграмм на литр) — это масса исследуемых частиц, содержащаяся в одном литре раствора (а не растворителя!). Если мы исследуем ионный состав воды, то под массой частиц будет подразумеваться масса атомов одного вида. Например, 10 мг/л железа означает, что в 1 литре раствора у вас содержится 10 мг атомарного железа — того самого, у которого молярная масса, согласно таблице Менделеева, 56 г/моль. И не важно, в какой форме это железо — двухвалентный ион или трёхвалентный. Просто некая абстракция — железо, как оно есть в таблице Менделеева. А если мы измеряем содержание какой-то соли, то под массой частиц будет подразумеваться масса молекулы этой соли. Например, 10 мг хлорида натрия NaCl в 1 литре раствора.
мг-экв/л (читается: миллиграмм-эквивалент на литр) — с этого момента начинается особая чёрная магия. Иеремия Рихтер, немецкий химик, открыл закон эквивалентов (и попутно портал в ад) в 1792 году. Закон гласит: вещества реагируют в количествах, пропорциональных их эквивалентам, или m1Э2 = m2Э1. Попробуйте найти химика, который приходит в восторг, считая эквиваленты! Мне такие маньяки пока не встречались, хотя я занимаюсь химией уже 14 лет. Начнём издалека. Возьмём обычную реакцию между мелом и соляной кислотой:
Улетевший углекислый газ и воду отбросим, как несущественное, и выделим в этой реакции самое важное:
Ca 2+ + 2Cl — = CaCl2 (в ионной форме)
Теперь возьмём каждый из ионов и заставим его вступить в гипотетическую реакцию гидрирования с катионом водорода, невзирая на знак заряда (да, мы, химики, любим всякие извращения; а на самом деле — масса катиона водорода принята за единицу, и теперь нам нужно найти количество других ионов, эквивалентное этой единице).
1/2Ca 2+ + H + = CaH (фактор эквивалентности = 0.5, а эквивалент водорода — частица 1/2Ca 2+ )
Cl — + H + = ClH (фактор эквивалентности = 1, а эквивалент водорода — частица Cl — )
Итак, с одним катионом водорода может (условно) прореагировать либо один анион хлора, либо половинка катиона кальция. Численное выражение доли вещества, эквивалентной одному катиону водорода, называется фактором эквивалентности. Теперь мы можем сделать простой вывод:
1/2Ca 2+ = Cl — (1 эквивалент кальция = 1 эквиваленту хлора)
Представим, что мы титруем щёлочность соляной кислотой (об этих страшных словах — позже). С соляной кислотой могут реагировать самые разные соли (гидрокарбонаты, карбонаты, гидроксиды. ) самых разных ионов (кальция, магния, натрия. ). Как нам всё это выразить в одной единице измерения? Мы не имеем права использовать здесь уже знакомую нам единицу измерения мг/л, потому что просто непонятно — миллиграмм чего? Кальция? Магния? Их смеси? В каком соотношении? Зато с эквивалентами эта проблема снимается сама собой:
Cl — = 1/2Ca 2+ = 1/2Mg 2+ = Na + = 1/3Al 3+ и т.д.
Нам не важно, какой именно вид катиона или аниона мы оттитровали, но мы знаем, что одному эквиваленту потраченной соляной кислоты всегда будет соответствовать один эквивалент неведомой штуки, которая с этой кислотой способна прореагировать. Хорошо, с эквивалентом более-менее разобрались. А что же такое миллиграмм-эквивалент? Это масса одного эквивалента в миллиграммах. Грубо — считается по таблице Менделеева как молярная масса, умноженная на фактор эквивалентности. Для приведённого выше отношения это будет выглядеть так:
35.45 мг Cl — = 20.04 мг Ca 2+ = 12.15 мг Mg 2+ = 22.99 мг Na + = 8.99 мг Al 3+
Заметьте, молярная масса, например, кальция равна 40.08 г/моль, но с 1 граммом водорода может прореагировать только половинка кальция — 20.04 грамма. Вот эта цифра — 20.04 — и будет грамм-эквивалентом кальция. Или миллиграмм-эквивалентом. Или микрограмм-эквивалентом. Эта единица удобна тем, что если мы когда-нибудь выясним, какое именно соединение прореагировало в той реакции с соляной кислотой, мы всегда сможем умножить количество миллиграмм-эквивалентов на массу одного эквивалента — и перевести таким образом миллиграмм-эквиваленты в обычные миллиграммы для конкретного соединения. Итак, мг-экв/л — это количество миллиграмм-эквивалентов вещества в одном литре раствора.
ppm (читается: пи-пи-эм, parts per million) — число частиц на миллион. Показывает, сколько исследуемых растворённых частиц находится в одном миллионе частиц раствора (не растворителя!). Единица измерения применяется на Западе почти повсеместно. Соответствует нашему мг/л (потому что миллиграмм — это, вроде как, тоже миллионная часть от литра, при условии, что плотность раствора равна 1.00, но при таком разбавлении изменением плотности всё равно можно пренебречь).
мкСм/см (читается: микросименс на сантиметр) — единица измерения удельной электропроводности воды. Берут два электрода, погружают в воду. На один подают известное количество тока, на втором измеряют, сколько дошло. Поскольку в водном растворе носителями заряда являются ионы, то по количеству перенесённых с одного электрода на другой электрончиков можно сделать вывод об общей доле ионов в растворе. Сименс — единица, обратная сопротивлению (1 См = 1 Ом -1 ). Измерение удельной электропроводности иногда может дать достаточно точное представление об общем солесодержании воды. Если вода относительно чистая, то условно можно считать, что 1 мкСм/см ≈ 0.5 мг/л солей. И вот мы вплотную подошли к сущности анализа воды.
Тут надо отвлечься и уточнить, что видов анализов воды — масса. Навскидку, есть химический и микробиологический. А ещё органолептический, радиометрический, несть им числа. Я занимаюсь непосредственно химическим анализом воды, о нём и поговорим. В России документ, регламентирующий качество воды для хозяйственно-бытовых нужд, называется «СанПиН 2.1.4.1074-01». И контролируемых параметров там — тьма тьмущая. Здесь уместно отметить, что такого понятия, как «техническая вода», ни в одном официальном документе не существует. Более того, то, что обычно в простонародье подразумевают под технической водой — это как раз вода, которую можно пить, но нельзя использовать в той самой технике. Подчас на производство или в паровой котёл нужно подавать полностью обессоленную (деионизованную) воду.
Смотреть в лаборатории все параметры, подразумеваемые СанПиНом — сумасшествие. Во-первых, на анализ одной пробы уйдёт тогда неделя (тогда как анализ по 12 показателям делается за 2 часа). А во-вторых, существующие фильтрующие материалы всё равно очищают воду только от конечного числа загрязнителей. И, конечно, большая часть указанных в СанПиНе загрязнителей практически не встречается в обычных природных водах или встречается в таком количестве, что заведомо проходит по нормам. Пойдём по порядку со всеми комментариями (по какому именно порядку — я ещё не решил).
Железо. Есть практически во всех подземных водах, а вот в поверхностных — реках, озёрах — обнаружить его можно нечасто. Бывает в двух формах: растворимое, или двухвалентное Fe 2+ и окисленное, или трёхвалентное Fe 3+ . Соли двухвалентного железа прекрасно растворяются в воде (железный купорос FeSO4 ∙ 7H2O многие садоводы найдут в профильных магазинах), однако кислородом воздуха очень быстро окисляются и переходят в соединения трёхвалентного железа. А вот соединения трёхвалентного железа в воде не растворимы — ржавчину все видели, а ржавчина это смесь Fe2O3 ∙ nH2O и Fe(OH)3.
FeCl3 прекрасно в воде растворяется, после чего гидролизуется до оксихлорида и выпадает в осадок. То же самое касается других растворимых соединений трёхвалентного железа — они подвержены гидролизу в водном растворе с образованием нерастворимых продуктов.
Поэтому в поверхностных источниках железа мало: оно если и было изначально, то быстро окислилось при контакте с атмосферой и ушло в ил. Помимо атмосферы, естественным врагом двухвалентного железа являются железобактерии, которые живут за счёт энергии, выделяемой при окислении ими двухвалентного железа. Зато у него есть верный союзник в виде сероводорода. В подземных водах часто содержится сероводород в большом количестве, а он является сильным восстановителем и не даёт железу окисляться даже при контакте с атмосферой. Вообще, зависимость формы железа в растворе от окислительно-восстановительного потенциала и водородного показателя наглядно отображена в диаграммах Пурбе. Железо является одним из микроэлементов и необходимо организму человека (суточная потребность — 10 мг ), и усваивается, в том числе, из воды. Конечно, содержание железа сказывается на органолептических свойствах воды (если его больше 1-2 мг/л), а избыточное его поступление в организм может спровоцировать разные отклонения в здоровье. Ну, это всегда так. Всё есть лекарство и всё есть яд, всё дело в дозе, сказал Парацельс.
ПДК железа общего в воде хозяйственно-бытового назначения составляет 0.3 мг/л. В городском водопроводе с труб при ржавлении летит примерно 0.10. 0.15 мг/л (там, где я живу). Удаляют железо просто: сначала окисляют, чтобы наверняка (напомню, окисленное железо в воде не растворимо), затем полученные частички коагулируют (укрупняют), и всю эту конструкцию ловят механическим способом — на слое загрузки. Существуют разные каталитические загрузки, на поверхности которых все указанные процессы и происходят. Представляют они собой песок, покрытый слоем оксида марганца — того самого катализатора окисления железа — и нуждаются в периодической реагентной промывке раствором перманганата калия (нет, соединения марганца не смываются с загрузки и не попадают в очищенную воду — ну, если, конечно, вы не захотите смешать каталитический материал с лимонной кислотой). Есть и безреагентные загрузки, но перед ними требуется предварительное окисление железа, а уж каким способом — атмосферным воздухом, озоном или хлором — решит инженер. Если в Вашей воде железа до 5 мг/л — считайте, что Вам крупно повезло: установка будет подешевле. Если железа 10 мг/л — уже дорого. А вот 30 мг/л и выше — можете распрощаться с планируемой поездкой в тёплые страны. Такая установка может стоить несколько сотен тысяч рублей. Вообще, основная стоимость большинства полупромышленных систем фильтрации как раз зависит от концентрации железа. Чем его больше — тем дороже. Поэтому так важно тщательно пролить воду перед отбором пробы — застоявшаяся в металлических трубах вода может набрать железа, и инженер предложит вам по анализу такую установку, на которую у Илона Маска денег не хватит. Но и это ещё не всё. Отдельно стоит упомянуть про так называемое органическое железо — комплексные органические соединения, содержащие в составе молекулы атом железа (как правило, гуматы — комплексы гуминовых кислот). Выбить железо из таких комплексов нелегко, и оно не окисляется на воздухе. Удаление из воды органического железа может быть затруднительным.
Марганец. От марганца на сантехнике появляется серый налёт, поэтому нормируют его жёстко. Организму человека этот микроэлемент тоже необходим (суточная потребность 2 мг [1] ). Из воды легко усваивается. Ещё содержится в свёкле и половине овощей вообще. Валентностей у марганца целых семь, подробно рассматривать не имеет смысла. Двухвалентный марганец хорошо растворим, трёх- и четырёхвалентный обычно подвергается гидролизу и выпадает в виде нерастворимых гидроксидов. В отличие от железа, марганец в поверхностных водах встречается чаще. Особенно если это колодцы, и в подземной воде, питающей их, содержится какой-нибудь двухвалентный ион марганца. Дело в том, что марганец так вот запросто атмосферным воздухом не окисляется. Может захватываться осаждающимся железом и удаляться совместно с ним. Загрузки все те же самые, ибо принцип тот же: окисление, укрупнение и механическая фильтрация. ПДК 0.1 мг/л.
Жёсткость. Жёсткость замыкает тройку параметров, на которые нацелены почти все полупромышленные системы очистки воды. Да-да, есть фильтры-обезжелезиватели (удаляют железо, марганец и некоторые другие тяжёлые металлы) и фильтры-умягчители (удаляют жёсткость). Безусловно, есть другие типы фильтров, которые работают, например, по окисляемости, но в конечном итоге для промышленных нужд вам предложат обратный осмос с предочисткой, тогда вода на выходе будет как по ГОСТу для лабораторий: 3. 5 мкСм/см. Но мы отвлеклись. В школе вам рассказывали, что жёсткость — это совокупность ионов кальция и магния. Именно они выпадают в виде накипи при кипячении воды. На самом деле, такое определение не совсем корректно. Да, значительную долю жёсткости составляют ионы кальция и магния, но вообще жёсткость — это сумма всех щелочноземельных ионов, а также некоторых двухвалентных ионов тяжёлых металлов. Цинк, барий, кадмий, даже двухвалентное железо — это всё жёсткость. Другое дело, что химик в лаборатории будет маскировать ионы двухвалентного железа при измерении жёсткости. Зато кадмий вполне себе на величине жёсткости отразится. Но поспешу вас успокоить: ионов кальция в составе жёсткости большинство — как правило, процентов 80, и ещё процентов 15 магния. Нормируют жёсткость исключительно для снижения количества накипи в чайниках, а особо рьяно — в отраслевых стандартах для всяких котельных, где жёсткости в воде быть не должно вообще. Иногда вы можете услышать, что использовать в хозяйстве нужно исключительно мягкую воду, а жёсткая, якобы, вредна. Жёсткая вода увеличивает затраты на мыло, уменьшает срок жизни стиральной машинки… Вас могут начать убеждать, аргументируя тем, что кальций из воды всё равно не усваивается, и организм получает его из молока и сыра. Это некорректно.
Давайте отвлечёмся и кратко поговорим о процессе скисания молока. В молоке содержится казеинат кальция и молочный сахар лактоза. Микроорганизмы, попавшие в молоко, начинают сбраживать лактозу, постепенно превращая её в молочную кислоту. Молочная кислота выбивает из казеината кальция кальций и замещает его на ион водорода. Казеинат кальция при этом превращается в казеин — белок молока, из которого целиком состоит творог. А кальций остаётся в сыворотке в виде лактата кальция. Так что творог и сыр кальцием бедны. А в натуральном свежем молоке — да, кальций есть. Но, чтобы усвоиться, он сначала должен быть выбит из казеината соляной кислотой желудка. В воде же кальций уже готовый — сразу в ионной форме, и усваивается мгновенно. Поэтому, вода — один из важнейших источников кальция в организме, а нужно нам его немало — суточная потребность составляет не менее 1000 мг. ПДК по жёсткости — 7 мг-экв/л. Если переводить это в кальций, то в воде может содержаться (7 ∙ 20.04) 140 мг/л кальция. Так что вам потребуется выпить 7-8 литров воды, чтобы получить суточную норму. Однако накипь начинает заметно образовываться уже при содержании жёсткости порядка 4 мг-экв/л. Ручное кусковое мыло — смесь натриевых солей высших жирных кислот — при контакте с жёсткой водой превращается в смесь кальциевых солей высших жирных кислот, а кальциевые соли мыла в воде растворяются плохо. Но сейчас производители добавляют в мыло умягчающие агенты — например, трилон Б, которые нивелируют этот процесс. Синтетические же моющие средства — порошки, гели и прочие лаурилсульфаты — вообще жёсткости не боятся и никак ею не осаждаются. Вывод? Пить полезно жёсткую воду (7 мг-экв/л согласно СанПиН), руки с мылом мыть в воде с содержанием жёсткости 2. 4 мг-экв/л, на стиральную и посудомоечную машины подавать мягкую воду (
Осмотическое давление, благодаря которому растения всасывают воду из почвы, действует по следующему принципу: если два раствора разделены полупроницаемой перегородкой, через которую могут проникнуть молекулы воды, но не пройдут ионы, то растворитель перетекает из области с меньшей концентрацией в область с большей, уравнивая концентрации. Обратный осмос использует точно такую же полупроницаемую мембрану, но искусственно создаётся давление как раз в области с большей концентрацией, в результате чего растворитель перетекает в область с меньшей концентрацией, а раствор концентрируется. При этом входной поток воды разделяется на два: пермеат (чистая вода) и концентрат, который сливается в дренаж. В бытовых осмосах соотношение пермеат: концентрат составляет примерно 1: 3 (3 части входной воды сливаются в дренаж). В дорогих промышленных этот процесс компенсируют, иначе потери будут страшными.
Водородный показатель. Он же pH. На нём и будем закругляться. Представляет собой отрицательный десятичный логарифм из концентрации ионов водорода, индицирует кислотность среды. Нормируется в диапазоне 6-9 ед. pH. Более кислый раствор растворит вам зубы, более щелочной начнёт раздражать слизистую желудка. Очень важный параметр для подбора оборудования — многие загрузки работают в определённом диапазоне pH. В природных водах почти всегда находится вблизи отметки 7 ед. pH, в каких-то экстраординарных случаях инженер может предложить дозировать в воду щёлочь или кислоту для достижения заданного значения кислотности.
В конце хочу добавить пару слов о типах фильтров. Я упоминал в тексте кабинетные системы и фильтры колонного типа. В сущности, это одно и то же. Есть некий баллон, внутри которого располагаются дренажно-распределительная система и фильтрующий материал. Только в кабинетных системах это всё зажато в небольшой объём и помещено в корпус размером со стиральную машинку. Из плюсов — меньший расход воды и реагентов на промывку, из минусов — один фильтрующий материал на все параметры. Фильтры колонного типа более гибкие в настройке — например, если кабинетник сразу удалит вам железо, марганец и жёсткость в ноль, и вы ничего с этим не сделаете, то, поставив последовательно две колонны — одну по железу, вторую по жёсткости — вы сможете регулировать выходную жёсткость воды так, чтобы вам было комфортно принимать душ (чтобы не было ощущения, будто мыло не смывается), при этом железа и марганца в очищенной воде не будет. Помните, что типоразмер баллона зависит от вашего водопотребления, и нельзя ставить самый маленький баллончик на расход воды в два кубометра в час. Просто начнутся проскоки загрязнений, и в конце концов вы убьёте фильтрующий материал. Фильтрующие материалы, к слову, обычно служат 5-7 лет, после чего их необходимо заменять. Но прежде рекомендую провести анализ воды на выходе, потому что я лично щупал фильтр, который исправно работает 11 лет на одной загрузке.
Материал получился большой, можно почитать на ночь, чтобы быстрее заснуть и крепче спать. Я попытался объять необъятное, рассказал самую суть и сейчас дополню, разве что, про бактериологическую очистку. Есть всего один метод убить живность в воде — окислить её. Для этого в простейшем случае в воду будут дозировать хлор в виде гипохлорита или на выходе поставят ультрафиолетовую лампу. Ультрафиолет ионизирует растворённый в воде кислород, а активный кислород как раз и убьёт бактерии. Оптимальный вариант — озонатор. УФ-лампа или озонатор ставятся на выходе после всей очистки, непосредственно перед подачей воды потребителю, а хлор — наоборот, в начале. Потому что хлор более медленный окислитель и ему нужно дать время, а потом излишки хлора нейтрализовать на угольном фильтре.
В водоочистке ещё очень много нюансов и подводных камней. Но… «Это неописуемо!» — сказала Моська, глядя на баобаб. опубликовано econet.ru
Если у вас возникли вопросы по этой теме, задайте их специалистам и читателям нашего проекта здесь.
Понравилась статья? Тогда поддержи нас, жми:
источник
Метод определения общей жесткости воды основан на том, что ионы кальция и магния связываются трилоном Б в комплексные соединения. О конце реакции судят по изменению цвета индикатора хромогена черного от розово-малинового до синевато-серого. Появление синевато-серого окрашивания свидетельствует об отсутствии ионов Са 2+ и Mg 2+ в растворе, т. е. о полном связывании их с трилоном Б.
В коническую колбу вместимостью 250 мл отмеривают 100 мл исследуемой воды, добавляют 5 мл аммиачного буферного раствора, индикатор хромоген (сухую смесь) и медленно титруют 0,1 н раствором трилона Б до перехода окраски в серовато-синюю.
Общую жесткость воды Жо, ммоль экв/л, вычисляют по формуле
где V1 – объем 0,1 н раствора трилона Б, израсходованный на титрование пробы, мл; К – коэффициент нормальности раствора трилона Б (К = Nфакт / 0,1); N1 – нормальность раствора трилона Б; V2 – объем исследуемой пробы воды, мл.
Определение карбонатной жесткости воды
Оттитровывают 100 мл воды 0,1 н раствором HCl в присутствии метилового оранжевого до перехода окраски от желтой к розовой. Карбонатную жесткость Жк, ммоль экв/л, вычисляют по формуле
где V3 – объем HCl, который пошел на титрование, мл; N2 – нормальность HCl, моль/л; V2 – объем воды, который взят для анализа, мл.
Некарбонатная жесткость определяется как разница между общей и карбонатной жесткостью
Определение количества диоксида углерода
В колбу поместите 200 мл исследуемой воды, добавьте 2 капли раствора фенолфталеина и взболтайте. Если вода окрасилась в интенсивный розовый цвет, это значит, что в ней нет растворенного диоксида углерода. Отсутствие окраски или очень слабая окраска свидетельствуют о присутствии растворенного диоксида углерода. В этом случае пробу титруют 0,1 н раствором NaOH до появления интенсивной окраски. Концентрацию диоксида углерода определяют по формуле
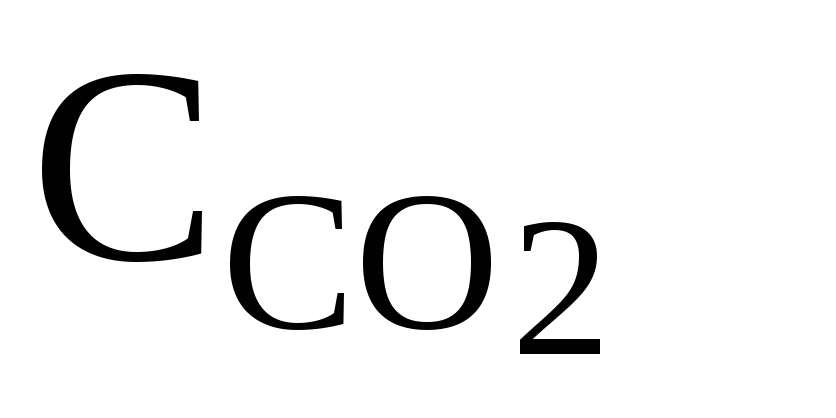
где N – нормальность NаОН, моль/л; V4 – его объем, мл.
Определение концентрации кальция и магния
К 100 мл воды добавляют 3 мл 10%-ного КОН до рН = 10–12, вносят примерно 0,2 г сухого индикатора мурексида, смешанного с сульфатом калия, и титруют трилоном Б до перехода окраски из розовой в фиолетовую.
Концентрацию кальция СК, ммоль экв/л, рассчитывают по формуле
где V5 – объем трилона Б, пошедший на титрование, мл.
Концентрацию магния См, ммоль экв/л, рассчитывают по формуле
После проведения полного обессоливания воды необходимо убедится в отсутствии в ней как катионов (Mg 2+ , Ca 2+ ), так и анионов (SO4 2– , NO3 – , Cl – ). Анализ на содержание указанных анионов в воде до ее обессоливания и после проводится качественно.
SO4 2– – раствор хлорида бария дает белый осадок сульфата бария;
Cl – – при добавлении раствора нитрата серебра образуется белый осадок хлорида серебра;
NO3 – – при добавлении раствора дифениламина в серной кислоте появляется характерное для ионов NO3 – синее окрашивание.
Определение содержания взвешенных частиц (мутность воды)
Мутность воды определяется фотоколориметрическим методом при длине волны 440 нм. Оптическую плотность измеряют в кюветах с толщиной поглощающего слоя 3 мм. Количество взвешенных частиц в воде находят по калибровочной кривой.
Регистрирующим прибором в фотоколориметре служит микроамперметр типа М907, оцифрованный в микроамперах и имеющий шкалу 0–100 делений, соответствующих шкале коэффициентов пропускания – и оптической плотности – D. При измерении со светофильтром 440 нм, отмеченным на лицевой панели колориметра черным цветом, ручку «Чувствительность» устанавливают в одно из положений 1, 2 или 3. Рабочие поверхности кювет перед каждым измерением необходимо тщательно протирать спирто-эфирной смесью, жидкость в кюветы наливать до метки на боковой поверхности кюветы. При установке кювет в кюветодержатель нельзя касаться пальцами участков поверхности кювет ниже уровня жидкости в них.
Колориметр включают в сеть за 15 мин до начала измерений. Во время прогрева кюветное отделение должно быть открыто (при этом шторка перед фотоприемником перекрывает световой пучок). В световой пучок помещают кювету со стандартным раствором, по отношению к которому производят измерения, и крышку кюветного отделения закрывают. Ручками «Чувствительность» и «Установка 100» устанавливают отсчет 100 по шкале колориметра. Затем поворотом ручки кювету со стандартным раствором заменяют кюветой с исследуемым раствором. После этого производят отсчет по шкале колориметра, соответствующий коэффициенту пропускания исследуемого раствора в процентах, или по шкале D в единицах оптической плотности. Измерения проводят 3–5 раз и окончательное значение измеряемой величины определяют как среднее арифметическое полученных значений.
источник
