Хорошо известно, что молекулы жиров участвуют в реакциях со свободными радикалами. Аминокислоты, составные части белковых макромолекул и пептидов, также являются мишенями атаки свободными радикалами (см. ОКИСЛЕНИЕ ЛИПОПРОТЕИДОВ (ЛИПИДОВ).
Окисление аминокислот в составе белка неизбежно приводит к физическим изменениям самих белков (характеризующимися изменениями флуоресценции). Эти физические изменения можно разбить на три группы: фрагментация, аггрегация и чувствительность к протеолизу .
Пероксидация жиров при реакции со свободными радикалами считается основным источником вреда, наносимого воздействием свободных радикалов . Хотя пероксидация жиров происходит при реагировании со свободными радикалами, этот процесс in vivo еще недостаточно изучен. Исследования in vitro показали, что пероксидация полиненасыщенных жирных кислот обычно состоит из трех стадий: инициация, элонгация и терминация .
Пероксидация липидных молекул необратимо нарушает их структуру ( Yu et al., 1992 ). Эти нарушения наиболее заметны, если повреждаются липиды — составные части биологической мембраны; пероксидация мембранных липидов приводит к нарушению липидного бислоя и структурной организации мембраны.
Исследования химии свободных радикалов показали, что нет таких биологических веществ, которые бы не подвергались воздействию свободных радикалов. Поэтому, неудивительно, что глюкоза и другие моносахара подвергаются окислению в определенных условиях.
Наиболее распространенный и легко обнаруживаемый тип повреждения белков — образование карбонильных групп при окислении аминокислот : лизина , аргинина и пролина [ Stadtman ea 1992 ]. В таблице представлены данные по концентрации карбонильных групп в белках в различных тканях человека и крысы, а также в белках мухи, нематоды и бактерии. Из таблицы видно, что концентрация карбонильных групп и, следовательно, уровень окислительных повреждений в белках не зависят ни от вида организма, ни от типа ткани. При анализе использовали данные для молодых организмов, так как уровень поврежденных белков, как будет видно из дальнейшего изложения, зависит от возраста. Этот уровень составляет 1.5-2.5 нмоль/мг белка, и у молодых особей никогда не превышает 3 нмоль/мг. Такой результат представляется особенно удивительным, поскольку разные организмы, а также различные ткани сильно различаются по интенсивности метаболизма, а следовательно, и по интенсивности продукции свободных радикалов. Каким же образом концентрация поврежденных белков в клетке поддерживается на постоянном уровне? Скорость производства свободных радикалов в клетке зависит, прежде всего, от интенсивности дыхания. Для того, чтобы при усилении дыхания степень повреждения белков поддерживалась на постоянном уровне, необходимо, чтобы при этом происходило увеличение скорости обновления поврежденных белков. То есть скорости дыхания и обновления белков в различных тканях и организмах должны быть коррелированы.
В условиях окислительного стресса происходит окислительная модификация белков. Свободные радикалы атакуют белки по всей длине полипептидной цепи, нарушая не только первичную, но и вторичную, и третичную структуру белков, что приводит к агрегации или фрагментации белковой молекулы ( Дубинина и соавт., 2002 ; Agarwal S. and Sohal R., 1995 ). Многие ферменты, содержащие SH-группы, такие как АТФазы или дегидрогеназы, легко окисляются в результате свободнорадикальной атаки.
Интересный пример окислительной модификации белков представляет ксантиндегидрогеназа , которая превращает ксантин (и гипоксантин) в мочевую кислоту, а мочевая кислота выступает как неферментативный компонент антиоксидантной системы.
В результате действия АФК происходит окисление SH-групп этого белка и превращение ксантиндегидрогеназы в ксантиноксидазу . Последняя, одновременно с мочевой кислотой, начинает образовывать супероксид-анион кислорода. В итоге происходит дополнительное увеличение концентрации свободных радикалов в тканях ( Болдырев, 2001 ).
Если белок содержит металл с переменной валентностью, в присутствии перекиси водорода образуется гидроксид-радикал , окисляющий аминокислоты в активном центре фермента, что может привести к его инактивации.
Так, повреждение комплекса I митохондрий , сукцинатдегидрогеназы и ферментов, содержащих железо-серные кластеры, в организме мышей, нокаутных по гену Mn-СОД , где супероксид-анион не утилизируется в достаточной степени, приводит к нарушению функции цикла трикарбоновых кислот и работы митохондриальной дыхательной цепи ( Raha and Robinson, 2000 ).
Карбоксильные группы белков под действием АФК превращаются в карбонильные группы, которые, в свою очередь, могут взаимодействовать с аминогруппами, образуя Шиффовы основания, приводящие в конечном итоге к образованию поперечных сшивок между белковыми молекулами и нарушению их активности ( Richter et al., 1988 ). Процесс химического сшивания наблюдается и при гликировании белков, который существенно активируется при окислительном стрессе.
источник
ЦЕЛЬ: Представлять общую схему обмена веществ в организме, обмен белков, жиров, углеводов и проявления патологии этих видов обмена.
1. Поступив в организм, молекулы пищевых веществ участвуют во множестве различных реакций. Эти реакции, а также остальные химические проявления жизнедеятельности называются обменом веществ, или метаболизмом. Пищевые вещества либо используются в качестве сырья для синтеза новых клеток, либо окисляются, доставляя организму энергию. Часть этой энергии необходима для непрерывного построения новых тканевых компонентов. Другая часть расходуется в процессе функционирования клеток: при сокращении мышц, передаче нервных импульсов, секреции клеточных продуктов. Остальная энергия освобождается в виде тепла.
Процессы обмена веществ принято разделять на анаболические и катаболические. Анаболизмом (ассимиляцией) называют химические процессы, при которых более простые вещества соединяются между собой с образованием более сложных веществ, что приводит к накоплению энергии, построению новой протоплазмы и росту. Катаболизмом (диссимиляцией) называют расщепление этих сложных веществ, приводящее к освобождению энергии, при этом происходит разрушение протоплазмы и расходование ее веществ.
Сущность обмена веществ заключается:
1) в поступлении в организм из внешней среды различных питательных веществ;
2) в усвоении и использовании их в процессе жизнедеятельности как источников энергии и материала для построения тканей;
3) в выделении образующихся продуктов обмена во внешнюю среду.
Специфические функции обмена веществ:
1) извлечение энергии из окружающей среды в форме химической энергии органических веществ;
2) превращение экзогенных веществ в строительные блоки, т.е. предшественники макромолекулярных компонентов клетки;
3) сборка белков, нуклеиновых кислот и других клеточных компонентов из этих строительных блоков;
4) синтез и разрушение тех биомолекул, которые необходимы для выполнения различных специфических функций данной клетки.
2. Обмен белков — это совокупность пластических и энергетических процессов превращения белков в организме, включая обмен аминокислот и продуктов их распада. Белки составляют основу всех клеточных структур и являются материальными носителями жизни. Биосинтез белков определяет рост, развитие и самообновление всех структурных элементов в организме и тем самым их функциональную надежность. Суточная потребность в белках (белковый оптимум) для взрослого человека в среднем составляет 100-120 г (при трате энергии 3000 ккал/сутки).
В распоряжении организма должны быть все аминокислоты (20) з определенном соотношении и количестве, иначе белок не может быть синтезирован. Многие составляющие белок аминокислоты (валин, лейцин, изолейцин, лизин, метионин, треонин, фенилаланин, триптофан) не могут синтезироваться в организме и должны поступать с пищей. Это т.н. незаменимые аминокислоты. Другие аминокислоты могут быть синтезированы в организме и называются заменимыми (12: гликокол, аланин, глутаминовая кислота, пролин, оксипролин, серии, тирозин, цистеин, аргинин, гистидин и др.). Белки делят на биологически полноценные (с полным набором всех восьми незаменимых аминокислот) и неполноценные (при отсутствии одной или нескольких незаменимых аминокислот).
Основными этапами обмена белков являются:
1) ферментативное расщепление белков пищи до аминокислот и всасывание последних;
2) превращение аминокислот;
5) образование конечных продуктов распада аминокислот.
Всосавшись в кровеносные капилляры ворсинок слизистой оболочки тонкого кишечника, аминокислоты по воротной вене поступают в печень, где они либо немедленно используются, либо задерживаются в качестве небольшого резерва. Часть аминокислот остается в крови и попадает в другие клетки тела, где они включаются в состав новых белков. Белки тела непрерывно и быстро расщепляются и синтезируются заново. Период обновления общего белка в организме составляет у человека 80 дней. Если пища содержит больше аминокислот, чем это необходимо для синтеза клеточных белков, ферменты печени отщепляют от них аминогруппы NH2, т.е. производят дезаминирование.
Другие ферменты, соединяя отщепленные аминогруппы с СО2, образуют из них мочевину, которая переносится с кровью в почки и выделяется с мочой. Углеродные цепи некоторых аминокислот, называемых «глюкогенными», могут превращаться в глюкозу или гликоген; углеродные цепи других аминокислот – «кетогенных» дают кетоновые тела. Белки практически не откладываются в депо, поэтому белки, которые организм расходует после истощения запаса углеводов и жиров, — не резервные, а ферменты и структурные белки клеток.
Нарушения обмена белков в организме могут быть количественные и качественные. О количественных изменениях белкового обмена судят по азотистому балансу, т.е. по соотношению количества азота, поступившегo в организм с пищей и выделенного из него. В норме у взрослого человека при адекватном питании, как правило, количество введенного в организм азота равно количеству азота, выведенного из организма (азотистое равновесие). Когда поступление азота превышает его выделение, говорят о положительном азотистом балансе, при этом происходит задержка азота в организме. Наблюдается в период роста организма, во время беременности, при выздоровлении. Когда количество выведенного из организма азота превышает количество поступившего, говорят об отрицательном азотистом балансе. Он отмечается при значительном снижении содержания белка в пище (белковом голодании).
Качественные изменения белкового обмена приводят к изменениям в структуре клеток и тканей — белковым дистрофиям — диспротеинозам.
3. Обмен жиров — это совокупность процессов превращения липидов (жиров) в организме. Жиры являются энергетическим и пластическим материалом, входят в состав оболочки и цитоплазмы клеток. Часть жиров накапливается в виде запасов, составляющих 10-30% массы тела. Основная масса жиров — это нейтральные липиды (триглицериды олеиновой, пальмитиновой, стеариновой и других высших жирных кислот). Суточная потребность в жирах для взрослого человека составляет 70-100 г. Биологическая ценность жиров определяется тем, что некоторые ненасыщенные жирные кислоты (линолевая, линоленовая, арахидоновая), необходимые для жизнедеятельности, являются незаменимыми и не могут образовываться в организме человека из других жирных кислот, поэтому они должны обязательно поступать с пищей (растительные и животные жиры). Суточная потребность в незаменимых жирных кислотах для взрослого человека составляет 10-12 г.
Основными этапами жирового обмена являются:
1) ферментативное расщепление жиров пищи в желудочно-кишечном тракте до глицерина и жирных кислот и всасывание последних в тонком кишечнике;
2) образование липопротеидов в слизистой оболочке кишечника и в печени и транспорт их кровью;
3) гидролиз этих соединений на поверхности клеточных мембран ферментом липопротеидлипазой, всасывание жирных кислот и глицерина в клетки, где они используются для синтеза собственных липидов клеток органов и тканей. После синтеза липиды могут подвергаться окислению, выделяя энергию, и превращаться в конечном итоге в углекислый газ и воду (100 г жиров дает при окислении 118 г воды). Жир может трансформироваться в гликоген, а затем подвергаться окислительным процессам по типу углеводного обмена. При избытке жир откладывается в виде запасов в подкожной клетчатке, большом сальнике, вокруг некоторых внутренних органов.
С пищей, богатой жирами, поступает некоторое количество липоидов (жироподобных веществ) — фосфатидов и стеринов. Фосфатиды необходимы организму для синтеза клеточных мембран, они входят в состав ядерного вещества, цитоплазмы клеток. Фосфатидами особенно богата нервная ткань. Главным представителем стеринов является холестерин. Он также входит в состав клеточных мембран, является предшественником гормонов коры надпочечников, половых желез, витамина D, желчных кислот. Холестерин повышает устойчивость эритроцитов к гемолизу, служит своеобразным изолятором для нервных клеток, обеспечивая проведение нервных импульсов. Нормальное содержание общего холестерина в плазме крови 3,11-6,47 ммоль/л.
Патология жирового обмена проявляется чаще всего в общем увеличении нейтрального жира в организме, называемом общим ожирением (тучностью). Причиной этого могут быть нейроэндокринные расстройства, а также избыточное питание, алкоголизм, малоподвижный образ жизни.
4. Обмен углеводов — это совокупность процессов превращения углеводов в организме. Углеводы являются источниками энергии для непосредственного использования (глюкоза) или образуют депо энергии (гликоген), являются компонентами ряда сложных соединений (нуклеопротеиды, гликопротеиды), используемых для построения клеточных структур. Суточная потребность в углеводах взрослого человека составляет 400-500 г.
Основными этапами углеводного обмена являются:
1) расщепление углеводов пищи в желудочно-кишечном тракте и всасывание моносахаридов в тонком кишечнике;
2) депонирование глюкозы в виде гликогена в печени и мышцах или непосредственное ее использование в энергетических целях;
3) расщепление гликогена в печени и поступление глюкозы в кровь по мере ее убыли в крови (мобилизация гликогена);
4) синтез глюкозы из промежуточных продуктов (пировиноградной и молочной кислот) и неуглеводных предшественников;
5) превращение глюкозы в жирные кислоты;
6) окисление глюкозы с образованием углекислого газа и воды.
Углеводы всасываются в пищеварительном канале в виде глюкозы, фруктозы и галактозы. Они поступают по воротной вене в печень, где фруктоза и галактоза превращаются в глюкозу, накапливающуюся в виде гликогена (полисахарид). Процесс синтеза гликогена в печени из глюкозы называется гликогенезом (в печени содержится в виде гликогена около 150-200 г углеводов). Часть глюкозы попадает в общий кровоток и разносится по всему организму, используясь как основной энергетический материал и как компонент сложных соединений (гликопротеиды, нуклеопротеиды).
Глюкоза является постоянной составной частью (биологической константой) крови. Содержание глюкозы в крови человека в норме 4,44-6,67 ммоль/л, при увеличении ее содержания (гипергликемии) до 8,34-10 ммоль/л она выводится с мочой в виде следов. При понижении уровня глюкозы в крови (гипогликемии) до 3,89 ммоль/л появляется чувство голода, до 3,22 ммоль/л — возникают судороги, бред и потеря сознания (кома).
При окислении глюкозы в клетках для получения энергии она в конечном итоге превращается в углекислый газ и воду. Распад гликогена в печени до глюкозы — гликогенолиз. Биосинтез углеводов из продуктов их распада или продуктов распада жиров и белков — гликонеогенез. Расщепление углеводов при отсутствии кислорода с накоплением энергии в АТФ и образованием молочной и пировиноградной кислот — гликолиз.
Когда поступление глюкозы превышает потребность, печень превращает глюкозу в жир, который откладывается про запас в жировых депо и может быть использован в будущем как источник энергии.
Нарушение нормального обмена углеводов проявляется повышением содержания глюкозы в крови. Постоянная гипергликемия и глюкозурия, связанная с глубоким нарушением углеводного обмена наблюдается при сахарном диабете. В основе болезни лежит недостаточность инкреторной функции поджелудочной железы. Вследствие недостатка или отсутствия инсулина в организме нарушается способность тканей использовать глюкозу, и она выводится с мочой.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: При сдаче лабораторной работы, студент делает вид, что все знает; преподаватель делает вид, что верит ему. 8930 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Задания для контроля уровня сформированности компетенций в учебное время. 1.Является ли окисление белков, жиров и углеводов в тканях экзотермическим
1.Является ли окисление белков, жиров и углеводов в тканях экзотермическим
2.В каком случае при потреблении 1 л кислорода в организме окисляется большее
1) при окислении белков; 2) при окислении жиров; 3) при окислении углеводов.
3.В каком случае у человека будет наблюдаться отрицательный азотистый баланс?
1) при голодании; 2) в период роста 3) при беременности
4.Все ли белки, поступающие с пищей, участвуют в обменных процессах?
5.Энергозатраты организма в условиях физиологического покоя в положении лёжа,
натощак, при температуре комфорта, составляют обмен:
1) рабочий 2) основной 3) энергии 4) веществ 5) валовый.
6. Общие (на протяжении суток) энергозатраты организма складываются из следующих компонентов:
1) основной обмен, рабочая прибавка 2) основной обмен, специфически–динамическое действие пищи 3) основной обмен, специфически — динамическое действие пищи, рабочая прибавка.
7.Энергозатраты организма в покое можно определить путём измерения:
1) ЧСС и АД 2) количества выделенного тепла 3) уровня глюкозы и свободных жирных кислот в крови 4) поглощённого кислорода 5) выделенного углекислого газа
8.Дыхательный коэффициент отражает:
1) количество тепла, освобождаемое при окислении 1г вещества
2) количество тепла, освобождаемое при потреблении 1л кислорода
3) соотношение объёма выделенного СО2 к объёму поглощенного кислорода
4) отношение объёма поглощённого кислорода к объёму выделенного СО2.
9.Прямая калориметрия заключается в определении энергетических затрат по количеству:
1) потреблённого кислорода и выделенного СО2
2) потреблённого кислорода
3) выделенного углекислого газа
10.Не может быть компонентом основного обмена:
1) повышение энергорасхода при эмоциях и действии на организм холода
2) затраты энергии на клеточный метаболизм
3) затраты энергии на дыхание
4) затраты энергии на кровообращение
1. В крови больного обнаружено 12 ммоль/л глюкозы. В анализах мочи присутствует сахар. Какой обмен страдает? С чем может быть связано данное явление?
2. Перед исследованием обмена животному ввели адреналин. Как повлияет это на энергетический обмен?
3. Одинаков ли уровень обмена у двух здоровых людей одного пола, возраста, роста и веса, если один из них перед исследованием получил 200 г. мяса, другой – 200 г. картофеля? Почему?
4. У каких животных в норме дыхательный коэффициент относительно выше – у хищников или травоядных?
Учебно-материальное обеспечение:
Обязательная:
1. Нормальная физиология. / Под ред. В.М. Смирнова / Учебник. М.: Академия», 2012
2. Нормальная физиология. Учебник. / Под ред. А.В, Завьялова. В.М. Смирнова.- М.: «Медпресс-информ», 2009
3. Физиология человека. Учебник./ Под ред. В.М. Покровского, Г.Ф. Коротько.- М.: Медицина, 2003
4. Физиология человека. Учебник./ Под ред. Н.А. Агаджаняна, В.И. Циркина.-СП.: СОТИС, 2002
5. Нормальная физиология. Учебник. / Под ред. Р.С. Орлова, А.Д. Н Орлова. М. Издателькая группа «ГЭОТАР-Медиа», 2005
6. Нормальная физиология. Учебник. / Под ред.В.Н. Яковлева. М.: Издательский центр «Академия», 2006
7. Руководство к практическим занятиям по нормальной физиологии. / Под ред. С.М. Будылиной, В.М. Смирнова. М.: Издательский центр «Академия», 2005
Дополнительная:
1. Руководство к практическим занятиям по физиологии / Под ред. К.В.Судакова М.: Медицина, 2002
2. Нормальная физиология. Учебник. / Под ред. К.В. Судакова – М.: «ГЭОТАР-Медиа», 2012
3. Физиология человека: атлас динамических систем /К.В. Судаков, В.В. Андрианов, Ю.Е. Вагин, И.И. Киселёв — М.: ГЭОТАР – Медиа, 2009
Материальное обеспечение:
Наглядные пособия:
а) таблицы по физиологии обмена веществ;
б) таблицы Гарриса – Бенедикта;
в) таблицы калорического эквивалента кислорода;
г) видеофильм «Обмен веществ».
Технические средства обучения: TV, DVD.
Оценивание уровня сформированности компетенций обучающихся проводится по балльно – рейтинговой системе.
Дата добавления: 2015-08-18 ; просмотров: 354 | Нарушение авторских прав
источник
1. Оценка метаболизма глюкозы. Три десятилетия назад Bier и соавт. были первыми, кто определил продукцию глюкозы печенью, используя инфузию D-[6,6- 2 Н2]глюкозы у новорожденных детей, и показал практически линейную зависимость между массой головного мозга и продукцией глюкозы в человеческом организме, начиная с недоношенного ребенка с массой тела 1000 г и заканчивая взрослым человеком с массой тела 80 кг.
Эти ученые высказали предположение, что размер головного мозга может являться принципиальной детерминантой тех факторов, которые регулируют продукцию глюкозы печенью на протяжении всей жизни человека. С тех пор разведение изотопа широко использовали, например, для оценки ответной продукции глюкозы на инсулин.
Так, Farrag и соавт. обнаружили, что повышение уровня инсулина в плазме при поддержании глюкозы на одинаковом базальном уровне путем введения глюкозы извне (подход, имеющий классическое название «эугликемический зажим») не способно полностью подавить выработку эндогенной глюкозы у новорожденных в отличие от взрослых и детей старшего возраста.
Гликогенолиз и глюконеогенез представляют собой два основных пути продукции глюкозы. Глюконеогенез можно исследовать, применяя методы разведения изотопа: при сокращении дозы экзогенной глюкозы в два раза от необходимой у детей с ОНМТ, получающих полное парентеральное питание, инфузия [2- 13 С]глицерола показала, что он является основным предшественником глюконеогенеза, отвечая за 64% продукции эндогенной глюкозы.
Доля остальных субстратов для глюконеогенеза, преимущественно таких аминокислот, как аланин и глютамин, была определена по включению 2 Н2 в глюкозу в процессе инфузии 2 Н2О.
В совокупности эти исследования показывают, что в условиях дефицита глюкозы, но достаточного количества жира и аминокислот организм детей с ОНМТ в состоянии поддерживать уровень глюкозы благодаря глюконеогенезу, в котором роль основного субстрата принадлежит глицеролу.
2. Оценка синтеза лактозы. Лактоза — основной углевод молока. Ее молекула состоит из одной молекулы глюкозы и одной молекулы галактозы. До недавнего времени путь образования лактозы грудного молока не был до конца понятен.
Комбинируя ведение [U- 13 С6]глюкозы и [2- 13 С]глицерола лактирующим матерям и мониторируя накопление 13 С в составе лактозы грудного молока, Sunehag и соавт. обнаружили, что после еды у ребенка практически вся глюкоза, находящаяся в составе лактозы молока, является производным глюкозы плазмы, в то время как только 68% галактозы образуется из глюкозы, а глицерол включается в новый синтез галактозы в молочной железе.
Некоторые стабильные изотопы, применяемые в исследованиях с использованием меченого атома у новорожденных детей in vivo
3. Оценка кинетики жира как источника энергии. Впервые выполненные более 20 лет назад исследования введения [1- 13 С]пальмитата или [2- 13 С]глицерола и [ 2 Н3]b-гидроксибутирата показали, что у новорожденных детей содержание глицерола, жирных кислот и кетоновых тел через 4 час с момента введения или натощак сравнимо с таковым у взрослых после 16—24 час голодания.
Было выявлено, что 75% транспортируемого глицерола конвертируется в глюкозу, что составляет 5% продукции глюкозы печенью. Более поздние исследования продемонстрировали появление 2Н в арахидоновой кислоте (20:4 n—6) и докозагексаеновой кислоте (22:6 n—3) после назначения 2Н-меченных линолевой (18:2 n-6) и линоленовой (18:3 n—3) кислот соответственно.
Это позволило сделать вывод о том, что организм младенцев обладает способностью конвертировать получаемые с пищей эссенциальные жирные кислоты в их длинноцепочечные полиненасыщенные кислые дериваты. Но даже в этом случае скорость их синтеза может быть недостаточна для удовлетворения потребностей ребенка. Было выявлено, что у получающих энтеральное питание недоношенных детей назначение среднецепочечных триглицеридов снижает окисление 13 С-меченной линолевой кислоты и длинноцепочечных полиненасыщенных жирных кислот без ухудшения эндогенного синтеза омега-6 ДЦПНЖК.
4. Оценка синтеза липидов. Исследования с использованием инфузии [13С]ацетата в течение 12 час показали, что скорость эндогенного синтеза холестерола была примерно в 3 раза выше у недоношенных младенцев по сравнению со взрослыми, что свидетельствует о хорошо развитом механизме синтеза холестерола у недоношенных детей.
Для вычисления скорости синтеза сложных молекул необходимо определить накопление изотопа в истинном предшественнике, что сложно сделать, т.к. он может быть локализован в труднодоступных тканях, например в печени. Молекулы ДЦЖК можно представить в виде продукта полимеризации множества молекул-предшественников, содержащих двухуглеродные единицы ацетил-СоА, например 8-ацетил-СоА в пальмитиновой кислоте.
Анализ распределения изотопомера представляет собой инновационный подход, при котором сначала определяют характер распределения однократно или множественно меченных молекул с помощью масс-спектрометрии в большой «полимерной» молекуле, а затем с помощью метода статистического моделирования меченые молекулы подвергают «обратной калькуляции» с вычислением накопления изотопа в маленькой молекуле субъединицы предшественника.
Как было выявлено с помощью анализа распределения изотопомера, скорости липогенеза липопротеин-пальмитата у новорожденных схожи с таковыми у взрослых, получающих нормальное питание.
В течение последнего десятилетия скорость синтеза фосфолипидов сурфактанта была определена с помощью включения 13 С в ряд аспиратов из трахеи после суточного введения следовых количеств как [ 13 С]ацетата, [ 13 С]глюкозы, так и [ 13 С4]пальмитата или [ 2 Н] пальмитата, в то время как скорость синтеза сурфактант-ассоциированного протеина В может быть определена путем введения [ 13 С]валина.
источник
Редактировать статью СВОБОДНО-РАДИКАЛЬНОЕ ОКИСЛЕНИЕ БЕЛКОВ И ЕГО СВЯЗЬ С ФУНКЦИОНАЛЬНЫМ СОСТОЯНИЕМ ОРГАНИЗМА
Кислород — буквально «тот, что порождает кислоту». Русское слово восходит к М. В. Ломоносову и является калькой французского слова oxygène, предложенного А. Лавуазье (от др.-греч. ὀξύς — «кислый» и γεννάω — «рождаю»).Атомный номер кислорода — 8; атомная масса — 15,9994. Плотность жидкого кислорода — 1,144; температура плавления составляет −218 ° C, температура кипения составляет −183 ° C. Элемент кислород занимает третье место после водорода и гелия по распространенности в Вселенной. Он — самый распространенный химический элемент на Земле — 47 % массы земной коры, 85,7 % массы гидросферы, 23,15 % массы атмосферы, 79 % и 65 % массы растений и животных соответственно. За объемом кислород занимает 92 % объема земной коры.
Функции кислорода в живых организмах • Участие в биосинтезе de novo биологически активных соединений;
Участие в обезвреживании биологически активных или токсичных метаболитов;
В реакциях, катализируемых ферментами-оксигеназами (обмен Фен и Тир);
80-90% фонда кислорода, поступающего в клетки, расходуется в основном на окисление субстратов в тканевом дыхании;
2%фонда кислорода идёт на образование АФК.
Участие в биосинтезе de novo биологически активных соединений.
Свободнорадикальное окисление белков
Атака и разрыв пептидной связи
Последовательность реакции начинается с извлечения гидроксил-радикалом водородного атома от α-атома углерода любого из аминокислотных остатков, что приводит к образованию алкильного радикала и воды (а). В результате последующего присоединения молекулы кислорода к алкильному радикалу образуется алкилпероксильный радикал (б), реагирующий далее с протонированным супероксид-анионом (НО . 2), либо с Fe 2+ и H + (в). Образованный алкилпероксид опять же может прореагировать любо (НО . 2), либо с Fe 2+ и H + , превращаясь в алкоксирадикал. На этой стадии возможен либо разрыв пептидной связи, либо еще одно окисление за счет протонированного супероксида или Fe 2+ и Н + до гидроксилпроизводного пептида (г). Алкил-, пероксил- и алкоксильные радикалы пептидов также могут абстрагировать атомы водорода из аминокислотных остатков, генерирую таким образом новые радикалы, способные вступать в аналогичные радикалы. При отсутствии О2 или его недостатке два алькильных производных пептидов могут провзаимодействовать между собой с образование внутри- и/или межпептидных сшивок.
Есть 4 механизма разрыва пептидной связи, вызванного активными формами кислорода:
1) Расщепление алкоксильных производных пептидов через α-амидный путь
Из N-конца осходного пептида образуется диамидное азотноцианидное производное
2) Расщепление алкоксильных производных пептидов через диамидный путь
Из бывшего N-конца образуется диамид и α-кетоацильное производное
3) Окисление боковых частей глутамильных и аспартильных остатков
Пример: Окисление глутамата
Расщепление начинается с извлечения гидроксильным радикалом атома водорода от γ-атома углерода глутаминового остатка. Далее следует серия превращений, аналогичных приведенным, и образуется щавелевая кислота и расщепляется пептидная связь. Фрагмент, образованный из N-концевой части исходного полипептида, представлен амидом, а из С-концевой – пирувиальной частью.
4) Окисление остатка пролина
Если в составе полипептида есть остатки моноаминодикарбоновых кислот, то по ним также возможно опосредованое окислением специфическое расщепление пептидной связи.
Г.Шусслер и К.Шиллинг установили, что количество образующихся пептидов сопоставимо с числом остатков пролина. А окисление пролиновых остатков приводит к образованию 2-пироллидиновых производных и расщеплению пептидной связи. В результате кислотного гидролиза 2-пирролидон превращается в 4-аминобутиловую кислоту, ее наличие расценивают как доказательство расщепления пептидов по 2 пирролидоновому пути.
Огромную роль в протекании свободнорадикального окисления белков имеют ионы железа. Они выступают донорами электронов, таким образом, иницируют данный процесс. В ряде патологических случаев ионы железа могут высвобождаться из клеточных депо, что приводит к интенсификации свободнорадикальных процессов с вытекающими отсюда последствиями.
Окисление боковых частей аминокислотных остатков
Практически все аминокислотные остатки могут подвергаться окислению гидроксильными радикалами, но только в ряде случаев установлена природа образуемых веществ. В таблице представлены данные по окислительной модификации аминокислотных остатков в составе белков, данные делятся на группы:
Фенилаланин может превращаться в моно- и дигидроксипроизводные, а тирозин в 3,4-дигидроксипроизводное. Данные вещества могут также подвергаться обратному окислению/восстановлению и генерировать АФК. Образующиеся при окислении тирозина радикалы могут также взаимодействовать между собой с образованием дитирозинов, что приводит к образованию внутри- и межмолекулярным сшивкам пептидов. Наличие 2,2’-бифенильных производных считается маркером индуцированных АФК повреждений белков.
Облучение триптофана γ-радиацией приводит к образованию разных гидроксилпроизводных, формилкинуренинов и 3-гидроксинуренинов. При УФ-облучении, в присутствии пероксинитрита, озона, Fe 2+ и H2O2, триптофан превращается в кинуренин и N-формилкинуренин. Триптофан и тирозин не являются основными целями для окисления.
Остатки гистидина, аргинина и лизина особенно чувствительны к АФК.
Аминокислоты, образующие карбоксильные группы при окислении
Окисление лизина, аргинина, гистидина и пролина ведет к образованию альдегидных или кетонных производных, а глутаминовой и аспарагиновой кислот к разрыву полипептидной цепи с образованием пирувиальной группы из N-концевой аминокислоты.
Окислительный разрыв полипептидной цепи по пути α-амидирования приводит к образованию 2-кетоацильного производного из N-концевой аминокислоты. Вдобавок, карбонильные группы могут быть введены в белки в результате из взаимодействия с углеводами-восстановителями, продуктами окисления углеводов (реакции гликооксидации и гликозилирования) или продуктами окисления липидов (малоновый диальдегид, 4-гидрокси-2-ноненаль). Образование дополнительных карбонильных групп позволяет определить продукты окисление белков с динитрофенилгидрозином. Гидразон считаются показателями свободнорадикальной модификации белков.
3)Содержащие серу аминокислоты (цистеин, метионин)
В ходе окисления цистеинового остатка, последовательно образуются производные сульфеновой, сульфиновой и сульфоновой кислот. Сульфеновые производные могут дальше либо окисляться до сульфиновых, либо образовывать смешанные эфиры с цистеином или глутамином. Сульфеновые производный могут восстанавливаться до цестеина ферментативным или не ферментативным путем. Полагают, что образование смешанных эфиров (сульфеновой к-ты с глутотионом) может препятствовать дальнейшему окислению серы.
Реакции с цистеином. Образованное дисульфидное производное (1) в результате реакции глутатион-дисульфидного обмена (2,3) превращается в исходные формы цистеинсодержащих пептидов. Конечным продуктами превращений (1-3) являются вода и окисленный глутатион, потом идет возобновление запасов восстановленного глутатиона. Дальше (4) реакция катализируется глутатионредуктазой и (5) восстанавливается NADPH
Реакции с метионином. При его окислении образуется MetSox (метионинсульфоксид) (6). Под действием фермента метионинсульфоксидредуктазы он восстанавливается до Met (7). Восстановительные компоненты поставляются тиоредоксином (T(SH)2), NADPH используется для его регенерации. Реакция восстановления T(SH)2 катализируется тиоредоксинредуктазой (8).
Индуцированное окисление с образованием поперечных сшивок
1) Взаимодействие 2-х алкильных радикалов –производных белков, которые образуются при окислении пептидной связи или боковых частей аминокислотных остатков (9).
2) Взаимодействие 2-х тирозильных радикалов (10).
3) Взаимодествие малонового и других диальдегидов с аминогруппами остатков лизина в молекулах двух разных белков (11).
4) Реакция присоединения Михаэля (продукт взаимодейтвия ГНЕ с к/л белком) с аминогруппой остатка лизина другого белка (12).
5) Взаимодействие карбонильной группы продуктов гликирования одного белка с аминогруппой остатка лизина другого белка (13).
6) Окисление активными формами остатков цистеина 2-х молекул белка (14).
Сшитые белки не деградируются мультикаталическими протеазами или протеросомами, что может приводить к аккумуляции окисленных белков при старении и ряде патологий. Данные комплексы могут ингибировать других окисленных белков.
Частичное окисление белков, приводящее к изменению их поверхностного заряда или гидрофобности, может быть одним из механизмов, ответственным за их пространственное распределение в клетке.
Окисление белков как показатель состояние организма
Содержание окисленных белков широко используется для оценки интенсивности стресса in vivo. В качестве наиболее применяемого метода используется определение содержания в белках одного из стабильных продуктов – дополнительно образованных карбонильных групп. В следующих состояниях организма надежно установлена активация свободнорадикальных процессов.
В ходе старения организма происходит аккумуляция окисленных белков и поскольку дополнительные карбоксильные группы образуются при окислении любой из форм АФК, то именно они используются в качестве маркеров.
Профессор Р. Сохаль изучал зависимость между накоплением карбонильных групп и продолжительностью жизни организмов. Он выявил закономерность, что при умеренной гипероксии, увеличивающей концентрацию белковых карбонилов, снижается продолжительность жизни. И поскольку увеличение образования АФК в МТХ стареющих организмов тесно связано с аккумуляцией белковых карбонилов, то именно окисление белков ответственно за процесс старения.
Так введение песчанкам и комнатным мухам спиновой ловушки с антиоксидантными свойствами (БФН) снижало уровень белковых карбонилов, что приводило к увеличению продолжительности жизни. А изменение когнитивных и моторных функций у мышей связанно с накоплением белковых карбонилов в зависимости от возраста. Увеличение белковых карбонилов приводило к снижению обучаемости, а увеличение окисления белков в мозжечке к потере двигательной концентрации.
Если данная теория старения корректна, а к этому склоняется большинство ученых, то замедлить старение можно снизив интенсивность генерации АФК или увеличить скорость его деградации. Это осуществимо использованием антиоксидантов или снижением калорийности пищи без нарушения сбалансированного питания.
На графике видна зависимость карбонильных групп в разных тканях разных организмов от возраста особи. С его увеличением содержание карбонильных групп в организме увеличивается. Этот график служит доказательством этой теории.
Ишемия-реперфузии
При ишемии уровень кислорода в тканях ниже нормального. При этом снижается интенсивность генерации АФК, карбонильных групп, повышается восстановительность внутриклеточной среды.
При 10-минутной ишемии песчанки, вызванной перекрытием двух каротидных артерий, уровень белковых карбонилов довольно быстро возрастал в ходе реперфузии. При этом была установлена связь между содержанием белковых карбонилов и активностью глатаминсинтетазы (ГС) – чем больше белковых карбонилов, тем меньше активность ГС. А снижение активности данного фермента приводит увеличению содержания глутамата, что может быть критическим фактором, приводящим к нейротоксичности и разрушению мозга при ишемии-реперфузии.
Нейродегенеративные болезни (Альцгеймера, Паркинсона, склероз).
Растмотрим на примере болезни Паркинсона. Данное нарушение характеризуется повышение содержания железа в substancia nigra pars compacta. Первопричиной же считается окислительный стресс, сопровождаемый интенсификацией пероксидного окисления липидов. Развитие же происходит под воздействием β-амилоида. Амилоидные пептиды объединяются в структуры, которые начинают проявлять нейротоксичность, нарушать гомеостаз ионов кальция и аккумулировать ионы железа. Данная цепочка усугубляет состояние организма и приводит к еще большему развитию заболевания.
У пациентов, страдающих болезнью Альцгеймера, содержание белковых карбонилов не отличается от контрольного, но активность ГС ниже нормы. А как сказано ранее, снижение активности данного фермента приводит увеличению содержания глутамата, что может быть критическим фактором, приводящим к нейротоксичности и разрушению мозга.
Причиной в основном является недостаток образования инсулина β-клетками поджелудочной железы, которому в основном предшествуют развитие в клетках в них окислительного стресса. Важным моментом является аутоокислительное гликозилирование.
Атеросклероз
Установлено, что с развитием атеросклероза тесно связано окисление макромолекул. Большая часть аккумулированных липидов образуется из липопротеидов низкой плотности. Модификация их белковой апоформы альдегидами и окисление липидов считается ключевым моментом в образование бляшек при атеросклерозе. В белках бляшек повышенное содержание 3-нитротирозина.
Свободнорадикальное окисление белков:
Окисление белков вовлечено в регуляцию их обмена
Способность восстанавливать окисленные остатки серосодержащих АМК используется в регуляции клеточных процессов
Окисление белков регулирует пространственно-временное распределение белков в клетке
Окисление белков как показатель состояния организма:
Состояние организма тесно связано с процессом окисления белков
При старении увеличивается содержание карбонильных групп в белках разных тканей
При ишемии уровень белковых карбонилов значительно ниже, чем при реперфузии, что может приводить к разрушению мозга.
При нейродегенеративных заболеваниях наблюдается снижение активности глутаминсинтетазы
Значительную роль в развитии осложнений диабета отводят аутоокислению углеводов, которые могут быть связаны с белками
При атеросклерозе в белках бляшек наблюдается повышенное содержание 3-нитротирозина
Ряд других патологий также связан с увеличенным содержанием окисленных белков, но в большинстве случаев специфические белки не выявлены
Ферментативные пути антиоксидантной защиты организма
Одной из систем антиоксидантной защиты организма является ферментативная. К ферментам, защищающим клетки от действия активных форм кислорода, относят супероксиддисмутазу, каталазу и глутатионпероксидазу. Наиболее активны эти ферменты в печени, надпочечниках и почках, где содержание митохондрий, цитохрома Р450 и пероксисом особенно велико.
Супероксиддисмутаза (СОД) — основной фермент антирадикальной защиты клетки, широко распространённый в тканях. Его основная функция заключается в обезвреживании супероксидного аниона с образованием пероксида водорода и молекулярного кислорода.
Супероксиддисмутаза обладает совершенно феноменальной активностью— она почти в сто раз активнее каталазы, а одна молекула этого фермента за одну секунду способна разложить около миллиона молекул пероксида водорода. Таким способом организмы, потребляющие кислород, защищаются от его разрушительного действия.
Изучение этого фермента началось еще в 1938 г., когда из крови вола был выделен белок сине-зеленого цвета, содержащий медь. Позже выяснилось, что он содержит также цинк и обладает ферментативной активностью по отношению к реакции окисления супероксид-радикала.
Супероксиддисмутаза — один из наиболее распространенных популяционно-генетических маркеров; мутации в гене супероксиддисмутазы обусловливают некоторые наследственные заболевания человека (напр., атеросклероз, боковой амиотрофический синдром), что используется для диагностических целей. Препараты супероксиддисмутазы применяют в качестве противовоспалительного средства, напр. при артритах.
Каталаза (H2O2:H2O2-оксидоредуктаза) — фермент, катализирующий реакцию разложения пероксида водорода на воду и молекулярный кислород. .Каталаза, один из главных ферментов, связанных с метаболизмом пероксида водорода. Каталаза-тетрамерный фермент, прочно связанный с четырьмя молекулами НАДФН. НАДФН не является необходимым компонентом для ферментативного превращения перекиси водорода до кислорода и воды, но предохраняет этот энзим против инактивирорвания под действием перекиси водорода.
Показано, что энзим может неспецифически стимулировать распад гидроперекисей липидов собственным негемовым железом, а не только препятствовать образованию гидроксильных радикалов путем метаболического удаления перекиси водорода. Количественное соотношение каталазы, перекисей и доноров водородав клетке обуславливает возможность для реализцации либо каталезной функции, либо пероксидазной. Этот же принцип определяет различие между тканями: в эритроцитах преобладает пероксидная функция, а в печени-каталазная. Разница концентрации каталазы в различных тканях при физиологических и патологических состояниях определяют неоднозначность стационарной концентрации перекиси водорода при одной и той же скорости ее генерации. Например, в печени и почках концентрациия перекиси водорода низкая при высоком содержании каталазы, в сердце и мозге содержания перекиси водорода значительно выше из-за низкого содержания каталазы.
Каталитический распад перекиси водорода впервые наблюдал Тенар (1818). Позднее Шенбейн (1863) объяснил процесс разложения перекиси водорода живыми тканями действием фермента, который и был выделен в 1901 г. Левом, назвавшим его каталазой.
Биологическая роль состоит в разрушении перекиси водорода, образующейся в клетках в результате действия ряда флавопротеиновых оксидаз (ксантиноксидазы, глюкозооксидазы, моноаминоксидазы ). Присутствие каталазы обеспечивает эффективную защиту клеточных структур от деградации под действием перекиси водорода. Генетически обусловленная недостаточность каталазы является одной из причин наследственного заболевания у человека.
Каталаза широко распространена в тканях животных и растений и в микроорганизмах, но полностью отсутствует у некоторых анаэробных микроорганизмов.
У ферментов антиоксидантной защиты супероксиддисмутазы и каталазы присутствует синергизм.
Другим ферментом, контролирующим уровень пероксида водорода в клетке является глутатионпероксидаза, локализованная в цитозоле и матриксе митохондрий. Глутатионпероксидаза катализирует реакции разложения перекисей более широкого спектра, чем каталаза. Помимо пероксида водорода она способна восстанавливать гидроперекиси жирных кислот, а так же перекиси белкогового или нуклеинового происхождения.
Глутатионпероксидза способствует разложению пероксида водорода и других гидроперекисей в реакции окисления-восстановления глутатиона.
Фермент специфичен для восстановленного глутатиона(GSH). Активность глутатионпероксидазы зависит от концентрации доноров водорода в клетке. Достаточной уровень GSH поддерживается в клетке синтезом de novo и восстановленим окисленного глутатиона в сопряженной системен НАДФН-глутатионпероксидазы. Восстановлением окисленного глутатиона в сопряженной системе НАДФН-глутатионредуктазы. Восстановленный НАДФН, который необходим для работы глутаонредуктазы, происходит главным образом из пентозофосфатного шунта.
Глутатионпероксидаза – важнейший фермент, обеспечивающий инактивацию пероксида водорода и пероксидных радикалов. Он катализирует восстановление пероксидов при участии трипептида глутатиона. SH-группа глутатиона служит донором электронов и, окисляясь образует дисульфидную форму глутатиона:
Н2О2 + 2НS-глутатион → 2Н2О + глутатион-S-S-глутатион
Окисленный глутатион восстанавливается глутатионредуктазой:
глутатион-S-S-глутатион + НАДФН+Н + → 2 HS-глутатион + НАДФ +
Глутатионпероксидаза имеет две активные формы: селензависимую и селеннезависимую. Их распределение неодинаково в различных тканях. Селензависимая глутатионпероксидаза утилизирует в качестве субстратов перекись водорода и органические гидроперекиси, в то время как для селееннезависимой более специфичны органические гидроперекиси, и в присутствии H2O2 ее активность падает.
Работами Ошино и Чанса (1997) установлено, что оба фермента ответственны за процесс, контролирующий поддержание стационарной концентрации перекиси водорода на различных субклеточных уровнях и в разных типах клеток. Каталаза особенно эффективна при наличии больших количеств H2O2, генерируемой в пероксисомах. Глутатионпероксидаза способна не только утилизировать гидроперекиси мембран, но и метаболизировать Н2О2 в цитолозе и митохондриях. В метаболизме Н2О2 ни один энзиматический путь не исключает другой. В обычных физиологических условиях эндогенная перекись водорода образуется в пероксисомах, где 90% ее разлагается каталазой. Однако, небольшая ее часть может диффундировать в цитозоль и метаболизироваться в системе глатутионпероксидазы. Преимущественная компартментализация каталазы в пероксисомах, глутатионпероксидазы в цитозоле и в митохондриях облегчает их эффективное сотрудничество в метаболизме Н2О2 и обеспечивает поддержание ее концентрации в клетке на уровне 10 -9 — 10 -7 М.
Таким образом супероксиддисмутаза и каталаза образуют антиоксидантную защиту, которая борется со свободными радикалами кислорода, не давая им возможности запустить цепные процессы окисления. Глутатионпероксидаза обезвреживает липидные перекиси, обрывая тем самым цепное переокисление липидов.
Примеры защиты белков от окисления
Как правило, такие примеры демонстрируются на моделях микроорганизмов. При изучении роли митохондриальной NAD⃰-киназы S.cerevisiaeбыло показано, что инактивация гена POS5, кодирующего упомянутый фермент, приводила к увеличению в 28 раз количество карбонильных групп белков в митохондриях и многократно меньшей по сравнению с исходным штаммом активности чувствительных к окислению ферментов: аконитазы и сукцинатдегидрогеназы. В нашей лаборатории изучались некоторые показатели окислительного стресса у этого же вида дрожжей, причем использовались разные штаммы: исходный и его изогенные производные, дефектные по одной из 2х, а также по обеим присутствующим в дрожжах каталазам. Оказалось, что чем выше активность каталазы, тем ниже уровень карбонильных групп в белках.
Между активностями каталазы и ферментов, чувствительных к окислению: глюкозо-6-фосфатдегидрогеназы и глутатионредуктазы, была обнаружена сильная положительная корреляция, т.е выходит, что чем выше активность каталазы, тем ниже уровень белковых карбонилов, но в тоже время выше активность чувствительных к окислению ферментов. При многократом подтверждении описанных выше результатов можно с определенной уверенностью говорить, что каталаза в условиях in vivo может защищать клеточные белки от свободнорадикального окисления.
На пекарских дрожжах также исследовали возможную защитную роль супероксиддисмутаз. Было использовано несколько разных методических подходов, но во всех случаях анализировали взаимосвязь между активностью супероксиддисмутазы и содержание карбонильных групп в белках. Изучаемая зависимость оказалась достаточно близкой к параболической. Выглядит так, будто бы в зависимости от активности супероксиддисмутаза может выступать как про-, так и антиоксидантом. В следующей работе условия несколько отличались от использованных в предыдущей работе, а результаты оказались на первый взгляд вообще противоположными. Зависимость содержания карбонильных групп в белках от активности супероксиддисмутазы имела куполообразную форму. Здесь также была выявлена хорошая положительная корреляция между активностями каталазы и супероксиддисмутазы. Похожие результаты были снова недавно получены нами при изучении влияния перекиси водорода на активность супероксиддисмутаз и каталаз у дрожжей. Поэтому мы пришли к выводу о том, что в усл. In vivo в нескольких различных экспериментальных моделях каталазы и супероксиддисмутазы могут защищать белки от свободно-радикального окисления, хотя, видимо, связь между ними не всегда линейная. В последние несколько лет было показано, что свободно-радикальное окисление определенных клеточных белков может индуцировать апоптоз. Очень интересную серию работ по свободно-радикальному окислению белков в связи с состоянием организма или отдельных клеток провели Т. Нистром с коллегами. Так, при исследовании почкующихся дрожжей Saccharomycescerevisiaeониустановили, что вне зависимости от «возраста»материнской клетки, от содержания в ней карбонильных групп белков в новой отпочковывающейся клетке концентрация окисленных белков всегда достаточно низка. При исследовании эмбриональных стволовых клеток ES теми же исследователями неожиданно было выявлено высокое содержание в них белковых карбонилов и конечных продуктов гликолизирования белков. Основными белками, подвергнутыми окислительной модификации, оказались шапероны и белки цитоскелета. Дифференциация клеток вызвала резкое снижение концентрации белковых карбонилов. Авторы считают, что описали часть ранее неизвестного процесса реювинализации на уровне белков, которая происходит на ранних стадиях эмбрионального развития. В прекрасном обзоре по роли свободно-радикального окисления белков в клетках разных организмов, пришел к выводу, что существует несколько вариантов развития в процессе раннего развития, созревания, произведения потомства и старения, но для получения целостной картины пока не хватает информации.
Выражаем благодарность за помощь в консультации работы
руководителю кафедры химии и фармацевтической химии
кандидату биологических наук, доценту М.М. Павловой
источник
Процессы происходящие в белках
Денатурация белков. Это сложный процесс, при котором под влиянием внешних факторов (температуры, механического воздействия, действия кислот, щелочей, ультразвука и др.) происходит изменение вторичной, третичной и четвертичной структур белковой макромолекулы. Первичная структура, а следовательно, и химический состав белка не меняются.
Денатурация сопровождается изменениями важнейших свойств белка:
потерей индивидуальных свойств (например, изменение окраски мяса при его нагревании вследствие денатурации миоглобина);
потерей биологической активности (например, в картофеле, грибах, яблоках и ряде других растительных продуктов содержатся ферменты, вызывающие их потемнение, при денатурации белки-ферменты теряют активность);
повышением атакуемости пищеварительными ферментами (как правило, подвергнутые тепловой обработке продукты, содержащие белки, перевариваются полнее и легче);
потерей способности к гидратации (растворению, набуханию);
потерей устойчивости белковых глобул, которая сопровождается их агрегированием (свертыванием, или коагуляцией, белка).
Процессы происходящие в углеводах
Набухание и клейстеризация крахмала. Набухание — одно из важнейших свойств крахмала, которое влияет на консистенцию, форму, объем и выход готовых изделий.
При нагревании крахмала с водой (крахмальной суспензии) до температуры 50-55°С крахмальные зерна медленно поглощают воду (до 50% своей массы) и ограниченно набухают. При этом повышения вязкости суспензии не наблюдается. Набухание это обратимо: после охлаждения и сушки крахмал практически не изменяется. При нагревании от 55 до 80°С крахмальные зерна поглощают большое количество воды, увеличиваются в объеме в несколько раз, теряют кристаллическое строение, а следовательно, анизотропность.
Процессы происходящие в жирах
Изменение жиров при жарке продуктов основным способом.
При жарке продуктов основным способом (с небольшим количеством жира) часть жира теряется. Эти потери называются угаром. Угар складывается из жира, который теряется в результате разбрызгивания, и потерь вследствие дымообразо-вания. Разбрызгивание вызывает интенсивное кипение влаги, содержащейся в жире и выделяющейся из продуктов. Большой угар дают жиры, содержащие влагу,- маргарин и сливочное масло. Интенсивно выделяют влагу при обжаривании полуфабрикаты, богатые белками (мясо, птица, рыба). На степень разбрызгивания жира влияет связь влаги в продукте. Так, при обжаривании сырого картофеля угар жира значительно больше, чем при обжаривании предварительно сваренных клубней.
Дымообразование связано с глубоким разложением жира при нагревании его до высокой температуры (170-200°С). Температура дымообразования зависит от вида жира, скорости нагревания его, величины греющей поверхности и ряда других факторов. Для жарки лучше использовать жиры с высокой температурой дымообразования — пищевой саломас (230° С), свиное сало (220°С) и др. Менее подходят для этой цели растительные масла с низкой температурой дымообразования (170- 180″С).
Одновременно с угаром жира происходит частичное поглощение его обжариваемыми продуктами.
Количество поглощенного, жира зависит также от влажности его и продукта, характера выделяемой из него влаги. Так, продукты, содержащие много белка (мясо, птица, рыба), поглощают мало жира, так как этому препятствует влага, выделяющаяся при денатурации белков. В предварительно сваренном картофеле влага связана крахмалом и жира впитывается больше, чем при обжаривании сырого картофеля. Чем мельче нарезка картофеля, тем больше он поглощает жира.
Основная масса впитываемого жира накапливается в корочке обрабатываемого продукта. При жарке мяса, рыбы и птицы поглощаемый ими жир эмульгируется в растворе глютина, образовавшегося при расщеплении коллагена. При этом продукт приобретает дополнительную сочность и нежность.
Влияние тепловой обработки на пищевую ценность жира.
При жарке пищевая ценность жира снижается вследствие уменьшения содержания в нем жирорастворимых витаминов, незаменимых жирных кислот, фосфатидов и других биологически активных веществ, а также за счет образования в нем неусвояемых компонентов и токсичных веществ.
Уменьшение содержания витаминов и фосфатидов происходит при любом способе жарки, тогда как содержание незаменимых жирных кислот снижается лишь при длительном нагревании. Вследствие уменьшения непредельности жира из-за разрыва двойных связей снижается его биологическая ценность.
Накапливающиеся в жире продукты окисления и полимеризации вызывают раздражение слизистой оболочки кишечника, оказывают послабляющее действие, ухудшают усвояемость не только жира, но и употребляемых вместе с ним продуктов.
Токсичность продуктов окисления и полимеризации проявляется при большом содержании их в рационе. При соблюдении режимов жарки вторичные продукты окисления появляются во фритюрных жирах в небольшом количестве.
источник
Энергетическая – преимущество углеводов состоит в способности глюкозы
окисляться как в аэробных, так и в анаэробных условиях;
Защитно-механическая – основное вещество трущихся поверхностей суста-вов, в сосудах, слизистых;
Опорная – целлюлоза в растениях, хондроитинсульфат в кости;
Структурная – в соединительной ткани, оболочке бактериальных клеток;
Гидроосмотическая и ионрегулирующая – мукополисахариды обладают вы-
сокой гидрофильностью, отрицательным зарядом и, таким образом, удер-
живают Н2О, Са2+, Mg2+, Na+, в межклеточном веществе и определяют тургор кожи, упругость тканей;
Кофакторная – гепарин является кофактором липопротеинлипазы плазмы крови и ферментов свертывания крови (инактивирует тромбокиназу).
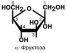
Моносахариды – это углеводы, которые не могут быть гидролизованы до более
простых форм. В свою очередь они подразделяются
в зависимости от числа содержащихся в их молекуле атомов углерода: триозы, тетрозы, пентозы, гексозы, гептозы, октозы:
в зависимости от присутствия альдегидной или кетонной группы: кетозы и альдо-
В природе существует огромное количество производных
как перечисленных выше моносахаров, так и других. Уроновые кислоты – дериваты гексоз, имеющие в 6 по-
ложении карбоксильные группы, например, глюкуроновая, га-лактуроновая, идуроновая, аскорбиновая кислоты.
Аминосахара – производные моносахаров, содержащие
аминогруппы, например, глюкозамин или галактозамин. Эти производные обязательно входят в состав дисахаридных
компонентов протеогликановых полисахаридов. Ряд антибио-
тиков (эритромицин. карбомицин) содержат в своем составе аминосахара.
Гликозиды – соединения, образующиеся путем конден-
сации моносахарида (свободного или в составе полисахари-да) с гидроксильной группой другого соединения, которым
может быть любой моносахарид или вещество не углеводной
природы (агликон), например, метанол, глицерол, стерол, фе-нол. Важное клиническое значение имеют входящие в состав
наперстянки сердечные гликозиды. В качестве агликона они
содержат стероиды. Известный антибиотик стрептомицин также является гликозидом.
Дисахариды – это углеводы, которые при гидролизе дают две одинаковые или
различные молекулы моносахарида.
Сахароза – пищевой сахар, в наибольшей мере содержится в сахарной свекле и
тростнике, моркови, ананасах, сорго.
Мальтоза – продукт гидролиза крахмала и гликогена, содержится в солоде, про-
Лактоза – молочный сахар, содержится в молоке. В некоторых ситуациях (на-
пример. беременность) может появляться в моче.
Целлобиоза – промежуточный продукт гидролиза целлюлозы. Здоровая микро-
флора кишечника способна гидролизовать до 3\4 поступающей сюда целлюлозы до
свободной глюкозы, которая либо потребляется самими микроорганизмами, либо всасывается в кровь.
Выделяют гомополисахариды. состоящие из одинаковых остатков моносахаров (крахмал. гликоген. целлюлоза) и гетерополисахариды (гиалуроновая кислота, хондроитинсульфаты) включающие разные моносахара.
Крахмал – гомополимер α-D-глюкозы. Находится в злаках, бобовых, картофеле и некоторых других овощах. Синтезировать крахмал способны почти все растения.
Двумя основными компонентами крахмала являются амилоза (15-20%.) и ами-лопектин (80-85%). Амилоза представляет собой неразветвленную цепь с ММ от 5 до 500 тысяч Д в которой остатки глюкозы соединены исключительно α-1-4-гликозид-ными связями. Амилопектин имеет массу не менее 1 млн Д и является весьма раз-ветвленной молекулой, содержащей α-1-4- и α-1-6-гликозидные связи, причем ветв-
ление происходит за счет присоединения небольших глюкозных цепочек к основной
цепи посредством α-1-6-гликозидных связей. Каждая ветвь имеет длину 24-30 остат-
ков глюкозы. веточки возникают примерно через 14-16 остатков глюкозы в цепочке.
Кроме строения, эти два полимера отличаются друг от друга по свойствам: во-первых. амилоза с йодом дает синее окрашивание, а амилопектин – красно-фиолетовое; во-вторых, амилоза более легко растворима в воде, например,
при варке картофеля в бульон переходит амилоза, именно она придает воде опалесцирующий оттенок, в самом же картофеле остается амилопектин.
Гликоген – резервный полисахарид животных тканей, в наибольшей мере со-
держится в печени и мышцах, Структурно он схож с амилопектином, но во-первых, длина веточек меньше – 11-18 остатков глюкозы, во-вторых, более разветвлен – че-
рез каждые 8-10 остатков. За счет этих особенностей гликоген более компактно уло-
жен, что немаловажно для животной клетки.
Целлюлоза является наиболее распространенным органическим соединением
биосферы. Около половины всего углерода Земли находится в ее составе. В отли-
чие от предыдущих полисахаридов она является внеклеточной молекулой, имеет волокнистую структуру и абсолютно нерастворима в воде. Единственной связью в
ней является β-1-4-гликозидная связь.
Интересно, что прочность целлюлозных волокон превышает таковую сталь-
ной проволоки того же диаметра, это позволяет волокнам формировать
весьма прочную структуру разнообразных растений, из продуктов питания достаточно вспомнить такие овощи как морковь, капуста, редька, а из рас-тений – любые деревья.
Инулин – полисахарид фруктозы. содержится в корнях георгинов, артишоков,
одуванчиков, Является легко растворимым соединением. В медицинской практике используется для определения очистительной способности почек – клиренса.
Декстраны – резервный полисахарид дрожжей и бактерий. Основным типом связи является α-1-6-гликозидная, а в мес-
тах ветвления – α-1-4-гликозидные связи, также встречаются α-1-2- и
α-1-3-гликозидные связи. В медицине декст-
раны используются как компонент крове-заменителей, например, в виде вязкого рас-
твора на 0,9% NaCl – реополиглюкина.
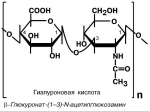
Гликозаминогликаны – полимерные молекулы, в которых в качестве мономеров
используются дисахаридные фрагменты, содержащие уроновые кислоты и аминопро-изводные сахаров. В качестве примера мож-но привести хондроитин-4-сульфат и хонд-роитин-6-сульфат, гиалуроновую кислоту,
кератансульфат, дерматансульфат, гепа-
рин. Эти молекулы входят в состав проте-
огликанов – сложных белков , функцией ко-торых являются заполнение межклеточно-
го пространства и удержание здесь воды,
также они выступают как смазочный и структурный компонент суставов и других
Выделяют два подкласса белков, содержащих углеводы: протеогликаны и глико-протеины. Между эти подклассами имеются существенные отличия:
Не содержат уроновых кислот
Углеводные цепи крайне велики
Более подробно см тема «Сложные белки».
Сиаловые кислоты являются ацетилпроизводными ней-
раминовой кислоты. Они , наряду с аминосахарами, входят в состав гликопротеинов.
Гликолипиды широко представлены в
нервной ткани и мозге. Размещаются они на
наружной поверхности плазматических мем-бран, при этом олигосахаридные цепи на-
правлены наружу. Большую часть гликолипи-
дов составляют гликосфинголипиды, вклю-чающие церамид (соединение аминоспирта
сфингозина с жирной кислотой) и один или
несколько остатков сахаров.
В нервной ткани главным гликолипидом является галактозилцерамид. В его состав входит длинноцепочечная жирная кислота.
Для других тканей более характерен глюкозилцерамид.
Еще одна группа гликолипидов, широко представленных в мозге, – ганглиозиды.
Они образуются из глюкозилцерамида и дополнительно содержат одну или несколь-
ко молекул сиаловой кислоты и моносахаров.
Здесь находится кальций-содержащий фермент α-амилаза. Оптимум ее рН
7,1-7,2, активируется ионами Cl – . Она беспорядочно расщепляет внутренние
α-1-4-гликозидные связи и не влияет на другие типы связей.
В ротовой полости углеводы расщепляются до декстринов и мальтозы. Дисаха-
Из-за низкой рН амилаза инактивируется, хотя некоторое время расщепление уг-
леводов продолжается внутри пищевого комка.
В полости тонкого кишечника работают совместно панкреатическая α-амилаза,
разрывающая α-1-4-связи, и олиго-1-6-глюкозидаза, действующая на точки ветвле-ния крахмала и гликогена.
Кроме полостного, имеется еще и пристеночное пищеварение, которое осуще-
сахаразо-изомальтазный комплекс – в тощей кишке гидролизует α-1,2-,
α-1,4-, α-1,6-гликозидные связи, расщепляет сахарозу, мальтозу мальтот-
гликоамилазный комплекс – находится в нижних отделах тонкого кишечни-
ка и расщепляет α-1,4-гликозидные связи в олигосахаридах
β-гликозидазный комплекс (лактаза) – гидролизует β-1,4-гликозидные свя-зи между галактозой и глюкозой (лактозу). У детей активность лактозы высо-
ка уже до рождения и сохраняется на высоком уровне до 5-7 лет, после чего
Нарушения переваривания дисахаридов
Существуют две наиболее встречающиеся формы нарушения переваривания
дисахаридов – дефект лактазы и сахаразы При наследственной патологии лактазы симптомы проявляются после первых
кормлений; патология сахаразы обнаруживается позднее, при введении в рацион сладкого.
Недостаточность лактазы может проявляться не только у младенцев.
Дело в том, что лактаза – это адаптивный фермент, его активность изме-
няется в зависимости от рациона. А человек является единственным млеко-питающим на Земле, которое потребляет молоко во взрослом состоянии. Примерно у 10-12% людей белой расы фермент перестает синтезироваться
уже в детском возрасте и возникает непереносимость молока. У народов Азии и Африки такая проблема есть у 80-95% населения.
Патогенез. Отсутствие гидролиза соответствующих дисахаридов приводит к ос-мотическому эффекту и задержке воды в просвете кишечника. Кроме этого, сахара активно потребляются микрофлорой и метаболизируют с образованием органичских кислот и газов. Из-за этого симптомами лактозной или сахаразной недостаточности являются диарея, рвота, метеоризм, вспучивание живота, его боли и спазмы.
Приобретенные формы недостаточности переваривания углеводов возникают в результате заболеваний стенок ЖКТ: энтериты, колиты, когда нарушается образо-
вание ферментов и их размещение на щеточной каемке энтероцитов. К тому же
ухудшается всасывание моносахаров.
Диагностика. Дифференциальная диагностика нарушений переваривания и вса-
сывания заключается в контроле уровня глюкозы крови после раздельного приема
обследуемым дисахаридов и эквивалентного количества моносахаридов. Незначи-тельный подъем концентрации глюкозы в первом случае указывает на нехватку
ферментов, во втором – на нарушение всасывания.
Лечение. Исключение из рациона молока или продуктов с добавлением сахара в зависимости от типа непереносимого углевода.
Роль целлюлозы в пищеварении
Целлюлоза ферментами человека не переваривается. Но в толстом кишечнике
под действием микрофлоры до 75% ее количества гидролизуется с образованием
целлобиозы и глюкозы. Глюкоза частично используется самой микрофлорой и окис-ляется до органических кислот (масляной, молочной), частично может всасываться в
кровь. Однако основная роль целлюлозы для человека состоит в другом:
стимулирует перистальтику кишечника,
абсорбирует холестерин и другие вещества, что препятствует их всасыва-нию.
ПЕРЕНОС ГЛЮКОЗЫ ЧЕРЕЗ МЕМБРАНЫ
Всасывание моносахаридов происходит по механизму вторичного активного транспорта. Это значит, что затрата энергии при переносе сахаров происходит, но тратится она не непосредственно на транспорт сахара, а на создание градиента
концентрации другого вещества. Используя этот градиент, сахар проникает внутрь
клетки. В случае глюкозы таким ве-ществом является натрий.
Особый фермент – К + ,Na + -АТФаза – постоянно, в обмен
на калий, выкачивает ионы натрия из клетки, именно этот транспорт тре-
бует затрат энергии. В просвете ки-
шечника содержание натрия относи-тельно высоко и он связывается со
специфическим белком, имеющим
два центра связывания: один для натрия, другой для сахара. Приме-чательно то, что сахар связывается с белком только после того, как с ним свяжется натрий. Белок-траснпортер свободно мигрирует в толще мембраны. При контакте бел-
ка с цитоплазмой натрий быстро отделяется от него и сразу отделяется сахар. Ре-
зультатом является накопление сахара в клетке, а ионы натрия вновь выкачиваются
Скорость переноса моносахаров
ТРАНСПОРТ ЧЕРЕЗ КЛЕТОЧНЫЕ МЕМБРАНЫ
Из крови в клетки глюкоза попадает при помощи облегченной диффузии – по
градиенту концентрации с участием белков -переносчиков (глюкозных транспортеров «ГлюТ»). Различают 5 видов транспортеров глюкозы ГлюТ 1, ГлюТ 2, ГлюТ 3, ГлюТ 4,
ГлюТ 5. Глюкозные транспортеры расположены на мембранах всех влеток.
Например, на поверхности β-клеток островков Лангерганса находится ГлюТ 2, благодаря ему генерируется сигнал для увеличения или снижения вы-
В мышцах и жировой ткани находится ГлюТ 4, только эти транспортеры явля-ются чувствительными к влиянию инсулина – при действии инсулина на клетку они
поднимаются к поверхности мембраны и переносят глюкозу внутрь. Данные ткани
получили название инсулинзависимых.
РЕАКЦИИ ВЗАИМОПРЕВРАЩЕНИЯ САХАРОВ
Поскольку в кишечнике всасываются все моносахарид, поступающие с пищей, то
перед организмом встает задача превратить их в глюкозу, так как в реакциях мета-болизма используется в основном глюкоза. Этот процесс получил название взаимо-
превращение сахаров. Цель его – создание только одного субстрата для реакций
мебаболизма, а именно α-D-глюкозы, что позволяет сэкономить ресурсы, не образо-вывать множество ферментов для каждого вида сахара.
Реакции перехода фруктозы в глюкозу достаточно просты. Сначала происходит активация фруктозы посредством фос-
форилирования 6-го атома углерода, затем изомеризация и,
наконец. отщепление уже ненужного фосфата.
Галактоза, как и фруктоза, сначала подвергается фосфо-рилированию, хотя и по 1-му атому углерода. Еще одним
отличием от обмена фруктозы является изомеризация в глю-
козу не напрямую, а через синтез УДФ-галактозы, собственно, которая и превращается в глюкозу.
Физиологический смысл этого усложения видимо состоит
в использовании УДФ-галактозы в молочной железе для син-теза лактозы. необходимой для образования молока.
Нарушения превращения галактозы
Нарушения обмена галактозы вызваны генетическим де-
фектом нескольких ферментов:
галактокиназы, частота дефекта 1:500000;
галактозо-1-фосфат-уридил-трансферазы, частота дефекта 1:40000;
эпимеразы, частота дефекта менее 1:1000000.
Заболевание, возникающее при этих нарушениях получи-
Диагностика. Концентрация га-
лактозы в крови возрастает до
0,3-0,5 ммоль/л), в крови также по-
является галактозо-1-фосфат. К ла-бораторным критериям относятся
также билирубинемия, галактозурия,
протеинурия, гипераминоацидурия, накопление гликозилированного ге-
моглобина. Дети отказываются от
Патогенез. Избыток галактозы
превращается в спирт галактитол (дульцитол), накапливающийся в
хрусталике и осмотически привле-
кающий сюда воду. Изменятся соле-вой состав и белки хрусталика, что
приводит к катаракте в молодом
возрасте. Катаракта возможна даже у плодов матерей с галактоземией,
употреблявших молоко во время бе-ременности.
При дефекте галактозо-1-фосфат-уридил-трансферазы АТФ постоянно расходуется на фосфо-
рилирование галактозы и дефицит энергии «токсически» действует на нейроны, гепа-
тоциты, нефроциты, угнетает активность многих ферментов. Как результат возмож-
ны задержка психо-моторного развития , умственная отсталость, некроз гепатоцитов и цирроз печени. В почках и кишечнике избыток галактозы и ее метаболитов ингиби-
рует транспорт аминокислот.
Лечение: исключение из рациона молока и других источников галактозы позво-ляет предотвратить развитие патологических симптомов. Однако сохранность ин-
теллекта может быть достигнута только при ранней, не позднее первых 2 месяцев
жизни, диагностике и вовремя начатом лечении.
Попав в клетку, глюкоза сразу же фосфорилируется. Фосфорилирование глюко-
зы решает сразу несколько задач:
фосфатный эфир глюкозы не в состоянии выйти из клетки, так как молекула
отрицательно заряжена и отталкивается от фосфолипидной поверхности
наличие заряженной группы обеспечивает правильную ориентацию молеку-
лы в активном центре фермента;
уменьшается концентрация свободной (нефосфорилированной) глюкозы, что способствует диффузии новых молекул из крови.
Наибольшие запасы гликогена имеются в печени и скелетных мышцах , но во-обще гликоген способен синтезироваться во всех тканях. Резервы гликогена в клет-
ках используются в зависимости от функциональных особенностей клеток. Гликоген печени расщепляется при снижении концентрации глюкозы в крови,
прежде всего между приемами пищи. Через 12-18 часов голодания запасы гликогена в печени полностью истощаются. В мышцах количество гликогена снижается обычно только после физической нагрузки – длительной и напряженной. Повышение содер-
жания гликогена в мышцах отмечается в период восстановления при приеме богатой
углеводами пищи. В печени гликоген накапливается после еды.
Такие отличия печени и мышц обусловлены наличием различных изоферментов гексокиназы, фермента, который
фосфорилирует глюкозу в глюкозо-
Для печени характерен изо-
фермент, получивший собственное
название – глюкокиназа. Отличия-ми этого фермента от гексокиназ
в низком сродстве к глюко-зе, что ведет к захвату глюкозы печенью только при ее высокой концентра-
продукт реакции – глюкозо-6-фосфат – не ингибирует фермент, в то время как в других тканях гексокиназа чувствительна к такому влиянию.
Благодаря этим отличиям гепатоцит может эффективно захватывать глюкозу по-
сле еды и метаболизировать ее в любом направлении.
Например, при переполнении запасов гликогена накапливающийся глюкозо-6-фосфат не подавляет глюкокиназу и усвоение глюкозы, а просто идет на
окисление до ацетил-S-КоА и в пентозофосфатный цикл, что в целом увели-
Регуляция глюкокиназы: активация – андрогены и инсулин, подавление – глю-кокортикоиды и эстрогены.
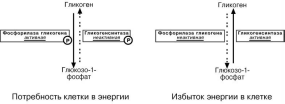
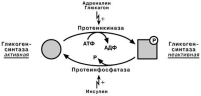
Мобилизация (распад) гликогена или гликогенолиз в норме активируется при недостатке свободной глюкозы в клетке, а значит и в крови (голодание, мышечная работа) . При этом уровень глюкозы крови поддерживают только печень и почки, ткани в которых имеется фермент глюкозо-6-фосфатаза, гидролизующий фосфат-ный эфир глюкозы. Образуемая свободная глюкоза выходит через плазматическую мембрану в кровь. Остальные органы используют гликоген только для собственных нужд.
В гликогенолизе непосредственно участвуют три фермента:
Фосфорилаза гликогена – расщепляет α-1-4-гликозидные связи с образова-
нием глюкозо-1-фосфата. Фермент работает до тех пор, пока до точки ветвления
α(1-6) не останется 4 остатка глюкозы.
α(1-4)–α(1-6)-глюкантрансфераза, фермент переносящий трисахаридный
фрагмент на другую цепь с образованием новой α-1-4-гликозидной связи. При этом
на прежнем месте остается один остаток глюкозы и «открытая» доступная α-1-6-гликозидная связь.
Амило-α-1-6-глюкозидаза, «деветвящий» фермент – гидролизует
α-1-6-гликозидную связь с высвобождением свободной глюкозы. В результате обра-зуется цепь без ветвлений, служащая субстратом для фосфорилазы.
Скорость гликогенолиза лимитируется только скоростью работы фосфорилазы гликогена. Ее активность может изменяться трямя способами.
Происходит фосфорилирование фермента при действии гормонов на клетку
через аденилатциклазный механизм. Он является так называемым каскадным регу-лированием:
Молекула гормона взаимодействуя со своим рецептором, активирует фермент
Аденилатциклаза превращает АТФ в циклический АМФ (цАМФ) – вторичный
цАМФ аллостерически активирует фермент протеинкиназу А;
Протеинкиназа А фосфорилирует различные внутриклеточные белки. Одним из этих белков является киназа фосфорилазы, которая при фосфорилировании ак-
Киназа фосфорилазы фосфорилирует фосфорилазу «b« гликогена, послед-
няя в результате превращается в активную фосфорилазу «а»;
Активная фосфорилаза « а» гликогена расщепляет α-1-4-гликозидные связи в гликогене с образованием глюкозо-1-фосфата.
Второй способ регуляции заключается в активации киназы фосфорилазы не
протеинкиназой, а ионами Ca 2+ и кальмодулином. Этот путь работает при инициа-ции кальций-фосфолипидного механизма. Такой способ оправдывает себя, напри-
мер, при мышечной нагрузке, когда гормональные влияния недостаточны, зато в ци-
топлазму под влиянием нервных импульсов поступают ионы Ca 2+ . Также некоторые
гормоны влияют на углеводный обмен посредством этого механизма.
Третий способ – аллостерическая активация благодаря присоединению АМФ к молекуле фосфорилазы «b«. Способ работает в любой клетке – при увеличении рас-
хода АТФ и накоплении продуктов его распада.
Синтез гликогена начинается с обра-
зования глюкозо -6 -фосфата под действи-ем глюкокиназы в печени или других гек-
сокиназ в остальных тканях. Как уже гово-
рилось, глюкокиназа обладает низким сродством к глюкозе и в гепатоцитах глю-
коза будет задерживаться только при вы-
соких концентрациях ее в клетке . Непосредственно же синтез гликогена
осуществляют следующие ферменты:
Фосфоглюкомутаза – превращает глюкозо-6-фофат в глюкозо-1-фофат;
раза – фермент, осуществляющий ключе-вую реакцию синтеза. Необратимость
этой реакции обеспечивается гидролизом
Гликогенсинтаза – образует α-1-4-гликозидные связи;
Амило-α-1.4-α-1,6-гликозил-транс-фераза, гликоген-ветвящий фермент –
переносит фрагмент с минимальной дли-
ной в 6 остатков глюкозы на эту же или соседнюю цепь с образованием
РЕГУЛЯЦИЯ ОБМЕНА ГЛИКОГЕНА
Ферменты метаболизма гликогена активны либо в фосфорилированной, либо в
фосфорилаза глико-гена активируется
после присоединения фосфатной группы
синтаза гликогена после присоединения
синтаза. Идут реак-ции катаболизма глю-
кое работают протеин-фосфатазы, которые освобождают ферменты от фос-
форной кислоты: в результате гликоген-фосфорилаза дефосфорилируется и становится не активной, активируется гликоген-синтаза. Начинается за-пасание глюкозы в виде гликогена.
Это наследственные заболевания, обусловленные недостаточностью каких-либо
ферментов, отвечающих за метаболизм гликогена. Средняя частота встречаемости составляет 1:40000.
Ранее гликогенозы классифицировались по номерам, однако в связи с открытием
новых видов этих болезней появилось много разночтений. В настоящее время глико-
генозы делят по патогенетическому признаку на печеночные, мышечные и сме-шанные формы. Следует отметить, что при гликогенозах количество гликогена не
всегда изменено, изменения могут быть только в структуре его молекулы.
Самый частый гликогеноз I типа или болезнь фон Гирке обусловлен аутосом-
но-рецессивным дефектом глюкозо-6-фосфатазы. Из-за того, что этот фермент есть
только в печени и почках, преимущественно страдают эти органы, и болезнь носит еще одно название – гепаторенальный гликогеноз. Даже у новорожденных детей
наблюдаются гепатомегалия и нефромегалия, обусловленные накоплением гликоге-на не только в цитоплазме, но и в ядрах клеток. Кроме этого, активируется синтез липидов с возникновением стеатоза печени. Так как фермент необходим для де-фосфорилирования глюкозо-6-фосфата с последующим выходом глюкозы в кровь, у больных отмечается гипогликемия, и, как следствие, ацетонемия, метаболический ацидоз, ацетонурия.
Гликогеноз III типа или болезнь Форбса-Кори или лимит-декстриноз – это аутосомнорецессивный дефект амило-α-1-6-глюкозидазы, «деветвящего» фермен-та, гидролизующего α-1-6 -гликозидную связь. Болезнь имеет более доброкачествен-ное течение и частота ее составляет примерно 25% от всех гликогенозов. Для боль-ных характерна гепатомегалия, умеренная задержка физического развития, в подро-стковом возрасте возможна небольшая миопатия.
Еще два печеночных гликогеноза – гликогеноз IV типа (болезнь Андерсена),
связанный с дефектом ветвящего фермента и гликогеноз VI типа (болезнь Херса), связанный с дефицитом печеночной фосфорилазы гликогена встречаются довольно редко.
Для этой группы гликогенозов характерны изменения ферментов мышечной тка-
ни. Это приводит к нарушению энергообеспечения мышц при физической нагрузке, болям в мышцах, судорогам.
Гликогеноз V типа (болезнь Мак-Ардля) – отсутствие мышечной фосфорила-
зы. При тяжелой мышечной нагрузке возникают судороги, миоглобинурия, хотя лег-кая работа не вызывает каких-либо проблем.
Эти заболевания касаются и печени, и мышц, и других органов.
Гликогеноз II типа (болезнь Помпе) – поражаются все гликогенсодержащие
клетки из-за отсутствия лизосомальной α-1-4-глюкозидазы. Происходит накопле-
ние гликогена в лизосомах и в цитоплазме. Заболевание составляет почти 10% всех гликогенозов и является наиболее злокачественным. Больные умирают в грудном
возрасте из-за кардиомегалии и .тяжелой сердечной недостаточности.
Агликогенозы – состояния, связанные с отсутствием гликогена.
В качестве примера агликогеноза можно привести наследственный аутосомно-
рецессивный дефицит гликоген-синтазы. Симптомами является резкая гипогликемия натощак, особенно утром, появляется рвота, судороги, потеря сознания. В результа-те гипогликемии наблюдается задержка психомоторного развития, умственная от-сталость. Болезнь несмертельна при адекватном лечении (частое кормление), хотя и опасна.
Путь, по которому глюкоза окисляется до пировиноградной кислоты для получе-
ния энергии, называется гликолизом. В зависимости от дальнейшей судьбы пирува-
та различают аэробный и анаэробный гликолиз.
аэробном процессе пировиноградная кислота превращается в ацетил-S-КоА и
далее сгорает в реакциях тканевого дыхания до СОB2B и НB2BО.
анаэробном процессе пировиноградная кислота восстанавливается до молоч-ной кислоты (лактата), поэтому в микробиологии анаэробный гликолиз называют
молочнокислым брожением. Лактат является метаболическим тупиком и далее ни во
что не превращается, единственная возмож-ность утилизовать лактат – это окислить его
Практически все клетки организма способ-ны к анаэробному гликолизу. Для эритроцитов
он является единственным источником энер-
гии. Клетки скелетной мускулатуры за счет бескислородного расщепления глюкозы спо-
собны выполнять мощную, быструю, интенсив-
ную работу, как, например, бег на короткие дистанции, напряжение в силовых видах спор-
Анаэробный гликолиз локализуется в цито-золе и включает 2 этапа из 11 ферментатив-ных реакций.
Первый этап – подготовительный, здесь происходит
затрата энергии АТФ, активация глюкозы и образование
Первая реакция гликолиза, строго говоря, к гликоли-
зу не относится. Это гексокиназная реакция о которой
ранее уже говорилось («Метаболизм гликогена»). Ее роль сводится к превращению глюкозы в реакционно способ-
ное соединение за счет фосфорилирования 6-го, не
включенного в кольцо, атома углерода.
Для печени характерен изофермент гексокиназы –
глюкокиназа. Низкое сродство этого фермента к глюко-
зе обеспечивает ее захват печенью только после приема пищи, когда создается высокая концентрация глюкозы в
крови. При обычных концентрациях глюкозы в крови пе-
чень ее не потребляет и та достается другим тканям. Вторая реакция – реакция изомеризации – необхо-
дима для выведения еще одного атома углерода из
кольца для его последующего фосфорилирования. В ней образуется фруктозо-6-фосфат.
Третья реакция – фосфорилирование фруктозо-6-
фосфата с образованием почти симметричной молекулы фруктозо-1,6-дифосфата.
В четвертой реакции фруктозо1,6-дифосфат разре-
зается пополам с образование двух фосфорилирован-ных триоз-изомеров, альдозы глицеральдегида (ГАФ) и
Пятая реакция подготовительного этапа – переход глицеральдегидфосфата и диоксиацетонфосфата друг в
друга. Равновесие реакции сдвинуто в пользу диокси-
ацетонфосфата, его доля составляет 97%, доля глице-ральдегидфосфата – 3%. Эта реакция, при всей ее про-
стоте, является вершителем судьбы глюкозы:
при нехватке энергии в клетке и активации окис-
ления глюкозы диоксиацетонфосфат превраща-
ется в глицеральдегидфосфат, который далее окисляется на втором этапе гликолиза;
при достаточном количестве АТФ, наоборот, глицеральдегидфосфат изомеризуется в диоксиацетонфосфат, и последний
отправляется на синтез жиров (см «Синтез триацилглицеридов»).
Второй этап гликолиза – это освобождение
энергии, содержащейся в глицеральдегидфосфате,
и запасание ее в форме АТФ.
Шестая реакция гликолиза – окисление глице-
ральдегидфосфата и присоединение к нему фос-
форной кислоты приводит к образованию макроэр-гического соединения 1.3-дифосфоглицериновой
В седьмой реакции энергия фосфоэфирной связи, заключенная в 1,3-дифосфоглицерате тра-
тится на образование АТФ. Реакция получила до-
полнительное название –реакция субстратного фосфорилирования, что уточняет источник энергии
для получения макроэргической связи в АТФ (суб-
страт) в отличие от окислительного фосфорилиро-вания (электрохимический градиент ионов водоро-
да на мембране митохондрий).
Подобных реакций в клетке всего три – 1) ука-занная реакция, 2) пируваткиназная реакция, деся-тая реакция гликолиза (см ниже), 3) тиокиназная
реакция цикла трикарбоновых кислот.
Восьмая реакция – синтезированный в преды-
дущей реакции 3-фосфоглицерат изомеризуется в
Девятая реакция – отрыв молекулы воды от
2-фосфоглицериновой кислоты приводит к образо-
ванию еще одной макроэргической фосфоэфирной связи.
Еще одна реакция субстратного фосфорили-рования – десятая реакция гликолиза – заключа-
ется в переносе макроэргического фосфата с фос-
Последняя реакция , одиннадцатая, образова-ние молочной кислоты из пирувата под действием
лактатдегидрогеназы. Важно то, что эта реакция
осуществляется только в анаэробных условиях. Эта реакция необходима клетке, так как НАДН, об-
разующийся в 6-й реакции, в отсутствие кислорода не может поступать и окисляться в митохондриях.
При наличии кислорода пировиноградная ки-
слота превращается в ацетил-S-КоА.
Процесс циклического восстановления и окис-
ления НАД в реакциях анаэробного гликолиза полу-
чил название гликолитическая оксиредукция.
В анаэробных условиях образуемый в шестой, ГАФ-дегидрогеназной реакции, НАДН используется
в последней реакции для восстановления пирувата до лактата. Образуемый таким образом НАД опять возвращается в шестую реакцию.
В аэробных условиях НАДН отдает свои атомы водорода на челночные систе-
мы (см ниже) для их передачи в дыхательную цепь митохондрий.
ЭНЕРГЕТИЧЕСКИЙ ЭФФЕКТ ОКИСЛЕНИЯ ГЛЮКОЗЫ
На подготовительном этапе
на активацию глюкозы затра-
чивается 2 молекулы АТФ, ка-ждая из которых оказывается
на триозе – глицеральдегид-
фосфате и диоксиацетонфос-фате. В следующий второй
этап входит только глицераль-
дегидфосфат, но его уже две молекулы, каждая из которых
окисляется до пирувата с об-
разованием 2-х молекул АТФ
реакциях субстратного фос-
зом, суммируя, получаем, что
на пути от глюкозы до пирувата
дегидрогеназную реакцию, из которой выходит НАДН. Если
используется в лактатдегидро-геназной реакции – окисляется
для образования лактата и в
получении АТФ не участвует.
– НАДН направляется в мито-хондрию, на процессы окисли-
тельного фосфорилирования, и
там его окисление приносит дивиденды в форме АТФ.
Эффект Пастера – это снижение потребления глюкозы и прекращение продукции молочной кислоты клеткой в присутствии кислорода.
Луи Пастер, занимавшийся вопросами виноделия, наблюдал подобный фено-мен при производстве вина. Забегая вперед, отметим, что спиртовое броже-ние весьма похоже на гликолиз, только вместо молочной кислоты из пирува-та образуется спирт.
Биохимический механизм эффекта Пастера заключается в конкуренции между
пируватдегидрогеназой, превращающей пируват в ацетил-S-КоА, и лактатдегид-
рогеназой, превращающей пируват в лактат. При отсутствии кислорода внутрими-тохондриальные процессы дыхания не идут, цикл трикарбоновых кислот тормозится
и накапливающийся ацетил-S-КоА ингибирует ПВК-дегидрогеназу. В этой ситуации
пировиноградной кислоте не остается ничего иного как превращаться в молочную. При наличии кислорода ингибирование ПВК-дегидрогеназы прекращается и она, об-
ладая большим сродством к пирувату, выигрывает конкуренцию.
Важно то, что пировиноградная кислота является для клетки токсичным
веществом, и клетке необходимо избавиться от нее каким угодно образом. Так как через мембраны она не проходит, то обезвреживание достигается
превращением пирувата 1) в лактат; 2) в ацетил-S-КоА; 3) в аланин (см «Ала-нинаминотрансфераза»), 4) в оксалоацетат.
Иллюстрацией к сказанному служит от-личие изоферментов лактатдегидроге-наз (ЛДГ) друг от друга. Сердечный
изофермент ЛДГ-1 обладает высоким сродством к молочной кислоте и «стре-
мится» поднять концентрацию пирува-та с целью его включения в ЦТК и полу-чения энергии для деятельности мио-
карда. Большое количество митохонд-
рий и поступление сюда лактата из других органов обеспечивает работу сердца при аэробных условиях. При не-хватке кислорода свойства ЛДГ-1 не из-
менятся, он по-прежнему будет сдвигать реакцию в сторону продукции пиро-
виноградной кислоты. Изофермент скелетной мышцы ЛДГ -5 обладает высо-ким сродством к пирувату, при отсутствии кислорода в клетке быстро и эффективно превращает его в лактат, легко проникающий сквозь мембраны. Таким образом, в анаэробных условиях сильнее будет страдать сердечная мышца, что, собственно говоря, и наблюдается в медицинской практике.
из цитозоля в митохонд-рию.
НАДН через мембрану не проходит, природа поза-
мающие этот водород в цитоплазме и отдающие его в матриксе митохонд-рий.
Определены две основные челночные системы – глицеролфосфатная и малат-
Глицеролфосфатный челнок активен в печени и в быстрых мышечных волок-нах. Его ключевыми ферментами являются изоферменты глицерол-3-фосфат-
дегидрогеназы, цитоплазматический и митохондриальный. Они отличаются своими
коферментами: у цитоплазматической формы – НАД, у митохондриальной – ФАД. Метаболиты гликолиза – диоксиацетонфосфат и НАДН образуют глицерол-3-
фосфат, поступающий в матрикс митохондрий, где он окисляется с образованием
ФАДН 2. Далее ФАДН2 направляется в дыхательную цепь и используется для полу-чения энергии.
Малат-аспартатный челнок более сложен: постоянно идущие в цитоплазме ре-
акции трансаминирования аспартата поставляют оксалоацетат, который под дейст-вием цитозольного пула малатдегидрогеназы восстанавливается до яблочной ки-
слоты. Последняя антипортом с α-кетоглутаратом проникает в митохондрии и, явля-
ясь метаболитом ЦТК, окисляется в оксалоацетат с образованием НАДН. Так как
мембрана митохондрий непроницаема для оксалоацетата, то он аминируется до ас-
парагиновой кислоты, которая в обмен на глутамат выходит в цитозоль.
Глюконеогенез – это синтез глюкозы из неуглеводных компонентов: лактата, пирувата. глицерола, метаболитов цикла Кребса, аминокислот. Все аминокислоты,
кроме кетогенных лейцина и лизина, способны участвовать в синтезе глюкозы. Неко-
торые из них – глюкогенные – полностью включаются в молекулу глюкозы, некото-рые – смешанные – частично.
организме всегда существует потребность в глюкозе:
для эритроцитов глюкоза является единственным источником энергии,
нервная ткань потребляет 120 г глюкозы в сутки, притом эта величина не за-висит от интенсивности ее работы. Только в экстремальных ситуациях (дли-
тельное голодание) она способна получать энергию из неуглеводных источ-
глюкоза играет весомую роль для поддержания необходимых концентраций
метаболитов цикла трикарбоновых кислот (в первую очередь оксалоацета-
Таким образом, при определенных ситуациях – при низком содержании углево-
дов в пище, голодании, длительной физической работе – организм должен иметь
возможность получить глюкозу. Это достигается процессом глюконеогенеза. Кроме получения глюкозы, глюконеогенез обеспечивает и уборку «шлаков» – лак-
тата, образованного при мышечной работе и в эритроцитах, и глицерола, являюще-
гося продуктом липолиза в жировой ткани.
Глюконеогенез лишь отчасти повторяет реакции окисления глюкозы. Как указы-
валось ранее, в гликолизе существуют три необратимые стадии: пируваткиназная
(десятая), фосфофруктокиназная (третья) и гексокиназная (первая). На этих стадиях существуют энергетические барьеры, которые обходятся с помощью специальных реакций.
Обход десятой реакции гликолиза
На этом этапе глюконеогенеза работают два основных фермента – в митохонд-
риях пируваткарбоксилаза и в цитозоле фосфоенолпируват-карбоксикиназа.
Пируваткарбоксилаза превращает пировиноградную кислоту в оксалоацетат. Необ-
ходимо отметить, что эта реакция идет в клетке постоянно, являясь анаплеротиче-
ской (пополняюшей) реакцией ЦТК. Далее оксалоацетат должен попасть в цитозоль
и превратиться в фосфоенолпируват. Однако дело осложняется непроницаемостью мембраны для оксалоацетата. Зато через мембрану может пройти малат, предшест-венник оксалоацетата по ЦТК. Так как в условиях недостаточности глюкозы в клетке активируется липолиз и окисление жирных кислот, то повышается количество НАДН в митохондриях. Этот избыток позволяет повернуть малатдегидрогеназную реакцию ЦТК вспять. Малат накапливается, выходит в цитозоль и здесь превращается в ок-салоацетат.
В цитоплазме фосфоенолпируват—карбоксикиназа
осуществляет превращение оксалоацетата в фосфоенол-
пируват, для реакции требуется энергия ГТФ. От молеку-лы отщепляется тот же углерод, что и присоединяется.
Обход третьей реакции гликолиза
Второе препятствие на пути синтеза глюкозы – фос-
фофруктокиназная реакция – преодолевается с помощью
фермента фруктозо-1,6-дифосфатазы. Этот фермент есть в почках, печени, поперечно-полосатых мышцах. Таким
образом, эти ткани способны синтезировать фруктозо-6-
Обход первой реакции гликолиза
Последняя реакция катализируется глюкозо-6-
фосфатазой . Она имеется только в печени и почках, сле-довательно, только эти ткани могут продуцировать сво-
Глюкозо-лактатный цикл (цикл Кори) – это связь глюконеогенеза в печени и об-
разования лактата эритроцитах или мыш-цах из глюкозы. В эритроцитах молочная
непрерывно, так как для них анаэробный
единственным спосо-бом образования энер-
гии. В скелетных мыш-цах накопление лакта-та является следстви-ем гликолиза при очень интенсивной, максимальной мощно-
сти, работе, и чем более такая работа интенсивна, тем менее продолжительна По-
сле нагрузки (во время восстановления) лактат удаляется из мышцы довольно бы-
Следует отметить, что если продолжи-
тельность нагрузки мала (до 10 секунд),
то количество АТФ пополняется пре-имущественно в
креатинфосфоки-назной реакции. В
таком режиме к при-меру работают мышцы у ттанги-
стов, прыгунов как в длину, так и в высо-
ту, метателей мо-лота, копья и т.п..
Если нагрузка не бо-лее 90 секунд – АТФ синтезируется в основном в реакциях анаэробного глико-
лиза. В спорте это бегуны-спринтеры на 100-500 м, спортсмены силовых ви-дов (борцы, тяжелоатлеты, бодибилдеры). Если напряжение мышцы длится
более двух минут – развивается аэробное окисление глюкозы в реакциях ЦТК
Но, хотя мы и говорим об аэробном окислении глюкозы, необходимо знать и помнить, что лактат образуется в мышце всегда: и при анаэробной, и при аэробной работе, однако в разных количествах.
Образовавшийся лактат может утилизоваться только одним способом – превра-
титься в пировиноградную кислоту. Но, как уже указывалось, пируват токсичен для
клеток и должен быть как можно быстрее утилизован. Сама мышца ни при работе, ни во время отдыха не занимается превращением лактата в пируват из-за наличия
специфического изофермента ЛДГ-5.
Если молочная кислота поступила в миокардиоциты, она быстро превраща-ется в пируват, далее в ацетил-S-КоА и вовлекается в полное окисление до
Большая часть лактата захватывается гепатоцитами, окисляется в пировино-
градную кислоту и вступает на путь глюконеогенеза.
Целью глюкозо-аланинового цикла также является уборка пирувата, но, кроме
этого решается еще одна немаловажная задача – уборка лишнего азота из мышцы.
При мышечной работе и в покое в миоците распадаются белки и образуемые амино-кислоты рансаминируются с α-кетоглутаратом. Полученный глутамат взаимодейст-
вует с пируватом. Образующийся аланин является транспортной формой и пирувата
и азота из мышцы в печень. В гепатоците идет обратная реакция трансаминирова-ния, аминогруппа передается на синтез мочевины, пируват используется для синте-за глюкозы
Глюкоза, образованная в печени из лактата или аланина, возвращается обратно в мышцы, восстанавливая во время отдыха запасы гликогена.
Кроме мышечной работы, глюкозо-аланиновый цикл активируется во время го-
лодания, когда мышечные белки распадаются и многие аминокислоты используются
качестве источника энергии, а их азот необходимо доставить в печень.
ЕГУЛЯЦИЯ ГЛИКОЛИЗА И ГЛЮКОНЕОГЕНЕЗА
Образование этилового спирта из глюкозы происходит в дрожжах и некоторых видах плесневых грибков. Суммарное
До стадии образования пирувата реакции спиртового броже-
ния совпадают с реакциями гликолиза, отличия заключаются
только в дальнейшем превращении пировиноградной кислоты. Цель этих превращений – удалить пируват из клетки и окислить
НАДН, который образовался в 6-й реакции.
Метаболизм поступающего этанола в организме происходит
в печени двумя путями. Первый путь заключается в окислении
спирта до уксусной кислоты, которая в виде ацетил-S-КоА посту-
пает в ЦТК. Через этот путь проходит от 70% до 90% всего эта-нола. Оставшаяся часть окисляется в микросомах алкогольокси-дазой. При регулярном поступлении этанола доля микросомаль-ного окисления возрастает, количество молекул алкогольоксида-зы увеличивается.
Так как при обезвреживании этанола образуется большое количество НАДН, в клетках печени активируется реакция превращения пирувата в лактат. Это приводит к гипогликемии, так как пировиноградная кислота является субстратом глюконео-генеза. Свободное проникновение молочной кислоты в кровь обуславливает лакта-
Если запасы гликогена в печени изначально невелики (голодание, недоедание, астеническое телосложение) или израсходованы (после физической работы), то при приеме алкоголя натощак гипогликемия наступает быстрее и может
быть причиной потери сознания. К этому стоит добавить сильный диурети-
ческий эффект этанола, ведущий к быстрому обезвоживанию организма и снижению кровоснабжения головного мозга со всеми вытекающими последст-виями.
Этанол является энергетически ценным соединением: при метаболизме 125 г этанола количество образующегося НАДН такое же, как при окислении 500 г глюко-
зы. При полноценном питании и частом потреблении этилового спирта, например, в виде пива, «этанольный» ацетил-S-КоА не столько сгорает в ЦТК, сколько использу-
ется для синтеза холестерина и нейтральных жиров, то есть происходит переход
энергии этанола в запасную форму, что приводит к пивному ожирению и повышает риск атеросклероза.
Пентозофосфатный путь окисления глюкозы не связан с образованием энергии.
для синтеза жирных кислот,
холестерина и других стероидов,
для синтеза глутаминовой кислоты из α-кетоглутаровой кислоты (реак-
ция восстановительного аминирования).
для систем защиты клетки от свободно-радикального окисления (анти-оксидантная защита).
2. Образование рибозо-5-фосфата, необходимого для синтеза нуклеиновых ки-
Наиболее активно реакции ПФП идут в цитозоле клеток печени, жировой ткани, эритроцитах, коре надпочечников, молочной железе при лактации, менее интенсив-
Пентозофосфатный путь включает два этапа – окислительный и неокислитель-ный.
На первом, окислительном, этапе глюкозо-6-фосфат в трех реакциях превра-
щается в рибулозо-5-фосфат, реакции сопровождаются восстановлением двух мо-лекул НАДФ до НАДФН.
Второй этап – этап структурных перестроек, благодаря которым пентозы воз-
вращаются в фонд гексоз. В этих реакциях рибулозо-5-фосфат может изомеризо-ваться до рибозо-5-фосфата и ксилулозо-5-фосфата. Далее под влиянием фермен-
тов транскетолазы и трансальдолазы происходят структурные перестройки с обра-
зованием иных моносахаридов. При реализации всех реакций второго этапа пентозы превращаются во фруктозо-6-фосфат и глицеральдегидфосфат. Из глицеральдегид-
3-фосфата при необходиости могут образоваться гексозы.
Связь пентозофосфатного пути и гликолиза
Судьба полученных фруктозо-6-фосфата и глицеральдегидфосфата различна
в зависимости от ситуации и потребностей клетки. Поэтому метаболизм глюкозо-6-фосфата может идти по 4 различным механизмам.
Механизм 1. Потребность в НАДФН и рибозо-5-фосфате сбалансирована
(например, при синтезе дезоксирибонуклеотидов). При таких условиях реак-
ции идут обычным порядком – образуется две молекулы NADPH и одна моле-
кула рибозо-5-фосфата из одной молекулы глюкозо-6-фосфата по окисли-тельной ветви пентозофосфатного пути.
Механизм 2. Потребность в рибозо-5-фосфате значительно превышает потребность в НАДФН (например, синтез РНК) Большая часть глюкозо-6-фосфата превращается во фруктозо-6-фосфат и глицеральдегид-3-фосфат
по гликолитическому пути. Затем две молекулы фруктозо-6-фосфата и одна молекула глицеральдегид-3-фосфата под действием трансальдолазы и
транскетолазы рекомбинируют в три молекулы рибозо-5-фосфата путем обращения реакции 2 этапа пентозофосфатного пути.
Механизм 3. Потребность в НАДФН значительно превышает потреб-
ность в рибозо-5-фосфате (например, биосинтез холестерола, жирных ки-слот). В этой ситуации по окислительным реакциям пентозофосфатного
пути образуются НАДФН и рибулозо-5-фосфат. Далее, под действием транс-кетолазы и трансальдолазы, рибулозо-5-фосфат превращается в пентозо-5-фосфаты, во фруктозо-6-фосфат и глицеральдегид-3-фосфат. В заключение
происходит ресинтез глюкозо-6-фосфата из фруктозо-6-фосфата и глице-ральдегидфосфата по пути глюконеогенеза. Подключение новых молекул
глюкозо-6-фосфата позволяет поддерживать стехиометрию процесса.
Механизм 4. Потребность в НАДФН значительно превышает потреб-ность в рибозо-5-фосфате и необходима энергия (например. антиокси-
дантная защита в эритроците). Глюкозо-6- фосфат превращается в рибозо-5-фосфат и далее во фруктозо-6- фосфат и глицеральдегид-3-фосфат, ко-торые ( в отличие от механизма 3) вступают на гликолитический путь обме-на, а не подвергаются обратному превращению в глюкозо-6-фосфат. Образо-ванный пируват вступает в ЦТК. В результате происходит одновременное генерирование НАДФН и АТФ.
Генетическая недостаточность глюкозо-6-фосфат-дегидрогеназы отмечается примерно с частотой 1:60, то есть на Земле имеется около 100 млн человек с этим заболеванием, которое, к счастью, не всегда проявляется. Следствием ферментного дефекта является снижение синтеза НАДФН в клетке. Особенно существенно это влияет на эритроциты , в которых окислительный этап пентозофосфатного цикла является единственным источником НАДФН.
Из разнообразных функций НАДФН для эритроцитов имеет значение одна – уча-
стие в работе антиоксидантной системы, а именно кооперация с глутатион-
пероксидазой, ферментом, восстанавли-
вающим пероксид водорода до воды. Пе-роксид водорода в клетке образуется из
свободных кислородных радикалов (актив-
ных форм кислорода), последние являются обычным продуктом деятельности ряда
ферментов, например, цитохромоксидазы.
При употреблении некоторых лекарст-венных препаратов (сульфаниламиды, (стрептоцид, сульфацил-Na), норсульфа-зол, парацетамол, аспирин, примахин, ме-тиленовый синий, нафталин) в клетках ак-
тивируются процессы свободно-радикального окисления. Обычная клетка, и эритро-
цит в том числе, довольно легко справляются с дополнительной нагрузкой. При не-
достаточности описываемого фермента перекись водорода накапливается в эритро-ците, усиливается повреждение его мембран и гемолиз.
ГОМЕОСТАЗ ГЛЮКОЗЫ В КРОВИ
Концентрация глюкозы в крови изменяется под влиянием многих гормонов. Ос-
новными гормонами являются глюкагон, адреналин, глюкокортикоиды, сомато-
тропный гормон с одной стороны, и инсулин с другой. Инсулин является единст-
венным гормоном организма, действие которого нацелено на снижение уровня глю-козы крови. Все остальные гормоны увеличивают его.
Уменьшение инсулином концентрации глюкозы в крови достигается следующи-
стимуляция белков-транспортеров на цитоплазматической мембране,
повышение синтеза глюкокиназы – фермента, получившего название «ло-
активация гликоген-синтазы -и стимуляция ее синтеза, что позволяет пре-
вратить излишки глюкозы в гликоген,
индукция синтеза глюкозо-6-фосфат-дегидрогеназы и 6-фосфоглюконат-дегидрогеназы,
стимуляция синтеза ферментов гликолиза – фосфофруктокиназы, пируват-киназы, что позволяет вовлечь глюкозу в окислительные процессы.
вовлечение глюкозы в синтез триацилглицеринов (см Синтез триацилглице-ролов ).
Многие ткани нечувствительны к действию инсулина, их называют инсулинне-
зависимыми. К ним относятся нервная ткань, стекловидное тело, хрусталик, сетчат-ка, клубочковые клетки почек, эндотелиоциты, семенники и эритроциты.
Глюкагон, адреналин и глюкокортикоиды повышают содержание глюкозы кро-
ви, активируя мобилизациию гликогена (гликогенфосфорилазу), стимулируя синтез ферментов глюконеогенеза (пируваткарбоксилазу, фосфоенолпируват-
карбоксикиназу, фруктозо-1,6-дифосфатазу и глюкозо-6-фосфатазу). Глюкокорти-
коиды, кроме этого, препятствуют проникновению глюкозы в клетку.
Гипергликемическим является состоянием, при котором концентрация глюкозы в крови более 6 ммоль/л.
По происхождению выделяют две группы таких состояний:
алиментарные – связаны с приемом пищи и продолжаются в норме не бо-лее 2 часов после еды.
нейрогенные – нервное напряжение. Стимулирующее секрецию адреналина
и мобилизацию гликогена в печени,
гипергликемия беременных – связана с относительной недостаточностью
инсулина при увеличении массы тела и потребностью плода в глюкозе.
Припри заболеваниях гипофиза, коры и мозгового слоя надпочечников, щи-
товидной железы, при органических поражениях ЦНС и поджелудочной же-
Сахарный диабет (СД) – полиэтиологическое заболевание, связанное:
со снижением количества β-клеток островков Лангерганса,
с нарушениями на уровне синтеза инсулина,
с мутациями, приводящими к молекулярному дефекту гормона,
со снижением числа рецепторов к инсулину и их аффинности в клетках-
с нарушениями внутриклеточной передачи гормонального сигнала.
Выделяют два типа сахарного диабета:
Инсулинзависимый сахарный диабет (ИЗСД)- диабет детей и подростков (юве-
нильный), его доля составляет около 20% от всех случаев СД;
Инсулиннезависимый сахарный диабет (ИНЗСД) – диабет взрослых, его доля
Подразделение типов СД на взрослый и ювенильный не всегда корректно, так
как встречаются случаи развития ИНЗСД в раннем возрасте, также ИНЗСД может переходить в инсулинзависимую форму
Более подробно рассмотрим 1 и 2 ти-
пы СД. Развитие ИЗСД обусловлено не-
достаточным синтезом инсулина в
β-клетках островков Лангерганса подже-
лудочной железы. Среди причин этого в
настоящее время на первый план выдви-
гаются аутоиммунные поражения и инфи-
цирование β-тропными вирусами (вирусы
Коксаки, Эпштейна-Бар, эпидемического паротита).
Имеется опасность использования коровьего молока или молочных смесей для вскармливания младенцев из-за возможного развития иммунного ответа на молочный альбумин и переключения иммунной атаки на β-клетки поджелудоч-ной железы.
Для диабета взрослых ведущей причи-
ной является инсулинорезистентность,
возникающая из-за функциональных или структурных нарушений инсулиновых ре-
Сравнительная характеристика типов сахарного диабета
Диагноз инсулинзависимого сахарного диабета ставится если
Имеются классические симптомы (полиурия, полидипсия, снижение массы те-
ла) и концентрация глюкозы натощак в нескольких повторных анализах капиллярной
Отсутствие соответствующих симптомов при концентрации глюкозы натощак в
нескольких повторных анализах капиллярной крови более 6,1 ммоль/л.
В сомнительных (и только!) случаях – отсутствие симптомов в сочетании не-однозначностью результатов анализов – рекомендуется нагрузочная проба с глюко-
зой. Она заключается в приеме испытуемым глюкозы из расчета 1,5-2,0 г на кг массы тела. Пробы крови отбирают непосредственно перед приемом глюкозы (нулевая ми-
нута, «тощаковый» уровень) и далее через 30, 60, 90 и 120 минут, при необходимости на 180 минуте.
В норме повышение концентрации
глюкозы составляет 50-75% к 60 ми-
нуте исследования и снижается до исходных величин к 90-120 минутам.
В абсолютных единицах по реко-
мендации ВОЗ подъем уровня глю-козы должен быть не более 7,5
Иногда пробы берут только на 0 и 120 минутах, однако это нежела-
тельно, так как упускается до-полнительная информация о состоянии организма. Так, по крутизне восходя-
щей части кривой можно судить об активности n. vagus, отвечающего за секрецию инсулина, о всасывающей функции кишечника, о способности печени усваивать глюкозу. К примеру, «голодная» печень с истощенными запасами
гликогена, более активно потребляет глюкозу из крови воротной вены по сравнению с «сытой», и подъем кривой более плавный. Аналогичная кривая на-блюдается при ухудшении всасывания глюкозы вследствие заболевания сли-
зистой кишечника. При циррозе печени отмечается обратная картина.
Довольно часто у взрослых вместо глюкозной нагрузки используется обычный завтрак, и кровь отбирают через 1, 2 или 2,5 часа после него. Если уровень глюкозы в указанное время не возвращается к норме, то подтверждается ди-агноз сахарного диабета.
проявляются повышенным в 2-3
раза уровнем глюкозы крови после нагрузки, что свидетельствует о
нарушении гормональных взаимо-
действий. Нормализация показате-лей происходит крайне медленно и
завершается не ранее 150-180 ми-
нут . Наиболее частой причиной та-ких кривых является скрытый са-
харный диабет 1 и 2 типа и повре-ждении паренхимы печени. Избы-
ток катехоламинов при феохромо-цитоме и трийодтиронина при ги-
перфункции щитовидной железы,
гиперкортицизм, заболевания гипоталамуса и гипофиза также проявляются в виде гипергликемической кривой.
При измерении уровня глюкозы после еды у больных с хорошо контролируе-мым сахарным диабетом результаты должны укладываться в диапазон 7,6-
9,0 ммоль/л. Величины большие 9,0 ммоль/л означают, что дозировка инсулина неправильна или диабет не компенсирован.
повышение концентрации глюкозы
не более чем на 25% с быстрым возвращением к исходным значе-
ниям. Наблюдаются при аденоме
островков Лангерганса, гипотирео-зе, гипофункции коры надпочечни-
ков, заболеваниях кишечника и
Очень быстрые эффекты (секунды)
Гиперполяризация мембран чувствительных к инсулину клеток;
Активация na+/h+-обменника, что выхывает выход ионов н+, вход в клетку ио-
Активация na+/к+-обменника, что выхывает выход ионов na+, вход в клетку ио-нов k+;
Угнетение ca2+-насоса, приводит к задержке ионов са2+ в клетке;
Стимуляция транспорта глюкозы в клетку – появление на мембране перенос-чиков глюкозы;
Стимулирование протеинфосфатаз приводит к активации гликогенсинтазы,
пируватдегидрогеназы, ГМГ-SКоА-редуктазы, ацетил-S-КоА-карбоксилазы;
Увеличивает липогенез за счет создания благоприятного «биохимического
активирует глюкозо-6-фосфатдегидрогеназу и, что вызывает наработку НАДФН,
глюкокиназу, что ведет к синтезу ацетил-SКоА,
ацетил-S-КоА-карбоксилазу и синтазу жирных кислот, повышая синтез жир-ных кислот.
Активирует цАМФ-фосфодиэстеразу, снижая тем самым ее активирующее
влияние на протеинкиназу А и реакции катаболизма.
Медленные эффекты (минуты-часы)
Активация синтеза глюкокиназы, АТФ-цитрат-лиазы, ацетил-S-КоА-карбо-
ксилазы, синтазы жирных кислот, пируваткиназы, люкозо-6-фосфатдегидрогеназы, цитолозольной малатдегидрогеназы.;
Увеличение синтеза тРНК для увеличения скорости транскрипции. Однако на-работку мРНК антагонистических ферментов снижает (например, для ФЕП-
Повышает фосфорилирование по серину рибосомального белка S6, что сти-мулирует синтез белка.
Очень медленные эффекты (часы-сутки)
Повышает синтез соматомедина, зависимый от гормона роста;
Увеличивает рост и пролиферацию клеток, действуя при этом синергично с
Стимулирует тирозиновые киназы., вызывает переход клетки из G1 в S-фазу клеточного цикла.
ОСЛЕДСТВИЯ ДЕФИЦИТА ИНСУЛИНА
Гипергликемия – так как отсутствует влияние инсулина и превалирует влия-
ние глюкагона, адреналина, кортизола, гормона роста.
Глюкозурия – почечный порог для глюкозы, т.е. концентрация глюкозы в кро-
ви при которой она появляется в моче, примерно равен 10,0 ммоль/л. В норме в мо-
че уровень глюкозы 0,8 ммоль/л и до 2,78 ммоль/сут, в других единицах около 0,5
г/сут, при СД количество теряемой глюкозы составляет до 100 г/сут и более.
Преобладание катаболизма белков над анаболизмом ведет к накоплению
мена, в первую очередь мочевины и ее повышен-
осмотически удерживают воду в просвете поччного
лиурия. Объем мочи воз-растает в 2-3 раза.
ТАГ в жировой ткани и пе-чени обуславливает ано-
жирных кислот и накопле-ние их недоокисленных
При диабете концентрация кетоновых тел возрастает
чой, кроме воды, теряются соли, в частности карбо-
наты, имеющие щелочной характер. Это усугубляет ацидоз.
ратация (в тяжелых случаях до 5 л) организма, которая заключается в падении объ-
ема крови, обезвоживанию клеток и их сморщиванию (дряблая кожа, запавшие гла-
за, мягкие глазные яблоки, сухость слизистых), уменьшению артериального давле-ния. Ацидоз вызывает одышку (дыхание Kussmaul, быстрое и глубокое) и дополни-
Активируется центр жажды и начинается полидипсия.
Дегидратация неминуемо приводит к недостаточности кровообращения в тка-
нях – активируется анаэробный гликолиз, накапливается лактат и в дополнение к ке-
тоацидозу возникает лактацидоз.
Закисление среды вызывает изменение взаимодействия инсулина с рецепто-
рами, клетки становятся нечувствительными к инсулину – инсулинорезистент-
Ацидоз крови уменьшает концентрацию 2,3-дифосфоглицерата в эритроци-
тах. Это, повышая сродство гемоглобина к кислороду, создает тканевую гипоксию и
Гипергликемия резко повышает потребление глюкозы инсулиннезависимыми тканями (клетки артериальных стенок, эндотелия, клетки Шванна, эритроциты, хру-
сталик и сетчатка глаза, семенники и гломерулярные клетки почек), в них вынужден-но активируется особые пути метаболизма глюкозы. Их интенсивность определяется только доступностью глюкозы:
Сорбитол плохо проникает через клеточные мембраны, его накопление в цитозоле приводит
осмотическому набуханию кле-ток и нарушению их функций. Например, возникновение ката-ракты хрусталика и нейропатий (нарушение осязания) в клетках Шванна
Неферментативное гли-козилирование различных бел-
ков, изменение их свойств и активация их синтеза за счет избытка энергии:
увеличивается синтез гликопротеинов базальной мембраны почечных клу-бочков. Это приводит к окклюзии капилляров и нарушению фильтрации
увеличивается синтез гликопротеинов в сетчатке глаза, что вызывает отек
увеличивается синтез гликопротеинов в стекловидном теле
увеличивается синтез тканевых белков за счет доступности глюкозы и энер-
гликозилированные белки хрусталика объединяются в крупные агрегаты,
рассеивающие свет. Это вызывает помутнение хрусталика и катаракту.
гликозилирование гемоглобина в эритроцитах, образование HbA1C
белков свертывающей системы, что увеличивает вязкость крови
белков ЛПНП, что уменьшает их связывание с рецепторами и повышает концентрацию ХС в крови
белков ЛПВП, что усиливает их сродство к рецепторам и быструю элимина-
Из-за двух последних нарушений возникают макроангиопатии развивается ате-
росклероз сосудов мозга, сердца, почек, конечностей. Характерно в основном для
ПЕРЕВАРИВАНИЕ И ВСАСЫВАНИЕ
При калорийности рациона 2000–3000 ккал суточное потребление углеводов составляет 300-450г. С пищей поступает крахмал, сахароза, лактоза, пищевые волокна (клетчатка и др.). Переваривание углеводов начинается в ротовой полости при участии α-амилазы слюны, которая расщепляет в крахмале α-1,4-гликозидные связи. Полное расщепление крахмала здесь не происходит, так как пребывание пищи во рту кратковременно. Из крахмала в ротовой полости образуются крупные фрагменты – декстрины. Желудочный сок не содержит ферментов, расщепляющих углеводы. Дальнейшее переваривание углеводов происходит в тонком кишечнике. Фермент поджелудочной железы α-амилаза расщепляет α-1,4-гликозидные связи крахмала и декстринов, α-1,6-гликозидные связи расщепляются ферментом кишечного сока – амило-1,6-гликозидазой. При действии двух ферментов образуется дисахарид мальтоза. Амилаза поджелудочной железы не расщепляет β-1.4-гликозидные связи, которыми соединены остатки глюкозы в молекуле целлюлозы. Поэтому пищевые волокна не перевариваются, но они должны присутствовать в рационе, так как улучшают перистальтику, ускоряют чувство насыщения и снижают уровень холестерина в крови, поскольку на них происходит адсорбция желчных кислот и выведение их из организма. Пищевые волокна обязательно должны присутствовать в рационе при ожирении, запорах, атеросклерозе, сахарном диабете. Мальтоза, образовавшаяся из крахмала, а также дисахариды пищи – сахароза и лактоза перевариваются ферментами тонкого кишечника – дисахаридазами. Эти ферменты работают не в просвете кишечника, а на поверхности эпителиальных клеток кишечника. Мальтоза расщепляется мальтазой до 2 молекул глюкозы, лактоза – лактазой до глюкозы и галактозы, сахароза – сахаразой до глюкозы и фруктозы (рис.3). Все моносахариды всасываются, сначала путем облегченной диффузии, а затем активным транспортом в симпорте с ионами Nа + .
Рис.3. Катаболизм дисахаридов и патогенез дисахаридозов
В крови воротной вены содержатся три моносахарида: глюкоза, фруктоза и галактоза. Все они попадают в печень, где происходит унификация фруктозы и галактозы, т.е. они превращаются в глюкозу – единственный моносахарид, используемый всеми клетками нашего организма.
Дисахаридозы – нарушение переваривания дисахаридов, связанные с недостаточной активностью дисахаридаз. Недостаточная активность ферментов может быть врожденной и приобретенной. Симптомы врожденных форм проявляются достаточно рано, например, после первого кормления грудным молоком (при дефиците лактазы) или при добавлении в рацион сахара или крахмала. Приобретенные формы могут наблюдаться при заболеваниях кишечника. Нерасщепленные дисахариды вызывают осмотическую диарею, сбраживаются микрофлорой кишечника с образованием углекислого газа, что приводит к метеоризму, коликам.
Многие ткани в качестве резервной формы глюкозы синтезируют гликоген. Синтез и распад гликогена обеспечивают постоянство концентрации глюкозы в крови. Синтезгликогена происходит в покое и сытости, как любой анаболический процесс требует энергии. Депонируется гликоген главным образом в печени и мышцах. Глюкоза, поступившая в клетку, фосфорилируется при участии гексокиназы за счет АТФ, при этом образуется глюкозо-6-фосфат, который в ходе обратимой реакции под действием фосфоглюкомутазы превращается в глюкозо-1-фосфат. Затем при участии УТФ глюкозо-1-фосфат превращается в УДФ-глюкозу. Эта молекула используется как донор остатков глюкозы при синтезе гликогена.
Так как гликоген в клетке никогда не расщепляется полностью, синтез гликогена осуществляется путем удлинения уже имеющейся молекулы полисахарида, называемой «затравка». К «затравке» последовательно присоединяются остатки глюкозы из УДФ-глюкозы α- 1,4-гликозидной связью при участии фермента гликогенсинтазы. Разветвленная структура гликогена образуется при участии «фермента ветвления» (рис.4). Регуляторными ферментами в синтезе гликогена являются гликогенсинтаза и гексокиназа. Синтез гликогена увеличивается под влиянием инсулина, а тормозится глюкагоном, катехоламинами, глюкокортикостероидами.
Рис.4. Обмен гликогена печени
Распад гликогена происходит путем последовательного отщепления остатков глюкозы в виде глюкозо-1-фосфата. Гликозидная связь расщепляется с присоединением неорганического фосфата, поэтому процесс называется фосфоролизом, а фермент – фосфорилазой. Образовавшийся глюкозо-1-фосфат затем изомеризуется фосфоглюкомутазой до глюкозо-6-фосфата. В печени (но не в мышцах) глюкозо-6-фосфат может гидролизоваться с образованием глюкозы, которая выделяется в кровь. Эту реакцию катализирует глюкозо-6-фосфатаза. Мышечный гликоген не используется для поддержания уровня глюкозы в крови, так как в мышцах нет фермента глюкозо-6-фосфатазы и образование свободной глюкозы там невозможно, а глюкозо-6-фосфат не может проникать через мембрану клеток. Таким образом, печень запасает глюкозу в виде гликогена не столько для собственных нужд, сколько для поддержания постоянной концентрации глюкозы в крови. Функция мышечного гликогена заключается в освобождении глюкозо-6-фосфата, потребляемого в самой мышце для окисления и использования энергии.
Регуляторными ферментами распада гликогена являются фосфорилаза и глюкозо-6-фосфатаза. Процесс распада усиливают катехоламины, глюкагон, глюкокортикостероиды; тормозит инсулин.
Для продолжения скачивания необходимо пройти капчу:
Сервис бесплатной оценки стоимости работы
- Заполните заявку. Специалисты рассчитают стоимость вашей работы
- Расчет стоимости придет на почту и по СМС
Прямо сейчас на почту придет автоматическое письмо-подтверждение с информацией о заявке.
источник