С развитием таких смежных наук, как генетика, молекулярная биология, химия, а также ростом технического прогресса, современная медицина может похвастаться инновационными методами диагностики самых разных заболеваний человека. Они отличаются высокой точностью результатов и безопасностью проведения. Одним из таких способов выявления проблем со здоровьем является иммуноферментный анализ. Он приобрел широкую популярность в последнее десятилетие и завоевал репутацию высокоэффективного, надежного и безопасного для пациента метода обнаружения заболеваний еще до появления внешних симптомов. Мы доступно объясним, что представляет собой такой вид диагностики, каков принцип его действия, отметим достоинства, сориентируем в стоимости такого анализа.
Для того чтобы понять, как, благодаря иммуноферментному анализу, лаборанты диагностируют различные заболевания, необходимо разобраться в физиологическом процессе, который происходит в организме во время заражения инфекциями. Когда патогенный микроорганизм попадает в кровоток, иммунная система человека демонстрирует защитную реакцию в виде выделения определенных веществ – антител. Они связываются с клеткой и анализируют, является ли она частью организма или внедрилась извне. Если иммунная система определила, что клетка чужеродная, то количество антител начинает увеличиваться с целью борьбы с патогенным микроорганизмом.
Антитела бывают разных видов, имеют свои особенности. Одни вещества появляются непосредственно в период инфицирования, другие остаются в течение всей жизни в организме человека и именно благодаря им вырабатывается стойкий иммунитет к конкретному заболеванию. Рзделяют белковые структуры на такие виды: A, D, E, M, G. В медицине антитела называют иммуноглобулинами. Поэтому принято обозначать показатели этих веществ латинскими буквами Ig.
Иммуноферментный анализ (ИФА) основан именно на данных медицинских знаний. С помощью специальных антигенов в лабораторных условиях можно определить наличие или отсутствие тех или иных антител в биологическом материале. По результатам такого анализа врач может поставить диагноз, а также определить не только наличие патологии, но и давность ее происхождения, выявить уровень опасности для пациента. При иммуноферментном анализе чаще других исследуют наличие антител групп M и G.
На самом деле иммуноферментный анализ не является инновацией современного общества. Его изобрели еще в 80-х годах. Но для проведения таких исследований требовалась громоздкая дорогостоящая аппаратура. Поэтому использовали такой метод только в специально оснащенных научных лабораториях: его применяли для типирования клеток и тканей. А вот широкого распространения в диагностической медицине он тогда не получил, использовать его было технически сложно и крайне затратно. Лишь с развитием техники и изобретением биополимерных материалов ИФА усовершенствовали. После чего метод стал популяризироваться и завоевывать доверие в медицинских кругах.
Как уже было сказано выше, данный метод подразумевает обнаружение в биоматериале — крови, околоплодных водах, стекловидном теле или спинномозговой жидкости — определенных групп иммуноглобулинов.
Различают исследования без нанесения антигена на поверхность и твердофазный иммуноферментный анализ, который предполагает проведение реакции в специальных лунках. Последний метод имеет большую чувствительность и надежность, поэтому именно таким образом проводят анализ в медицинских лабораториях для обнаружения заболеваний человека.
В зависимости от предполагаемого заболевания, из набора для иммуноферментного анализа используют необходимый антиген, который во время химической реакции при наличии инфекции свяжется с патогенной флорой. Этот процесс называется проведением иммунной реакции.
Затем для того, чтобы визуально определить результат исследования, проводят ферментативную фазу ИФА. Она предполагает окрашивание материала с помощью специальных реагентов. В данном исследовании применяют такие ферменты, как щелочная фосфатаза, пероксидаза и авидин. В зависимости от получившегося цвета в процессе проведения химических реакций и определяют результат иммуноферментного анализа.
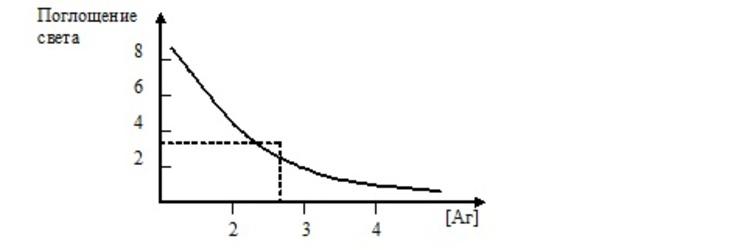
Анализ ферментативной фазы диагностики проводится с помощью метода, который имеет название «колориметрия». Дело в том, что не только цвет материала дает информацию об инфекции, но и получившаяся в результате химических реакций плотность окраса. Именно этот показатель определяет концентрацию патогенного микроорганизма. Если по старинке используют ручной метод диагностики, то для определения указанных показателей выстраивают специальный калибровочный график.
В современных лабораториях сегодня редко применяют ручной метод. Для проведения анализа ИФА используют специальный аппарат – колориметр, в котором вручную задаются лишь параметры исследования, а затем всю работу, включая построение графика, прибор проводит автоматически.
Различают прямой и непрямой методы иммуноферментного анализа. Первый вид занимает меньше времени, так как имеет лишь 3 стадии выполнения. Сперва к антигенам исследуемого материала, помещенным в специальные лунки, добавляют специфические антитела. Затем удаляют избыточное их количество и проводят ферментативную фазу анализа, получая таким образом результат.
Непрямой метод применяется намного чаще, так как имеет более высокую чувствительность по сравнению с прямым способом диагностики. При его проведении используется двойное исследование. А именно — сначала антиген связывают с немеченым антителом, а затем с меченым. Такой процесс занимает больше времени, но и результат является наиболее точным.
Наборы для иммуноферментного анализа выпускают разные производители, в самых разных комплектациях. В России признанной является компания «Союз медико-биологический». Данный производитель выпускает наборы реагентов для исследования методом ИФА практически всех распространенных в наших широтах инфекций, поддающихся анализу таким способом. Кроме непосредственно самих реагентов в комплекты входят дополнительные материалы, что обеспечивает безопасность, удобство и быстроту выполнения анализа. Кроме того, химические субстанции окрашены в разные цвета, что снижает вероятность ошибки в выборе реагента лаборантом.
Отличаются химико-биологические наборы относительной доступностью, что прямо влияет на распространение и доступность иммуноферментного анализа для населения.
Несомненно, иммуноферментный анализ имеет ряд преимуществ по сравнению с другими диагностическими методиками:
- С его помощью можно определить даже незначительное наличие патогенных организмов, что говорит о высокой чувствительности теста.
- Возможность обнаружения заболевания на самых ранних стадиях, что значительно повышает шанс на благополучное излечение.
- Простота и удобство взятия биологического материала. Такой анализ проводят как в частных лабораториях, так и в государственных. При необходимости материал может взять медсестра у пациента дома.
- Для анализа требуется совсем незначительный объем биоматериала.
- Быстрое получение результата. Современное медицинское оборудование позволяет выполнить анализ в течение суток.
- Возможность обнаружения скрытых бессимптомных форм инфекции.
- Доступность исследования.
- При необходимости возможно проведение массовых обследований данным методом.
- Существует возможность отслеживания протекания заболевания и эффективности назначенного лечения, так как можно проводить анализ методом ИФА многократно абсолютно безопасно для пациента.
- Автоматизация этапов проведения анализа, что исключает человеческий фактор и повышает достоверность результатов.
- Реагенты для проведения ИФА хранятся достаточно долго – около года.
- Проведение анализа возможно при колебаниях температуры окружающей среды.
Антитела группы М вырабатываются иммунной системой сразу после обнаружения чужеродного антигена. Следовательно, если иммуноферментный анализ завершился обнаружением таких веществ в биоматериале, то это свидетельствует об острой стадии протекания заболевания, первичном инфицировании. Иммуноглобулины группы М могут находиться в организме до месяца в зависимости от вида заражения. Затем их количество уменьшается до полного исчезновения.
На смену иммуноглобулинам группы М появляются белковые структуры вида G. Эти вещества вырабатывают стойкий, в большинстве случаев пожизненный иммунитет к заболеванию. Определение белковой структуры IgG в исследуемом материале указывает на то, что организм ранее встречался с возбудителем и имеет защитную реакцию от повторного заражения.
Иммуноферментный анализ крови применяют для определения разных инфекционных заболеваний, гормональных состояний, делают аллергопробы. А именно:
- определяют уровень гормонов щитовидной железы;
- показатели репродуктивной гормональной панели;
- онкомаркеры;
- обнаруживают возбудителей инфекционных заболеваний, таких как цитомегаловирус, гепатит, токсоплазма, краснуха, корь, туберкулез, хламидия, сифилис, микоплазма, уреплазма, кандида, лямблии и даже ВИЧ;
- диагностируют аутоиммунные заболевания. В том числе часто используют для исследования гормонов щитовидной железы иммуноферментный анализ: ТТГ, ТГ, Т3 и Т4.
Кроме диагностических целей, метод иммуноферментного анализа применяют в научно-исследовательской медицинской деятельности.
В большинстве случаев для анализа рекомендуется забор венозной крови. После обработки и подготовки материала для исследования проводят иммуноферментный анализ сыворотки крови или плазмы.
Особого внимания требует исследование гормональной панели, так как в данном случае крайне важно учитывать особенности забора материала. Например, диагностика большинства гормонов репродуктивной системы женщины требует взятия венозной крови в определенные дни менструального цикла. На ряд других гормонов действуют внешние факторы: сезонность, время суток, психологическое состояние пациента и многое другое. Не учитывая специфические факторы, можно получить ложный результат, что приведет к обострению заболевания или неправильно назначенному лечению.
В некоторых, чаще осложненных случаях, для анализа могут понадобиться спинномозговая жидкость, стекловидное тело или околоплодные воды беременной женщины. Процедуры по забору этих биологических материалов несут определенный риск, имеют противопоказания и восстановительный период. Поэтому следует проводить только по показаниям врача и под его профессиональным наблюдением такой иммуноферментный анализ. Расшифровка в таком случае требует специальных медицинских знаний и может занять некоторое время.
Иммуноферментный анализ следует проводить, придерживаясь всех рекомендаций, так как на результаты исследования влияют внешние факторы. Например, важно сдавать венозную кровь натощак утром (до 11 часов). За 2 недели до предполагаемого забора материала нужно прекратить прием каких-либо лекарственных препаратов, особенно гормональных. Несколько дней перед исследованием следует воздержаться от употребления алкоголя и жирной пищи, а также исключить физическую нагрузку, переживания и стрессы.
Расшифровка результатов иммуноферментного анализа требует специальных знаний об особенностях белковых структур (антител), о которых было рассказано выше (IgG и IgM). В соответствии с этими данными анализируют показатели исследований. В таблице описаны варианты, которые могут быть получены при проведении анализа:
| Иммуноглобулины M | Иммуноглобулины G | Предполагаемая расшифровка |
| отрицательно | отрицательно | Организм никогда не сталкивался с данной инфекцией. Нет ни возбудителя, ни антител к нему. |
| отрицательно | положительно | Организм выработал стойкий иммунитет к инфекции. |
| положительно | отрицательно | Острая форма инфицирования. |
| положительно | положительно | Вероятнее всего первичное заражение, но требуются дополнительные диагностические исследования. |
Анализируя представленную таблицу, можно сделать вывод, что в большинстве случаев для подтверждения диагноза потребуются дополнительные исследования. Не может дать однозначного ответа один лишь иммуноферментный анализ. Норма в данном случае не имеет четких границ: обнаруженные белки группы G указывают лишь на то, что организм ранее подвергался инфицированию определяемым возбудителем. Но этот же результат может говорить и о наличии острой фазы — важно сопоставить множество факторов и показателей для того, чтобы поставить правильный диагноз.
ИФА является точным на 90%. Все же существуют факторы риска, которые влияют на искажение результата диагностики: неисправность аппаратуры, неправильный забор материала, его хранение и транспортировка, неучет иных внешних факторов.
Не рекомендуется проводить диагностику после переливания крови, гемолиза, хирургических вмешательств, взятия биопсии или пункции биологического материала — это также может повлиять на результаты показателей.
Стоимость диагностического исследования имеет большой диапазон и зависит от вида анализа и определяемого антигена, так как исходя из этих факторов рассчитывается стоимость реагентных наборов и определяется сложность проведения анализа. Но в большинстве случае является доступным многим пациентам иммуноферментный анализ. Цена его составляет от 300 р. до 2000 р.
ИФА – доступный, быстрый и высокоэффективный метод диагностики большого перечня заболеваний. Но расшифровкой результатов и постановкой диагноза имеет право заниматься только квалифицированный медицинский работник.
источник
Для проведения комплексной оценки состояния организма применяется ИФА-метод проведения диагностики. Иммуноферментный анализ крови предназначен для диагностирования инфекционных, гематологических, первичных и вторичных иммунодефицитов.
Многие пациенты интересуются методом ИФА: что это, для чего проводится исследование. Иммуноферментный анализ начал использоваться сравнительно недавно. Изначально с его помощью изучались антигенные структуры, и он проводился только в научных целях. Затем ученые пришли к выводу, что при помощи ферментов можно выявить специфические антитела, возникающие в ответ на протекающее заболевание.
На сегодняшний день этот метод имеет широкую сферу применения. Современные лаборатории используют его для диагностирования:
- опухолей;
- гормональных нарушений;
- инфекций;
- хронических или перенесенных ранее инфекционных процессов;
- гельминтов.
Если в организме протекает инфекционный процесс, то этот вид диагностики считается наиболее оптимальным для определения типа заболевания.
Метод ИФА — что это, какова суть этого вида исследования? Этот и многие другие вопросы интересуют пациентов. Основой этого способа диагностики считается связывание иммунных клеток организма с антигенами возбудителей инфекции. Получившийся комплекс определяют при помощи специального фермента.
Реакцию на наличие таких иммунных комплексов проводят в лабораторных условиях, применяя уже готовые соединения, чтобы определить, есть ли в крови подобные им.
Суть метода ИФА достаточно простая, однако из-за того, что анализ крови проводится для выявления многих инфекций и болезней, существует несколько его разновидностей. Каждый отличается схемой проведения и областью применения. Может быть прямой или непрямой ИФА. Прямой метод подразумевает под собой то, что применяются обездвиженные антитела, реагирующие с антигенами. Основным плюсом такого метода является то, что все процессы можно автоматизировать, а значит, диагностика занимает немного времени.
Непрямой метод подразумевает, что применяются антитела вторичного характера. А на твердой фазе обездвиживается антиген. Анализ позволяет определить антитела к различным антигенам. Это помогает достигнуть более точного результата, однако метод отличается сложностью.
Лабораторные исследования методом ИФА имеют множество преимуществ в сравнении с другими способами диагностики. К основным можно отнести такие:
- высокая чувствительность;
- стабильность при хранении ингредиентов;
- скорость проведения диагностики;
- можно применять небольшое количество исследуемого материала;
- есть возможность автоматизации всех процессов;
- можно выявить инфекцию на самых ранних стадиях.
Проведение исследования при помощи метода ИФА могут назначить при подозрении на множество болезней:
- острые и хронические инфекции, венерические болезни;
- наличие паразитов;
- аутоиммунные патологии;
- онкологические заболевания;
- для определения уровня гормонов.
На наличие антител исследуется венозная кровь. Перед проведением анализа из нее выделяют элементы, которые могут осложнять исследование. Может проводиться забор и других биологических жидкостей.
Использование метода ИФА помогает определить наличие многих инфекций в организме, в частности и сифилиса. Для проведения исследования берется кровь из вены натощак. Затем осуществляется исследование, помогающее определить не только наличие болезни в организме, но и точные сроки ее начала, так как в течение болезни одни антитела заменяются другими в строго определенном порядке.
При острой фазе, свидетельствующей о продолжительном течении болезни, или при обострении хронической инфекции в крови будут обнаружены иммуноглобулины типа M. Наличие иммуноглобулинов типа A свидетельствует о том, что инфекция обитает в организме более 4 недель. Иммуноглобулины группы G говорят о разгаре болезни или о ранее проведенной терапии.
ИФА-метод применяется и для проведения анализа на ВИЧ-инфекции. Диагностика в таком случае имеет определенные особенности, которые связаны с протеканием и прогрессированием болезни. Этот метод исследования считается наиболее приемлемым для определения, однако проводить его нужно не ранее чем через месяц после воздействия факторов риска. Это связано с наличием инкубационного периода, протекающего от 45 дней и до 6 месяцев. Именно поэтому анализ нужно повторить через полгода.
Положительным результат считается, если при первичном исследовании были обнаружены антитела. В таком случае анализ повторяется через полгода, если снова результат положительный, то исследование проводится с применением высокоспецифичных тестовых систем.
Достаточно часто доктора назначают проведение иммуноферментного анализа для определения наличия паразитов в организме. При помощи такого метода исследования можно определить:
Несмотря на все преимущества, существуют также недостатки метода ИФА. Основным недостатком считается то, что при проведении исследования доктор должен заранее иметь предположение о заболевании.
При диагностике инфекционных болезней нет возможности случайно найти возбудителя и определить его иммуноферментные свойства. Тест только указывает на наличие антител в крови больного. Кроме того, это достаточно дорогостоящий анализ.
Результатом качественного ИФА будет либо наличие антител, либо их отсутствие в крови. Если проводится количественный анализ, то концентрация антител может выражаться или в цифровом значении, или в определенным количеством знаков +.
Кроме того, анализируются такие показатели, как:
Показатель IgM указывает на протекание острого инфекционного процесса в организме. Полное его отсутствие может говорить об отсутствии возбудителя болезни или переходе ее в хроническую стадию.
Сейчас существуют специальные тесты ИФА, которые можно провести самостоятельно.
источник

Иммуноферментный анализ крови – это лабораторное иммунологическое исследование крови, при котором происходят качественные и количественные измерения антител (антигенов), а также гормонов. Этот метод предоставляет до 90% точности при установлении диагноза заболевания.
Медицинские лаборатории используют несколько вариантов его проведения, что влияет на срок готовности результатов. Но в среднем выдача результатов исследования происходит в период 1-10 дней после сдачи крови.
При данном виде анализа крови устанавливаются антитела разных видов – это иммуноглобулины класса M, A, G (JgM, JgA, JgG). Их накопление происходит в различные временные промежутки. Первыми начинают проявляться иммуноглобулины класса М (пятый день после начала болезни). Такие иммуноглобулины задерживаются в организме пять-шесть недель, после чего начинают исчезать из крови организма. Именно в данный период времени выявляются антитела класса М.
Вторыми проявляются иммуноглобулины класса G (через три-четыре недели). Они задерживаются в организме несколько месяцев или лет. Во время проведения иммуноферментного анализа крови и расшифровки его результата можно обнаружить возрастание антител класса G. Это свидетельствует о наличии инфекции или реинфекции.
Антитела класса А проявляются в крови на протяжении двух-четырех недель. Но всего лишь 20% из них присутствуют в сыворотке крови. Остальные же входят в состав секрета слизистых оболочек. Иммуноглобулины класса А начинают исчезать в промежутке времени от двух недель до двух месяцев. Данный процесс является свидетельством уничтожения инфекции в организме. Если после выздоровления человека проводился повторный иммуноферментный анализ крови и расшифровка результата показала наличие антител класса А – это свидетельство хронической инфекции.
Расшифровка результатов анализа может принимать такие значения:
- JgM (-), JgG (-), JgA (-) – отсутствие иммунитета к инфекции;
- JgM (-), JgG (+), JgA (-) – наличие поствакционного или постинфекционного иммунитета;
- JgM (+), JgG (-/+), JgA (-/+) – наличие острой инфекции;
- JgM (+), JgG (+), JgA (+) – наличие обострения хронической инфекции;
- JgM (-), JgG (+/-), JgA (+/-) – наличие хронической инфекции;
- JgM (-) – выздоровление.
В расшифровке (+) является положительным результатом, а (–) – отрицательным результатом.
Помимо уточнения классов антител в расшифровке встречаются количественные их показатели. Но обширное их объяснение может предоставить только лечащий врач.

Иммуноферментный анализ сыворотки крови основан на взаимодействии антигена с антителом, причем один из них содержит в своей структуре фермент. При взаимодействии двух компонентов содержимое пробирки должно менять свой цвет. Результаты сравниваются со стандартной цветовой шкалой, и далее устанавливается антиген, который присутствует в материале. Другими словами принцип иммуноферментного анализа сыворотки крови можно объяснить так:
- подготавливаются наборы антигенов (например, возбудители инфекционных заболеваний, аллергены или гормоны);
- пациент сдает кровь на анализ, из которой в лаборатории выделяется сыворотка;
- материал для исследования добавляется в лунки готовых наборов, после чего возникает реакция антиген-антитело;
- оставшаяся сыворотка крови убирается, а обнаруженные антитела распознаются при помощи индикаторов.
Иммуноферментный анализ сыворотки крови считается достоверным. Но в тех случаях, когда произошло неправильное взятие крови для анализа, или была нарушена техника проведения исследования, или же имеются у человека скрытые системные заболевания, результаты иммуноферментного анализа сыворотки крови могут оказаться ложными.
Иммуноферментный анализ сыворотки крови исследует практически все гормоны щитовидной железы, онкомаркеры и различные виды инфекций.
К гормонам щитовидной железы относятся тиреоглобулин (ТГ), тироксин (Т4), трийодтиронин (Т3), свободный тироксин (Т4), свободный трийодтиронин (Т3).
Иммуноферментный анализ крови в норме считается, если присущи такие допустимые нормы гормонов щитовидной железы:
- тиреоглобулин (ТГ) – допустимые границы 70 МЕ/мл;
- тироксин (Т4) – 64-146 нмоль/л (50-113 нг/мл);
- трийодтиронин (Т3) – 1,8-2,8 нмоль/л (0,8-2,0 нг/мл);
- свободный тироксин (Т4) – 11-25 пмоль/л (10-27 пг/мл);
- свободный трийодтиронин (Т3) – 4,49-9,3 пмоль/л (2,5-5,8 пг/мл).
В случае исследования половых гормонов иммуноферментный анализ крови в нормедля женщин считается, если в организме выделяется лютеинизирующий гормон (ЛГ) в таких пределах:
- фолликулярная фаза цикла (с первого дня месячных до двенадцатого-четырнадцатого) – 2-14 мЕд/л;
- овуляционная фаза цикла (с двенадцатого дня по четырнадцатый день) – 24-150 мЕд/л;
- лютеиновая фаза цикла (с пятнадцатого-шестнадцатого дня и до начала следующих месячных) – 2-17 мЕд/л.
В норме для мужчин принимается, если половой гормон вырабатывается в пределах 0,5-10 мЕд/л.
При исследовании хронического гонадотропина (ХГ) референсные значения зависят от пола человека.
- У взрослых мужчин и небеременных женщин нормой считается уровень ХГ ниже 5мЕд/мл.
- У беременных женщин результат зависит от срока беременности и может колебаться в пределах 25-49000 мЕд/мл.
Иммуноферментный анализ крови исследует множество онкологических показателей. К ним можно отнести наличие пролактина, эстрадиола, прогестерона, тестостерона, стероид связывающего глобулина (ССГ) и других маркеров. Но интерпретация результата анализа и норм этих показателей должна проводиться только лечащим врачом.
Кроме того, данный метод диагностирует инфекционные (например, краснуха, корь, туберкулез, герпес, сифилис, гепатит, псевдотуберкулез) и аутоиммунные заболевания разного вида, а также устанавливает иммунный статус человека. Но все показатели и полученные результаты должны расшифровываться квалифицированным специалистом.
источник
Иммуноферментный анализ (ИФА) — это лабораторное исследование, основанное на реакции «антиген-антитело». Суть этого лабораторного метода — выявление специфических антител с помощью специальных биохимических реакций, которые помогают определить присутствие или отсутствие антител и их количество.
Методом ИФА можно определить уровень гормонов, иммуноглобулинов, иммунологических комплексов и других биологически активных веществ. Материалом для исследования может служить кровь (ИФА крови), спинномозговая жидкость, содержимое стекловидного тела, околоплодные воды и т.д.
- высокая чувствительность, которая, составляющая 90%;
- стабильность при хранении всех ингредиентов, необходимых для проведения ИФА (год и более);
- быстрота и удобство проведения диагностической реакции;
- возможность использовать минимальные объемы исследуемого материала;
- возможность автоматизации всех этапов проведения реакции;
- небольшая стоимость диагностических наборов;
- возможность ранней диагностики инфекции;
- унифицированность и пригодность для массовых обследований;
- легкость в отслеживании динамики развития процесса инфекционного заболевания.
Недостаток — относясь к непрямым методам диагностики, он позволяет определить иммунный ответ организма на возбудителя, а не самого возбудителя.
Метод иммуноферментного анализа используется для определения наличия антигенов возбудителей различных инфекций и для определения наличия антител классов (IgA, IgM, IgG) к антигенам различных возбудителей (вирусные гепатиты, ВИЧ, сифилис, TORCH, хламидиозы, паразитозы). С помощью ИФА можно определить антитела к любой инфекции, при условии, конечно, что организм их выработал. Этот метод позволяет различать острые и хронические формы заболеваний, выделять стадию заболеваний и выявлять практически здоровых носителей и контролировать вакцинацию. Необходимо заметить, что наличие антител в сыворотке крови или в патологическом материале может свидетельствовать лишь о контакте организма с возбудителем в настоящее время или в прошлом.
Для постановки диагноза, ИФА диагностики, используют лабораторные тесты для идентификации возбудителя, инструментальные методы обследования и клиническую диагностику (клинический опыт врача). Естественно, что только по наличию тех или иных антител не может быть поставлен достоверный диагноз заболевания. Необходимо одновременно выявлять антитела к возбудителю методом ИФА и выявлять возбудителя методом ПЦР (полимеразная цепная реакция) или другими методами.
| Название исследования | Клинический материал | Результат | Срок испол. | Цена | ||
| СЕРОЛОГИЧЕСКИЕ МАРКЕРЫ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ | ||||||
| Гепатит А | ||||||
| anti-HAV IgG | кровь (сыворотка) | кач. | 2 р.д. | 320,00р. | ||
| anti-HAV IgM | кровь (сыворотка) | кач. | 2 р.д. | 320,00р. | ||
| Гепатит В | ||||||
| HBsAg | кровь (сыворотка) | кач. | 2 р.д. | 200,00р. | ||
| anti-HBs | кровь (сыворотка) | кач. | 2 р.д. | 340,00р. | ||
| anti-HBs | кровь (сыворотка) | кол. | 2 р.д. | 520,00р. | ||
| anti-HBc IgM | кровь (сыворотка) | кач. | 2 р.д. | 560,00р. | ||
| HBeAg | кровь (сыворотка) | кач. | 2 р.д. | 440,00р. | ||
| anti-HBe | кровь (сыворотка) | кач. | 2 р.д. | 390,00р. | ||
| HBsAg (количественный метод) | кровь (сыворотка) | кол. | 2 р.д. | 1 370,00р. | ||
| anti-HBc (суммарное) | кровь (сыворотка) | кач. | 2 р.д. | 340,00р. | ||
| Гепатит С | ||||||
| anti-HCV IgM | кровь (сыворотка) | кач. | 2 р.д. | 360,00р. | ||
| anti-HCV (суммарное) | кровь (сыворотка) | кач. | 1 р.д. | 340,00р. | ||
| Гепатит D | ||||||
| anti-HDV | кровь (сыворотка) | кач. | 2 р.д. | 320,00р. | ||
| anti-HDV IgM | кровь (сыворотка) | кач. | 2 р.д. | 320,00р. | ||
| Гепатит Е | ||||||
| anti-HEV IgG | кровь (сыворотка) | кач. | 2 р.д. | 420,00р. | ||
| anti-HEV IgМ | кровь (сыворотка) | кач. | 2 р.д. | 530,00р. | ||
| Сифилис | ||||||
| Syphilis RPR (RW) | кровь (сыворотка) | кач. | 1 р.д. | 220,00р. | ||
| Syphilis TPHA (РПГА) | кровь (сыворотка) | кач. | 1 р.д. | 290,00р. | ||
| Syphilis TPHA (РПГА) | кровь (сыворотка) | п.кол. | 1 р.д. | 340,00р. | ||
| anti-Treponema pallidum (суммарные) | кровь (сыворотка) | кач. | 2 р.д. | 570,00р. | ||
| ВИЧ | ||||||
| anti-HIV 1/2 | кровь (сыворотка) | кач. | 1 р.д. | 420,00р. | ||
| Вирус простого герпеса | ||||||
| anti-HSV 1 типа IgG | кровь (сыворотка) | кол. | 2 р.д. | 410,00р. | ||
| anti-HSV 2 типа IgG | кровь (сыворотка) | кол. | 2 р.д. | 410,00р. | ||
| anti-HSV 1,2 типа IgG | кровь (сыворотка) | кач. | 2 р.д. | 470,00р. | ||
| anti-HSV 1,2 типа IgM | кровь (сыворотка) | кач. | 2 р.д. | 470,00р. | ||
| Цитомегаловирус | ||||||
| anti-CMV IgG | кровь (сыворотка) | кол. | 2 р.д. | 500,00р. | ||
| anti-CMV IgM | кровь (сыворотка) | кач. | 2 р.д. | 410,00р. | ||
| CMV IgG (авидность) | кровь (сыворотка) | кач. | 3 р.д. | 790,00р. | ||
| Вирус краснухи | ||||||
| anti-Rubella IgG | кровь (сыворотка) | кол. | 2 р.д. | 440,00р. | ||
| anti-Rubella IgM | кровь (сыворотка) | кач. | 2 р.д. | 410,00р. | ||
| Rubella IgG (авидность) | кровь (сыворотка) | кол. | 3 р.д. | 800,00р. | ||
| Вирус кори | ||||||
| anti-Measles virus IgG | кровь (сыворотка) | кач. | 2 р.д. | 520,00р. | ||
| anti-Measles virus IgM | кровь (сыворотка) | кач. | 2 р.д. | 520,00р. | ||
| Вирус паротита | ||||||
| anti-Mumps IgG | кровь (сыворотка) | кач. | 2 р.д. | 550,00р. | ||
| anti-Mumps IgM | кровь (сыворотка) | кач. | 2 р.д. | 550,00р. | ||
| Вирус Эпштейна- Барр | ||||||
| anti-EBV-VCA IgG | кровь (сыворотка) | кач. | 2 р.д. | 530,00р. | ||
| anti-EBV-VCA IgM | кровь (сыворотка) | кач. | 2 р.д. | 530,00р. | ||
| anti-EBV-EBNA IgG | кровь (сыворотка) | кач. | 2 р.д. | 530,00р. | ||
| anti-EBV-EA IgG | кровь (сыворотка) | кол. | 2 р.д. | 530,00р. | ||
| Хеликобактер | ||||||
| anti-Helicobacter pylori IgA | кровь (сыворотка) | кач. | 2 р.д. | 530,00р. | ||
| anti-Helicobacter pylori IgG | кровь (сыворотка) | кол. | 2 р.д. | 530,00р. | ||
| Хламидии | ||||||
| anti-Chlamydia trachomatis IgG | кровь (сыворотка) | п.кол. | 2 р.д. | 440,00р. | ||
| anti-Chlamydia trachomatis IgA | кровь (сыворотка) | п.кол. | 2 р.д. | 440,00р. | ||
| anti-Chlamydia pneumonia IgG | кровь (сыворотка) | кач. | 2 р.д. | 440,00р. | ||
| anti-Chlamydia pneumonia IgA | кровь (сыворотка) | кач. | 2 р.д. | 440,00р. | ||
| anti-Chlamydia trachomatis IgМ | кровь (сыворотка) | кач. | 2 р.д. | 440,00р. | ||
| anti-Chlamydia pneumonia IgМ | кровь (сыворотка) | кач. | 2 р.д. | 440,00р. | ||
| Микоплазмы | ||||||
| anti-Mycoplasma hominis IgG | кровь (сыворотка) | кач. | 2 р.д. | 310,00р. | ||
| anti-Mycoplasma hominis IgM | кровь (сыворотка) | кач. | 2 р.д. | 310,00р. | ||
| anti-Mycoplasma hominis IgА | кровь (сыворотка) | кач. | 2 р.д. | 310,00р. | ||
| anti-Mycoplasma pneumonia IgG | кровь (сыворотка) | кол. | 2 р.д. | 310,00р. | ||
| anti-Mycoplasma pneumonia IgA | кровь (сыворотка) | кол. | 2 р.д. | 310,00р. | ||
| anti-Mycoplasma pneumonia IgM | кровь (сыворотка) | кач. | 2 р.д. | 310,00р. | ||
| Токсоплазмы | ||||||
| anti-Toxo gondii IgG | кровь (сыворотка) | кол. | 2 р.д. | 480,00р. | ||
| anti-Toxo gondii IgM | кровь (сыворотка) | кач. | 2 р.д. | 480,00р. | ||
| Toxo gondii IgG (авидность) | кровь (сыворотка) | кач. | 3 р.д. | 810,00р. | ||
| Лямблии | ||||||
| anti-Giardia Lamblia(cуммарные) | кровь (сыворотка) | кач. | 2 р.д. | 320,00р. | ||
| anti-Giardia Lamblia IgM | кровь (сыворотка) | кач. | 2 р.д. | 320,00р. | ||
| Гельминты | ||||||
| антитела к описторхам | кровь (сыворотка) | кач. | 2 р.д. | 280,00р. | ||
| антитела к эхинококку | кровь (сыворотка) | кач. | 2 р.д. | 280,00р. | ||
| антитела к токсокарам | кровь (сыворотка) | кач. | 2 р.д. | 280,00р. | ||
| антитела к трихинеллам | кровь (сыворотка) | кач. | 2 р.д. | 280,00р. | ||
| антитела к аскаридам IgG | кровь (сыворотка) | кач. | 2-4 р.д. | 610,00р. | ||
| Уреаплазмы | ||||||
| anti-Ureaplasma urealyticum IgG | кровь (сыворотка) | кач. | 2 р.д. | 310,00р. | ||
| anti-Ureaplasma urealyticum IgА | кровь (сыворотка) | кач. | 2 р.д. | 310,00р. | ||
| anti-Ureaplasma urealyticum IgМ | кровь (сыворотка) | кач. | 2 р.д. | 310,00р. | ||
| Вирус герпеса VI типа | ||||||
| anti-HHV IgG | кровь (сыворотка) | кач. | 4 р.д. | 610,00р. | ||
| Парвовирус В19 | ||||||
| anti-В19 IgG | кровь (сыворотка) | п.кол. | 2-4 р.д. | 820,00р. | ||
| anti-В19 IgM | кровь (сыворотка) | кач. | 2-4 р.д. | 890,00р. | ||
| Вирус ветряной оспы (VZV) | ||||||
| anti-VZV IgG | кровь (сыворотка) | п.кол. | 2 р.д. | 610,00р. | ||
| anti-VZV IgM | кровь (сыворотка) | кач. | 2 р.д. | 610,00р. | ||
| Диагностика кандидоза и аспергиллеза | ||||||
| Антитела к Candida IgG | кровь (сыворотка) | кач. | 2 р.д. | 520,00р. | ||
| Антитела к Aspergilius IgG | кровь (сыворотка) | кач. | 2 р.д. | 520,00р. | ||
| Вирус клещевого энцефалита | ||||||
| Антитела к вирусу клещевого энцефалита IgG | кровь (сыворотка) | кол. | 1-4 р.д. | 630,00р. | ||
| Антитела к вирусу клещевого энцефалита IgМ | кровь (сыворотка) | п.кол. | 1-4 р.д. | 700,00р. | ||
| Вирус Денге | ||||||
| Антитела к вирусу Денге, IgG | кровь (сыворотка) | кол | 4 р.д. | 2210,00р. | ||
| Антитела к вирусу Денге, IgМ | кровь (сыворотка) | п.кол. | 4 р.д. | 2210,00р. | ||
| Коклюш | ||||||
| Антитела к Bordetella pertussis IgG | кровь (сыворотка) | кол. | 2 р.д. | 610,00р. | ||
| Антитела к Bordetella pertussis IgМ | кровь (сыворотка) | кач. | 2 р.д. | 610,00р. | ||
| Антитела к Bordetella pertussis IgА | кровь (сыворотка) | кач. | 2 р.д. | 610,00р. | ||
| Вирус Западного Нила | ||||||
| anti-WNV IgM | кровь (сыворотка) | п.кол. | 4 р.д. | 2210,00р. | ||
| anti-WNV IgG | кровь (сыворотка) | п.кол. | 4 р.д. | 2210,00р. | ||
| Боррелии | ||||||
| anti-Borrelia, IgM | кровь (сыворотка) | п.кол. | 1-4 р.д. | 770,00р. | ||
| anti-Borrelia, IgG | кровь (сыворотка) | кол. | 1-4 р.д. | 770,00р. | ||
| Легионеллы | ||||||
| Ag Legionella pneumophila серогруппы 1 | моча | кач. | 2-5 р.д | 610,00р. | ||
р.д. — рабочий день, кол. — количественный, кач. — качественный, п.кол — полуколичественный
* Исследование в режиме CITO:
— поступление биологического материала до 14.00 — выдача результатов исследований после 19.00 в тот же день по факсу или электронной почте;
— поступление биологического материала после 14.00 — выдача результатов исследований до 13.00 следующего дня по факсу или электронной почте.
источник
5.1 Сущность и классификация ИФА.
ИФА появился в середине 60-х годов и первоначально был разработан как метод для индификации антигена в гистологическом препарате, а также для визуализации линий преципитации в тесте иммунодиффузии и иммуноэлектрофореза, а затем стал использоваться для количественного определения антигенов и антител в биологических жидкостях. В разработке метода принимали участие Е.Энгвалл и Р.Пэлман, а также независимо от них В. Ван Вееман и Р.Шурс.
Рис. 6 Основной принцип ИФА:
для выявления антигенов; 2) для выявления антител
Метод основан на специфическом связывании антитела с антигеном, при этом один из компонентов конъюгирован с ферментом, в результатереакции с соответствующим хромогенным субстратом образовывается окрашенный продукт, количество которого можно определить спектрофотометрически (рис. 6).
Открытие возможности иммобилизации антигена и антитела на различных носителях с сохранением их связывающей активности позволило расширить использование ИФА в различных областях биологии и медицины.
Появление моноклональных антител послужило дальнейшему развитию ИФА, что позволило повысить его чувствительность, специфичность и воспроизводимость результатов.
Теоретически ИФА основывается на данных современной иммунохимии и химической энзимологии, знании физико-химических закономерностей реакции антиген-антитело, а также на главных принципах аналитической химии. Чувствительность ИФА и время его проведения определяется несколькими основными факторами: кинетическими, термодинамическими характеристиками реакции антиген-антитело, соотношением реагентов, активностью фермента и разрешающей способностью методов его детекции. В общем виде реакция антиген-антитело может быть описана простой схемой:
Разнообразие объектов исследования от низкомолекулярных соединений до вирусов и бактерий, а также необычайно широкий круг задач, связанных с многообразием условий применения ИФА, обусловливают разработку чрезвычайно большого количество вариантов этого метода.
Любой вариант ИФА содержит 3 обязательные стадии:
1. стадия узнавания тестируемого соединения специфическим к нему антителом, что ведет к образованию иммунного комплекса;
2. стадия формирования связи конъюгата с иммунным комплексом или со свободными местами связывания;
3. стадия превращения ферментной метки в регистрируемый сигнал. В основу классификации методов ИФА положено несколько подходов:
1. По типу реагентов, присутствующих на первой стадии ИФА, различают конкурентный и неконкурентный методы.
А) В конкурентном ИФА на первой стадии в системе присутствуют одновременно анализируемое соединение и его аналог, меченный ферментном и конкурирующий за центры специфического связывания с ним.
Б) Для неконкурентных методов характерно присутствие в системе на первой стадии только анализируемого соединения и специфичных к нему центров связывания.
2. Все методы ИФА делются на гомогенные и гетерогенные.
Если все три стадии ИФА проходят в растворе и между основными стадиями нет дополнительных этапов разделения образовавшихся иммунных комплексов от непрореагировавших компонентов, метод относится к группе гомогенных.
В основе гомогенного ИФА, применяемого, как правило, для определения низкомолекулярных субстанций, лежит ингибирования активности фермента при его соединении с антигеном или антителом. Активность фермента восстанавливается в результате реакции антиген-антитело.
При связывании антитела с антигеном, содержащим ферментную метку, происходит ингибирование активности фермента на 95% по отношению к высокомолекулярному субстрату, что обусловлено стерическим исключением субстрата из активного центра фермента. По мере увеличения концентрации антигена связывается все больше антител и сохраняется все больше свободных конъюгатов антиген-фермент, способных гидролизовать высокомолекулярный субстрат. Анализ проводят очень быстро, для одного определения требуется 1 минута. Чувствительность метода достаточно высока. С его помощью можно определить вещество на уровне пикомолей.
Для гетерогенных методом характерно проведение анализа в двухфазной системе с участием твердой фазы – носителя, и обязательная стадия разделения иммунных комплексов от непрореагировавших компонентов (отмывка), которые находятся в разных фазах (образовавшиеся иммунные комплексы находятся на твердой фазе, а непрореагировавшие комплексы – в растворе). Гетерогенные методы, в которых формирование иммунных комплексов на первой стадии протекает на твердой фазе, называют твердофазными методами.
Методы относятся к гомогенно- гетерогенным, если 1 стадия – образование специфических комплексов происходит в растворе, а затем для разделения компонентов используют твердую фазу с иммобилизированным реагентом.
3. По принципу определения тестируемого вещества:
А) Прямое определение концентрации вещества (антигена или антитела) по числу провзаимодействующих с ним центров связывания. В этом случае ферментная метка будет находиться в образовавшемся специфическом комплексе АГ-АТ. Концентрация определяемого вещества будет прямо пропорциональна регистрируемому сигналу.
Б) Определение концентрации вещества по разности общего числа мест связывания и оставшихся свободными центров связывания. Концентрация определяемого вещества при этом будет возрастать, а регистрируемый сигнал снижаться, следовательно, в данном случае прослеживается обратная зависимость от величины регистрируемого сигнала.
5.2 Характеристика компонентов, используемых в ИФА.
Ферментные метки обладают чрезвычайно мощьным каталитическим действием, одна молекула фермента может реагировать с большим количеством молекул субстрата. Таким образом, фермент, присутствующий в ничтожных количествах, можно выявить и количественно определить по образованию продуктов, катализируемой им реакции. Другое преимущество применения ферментов в качестве меток обусловлено наличием в молекуле многочисленных функциональных групп (сульфгидрильных, карбоксильных, остатков тиразина и др.), через которые можно ковалентно присоединить молекулы лиганда.
Ферментные маркеры, используемые в ИФА, должны обладать следующими свойствами:
– высокая активность и стабильность фермента в условиях анализа, при модификации и в конъюгате с антителами или другими белками;
– наличие чувствительных субстратов и простота метода определения продуктов или субстратов ферментативной реакции;
– возможность адаптации субстратных систем к дальнейшему усилению;
– отсутствие фермента и его ингибиторов в исследуемой биологической жидкости.
В ИФА может использоваться не менее 15 различных ферментов. Наибольшее применение, в соответствии с вышеназванными требованиями, нашли пероксидаза хрена (ПХ), щелочная фосфотаза (ЩФ) и β-D-галактозидаза. Все три стабильны и катализируют высокочувствительные реакции. Кроме того, продукты, получаемые в результате реакций, катализируемых этими ферментами, в зависимости от используемого субстрата, могут выявляться не только колориметрическими методами, но также флуоресцентными методами. Другие ферменты используются значительно реже. Это объясняется их более низкой в сравнении с ПХ и ЩФ удельной активностью.
Выбор субстрата в первую очередь определяется используемым в качестве метки ферментом, так как реакция фермент-субстрат высоко специфична.
Основные требования к субстрату:
– обеспечение высокой чувствительности метода при выявлении фермента в конъюгате;
– образование хорошо учитываемых (например, окрашенных) продуктов реакции фермент-субстрат;
– субстрат должен быть безопасным, дешевым, доступным и удобным для применения.
Чаще используют хромогенные субстраты, которые, разрушаясь, образуют окрашенное вещество. Перспективным является использование высокоэнергетических субстратов – флуоресцентных, хемипюминесцентных. Применение таких субстратов позволяет теоретически повысить чувствительность ИФА на два порядка.
Конъюгат – это антиген или антитело, меченные ферментной меткой. Образование коньюгата – один из важных этапов проведения ИФА.
При формировании конъюгата подбирают такой оптимальный метод введения ферментной метки, чтобы оба компонента конъюгата сохраняли свою биологическую активность: фермент — способность взаимодействовать с субстратом, а антиген или антитело — антигенность и антигенсвязывающую активность, соответственно. Наличие меченого, высокоочищенного антигена позволяет использовать конкурентные методы. В этом случае на конечном этапе можно измерять активность конъюгата, не связанного с иммобилизованными антителами, что позволяет избежать процедуры отмывки и делает анализ более удобным. Однако антигены разнообразны по своим физико-химическим свойствам и строению, а значит невозможно разработать универсальные методики для получения конъюгата с антигеном. В этом случае получение конъюгата антигена с ферментом представляет собой отдельную сложную задачу. Приготовление меченых антител для ИФА методически более доступно.
Конъюгирование фермента с иммунохимически активными белками производится различными методами: химическая сшивка, ковалентное связывание молекулы фермента с АГ или AT и образование соединений через нековалентные связи, например, когда связь между ферментом и АГ или AT осуществляется иммунологически, через взаимодействие антиген-антитело.
Наиболее широкое распространение получили ковалентные способы приготовления конъюгатов. Выбор реакции связывания определяется типом доступных функциональных групп в данных белковых молекулах. В качестве реагентов, используемых для введения фермента в молекулы антигенов и антител, используют глутаровый альдегид, периодат натрия и др.
Существует одноэтапный и двухэтапный методы получения конъюгатов с помощью глутарового альдегида. Могут образовываться конъюгаты различных размеров с редуцированной ферментативной активностью (15 — 60 % от свободного фермента). Образовавшийся конъюгат больших размеров может стерически затруднять определение тестируемого вещества. Конъюгаты с относительно низкой молекулярной массой состоят из Fab-фрагмента и одной молекулы фермента.
В результате двухэтапного синтеза, который заключается в поэтапном получении сначала модифицированного с помощью сшивающего агента фермента, его выделении, а затем последующем взаимодействии его с антигеном (антителом), образуются молекулы однородного состава, содержащие 1-2 молекулы фермента на молекулу иммуноглобулина и сохраняющие высокую ферментативную и иммунологическую активность. Однако количество таких образовавшихся конъюгатов невелико (для пероксидазы хрена составляет 5 — 10 %).
Наибольшее практическое применение нашел метод получения иммунопероксидазных конъюгатов, основанный на окислении углеводного компонента фермента периодатом натрия (связывание пероксидазы в конъюгат достигает 70-90 % от начального количества фермента).
Надежный конъюгат должен обладать следующими свойствами:
— высоким антительным тигром и высокой афинностью к антигену, чтобы его можно было использовать в большом разведении, и таким образом, уменьшить неспецифическое связывание;
— достаточной специфичностью в рабочем разведении;
— преобладанием мономерных форм над полимерными, т.к. полимерные формы имеют тенденцию к неспецифической адгезии на пластике, что приводит к высокому фоновому уровню реакции;
— оптимальным молярным соотношением между ферментом и антителами (оптимальное соотношение составляет около 1:1);
— достаточной ферментативной активностью конъюгата. Это свойство определяется главным образом условиями конъюгации и соотношением молекул фермента и антител в конъюгате.
5.3 Гетерогенные методы ИФА.
Гетерогенные ИФА (или твердофазные ИФА) включают методы, в которых анализируемое соединение находится в двух фазах. Для разделения компонентов иммунохимической реакции используют твердую фазу (нерастворимый носитель, как правило, пластик) с иммобилизованными на ней антителами или антигеном, которую отмывают на каждой стадии с целью удаления промежуточных продукто непрореагировавших компонентов.
Иммобилизацию можно проводить путем ковалентного связывания антител (антигенов) с активированным носителем, используя химические подходы, а также путем физической адсорбции антител (антигенов) на поверхности твердых полимеров (например, полистирольных пластин). В зарубежной литературе это направление получило название ELISA-тест или энзимсвязанный иммуносорбентный метод (от англ. enzyme-linked immunosorbent assay).
Неконкурентный ИФА определения антигенов на примере использования меченых ферментом специфических антител и иммобилизованных антител.
К носителю с иммобилизованными антителами добавляют раствор, содержащий анализируемый антиген. В процессе инкубации образуется специфический комплекс антиген-антитело. Затем носитель отмывают от несвязавшихся антигенов и добавляют меченые антитела – конъюгат. При этом количество связавшегося конъюгата прямо пропорционально количеству антигена в исследуемом образце. После вторичной инкубации и удаления избытка конъюгата добавляют хромогенный субстрат для используемого фермента, который изменяет цвет под действием фермента, т. е. происходит ферментативная реакция с окрашиванием раствора в лунках. Степень окраски прямо пропорциональна количеству меченых ферментом специфических антител, фермента и, соответственно, исследуемого антигена. Измерения оптической плотности раствора в лунках при определенной волне (в зависимости от используемого субстрата) проводят с помощью специальных спектрофотометров, адаптированных для микропланшетов – ридеров. Количественную оценку концентрации антигена в пробе определяют, сравнивая результаты с калибровочной кривой зависимости оптической плотности раствора от концентрации стандартного раствора антигена.
Поскольку на стадии выявления специфического иммунокомплекса антиген оказывается связанным с молекулами иммобилизованных и меченых антител, в литературе этот метод часто называют «сэндвич»-метод (от англ. sandvich) или двухцентровый метод ИФА (от англ. two-site assay).
Этот метод может быть использован для анализа только тех антигенов, на поверхности которых имеется, по крайней мере, две антигенные детерминанты. Для анализа большого количества моновалентных антигенов (лекарственных соединений, пестицидов и др.) он неприемлем.
Основное достоинство данного метода – высокая чувствительность. Предел обнаружения соединений данным методом в настоящее время достигает величины порядка 10-21 моль, что соответствует обнаружению в образце всего 600 молекул анализируемого вещества. Максимальная чувствительность достигается при проведении каждой иммунологической реакции в равновесном режиме, что сказывается на длительности проведения анализа, которая в среднем составляет 4 – 6 часов. Неконкурентный ИФА определения антител на примере использования меченых ферментом вторичных антител и иммобилизованных антигенов.
К иммобилизованному антигену добавляют исследуемую сыворотку. После инкубации и отмывания от несвязавшихся антител добавляют меченые вторичные антитела, которые специфичны к анализируемым антителам. После вторичной инкубации и удаления избытка меченых вторичных антител содержание ферментной метки на носителе пропорционально концентрации специфических антител в сыворотки.
Данная схема является одной из наиболее распространенных ИФА определения антител, поскольку позволяет выявлять антитела к разным антигенам.
Гетерогенный конкурентный ИФА определения антигена на примере использования меченого антигена и иммобилизованных антител.
К иммобилизованным на носителе антителам добавляют раствор, содержащий анализируемый антиген и фиксированную концентрацию конъюгата антигена с ферментом. После проведения инкубации носитель отмывают от несвязавшихся свободного и меченого антигена и регистрируют ферментативную активность на носителе, которая обратно пропорциональна концентрации определяемого антигена.
Гомогенный иммуноферментный анализ (ГИФА) — наиболее простой в методическом отношении вид ИФА. При его постановке один из участников иммунной реакции (обычно это низкомолекулярный антиген) метится ферментом и за ходом формирования комплекса антиген-антитело следят, регистрируя изменение активности фермента.
Такое нарушение ферментативной активности может возникать либо за счет пространственного разобщения фермента и субстрата, либо за счет конформационных изменений в молекуле фермента, сопровождающих формирование иммунного комплекса. ГИФА имеет ряд существенных преимуществ перед другими иммунохимическими методами. Во-первых, высокая экспрессия (весь анализ с помощью ГИФА , занимает минуты и даже доли минут).
Рис.8 Варианты гомогенного иммуноферментного анализа(А- эффект разобщения фермента (Ф) и субстрата (С) за счет стерических препятствий при взаимодействии антигена (Аг) и антитела (Ат); Б- эффект изменения конформации фермента при формировании комплекса антиген- антитело).
Во-вторых, метод имеет одну стадию и не требует трудоемких и требующих времени этапов промывки. И наконец, в-третьих, метод требует минимальных объемов (8-50 мкл) и количеств биологического или клинического образца. Однако у метода ГИФА имеется один крайне существенный недостаток — на его основе можно создавать диагностические тест-системы только для низкомолекулярных антигенов. Только, в этом случае антитело, взаимодействуя с антигеном, может эффективно экранировать или модифицировать связанную с этим антигеном молекулу фермента. Именно в связи с этим, ( несмотря на кажущуюся простоту и очевидные преимущества перед другими методами, на основе ГИФА были созданы диагностикумы для выявления только гормонов, пептидов, лекарственных и наркотических веществ и некоторых низкомолекулярных белков.
5.5 «Сэндвич» — вариант ИФА для выявления антигенов.
Антигены, определяемые с помощью данного варианта ИФА, должны иметь несколько эпитопов, способных связывать антитела, или обладать повторяющимися, пространственно разделенными эпитопами одинаковой специфичности.
При проведении этого варианта ИФА высокоспецифичные поли- или моноклональные антитела, адсорбированные на твердой фазе, инкубируют с исследуемым образцом. После процедуры отмывания в лунки вносят меченные ферментом антитела (конъюгат) к тому же антигену и далее проводят все остальные этапы реакции. Эффективность образования специфического комплекса на каждой стадии анализа зависит от константы связывания реакции антиген-антитело.
источник
Иммуноферментный анализ — лабораторный иммунологический метод качественного определения и количественного измерения антигенов и антител. Различают несколько десятков модификаций ИФА. Наибольшее распространение получил твердофазный гетерогенный иммунный анализ — ELISA (enzyme linked immunosorbent assay).
В основе метода иммуноферментного анализа (ИФА) лежит принцип специфического взаимодействия между антигеном и соответствующим ему антителом. Выявление образовавшегося комплекса проводят с использованием так называемого конъюгата, который представляет собой анти-антитело, соединённое с ферментной меткой (обычно используют пероксидазу хрена либо другие пероксидазы).
Конъюгат может быть получен с использованием поликлональных антивидовых антител (например, кроличьи антитела против иммуноглобулинов человека) или моноклональных антител, направленных против человеческих иммуноглобулинов определённого класса (M, G, А).
В зависимости от того, какие антитела использованы, тест-система будет выявлять в исследуемом образце или специфические антитела независимо от их класса, или антитела лишь определённого класса (например, только иммуноглобулин G или только иммуноглобулин M).
Методы иммуноферментного анализа. Первичным процессом в иммуноферментном (или иммунохимическом) анализе является стадия «узнавания» анализируемого соединения специфическим к нему антителом. Так как процесс образования иммунохимических комплексов происходит в строго количественном соотношении, обусловленном аффинностью, концентрациями компонентов и условиями реакции, то достаточным для определения исходной концентрации анализируемого соединения является количественная оценка образовавшихся иммунных комплексов. Для такой оценки возможно либо прямое определение концентрации образующихся иммунокомплексов (тип 1), либо количественная оценка оставшихся свободными мест специфического связывания (тип 2). Второй общей стадией любого метода иммуноферментного анализа является формирование связи меченного ферментом соединения со специфическим комплексом или свободными центрами связывания. И наконец, заключительным обязательным процессом в иммуноферментном анализе является трансформация ферментной метки в соответствующий сигнал, измеряемый каким-либо физико-химическим методом (спектрофотометрическим, флуориметрическим, люминесцентным и т.д.), что достигается путем измерения скорости превращения субстрата или количества продукта, образующегося за фиксированный промежуток времени.
Принимая во внимание вышеописанные подходы для определения специфических комплексов, дальнейшую классификацию методов иммуноферментного анализа, можно осуществить по типу реагентов, используемых на первой стадии анализа. Если на первой стадии в системе присутствуют только анализируемоле соединение и соответствующие ему центры связывания (антиген и специфические анатитела), то метод является неконкурентным. Для неконкурентного анализа типа 1 оптимальным является соотношение компонентов, при котором концентрация центров связывания значительно превышает концентрацию определяемого соединения. Необходимым условием для неконкурентного анализа типа 2 является соблюдение соотношения избытка или сравнимой концентрации определяемого соединения (антигена) и мест специфического связывания, так как в этом случае определяется разность общего числа мест связывания и числа образовавшихся иммунных комплексов. Если на первой стадии анализа в системе одновременно присутствуют анализируемое соединение и его аналог (меченное ферментом анализируемое соединение или анализируемое соединение, иммобилизованное на твердой фазе), конкурирующие за имеющиеся в относительном недостатке центры специфического связывания, то метод является конкурентным. Необходимым условием конкурентного метода является недостаток центров специфического связывания по отношению к суммарной концентрации анализируемого соединения и его аналога.
Следующим принципом классификации методов иммуноферментного анализа является их разделение по типу проводимых на каждой из иммунохимических стадий реакций. В соответствии с этим все методы можно разделить на две группы – гомогенные и гетерогенные.
Гетерогенные методы иммуноферментного анализа.Гетерогенный иммуноферментный анализ объединяет методы, в которых анализ проводится в двухфазной системе, при этом разделение на фазы может происходить на любой стадии определения. В целях удобства классификации целесообразно проводить разделение гетерогенных методов по характеру проведения первой стадии «узнавания», которая является определяющей для всего анализа. Если на первой стадии антиген или антитело используют в иммобилизованном состоянии и формирование специфического иммунокомплекса проходит на твердой фазе, то метод относится к твердофазным (англ. solid phase assay). Если же на первой стадии анализа образование специфических иммунных комплексов происходит в растворе, а лишь затем для целей разделения используют твердую фазу с иммобилизованным реагентом, то такие методы целесообразно классифицировать как гомогенно-гетерогенные.
Многообразие методов гетерогенного иммуноферментного анализа, относящихся к типам 1 и 2, обусловлено возможностью введения ферментной метки как в молекулу антигена, так и молекулу антитела. Кроме того, для конкретной схемы анализа определяющим является, какой из реагентов – антитело или антиген, использован в иммобилизованном виде для разделения иммунохимических комплексов от несвязавшихся компонентов.
В качестве примера гетерогенного неконкурентного метода проведения иммуноферментного анализа приведем одну из самых распространенных схем иммуноферментного анализа белков (поливалентных антиегенов), основанную на использовании пары антител различной антигенной специфичности, одно из которых иммобилизовано на поверхности твердого носителя, а второе конъюгировано с ферментной меткой (например, пероксидазой хрена). Анализ проводят следующим образом. В лунки полистирольного планшета с сорбированными антителами вносят анализируемый образец, инкубируют в течение 1 часа, при этом анализируемый антиген образует вступает в реакцию с антителами и образует иммунокомплекс на поверхности лунок. Планшет отмывают от несвязавшихся компонентов и добавляют меченные ферментом антитела. После вторичной инкубации и удаления избытка конъюгата антител с ферментом определяют ферментативную активность носителя, которая пропорциональна начальной концентрации исследуемого антигена. На стадии выявления специфического иммунокомплекса антиген оказывается как бы зажатым между молекулами иммобилизованных и меченых антител, что послужило поводом для широкого распространения в литературе названия «сэндвич»-метод (англ. sandwich). Часто в литературе встречается и другое название двухцентровой метод (англ. two-site assay). Схема может быть использована для анализа только тех антигенов, на поверхности которых существуют, по крайней мере две расположенные далеко друг от друга антигенные детерминанты, а для определения большого числа моновалентных антигенов (например, низкомолекулярные гормоны, лекарственные соединения, пестициды) метод неприемлем.
Конкурентный твердофазный анализ низкомолекулярных антигенов может быть реализован по следующей схеме. К иммобилизованным на носителе антителам добавляют раствор, содержащий анализируемый антиген и фиксированную концентрацию конъюгата антигена с ферментом. После проведения инкубации носитель отмывают от несвязавшихся свободного и меченого антигена и регистрируют ферментативную активность на носителе, которая обратно пропорциональна концентрации определяемого антигена.
Конкурентные твенрдофазные методы обладают меньшей чувствительностью по сравнению с неконкурентными. Предел обнаружения различных соединений для них ограничен как чувствительностью регистрации ферментной метки, так и аффинностью антител, в то время, как для неконкурентных методов, при отсутствии неспецифических взаимодействий, — только чувствительностью определения фермента. Поэтому для достижения высокой чувствительности анализа конкурентным методом необходимо использовать высокоаффинные антитела.
Гомогенные методы иммуноферментного анализа. К гомогенным относятся методы, осуществляемые в однофазной системе, и не требующие стадии механического разделения образовавшихся комплексов. Во всех схемах проведения гомогенного иммуноферментного анализа регистрируется концентрация не образующегося специфического комплекса антитело-антиген, а оставшихся свободными центров специфического связывания. Однако, в противоположность гетерогенным схемам, наблюдаемая ферментативная активность, соответствующая концентрации незанятых мест специфического связывания, может как уменьшаться, так и увеличиваться, что обусловлено различной природой воздействия связывания лигандов на ферментнативную активность. Введение метки в молекулу антигена является одним из наиболее распространенных подходов в гомогенных методах иммуноферментного анализа. Все гомогенные методы относятся к конкурентным и основаны на одновременном взаимодействии с антителами анализируемого и меченого антигенов. После образования в растворе соответствующего иммунохимического комплекса проводят измерение ферментативной активности, которая пропорциональна концентрации свободного или связанного меченого лиганда.
Одним из распространенных методов является EMIT-анализ (enzyme multiplied immunoassay technique), основанный на изменении активности ферментной метки в конъюгате фермент-антиген при образовании комплекса с антителами, происходящем в результате конформационных перестроек в молекуле фермента или стерическом исключении доступности молекулы субстрата к активному центру фермента при комплексообразовании конъюгата с антителами. Достоинствами гомогенных методов является значительное сокращение времени проведения анализа (несколько минут), недостатками – меньшая чувствительность и возможность влияния состава анализируемого образца на результаты анализа.
Существует несколько методов постановки реакции, однако в настоящее время наиболее часто для выявления специфических антител используются следующая схема (т. н. сэндвич-метод ИФА):
На лунках тест-планшета зафиксирован антиген возбудителя, который инкубируется с испытуемой сывороткой или плазмой крови. При наличии в них специфических антител происходит связывание их с образованием комплекса антиген-антитело.
В дальнейшем, при инкубации этого комплекса с конъюгатом, происходит присоединение анти-антител к имеющимся комплексам антиген-антитело. Ферментативная реакция (цветная реакция) проходит в присутствии перекиси водорода и субстрата, представленного неокрашенным соединением, которое в процессе пероксидазной реакции окисляется до окрашенного продукта реакции на заключительном этапе проведения исследования. Интенсивность окрашивания зависит от количества выявленных специфических антител.
Результат оценивается спектрофотометрически или визуально. По такому принципу построена большое количество тест-систем для иммуноферментной диагностики различных инфекций: ВИЧ-инфекция, вирусные гепатиты, цитомегаловирусная, герпесная, токсоплазменная и другие инфекции.
Для серодиагностики используются 96 луночные полистирольные планшеты, на стенках ячеек которых заранее адсорбируется антиген. Исследуемая сыворотка вносится в ячейку планшета. При этом гомологичные антигену антитела прикрепляются к нему. Не прикрепившиеся антитела удаляются промыванием. Далее в ячейки вносят антитела против иммуноглобулинов (антител) человека, меченные ферментом. Если в исследуемой сыворотке присутствовали определяемые антитела, то они на этом этапе выступят в роли антигенов, с которыми прореагируют меченные антитела. Добавление после промывки хромогенного вещества (красителя) позволит учесть реакцию по развивающемуся окрашиванию в ячейках. Интенсивность окраски при этом пропорциональна количеству фермента, а следовательно количеству антител. При измерении оптическую плотности (ОП) жидкости в ячейке и сравнивании ее с контрольным образцом подсчитывается концентрация антител в единицах объема. Наиболее часто применяется подсчет результатов в единицах оптической плотности. Надо учитывать, что для каждой тест-системы есть свои показатели учета результатов и показатели нормы и патологии на которые надо ориентироваться при интерпретации результатов.
Однако следует отметить, что иммуноферментный анализ может давать и ложные результаты. Ложноположительные могут возникнуть за счет ревматоидного фактора, представляющего собой иммуноглобулин M против собственных иммуноглобулинов G человека; за счёт антител, образующихся при различных системных заболеваниях, нарушениях обмена или приёме лекарственных препаратов; у новорожденных такие ложноположительные реакции могут возникать за счёт образования в организме ребёнка M-антител к иммуноглобулину G матери. Ложноотрицательные результаты реакции обусловлены конкуренцией между иммуноглобулинами М и G, а также техническими ошибками при постановке реакции.
В зависимости от того, какие антигены используются, все иммуноферментные тест-системы для выявления антител подразделяются на:
1. Лизатные — в которых используется смесь нативных антигенов (лизированный или обработанный ультразвуком возбудитель инфекции, полученный в культуре);
2. Рекомбинантные — в которых используются полученные генно-инженерным способом белки-аналоги определенных белковых антигенов возбудителя;
3. Пептидные — использующие химически синтезированные фрагменты белков.
Общее направление развития ИФА-диагностикумов — это направление от лизатных тест-систем, которые принято называть тест-системами первого поколения, к рекомбинантным и пептидным.
Технология получения рекомбинантных белков позволяет получить в достаточно чистом виде аналог любого отдельного антигена.
Для создания высококачественной рекомбинантной тест-системы необходимо из всего антигенного многообразия возбудителя выбрать антигены, которые были бы высокоиммуногенными (то есть, в организме инфицированного человека должны вырабатываться антитела к этим антигенам в достаточно большом количестве) и высокоспецифичными (то есть, характерными лишь для данного возбудителя и не дающими перекрёстных реакций с антителами другой природы).
Кроме того, большое значение имеет качество очистки рекомбинантных белков. В идеальном случае возможно получение рекомбинантной тест-системы практически со 100%-ной специфичностью при высокой чувствительности.
На практике этого не всегда удаётся достичь, однако специфичность лучших рекомбинантных тест-систем приближается к 100 %.
Таким образом, за счёт несомненных преимуществ иммуноферментного анализа: удобства в работе, быстроты, объективности за счет автоматизации учёта результатов, возможности исследования иммуноглобулинов различных классов (что важно для ранней диагностики заболеваний и их прогноза) в настоящее время является одним из основных методов лабораторной диагностики.
В основном в современной венерологии ИФА применяется для диагностики сифилиса (в комплексе с другими реакциями), ВИЧ-инфекции, вирусных гепатитов. Имеет ограниченное значение для диагностики хламидийной инфекции, цитомегаловирусной инфекции и других герпетических инфекций. Метод ИФА используется также для определения антител при различных инфекционных заболеваниях, уровня гормонов, аутоантител и различных маркеров онкологических заболеваний.
20. Радиоиммунный анализ: принципы, вид, основные этапы исследования, приборы. Применение в КДЛ.
Радиоиммунный анализ (РИА), также радиоиммунологический или изотопный иммунологический анализ, (англ. Radioimmunoassay, RIA) — метод количественного определения биологически активных веществ в биологических жидкостях, основанный на конкурентном связывании искомых стабильных и аналогичных им меченных радионуклидом веществ со специфическими связывающими системами (чаще всего с АТ), с последующей детекцией на специальных счетчиках — радиоспектрометрах.
Впервые метод был разработан Соломоном Берсоном и Розалин Сасмен Ялоу в 1950-х годах. С помощью этого метода они изучали клиренс инсулина у больных диабетом. Р. Ялоу получила за это Нобелевскую премию в 1977 году.
Для метки антител или антигенов чаще всего используется изотоп йода 125 I , который имеет период полураспада 60 дней и высокую удельную радиоактивность.
В связи с тем, что меченый антиген добавляют в определенном количестве, можно определить часть вещества, которая связалась с антителами, и часть, оставшуюся несвязанной в результате конкуренции с выявляемым немеченым антигеном. Исследование выполняют in vitro. Для Р. а. выпускают стандартные наборы реагентов, каждый из которых предназначен для определения концентрации какого-либо одного вещества. Исследование проводят в несколько этапов: смешивают биологический материал с реагентами, инкубируют смесь в течение нескольких часов, разделяют свободное и связанное радиоактивное вещество, осуществляют радиометрию проб, рассчитывают результаты. Метод отличается высокой чувствительностью, его можно использовать в диагностике заболеваний сердечно-сосудистой, эндокринный и других систем, для установления причин бесплодия, нарушения развития плода, в онкологии для определения маркеров опухолей и контроля за эффективностью лечения, для определения концентрации в крови иммуноглобулинов, ферментов и лекарственных веществ. В ряде случаев исследования выполняют на фоне нагрузочных функциональных проб (например, определение содержания инсулина в сыворотке крови на фоне пробы на толерантность к глюкозе) либо в динамике (например, определение в крови половых гормонов на протяжении менструального цикла).
Радиоиммунный анализ обладает высокой чувствительностью и специфичностью. Так, например, с помощью коммерческого набора фирмы “ЭББОТТ” — Австрия II-I 125 удается выявлять HBsAg в концентрациях до 0,1 нг/мл. К преимуществам метода можно отнести возможность стандартизации и автоматизации метода с получением ответов в цифровом выражении. Недостатком метода являются ограничения, определяемые режимом работы с радиоактивным материалом, и относительно короткий срок годности диагностического набора, что связано с распадом радиоактивной метки.
Диагностические наборы для выявления различных антигенов вирусов гепатитов А, В и D и антител к ним выпускаются фирмой “Изотоп” (Ташкент) и некоторыми зарубежными фирмами (например, фирмой “ЭББОТТ”). В качестве твердой фазы применяются полистироловые шарики (“ЭББОТТ”) или пробирки (“Изотоп”). Для метки антител или антигенов чаще всего используется изотоп I 125 , который имеет период полураспада 60 дней и высокую удельную радиоактивность. Измерение радиоактивной метки, т. е. излучения, проводится на специальных счетчиках — радиоспектрометрах. Подсчет радиоактивных импульсов как в контрольных, так и исследуемых образцах проводится в единое фиксированное время, обычно в течение 1 минуты. При анализе результатов реакции необходимо учитывать наличие фона радиоактивности, который может влиять на конечный результат реакции. Причинами повышенного фона могут быть: загрязнение контейнера или гнезда для пробы; неправильная настройка прибора; наличие источника сильного излучения вблизи прибора.
Для подтверждения положительного результата, полученного при первичном скрининге образцов, рекомендуется повторное исследование РИА или в альтернативном тесте. При обнаружении HBsAg необходимо проводить конфирмационный тест.
Радиоиммунный анализ — высокочувствительный метод, основанный на реакции антиген-антитело, один из компонентов которой несет радиоактивную метку. Метод позволяет обнаруживать как антигены, так и антитела и определять их концентрацию в исследуемой пробе.
Метод применяют для выявления антигенов микробов, определения гормонов, ферментов, лекарственных веществ и иммуноглобулинов. Является наиболее чувствительным методом определения антигенов и антител, используется для определения гормонов, лекарственных веществ и антибиотиков, для диагностики бактериальных, вирусных, риккетсиозных, протозойных заболеваний, исследования белков крови, тканевых антигенов.
Хроматография: теоретические основы, принцип метода. Сорбенты и элюенты для хроматографического анализа. Методы проявления хроматограмм. Основные виды хроматографии: адсорбционная, ионообменная, гель-фильтрация, аффинная, ВЭЖХ. Аналитические характеристики, применение в клинике.
Хроматография (от греч. χρώμα — цвет) — метод разделения и анализа смесей веществ, а также изучения физико-химических свойств веществ. Основан на распределении веществ между двумя фазами — неподвижной (твердая фаза или жидкость, связанная на инертном носителе, сорбент) и подвижной (газовая или жидкая фаза, элюент). Название метода связано с первыми экспериментами по хроматографии, в ходе которых разработчик метода Михаил Цвет разделял ярко окрашенные растительные пигменты. Хроматограмма — результат регистрирования зависимости концентрации компонентов на выходе из колонки от времени.
Основные виды хроматографии. В зависимости от природы взаимодействия, обусловливающего распределение компонентов между элюентом и неподвижной фазой, различают следующие основные виды — адсорбционную, распределительную, ионообменную, эксклюзионную (молекулярно-ситовую) и осадочную.
Адсорбционнаяхроматография основана на различии сорбируемости разделяемых веществ адсорбентом (твёрдое тело с развитой поверхностью); распределительнаяхроматография — на разной растворимости компонентов смеси в неподвижной фазе (высококипящая жидкость, нанесённая на твёрдый макропористый носитель) и элюенте (следует иметь в виду, что при распределительном механизме разделения на перемещение зон компонентов частичное влияние оказывает и адсорбционное взаимодействие анализируемых компонентов с твёрдым сорбентом); ионообменнаяхроматография — на различии констант ионообменного равновесия между неподвижной фазой (ионитом) и компонентами разделяемой смеси; эксклюзионная (молекулярно-ситовая)хроматография — на разной проницаемости молекул компонентов в неподвижную фазу (высокопористый неионогенный гель). Эксклюзионная хроматография подразделяется на гель-проникающую (ГПХ), в которой элюент — неводный растворитель, и гель-фильтрацию, где элюент — вода. Осадочная Х, основана на различной способности разделяемых компонентов выпадать в осадок на твёрдой неподвижной фазе.
В соответствии с агрегатным состоянием элюента различают газовую и жидкостную Х. В зависимости от агрегатного состояния неподвижной фазы газовая Хбывает газо-адсорбционной (неподвижная фаза — твёрдый адсорбент) и газожидкостной (неподвижная фаза — жидкость), а жидкостная Х — жидкостно-адсорбционной (или твёрдо-жидкостной) и жидкостно-жидкостной. Последняя, как и газо-жидкостная, является распределительной Х. К твёрдо-жидкостной Х относятся тонкослойная и бумажная.
Различают колоночную и плоскостную Х. В колоночной сорбентом заполняют специальные трубки — колонки, а подвижная фаза движется внутри колонки благодаря перепаду давления. Разновидность колоночной Х — капиллярная, когда тонкий слой сорбента наносится на внутренние стенки капиллярной трубки. Плоскостная Х подразделяется на тонкослойную и бумажную. В тонкослойной Х тонкий слой гранулированного сорбента или пористая плёнка наносится на стеклянную или металлическую пластинки; в случае бумажной Х используют специальную хроматографическую бумагу. В плоскостной Х перемещение подвижной фазы происходит благодаря капиллярным силам.
При хроматографировании возможно изменение по заданной программе температуры, состава элюента, скорости его протекания и др. параметров.
В зависимости от способа перемещения разделяемой смеси вдоль слоя сорбента различают следующие варианты Х: фронтальный, проявительный и вытеснительный. При фронтальном варианте в слой сорбента непрерывно вводится разделяемая смесь, состоящая из газа-носителя и разделяемых компонентов, например 1, 2, 3, 4, которая сама является подвижной фазой. Через некоторое время после начала процесса наименее сорбируемый компонент (например, 1) опережает остальные и выходит в виде зоны чистого вещества раньше всех, а за ним в порядке сорбируемости последовательно располагаются зоны смесей компонентов: 1 + 2, 1 + 2 + 3, 1 + 2 + 3 + 4. При проявительном варианте через слой сорбента непрерывно проходит поток элюента и периодически в слой сорбента вводится разделяемая смесь веществ. Через определённое время происходит деление исходной смеси на чистые вещества, располагающиеся отдельными зонами на сорбенте, между которыми находятся зоны элюента. При вытеснительном варианте в сорбент вводится разделяемая смесь, а затем поток газа-носителя, содержащего вытеснитель (элюент), при движении которого смесь через некоторый период времени разделится на зоны чистых веществ, между которыми окажутся зоны их смеси . Ряд видов Х осуществляется с помощью приборов, называемых хроматографами, в большинстве из которых реализуется проявительный вариант Х.Хроматографы используют для анализа и для препаративного (в т. ч. промышленного) разделения смесей веществ. При анализе разделённые в колонке хроматографа вещества вместе с элюентом попадают через различные промежутки времени в установленное на выходе из хроматографической колонки детектирующее устройство, регистрирующее их концентрации во времени. Полученную в результате этого выходную кривую называют хроматограммой. Для качественного хроматографического анализа определяют время от момента ввода пробы до выхода каждого компонента из колонки при данной температуре и при использовании определённого элюента. Для количественного анализа определяют высоты или площади хроматографических пиков с учётом коэффициентов чувствительности используемого детектирующего устройства к анализируемым веществам.
Для анализа и разделения веществ, переходящих без разложения в парообразное состояние, наибольшее применение получила газоваяхроматография, где в качестве элюента (газа-носителя) используются гелий, азот, аргон и др. газы. Для газо-адсорбционного варианта Х в качестве сорбента (частицы диаметром 0,1—0,5 мм)используют силикагели, алюмогели, молекулярные сита, пористые полимеры и др. сорбенты с удельной поверхностью 5—500 м 2 /г. Для газо-жидкостной Х сорбент готовят нанесением жидкости в виде плёнки (высококипящие углеводороды, сложные эфиры, силоксаны и др.) толщиной несколько мкм на твёрдый носитель с удельной поверхностью 0,5—5 м 2 /г и более. Рабочие температурные пределы для газо-адсорбционного варианта Х от —70 до 600 °С, для газо-жидкостного от —20 до 400 °С. Газовой Х можно разделить несколько см 3 газа или мг жидких (твёрдых) веществ; время анализа от несколькихсек до нескольких часов.
В жидкостной колоночнойХ в качестве элюента применяют легколетучие растворители (например, углеводороды, эфиры, спирты), а в качестве неподвижной фазы — силикагели (в т. ч. силикагели с химически привитыми к поверхности различными функциональными группами — эфирными, спиртовыми и др.), алюмогели, пористые стекла; размер частиц всех этих сорбентов несколько мкм. Подавая элюент под давлением до 50 Мн/м 2 (500 кгс/см 2 ), удаётся сократить время анализа от 2—3 ч до нескольких мин. Для повышения эффективности разделения сложных смесей используют программируемое во времени изменение свойств элюента путём смешения растворителей разной полярности (градиентное элюирование).
В тонкослойной и бумажной Х исследуемую смесь в жидком виде наносят на стартовую линию (начало пластинки или полоски бумаги), а затем разделяют на компоненты восходящим или нисходящим потоком элюента. Последующее обнаружение (проявление) разделённых веществ на хроматограмме (так в этих случаях называют пластину с нанесённым на неё сорбентом или хроматографическую бумагу, на которых произошло разделение исследуемой смеси на компоненты) осуществляют при помощи ультрафиолетовой (УФ) спектроскопии, инфракрасной (ИК) спектроскопии или обработкой реактивами, образующими с анализируемыми веществами окрашенные соединения.
Качественно состав смесей с помощью этих видов Х характеризуют определённой скоростью перемещения пятен веществ относительно скорости движения растворителя в данных условиях. Количественный анализ осуществляют измерением интенсивности окраски вещества на хроматограмме.
Хроматография широко применяется в лабораториях и в промышленности для качественного и количественного анализа многокомпонентных систем, контроля производства, особенно в связи с автоматизацией многих процессов, а также для препаративного (в т. ч. промышленного) выделения индивидуальных веществ (например, благородных металлов), разделения редких и рассеянных элементов.
Газовая Хроматография применяется для газов разделения, определения примесей вредных веществ в воздухе, воде, почве, промышленных продуктах; определения состава продуктов основного органического и нефтехимического синтеза, выхлопных газов, лекарственных препаратов, а также в криминалистике и т.д. Разработаны аппаратура и методики анализа газов в космических кораблях, анализа атмосферы Марса, идентификации органических веществ в лунных породах и т.п.
Газовая Хроматография применяется также для определения физико-химических характеристик индивидуальных соединений: теплоты адсорбции и растворения, энтальпии, энтропии, констант равновесия и комплексообразования; для твёрдых веществ этот метод позволяет измерить удельную поверхность, пористость, каталитическую активность.
Жидкостная Хроматография используется для анализа, разделения и очистки синтетических полимеров, лекарственных препаратов, детергентов, белков, гормонов и др. биологически важных соединений. Использование высокочувствительных детекторов позволяет работать с очень малыми количествами веществ (10 -11 —10 -9 г ), что исключительно важно в биологических исследованиях. Часто применяется молекулярно-ситовая Хроматография и Хроматография по сродству; последняя основана на способности молекул биологических веществ избирательно связываться друг с другом.
Тонкослойная и бумажная Хроматография используются для анализа жиров, углеводов, белков и др. природных веществ и неорганических соединений.
В некоторых случаях для идентификации веществ используется Хроматография в сочетании с др. физико-химическими и физическими методами, например с масс-спектрометрией, ИК-, УФ-спектроскопией и др. Для расшифровки хроматограмм и выбора условий опыта применяют ЭВМ.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
источник