Цель работы : определение фосфат-ионов в пробах природных вод.
Фосфор является необходимым элементом для жизни. Являясь важнейшим биогенным элементом, именно фосфор чаще всего лимитирует развитие продуктивности водоемов. Поэтому поступление избытка соединений фосфора с водосбора в виде минеральных удобрений с поверхностным стоком полей (с гектара орошаемых земель может выносится 0,4–0,6 кг фосфора), со стоками ферм (0,01–0,05 кг/ сут . на одно животное), с недоочищенными или неочищенными бытовыми сточными водами (0,003–0,006 кг/ сут . на одного жителя), а также с некоторыми производственными расходами приводит к резкому неконтролируемому приросту растительной биомассы водного объекта. Особенно характерен данный процесс для малопроточных и непроточных водоемов. Происходит изменение трофического статуса водоема, сопровождающееся перестройкой всего водного сообщества и ведущее к преобладанию гнилостных процессов (и, соответственно, возрастанию мутности, солености, концентрации бактерий).
В природных и сточных водах фосфор может присутствовать в разных видах. В растворенном состоянии (иногда говорят — в жидкой фазе анализируемой воды) он может находиться в виде ортофосфорной кислоты (Н3РО4) и ее анионов в виде мет а- , пиро — и полифосфатов (эти вещества используют для предупреждения образования накипи, они входят также в состав моющих средств). Кроме того, существуют разнообразные фосфорорганические соединения — нуклеиновые кислоты, нуклеопротеиды, фосфолипиды и др., которые также могут присутствовать в воде, являясь продуктами жизнедеятельности или разложения организмов. К фосфорорганическим соединениям относятся также некоторые пестициды.
Минерализация приводит к превращению в ортофосфаты все, даже труднорастворимые , формы фосфатов в воде. Таким образом, определяется содержание общего фосфора в любой воде (этот показатель можно определять как для растворенных фосфатов, так и для нерастворимых соединений фосфора). Однако для природных вод, не содержащих или содержащих незначительное количество трудногидролизующихся фосфатов в твердой фазе, минерализации обычно не требуется, и полученный при анализе гидролизованной пробы результат с хорошим приближением может быть принят за содержание общего фосфора.
ПДК полифосфатов ( триполифосфат и гексаметафосфат ) в воде водоемов составляет 3,5 мг/л в пересчете на ортофосфат-анион РО4 3- , лимитирующий показатель вредности – органолептический.
Диапазон определяемых концентраций ортофосфатов в воде при визуально-колориметрическом определении – от 0,2 до 7,0 мг/л, при фотометрическом определении – 0,01–0,4 мг/л. Определение визуально-колориметрическим методом возможно и при концентрации ортофосфатов более 7,0 мг/л после соответствующего разбавления пробы чистой водой.
Метод основан на получении восстановленной фосфорномолибденовой гетерополикислоты – «молибденовой сини».
При взаимодействии фосфатов с молибдатом ( VI ) в кислой среде образуется фосфорно-молибденовая гетерополикислота Н7 Р( Мо2О7)6, которая восстанавливается аскорбиновой кислотой в присутствии сурьмяно-виннокислого калия до фосфорно-молибденового комплекса, окрашенного в голубой цвет.
Оптическую плотность образованного фосфорно-молибденового комплекса определяют на фотоэлектроколориметре при красном светофильтре. Содержание фосфора фосфатов в пробе определяют по показаниям прибора, пересчитанным по предварительно построенному градуировочному графику.
– колбы мерные вместимостью 50, 100 см 3 ;
– цилиндры мерные вместимостью 50, 100 см 3 ;
– колбы конические плоскодонные вместимостью 100 см 3 ;
– смесь аскорбиновой и серной кислот.
1. В коническую плоскодонную колбу вместимостью 100 см 3 отбирают 50,0 см 3 отфильтрованной исследуемой пробы воды. Объем отбирают пипеткой вместимостью 50 см 3 . К пробе добавляют 10,0 см 3 смешанного реактива, и раствор хорошо перемешивают.
2. Через 10 мин на фотоэлектроколориметре измеряют оптическую плотность раствора при красном светофильтре в кювете с толщиной оптического слоя 5 см , используя в качестве сравнения дистиллированную воду.
3. Если исследуемая проба воды окрашена или слегка мутная, отдельно измеряют ее оптическую плотность относительно дистиллированной воды при красном светофильтре в кювете с толщиной оптического слоя 5 см , добавив к пробе 10 см 3 смеси серной и аскорбиновой кислот вместо смешанного индикатора.
4. По градуировочной характеристике полученному значению оптической плотности ставят в соответствие значение концентрации фосфат-ионов в исходной пробе воды. Содержание фосфатов ( Сх ) в мг/дм 3 находят по формуле:
где С о – концентрация фосфат-ионов , найденная по градуировочной характеристике, мг/дм 3 ;
n – степень разбавления исходной пробы воды (в случае, если исследуемую пробу не разбавляли, n = 1).
Форма записи результатов определения фосфат иона в пробах природных вод представлена ниже.
Таблица. Форма записи результатов определения фосфат-иона в пробах природных вод
Содержание
фосфат-иона ,
найденного
по градуировочному
графику мг/дм3
источник
В этом разделе не рассматриваются синтезированные в промышленности фосфорорганические соединения. Природные соединения органического фосфора поступают в природные воды в результате процессов жизнедеятельности и посмертного распада водных организмов, обмена с донными отложениями.
Органические соединения фосфора присутствуют в поверхностных водах в растворенном, взвешенном и коллоидном состоянии.
Фосфор минеральный
Соединения минерального фосфора поступают в природные воды в результате выветривания и растворения пород, содержащих ортофосфаты (апатиты и фосфориты) и поступления с поверхности водосбора в виде орто-, мета-, пиро- и полифосфат-ионов (удобрения, синтетические моющие средства, добавки, предупреждающие образование накипи в котлах и т.п.), а также образуются при биологической переработке остатков животных и растительных организмов. Избыточное содержание фосфатов воде, особенно в грунтовой, может быть отражением присутствия в водном объекте примесей удобрений, компонентов хозяйственно-бытовых сточных вод, разлагающейся биомассы.
Основной формой неорганического фосфора при значениях pH водоема больше 6.5 является ион HPO42- (около 90%).
В кислых водах неорганический фосфор присутствует преимущественно в виде H2PO4-.
| Концентрация фосфатов в природных водах обычно очень мала — сотые, редко десятые доли милиграммов фосфора в литре, в загрязненных водах она может достигать нескольких миллиграммов в 1 дм3. Подземные воды содержат обычно не более 100 мкг/дм3 фосфатов; исключение составляют воды в районах залегания фосфорсодержащих пород. |
Содержание соединений фосфора подвержено значительным сезонным колебаниям, поскольку оно зависит от соотношения интенсивности процессов фотосинтеза и биохимического окисления органических веществ. Минимальные концентрации фосфатов в поверхностных водах наблюдается обычно весной и летом, максимальные — осенью и зимой, в морских водах — соответственно весной и осенью, летом и зимой.
Общее токсическое действие солей фосфорной кислоты возможно лишь при весьма высоких дозах и чаще всего обусловлено примесями фтора [9].
| В методике оценки экологической ситуации, принятой Госкомэкологией РФ, рекомендован норматив содержания растворимых фосфатов в воде — 50 мкг/дм3. |
Без предварительной подготовки проб колориметрически определяются неорганические растворенные и взвешенные фосфаты.
Полифосфаты
Men(PO3)n , Men+2PnO3n+1 , MenH2PnO3n+1
Применяются для умягчения воды, обезжиривания волокна, как компонент стиральных порошков и мыла, ингибитор коррозии, катализатор, в пищевой промышленности.
Малотоксичны. Токсичность объясняется способностью полифосфатов к образованию комплексов с биологически важными ионами, особенно с кальцием [53].
| Установленное допустимое остаточное количество полифосфатов в воде хозяйственно-питьевого назначения составляет 3.5 мг/дм3 (лимитирующий показатель вредности — органолептический). |
Соединения серы
©2015 arhivinfo.ru Все права принадлежат авторам размещенных материалов.
Эта операция слегка снижает растворимость фосфора удобрения в воде, но не влияет на его цит-ратную растворимость. [16]
Это распределение зависит от соотношения значений растворимости данной примеси в окисле и кремнии. Например, как показано на рис. 7 — 12, растворимость фосфора в кремнии больше, чем в окисле. Это приводит к обогащению фосфором прилегающего к окислу слоя кремния. [18]
Представленные на рис. 24 данные по влиянию легирующих элементов на растворимость фосфора в а-железе показывают, что легирование железа, содержащего фосфор, может приводить к нескольким конкурирующим процессам. К ним относятся усиление зернограничной сегрегации фосфора при умеренном снижении его растворимости в железе, с одной стороны, и ослабление сегрегации из-за связывания растворенного фосфора при выделении фосфидов в результате очень сильного снижения растворимости фосфора с другой. В ряде работ показано И09, 241 ], что в случае низколегированных конструкционных сталей весьма эффективными добавками, связывающими охрупчивающие примеси в химические соединения и значительно ослабляющими склонность к отпускной хрупкости, являются редкоземельные элементы, в частности, лантан и церий. [19]
Транзисторы типа р-п — р используются крайне редко, так как имеют худшие электрические параметры. Основное преимущество технологии изготовления транзисторов типа п-р — п связано с относительно ( большим коэффициентом растворимости фосфора в кремнии, диффузия которого используется при создании области эмиттера. Кроме того, в транзисторах типа п-р — п неосновными носителями в базе являются электроны. Подвижность электронов при одинаковой температуре и концентрации примесей в кремнии приблизительно в два раза превышает подвижность дырок. [20]
Из этого ясно, что недостаток серы может возникать в областях, где с некоторого времени отказались от сульфатных удобрений и где навоз стали применять реже. Недостаток серы встречается сравнительно редко; однако, по нашему мнению, земледельцы-практики часто не обращают на это внимания, и в большинстве случаев, когда констатируют преимущество сульфата аммония или суперфосфата над аммонитратами или шлаками и объясняют это преимущество аммиачной формой азота или растворимостью фосфора, действительной причиной является именно присутствие серы. [21]
Вредное влияние фосфора на свойства сварных соединений заключается в снижении высокотемпературных характеристик металла шва вследствие ослабления межкристаллитных границ ( при выделении легкоплавких включений) и в ухудшении механических свойств швов при нормальной и низких температурах. Последнее обусловлено снижением пластичности металла в результате растворения фосфора и наличием на границах кристаллитов хрупких неметаллических прослоек. Так как растворимость фосфора в аустените ниже, чем в феррите, опасность образования кристаллизационных трещин и снижения механических свойств металла шва значительно больше для швов с аустенитнои структурой. [23]
Обогащение расплава фосфором также вызывает образование горячих трещин по границам кристаллитов. Так как растворимость фосфора в аустени-те меньше, чем в феррите, опасность возникновения кристаллизационных трещин в аустенитных швах значительно больше.
В швах на углеродистых и низколегированных сталях фосфор преимущественно находится в твердом растворе, а не в виде неметаллических включений. Это обусловлено низкой концентрацией фосфора в металле швов и относительно высокой его растворимостью в феррите. В связи с низкой растворимостью фосфора в аустените фосфорсодержащие включения значительно чаще встречаются в швах с аустенитной структурой. В этих включениях фосфор может находиться в виде фосфидов, фосфидных эвтектик и фосфатов. [26]
Представленные на рис. 24 данные по влиянию легирующих элементов на растворимость фосфора в а-железе показывают, что легирование железа, содержащего фосфор, может приводить к нескольким конкурирующим процессам. К ним относятся усиление зернограничной сегрегации фосфора при умеренном снижении его растворимости в железе, с одной стороны, и ослабление сегрегации из-за связывания растворенного фосфора при выделении фосфидов в результате очень сильного снижения растворимости фосфора с другой. В ряде работ показано И09, 241 ], что в случае низколегированных конструкционных сталей весьма эффективными добавками, связывающими охрупчивающие примеси в химические соединения и значительно ослабляющими склонность к отпускной хрупкости, являются редкоземельные элементы, в частности, лантан и церий. [27]
Судя по выделению фосфора, SiP не является низшим фосфидом кремния. Последние 0 2 г-ат фосфора выделяются только при низком давлении. Бильц предполагал, что это может быть также и результатом растворения фосфора в кремнии. Однако измерение растворимости фосфора в кремнии, проведенное Фуллером и Дитценбергером [126], показало, что при температуре 1250 таковая составляет всего около 1 3 вес. [29]
В соответствии с моделью неоднородного карбидообразования [1] при отпуске закаленной легированной стали вследствие более быстрого распада пересыщенного твердого раствора на границах зерен концентрация карбидообразующих элементов в феррите вблизи границ падает быстрее, чем в феррите объема зерна, приближаясь к равновесной, и остается ниже средней концентрации этих элементов внутри зерна в течение времени, зависящего от состава стали и температуры отпуска. Предполагается, что в обедненных карбидообразующими элементами приграничных зонах понижается термодинамическая активность фосфора, поэтому фосфор диффундирует в эти зоны. Влияние некарбидообразующих элементов в рамках этой модели является косвенным. Никель, например, ускоряет падение растворимости фосфора с понижением температурь), что связывается с повышением его термодинамической активности, усиливающим, в свою очередь, влияние неоднородно-стей твердого раствора на распределение фосфора. Влияние других элементов может быть обусловлено изменением поверхностной энергии и избыточной энергии границ зерен, размера аустенитного зерна, сопротивления начальной пластической деформации, т.е. изменением фона, на котором развиваются основные ( в рамках этой модели) процессы, ответственные за охрупчивание — неоднородное карбидообразование и перераспределение фосфора и его аналогов. [30]
Страницы: 1 2 3
Современный человек в повседневной жизни не может обойтись без химии. И часто случается так, что не находится времени глянуть какие продукты употребляются и используются в быту.
Аллергия, пониженный иммунитет и другие проблемы со здоровьем могут быть следствием интоксикации фосфатами. Не говоря уже о тяжелой экологической обстановке окружающей среды.
Фосфаты – это неорганические химические соединения, которые образуются из фосфорной кислоты и металлов. Существует множество разновидностей фосфатов, а сфера их применения начинается пищевой промышленностью и заканчивается выплавкой металлов.
В быту человек встречается с фосфатами в пище, а также во время стирки или мытья посуды, то есть при контакте с бытовой химией. Чаще всего фосфаты представлены в виде трёх соединений – фосфата кальция (Ca3(PO4)2), ортофосфата калия (K3PO4) и фосфата натрия (Na3PO4).
Они могут находится в колбасе, сыре (добавляют для однородности), выпечке, тортах (разрыхлитель для теста), в прочих пищевых продуктах как консервант. В бытовую химию фосфаты добавляют в моющие средства, порошки, шампуни и пр. в качестве смягчителя воды. При чём в стиральных порошках фосфатов значительно больше, чем указывают на упаковке.
Фосфаты в естественном виде присутствуют в таких продуктах как мясо и орехи, но, в основном, выводятся организмом. Но с искусственными фосфатными солями всё по-другому.
Влияние на здоровье человека
Давно известно, что эти вещества представляют серьёзную опасность для здоровья людей, особенно тех, кто страдает почечной недостаточностью. Долгое время врачи предупреждали об опасности слишком большого количества фосфатов в крови. Несколько исследований уже показали, что люди с заболеванием почек подвергаются повышенному риску смерти. Поскольку повреждённые почки больше не могут выводить определенные вещества, такие как, например, фосфаты. Они накапливается в крови и залегают в сосудах и мягких тканях.
Слишком большой уровень фосфатов в крови увеличивает риск смерти.
И тем не менее, риску подвергаются даже здоровые люди. Несколько исследований это доказывают. У здоровых людей фосфаты, что находятся в крови, выводятся через почки. Но чем больше фосфатов человек употребляет, тем быстрее почка перенапрягается и теряет эту способность. В результате наблюдается повышенный уровень фосфатов в крови, повреждения сосудов (их внутренние стенки изменяются и кальцифицируются), а также сердца. При этом риск инсульта или сердечного приступа в значительной мере возрастает.
Сердечно-сосудистая система – не единственная кто страдает от соединений фосфора. Кости также подвергаются риску по той простой причине, что фосфаты обеспечивают высвобождение и вымывание кальция из них. В результате кости теряют минералы и становятся хрупкими, что может привести к остеопорозу, а также увеличению риска переломов при значительных нагрузках.
Согласно исследованиям, взрослый человек может употреблять максимум 700 мг фосфатов в сутки. К сожалению, даже если вы и захотите уменьшить их употребление, – это будет почти невозможно. Например, замороженная пицца часто содержит в три раза больше рекомендуемой нормы фосфатов. Фастфуды и сладкие безалкогольные напитки буквально наводняют организм искусственными фосфатами.
Опасность в том, что искусственные фосфаты свободно растворяются и поглощаются организмом почти на 100%. Автоматический барьер для устранения избытка, который служит для регулирования натуральных фосфатов, здесь не работает. Тело поглощает гораздо больше, чем может справиться.
Также фосфаты могут попадать в тело человека через кожу, нарушая кислотно-щелочной баланс в клетках. Следствие – дерматологические болезни и ускоренное старение кожи. Кроме того, фосфаты таким образом влияют и на кровь человека – изменяют содержание гемоглобина, плотность сыворотки и количество белка. Что в свою очередь приводит к нарушению работы печени, мышц, тяжелым отравлениям, нарушению обмена веществ, обострению хронических болезней.
Садоводы знают, что фосфаты необходимы растениям в качестве удобрений. Так же само фосфаты действуют и в водоёмах, ускоряя рост водорослей. В результате бурного роста, водная растительность поглощает значительное количество растворённого в воде кислорода. По этой причине может наблюдаться гибель и превращение озёр в болота, мор рыбы, умирают животные и т.п. В конечном итоге, водоёмы полностью зарастают.
Попадают фосфаты в водоёмы с полей, а также через сточные воды, которые проходят обработку на очистных сооружениях активным мулом. Активный мул – это микроорганизмы, и они не справляются с огромным потоком фосфатов из городов и погибают. В следствие чего, фосфатные соединения не полностью удаляются из сточных вод и попадают в водоёмы.
От «нашествия водорослей» и экологической катастрофы страны и водоёмы средней климатической полосы спасает лишь недостаточное количество тепла и света, что поступает в холодный период года.
Фосфорные соединения не всегда упоминаются на упаковках товаров в открытом виде. Производителю попросту это не совсем выгодно, поэтому зачастую их скрывают за номерами с индексом «Е»:
• E338 (фосфорная кислота);
• Е339 (фосфат натрия);
• E340 (фосфат калия);
• E341 (фосфат кальция);
• Е343 (фосфат магния);
• E450 (дифосфат);
• E451 (трифосфат);
• E452 (полифосфат);
• Е442 (аммонийные соли фосфатидиловой кислоты);
• Е541 (кислый алюмофосфат натрия);
• Е1410 (монокрахмал-фосфат);
• Е1412 (дикрахмал фосфат);
• Е1413 (фосфатированный дикрахмал фосфат);
• Е1414 (ацетилированный крахмал);
• Е1442 (гидроксипропилдикрахмалфосфат).
Также они скрываются за терминами «регулятор кислотности». На колбасных или сырных продуктах имеются только маленькие знаки со словами «содержит фосфат». И если они используются в производстве продуктов питания только как вспомогательные средства или являются частью ингредиента – как в сыре замороженной пиццы, – они могут не упоминаться в конечном продукте. Поэтому потребителю сложно идентифицировать их как таковые. Таким образом, искусственные фосфаты и вредят здоровью человека.
Откажитесь от готовых к употреблению продуктов и фастфуда. Обращайте внимание на указанные выше номера на этикетках и держитесь подальше от таких товаров.
Что касается бытовой химии, используйте экологические «мягкие», щадящие, бесфосфатные моющие средства и порошки с пониженным содержанием поверхностно-активных веществ (ПАВ).
В такой продукции значительно уменьшена концентрация ПАВ, фосфатов вообще нет, а моющие свойства не уступают химии с фосфатами. Единственным недостатком является цена. Но негативное влияние на организм почти отсутствует.
Уменьшить эвтрофикацию (зарастание, заболачивание) водоёмов можно использованием именно бесфосфатных моющих средств и порошков, а также правильной агротехники на полях и огородах.
Ситуация с фосфатами на постсоветском пространстве близится к критической. Без применения мер на уровне правительств, принятия соответствующих норм и законов, она будет значительно усугубляться. Но человек – существо с правом выбора, и он сам способен выбирать как и в какой среде ему жить. Будьте внимательны, проверяйте состав продуктов, которые используете и употребляете. Позаботьтесь о себе, окружающей среде и будущем своих детей.
источник
Фосфор относится к числу биогенных элементов, имеющих особое значение для развития жизни в водных объектах. Соединения фосфора встречаются во всех живых организмах, они регулируют энергетические процессы клеточного обмена. При отсутствии соединений фосфора в воде рост и развитие водной растительности прекращается, однако избыток их также приводит к негативным последствиям, вызывая процессы эвтрофирования водного объекта и ухудшение качества воды.
Соединения фосфора попадают в природные воды в результате процессов жизнедеятельности и посмертного распада водных организмов, выветривания и растворения пород, содержащих фосфаты, обмена с донными осадками, поступления с поверхности водосбора, а также с бытовыми и промышленными сточными водами. Загрязнению природных вод фосфором способствуют широкое применение фосфорных удобрений, полифосфатов, содержащихся в моющих средствах, флотореагентов и др.
Фосфаты в воде могут присутствовать в виде различных ионов в зависимости от величины рН. В водах соединения фосфора, как минеральные, так и органические могут присутствовать в растворенном, коллоидном и взвешенном состоянии. Переход соединений фосфора из одной формы в другую осуществляется довольно легко, что создает сложности при определении тех или иных его форм. Обычно идентификация их осуществляется по процедуре, с помощью которой проводят химический анализ сточных вод . В том случае, когда анализируют фильтрованную пробу воды, говорят о растворенных формах, в противном случае — о суммарном содержании. Содержание взвешенных соединений фосфора находят по разности. Определение растворенных фосфатов (ортофосфатов) при анализе сточных вод осуществляется по реакции с молибдатом аммония и аскорбиновой кислотой с образованием молибденовой сини в исходной водной пробе, в то время как для определения полифосфатов в сточной воде требуется предварительно перевести их в фосфаты путем кислого гидролиза.
Для получения сравнимых результатов определения соединений фосфора и однозначной их интерпретации важно строгое соблюдение условий предварительной обработки проб и процедуры анализа сточных вод , в частности при определении растворенных форм проба должна быть отфильтрована как можно быстрее после отбора через фильтр с размером пор 0,45 мкм.
Концентрация фосфатов в незагрязненных природных водах может составлять тысячные, редко сотые доли мг/дм 3 . Повышение их содержания свидетельствует о загрязнении водного объекта. Концентрация фосфатов в воде подвержена сезонным колебаниям, поскольку она зависит от интенсивности процессов фотосинтеза и биохимического разложения органических веществ Минимальные концентрации соединений фосфора наблюдаются весной и летом, максимальные — осенью и зимой
Уменьшение содержания фосфатов в воде связано с потреблением его водными организмами, а также переходом в донные отложения при образовании нерастворимых фосфатов
Предельно допустимая концентрация фосфатов (в пересчете на фосфор) в воде водных объектов рыбохозяйственного назначения составляет
— для олиготрофных водных объектов 0,05 мг/дм;
— для мезотрофных — 0,15 мг/дм;
Предельно допустимая концентрация фосфатов для водных объектов хозяйственно-питьевого и культурно-бытового назначения не установлена, в них нормируется только содержание полифосфатов Предельно допустимая концентрация полифосфатов составляет 3,5 мг/дм 3 в пересчете на фосфат-ион и 1,1 мг/дм 3 в пересчете на фосфор.
источник
Аналитический центр более 20 лет занимается химическим анализом и разработкой новых методов анализа и диагностики веществ и материалов
В нашем распряжении самый современный приборный парк благодаря научно-техническому взаимодействию с крупнейшими мировыми разработчиками аналитического оборудования
Наши сотудники — это лучшие специалисты страны в области химического анализа, кандидаты и доктора наук
Аккредитация позволяет исследовать питьевую, природную, морскую, технологическую, талую воду и воду бассейнов
Обратившись к нам, Вы получите не только точные данные о присутствующих в воде загрязнителях, но и подробные рекомендации о способах очистки воды.
На основании анализа воды БЕСПЛАТНО подберем несколько вариантов систем водоочистки!
В нашей лаборатории Вы можете проверить качество воды из любого источника: колодца, скважины, водопровода, бассейна, родника, водоема. Для каждого источника есть оптимальный набор показателей, характеризующий возможность использования воды для тех или иных нужд. Чтобы правильно подобрать набор показателей, свяжитесь с нами по номеру +7 (495)149-23-57 или напишите на почту info@ion-lab.ru
Мы рекомендуем выбирать набор параметров в зависимости от того, какой у Вас источник водоснабжения, а также для каких целей планируете использовать воду. Для воды из городского водопровода, а также для воды, используемой в технических целях, подойдут наборы «Минимальный» или «Начальный». Для воды природных источников (скважины, колодцы, родники и т.д.) мы рекомендуем проверить воду на химический состав (наборы «Расширенный» или «Максимальный»), а также сделать анализ на микробиологию.
Да, Вы можете самостоятельно отобрать воду для анализа, следуя инструкции. Или же заказать выезд специалиста, который приедет в назначенное время со всей необходимой тарой, отберет воду и доставит ее в лабораторию.
Да, конечно! Пункт приема проб расположен по адресу: Москва, ул. Добролюбова, 21А, корпус А, пом. 14 (в пешей доступности от метро Фонвизинская, Бутырская, Тимирязевская)
Стоимость выезда специалиста зависит от выбранного Вами набора показателей и удаленности. Более точная информация размещена в разделе Доставка и оплата
© 1997-2019 — Лаборатория ИОН. Все права защищены.
Для химического анализа необходимо заполнить водой чистую пластиковую тару (оптимально 1,5 л). Использовать бутылки из-под сладких, газированных или ароматизированных напитков, а также солёной или минеральной воды недопустимо.
Если выбранный Вами анализ включает определение содержания нефтепродуктов, необходимо заполнить дополнительную стеклянную тару объемом 0,2 л.
Если выбранный Вами анализ включает определение содержания сероводорода, необходимо заполнить дополнительную стеклянную тару объемом 0,5 л (необходимо использовать консервант).
При отборе воды из проточного источника, непосредственно перед отбором необходимо пролить воду сильной струёй в течение 3-5 минут. Перед отбором проб ёмкости и крышки необходимо 3 раза промыть изнутри водой, подлежащей анализу. Использование моющих средств недопустимо. Наполнять тару необходимо тонкой струёй по стенке сосуда «под горлышко». Это снижает насыщение воды кислородом и предотвращает протекание реакций.
Для микробиологического анализа необходимо использовать стерильный контейнер для биоматериалов объемом 150-200 мл.
Перед взятием пробы необходимо протереть водопроводный кран спиртовой салфеткой, уделив особое внимание месту выхода воды.
При отборе воды из водопровода, скважины или колонки необходимо пролить воду сильной струёй в течение 3–5 минут.
При отборе воды из колодца с помощью ведра необходимо обдать ведро кипятком для дезинфекции. Отбор пробы через поливочные шланги и предметы, контактирующие с почвой, не допускается.
Для отбора пробы необходимо надеть перчатки и вскрыть упаковку стерильного контейнера. Не касаясь внутренней поверхности ёмкости, отобрать образец воды (2/3 объема контейнера) и закрыть крышкой.
Рекомендуем доставлять пробу сразу после отбора.
Если сразу после отбора нет возможности доставить пробу в лабораторию, допускается хранение образцов при температуре 2–10 °C в течение 1 суток.
Съезд на ул. Руставели, на первом светофоре поворот налево на ул. Яблочкова.
Через 300 м поворот направо на ул. Гончарова, через 500 м поворот налево (напротив дома №6), через 200 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Поворот на ул. Руставели, на светофоре поворот направо на ул. Добролюбова, через 300м на светофоре поворот налево на ул. Гончарова, напротив дома №6 поворот направо, через 200 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Двигаясь по ул. Милошенкова, поворачиваем на ул. Добролюбова
Через 150 метров поворот направо, за домом 21АкБ поворот налево, через 100-120 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Ближайшее станция метро – Фонвизинская (600 м)
Последний вагон из центра. Выход в сторону улицы Фонвизина. Из стеклянный дверей направо. Перейти через пешеходный переход и идти через дворы в соответствии со схемой. Пункт назначения — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Анализ «Минимальный» содержит минимальный и обязательный перечень загрязнителей, часто встречающихся в питьевой воде, и включает 16 показателей:
- органолептические: мутность, цветность, запах, привкус;
- общехимические: рН, жесткость, окисляемость перманганатная, минерализация, электропроводность, щелочность общая, щелочность свободная;
- катионы: железо, аммоний;
- анионы: нитраты, карбонат, гидрокарбонат.
Данный набор рекомендуется для исследования воды хозяйственно-бытового назначения. Анализ «Минимальный» не обладает достаточной информативностью для подбора системы водоочистки, так как не позволяет получить полную картину о безопасности воды. Если Вы планируете использовать воду в питьевых целях, рекомендуем обратить внимание на наборы, содержащие большее число параметров.
- Точность определения
- Подходит для воды, применяемой в хоз-бытовом назначении
- Срок выполнения — 3-4 рабочих дня
- Не подходит для воды, применяемой в питьевых целях
- Не подходит для корректного подбора фильтров
- Не содержит определения опасных загрязнителей
Анализ «Начальный» предназначен для выявления наиболее часто встречающихся вредных веществ в питьевой воде и включает 23 параметра: мутность, цветность, запах, привкус, рН, жесткость, окисляемость, минерализация, электропроводность, щелочность свободная, щелочность общая, железо, марганец, калий, магний, кальций, фториды, хлориды, нитраты, сульфаты, карбонат, гидрокарбонат, аммоний Данный анализ рекомендуется для оценки качества воды из колодцев, скважин, родников. По протоколу анализа «Начальный» возможен подбор системы водоочистки и типа фильтрующей загрузки. В перечень определяемых параметров входят органолептические показатели, общие химические показатели, а также содержание катионов и анионов
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для колодцев и скважин
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Позволяет корректно и экономично настроить водоочистное оборудование
- Не содержит перечень тяжелых металлов
- Не содержит перечень всех опасных загрязнений
- Срок выполнения исследований 5-6 рабочих дней
Анализ «Расширенный» содержит перечень наиболее часто встречающихся загрязнителей воды, вне зависимости от источника, и включает 31 показатель: мутность, цветность, запах, привкус, рН, жесткость, окисляемость, минерализация, электропроводность, щелочность общая, щелочность свободная, аммоний, алюминий, железо общее, магний, кальций, калий, натрий, марганец, медь, мышьяк, свинец, кадмий, цинк, стронций, фториды, хлориды, нитраты, сульфаты, гидрокарбонат, карбонат. Данный набор рекомендуется, в первую очередь, владельцам колодцев и скважин. Содержит перечень основных тяжелых металлов. Перед покупкой системы водоподготовки рекомендуем провести исследование воды с данным перечнем загрязнителей. Ориентируясь на полученную информацию, Вы сможете подобрать оборудование водоочистки с эффективностью до 98%, а так же корректно его настроить.
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для колодцев и скважин
- Содержит перечень тяжелых металлов
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Позволяет корректно и экономично настроить водоочистное оборудование
Анализ «Максимальный» содержит полный перечень опасных для здоровья человека веществ, встречающихся в воде, поступающих из скважин или колодцев, включая ионы тяжелых металлов и органические вещества, а именно: мутность, цветность, запах, привкус, рН, жесткость, окисляемость, минерализация, электропроводность, щелочность общая, щелочность свободная, аммоний, натрий, калий, магний, кальций, алюминий, железо, марганец, литий, барий, бериллий, бор, ванадий, молибден, кобальт, цинк, никель, хром, стронций, кадмий, мышьяк, медь, свинец, кремний, серебро, титан, ртуть, гиброкарбонат, карбонат, нитрат, хлорид, сульфат, фосфат, фторид, нитрит, сероводород, сульфид, гидросульфид, хлор общий, хлор остаточный, хлор остаточный свободный, АПАВ, нефтепродукты, фенол, формальдегид, бензол, толуол, о-ксилол, п-ксилол, м-ксилол, стирол Данное исследование рекомендуется для клиентов, которые серьезно относятся к выбору питьевой воды. Протокол анализа «Максимальный» позволяет со 100% уверенностью сделать вывод о пригодности воды для питья и приготовления пищи. Результаты исследования позволяют выбрать схему водоочиски, а также оценить эффективность уже установленного оборудования.
Воды, применяемой в хозяйственно-бытовом назначении; оценки работы системы водоочистки.
пластиковая бутылка 1,5 — 2 л.
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для любых источников воды
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Включает полный перечень тяжелых металлов
- Позволяет корректно и экономично настроить водоочистное оборудование
- Содержит полный перечень опасных органических веществ
Помимо хичиеского анализа воды мы настоятельно рекомендуем провести микробиологическое исследование Вашей воды. Микробиологический анализ воды включает определение общего микробного числа (ОМЧ), количества общих колиформных и колиформных термотолерантных бактерий.
источник
Фосфор является одним из главных биогенных элементов, определяющих продуктивность водоема. Соединения фосфора встречаются во всех живых организмах и регулируют энергетические процессы клеточного обмена.
Источники. Соединения фосфора поступают в поверхностные воды в результате процессов жизнедеятельности и разложения отмерших водных организмов, обмена с донными осадками, поступления с поверхности водосбора, выветривания и растворения пород.
Важным фактором повышения содержания соединений фосфора в поверхностных водах, нередко приводящим к значительной эвтрофикации водоемов, является хозяйственная деятельность человека. Загрязнению поверхностных вод фосфором способствуют широкое применение фосфорных удобрений, полифосфатов, как моющих средств, флотореагентов и умягчителей воды. Органические и минеральные соединения фосфора образуются при биологической переработке бытовых сточных вод и пищевых остатков, а также в процессах биологической очистки промышленных стоков.
Формы миграции. В природных водах соединения фосфора находятся в растворенном, коллоидном и взвешенном состояниях. Под влиянием физических, химических и биологических факторов относительно легко осуществляются переходы из одной формы в другую, что важно учитывать при анализе.
Растворенный фосфор представляет собой неорганические орто-, пиро-, мета- и полифосфаты и органические фосфаты.
Взвешенный фосфор (частицы более 0,45 мк) также может быть неорганического (фосфорсодержащие минералы) и органического происхождения. Органические взвеси (сестон) состоят из живых и отмерших (детрит) водных организмов. По сравнению с другими биогенными элементами фосфор обычно значительно быстрее переходит из органических в минеральные формы, т.е. является более динамичным в стадии прохождения через живое вещество.
Соотношение неорганических форм, в частности ортофосфатов, зависит от рН воды (таблица).
Соотношение форм производных фосфорной кислоты в воде
в зависимости от рН (% молей)
При значениях рН выше 6,5 характерных для поверхностных вод, фосфаты находятся, главным образом, в виде НРО4 .
Существенную часть неорганического растворимого фосфора могут составлять полифосфаты.
При значениях рН выше 8,5 характерных для поверхностных вод, фосфаты находятся главным образом в виде HPO4 2- .
Существенную часть неорганического растворимого фосфора могут составлять полифосфаты.
Содержание в поверхностных водах. Концентрация фосфатов в поверхностных водах составляет обычно сотые и тысячные доли мг Р/л. Содержание соединений фосфора подвержено значительным сезонным колебаниям, поскольку оно зависит от соотношения интенсивности процессов фотосинтеза и биохимического разложения органических веществ. Минимальные концентрации фосфатов наблюдаются обычно весной и летом, максимальные — осенью и зимой.
Свойства и цели наблюдения. Поскольку фосфор является элементом, лимитирующим развитие водных организмов, оценка его количественного содержания и характера распределения имеет большое значение при определении настоящей и потенциальной биологической продуктивности водоема. Загрязнение водоема соединениями фосфора ведет к его эвтрофикации и в связи с этим к существенному ухудшению качества воды.
Методы определения. Анализ вод на формы фосфора включает две общие стадии: превращение в растворимые ортофосфаты и их последующее количественное определение.
Для определения ортофосфатов наиболее широкое распространение в гидрохимии получили колориметрические методы, основанные на получении восстановленной фосфорно-молибденовой гетерополикислоты –«молибденовой сини».
Для определения очень низких концентраций (меньше 5 мкг/л), особенно в окрашенных водах, предложены флюориметрические и экстракционно- фотометрические методы.
Отбор, предварительная обработка, хранение проб. Фосфаты являются биохимически подвижными компонентами, определение которых следует производить в свежеотобранных пробах. Если анализ не может быть выполнен немедленно, пробы фильтруют через мембранный фильтр 0,45 мк, добавляют 2—4 мл хлороформа на 1 л воды и хранят при 3-5°С не более трех суток.
Назначение метода. Метод основан на взаимодействии фосфатов с молибдатом в кислой среде с образованием фосфорно-молибденовой гетерополикислоты H7[P(Mo27)6l 28Н2О восстановлением ее аскорбиновой кислотой в присутствии сурьмяновиннокислого калия до фосфорно-молибденового комплекса, окрашенного в голубой цвет.
Характеристики метода. Минимальная определяемая концентрация 0,005 мгР/л. Относительное стандартное отклонение U при концентрации 0,06 мгР/л составляет 1,5% (п =20). Продолжительность определения единичной пробы 40 мин
Качественное определение. Для определения фосфатов применяют молибденовую жидкость. Ее наливают в пробирку, доливают исследуемую воду и слегка подогревают. В случае присутствия иона PO4 3- выпадает желтый кристаллический осадок.
источник
Массовая концентрация фосфатов и полифосфатов в водах. Методика выполнения измерений фотометрическим методом
Документ устанавливает методику выполнения измерений массовой концентрации неорганических соединений фосфора — фосфатов и полифосфатов — в сумме(фосфор минеральный) и раздельно в пробах природных и очищенных сточных вод в диапазоне от 0,010 мг/дм куб. до 0,200 мг/дм куб. в пересчете на фосфор фотометрическим методом.
| Обозначение: | РД 52.24.382-2006 |
| Название рус.: | Массовая концентрация фосфатов и полифосфатов в водах. Методика выполнения измерений фотометрическим методом |
| Статус: | действует |
| Заменяет собой: | РД 52.24.382-95 «Методические указания. Методика выполнения измерений массовой концентрации фосфатов и полифосфатов в водах фотометрическим методом» |
| Дата актуализации текста: | 05.05.2017 |
| Дата добавления в базу: | 01.09.2013 |
| Дата введения в действие: | 01.04.2006 |
| Утвержден: | 01.04.2006 Росгидромет (Rosgidromet ) |
| Ссылки для скачивания: |

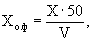 (3)
(3)