Для определения карбонатной жёсткости титруют некоторый объем исследуемой воды стандартным раствором соляной кислоты в присутствии индикатора метилового оранжевого. При этом протекают реакции с гидрокарбонатами:
При достижении точки эквивалентности, когда прореагируют все карбонаты и гидрокарбонаты, индикатор меняет окраску с желтой на оранжевую.
Поскольку содержание карбонатов обычно во много раз меньше, чем содержание гидрокарбонатов, а именно присутствие последних определяет наличие у воды временной жёсткости, такое определение иногда называют определением временной жёсткости. При этом предполагают, что содержание карбонатов настолько мало, что их вкладом в постоянную жёсткость можно пренебречь.
При определении общей жёсткости используют метод титрования, который называется комплексонометрическим методом, так как в нем используются вещества с общим названием комплексоны. Один из комплексонов, наиболее широко применяемый — трилон Б (это торговая марка, под которой впервые был выпущен этот химический продукт). Он представляет производное органической кислоты, в составе молекулы которого присутствуют два атома водорода, способные замещаться на атомы металла. Не рассматривая строения молекулы трилона Б, используем ее общепринятое условное обозначение: H2Y.
Определение основано на том, что ионы кальция и магния образуют растворимые комплексные соединения с Трилоном Б:
В качестве индикаторов используют реактивы, которые дают с определяемыми ионами характерно окрашенные соединения. При достижении точки эквивалентности, когда почти все ионы Ca 2+ и Mg 2+ связываются с трилоном Б в комплексы и их концентрация в растворе резко уменьшается, окраска раствора меняется. Титрование необходимо проводить в слабощелочной среде (для связывания образующихся ионов водорода), поэтому к титруемому раствору кроме индикатора добавляют так называемый буферный раствор, который обеспечивает постоянство величины pH (при осуществлении данного титрования добавляют аммиачный буферный раствор, который поддерживает постоянство pH в пределах 8…10 единиц).
1. Методом кислотно-основного титрования определить карбонатную жёсткость водопроводной воды.
2. Методом комплексонометрического титрования определить общую жёсткость водопроводной воды.
3. По экспериментальным данным сделать вывод об уровне жёсткости исследованной воды и рассчитать величину постоянной жёсткости.
Опыт 1. Определение карбонатной жёсткости
В две конические колбы налить по 100 мл исследуемой (водопроводной) воды (отмерив ее мерным цилиндром), добавить 5-6 капель раствора индикатора метилового оранжевого. Одна из колб является контрольной, т.е. используется, чтобы заметить изменение окраски раствора в другой колбе при титровании. Записать начальный уровень титранта в бюретке.
Перед титрованием убеждаются, что в бюретке достаточно раствора, а стеклянный носик полностью заполнен жидкостью. Пузырьки воздуха из носика выдавливают потоком жидкости, повернув трубку носика вверх под углом около 45°. Выпускное устройство бюретки представляет резиновую трубку со стеклянным шариком внутри. Для вытекания жидкости слегка оттягивают большим и указательным пальцем стенку трубки от шарика, чтобы между ними образовался просвет. Наполняют бюретку через воронку, после чего воронку вынимают из верхнего отверстия; если этого не сделать, во время титрования с воронки может стечь оставшийся в ней раствор, и измерение объема окажется неточным.
При необходимости долить раствор титранта в бюретку, доведя уровень до нулевого деления. Во вторую колбу из бюретки прибавлять 0,1 н. раствор соляной кислоты до перехода окраски индикатора из желтой в оранжевую (получаемый цвет, скорее, можно назвать персиковым).
Поверхность жидкости в бюретке представляется широкой вогнутой полосой (мени́ск). Отсчет значений по шкале производят по нижнему краю мениска, глаз наблюдателя должен находиться на уровне мениска. Титрант из бюретки сначала приливают достаточно быстро, непрерывно перемешивая содержимое колбы вращательными движениями. На шарик надавливают левой рукой, а колбу держат и перемешивают правой рукой. Титрование проводят стоя! За окраской раствора наблюдают, подложив под колбу лист белой бумаги для лучших условий наблюдения. По мере приближения к концу титрования, о чем можно судить по появлению в центре колбы «облачка» розовой окраски, тут же исчезающего при дальнейшем перемешивании, титрант приливают уже по каплям. Раствор должен изменить цвет от прибавления одной определенной капли; в этот момент розовое «облачко» не исчезнет, а распространится по всему раствору.
Чтобы убедиться в отсутствии значительных случайных ошибок при выполнении титрования и при отмеривании объема титруемого раствора, титрование повторяют два-три раза и рассчитывают среднюю величину Vстанд, которую в дальнейшем используют для расчетов.
Записать уровень раствора в бюретке и вычислить объем титранта, пошедший на титрование, как разность конечного и начального отсчетов. Титрование повторить (можно использовать «контрольную колбу»). Рассчитать объем стандартного раствора как среднее по результатам двух титрований. Вычислить карбонатную жёсткость Жкарб исследуемой воды (в ммоль экв/л) по формуле:
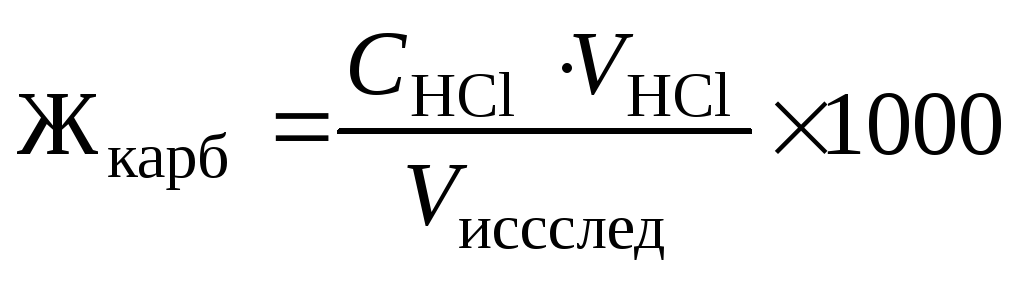
где СHCl — молярная концентрация эквивалента (нормальность) раствора соляной кислоты; VHCl — объем соляной кислоты, пошедший на титрование; Vисслед — объем исследуемой воды; 1000 — коэффициент перехода от моль экв/л к ммоль экв/л.
Опыт 2. Определение общей жёсткости
Титрование проводят в присутствии индикатора «хром темно-синий». В коническую колбу налить 25 мл исследуемой воды и добавить дистиллированной воды до общего объема 100 мл (отмерять цилиндром). Добавить 5 мл аммиачного буферного раствора и 5-7 капель раствора индикатора хрома темно-синего; при этом раствор приобретает винно-красную окраску.
Записать начальный уровень титранта в бюретке. При необходимости долить раствор титранта в бюретку, доведя уровень до нулевого деления. Из бюретки по каплям прибавлять 0,1 н. раствор трилона Б до изменения окраски раствора от винно-красной до синевато-сиреневой.
В отличие от титрования в первом опыте, где реакция протекает практически мгновенно, взаимодействие трилона Б с кальцием и магнием требует некоторого заметного промежутка времени. Чтобы не пропустить момент достижения точки эквивалентности, титрант с самого начала титрования добавляют отдельными каплями с интервалом в две-три секунды, внимательно наблюдая, не меняется ли окраска титруемого раствора. Если приливать титрант быстрее, то некоторое количество его попадет в уже оттитрованный раствор, который еще не успел поменять окраску; в результате раствор будет перетитрован, а объем пошедший на титрование — завышен.
Записать уровень раствора в бюретке и вычислить объем титранта, пошедший на титрование, как разность конечного и начального отсчетов. Титрование повторить. Рассчитать объем стандартного раствора как среднее по результатам двух титрований. Вычислить общую жёсткость Жобщ исследуемой воды (в ммоль экв/л) по формуле:
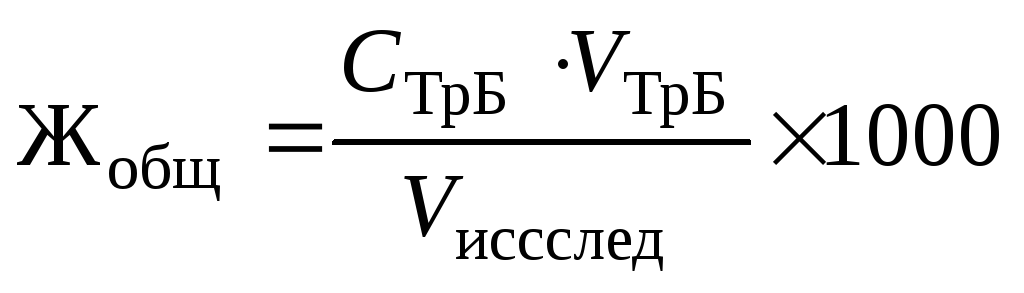
где СТрБ — молярная концентрация эквивалента (нормальность) раствора трилона Б; VТрБ — объем трилона Б, пошедший на титрование; Vисслед — объем исследуемой воды; 1000 — коэффициент перехода от моль экв/л к ммоль экв/л.
По полученным данным сделать вывод об уровне жёсткости исследованной воды.
Пренебрегая вкладом карбонатов в величину постоянной жёсткости и считая, что в данном случае временная жёсткость воды совпадает с карбонатной жёсткостью, т.е. Жкарб = Жвр, рассчитать постоянную жёсткость воды по разности между общей и временной жёсткостью.
источник
Жесткость воды. Мягкая вода. Жесткая вода. Перевод единиц (градусов) жесткости воды. Нормы жесткости воды. Таблицы значений жесткости воды.
Жесткость воды. Мягкая вода. Жесткая вода. Перевод единиц (градусов) жесткости воды. Нормы жесткости воды. Таблицы значений жесткости воды.
- жёсткой называется вода с большим содержанием солей ,
- мягкой с малым содержанием
«Жёсткая» вода — исторически: ткань, постиранная с использованием мыла на основе жирных кислот в жёсткой воде — более жёсткая на ощупь. Этот факт объясняется, с одной стороны, отложением на ткани кальциевых и магниевых солей жирных кислот, образующихся в процессе стирки. С другой стороны, волокна ткани обладают ионообменными свойствами, и, как следствие, свойством сорбировать многовалентные катионы — на молекулярном уровне.
- временная (карбонатная) жёсткость, — обусловлена гидрокарбонатами кальция и магния Са(НСО3)2; Mg(НСО3)2,
- постоянная (некарбонатная) жёсткость — вызванную присутствием других солей, не выделяющихся при кипячении воды: в основном, сульфатов и хлоридов Са и Mg (CaSO4, CaCl2, MgSO4, MgCl2).
С 1 января 2014 года в России введен межгосударственный стандарт ГОСТ 31865-2012 «Вода. Единица жесткости». По новому ГОСТу жесткость выражается в градусах жесткости (°Ж). 1 °Ж соответствует концентрации щелочноземельного элемента, численно равной 1/2 его миллимоля на литр (1 °Ж = 1 мг-экв/л). В разных странах использовались (иногда используются до сих пор) различные внесистемные единицы — градусы жёсткости.
| Жесткость, °Ж | Кальций, мг/л | Магний, мг/л | |
|---|---|---|---|
| Москва | 2,0-5,5 | 46 | 11 |
| Париж | 5,0-6,0 | 90 | 6 |
| Берлин | 5,0-8,8 | 121 | 12 |
| Нью-Йорк | 0,3-0,4 | 6 | 1 |
| Сидней | 0,2-1,3 | 15 | 4 |
- Рекомендации всемирной организации здравоохранения (ВОЗ) для питьевой воды:
- кальций – 20-80 мг/л; магний – 10-30 мг/л. Для жесткости какой-либо рекомендуемой величины не предлагается. Московская питьевая вода по данным показателям соответствует рекомендациям ВОЗ.
- Российские нормативные документы (СанПиН 2.1.4.1074-01 и ГН 2.1.5.1315-03) для питьевой воды регламентируют:
- кальций – норматив не установлен; магний – не более 50 мг/л; жесткость — не более 7°Ж.
- Норматив физиологической полноценности бутилированной воды (СанПиН 2.1.4.1116-02):
- кальций – 25-130 мг/л; магний – 5-65 мг/л; жесткость – 1,5-7°Ж.
- По содержанию кальция и магния бутилированная вода высшей категории официально ничем не лучше воды из-под крана
| °Ж = 1 мг-экв/л | mmol/L | ppm, mg/L | dGH, °dH | gpg | °e, °Clark | °fH | |
| 1 русский °Ж = 1 мг-экв/л это: | 1 | 0,5 | 50,05 | 2,804 | 2,924 | 3,511 | 5,005 |
|---|---|---|---|---|---|---|---|
| 1 ммоль/л = mmol/L это: | 2 | 1 | 100.1 | 5.608 | 5.847 | 7.022 | 10.01 |
| 1 американский° ppmw = mg/L = American degre: | 0,01998 | 0.009991 | 1 | 0.05603 | 0.05842 | 0.07016 | 0.1 |
| 1 немецкий° dGH, °dH это: | 0,3566 | 0.1783 | 17.85 | 1 | 1.043 | 1.252 | 1.785 |
| 1 американская популярная ед. gpg это: | 0,342 | 0.171 | 17.12 | 0.9591 | 1 | 1.201 | 1.712 |
| 1 английский °e, °Clark это: | 0,2848 | 0.1424 | 14.25 | 0.7986 | 0.8327 | 1 | 1.425 |
| 1 французский °fH это: | 0,1998 | 0.09991 | 10 | 0.5603 | 0.5842 | 0.7016 | 1 |
| Пример: 1 °Ж = 50,05 ppm | |||||||
- американские градусы жесткости воды, внимание тут два пункта:
- gpg = Grains per Gallon: 1 гран (0.0648 г) CaCO3 в 1 американском галлоне (3.785 л) воды. Поделив граммы на литры получаем: 17.12 мг/л СаСО3 — это не «американский градус», но очень употребляемая в штатах величина жесткости воды.
- американский градус = ppmw = mg/L = American degre: 1 часть CaCO3 в 1000000 частей воды 1мг/л CaCO3
- английские градусы жесткости воды = °e = °Clark: 1 гран (0.0648 г) в 1 английском галлоне (4.546) л воды = 14.254 мг/л CaCO3
- французские градусы жесткости воды (°fH or °f) (fh): 1 часть CaCO3 в 100000 частей воды, или 10 мг/л CaCO3
- немецкие градусы жесткости воды = °dH (deutsche Härte = «немецкая жесткость» может быть °dGH (общая жесткость) или °dKH (для карбонатной жёсткости)): 1 часть оксида кальция – СаО в 100000 частей воды, или 0.719 частей оксида магния – MgO в 100000 частей воды, что дает 10 мг/л СаО или 7.194 мг/л MgO
- русский (РФ) градус жесткости воды °Ж = 1 мг-экв/л: соответствует концентрации щелочноземельного элемента, численно равной 1/2 его миллимоля на литр, что дает 50,05 мг/л CaCO3 or 20.04 мг/л Ca2+
- ммоль/л = mmol/L: соответствует концентрации щелочноземельного элемента, численно равной 100.09 мг/л CaCO3 or 40.08 мг/л Ca2+
- Термоумягчение. Основан на кипячении воды, в результате термически нестойкие гидрокарбонаты кальция и магния разлагаются с образованием накипи:
- Ca(HCO3)2 → CaCO3↓ + CO2 + H2O.
- Кипячение устраняет только временную (карбонатную) жёсткость. Находит применение в быту.
- Реагентное умягчение. Метод основан на добавлении в воду кальцинированной соды Na2CO3 или гашёной извести Ca(OH)2. При этом соли кальция и магния переходят в нерастворимые соединения и, как следствие, выпадают в осадок. Например, добавление гашёной извести приводит к переводу солей кальция в нерастворимый карбонат:
- Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
- Лучшим реагентом для устранения общей жесткости воды является ортофосфат натрия Na3PO4, входящий в состав большинства препаратов бытового и промышленного назначения:
- 3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaHCO3
- 3MgSO4 + 2Na3PO4 → Mg3(PO4)2↓ + 3Na2SO4
- Ортофосфаты кальция и магния очень плохо растворимы в воде, поэтому легко отделяются механическим фильтрованием. Этот метод оправдан при относительно больших расходах воды, поскольку связан с решением ряда специфических проблем: фильтрации осадка, точной дозировки реагента.
- Катионирование. Метод основан на использовании ионообменной гранулированной загрузки (чаще всего ионообменные смолы). Такая загрузка при контакте с водой поглощает катионы солей жёсткости (кальций и магний, железо и марганец). Взамен, в зависимости от ионной формы, отдаёт ионы натрия или водорода. Эти методы соответственно называются Na-катионирование и Н-катионирование.
- При правильно подобранной ионообменной загрузке жёсткость воды снижается при одноступенчатом натрий-катионировании до 0,05-0,1 °Ж, при двухступенчатом — до 0,01 °Ж.
- В промышленности с помощью ионообменных фильтров заменяют ионы кальция и магния на ионы натрия и калия, получая мягкую воду.
- Обратный осмос. Метод основан на прохождении воды через полупроницаемые мембраны (как правило, полиамидные). Вместе с солями жёсткости удаляется и большинство других солей. Эффективность очистки может достигать 99,9 %.
- Различают нанофильтрацию (условный диаметр отверстий мембраны равен единицам нанометров) и пикофильтрацию (условный диаметр отверстий мембраны равен единицам пикометров).
- В качестве недостатков данного метода следует отметить:
- — необходимость предварительной подготовки воды, подаваемой на обратноосмотическую мембрану;
- — относительно высокая стоимость 1 л получаемой воды (дорогое оборудование, дорогие мембраны);
- — низкую минерализацию получаемой воды (особенно при пикофильтрации). Вода становится практически дистиллированной.
- Электродиализ. Основан на удалении из воды солей под действием электрического поля. Удаление ионов растворенных веществ происходит за счёт специальных мембран. Так же как и при использовании технологии обратного осмоса, происходит удаление и других солей, помимо ионов жёсткости.
источник
Представить себе жизнь без воды сегодня невозможно. Любой человек использует ее каждый день, не обходится без воды и производство. Во многих технологических процессах воду используют постоянно. Производство микросхем, даже абразивные чистки применяют воду с завидным постоянством. И можно смело утверждать, что без качественной воды сегодня не продержаться на рынке. Что касается обычных потребителей, то вода плохого качества влияет на здоровье. Негативно влияет. Снижает качество обработки продуктов и многое-многое другое.
В чем причина плохого качества воды? Что делает ее жесткой? Сразу нужно уточнить, что варианты загрязнения могут быть самыми разными. От банальной грязи и твердых примесей, до невидимых органических примесей, которые могут сделать воду вирусоносной, жесткой или железистой.
Способов смягчения жесткой воды на сегодня идентифицировано несколько. Что вообще понимают под термином «жесткость»? Это такая характеристика воды, которая подразумевает под собой наличие в воде определенного размера включений солей кальция и магния.
Карбонатная жесткость воды подразумевает наличие в воде карбонатных солей. Это как раз и есть соли кальция и магния. Жесткость может быть и сульфатной. Но в большинстве случаев встречается именно карбонатная. А это практически 98 процентов случаев. Потому и будем уделять карбонатной жесткости воды больше всего внимания.
Итоговое содержание солей в воде именуют жесткостью. Даже если быть совсем точной, то это общая жесткость. Для жизни это один из самых важных факторов. Для производства также есть большое значение в этом показателе. Для тех, кто держит аквариум, карбонатная жесткость воды также является важным показателем. Т.к. в очень некачественной воде рыбы жить не смогут. Данный показатель подвергается постоянному контролю. Даже пресную воду следует различать по жесткости.
Общую жесткость делят на два подвида постоянную и временную. Эти виды также могут называться карбонатной, то есть временной и некарбонатной, то есть постоянной.
Карбонатную жесткость воды образуют гидрокарбонаты и карбонаты кальция и магния, о которых говорилось выше, при показателе кислотно-щелочного баланса, равного 8,3. Некарбонатную жесткость образуют кальциевые и магниевые соли сильнодействующих кислот.
Соли, образующие жесткость, ведут себя по-разному в воде. Одни при нагреве выпадают в осадок, другие полностью растворяются. Это и послужило признаком иерархии. Соли, которые создавали малорастворимый осадок, создали временную жесткость, то есть устранимую. Те же соли, которые растворялись в воде, образовали постоянную жесткость.
Более или менее с начальными понятиями определились. Теперь рассмотрим более подробно про снижение жесткости воды и узнаем, какие вещества и как образуют столь нужную нам для рассмотрения карбонатную жесткость воды.
Временная жесткость воды присутствует вместе с двухвалентными катионами кальция, магния и железа, а также бикарбонатных и гидрокарбонатных анионов. Стоит такую воду нагреть, и гидрокарбонаты разлагаются. На смену им приходят – малорастворимый карбонатный осадок, вода и углекислый газ.
Когда говорят об устранении жесткости в воде, то имеют в виду именно карбонатную жесткость воды. Ее можно устранить из воды, т.к. ее составляющие вступают в реакцию. Это временное явление и даже прокипятив воду, жесткость можно убрать, правда, тогда все прелести такой воды в виде накипи осядут на стенках оборудования.
Ну и постоянная жесткость остается в воде и после кипячения. Источники ее создания, это сульфаты, силикаты, хлориды и нитраты. На постоянную жесткость нельзя повлиять. Правда, при устранении карбонатной жесткости воды уменьшается количество и постоянной.
Что понимают под временной и постоянной жесткостью мы разобрались. Какие же на сегодня существуют варианты устранения карбонатной жесткости? Можно ли без лишних расходов сделать это в домашних условиях? И почему так вредная некачественная вода?
О накипи можно слагать легенды. Каждый из нас лицезрел ее на стенках чайника, кастрюль, не знал как с ней справится, когда она покрывает прочным слоем сеточку крана. Чего и говорить, но жесткая вода в домашних условиях, одна из самых больших проблем любой хозяйки. Времени на устранение уходит очень много, денег при этом не меньше, и бытовые приборы страдают от устранения налета не меньше, чем от самой накипи.
Но кроме бытовых проблем, данные методы устранения жесткости воды доставляют огромное количество неприятностей промышленности. Котельные, металлургия, микроэлектроника, химическая промышленность, теплоэнергетика. Все эти отрасли обойтись без качественной воды не могут. Качественная вода предполагает в дальнейшем производство качественной продукции.
И естественно очистка воды является главным производственным элементом в пищевой промышленности. Нельзя произвести вкусную и полезную воду, когда ее плохо очистили. Поэтому что дома в своей квартире, что на промышленном производстве умягчению воды следует уделять достаточно внимания.
Кроме умягчения можно бороться просто с накипью. Для этого достаточно устранять налет своевременно. Но проводить такие процедуры нужно постоянно и использовать для этого агрессивные средства или специальные механические приборы, которые позволят очистить даже самый толстый слой накипи.
Как и у каждой чистки, у очищения накипи есть масса недостатков. Мало того, что расходы на приобретение средств становятся постоянными и не малыми, так еще и бытовые приборы не так просто чистить. Да и поверхности никогда уже не будут по-прежнему гладкими. И естественно с каждым устранением накипи, поверхность будет становиться все более испорченной, а новые отложения будут образовываться быстрее. Может начать развиваться коррозия. Чтобы этого не произошло, давайте узнаем какие применяются способы для определения карбонатной жесткости воды.
Что у самой воды, что у накипи есть несколько особенностей, делающих их образование крайне неприятным. Некачественная вода плохо растворяет моющие средства. И это притом, что мы все моем в воде. Такая особенность вызывает резкое увеличение расходов и мыла с порошком и воды. Вода сегодня стоит немало, чтобы постоянно платить за определение карбонатной жесткости воды.
Что же касается непосредственно накипи, то она почти не проводит тепло. И из-за этого все беды. Образовываясь на топливных поверхностях и элементах, она просто полностью блокирует нормальную работу любого нагревательного прибора. В результате происходят необратимые вещи. Если не убирать такой налет своевременно.
Таблица. Виды и способы определения жесткости воды
| Состав исходной воды | Вид жесткости | Способ определения жесткости воды | |
| катионы кальция | анионы магния | ||
| Са | С плюсом | Карбонатная или некарбонатная | Химический анализ |
| Са | Постоянная или временная | Тест-полоска для определения жесткости | |
| Са Временная, карбонатная и в малой | Специализированная лаборатория | ||
Если вы пренебрегли каким либо способом, приведённым в таблице, вы можете лишиться своего дорогостоящего оборудования. Каждый из приведенных в таблице способов определения карбонатной жесткости воды крайне важен!
Во-первых, ухудшается работа любого оборудования или бытового прибора. КПД резко идет вниз. Из-за того, что накипь плохо нагревается, приходится расходовать в разы больше топлива, электричества, мощности с целью хоть как то нагреть воду. Для промышленности такая особенность накипи выливается в огромные расходы. Прибор постепенно покрывается накипью, пока поверхность практически полностью прекращает передавать тепло воде. Тогда срабатывает система защиты. Прибор самопроизвольно отключается, с целью защитить себя от перегрева. Получив такой сигнал, приступить к очистке поверхностей следует немедленно.
Накипи ведь много не надо. Из стадии легкий известковый налет она быстро переходит в стадию твердый известковый камень, который так легко не уберешь. И когда поверхности покрыты вот таким камнем и происходит перегорание прибора. Иногда это может выглядеть как взрыв или трещина, в чем тоже мало приятного. Трубы в водопроводе разрывает и протирает по этой причине.
Возиться с постоянным устранением налета, особенно в промышленности чрезвычайно накладно. Существует ряд способов, как справиться с повышенной жесткостью воды не повредив всю систему. Средства от накипи не дешевые. Как и вызов бригады для очистки. Подвергать таким нагрузкам поверхности постоянно тоже нельзя. Какой же путь избрать? Как наиболее эффективно бороться с карбонатной жесткостью воды?
Сразу скажу, что определение карбонатной жесткости воды в домашних условиях невозможно. Единственный, так сказать, кустарный вариант доступен только для очищения очень малого количества воды. И это вода будет скорее лечебной, чем просто умягченной. Многие ведь считают, что умягчители воды – дорогое удовольствие. Сегодня, к счастью это не так. Грамотность населения и просвященность в сфере очистки воды с каждым годом растет и потому между производителями фильтров для воды увеличивается конкуренция. И в ценах на подобные очистительные приборы наметилась положительная динамика к снижению.
Но вернемся к определению карбонатной жесткости воды в домашних условиях. Единственный материал, который позволит вам действительно получить качественную воду, это кремний. Все, что вам для этого нужно, это купить кусочек кремния и настоять на нем воду в течении недели. Вода получается мягкой, еще и снабженной всевозможными полезными веществами. Все полезные свойства кремния еще не изучены до конца, в будущем его планирует плотно использовать медицина. Но для очищения воды в домашних условиях, его достаточно, только для небольших обьемов.
Если же вы хотите поставить определение жесткости воды на поток, то вам нужен не просто умягчитель, вам нужна водоподготовка. Обойтись одним фильтром проблематично. Вода для быта и вода для потребления несколько разные инстанции и требования к качеству немного отличаются.
Для максимальной защиты предприятия или семьи дома потребуется, как минимум два умягчителя воды. Причем один должен чистить всю воду, априори. Другой будет проводить дополнительную очистку, которая поможет получить качественную питьевую воду. Для общих целей больше всего подходят, да и их чаще всего, и используют ионообменный фильтр для воды и электромагнитный умягчитель воды АкваЩит. Для получения вкусной питьевой воды лучше всего подойдет обратный осмос или фильтр-кувшин. Если уж совсем экономично.
Для специальной очистки, которая нужна в той же фармакологии или микроэлектронике используют микро или нанофильтрацию. Из последовательного соединения всех этих приборов и складывается водоподготовка. Часто, когда обрабатывают первичную воду, такую систему дополнительно оснащают механическими фильтрами, обеззараживателями, кондиционерами и обезжелезивателями. Тогда чистка идет сто процентная. От А до Я.
В быту из всех фильтров больше всего сегодня помогают избавиться от карбонатной жесткости воды электромагнитные приборы АкваЩит. Еще совсем недавно самыми прогрессивными очистителями считались магнитные устройства. Но в процессе эксплуатации было выявлена уйма недостатков, которые очень быстро привели к закату «звезды» магнитного устройства. Тогда собственно и изобрели электромагнитный прибор, как улучшенный вариант магнита.
Ионообменный фильтр хоть и считается одним из самых старых способов понижения жесткости воды, но тем не менее сегодня по прежнему занимает лидирующие позиции. Хотя в работе он довольно затратный. Его фильтрующая смола после полного забивания солями жесткости требует замены или восстановления. Стоит сменный картридж не то, чтобы дорого, но и не дешево. Менять при этом фильтр приходится раз в квартал.
Теперь зададимся вопросом: как вычислить карбонатную жесткость воды? Вот лишь несколько способов, как это можно сделать:
- Сделать химический анализ на жесткость;
- Отдать исходную воду в лабораторию;
- Купить специальный тест-полоску, которая покажет точную жесткость питьевой воды;
- Обратиться к специалистам за помощью в определении жесткости воды.
Если это крупное промышленное предприятие, вычислить жесткость воды можно и иными способами. Смолу придется восстанавливать путем постоянных промывок с помощью сильносоленого раствора. Потом появляются проблемы с устранением отходов, которые к тому же сильно соленные и требуют доочистки для утилизации. Но умягчает воду такой прибор намного лучше любых других. Как эконом вариант, этот прибор для вычисления карбонатной жесткости необходим и незаменим.
Электромагнитный прибор заслужил море комплиментов при использовании в быту, а также на предприятиях теплоэнергетики. У него масса плюсов, которые выгодно выделяют его из основной массы умягчителей.
Вычислить карбонатную и некарбонатную жесткость воды можно по следующей формуле Ca 2+ + 2HCO 3 — = CaCO 3 ↓ + H 2 O + CO 2 ↑ или же такой H + + HCO 3 — H 2 CO 3 CO 2 + H 2 O
При всей компактности и удобстве, электромагнитный прибор в состоянии не просто связать карбонатную жесткость воды, он отлично поможет избавиться от старой накипи, застрявшей на стенках. И сделает это крайне осторожно и очень качественно. Достаточно проработать прибору месяц, как слой накипи на стенках уменьшиться значительно. Вам даже достаточно будет замерить слой накипи перед установкой прибора и спустя месяц. Разница будет ощутимой. И при этом за месяц, вам к прибору даже не придется притрагиваться. Полное отсутствие обслуживания также является немаловажным плюсом данного прибора для вычисления жесткости воды. И никакого привыкания к влиянию электромагнитных волн.
Акващит прекрасно сотрудничает с любыми поверхностями, ему не важно, из чего сделаны трубы, а также все равно с какой скоростью течет вода и холодная она, или горячая. Не работает такой прибор только с неподвижной водой. АкваЩит прекрасно уменьшает жесткость воды не меняя химический состав жидкости. Но поскольку он сам устраняет осадок, то стоячая вода ему не страшна.
При монтаже прибора следует помнить, что ставить его нужно только на чистую внутри трубу. С остатками старой накипи прибор справится, а вот сразу пробиться через нее не сможет. Поэтому место установки следует обязательно чистить.
Мы рассмотрели все варианты классификаций карбонатной жесткости воды, а также узнали как вычислить и как определить карбонатную жесткость. С нею сегодня есть масса возможностей справится. При этом достаточно недорогих. Так, что с целью защитить себя от вредного влияния некачественной воды лучше продумайте варианты установки системы подготовки воды заранее.
источник
Как выполняется контроль жёсткости воды. Понятие жёсткости, от чего она зависит. Анализ воды на жёсткость дома. Лабораторные методы контроля общей и временной жёсткости жидкости. Приборы для выполнения анализа. Методы борьбы с повышенной жёсткостью в быту. Контроль жёсткость воды или анализ воды на жёсткость нужен для определения концентрации солей в жидкости. Этот анализ можно проводить в лабораторных условиях и дома.
Жёсткость воды – термин, говорящий о процентном соотношении солевых частиц магния и калия в жидкости. Она подразделяется на две разновидности:
- Временная (такая жидкость называется карбонатная);
- Общая жёсткость (данная вода относится к некарбонатной).
Первый тип жёсткости характеризуется присутствием гидрокарбонатных солевых частиц магния и калия. Если такую воду закипятить, то элементы распадутся на карбонаты и гидроксиды и выпадут в осадок. Именно этот белый налёт часто покрывает наши чайники изнутри и собирается на других нагревательных элементах.
Для жидкости с общей жёсткостью характерно наличие других химических элементов (различных нитратов, хлоридов и тп.п). Обычно жёсткость питьевой воды связана с особенностями вашего региона, составом грунтов. Чем больше известковых пород находится в почве, тем выше жёсткость воды. Но важно не только понимать суть понятия, но и знать, как проверить жёсткость воды. Выполнить это легко как в быту, так и на заводе.
Для проверки жёсткости водопроводной воды дома можно использовать следующие способы:
- Постарайтесь обильно вспенить мыльный брусок или порошок для стирки. Если у вас образуется мало пены, то ваша вода имеет повышенную жёсткость. Это возникает по той причине, что солевые частицы калия и магния не позволяют мылу пениться. При обильной пышной пене от любого моющего средства можно утверждать, что вода нежёсткая. Но этот метод не позволят точно определить степень жёсткости.
- На вкус также можно отличить жёсткую воду от мягкой. Она более горькая. Но не все могут точно уловить горьковатый привкус солей магния и калия.
- Белый осадок в чайниках, накипь на нагревательных элементах других бытовых приборов – признак жёсткой воды. Осадок возникает из-за распада солей и выпадения их на дно. Данная особенность жёсткой воды очень вредит бытовым приборам и отопительному трубопроводу.
- От жёсткости воды зависит скорость заваривания чайного напитка. При мягкой воде на эту процедуру уйдёт от 3 до 6 мин., в жёсткой воде чай будет завариваться от 8 до 12 мин. Кстати, на вкус оба напитка будут существенно отличаться.
- Благодаря нехитрому компактному измерительному прибору можно очень легко определить жёсткость любой жидкости. Он называется TDS-метр. Агрегат измерят электропроводность жидкости. Чем выше показатель, тем больше уровень солесодержания жидкости. Обычно его ещё называют солемер. Чаще такой анализ воды на жёсткость делают владельцы аквариумов и цветоводы.
- Проверить жёсткость воды в быту можно, используя тест-полоски, продающейся в аптеках медтехники.
Для этого анализа можно использовать колориметрическую методику и принцип титрования. Процедура анализа выполняется так: порция воды смешивается с метилоранжем (индикатором), ёмкость устанавливается на светлом фоне. Во вторую тару с водой добавляют соляную кислоту, пока не получится красно-оранжевый цвет воды.
Временную жёсткость жидкости находят в процессе расчёта требуемого количества соляной кислоты по формуле: Нвр = NHCl * VHCL* 1000/ V1, где N-насыщенность раствора, V-его количество, V1-количество пробы.
Этот анализ проводят в лаборатории. Для него используют комплексонометрическую методику. Она базируется на принципе возникновения соединений ионов, подвергающихся анализу, с природными реагентами. Сначала воду в пробирке разводят раствором индикатора на спирту (чёрного этиохрома «Т»). Также для этих целей может использоваться сухая смесь кальциевых и натриевых хлоридов. В итоге полученная смесь окрашивается в насыщенный рубиновый цвет. Затем в пробирку капается вещество, называемое Трилон.
Расчёт общей жёсткости производится по уравнению: Жо=Nx*Vx*1000/V1, где N-насыщенность вещества Трилон, V-его количество, V1-количество пробы.
Как мы уже говорили выше, прибор контроля жёсткости воды называется солемер или TDS-метр. Точность проверки составляет 2%. Основной принцип работы данного агрегата построен на зависимости электропроводности жидкости от общего числа примесей солей магния и калия. То есть чем больше данных солей в воде, тем больше будут показания прибора, а следовательно, тем выше жёсткость воды.
На некоторых предприятиях и заводах наблюдается прямая зависимость между жёсткостью используемой воды и исправностью работы оборудования. Поэтому для обеспечения бесперебойной работы технологического оборудования требуется осуществлять постоянный автоматический контроль жёсткости воды.
Для этих целей используется специальное оборудование, например, анализатор «АКМС-1». Этот прибор непрерывно контролирует содержание солевых частиц кальция и магния в жидкости, поступающей в технологическое оборудование. То есть он подсчитывает общую жёсткость в пределах 0,005-25,0 мг-экв/л.
Как понять, что ваша водопроводная вода жёсткая, мы писали выше. Теперь перечислим ряд мер, позволяющих снизить жёсткость воды в домашних условиях:
- Самый простой способ – кипячение воды.
- Фильтрация воды через системы обратного осмоса (специальные мембраны).
- Использование смягчающих солей.
- Применение фильтрующих картриджей.
- Магнитное фильтрующее устройство.
- Использование ионообменной смолы в комплексе с солевым раствором.
Хотите провести контроль жёсткости воды? Заказать такую услугу вы можете у наших специалистов, для этого вам достаточно связаться с нами по указанным телефонам.
источник
Как отмечалось выше (разд. «Щелочность и кислотность») щелочность природной воды определяет, содержание карбонатов и гидрокарбонатов. Содержание этих компонентов в воде обусловлено процессами растворения атмосферного СОг, взаимодействия воды с находящимися в прилегающих грунтах известняками и, конечно, протекающими в воде жизненными процессами дыхания всех водных организмов.
Карбонат- и гидрокарбонат-анионы определяют титриметрическим методом, основанным на измерении водородого показателя (pH) по фенолфталеину (определение карбонат-анионов) или по метиловому оранжевому (определение гидрокарбонат-анионов) в качестве индикаторов. Используя эти два индикатора, удается наблюдать две точки эквивалентности: в первой точке (pH 8,0—8,2) в присутствии фенолфталеина полностью завершается титрование карбонат-анионов, а во второй (pH 4,1—4,5) — гидрокарбонат-анионов. По результатам титрования можно определить концентрации в анализируемом растворе основных ионных форм, обусловливающих связывание водородных ионов (гидроксил-, карбонат- и гидрокарбонат-анионов), а также свободной и общей щелочности воды, величины которой находятся в стехиометрической зависимости от содержания гидроксил-, карбонат- и гидрокарбонат-анио- нов. Для титрования обычно используют титрованные растворы соляной кислоты с точно известным значением концентрации — 0,05 либо 0,1 моль/л.
Определение карбонат-анионов основано на реакции
Присутствие карбонат-аниона в концентрациях, определяемых аналитически, возможно лишь в водах, pH которых более 8,0—8,2. В случае присутствия в анализируемой воде гидроксил-анионов при определении карбонатов протекает также реакция нейтрализации:
Определение гидрокарбонат-анионов основано на реакции
Таким образом, при титровании по фенолфталеину в реакции с кислотой участвуют анионы ОН — и СОз 2- , а при титровании по метиловому оранжевому — ОН — , СОз 2- и НСОз — .
Величина карбонатной жесткости рассчитывается с учетом эквивалентных масс участвующих в реакциях карбонат- и гидрокарбонат-анионов.
При анализе карбонатных природных вод результаты рассчитывают по расходу кислоты на титрование по фенолфталеину и метилоранжу. Если титрование в присутствии фенолфталеина обычно не вызывает затруднений, так как происходит изменение окраски от розовой до бесцветной, то в присутствии метилового оранжевого при изменении окраски от желтой до оранжевой определить момент окончания титрования иногда довольно сложно. Это может привести к значительной ошибке при определении объема кислоты, израсходованной на титрование. В этих случаях для более четкого выявления момента окончания титрования определение полезно проводить в присутствии контрольной пробы, для чего рядом с титруемой пробой помещают такую же порцию воды (во второй склянке), к которой добавлено такое же количество индикатора.
В результате титрования карбоната и гидрокарбоната, которое может выполняться как параллельно в разных пробах, так и последовательно в одной и той же пробе, для расчета значений концентраций необходимо определить общее количество кислоты в миллилитрах, израсходованной на титрование карбоната (Ук) и гидрокарбоната (Кгк). Следует иметь в виду, что при определении расхода кислоты на титрование по метилоранжу (Емо) происходит последовательное титрование и карбонатов, и гидрокарбонатов. По этой причине расходуемый на титрование объем кислоты Кмо обусловлен присутствием в исходной пробе карбонатов, перешедших после реакции с катионом водорода в гидрокарбонаты, и не характеризует только концентрацию гидрокарбонатов в исходной пробе. Следовательно, при расчете концентраций основных ионных форм, обусловливающих расход кислоты, необходимо учесть расход кислоты при титровании по фенолфталеину (Кф) и метилоранжу (Кмо)- Рассмотрим несколько возможных вариантов, сопоставляя величины Уф и Кмо.
- 1. Уф = 0. Карбонаты, а также гидроксил-анионы в пробе отсутствуют, и при титровании по метилоранжу объем кислоты связан только с присутствием гидрокарбонатов.
- 2. Кф*0, причем 2 УфУмо- В данном случае в исходной пробе гидрокарбонаты отсутствуют, но присутствуют не только карбонаты, но и другие потребляющие кислоту анионы, а именно гидроксил-анионы. При этом содержание последних эквивалентно Кон = 2 Уф — Кмо- Содержание карбонатов можно рассчитать, решив систему уравнений
5. Уф = Умо- В исходной пробе отсутствуют и карбонаты, и гидрокарбонаты, и потребление кислоты обусловлено присутствием сильных щелочей, содержащих гидроксил-анионы.
Присутствие свободных гидроксил-анионов в заметных количествах (случаи 4 и 5) возможно только в сточных или загрязненных водах.
Массовые концентрации анионов (не солей!) рассчитываются на основании уравнений реакций потребления кислоты карбонатами (Ск) и гидрокарбонатами (Срк.) в мг/л по формулам
где Ук и У к — объемы раствора соляной кислоты, израсходованные на титрование карбоната и гидрокарбоната соответственно, мл; Н — точная концентрация титрованного раствора соляной кислоты (нормальность), моль/л экв.; УА — объем пробы воды, взятой для анализа, мл; 60 и 61 — эквивалентная масса карбонат- и гидрокарбонат-аниона соответственно в соответствующих реакциях; 1000 — коэффициент пересчета единиц измерений. Результаты титрования по фенолфталеину и метилоранжу позволяют рассчитать показатель щелочности воды, который численно равен количеству эквивалентов кислоты, израсходованной на титрование пробы объемом 1 л. При этом потребление кислоты при титровании по фенолфталеину характеризует свободную щелочность, а по метилоранжу — общую щелочность (в ммоль/л). Показатель щелочности используется в России, как правило, при исследовании сточных вод. В некоторых странах (США, Канаде, Швеции и др.) щелочность определяется при оценке качества природных вод и выражается массовой концентрацией в пересчете на СаС03.
Следует иметь в виду, что при анализе сточных и загрязненных природных вод получаемые результаты не всегда корректно отражают свободную и общую щелочности, так как в анализируемых пробах воды наряду с карбонатами и гидрокарбонатами, могут присутствовать другие соединения (см. «Щелочность и кислотность»).
Пипетка на 2 мл или на 5 мл, мерный шприц с наконечником и соединительной трубкой; пипетка-капельница; склянка с меткой «10 мл».
Раствор индикатора метилового оранжевого (0,1%) водный; раствор индикатора фенолфталеина; раствор соляной кислоты титрованный (0,05 моль/л).
Приготовление растворов см. приложение 3.
А. Титрование карбонат-аниона
1. В склянку налейте до метки (10 мл) анализируемую воду.
2. Добавьте пипеткой 3—4 капли раствора фенолфталеина.
Примечание. При отсутствии окрашивания раствора либо при слабо-розовом окрашивании считают, что карбонат-анион в пробе отсутствует (pH пробы менее 8,0—8,2).
3. Постепенно титруйте пробу с помощью мерного шприца с наконечником либо мерной пипетки раствором соляной кислоты (0,05 моль/л) до тех пор, пока окраска побледнеет до слабо-розовой (практически бесцветной), и определите объем раствора соляной кислоты, израсходованный на титрование по фенолфталеину (Уф, мл).
Раствор после титрования карбонат-аниона оставьте для дальнейшего определения в нем массовой концентрации гидрокарбонат-аниона.
Б. Титрование гидрокарбонат-аниона
4. В склянку налейте до метки (10 мл) анализируемую воду либо используйте раствор после определения карбонат-аниона.
5. Добавьте пипеткой 1 каплю раствора метилового оранжевого.
Примечание. Для более четкого определения момента окончания титрования определение полезно проводить в присутствии контрольной пробы, для чего рядом с титруемой пробой помещают такую же порцию анализируемой воды (во второй склянке), к которой добавлено такое же количество индикатора.
6. Постепенно титруйте пробу с помощью мерного шприца с наконечником раствором соляной кислоты (0,05 моль/л) при перемешивании до перехода желтой окраски в оранжевую, определяя общий объем раствора, израсходованного на титрование по метилоранжу (Ую, мл). При использовании раствора после определения карбонат-аниона необходимо определить суммарный объем, израсходованный на титрование карбоната и гидрокарбоната.
Примечание. При титровании обязательно перемешивайте раствор ! Момент окончания титрования определяйте по контрольной пробе.
В. Определение ионных форм, обусловливающих потребление кислоты на титрование В зависимости от соотношения между количествами кислоты, израсходованными на титрование по фенолфталеину (Уф) и метилоранжу (КМо), по табл. IV. 12 выберите подходящий вариант для вычисления ионных форм, обусловливающих потребление кислоты при титровании.
Таблица IV. 12. Определение ионных форм, обусловливающих потребление кислоты на титрование
источник
Вода имеет огромное значение в жизни каждого человека. Организм представляет собой комплекс водных растворов, суспензий и коллоидов. Степень жесткости воды непосредственно влияет на состояние организма, а также отвечает за долгий срок службы бытовой техники.
Фактически ни один из природных источников не обладает идеальным составом воды H2O. Основными источниками влаги являются поверхностные
наземные и подземные воды. Почему вода стала жесткой? Что на нее влияет? Процесс начинается еще в период ее формирования в горных породах. Жесткость воды – это комплекс физических характеристик воды, соответствующих количеству солей щелочноземельных металлов. Он претерпевает изменения также в соответствии с климатом, погодными условиями. Особо влияет на состав техногенный фактор, включающий сточные воды промышленного и бытового характера, сельского хозяйства. Влага из открытых и подземных источников требует очистки, чтобы соответствовать нормативным требованиям СанПин.
От чего зависит изменение состава воды? Жесткость обеспечивается повышенным содержанием минералов и химических элементов: железа, сульфидов, фторидов, марганца, солей кальция и магния, органических соединений. Она проявляется в ухудшении вкусовых параметров воды, плохом образовании пены при использовании мыла, стянутости кожи после умывания. Характерная жесткость волос, скрип после мытья говорят о разрушении защитной жировой пленки вследствие негативного воздействия повышенного количества минералов. Но излишне мягкая вода обладает высокими коррозионными свойствами, сказывающимися на состоянии водопроводных труб. Отсутствие необходимых минералов в составе мягкой воды приводит к развитию рахита у детей, так как кости не получают требуемых веществ.
Общий показатель минерализации представлен временной и постоянной составляющей:
- Временная (карбонатная). В составе, кроме катионов Ca2+, Fe2+, Mg2+, содержатся также растворимые бикарбонаты Mg и Ca. После кипячения они становятся нерастворимыми карбонатами, образующими накипь.
- Постоянная (некарбонатная). Независимо от кипячения жидкость такого типа сохраняет свои жесткие признаки, так как содержит соли магния
и кальция нитратных, хлоридных, сульфатных анионов.
Вода допустимой жесткости пригодна для питья. Содержащиеся в ней микроэлементы нужны человеческому организму:
- Магний. Активизирует обмен углеводов, участвует в образовании белков, уменьшает возбудимость нервных клеток.
- Кальций. Поддерживает костную ткань, отвечает за работу сердца, свертываемость крови, расслабление мышц, работу иммунитета.
Постоянный прием жесткой воды ведет к проблемам функционирования пищеварительной системы, формированию камней в почках, печени, желчном пузыре. Нормальный уровень минерализации составляет не более 7 мг/л. При бытовом использовании временная жесткость приводит в негодность бытовую технику из-за образования плотного налета накипи.
Какая должна быть вода для питья и бытовых нужд? Классификация единиц измерения жесткости весьма разноплановая. Часто можно увидеть обозначение в миллимолях на литр, принятое на постсоветском пространстве. Миллимолем называют единицу объема соли жесткости на литр воды. Единицей измерения жесткости воды за границей является градус жесткости. Основные категории обозначения:
- ppm (мг/литр) CaCO3;
- DH – Германия (1 dH=17,8 ppm);
- F – Франция (1 f =10 ppm);
- A – Америка (1A=50,05 ppm);
- Clarc – Великобритания (1 Clarc=14,3 ppm);
- мг-экв/л (1 мг-экв/л =50,05 ppm).
Как рассчитать жесткость воды? Один мг-экв/л – это 20,04 миллиграмм Ca2+ или 12,16 миллиграмм Mg2+ на литр. Норма жесткости – 1,0–2,0 мг-экв/л. Водопроводная вода имеет жесткость от 1,5 до 5 мг-экв/л, что зависит от водозабора и не требует корректировки. Централизованный источник водоснабжения обязан выдавать питьевую воду с нормальной жесткостью – до 7 мг-экв/литр (в исключительных случаях – не более 10 мг-экв/литр).
После 2005 года Россия применяет новый национальный стандарт, определяющий параметры известковости. Для измерения содержания солей используется «градус жесткости» – °Ж, который равняется 1 мг-экв/литр. Формула общего показателя °Ж – H общая = H карбонатная + H некарбонатная. В соответствии с этим коэффициентом шкала степени мягкости подразделяется на несколько категорий:
- сверхжесткая – свыше 12 мг-экв/л;
- жесткая – более 10 °Ж (от 8 до 12 мг-экв/л);
- средняя – от 2 до 10 °Ж (от 4 до 8 мг-экв/л);
- мягкая – до 2 °Ж (до 4 мг-экв/л);
- очень мягкая (до 1,5 мг-экв/л).
Какая должна быть вода? Характеристика высококачественной питьевой воды по нормативным требованиям:
- органолептические характеристики: прозрачность, отсутствие запаха, приятный вкус;
- pH = 7–7,5, жесткость не превышает значение 7 ммоль/л, что является средним уровнем. Допускается небольшое ощелачивание воды, но не окисление;
- общее число минералов не выше 1 г/л, вода является слабоминерализованной;
- отсутствие вредных веществ или концентрация в пределах десятых-сотых долей ПДК;
- отсутствие вирусов, бактерий, грибков.
Даже средний параметр жесткости по стандарту, равняющийся 4–5 °Ж, уже доставляет неприятности в виде налета извести на мойке, накипи на чайнике, белесых разводов на посуде, забитого аэратора водопроводного крана.
Как измеряется жесткость воды? Степень жесткости следует знать не только в отношении питьевой воды. Аквариумисты сталкиваются с необходимостью создания определенной минерализации водной среды для разведения рыб. Выращивание комнатных растений также требует информированности о показателе жесткости.
Оборудование для очистки невозможно подобрать правильно без понимания результатов анализа. Самым точным измерением является лабораторный анализ, сделанный в Санэпидемстанции. Фиксирование степени минерализации производится тремя основными методами:
- химическим;
- комплексонометрическим (определение карбонатной и временной жесткости);
- атомной спектрометрии.
Все приборы диагностирования, от бытовых до профессиональных лабораторных, позволяют осуществлять контроль над составом и уровнем загрязнения. Анализ питьевой воды осуществляется не только стационарно, но и непосредственно на точке забора.
Анализаторы воды подразделяются на монопараметрические (анализ одного параметра) и многопараметрические (анализ нескольких характеристик). С их помощью проводятся исследования всех типов воды: питьевой, технической, грунтовой, из искусственных водоемов; сточной. При этом анализ производится на основе химического, оптического, электрохимического, хроматографического, фотохимического метода.
Анализаторы могут быть портативными, производящими замер параметров в течение 5 минут в бытовых или полевых условиях. Другой вариант анализаторов – стационарный. Они монтируются в проточных трубах водопровода и других магистралей. Постоянная работа устройств обеспечивает выдачу объективных данных состава воды каждый час.
Одним из самых доступных механизмов для определения жесткости является электролизер. Этот аппарат не производит измерений, жесткость определяется по степени изменения цвета воды во время его работы. Более точный инструмент, помогающий получить косвенные показатели величины общей жесткости – TDS-3. Принцип его работы основан на определении электропроводности.
Наиболее быстрый способ установления жесткости в домашних условиях — использование тест-полоски со специальным реагентом. Опущенная в воду полоска начнет менять цвет в соответствии с концентрацией жесткости воды. Точность у приема невысокая, результат определяется по интенсивности окраса путем сравнения с градацией возможных вариантов.
- Термический. Производится кипячение.
- Реагентный (известь, сода кальцинированная и пищевая, едкий натр, синтетические средства). Наблюдается появление осадка нерастворимых соединений кальциевых и магниевых солей. Один из лучших реагентов – ортофосфат натрия, понижающий уровень жесткости до 0,05 °Ж.
- Мембранный. Ионы отделяются посредством нанофильтрации и обратного осмоса полунепроницаемой мембраны.
- Магнитный и Электромагнитный. Магнитогидродинамический резонанс предотвращает кристаллизацию карбоната кальция. Происходит его модификация в арагонит, лишенный свойства откладываться на поверхностях.
- Ионообменный.
- Комбинированный.
Простая технология устранения жесткости – это процесс кипячения, в результате которого часть солей гидрокарбоната кальция разлагается. Но такой метод не полностью избавляет от жесткости и не годится для больших объемов воды. Водопроводная кипяченая вода приносит человеку лишь вред. Процесс кипячения увеличивает вредоносность хлорорганики, содержащейся в ее составе и обладающей канцерогенными свойствами.
Защитить технику позволяет бытовая химия, например, специальное средство «Калгон». Действие подобных препаратов основано на предотвращении выпадения солей в осадок. Метод подходит лишь для защиты стиральной или посудомоечной машины. Такие вещества не предназначены для питьевой воды. Добавление извести для очистки должно сочетаться с применением реагентов-коагулянтов. Способ помогает снизить повышенное содержание карбонатных соединений.
Сочетание извести и соды позволяет смягчить воду до 1,4–1,8 мг-экв/л. Если жидкость обладает карбонатной жесткостью, то применяется сода с натрием. Недостатком приема использования реагентов является наличие твердого осадка, очистка только не питьевой воды, непременность точной дозировки и безопасного хранения.
Более простой механизм для очистки жесткой воды – магнитный. Он эффективен для технической воды, позволяя контролировать чистоту внутренних поверхностей оборудования. В пластиковом корпусе находится процессор, постоянный магнит, два провода. Процесс основывается на изменении физических свойств воды. Минерализующие элементы перестают образовывать накипь и отложения, устраняются с потоком. Образующийся шлак скапливается в отстойниках, а затем удаляется.
Электромагнитный способ базируется на использовании электромагнитных волн. Ионы кальция и магния не осаждаются, а в виде взвесей ликвидируются вместе со струей воды. При этом происходит очистка загрязненных ранее участков.
Самый экономичный и доступный рецепт смягчения воды – это ионообменный кувшин с электромагнитом. Процесс очистки основан на ионообменных свойствах мелкозернистой натриевой смолы. Объем очищаемой воды небольшой, запас ионов в смолах требует своевременной регенерации или замены, но качество очистки хорошее.
Устранение жесткости происходит реагентным путем, использованный картридж подлежит замене. Подобного типа прибор может быть магистральным, врезаемым непосредственно в трубу. Так осуществляется очищение всей поступающей в квартиру воды. При этом затраты при использовании возрастают из-за потребности создания обходного пути или запорной арматуры, а также замены картриджей. Смена картриджа производится раз в квартал. Недостаток метода – в очистке воды, не предназначенной для питья и приготовления пищи.
Есть также усовершенствованный вариант – мембранный, служащий основой для обратноосмотического эффекта. Посредством избыточного давления жесткая влага продавливается сквозь полупроницаемую мембрану, освобождаясь от всех солей и примесей. На выходе остается почти дистиллированная вода. Это тактика максимальной очистки. После такой обработки вода требует дополнительной минерализации.
Для смягчения питьевой воды применяются фильтры:
- Фильтр обратного осмоса. Производит полную очистку от всех ненужных примесей и солей, придающих жесткость воде. Обратноосмотическая мембрана действует до 1,5 лет, картриджи меняют раз в полгода.
- Проточный фильтр под мойку («Умягчающий», H). Дополнительный картридж содержит ионообменную смолу внутри, заменяющую ионы солей магния и кальция безопасными ионами натрия.
Все перечисленные методики могут использоваться также в различных комбинациях друг с другом.
Изменение параметра жесткости в меньшую сторону – это недешевая операция, требующая вложения денег. Развитие современных технологий вносит новые решения очистки. Снижение высокой минерализации воды – это жизненная потребность любого человека, желающего оставаться здоровым.
источник

