Жёсткость – технологическая характеристика качества воды любого происхождения, связанная с содержанием растворимых в ней соединений кальция и магния. Она определят, в основном, потребительские качества воды и потому анализ воды на жесткость имеет важное хозяйственное значение. Общая жесткость определяется как суммарное содержание всех солей кальция и магния в растворе.
В разных странах существуют свои нормы жесткости для воды. У нас в стране вода классифицируется по жесткости таким образом: вода считается мягкой, если её жёсткость (Q) меньше 4 ммоль/л, средняя – 4-8, жёсткая – 8-12, очень жёсткая – свыше 12ммоль/л.
Рекомендованная единица СИ для измерения концентрации — моль на кубический метр (моль/м³), однако, на практике для измерения жёсткости используются градусы жёсткости и миллиграммы эквивалента на литр (мг-экв/л).
— Мягкая вода с жесткостью менее 3,0 мг-экв/л,
— Средней жесткости – 3,0-6,0 мг-экв/л
— Жесткая – более 6,0 мг-экв/мл.
В разных странах использовались (иногда используются до сих пор) различные внесистемные единицы — градусы жёсткости. По величине общей жёсткости различают воду мягкую (до 2 °Ж), средней жёсткости (2-10 °Ж) и жёсткую (более 10 °Ж).
Жёсткость воды поверхностных источников существенно колеблется в течение года; она максимальна в конце зимы, минимальна — в период паводка
Химический анализ воды показал, что существует два типа жесткости: временная и постоянная. Временная (карбонатная) жёсткость обусловлена наличием гидрокарбонатов кальция и магния (Ca(HCO3)2 , Mg(HCO3)2). Устраняется кипячением.Если в воде присутствуют ионы железа, то образуется FeCO3 — неустойчивое в воде вещество. В присутствии кислорода конечным продуктом цепочки реакций оказывается Fe(OH)3, представляющий собой темно-рыжий осадок. Поэтому, чем больше в воде железа, тем сильнее окраска у накипи, которая осаждается на стенках и дне сосуда при кипячении
Постоянная (некарбонатная) жёсткость обусловлена наличием хлоридов, сульфатов, нитратов и других анионов. Кипячением не устраняется. Для её устранения используют химические и физические способы.
Химический способ основан на переводе растворимых соединений кальция и магния в нерастворимые и удалением их при фильтровании.
. Физические способы основаны на применении ионообменных смол. Наиболее широко используется катионообменный способ, основанный на применении специальных реагентов – катионитов, которые загружаются в фильтры и при пропускании через них воды, заменяют катионы кальция и магния на катион натрия.
Лучшим реагентом для устранения общей жесткости воды является ортофосфат натрия Na3PO4, входящий в состав большинства препаратов бытового и промышленного назначения
Полностью очистить воду от солей жёсткости можно дистилляцией.
Анализ воды на жесткость в лаборатории производится комплексонометрическийм методом и методом нейтрализации.
Комплексонометрический метод основан на образовании устойчивых комплексонатов при взаимодействии ионов металлов с комплексоном III (метод комплексонометрии). В основе этого метода лежит титрование воды в присутствии аммонийного буферного раствора (pH=10,0) и индикатора хромогена чёрного раствором комплексона III до перехода винно-красной окраски в синюю.
Анализ проб воды на временную жесткость проводят, используя метод нейтрализации в основе, которого лежит титрование воды в присутствии индикатора метилового оранжевого раствором соляной кислоты до перехода жёлтой окраски индикатора в оранжевую. При добавлении кипячении карбонатная жесткость воды уменьшается на 57-70%.
Таким образом, можно определить общую и временную жесткость воды и частично снизить ее негативное воздействие на организм.
источник
Определяют общую, кальциевую и магниевую жесткость.
Общая жесткость воды характеризует суммарную концентрацию ионов кальция (кальциевая жесткость) и магния (магниевая жесткость), мг-экв/л.
В зависимости от анионов, с которыми взаимодействуют катионы жесткости (Mg2+, Ca2+), различают карбонатную и некарбонатную жесткость.
Карбонатная жесткость обусловлена присутствием в воде карбонатов кальция и магния. Некорбанатная — содержанием в воде, главным образом, сульфатов и хлоридов кальция и магния. Карбонатная и некарбонатная жесткость могут быть рассчитаны на основании определения общей, кальциевой жесткости и концентраций сульфатов и хлоридов.
Определение жесткости проводят комплексонометрическим методом с двунатриевой солью этилендиаминтетрауксусной кислоты (Трилоном Б, Na2H2R):
NaOOC – H2C CH2OOH
N – CH2 – CH2 – N (11)
Титрование проводят в щелочной среде в присутствии индикатора ( хромоген черный ЕТ-00, эриохром черный Т, кислотный хром темно-синий, точка эквивалентности при рН
При титровании раствора Трилоном Б происходит разрушение комплекса металла с индикатором (Me2+ [Ind]) и образование более прочного комплекса металла с Трилоном Б:
Me2+[Ind] + Na2H2R Na2[ MeR ] + Ind + 2 H+, (12)
где Me — Ca, Mg; R — радикал этилендиаминтетрауксусной кислоты.
Условия применимости. Метод применим при минимальной жесткости
0.05 мг-экв/л. При жесткости выше 20 мг-экв/л можно проводить титрование пробы 0,1 н Раствором трилона Б. При жесткости от 0,5 до 20 мг-экв/л — 0,05 н. раствором трилона Б и при жесткости менее 0,5 мг-экв/л — применяется раствор концентрации 0,01 н.
Мешающие влияния. Определению жесткости мешают железо, цинк, медь, олово, марганец, так как применяемы индикаторы чувствительны к присутствию данных катионов. Для устранения мешающего влияния в пробу добавляют сульфид натрия, а в случае присутствия марганца — солянокислый гидроксиламин.
– 1% раствор солянокислого гидроксиламина;
– 2–5% раствор сульфида натрия;
– индикатор (хромоген черный ЕТ-00, эриохром черный Т, кислотный хром темно-синий);
Определение общей жесткости. Для анализа берут пипеткой 100 мл пробы (или меньшее количество при высокой жесткости, доводя объем до 100 мл), если необходимо добавляют 2 мл раствора солянокислого гидроксиламина (1%) и 1 мл раствора сульфида натрия (2. 5%), 5 мл буферного раствора (рН=10) и 0,1–0,2 г индикатора. После перемешивания пробу титруют трилоном Б до перехода окраски из винно-красной до синей.
Общую жесткость пробы х, мг-экв/л, вычисляют по формуле:
(13)
где N – нормальность раствора трилона Б;
V – количество раствора трилона Б, израсходанного на титрование, мл.
В кислой среде необходимо параллельно определить кислотность, а затем в пробу для определения жесткости добавить эквивалентное количество щелочи, пошедшее на нейтрализацию кислотности и производить определение обычным способом.
Ион кальция в щелочной среде при рН выше 10 с мурексидом образует соединения, окрашенные в оранжево-розовый цвет. В этих условиях магний не титруется трилоном Б.
Для определения в колбу отбирают пипеткой 100 мл пробы, содержащей не более 15 мг кальция или меньшее количество пробы, разбавленное до 100 мл дистиллированной водой.
Кислые пробы при анализе нейтрализуют добавлением щелочи в количестве, эквивалентном кислотности пробы. При анализе проб, щелочность которых превышает 6 мг-экв/л, добавляют эквивалентное количество 0,1 н соляной кислоты, кипятят 1 минуту и охлаждают.
Затем прибавляют 2 мл едкого натра, индикатор и титруют трилоном Б до изменения окраски из розовой в лиловую.
Помимо перечисленных вредных влияний на точность определения могут влиять фосфаты. При высоком содержании фосфатов при рН
12–13 выпадает осадок фосфата кальция. Для устранения влияния фосфатов раствор разбавляют.
– коническая колба емкостью 250 мл;
В коническую колбу емкостью 250 мл вносят 100 мл исследуемой воды. Затем прибавляют 2 мл 2 н раствора NаОН, на кончике ложечки вносят в колбу немного сухого индикатора мурексида и медленно титруют 0,1 н раствором трилона Б при энергичном перемешивании до перехода окраски от красной до лиловой.
Расчет содержания иона Са2+ в воде производят по формуле
(14)
где V – количество раствора трилона Б в мл, израсходованное на титрование;
К – поправочный коэффициент к титру раствора трилона Б;
N– нормальность раствора трилона Б;
W – объем исследуемой воды в мл.
Магниевую жесткость определяют расчетным способом, вычитая результаты определения кальциевой жесткости из общей жесткости.
Содержание ионов магния Мg2+ вычисляют по формуле:
где А – общая жесткость воды, мг-экв/л;
В – кальциевая жесткость воды, мг-экв/л;
L – эквивалент магния, мг/л.
источник
Химический анализ природной и питьевой воды. Метод ионообменной хроматографии и титриметрический метод определения ионов кальция и магния. Особенности приготовления растворов. Устранение мешающего влияния катионов железа, марганца, цинка, меди и олова.
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Методика определения ионов кальция и магния в природных водах (определение общей жесткости воды)
2. Приготовление растворов
3.1 Титриметрический метод
3.2 Метод ионообменной хроматографии
Химический анализ природной и питьевой воды показывает, что любая вода представляет собой не чистое вещество с формулой Н2О, а смесь большого количества веществ.
Многочисленные анализы природных вод показали, что среди большого числа компонентов, растворенных в них, 90 % солесодержания составляют карбонаты, гидрокарбонаты, хлориды и сульфаты кальция, магния и натрия. О.А. Алекиным предложена классификация природных вод по результатам их химического анализа. По преобладающему аниону воды делятся на три класса: карбонатные (гидрокарбонатные), хлоридные и сульфатные. По преобладающему катиону воды делятся на три группы: кальциевые, магниевые и натриевые.
В природных водах постоянно находятся ионы кальция и магния, обеспечивающие жесткость воды. Источник их поступления в воду — растворение гипса, известняков и доломитов, входящих в состав горных пород. В санитарно-гигиеническом отношении ионы кальция и магния не представляют большой опасности, но чрезмерная жесткость воды делает ее непригодной для бытовых целей, т.к. образующаяся накипь выводит из строя нагревательные элементы электрических систем нагрева воды. Оптимальная жесткость воды — до 7 мг-экв/л.
Для определения ионов кальция и магния используются два метода:
2. метод ионообменной хроматографии
1. Наиболее точный и распространенный метод определения общей жесткости — комплексометрический, основанный на образовании ионами Са 2+ и Mg 2+ прочных внутрикомплексных соединений с трилоном Б. В качестве индикатора при определении общей жесткости используется эриохром черный. В зависимости от общей жесткости концентрация рабочего раствора трилона Б и объем пробы воды могут быть различными.
Для определения кальция в природных водах преимущественно используются трилонометрический метод с индикатором мурексидом.
Содержание магния проводят расчетным методом, зная общую жесткость и содержание кальция.
2. Приготовление растворов
Раствор трилона Б с концентрацией 0,02 моль/дм 3 эквивалента.
Навеску 3,72г. трилона Б растворяют в 1 дм 3 дистиллированной воды. Точную концентрацию устанавливают по стандартному раствору хлорида цинка. Раствор хранят в полиэтиленовой посуде, проверяют его концентрацию не реже 1 раза в месяц.
Раствор хлорида цинка с концентрацией 0,02 моль/ дм 3 эквивалента.
Отвешивают на технических весах около 0,35 г металлического цинка, смачивают его небольшим количеством концентрированной соляной кислоты и сейчас же промывают дистиллированной водой. Цинк сушат в сушильном шкафу при 105 течение 1ч, затем охлаждают и взвешивают на аналитических весах.
Навеску цинка помещают в мерную колбу вместимостью 500 см 3 , в которую предварительно вносят 10-15 см 3 дистиллированной воды и 1,5 см 3 концентрированной соляной кислоты. Цинк растворяют. После растворения цинка объём раствора доводят до метки на колбе дистиллированной водой. Рассчитывают молярную концентрацию эквивалента раствора хлорида цинка CZn(1/2 ZnCl2), моль/дм 3 , по формуле:
где m — навеска металлического цинка, г; 32,69 — молярная масса эквивалента Zn 2+ , г/моль; V — объём мерной колбы, см 3 .
Буферный раствор NH4Cl +NH4OH.
7,0 г хлорида аммония растворяют в мерной колбе вместимостью 500 см 3 в 100 см 3 дистиллированной воды и добавляют 75 см 3 концентрированного раствора аммиака. Объем раствора доводят до метки дистиллированной водой и тщательно перемешивают. Буферный раствор хранят в стеклянной или полиэтиленовой посуде не более 2 месяцев. Гидроксид натрия, 2 моль/дм 3 .
40 г гидроксида натрия растворяют в мерной колбе вместимостью 500 см 3 и раствор доводят до метки дистиллированной водой.
Индикатор эриохром черный Т.
Растереть в ступке 0,25 г эриохрома черного Т с 50 г хлорида натрия.
0,5 г мурексида растереть с 100 г хлорида натрия. Водный раствор лучше не готовить, т.к. мурексид нестоек в растворе.
Раствор сульфида натрия, 4%.
2 г сульфида натрия растворяют в 50 см 3 дистиллированной воды. Хранят в плотной закрытой полиэтиленовой посуде не более недели.
Раствор гидрохлорида гидроксиламина.
5 г гидрохлорида гидроксиламина растворяют в 100 см 3 дистиллированной воды. Хранят не более 2 месяцев.
Установление точной концентрации раствора трилона Б.
В коническую колбу вместимостью 250 см 3 вносят 10 см 3 раствора хлорида цинка, добавляют дистиллированной воды приблизительно до 100 см 3 , 5 см 3 буферного раствора и 10-15 мг индикатора эриохрома чёрного Т. Содержимое конической колбы тщательно перемешивают и титруют из бюретки раствором трилона Б до перехода окраски красной в голубую. Концентрацию раствора трилона Б рассчитывают по формуле:
3.1 Титриметрический метод
Определение ионов кальция и магния
Устранение мешающих ионов
Для устранения мешающего влияния катионов железа, цинка, меди и олова в пробу добавляют 0,5 мл раствора сульфида натрия.
Для устранения мешающего влияния марганца в пробу добавляют 0,5 мл солянокислого раствора гидроксиламина.
Перед выполнением анализа пробы воды с неизвестной величиной жёсткости проводят оценочное титрование. Для этого берут 10 см 3 воды, добавляют 0,5 см 3 буферного раствора, индикатор (эриохром чёрный Т) и титруют до перехода окраски из красной в голубую. По величине израсходованного трилона Б выбирают из таблицы 1 соответствующий объём пробы воды.
ионообменный хроматография вода магний
Таблица 1. Объём пробы воды, рекомендуемый для определения жёсткости по результатам оценочного титрования
Объём израсходованного раствора трилона Б, см 3
Рекомендуемый объём пробы, см 3
v Определение суммы кальция и магния
К пробе необходимого объёма (см. Оценочное титрование) 100 см 3 добавляют 5 см 3 буфера, индикатор (эриохром чёрный Т) на шпателе. Сразу же титруют при перемешивании до перехода окраски от винно-красной к синей.
К пробе необходимого объёма (см. Оценочное титрование) 100 см 3 добавляют 2 см 3 NaOH (2н) и индикатора (мурексид) на шпателе. Титруют до перехода окраски от красной в фиолетовую. Окраску раствора следует сравнивать с цветом перетитрованного раствора.
Содержание кальция высчитывают по формуле:
где Стр — молярная концентрация эквивалента трилона Б, моль/дм 3 ; V’ тр — объем трилона Б, пошедший на титрование с мурексидом, см 3 (см. Определение кальция); 20,04 — масса эквивалента Ca 2+ ; Vпробы — объем пробы, взятый для анализа, см 3 .
Содержание магния высчитывают по формуле:
где Стр — молярная концентрация эквивалента трилона Б, моль/дм 3 ; V тр — объем трилона Б, пошедший на титрование с эриохромом черным Т, см 3 (см. Определение суммы кальция и магния); V’тр — объем трилона Б, пошедший на титрование с мурексидом, см 3 (см. Определение кальция); 12,15- масса эквивалента Mg 2+ ; Vпробы- объем пробы, взятый для анализа, см 3 .
v Определение общей жесткости воды
Общую жесткость находят по формуле:
где Стр — молярная концентрация эквивалента трилона Б, моль/дм 3 ; Vтр — объем раствора трилона Б, пошедшего на титрование пробы, см 3 ; Vпробы — объем пробы, взятый для анализа, см 3 .
Метод добавок. Для определения данным методом в пробу вводят добавку, равную 50-150% (желательно 100%) жёсткости воды (см. Определение общей жёсткости воды) ГСО 8206-2002.
Затем высчитывают общую жесткость воды с добавкой.
a. Результаты измерений, полученных в условиях воспроизводимости для пробы 1.
Проба 1: оз. Среднее, с. Озёрное, 85 км от берега, дата: 1.10.13, время: 16.55, t = +3.
Установлена точная концентрация трилона Б: Стрилона = 0,002226 (моль/дм 3 ). При выполнении оценочного титрования объем необходимой пробы соответствует 100 (мл).
источник
Жесткость воды. Мягкая вода. Жесткая вода. Перевод единиц (градусов) жесткости воды. Нормы жесткости воды. Таблицы значений жесткости воды.
Жесткость воды. Мягкая вода. Жесткая вода. Перевод единиц (градусов) жесткости воды. Нормы жесткости воды. Таблицы значений жесткости воды.
- жёсткой называется вода с большим содержанием солей ,
- мягкой с малым содержанием
«Жёсткая» вода — исторически: ткань, постиранная с использованием мыла на основе жирных кислот в жёсткой воде — более жёсткая на ощупь. Этот факт объясняется, с одной стороны, отложением на ткани кальциевых и магниевых солей жирных кислот, образующихся в процессе стирки. С другой стороны, волокна ткани обладают ионообменными свойствами, и, как следствие, свойством сорбировать многовалентные катионы — на молекулярном уровне.
- временная (карбонатная) жёсткость, — обусловлена гидрокарбонатами кальция и магния Са(НСО3)2; Mg(НСО3)2,
- постоянная (некарбонатная) жёсткость — вызванную присутствием других солей, не выделяющихся при кипячении воды: в основном, сульфатов и хлоридов Са и Mg (CaSO4, CaCl2, MgSO4, MgCl2).
С 1 января 2014 года в России введен межгосударственный стандарт ГОСТ 31865-2012 «Вода. Единица жесткости». По новому ГОСТу жесткость выражается в градусах жесткости (°Ж). 1 °Ж соответствует концентрации щелочноземельного элемента, численно равной 1/2 его миллимоля на литр (1 °Ж = 1 мг-экв/л). В разных странах использовались (иногда используются до сих пор) различные внесистемные единицы — градусы жёсткости.
| Жесткость, °Ж | Кальций, мг/л | Магний, мг/л | |
|---|---|---|---|
| Москва | 2,0-5,5 | 46 | 11 |
| Париж | 5,0-6,0 | 90 | 6 |
| Берлин | 5,0-8,8 | 121 | 12 |
| Нью-Йорк | 0,3-0,4 | 6 | 1 |
| Сидней | 0,2-1,3 | 15 | 4 |
- Рекомендации всемирной организации здравоохранения (ВОЗ) для питьевой воды:
- кальций – 20-80 мг/л; магний – 10-30 мг/л. Для жесткости какой-либо рекомендуемой величины не предлагается. Московская питьевая вода по данным показателям соответствует рекомендациям ВОЗ.
- Российские нормативные документы (СанПиН 2.1.4.1074-01 и ГН 2.1.5.1315-03) для питьевой воды регламентируют:
- кальций – норматив не установлен; магний – не более 50 мг/л; жесткость — не более 7°Ж.
- Норматив физиологической полноценности бутилированной воды (СанПиН 2.1.4.1116-02):
- кальций – 25-130 мг/л; магний – 5-65 мг/л; жесткость – 1,5-7°Ж.
- По содержанию кальция и магния бутилированная вода высшей категории официально ничем не лучше воды из-под крана
| °Ж = 1 мг-экв/л | mmol/L | ppm, mg/L | dGH, °dH | gpg | °e, °Clark | °fH | |
| 1 русский °Ж = 1 мг-экв/л это: | 1 | 0,5 | 50,05 | 2,804 | 2,924 | 3,511 | 5,005 |
|---|---|---|---|---|---|---|---|
| 1 ммоль/л = mmol/L это: | 2 | 1 | 100.1 | 5.608 | 5.847 | 7.022 | 10.01 |
| 1 американский° ppmw = mg/L = American degre: | 0,01998 | 0.009991 | 1 | 0.05603 | 0.05842 | 0.07016 | 0.1 |
| 1 немецкий° dGH, °dH это: | 0,3566 | 0.1783 | 17.85 | 1 | 1.043 | 1.252 | 1.785 |
| 1 американская популярная ед. gpg это: | 0,342 | 0.171 | 17.12 | 0.9591 | 1 | 1.201 | 1.712 |
| 1 английский °e, °Clark это: | 0,2848 | 0.1424 | 14.25 | 0.7986 | 0.8327 | 1 | 1.425 |
| 1 французский °fH это: | 0,1998 | 0.09991 | 10 | 0.5603 | 0.5842 | 0.7016 | 1 |
| Пример: 1 °Ж = 50,05 ppm | |||||||
- американские градусы жесткости воды, внимание тут два пункта:
- gpg = Grains per Gallon: 1 гран (0.0648 г) CaCO3 в 1 американском галлоне (3.785 л) воды. Поделив граммы на литры получаем: 17.12 мг/л СаСО3 — это не «американский градус», но очень употребляемая в штатах величина жесткости воды.
- американский градус = ppmw = mg/L = American degre: 1 часть CaCO3 в 1000000 частей воды 1мг/л CaCO3
- английские градусы жесткости воды = °e = °Clark: 1 гран (0.0648 г) в 1 английском галлоне (4.546) л воды = 14.254 мг/л CaCO3
- французские градусы жесткости воды (°fH or °f) (fh): 1 часть CaCO3 в 100000 частей воды, или 10 мг/л CaCO3
- немецкие градусы жесткости воды = °dH (deutsche Härte = «немецкая жесткость» может быть °dGH (общая жесткость) или °dKH (для карбонатной жёсткости)): 1 часть оксида кальция – СаО в 100000 частей воды, или 0.719 частей оксида магния – MgO в 100000 частей воды, что дает 10 мг/л СаО или 7.194 мг/л MgO
- русский (РФ) градус жесткости воды °Ж = 1 мг-экв/л: соответствует концентрации щелочноземельного элемента, численно равной 1/2 его миллимоля на литр, что дает 50,05 мг/л CaCO3 or 20.04 мг/л Ca2+
- ммоль/л = mmol/L: соответствует концентрации щелочноземельного элемента, численно равной 100.09 мг/л CaCO3 or 40.08 мг/л Ca2+
- Термоумягчение. Основан на кипячении воды, в результате термически нестойкие гидрокарбонаты кальция и магния разлагаются с образованием накипи:
- Ca(HCO3)2 → CaCO3↓ + CO2 + H2O.
- Кипячение устраняет только временную (карбонатную) жёсткость. Находит применение в быту.
- Реагентное умягчение. Метод основан на добавлении в воду кальцинированной соды Na2CO3 или гашёной извести Ca(OH)2. При этом соли кальция и магния переходят в нерастворимые соединения и, как следствие, выпадают в осадок. Например, добавление гашёной извести приводит к переводу солей кальция в нерастворимый карбонат:
- Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
- Лучшим реагентом для устранения общей жесткости воды является ортофосфат натрия Na3PO4, входящий в состав большинства препаратов бытового и промышленного назначения:
- 3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaHCO3
- 3MgSO4 + 2Na3PO4 → Mg3(PO4)2↓ + 3Na2SO4
- Ортофосфаты кальция и магния очень плохо растворимы в воде, поэтому легко отделяются механическим фильтрованием. Этот метод оправдан при относительно больших расходах воды, поскольку связан с решением ряда специфических проблем: фильтрации осадка, точной дозировки реагента.
- Катионирование. Метод основан на использовании ионообменной гранулированной загрузки (чаще всего ионообменные смолы). Такая загрузка при контакте с водой поглощает катионы солей жёсткости (кальций и магний, железо и марганец). Взамен, в зависимости от ионной формы, отдаёт ионы натрия или водорода. Эти методы соответственно называются Na-катионирование и Н-катионирование.
- При правильно подобранной ионообменной загрузке жёсткость воды снижается при одноступенчатом натрий-катионировании до 0,05-0,1 °Ж, при двухступенчатом — до 0,01 °Ж.
- В промышленности с помощью ионообменных фильтров заменяют ионы кальция и магния на ионы натрия и калия, получая мягкую воду.
- Обратный осмос. Метод основан на прохождении воды через полупроницаемые мембраны (как правило, полиамидные). Вместе с солями жёсткости удаляется и большинство других солей. Эффективность очистки может достигать 99,9 %.
- Различают нанофильтрацию (условный диаметр отверстий мембраны равен единицам нанометров) и пикофильтрацию (условный диаметр отверстий мембраны равен единицам пикометров).
- В качестве недостатков данного метода следует отметить:
- — необходимость предварительной подготовки воды, подаваемой на обратноосмотическую мембрану;
- — относительно высокая стоимость 1 л получаемой воды (дорогое оборудование, дорогие мембраны);
- — низкую минерализацию получаемой воды (особенно при пикофильтрации). Вода становится практически дистиллированной.
- Электродиализ. Основан на удалении из воды солей под действием электрического поля. Удаление ионов растворенных веществ происходит за счёт специальных мембран. Так же как и при использовании технологии обратного осмоса, происходит удаление и других солей, помимо ионов жёсткости.
источник
Методы определения жесткости
Drinking water. Methods of hardness determination
____________________________________________________________________
Текст Сравнения ГОСТ 31954-2012 с ГОСТ Р 52407-2005 см. по ссылке.
— Примечание изготовителя базы данных.
____________________________________________________________________
МКС 13.060.50
ТН ВЭД 220100000
220100000
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены в ГОСТ 1.0-2015 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2-2015 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Обществом с ограниченной ответственностью «Протектор» совместно с Закрытым акционерным обществом «Центр исследования и контроля воды»
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (по переписке, протокол от 3 декабря 2012 г. N 54)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97
Сокращенное наименование национального органа по стандартизации
Минэкономики Республики Армения
Госстандарт Республики Беларусь
Госстандарт Республики Казахстан
4 Приказом Федерального агентства по техническому регулированию и метрологии от 12 декабря 2012 г. N 1899-ст межгосударственный стандарт ГОСТ 31954-2012 введен в действие в качестве национального стандарта Российской Федерации с 1 января 2014 г.
5 В настоящем стандарте учтены основные нормативные положения международных стандартов:
— ISO 6059:1984 «Качество воды. Определение суммарного содержания кальция и магния. Титриметрический метод с применением ЭДТА» («Water quality — Determination of the sum of calcium and magnesium — EDTA titrimetric method», NEQ);
— ISO 7980:1986 «Качество воды. Определение кальция и магния. Атомно-абсорбционный спектрометрический метод» («Water quality — determination of calcium and magnesium — Atomic absorption spectrometric method», NEQ).
Стандарт подготовлен на основе применения ГОСТ Р 52407-2005
7 Издание (июль 2018 г.) с Поправкой (ИУС 1-2017)
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе «Национальные стандарты», а текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
Жесткость воды является одним из основных показателей, характеризующим применение воды в различных отраслях.
Жесткостью воды называется совокупность свойств, обусловленных содержанием в ней щелочноземельных элементов, преимущественно ионов кальция и магния.
В зависимости от рН и щелочности воды жесткость выше 10 °Ж может вызывать образование шлаков в распределительной системе водоснабжения и накипи при нагревании. Вода жесткостью менее 5 °Ж может оказывать коррозионное воздействие на водопроводные трубы. Жесткость воды может влиять и на применяемость для потребления человеком с точки зрения ее вкусовых свойств.
При комплексонометрическом (титриметрическом) определении жесткости ионы алюминия, кадмия, свинца, железа, кобальта, меди, марганца, олова и цинка влияют на установление эквивалентной точки и мешают определению. Ионы ортофосфата и карбоната могут осаждать кальций в условиях титрования. Определению могут также мешать некоторые органические вещества. Если мешающее влияние невозможно устранить, определение жесткости рекомендуется проводить методами атомной спектрометрии.
Настоящий стандарт предусматривает использование различных методов определения жесткости воды с учетом приведения количественной характеристики жесткости воды (единицы жесткости) через градусы жесткости (°Ж) по ГОСТ 31865.
Настоящий стандарт распространяется на природные (поверхностные и подземные) воды, в том числе воды источников питьевого водоснабжения, а также на питьевую воду, в том числе расфасованную в емкости, и устанавливает следующие методы определения жесткости воды:
— комплексонометрический метод (метод А);
— методы атомной спектрометрии (методы Б и В).
Метод Б применяют для определения массовой концентрации ионов кальция и магния.
Метод В является арбитражным по отношению к другим методам определения жесткости.
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:
ГОСТ ИСО/МЭК 17025-2009 Общие требования к компетентности испытательных и калибровочных лабораторий
ГОСТ 17.1.5.05-85 Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков
ГОСТ 1770-74 (ISO 1042-83, ISO 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Технические условия
ГОСТ 2053-77 Реактивы. Натрий сернистый 9-водный. Технические условия
ГОСТ 3118-77 Реактивы. Кислота соляная. Технические условия
ГОСТ 3760-79 Реактивы. Аммиак водный. Технические условия
ГОСТ 3773-72 Реактивы. Аммоний хлористый. Технические условия
ГОСТ 4233-77 Реактивы. Натрий хлористый. Технические условия
ГОСТ 4328-77 Реактивы. Натрия гидроокись. Технические условия
ГОСТ 4461-77 Реактивы. Кислота азотная. Технические условия
ГОСТ 5456-79 Реактивы. Гидроксиламина гидрохлорид. Технические условия
ГОСТ 5457-75 Ацетилен растворенный и газообразный технический. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 10652-73 Реактивы. Соль динатриевая этилендиамин-N,N,N’,N’-тетрауксусной кислоты 2-водная (трилон Б). Технические условия
ГОСТ 17433-80 Промышленная чистота. Сжатый воздух. Классы загрязненности
ГОСТ 18300-87 Спирт этиловый ректификованный технический. Технические условия
ГОСТ 23950-88 Вода питьевая. Метод определения массовой концентрации стронция
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 29169-91 (ИСО 648-77) Посуда лабораторная стеклянная. Пипетки с одной отметкой
ГОСТ 29227-91 (ИСО 835-1-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
ГОСТ 29251-91 (ИСО 385-1-84) Посуда лабораторная стеклянная. Бюретки. Часть 1. Общие требования
ГОСТ 31861-2012 Вода. Общие требования к отбору проб
ГОСТ 31862-2012 Вода питьевая. Отбор проб
ГОСТ 31865-2012 Вода. Единица жесткости
ГОСТ 31870-2012 Вода питьевая. Определение содержания элементов методами атомной спектрометрии
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя «Национальные стандарты» за текущий год. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
Общие требования к отбору проб — по ГОСТ 31861, ГОСТ 31862 и ГОСТ 17.1.5.05.
Пробу отбирают объемом не менее 400 см для анализа по методу А и не менее 200 см для анализа по методам Б и В в емкость, изготовленную из полимерных материалов или стекла.
Срок хранения пробы воды — не более 24 ч.
Для увеличения срока хранения пробы и для предотвращения осаждения из воды карбонатов кальция (что характерно для подземных или бутилированных вод) пробу подкисляют кислотой до рН
Для воды, расфасованной в емкости, сроки и температурные условия хранения должны соответствовать требованиям, указанным в нормативной документации* на готовую продукцию.
_______________
* В Российской Федерации — требованиям ГОСТ Р 52109-2003 «Вода питьевая, расфасованная в емкости. Общие технические условия» — переоформляется в межгосударственный стандарт.
4.1 Сущность метода
Метод основан на образовании комплексных соединений трилона Б с ионами щелочноземельных элементов. Определение проводят титрованием пробы раствором трилона Б при рН=10 в присутствии индикатора. Наименьшая определяемая жесткость воды — 0,1 °Ж.
Если исследуемая проба была подкислена для консервации или проба имеет кислую среду, то в аликвоту пробы добавляют раствор гидроксида натрия (см. 4.3.8) до рН=6-7. Если проба воды имеет сильнощелочную среду, то в аликвоту пробы добавляют раствор соляной кислоты (см. 4.3.7) до рН=6-7. Контроль рН проводят по универсальной индикаторной бумаге или с использованием рН-метра. Для удаления из воды карбонат и бикарбонат ионов (что характерно для подземных или бутилированных вод) после добавления к аликвоте пробы раствора соляной кислоты до рН=6-7 проводят ее кипячение или продувание воздухом или любым инертным газом в течение не менее пяти минут для удаления углекислого газа. Критерием наличия в воде значительного количества карбонатов может служить щелочная реакция воды.
Присутствие в воде более 10 мг/дм ионов железа; более 0,05 мг/дм каждого из ионов меди, кадмия, кобальта, свинца; свыше 0,1 мг/дм каждого из ионов марганца (II), алюминия, цинка, кобальта, никеля, олова, а также цветность более 200 °Ж и повышенная мутность вызывают при титровании нечеткое изменение окраски в точке эквивалентности и приводят к завышению результатов определения жесткости. Ортофосфат- и карбонат-ионы могут осаждать кальций в условиях титрования при рН=10.
Для уменьшения влияния содержащихся в воде цинка до 200 мг/дм , алюминия, кадмия, свинца до 20 мг/дм , железа до 5 мг/дм , марганца, кобальта, меди, никеля до 1 мг/дм к аликвоте пробы до введения индикатора добавляют 2 см раствора сульфида натрия (см. 4.3.6); для уменьшения влияния марганца до 1 мг/дм , железа, алюминия до 20 мг/дм , меди до 0,3 мг/дм добавляют от 5 до 10 капель раствора гидроксиламина гидрохлорида (см. 4.3.5). Мутность (взвешенные вещества) пробы устраняют фильтрованием через мембранные фильтры с диаметром пор 0,45 мкм или бумажные обеззоленные фильтры «синяя лента». Влияние цветности и других факторов устраняют разбавлением пробы в ходе анализа по 4.5, если это позволяет определяемое значение жесткости воды.
Примечание — Фильтрование пробы может привести к занижению результатов определения жесткости воды, особенно воды с щелочной реакцией.
Если мешающие влияния устранить невозможно, то определение жесткости проводят методами атомной спектрометрии.
4.2 Средства измерения, вспомогательное оборудование, реактивы, материалы
Государственный (межгосударственный) стандартный образец (ГСО) состава жесткости (общей жесткости) воды с относительной погрешностью аттестованного значения при доверительной вероятности 0,95 не более ±1,5%.
Весы лабораторные* с наибольшим пределом взвешивания 220 г, обеспечивающие точность взвешивания с пределом допускаемой абсолютной погрешности не более ±0,75 мг.
_______________
* В Российской Федерации действует ГОСТ Р 53228-2008 «Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания».
рН-метр любого типа.
Колбы мерные по ГОСТ 1770 2-го класса точности.
Пипетки градуированные по ГОСТ 29227 2-го класса точности или пипетки с одной отметкой по ГОСТ 29169 2-го класса точности.
Бюретки по ГОСТ 29251 2-го класса точности вместимостью 25 см и (или) 10 см или полуавтоматический цифровой титратор (цифровая бюретка) вместимостью 30 или 50 см с шагом дозирования не более 0,05 см .
4.3 Приготовление растворов и индикаторов
4.3.1 Раствор трилона Б молярной концентрации 25 ммоль/дм
Трилон Б высушивают при 80°С в течение двух часов, отвешивают 9,31 г, помещают в мерную колбу вместимостью 1000 см , растворяют в теплой от 40°С до 60°С бидистиллированной воде и после охлаждения раствора до комнатной температуры доводят до метки бидистиллированной водой. Установку поправочного коэффициента к концентрации раствора трилона Б (см. 4.4), приготовленного из навески, проводят по раствору сульфата магния (см. 4.3.2). Раствор из ГСО состава трилона Б или стандарт-титра (фиксанала) трилона Б готовят в соответствии с инструкцией по применению, разбавляя его до требуемой концентрации.
Раствор трилона Б пригоден для использования в течение 6 мес. Рекомендуется не реже одного раза в месяц проверять значение поправочного коэффициента.
4.3.2 Раствор ионов магния молярной концентрации 25 ммоль/дм
Раствор готовят из ГСО состава водного раствора ионов магния или стандарт-титра (фиксанала) сульфата (сернокислого) магния в соответствии с инструкцией по его применению, при необходимости разбавляя до требуемой концентрации.
Примечание — Если в используемых стандарт-титрах (фиксаналах) или ГСО состава водных растворов концентрация вещества выражена в нормальностях (н), мг/дм , г/м и т.п., необходимо провести пересчет концентрации вещества в моль/дм .
4.3.3 Буферный раствор рН=(10±0,1)
Для приготовления 500 см буферного раствора в мерную колбу вместимостью 500 см помещают 10 г хлорида аммония, добавляют 100 см бидистиллированной воды для его растворения и 50 см 25%-ного водного аммиака, тщательно перемешивают и доводят до метки бидистиллированной водой.
Буферный раствор пригоден для использования в течение 2 мес при его хранении в плотно закрытой емкости, изготовленной из полимерного материала. Рекомендуется периодически перед применением буферного раствора проверять его рН с использованием рН-метра. Если значение рН изменилось более чем на 0,2 единицы рН, то готовят новый буферный раствор.
4.3.4.1 Раствор индикатора
Для приготовления 100 см раствора индикатора в стакан вместимостью не менее 100 см помещают 0,5 г индикатора эриохром черный Т, добавляют 20 см буферного раствора, тщательно перемешивают и добавляют 80 см этилового спирта. Раствор пригоден для использования в течение 10 сут при хранении в темной стеклянной емкости.
Допускается вместо индикатора эриохром черный Т использовать индикатор хромовый темно-синий кислотный, раствор которого готовят аналогичным способом. Срок хранения этого раствора — не более 3 мес.
4.3.4.2 Сухая смесь индикатора
Сухую смесь индикатора готовят в следующей последовательности: 0,25 г эриохрома черного Т смешивают с 50 г хлорида натрия в фарфоровой ступке и тщательно растирают. Смесь пригодна для использования в течение одного года при хранении в темной стеклянной емкости.
4.3.5 Раствор гидроксиламина гидрохлорида
Для приготовления 100 см раствора 1 г гидроксиламина гидрохлорида ( ) растворяют в 100 см бидистиллированной воды. Раствор пригоден для использования в течение 2 мес.
4.3.6 Раствор сульфида натрия
Для приготовления 100 см раствора 5 г сульфида натрия или 3,5 г растворяют в 100 см бидистиллированной воды. Раствор готовят в день проведения определений.
4.3.7 Раствор соляной кислоты молярной концентрации 0,1 моль/дм
В мерную колбу вместимостью 1000 см , наполовину заполненную бидистиллированной водой, наливают 8 см соляной кислоты и доводят до метки бидистиллированной водой. Срок хранения раствора — не более 6 мес.
Приготовление раствора кислоты из стандарт-титра (фиксанала) проводят в соответствии с инструкцией по его приготовлению.
4.3.8 Раствор гидроксида натрия молярной концентрации 0,2 моль/дм
Для приготовления 1000 см раствора в стакан помещают 8 г гидроксида натрия, растворяют в бидистиллированной воде, после остывания раствор переносят в мерную колбу вместимостью 1000 см и доводят до метки бидистиллированной водой. Срок хранения раствора в емкости из полимерного материала — не более 6 мес.
4.4 Установление коэффициента поправки к концентрации раствора трилона Б
В коническую колбу вместимостью 250 см вносят 10,0 см раствора ионов магния (см. 4.3.2), добавляют 90 см бидистиллированной воды, 5 см буферного раствора (см. 4.3.3), от 5 до 7 капель раствора индикатора (см. 4.3.4.1) или от 0,05 до 0,1 г сухой смеси индикатора (см. 4.3.4.2) и сразу титруют раствором трилона Б (см. 4.3.1) до изменения окраски в эквивалентной точке от винно-красной (красно-фиолетовой) до синей (с зеленоватым оттенком) при использовании индикатора эриохром черный Т, а при использовании индикатора хромовый темно-синий кислотный до синей (сине-фиолетовой).
Раствор трилона Б в начале титрования добавляют довольно быстро при постоянном перемешивании. Затем, когда цвет раствора начинает меняться, раствор трилона Б добавляют медленно. Эквивалентной точки достигают при изменении окрашивания, когда цвет раствора перестает меняться при добавлении капель раствора трилона Б.
Титрование проводят на фоне титрованной контрольной пробы. В качестве контрольной пробы можно использовать немного перетитрованную анализируемую пробу. За результат принимают среднеарифметическое значение результатов не менее двух определений. Значение коэффициента поправки должно быть равным 1,00±0,03.
Коэффициент поправки к концентрации раствора трилона Б рассчитывают по формуле
где — объем раствора трилона Б, израсходованный на титрование, см ,
10 — объем раствора ионов магния (см. 4.3.2), см .
Примечание — При приготовлении растворов по 4.3-4.4 допускается вместо бидистиллированной воды использовать дистиллированную воду, если определяемое значение жесткости более 1 °Ж.
4.5 Порядок проведения определений
4.5.1 Выполняют два определения, для чего пробу анализируемой воды делят на две части.
4.5.2 В колбу вместимостью 250 см помещают первую часть аликвоты пробы анализируемой воды объемом 100 см , 5 см буферного раствора (см. 4.3.3), от 5 до 7 капель раствора индикатора (см. 4.3.4.1) или от 0,05 до 0,1 г сухой смеси индикатора (см. 4.3.4.2) и титруют раствором трилона Б (см. 4.3.1), как описано в 4.4.
4.5.3 Вторую часть аликвоты пробы объемом 100 см помещают в колбу вместимостью 250 см , добавляют 5 см буферного раствора, от 5 до 7 капель раствора индикатора или от 0,05 до 0,1 г сухой смеси индикатора, добавляют раствор трилона Б, которого берут на 0,5 см меньше, чем пошло на первое титрование (см. 4.5.2), быстро и тщательно перемешивают и титруют (дотитровывают), как описано в 4.4.
Примечания
1 Нечеткое изменение окраски индикатора в эквивалентной точке или изменение окраски на серый цвет указывает на присутствие мешающих веществ. Устранение мешающих влияний — по 4.1. Если мешающие влияния устранить невозможно, определение жесткости проводят методами атомной спектрометрии (см. раздел 5).
2 Если расход раствора трилона Б превышает 20 см — при использовании бюретки вместимостью 25 см или 9 см — при использовании бюретки вместимостью 10 см , то объем анализируемой пробы уменьшают, добавляя в нее бидистиллированную воду до объема 100 см . Аликвоту пробы уменьшают и для устранения влияния цветности воды.
3 Если расход раствора трилона Б менее 1 см — при использовании бюретки вместимостью 25 см или менее 0,5 см — при использовании бюретки вместимостью 10 см , то рекомендуется использовать раствор трилона Б молярной концентрацией 5 ммоль/дм или 2,5 ммоль/дм соответственно. Раствор трилона Б по 4.3.1 разбавляют в 5 или 10 раз.
4.6 Обработка результатов определения
где — коэффициент пересчета, равный 2 ,
где — концентрация раствора трилона Б, моль/м (ммоль/дм ), (как правило 50);
— множитель разбавления исходной пробы воды при консервировании (как правило 1);
— коэффициент поправки к концентрации раствора трилона Б, рассчитанный по формуле (1);
— объем раствора трилона Б, израсходованный на титрование, см ;
— объем пробы воды, взятой для анализа, см .
4.6.2 За результат измерения принимают среднеарифметическое значение результатов двух определений. Приемлемость результатов определений оценивают исходя из условия:
где — предел повторяемости (см. таблицу 1);
и — результаты определений по 4.5.2 и 4.5.3, °Ж.
Если расхождение между двумя результатами превышает установленное значение, то определение жесткости воды повторяют. Проверку приемлемости в этом случае проводят по [1, раздел 5].
источник
Метод определения общей жесткости воды основан на том, что ионы кальция и магния связываются трилоном Б в комплексные соединения. О конце реакции судят по изменению цвета индикатора хромогена черного от розово-малинового до синевато-серого. Появление синевато-серого окрашивания свидетельствует об отсутствии ионов Са 2+ и Mg 2+ в растворе, т. е. о полном связывании их с трилоном Б.
В коническую колбу вместимостью 250 мл отмеривают 100 мл исследуемой воды, добавляют 5 мл аммиачного буферного раствора, индикатор хромоген (сухую смесь) и медленно титруют 0,1 н раствором трилона Б до перехода окраски в серовато-синюю.
Общую жесткость воды Жо, ммоль экв/л, вычисляют по формуле
где V1 – объем 0,1 н раствора трилона Б, израсходованный на титрование пробы, мл; К – коэффициент нормальности раствора трилона Б (К = Nфакт / 0,1); N1 – нормальность раствора трилона Б; V2 – объем исследуемой пробы воды, мл.
Определение карбонатной жесткости воды
Оттитровывают 100 мл воды 0,1 н раствором HCl в присутствии метилового оранжевого до перехода окраски от желтой к розовой. Карбонатную жесткость Жк, ммоль экв/л, вычисляют по формуле
где V3 – объем HCl, который пошел на титрование, мл; N2 – нормальность HCl, моль/л; V2 – объем воды, который взят для анализа, мл.
Некарбонатная жесткость определяется как разница между общей и карбонатной жесткостью
Определение количества диоксида углерода
В колбу поместите 200 мл исследуемой воды, добавьте 2 капли раствора фенолфталеина и взболтайте. Если вода окрасилась в интенсивный розовый цвет, это значит, что в ней нет растворенного диоксида углерода. Отсутствие окраски или очень слабая окраска свидетельствуют о присутствии растворенного диоксида углерода. В этом случае пробу титруют 0,1 н раствором NaOH до появления интенсивной окраски. Концентрацию диоксида углерода определяют по формуле
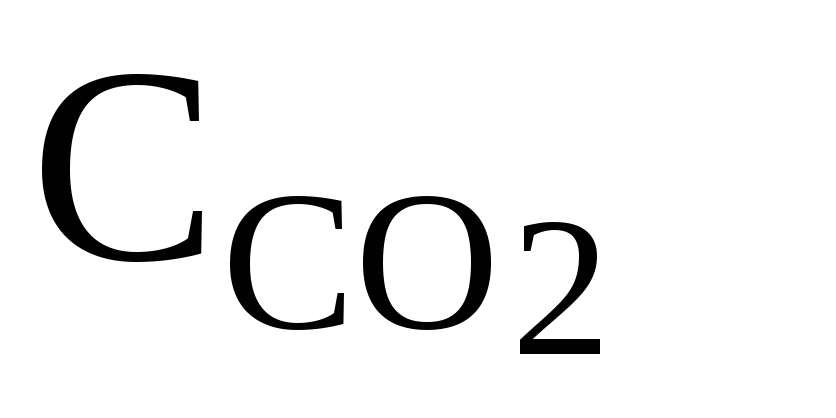
где N – нормальность NаОН, моль/л; V4 – его объем, мл.
Определение концентрации кальция и магния
К 100 мл воды добавляют 3 мл 10%-ного КОН до рН = 10–12, вносят примерно 0,2 г сухого индикатора мурексида, смешанного с сульфатом калия, и титруют трилоном Б до перехода окраски из розовой в фиолетовую.
Концентрацию кальция СК, ммоль экв/л, рассчитывают по формуле
где V5 – объем трилона Б, пошедший на титрование, мл.
Концентрацию магния См, ммоль экв/л, рассчитывают по формуле
После проведения полного обессоливания воды необходимо убедится в отсутствии в ней как катионов (Mg 2+ , Ca 2+ ), так и анионов (SO4 2– , NO3 – , Cl – ). Анализ на содержание указанных анионов в воде до ее обессоливания и после проводится качественно.
SO4 2– – раствор хлорида бария дает белый осадок сульфата бария;
Cl – – при добавлении раствора нитрата серебра образуется белый осадок хлорида серебра;
NO3 – – при добавлении раствора дифениламина в серной кислоте появляется характерное для ионов NO3 – синее окрашивание.
Определение содержания взвешенных частиц (мутность воды)
Мутность воды определяется фотоколориметрическим методом при длине волны 440 нм. Оптическую плотность измеряют в кюветах с толщиной поглощающего слоя 3 мм. Количество взвешенных частиц в воде находят по калибровочной кривой.
Регистрирующим прибором в фотоколориметре служит микроамперметр типа М907, оцифрованный в микроамперах и имеющий шкалу 0–100 делений, соответствующих шкале коэффициентов пропускания – и оптической плотности – D. При измерении со светофильтром 440 нм, отмеченным на лицевой панели колориметра черным цветом, ручку «Чувствительность» устанавливают в одно из положений 1, 2 или 3. Рабочие поверхности кювет перед каждым измерением необходимо тщательно протирать спирто-эфирной смесью, жидкость в кюветы наливать до метки на боковой поверхности кюветы. При установке кювет в кюветодержатель нельзя касаться пальцами участков поверхности кювет ниже уровня жидкости в них.
Колориметр включают в сеть за 15 мин до начала измерений. Во время прогрева кюветное отделение должно быть открыто (при этом шторка перед фотоприемником перекрывает световой пучок). В световой пучок помещают кювету со стандартным раствором, по отношению к которому производят измерения, и крышку кюветного отделения закрывают. Ручками «Чувствительность» и «Установка 100» устанавливают отсчет 100 по шкале колориметра. Затем поворотом ручки кювету со стандартным раствором заменяют кюветой с исследуемым раствором. После этого производят отсчет по шкале колориметра, соответствующий коэффициенту пропускания исследуемого раствора в процентах, или по шкале D в единицах оптической плотности. Измерения проводят 3–5 раз и окончательное значение измеряемой величины определяют как среднее арифметическое полученных значений.
источник
Как выполняется контроль жёсткости воды. Понятие жёсткости, от чего она зависит. Анализ воды на жёсткость дома. Лабораторные методы контроля общей и временной жёсткости жидкости. Приборы для выполнения анализа. Методы борьбы с повышенной жёсткостью в быту. Контроль жёсткость воды или анализ воды на жёсткость нужен для определения концентрации солей в жидкости. Этот анализ можно проводить в лабораторных условиях и дома.
Жёсткость воды – термин, говорящий о процентном соотношении солевых частиц магния и калия в жидкости. Она подразделяется на две разновидности:
- Временная (такая жидкость называется карбонатная);
- Общая жёсткость (данная вода относится к некарбонатной).
Первый тип жёсткости характеризуется присутствием гидрокарбонатных солевых частиц магния и калия. Если такую воду закипятить, то элементы распадутся на карбонаты и гидроксиды и выпадут в осадок. Именно этот белый налёт часто покрывает наши чайники изнутри и собирается на других нагревательных элементах.
Для жидкости с общей жёсткостью характерно наличие других химических элементов (различных нитратов, хлоридов и тп.п). Обычно жёсткость питьевой воды связана с особенностями вашего региона, составом грунтов. Чем больше известковых пород находится в почве, тем выше жёсткость воды. Но важно не только понимать суть понятия, но и знать, как проверить жёсткость воды. Выполнить это легко как в быту, так и на заводе.
Для проверки жёсткости водопроводной воды дома можно использовать следующие способы:
- Постарайтесь обильно вспенить мыльный брусок или порошок для стирки. Если у вас образуется мало пены, то ваша вода имеет повышенную жёсткость. Это возникает по той причине, что солевые частицы калия и магния не позволяют мылу пениться. При обильной пышной пене от любого моющего средства можно утверждать, что вода нежёсткая. Но этот метод не позволят точно определить степень жёсткости.
- На вкус также можно отличить жёсткую воду от мягкой. Она более горькая. Но не все могут точно уловить горьковатый привкус солей магния и калия.
- Белый осадок в чайниках, накипь на нагревательных элементах других бытовых приборов – признак жёсткой воды. Осадок возникает из-за распада солей и выпадения их на дно. Данная особенность жёсткой воды очень вредит бытовым приборам и отопительному трубопроводу.
- От жёсткости воды зависит скорость заваривания чайного напитка. При мягкой воде на эту процедуру уйдёт от 3 до 6 мин., в жёсткой воде чай будет завариваться от 8 до 12 мин. Кстати, на вкус оба напитка будут существенно отличаться.
- Благодаря нехитрому компактному измерительному прибору можно очень легко определить жёсткость любой жидкости. Он называется TDS-метр. Агрегат измерят электропроводность жидкости. Чем выше показатель, тем больше уровень солесодержания жидкости. Обычно его ещё называют солемер. Чаще такой анализ воды на жёсткость делают владельцы аквариумов и цветоводы.
- Проверить жёсткость воды в быту можно, используя тест-полоски, продающейся в аптеках медтехники.
Для этого анализа можно использовать колориметрическую методику и принцип титрования. Процедура анализа выполняется так: порция воды смешивается с метилоранжем (индикатором), ёмкость устанавливается на светлом фоне. Во вторую тару с водой добавляют соляную кислоту, пока не получится красно-оранжевый цвет воды.
Временную жёсткость жидкости находят в процессе расчёта требуемого количества соляной кислоты по формуле: Нвр = NHCl * VHCL* 1000/ V1, где N-насыщенность раствора, V-его количество, V1-количество пробы.
Этот анализ проводят в лаборатории. Для него используют комплексонометрическую методику. Она базируется на принципе возникновения соединений ионов, подвергающихся анализу, с природными реагентами. Сначала воду в пробирке разводят раствором индикатора на спирту (чёрного этиохрома «Т»). Также для этих целей может использоваться сухая смесь кальциевых и натриевых хлоридов. В итоге полученная смесь окрашивается в насыщенный рубиновый цвет. Затем в пробирку капается вещество, называемое Трилон.
Расчёт общей жёсткости производится по уравнению: Жо=Nx*Vx*1000/V1, где N-насыщенность вещества Трилон, V-его количество, V1-количество пробы.
Как мы уже говорили выше, прибор контроля жёсткости воды называется солемер или TDS-метр. Точность проверки составляет 2%. Основной принцип работы данного агрегата построен на зависимости электропроводности жидкости от общего числа примесей солей магния и калия. То есть чем больше данных солей в воде, тем больше будут показания прибора, а следовательно, тем выше жёсткость воды.
На некоторых предприятиях и заводах наблюдается прямая зависимость между жёсткостью используемой воды и исправностью работы оборудования. Поэтому для обеспечения бесперебойной работы технологического оборудования требуется осуществлять постоянный автоматический контроль жёсткости воды.
Для этих целей используется специальное оборудование, например, анализатор «АКМС-1». Этот прибор непрерывно контролирует содержание солевых частиц кальция и магния в жидкости, поступающей в технологическое оборудование. То есть он подсчитывает общую жёсткость в пределах 0,005-25,0 мг-экв/л.
Как понять, что ваша водопроводная вода жёсткая, мы писали выше. Теперь перечислим ряд мер, позволяющих снизить жёсткость воды в домашних условиях:
- Самый простой способ – кипячение воды.
- Фильтрация воды через системы обратного осмоса (специальные мембраны).
- Использование смягчающих солей.
- Применение фильтрующих картриджей.
- Магнитное фильтрующее устройство.
- Использование ионообменной смолы в комплексе с солевым раствором.
Хотите провести контроль жёсткости воды? Заказать такую услугу вы можете у наших специалистов, для этого вам достаточно связаться с нами по указанным телефонам.
источник