С целью охраны здоровья населения, для предупреждения желудочно-кишечных инфекций советским санитарным законодательством предусмотрены необходимые мероприятия по содержанию в надлежащем санитарном состоянии источников водоснабжения. Показатели качества воды постоянно действующих водопроводных сооружений и артезианских скважин нормируются Государственным общесоюзным стандартом — ГОСТ 2874-54.
При лабораторно-производственном контроле микробиологическое исследование воды из действующей водопроводной сети и постоянно действующих артезианских скважин должно производиться не реже 1 раза в месяц. Использование новых скважин допускается в тех случаях, когда коли-титр воды укладывается в нормы, допускаемые ГОСТом. Анализ воды таких скважин в первый год их эксплуатации проводят чаще.
Для выполнения микробиологического анализа воды бактериологическая лаборатория должна иметь запас стерильной посуды: бутылки емкостью 0,5 л, пипетки на 100, 10 и 1 мл, мерные цилиндры и чашки Петри. Тщательно вымытые и высушенные бутылки закрывают ватными пробками, накрывают бумажными колпачками и завязывают шпагатом или толстыми нитками. Помещают бутылки в бумажные пакеты и стерилизуют в сушильном шкафу при температуре 160 °С в течение 1 ч или в автоклаве при 120°С в течение 30 мин. При стерилизации бутылок с притертыми пробками бутылки и пробки стерилизуют отдельно: бутылки перед стерилизацией плотно закрывают ватной пробкой, а для стеклянной пробки делают небольшой пакетик из бумаги и привязывают ее к горлышку бутылки.
Пробу воды для исследования на фекальное загрязнение отбирают в количестве 0,5 л. При исследовании нескольких скважин или колодцев пробы отбирают от каждого объекта отдельно в часы наибольшего расхода воды. Из вновь сооруженной скважины или колодца при отсутствии постоянного отлива воды пробы отбирают после предварительной откачки воды в течение не менее 12 ч.
Отбор пробы воды из водопроводного крана производят следующим образом. Водопроводный кран обжигают в пламени горящего ватного тампона, смоченного спиртом. Затем кран открывают на 10-15 мин, давая воде стечь. Бутылку вынимают из пакета, развязывают бумажный колпачок, вынимают пробку, захватив ее между ладонью и двумя последними пальцами правой руки, и держат ее, стараясь не загрязнить. Подставляют бутылку под струю воды так, чтобы не замочить ее снаружи и не замочить пробку. Наполнив бутылку водой, закрывают ее пробкой над пламенем горелки, завязывают колпачок и делают запись для данной пробы: откуда взята проба, дата и час отбора пробы, цель исследования и фамилия лица, производившего отбор пробы.
Вода должна быть исследована тотчас же после взятия пробы, но не позднее 2 ч после ее отбора. При невозможности выполнения этого условия анализ должен быть произведен не позднее чем через 6 ч после отбора пробы при условии сохранения воды при температурах от 1 до 5°С. Пробы следует предохранять от резких толчков, чтобы не замочить пробок. При санитарно-гигиенической оценке воды по действующему ГОСТу 2874-54 исходят из следующих бактериологических показателей: общего количества микробов в воде (микробное число), коли-титра, коли-индекса.
Воду артезианских скважин и водопроводную, поступающую в городскую сеть, анализируют в количествах от 500 до 10 мл, воду открытых водоемов в зависимости от предполагаемой степени загрязнения — до 0,001 мл.
Под микробным числом воды понимают количество колоний, вырастающих на мясопептонном агаре в чашке Петри из 1 мл исследуемой воды после инкубации посева при 37 °С в течение 24 ч. У питьевой воды микробное число должно быть не более 100. В воде колодцев и открытых водоемов микробное число допускается до 1000.
При микробиологическом исследовании заведомо чистой воды вносят 1 мл ее в стерильную чашку Петри, заливая 15 мл расплавленного и охлажденного до 45°С мясопептонного агара. При исследовании загрязненных вод делают разведение в 10 или в 100 раз и высевают 1 мл соответствующего разведения.
На крышках чашек делают надпись с указанием номера пробы, разведения и даты посева. После инкубации посевов производят подсчет колоний по обычной методике.
Показателями фекального загрязнения воды являются коли-титр и коли-индекс. Под титром кишечной палочки (коли-титром) подразумевается наименьшее количество исследуемого материала (воды), выраженное в миллилитрах (или граммах), в котором обнаруживается хотя бы одна кишечная палочка. Для питьевой воды титр кишечной палочки должен быть не ниже 300 (для Москвы и Ленинграда — не ниже 500).
Коли-индекс кишечной палочки — количество особей кишечной палочки, обнаруженное в 1 л жидкости (воды) или в 1 г плотного вещества. Установив коли-титр исследуемого вещества, можно произвести перерасчет на коли-индекс, и наоборот. Для получения коли-индекса нужно разделить 1000 на коли-титр.
Вода колодцев и открытых водоемов признается доброкачественной при коли-титре не менее 90 и коли-индексе не более 11. Определение коли-титра чаще всего производится трехфазным методом бродильных проб.
1-й этап — первый день (первая бродильная проба). Исследуемую воду засевают (с соблюдением правил стерильности) в бродильные сосуды с глюкозо-пептонной средой (ГПС). Для выявления газообразования в посевах на дно бродильных сосудов перед заполнением их питательной средой предварительно должны быть опущены поплавки — маленькие пробирочки, перевернутые вверх дном (см. стр. 192). В каждый бродильный сосуд помещают по одному поплавку. Во время стерилизации поплавки заполняются средой.
Если микроорганизмы при развитии на данной питательной среде образуют газ, то он, скапливаясь в поплавке, вытесняет из него жидкость и поплавок поднимается над поверхностью среды в пробирке или флаконе.
В зависимости от характера источника для посева берут 300-500 мл исследуемой воды. Посев 300 мл воды производят следующим образом: два объема воды по 100 мл засевают в два флакона с 10 мл концентрированной глюкозо-пептонной среды и 10 объемов воды по 10 мл засевают в 10 пробирок, содержащих по 1 мл ГПС. При посеве 500 мл воды 4 объема засевают во флаконы по 100 мл и 10 объемов по 10 мл в пробирки.
При исследовании сильно загрязненных вод необходимо засевать меньшие объемы воды — от 10 до 0,0001 мл и даже 0,00001 мл (по 1 мл из соответствующих разведений). В этом случае посев производится в пробирки, содержащие по 10 мл разведенной глюкозо-пептонной среды. Посев производят по схеме — четыре десятикратно убывающих объема исследуемой воды, например: 100, 10, 1 и 0,1 или 10, 1, 0,1 и 0,01 мл (в зависимости от предполагаемого загрязнения воды).
Посевы инкубируют 24 ч при 43°С. При возникновении газообразования и помутнения среды бродильные сосуды (флаконы и пробирки) отмечают знаком « + »; при отсутствии газообразования и помутнения — знаком «-».
2-й этап — второй день. Из сосудов с признаками микробного роста (помутнение или помутнение и газообразование) производят высев петлей на среду Эндо в чашки Петри. Засеваемый материал наносят на поверхность среды в виде пересекающихся штрихов или растирают шпателем для получения изолированных колоний. Посевы выращивают при 37 °С в течение 24 ч. Во избежание расплывчатого роста колоний чашки со средой Эндо перед посевом следует слегка подсушить в термостате в течение 30 мин.
По окончании выращивания посевы в чашках Петри просматривают. Отсутствие роста дает окончательный отрицательный ответ: фекальное загрязнение отсутствует. При наличии роста приготовляют мазки, окрашивают их по Граму, исследуя все подозрительные на кишечную палочку колонии — как ярко-красные, так и бесцветные или с розовым оттенком и красным центром. Обнаружение при микроскопировании в мазках грамотрицательных неспороносных палочек указывает на возможное наличие бактерий кишечной группы. В этом случае необходимо провести вторую бродильную пробу — третий этап исследования.
3-й этап — третий день (вторая бродильная проба). Материал из подозрительных на кишечную палочку колоний со среды Эндо пересевают в пробирки с разведенной ГПС и поплавками и выдерживают 24 ч при температуре 43°С. Если на среде Эндо изолированных колоний не было или наблюдалась смешанная культура, необходимо повторить пересев на свежую чашку Петри со стерильной средой Эндо до получения изолированных колоний.
По истечении 24 ч просматривают посевы в пробирках. Наличие газа дает окончательный положительный ответ о присутствии кишечной палочки. Результаты анализа выражают в виде коли-титра и коли-индекса, пользуясь таблицами (табл. 8, 9 и 10).
При исследовании водопроводной воды предпочтительнее производить определение коли-индекса путем посева воды на мембранные фильтры (рис. 82). Этот метод позволяет концентрировать микрофлору, содержащуюся в значительном объеме воды, на небольшом участке поверхности плотной питательной среды.
Исследование воды на фекальное загрязнение методом мембранных ультрафильтров в последние годы получило довольно широкое распространение в бактериологических лабораториях благодаря следующим преимуществам:
1) срок анализа сокращается до 24 ч, что значительно экономит время;
3) обнаруживаются самые незначительные количества микробов в воде;
4) проводится прямой и достаточно точный подсчет количества колоний;
5) метод позволяет выделить каждый микроб в чистой культуре.
Мембранные фильтры (ультрафильтры) — это пористые нитроцеллюлозные пленки, которые выпускаются в виде кружков диаметром 35 мм и толщиной 0,1 мм с различным диаметром пор. Для исследования воды применяют фильтры № 3. В сухом виде мембранные фильтры пригодны к использованию в течение одного года. Для более продолжительного хранения их помещают в герметически закрытую склянку с притертой пробкой, в которую наливают 30%-ный водный раствор спирта.
Техника выполнения анализа следующая:
1-й день. Мембранные фильтры перед употреблением помещают в стакан с дистиллированной водой, подогревают воду до 50-60°С, меняя ее 2-3 раза. Затем снова наливают чистую дистиллированную воду и кипятят 20-30 мин до полного удаления воздуха и органических примесей (растворителей), применявшихся при изготовлении ультрафильтров.
Фильтрацию исследуемой воды осуществляют на металлических фильтрах Зейтца с сеткой. Непосредственно перед фильтрованием металлические фильтры обжигают или кипятят. После охлаждения прибора в него укладывают на сетку мембранный фильтр матовой поверхностью вверх. Укладывание фильтра нужно производить осторожно обожженным и охлажденным пинцетом с гладкими краями. Во избежание повреждения фильтра на него накладывают кружочки стерильной фильтровальной бумаги, предварительно смоченные стерильной дистиллированной водой. На фильтре закрепляют воронку и приступают к фильтрованию отобранной пробы исследуемой воды. Объемы воды, подлежащие фильтрации, варьируют от 300 до 500 мл в зависимости от общей предполагаемой характеристики источника водоснабжения.
При анализе загрязненных вод следует производить фильтрование после предварительного разведения: в 100 мл стерильной воды вводят 1 мл исследуемой пробы и приступают к фильтрации после тщательного перемешивания. Для фильтрации прибор необходимо подсоединить к водоструйному или вакуумному насосу. Вакуум в колбе Бунзена должен быть не менее 0,5 ат (4,9 * 10000 н/м2).
По окончании фильтрации снимают воронку с прибора, фильтр захватывают обожженным пинцетом и накладывают на поверхность среды Эндо в чашки Петри. Чашки помещают в термостат при 37 °С на 24 ч.
2-й день. Через 24 ч инкубации посевы просматривают и выявляют на поверхности фильтров колонии, типичные для группы кишечной палочки: ярко-красные колонии с металлическим блеском — колонии Е. coli commune; слабо-розовые или бесцветные без блеска, выпуклые, слизистые — колонии Е. paracoli. Подсчет колоний производят при помощи лупы.
Из колоний, характерных для кишечной группы, делают мазки и окрашивают по Граму. При обнаружении в мазках грамотрицательных палочек материал из этих колоний пересевают в пробирки с разведенной глюкозо-пептонной средой. Посевы помещают в термостат при 43 °С на 24 ч.
3-й день. После инкубации посевы просматривают и отмечают наличие или отсутствие газообразования. Газообразование свидетельствует о наличии кишечной палочки и наоборот. Расчет коли-титра и коли-индекса производится следующим образом.
источник
Степень микробного загрязнения воды важно учитывать в технологии пищевых производств. Вода, поступающая на производство, по качеству должна соответствовать санитарным нормам. Для контроля за санитарным состоянием такой воды регулярно проводят ее микробиологический анализ. Водопроводную воду исследуют не реже одного раза в месяц, артезианскую — не реже одного раза в год, воду открытых водоемов и колодцев — ежедневно.
Пробы воды для микробиологического исследования отбирают с соблюдением правил асептики, (стерильности) в стерильную стеклянную посуду с притертыми или ватно-марлевыми пробками. Перед взятием пробы из водопроводного крана, трубы или колодца с насосом воду спускают в течение 5— 10 мин, а края спускной трубы перед набором воды обжигают пламенем. Из открытых водоемов пробы воды отбирают при помощи специальных приборов — батометров — на расстоянии 10—15 см от дна. В проточных водоемах пробы отбирают около берега и в центре течения.
При обычном плановом санитарном контроле должно быть взято не менее 500 мл воды, для исследования на присутствие патогенных микроорганизмов — не менее 1 л. Пробы отбирают в часы наибольшего расходования воды на предприятии. Микробиологический анализ воды выполняют не позднее 2 ч с момента взятия пробы. В исключительных случаях допускается удлинение срока до 6 ч при обязательном хранении проб при низких положительных температурах (1—5 °С). При транспортировке в теплое время года пробы предохраняют от нагревания, а в зимнее время — от замораживания.
При санитарно-микробиологическом исследовании воды определяют микробное число и количество бактерий группы кишечной палочки (коли-титр).
Микробное число — общая микробная загрязненность — определяется числом микробных колоний, которые вырастают на простой питательной среде (МПА) при 37 °С в течение 24 ч из посева 1 мл исследуемой пробы воды.
Данный показатель позволяет учитывать не все микроорганизмы, содержащиеся в 1 мл воды, а лишь способные расти на простых средах при указанной температуре (мезофильные, сапротрофные). Однако число сапротрофных микроорганизмов, вырастающих на МПА, обычно соответствует степени загрязненности воды органическими веществами и, таким образом, косвенно характеризует ее санитарное состояние.
Для определения микробного числа делают посевы с соблюдением правил асептики в чашки Петри с МПА методом заливки с таким расчетом, чтобы на чашках вырастало от 30 до 300 колоний. Поэтому из проб артезианской и водопроводной воды (содержащей обычно меньше микроорганизмов) высевают соответственно объемы в 1 мл и 0,1 мл из неразведенных проб. При исследовании воды открытых водоемов высевают по 1 мл из предварительно приготовленных в стерильной воде десятикратных разведений исследуемой пробы (10 -1 —10 -3 и более, в зависимости от предполагаемого загрязнения).
Указанные выше объемы проб воды (1 мл, 0,1 мл) или ее разведений (по 1 мл каждого) вносят стерильной пипеткой в пустые стерильные чашки Петри, в которые затем наливают расплавленный теплый МПА (с температурой не выше 45— 46 о С). Воду и МПА тщательно перемешивают и после застывания среды посевы выращивают в термостате при 37 °С в течение 24 ч. Затем подсчитывают микробные колонии.
Общее число микробных колоний, выросших на всей чашке Петри, умножают на разведения, из которых был сделан высев 1 мл (чтобы перевести па 1 мл исследуемой воды). Затем определяют среднее арифметическое число колоний — микробное число исследуемой пробы.
Кишечная палочка — самый многочисленный и постоянный обитатель толстого отдела кишечника человека и всех теплокровных животных. Она выделяется во внешнюю среду с фекальными массами, поэтому используется как индикатор фекального загрязнения внешней среды и косвенный показатель наличия в воде болезнетворных микробов — возбудителей кишечных инфекций человека, выделяемых с фекалиями в воду и другие объекты.
Таким образом, кишечная палочка служит санитарно-показательным микроорганизмом воды. Поскольку она не образует спор и гибнет при относительно щадящих методах обеззараживания, ее присутствие в консервированных продуктах или воде указывает на нарушение режима консервирования и на недостаточность обработки воды, так как если кишечная палочка сохранила жизнеспособность, значит, могли выжить и другие неспорообразующие бактерии, такие, как дизентерийная шигелла, брюшнотифозная сальмонелла и другие патогенные бактерии — возбудители желудочно-кишечных заболеваний.
Кали-индекс (индекс кишечной палочки) — это число кишечных палочек, обнаруженных в 1 л исследуемой воды (по международным стандартам — в 100 мл).
По существующим нормативам коли-титр питьевой воды не должен быть менее 333 мл (в Москве — не менее 500 мл), а коли-индекс — не более 3 (см. п. 1.4.).
Коли-титр определяют методами бродильных проб. Данные методы основаны на способности кишечной палочки теплокровных животных и человека развиваться при повышенных температурах (43—44 °С) и сбраживать сахара (маннит, глюкозу и др.) с выделением газа. Существуют двух- и трехэтапные бродильные методы.
Трех этапный бродильный метод заключается в следующем. На первом этапе ставят первую бродильную пробу: различные разведения исследуемой воды при помощи стерильных пипеток вносят в колбы и пробирки со специальными углеводными жидкими средами (среда Булира, среда Эйкмана, розоловая и др.) и поплавками. В зависимости от предполагаемого микробного загрязнения водоисточника применяют разные схемы посева. Так, при исследовании водопроводной воды делают посевы в общем объеме 300 мл (2 объема по 100 мл и 10 объемов по 10 мл). Воду городов Москвы и Санкт-Петербурга засевают в объеме 500 мл (4 объема по 100 мл и 10 объемов по 10 мл). При исследовании воды открытых водоемов (речной, озерной и т. д.) необходимо посеять воду в общем объеме 111,1 мл (1 объем — 100 мл; I объем — 10 мл и по одному объему в 1 мл и 0,1 мл).
Соотношение между средой и засеваемой водой должно быть 1 : 2. Поэтому посевы малых количеств воды (1 мл, 0,1 мл) выполняют в пробирки с разведенной средой (обычной концентрации), а большие объемы воды (100 мл и 10 мл) — в концентрированную среду.
Посевы выращивают в термостате при 43—44 о С в течение 24 ч. При указанной температуре подавляется развитие микроорганизмов, не имеющих санитарно-показательного значения для воды. Затем просматривают посевы для выявления признаков роста кишечной палочки (наличие пузырьков газа в поплавках, изменение цвета, помутнение).
На втором этапе для подтверждения правильности обнаружения роста кишечной палочки в жидкой среде из посева с признаками роста при помощи бактериальной петли делают высев в чашки Петри со средой Эндо и выращивают культуру при 37 °С 24 ч.
Среда Эндо состоит из МПА, лактозы и обесцвеченною индикатора (фуксин обесцвечен сульфитом натрия). На данной среде бактерии группы кишечной палочки теплокровных животных образуют типичные темно-красные, ярко-красные или розовые колонии с темным центром, имеющие металлический блеск или без него. Столь характерный рост на среде Эндо этих бактерий обусловлен тем, что они активно сбраживают лактозу, продукты расщепления которой вызывают восстановление индикатора фуксина, окрашивающего колонии. При отсутствии характерного роста на пробу дают отрицательный ответ.
При наличии типичных колоний из них делают мазки. которые окрашивают по Граму и микроскопируют. Если в мазках обнаруживают мелкие неспорообразующие грамотрицательные палочки, то переходят к третьему этану для окончательного подтверждения результатов исследования.
На третьем этапе из типичных колоний, в которых при микроскопировании обнаружены характерные микробныеклетки, делают пересев в разведенную жидкую углеводную среду (Булира, Эйкмана и др.). Посевы выращивают при 43— 44 °С в течение 24 ч, после чего учитывают окончательно. При наличии в посевах помутнения, газообразования и изменения цвета дают положительный ответ, результаты которого выражают в виде коли-титра. При отсутствии газообразования дается отрицательный ответ, т. с. данные первой бродильной пробы подтверждаются.
Коли-индекс определяют методом мембранных фильтров. Для этой цели используют мембранные фильтры № 3 (ультрафильтры) — пористые пленки, изготовленные из микроклетчатки (нитроцеллюлозы), с диаметром пор 0,7 мкм. Перед фильтрацией их подвергают стерилизации двойным кипячением в дистиллированной воде в течение 15—20 мин. Затем стерильным пинцетом фильтры помещают на предварительно профламбированную поверхность фильтровального прибора Зейтца. Через фильтр Зейтца проводят фильтрацию под вакуумом определенного количества исследуемой воды (через один мембранный фильтр — не более 100 мл воды).
По окончании фильтрации освобождают фильтровальную пластинку, частично разбирая прибор. При помощи стерильного пинцета фильтр кладут осадком вверх на поверхность среды Эндо, залитой в чашку Петри, плотно прижимая к среде. В одну чашку можно поместить 4—5 фильтров. После культивирования в термостате при 37 °С в течение 18—24 ч подсчитывают выросшие на фильтре колонии, характерные для группы кишечной палочки. Из 2—3 колоний, типично окрашенных и бесцветных, берут материал для мазков, окрашивают их по Граму и микроскопируют с иммерсионным объективом.
Если в мазках присутствуют мелкие грамотрицательные неспорообразующие палочки, из оставшейся части колонии делают пересев в пробирки с небольшим объемом жидкой углеводной среды (среда Булира или др.). Посевы выращивают при 43—44 °С в течение 24 ч. Наличие газообразования — последний показатель присутствия бактерий группы кишечной палочки.
Материалы и оборудование: среда Булира и пробирках с поплавками, стерильные моровские пипетки на 1 мл, стерильные чашки Петри, среда Эндо агаризованная, простерилизованная вода в пробирках по 9 мл, образны воды для исследования.
источник
Вода является одним из основных факторов внешней среды.
Она необходима для построения клеток организма. Без воды в клетках не могут нормально протекать химические и физиологические процессы. Без воды невозможно проводить мероприятия по санитарному благоустройству населенных пунктов, поддерживать чистоту в жилищах, готовить пищу и пр.
Наряду с этим вода может явиться фактором передачи возбудителей инфекционных болезней.
Загрязненная вода может сыграть определенную роль в возникновении и распространении кишечных инфекций, туляремии, инфекционного гепатита, Ку-лихорадки, амебиаза, микозов.
Вода не должна содержать патогенных микроорганизмов.
Эпидемиологическая безопасность воды определяется степенью общего бактериального загрязнения и содержанием бактерий группы кишечной палочки.
Для оценки качества питьевой воды используются такие количественные показатели как коли – титр, коли – индекс, общее микробное число.
По бактериологическим показателям питьевая вода должна соответствовать следующим требованиям: общее количество бактерий в 1 мл неразбавленной воды не более 100, коли – индекс (количество бактерий группы кишечной палочки в 1 л воды) не более з3 особей, коли – титр (количество воды, содержащей 1 бактериальную клетку кишечной палочки ) – 300 мл.
Коли – титр в питьевой воде определяется методом мембранных фильтров и двух- или трехфазным бродильным методом.
Выбор метода определяется количеством и качеством исследуемой воды.
При исследовании чистой, хорошо фильтрующейся воды, удобнее использовать метод мембранных фильтров.
При исследовании воды, содержащей коллоидные вещества и посторонние примеси, затрудняющие фильтрацию, пользуются бродильным методом.
При определении титра кишечной палочки методом мембранных фильтров необходимо выполнить три этапа: подготовить мембранные фильтры, подготовить фильтровальный аппарат, произвести фильтрование и вырастить посевы.
1. Подготовка мембранных фильтров. Для фильтрования воды отбираются мелкопористые нитроцеллюлозные мембранные фильтры №3 (без изъянов) и помещаются в химический огнеупорный стакан с подогретой до 50 – 60 градусов по Цельсию дистиллированной водой. После этого воду в стакане необходимо нагревать на слабом огне до ее закипания. Кипячение фильтров производится трижды по 15 минут. После первого и второго кипячения вода из стакана сливается и заменяется свежей. После последнего кипячения вода не сливается и фильтры остаются в ней до употребления.
2. Подготовка фильтровального аппарата. Воронку и столик фильтровального аппарат Зейтца стерилизуют кипячением или обжиганием. На охлажденный столик аппарата, прокаленным на огне и остуженным пинцетом с гладкими кончиками, помещают мембранный фильтр. На столик с фильтром устанавливают и закрепляют верхнюю часть прибора – воронку.
3. Фильтрование воды и выращивание посевов. В воронку фильтровального аппарата стерильно наливают исследуемый объем воды и с помощью насоса создают вакуум в приемном сосуде.
Бактерии, находящиеся в пробе воды, задерживаются на фильтре.
По окончании фильтрации снимают воронку фильтра, осторожно стерильным пинцетом снимается фильтр и переносится в чашку Петри с питательной средой.
Выращивание фильтра на той или иной питательной среде позволяет выделить определенную группу микроорганизмов.
Для выявления эшерихий фильтр накладывается на агар Эндо или на другую среду (среда Плоскирева), используемую для выявления микробов этой группы.
Чашки Петри крышками вниз помещаются в термостат на 24 часа при 37 градусах по Цельсию. По окончании выращивания фильтры просматривают при помощи лупы.
Результат считается отрицательным, если на агаре Эндо отсутствуют ярко – красные колонии – это значит, что кишечной палочки в данном объеме воды нет.
При наличии красных колоний с металлическим блеском (характерным для колоний кишечной палочки) из колоний делают мазки и окрашивают их по методу Грамма.
При наличии грамотрицательных палочек средних размеров, не образующих споры, из колоний производят отсев в пробирки в пробирки с глюкозопептонной средой Эйкмана. Посевы помещают в термостат на 24 часа при 43 градусах (температура, при которой прорастают особи, выделяемые теплокровными).
Помутнение питательной среды и наличие газообразования свидетельствует о присутствии кишечной палочки в данном объеме исследуемой воды.
Определение коли – титра бродильным методом проводится в три этапа.
В первый день в зависимости от степени загрязнения производят посев различных объемов исследуемой воды на среду Булира с поплавками.
Объемы воды обратно пропорциональны степени ее загрязнения.
Как правило засевают четыре десятикратно уменьшающихся объема воды (например: 1; 0,1; 0,01; 0,001 мл).
Посевы выдерживают 24 часа при 43 градусах по Цельсию.
На второй день после изъятия посевов из термостата отбирают те колбы, в которых изменился цвет индикатора в среде Булира, а в поплавках скопился образовавшийся газ. Из этих колб делают отсев в чашки Петри с агаром Эндо. Посевы помещают в термостат на 24 часа при 37 градусах.
На третий день посевы извлекают из термостата и макроскопически исследуют выросшие колонии. Наличие ярко красных колоний с металлическим блеском указывает на присутствие в данном объеме воды кишечной палочки.
Для подтверждения из отобранной колонии делают мазок и производят отсев в пробирку со средой Булира.
Мазок окрашивают по Грамму и микроскопируют, а пробирку с посевом ставят в термостат на 24 часа при 43 градусах.
Наличие в микропрепарате грамотрицательных палочек, изменение окраски среды Булира и наличие газа в поплавке являются доказательством присутствия кишечной палочки.
При определении микробного числа стерильными пипетками отбирают и засевают в чашки Петри с МПА 1 мл; 0,1 мл (или еще большее разведение) исследуемой воды.
Получение различных объемов достигается разведением исследуемой воды стерильной водой. Из одной пробы производят посев не менее двух разведений. При этом каждый объем воды отбирается отдельной стерильной пипеткой.
Посевы помещают в термостат при 37 градусах на 24 часа. Затем производят подсчет колоний, выросших на питательной среде в чашке. Колонии подсчитываются с помощью лупы на черном фоне. Для того, чтобы получить число колоний в 1 мл воды, полученное число необходимо умножить на разведение. Все полученные результаты суммируются и выводится средняя арифметическая величина.
При изучении бактериальной флоры в открытых водоемах с целью выявления влияния каких – либо загрязнителей может быть применен метод пластинок обрастания.
Метод основан на свойстве микроорганизмов прикрепляться к поверхности стекла. Этот метод позволяет получить сведения об экологических взаимоотношениях микроорганизмов, их реакцию на изменения во внешней среде.
Для получения пластинок обрастания, тщательно обезжиренные предметные стекла прикрепляют каким – либо способом через определенные промежутки на тросе. Трос, несущий стекла, с грузом на нижнем конце и поплавком на верхнем опускают в водоем.
Стекла должны быть пронумерованы, а в журнале необходимо записать какие номера стекол какому горизонту соответствуют.
Установку со стеклами в водоеме выдерживают 3- 4 суток, после чего ее извлекают из воды и аккуратно вынимают стекла. Стекла высушивают и фиксируют смесью Никифорова (равные объемы этилового спирта и эфира) или метиловым спиртом, окрашивают по Грамму, а также другими сложными методами окраски для выявления железо- и серобактерий и других видов микроорганизмов.
Микропрепараты изучают с помощью иммерсионного микроскопа, что дает возможность характеризовать видовой состав микрофлоры на разных горизонтах водоема.
При подсчете микробов на площади один квадратный сантиметр определяется их количественное содержание.
При учете бактерий по физиологическим группам производя посевы на питательные среды для выявления десульфурирующих бактерий, бактерий участвующих в процессах аммонификации, нитрификации и денитрификации. Производят посевы для выявления облигатных аэробов и анаэробов, участвующих в фиксации азота и разложении клетчатки.
источник
Лабораторная работа «САНИТАРНО-БАКТЕРИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ ВОДЫ»
Санитарно-бактериологическое исследование воды заключается в следующем:
1. Определяют общее количество микробов в 1 мл.
2. Определяют титр кишечной палочки.
Взятие проб воды для санитарно-бактериологического исследования. Воду для санитарно-бактериологического исследования отбирают в количестве 500 мл в бутылки, предварительно простерилизованные в бумажных пакетах, с ватно-марлевой пробкой, покрытой сверху бумажным колпачком. К горлышку бутылки привязывают пакетик с завернутой в него запасной пробкой.
Из кранов водопроводных сооружений пробы берут в период наибольшего расхода воды после предварительной стерилизации крана обжиганием пламенем горящего тампона, смоченного спиртом, и последующего спуска воды в течение 10-15 мин при полностью открытом кране.
Пробы хлорированной воды берут во флаконы с дехлоратором, так как под действием хлора микробы в воде погибают. В качестве дехлоратора на 500 мл исследуемой воды добавляют 10 мг серноватистокислого натрия.
К отобранным пробам воды прилагают сопроводительный документ с указанием следующих данных:
1) место расположения крана;
2) дата отбора пробы с указанием года, месяца, числа и часа;
3) особые обстоятельства при отборе пробы (время спуска воды из крана, условия транспортировки и т. д.).
4) цель исследования: сделан ли отбор пробы в порядке текущего санитарного надзора или по особым показаниям.
Бактериологический анализ воды должен быть произведен не позднее 2 ч с момента ее взятия. Указанный срок может быть увеличен до 6 ч при условии сохранения или транспортировки пробы воды при температуре от 1 до 5°С, что достигается с помощью резиновых мешков, наполненных зимой теплой водой, а летом — льдом. ГОСТ 2871—82 «Вода питьевая. Гигиенические требования и контроль за качеством» нормирует следующие бактериологические показатели питьевой водопроводной воды:
а) общее число бактерий при посеве 1 мл неразведенной воды, определяемое числом колонии на мясо-пептонном агаре после 24-часового выращивания при температуре 37°С (не более 100); б) количество кишечных палочек в 1 л воды, определяемое числом колоний на среде Эндо с применением концентрации бактерий на мембранных фильтрах (не более 3).
Определение общего числа микробов в воде
Общее микробное загрязнение определяется количеством микроорганизмов в 1 мл воды, которые при посеве на мясо-пептонный агар и инкубации при 37±0,5°С в течение 24 ч образуют колонии, видимые простым глазом или при увеличении в 2-5 раз.
В зависимости от степени предполагаемого загрязнений производят посев не менее двух различных объемов воды, выбранных с таким расчетом, чтобы на чашках вырастало от 30 до 300 колоний. Водопроводную воду и воду артезианских колодцев засевают в неразведенном виде по 1 мл.
Из исследуемого образца неразведенной воды и из пробирок с ее разведениями в соответствии со степенью предполагаемого загрязнения берут по 1 мл, вносят в стерильные чашки Петри и заливают 10-12 мл растопленного и остуженного до 45 °С мясо-пептонного агара. Круговыми движениями руки, вращая чашки по горизонтальной поверхности стола, распределяют их содержимое равномерным слоем по всей площади дна. После застудневания агара чашки с посевами вверх дном помещают в термостат при 37±0,5°С на сутки.
После указанного срока выращивания приступают к подсчету колоний, выросших как на поверхности, так и в глубине агара.
Если в чашке с наиболее высоким разведением выросло свыше 300 колоний и анализ нельзя повторить, колонии подсчитывают при помощи пластинки с сеткой и лупы при сильном боковом освещении. Подсчитывают в разных местах чашки не менее 20 квадратов площадью 1 см 2 каждый. Затем выводят среднее арифметическое число колоний, приходящееся на 1 см 2 , и умножают его на площадь чашки в квадратных сантиметрах.
Результаты анализа выражают количеством бактерий на 1 мл исследуемой воды, для чего число выросших на чашке колоний умножается на степень разведения воды.
За окончательное количество бактерий принимается среднее арифметическое результата подсчета на двух параллельных чашках. При оформлении протокола количество микроорганизмов, определенное .в 1 мл исследуемой воды, округляют (таблица1).
Таблица 1 Запись результатов определения микробного числа воды
При количестве колоний в 1 мл
Запись результата анализа
Конкретная цифра подсчета
Методы определения титра кишечной палочки в воде
Коли-титр в питьевой воде, согласно действующему ГОСТ 2871-82 «Вода питьевая. Гигиенические требования и контроль за качеством», определяют методом мембранных фильтров и бродильным методом. Выбор метода зависит от качества исследуемой воды. При исследовании чистой, хорошо фильтрующейся воды удобнее пользоваться методом мембранных фильтров. При исследовании воды, содержащей коллоидные вещества и посторонние примеси, затрудняющие процесс фильтрования, пользуются бродильным методом.
Определение титра кишечной палочки методом мембранных фильтров. Сущность метода заключается в концентрировании бактерий из определенного объема воды на мембранных фильтрах с подращиванием их на среде Эндо при 37 о С, дифференцированием выросших колоний и последующим подсчетом количества бактерий группы кишечных палочек в 1 л воды.
Первый день. 1. Подготовка мембранных фильтров. Для фильтрования воды отбирают мембранные фильтры № 3 (без изъянов), помещают их в подогретую до температуры 80°С дистиллированную воду и ставят на слабый огонь до закипания. Кипячение фильтров производят трижды по 10 мин. После первого и второго кипячения воду сливают. После последнего кипячения воду не сливают и фильтры оставляют в ней до употребления.
2. Подготовка фильтровального аппарата. Перед посевом воды фильтровальный аппарат протирают ватным тампоном, смоченным спиртом, и обжигают в целях стерилизации. На охлажденный после прожигания столик фильтровального аппарата помещают с помощью стерильного пинцета с гладкими кончиками мембранный фильтр. Во избежание повреждения фильтра под него подкладывают кружок стерильной фильтровальной бумаги. Если вода содержит большое количество взвешенных веществ или клеток фитопланктона, ее сначала фильтруют через предварительный фильтр № 6, помещая его поверх фильтра № 3.
На фильтровальный столик с положенными на него фильтрами устанавливают и закрепляют верхнюю часть прибора — воронку.
3. Фильтрование воды. В воронку фильтровального аппарата стерильно наливают исследуемый объем воды и с помощью водоструйного насоса создают вакуум в приемном сосуде.
При анализе воды, поступающей в водопроводную сеть, необходимо брать объем не менее 333 мл. При анализе воды неизвестного качества следует засевать 3-4 десятикратных объема. Например, из водопроводной сети можно фильтровать 3; 30; 100; 200 мл воды, на этапах очистки — 0,1; I; 10; 100 мл.
Фильтруют сначала меньшие, а затем большие объемы воды через один фильтровальный аппарат, меняя каждый раз фильтры. При фильтровании небольших объемов воды (1 мл и меньше) в воронку сначала наливают 10 мл стерильной воды, а затем вносят анализируемую воду. По окончании фильтрования снимают воронку прибора, фильтр захватывают обожженным пинцетом и накладывают на поверхность среды Эндо в чашки Петри.
На одну чашку можно поместить 4-5 фильтров. Под каждым фильтром делают надпись с указанием даты, номера анализа и объема профильтрованной воды. Посевы инкубируют в термостате 18-24 ч при 37°С.
Второй день. 1. По окончании инкубации производят просмотр посевов:
а) отсутствие микробного роста на фильтрах или обнаружение на них колоний, не характерных для бактерии кишечной группы (губчатые, пленчатые с неровной поверхностью и краем), позволяет на этом этапе анализа закончить исследования (18-24 ч) с выдачей отрицательного результата на присутствие кишечных палочек в анализируемом объеме воды;
б) при обнаружении на фильтре колоний, характерных для кишечных палочек (темно-красных с металлическим блеском или без него, розовых и прозрачных), исследование продолжают. Из нескольких колоний каждого типа готовят мазки, окрашивают их по Граму, микроскопируют. Отсутствие в мазках грамотрицательных, неспороносных палочек является основанием для прекращения анализа с регистрацией отрицательного результата.
При обнаружении в мазке грамотрицательных палочек, морфологически сходных с кишечной (возможны удлиненные, нитевидные формы или крупные полярно окрашенные палочки), ставится оксидазная проба.
2. Оксидазный тест предложен для дифференциации бактерий семейства Enterobacteriaceae от грамотрицательных бактерий семейства Pseudomanadaсеае и других водных сапрофитов, которые в отличие от кишечных бактерий вырабатывают фермент оксидазу, окисляющую фенилен-диаминовые соединения до индофенола, имеющего ярко-синий цвет.
Для постановки оксидазного теста мембранные фильтры с выросшими на них колониями переносят (не переворачивая) на лист фильтровальной бумаги, предварительно смоченный реактивом для выявления оксидазы (рец. 32). Результат реакции учитывают через 2-4 мин.
Колонии микроорганизмов, продуцирующие оксидазу (не относящиеся к семейству кишечных бактерий), при взаимодействии с добавленным реактивом, приобретают синий ободок при периферии или окрашиваются в синий цвет полностью (положительная реакция).
Колонии семейства Enterobacteriaceae, не продуцирующие фермент оксидазу, не изменяют своего первоначального цвета (отрицательная реакция).
При обнаружении на мембранных фильтрах однотипных лактозоположительных колоний (темно-красных с металлическим блеском или без него), не вырабатывающих оксидазы, анализ воды заканчивается на данном этапе подсчетом выросших колоний.
При обнаружении на мембранных фильтрах розовых и бесцветных колоний с отрицательной оксидазной активностью, их подсчитывают и подтверждают принадлежность к бактериям группы кишечных палочек посевом 2-3 изолированных колоний каждого типа в полужидкую среду с глюкозой (Рец. 44). Результаты роста учитывают через 4-5 ч инкубации в термостате при 37°С. При образовании кислоты и газа результат считается положительным, при отсутствии кислото- и газообразования — отрицательным. При наличии только кислоты пробирки оставляют в термостате для окончательного учета результатов роста через 24 ч. При отсутствии газообразования через сутки получают окончательный отрицательный результат, при наличии газообразования — положительный результат.
Вычисление коли — индекса. Результат выражают в виде коли-индекса, определяемого посредством суммирования колоний кишечных палочек, выросших на поверхности мембранных фильтров в одной пробе воды, и пересчитывают это количество на 1 л воды.
Пример. При исследовании пробы воды профильтровано 3 объема по 100 мл. Па первом и втором фильтрах выросло по 3 колонии, на третьем- 9 колоний. Всего выросло 15 колоний. Таким образом, коли-индекс исследуемого образца воды равен: 1000 X 15 : 300 = 50.
Питьевая вода удовлетворяет требованиям ГОСТ 2871-82 в том случае, когда коли-индекс не превышает 3.
При установлении бактериальной загрязненности воды свыше допустимых норм прибегают к повторному исследованию воды на наличие бактерий свежего фекального загрязнения (преимущественно колибактерий), способных ферментировать лактозу до кислоты и газа при 43±0,5°С, в присутствии ингибиторов посторонней микрофлоры. Исследуемый образец воды фильтруют через мембранный фильтр с последующим подращиванием его на среде Эндо в течение 24 ч при 37 о С.
При повторном обнаружении на фильтрах лактозоположительных темно-красных колоний с металлическим блеском и без него параллельно определению коли-индекса эти колонии в количестве не более 15 засевают в лактозную среду с борной кислотой (рец. 143), предварительно нагретую в водяной бане до 43 о С, и 24 ч инкубируют в термостате при 43 С С. Вместо указанной среды можно пользоваться желчно- лактозной средой с бриллиантовым зеленым (рец. 142), инкубацией посевов при 44,5°С.
Помутнение с образованием кислоты и газа в посевах является показателем свежего фекального загрязнения; появление микробного роста (помутнение среды) без газообразования не учитывается.
Определение титра кишечной палочки бродильным методом. Сущность бродильного метода заключается в посеве определенных объемов исследуемой воды, инкубации ее при 37°С в средах накопления с последующим высевом на среду Эндо, дифференциацией выросших колоний и определением наиболее вероятного числа бактерий группы кишечных палочек в 1 л воды по таблицам.
Первый день. Для установления титра кишечной палочки бродильным методом воду в зависимости от характера водоисточника засевают во флаконы и пробирки с глюкозо-пептонной (рец. 140) или лактозо-пептонной средой (рец. 141) с поплавками или комочками ваты для выявления газообразования:
а) при исследовании воды на этапах очистки и обеззараживания засевают: 100; 10; 1, 0,1 мл;
б) на выходе в водопроводную сеть — три объема по100 мл; три объема по 10 мл; три объема по 1 мл.
Посев воды в объеме 100 и 10 мл производится во флаконы и пробирки, соответственно с 10 и 1 мл концентрированной питательной среды. Посев воды в объеме 1 и 0,1 мл засевается в пробирки с 10 мл среды нормальной концентрации. Флаконы и пробирки с засеянными средами инкубируют в термостате 24 ч при 37 С С.
Второй день. 1. Учитывают результаты посевов:
а) отсутствие помутнения и образования кислоты и газа во флаконах и пробирках, является показателем отрицательного результата на наличие бактерий группы кишечной палочки в исследуемом объеме воды, дающим право закончить исследование через 24 ч;
б) при помутнении питательной среды с образованием кислоты и газа или помутнении и кислотообразовании (на глюкозо-пептонной среде) или только помутнении (на лактозо-пептонной среде) производится высев на среду Эндо. Высев делается бактериальной петлей, густым штрихом, для получения изолированных колоний. Чашки с посевами инкубируют 16-18 ч при 37 С С.
Третий день. 1 Просматривают посевы на среде Эндо:
а) отсутствие микробного роста или наличие пленчатых, губчатых колоний с неровной поверхностью и краями, а также плесневых и других не характерных для кишечной палочки колоний является основанием для отрицательного ответа;
б) при обнаружении лактозоположительных темно-красных колоний с металлическим блеском или без него необходимо установить принадлежность выросших микроорганизмов к семейству кишечных бактерий. С этой целью производится микроскопирование материала колоний и постановка оксидазного теста.
2. Оксидазный тест при исследовании воды бродильным методом ставится следующим образом. Со среды Эндо бактериальной петлей или стеклянной палочкой снимают по 2-3 колонии каждого типа. Снятую таким образом микробную массу наносят штрихом на фильтровальную бумагу, смоченную реактивом (рец. 32). При отрицательном результате оксидазного теста бумага в месте нанесения бактериальной культуры цвета не изменяет. При положительном, результате — в течение минуты -приобретает ярко-синюю окраску. При постановке данного теста одним из обязательных условий является исследование изолированных колоний, так как примесь оксидазоположительных бактерий может привести к ложному посинению материала и необоснованному исключению при подсчете колоний кишечных палочек.
Наличие в мазках грамотрицательных неспороносных палочек с отрицательной реакцией оксидазного теста позволяет немедленно дать положительный ответ о наличии бактерий группы кишечной палочки в исследуемой воде.
При исследовании питьевой воды учитывают розовые и бесцветные колонии. В этих случаях из 2-3 колонии разного типа делают мазки, окрашивают по Граму, микроскопируют. При обнаружении грамотрицательных неспороносных палочек с колониями каждого типа ставится оксидазный тест. При наличии грамположительных или спорообразующих бактерий и положительном результате оксидазного теста на 40-42-м часу ведения анализа дается отрицательный результат на наличие бактерий кишечной группы исследуемого объема воды.
3. При выявлении в воде грамотрицательных, бесспоровых, оксидазоотрицательных бактерий из 2-3 колоний различного типа берут микробную культуру для высева в полужидкую среду с глюкозой. Результат роста учитывают после 4-5 ч инкубации в термостате при 37° С:
а) При обнаружении кислоты и газа в посеве дается положительный ответ;
6) при отсутствии кислоты и газа дается отрицательный ответ;
в) при наличии в посевах только кислоты пробирки оставляют еще на 24 ч для окончательного учета. При отсутствии газообразования на 2-е сутки дается окончательный отрицательный результат, при появлении газа — окончательный положительный результат.
Таблица 2 Определение коли-индекса при исследовании 300 мл воды
Количество положительных результатов анализа воды из:
источник
То, что сырая вода из-под крана или из колодца зачастую непригодна для питья, знают многие. Но в чём причина? Как правило, самый распространённый ответ на этот вопрос: там микробы. Но какие именно микроорганизмы в воде представляют реальную опасность для здоровья, как определить загрязнение воды, как очистить воду, например, от кишечной палочки и других болезнетворных бактерий? Обо всём этом читайте в нашей статье.
Для начала разберёмся, что собой представляет кишечная палочка. Эта бактерия живёт в кишечнике человека и животных. Попадая в воду вместе с бытовыми и канализационными стоками, отходами жизнедеятельности, она приводит к её загрязнению. Как может оказаться кишечная палочка в воде? Вариантов несколько.
- попадание фекальных стоков вследствие неполадок или устаревшей канализационной системы
- использование поверхностного водоёма для водопоя крупного рогатого скота
- попадание в водоём бытовых стоков из частных хозяйств
Особенно активно размножается кишечная палочка в воде в тёплое время года, как раз в разгар пляжного сезона. А ведь воду с ней опасно не только пить, но и купаться в ней. Также весной во время таяние снега или после затяжных дождей, кишечная палочка может проникнуть в грунтовые воды, а оттуда – в систему водоснабжения.
То, что кишечная палочка, возможно, присутствует в воде, иногда можно предполагать даже без проведения анализов. Вода имеет очень неприятный запах, может присутствовать желтовато-коричневый оттенок. Но часто бывает, что вроде бы обычная на первый взгляд вода представляет серьёзную опасность для здоровья. Бывает, что кишечная палочка обнаруживается в питьевой воде из-под крана. К этому приводят неполадки в системе водоснабжения или водоподготовки.
Достоверно определить состав поможет только анализ воды в лаборатории.
Кишечная палочка в воде может нанести серьёзный вред здоровью: от банального расстройства желудка до тяжёлых воспалений и поражений внутренних органов. При попадании в организм кишечная палочка может провоцировать:
- кишечные инфекции (чаще всего проявляющиеся в виде диареи, тошноты, рвоты и т.п.)
- воспаления мочевыводящих путей и половых органов
- уретрит (у мужчин)
- гемолитико-уремический синдром (в группе риска, прежде всего, дети и пожилые люди), который может привести к острой почечной недостаточности
Среди множества штаммов кишечной палочки самым опасным считается E. Coli.
Согласно Государственным санитарным нормам, колиморфных бактерий (бактерий группы кишечной палочки) в питьевой воде, подающейся в водопровод, не должно быть вообще. Их наличие может спровоцировать эпидемическую ситуацию в насёлённом пункте. Для того чтобы заразиться кишечной палочкой не обязательно пить сырую воду. Достаточно просто помыть ею овощи, которые не подвергаются дальнейшей термической обработке, и бактерии попадут в организм.
Учитывая возможные негативные последствия от контакта с этой бактерией, закономерным становится вопрос, как убить кишечную палочку в воде. Самыми распространёнными являются:
- химический метод (например, хлорирование воды или добавление других реагентов)
- физический метод (например, кипячение)
Все эти способы призваны подавить жизнедеятельность и размножение бактерий.
Учитывая, что перед подачей в систему водоснабжения вода подвергается обеззараживанию, то риск обнаружить кишечную палочку в питьевой воде из-под крана ниже, чем в воде из колодца. Специалисты отмечают, что значительный процент колодезной воды не соответствует нормам именно по микробиологическим показателям.
Единственным максимально надёжным способом выявить кишечную палочку является бактериологический анализ воды в лаборатории. Если проблема существует, то меры нужно принимать незамедлительно. В случае, если кишечная палочка выявлена в колодце или скважине на вашем участке, необходимо тут же прекратить использование этой воды. Затем провести полную дезинфекцию и установить мощную систему обеззараживания. Если есть возможность, лучше пробурить скважину в другом месте. Когда кишечная палочка обнаружилась в водопроводной воде, нужно проинформировать городской Водоканал и прекратить использование воды, до полного решения ситуации. (Возможно, имеет место неисправность или нарушений технологий обеззараживания воды перед подачей в систему).
Кипячение способно убить кишечную палочку и другие бактерии, но кипятить воду для всех бытовых нужд и для купания очень проблематично. Поэтому более надёжным способом является установка фильтров, в частности, системы обратного осмоса. Это поможет обезопасить себя и свою семью.
источник
Выявление кишечной палочки в анализе мочи свидетельствует об инфекционном процессе и требует дополнительных методов обследования. Иногда ее наличие может быть следствием неправильного сбора биологического материала или несоблюдения элементарных правил гигиены, в этом случае анализ нужно сдать повторно.
Моча человека априори стерильна. Но это – в идеале, который в обычной жизни встречается крайне редко. На практике в каждом анализе мочи присутствует та или иная микрофлора, следы белка, эритроцитов, солевые образования – продукты жизнедеятельности человека. В половине случаев патогенные микроорганизмы представлены кишечной палочкой – Escherichia coli. Это одна из самых опасных бактерий в мире, входящая в десятку лидеров патогенности. Но обнаруженная в анализе палочка, чаще всего, не является следствием патологического инфицирования, а попадает туда в результате:
- Несоблюдения правил интимной гигиены. Повторный анализ может опровергнуть вероятность инфекции.
- Как следствие «бессимптомной» бактериурии неясного генеза. Требуется уточнение результатов: сахарный диабет, например, создает благоприятные условия для размножения кишечной палочки, но только превышение 105 палочек в 1 мл мочи свидетельствует о латентном инфицировании.
Превышение микробного числа (более 105 микробов в миллилитре мочи) говорит о возникновении инфекции мочеполовой системы. Так развивается нефрит, цистит, уретрит. При этом очень важно присоединение пиогенной флоры, которая также диагностируется анализом мочи (лейкоциты). Наличие подобного симбиоза требует немедленного лечения. Особенно опасен такой вариант развития событий для беременных и детей до 12 лет, когда иммунные силы организма снижены, гормональный фон – нестабилен, и инфекция чувствует себя вполне уверенно в организме.
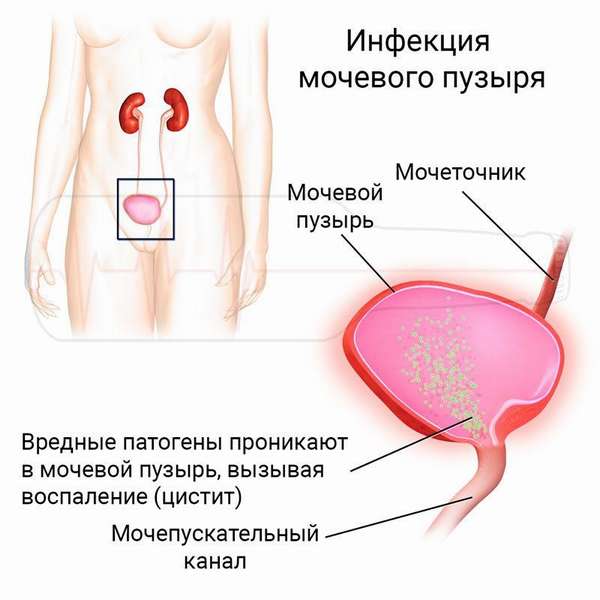
Кишечная палочка обитает в безвоздушном пространстве, она – факультативный анаэроб, ей не нужен кислород для размножения и роста. Оптимальная среда – кишечник. Но, появляясь в среде, содержащей кислород, она удивительно быстро приспосабливается к новым условиям и продолжает свое существование. В минимальных количествах палочка способна приносить пользу, синтезируя витамин К в кишечнике, выдавливая все болезнетворные бактерии со своей территории. Но попадая в непривычную среду обитания, например, в нижние отделы мочевыводящих путей, микроб начинает вести себя агрессивно, вырабатывает токсины и вызывает тяжелейшие недуги.
Кишечной палочке противостоит эпителий влагалища, уретры, мочевого пузыря, способный синтезировать специальную антибактериальную слизь, которая вымывает вместе с собой тысячи Escherichia coli. Кроме того, и моча обладает свойствами природного антисептика. Кажется, защита достаточно надежна, но есть ряд факторов, снижающих ее:
- Кислая рН делает из мочи отличный субстрат для размножения микроба.
- Не частое опорожнение мочевого пузыря, дающее возможность палочке задержаться в системе мочевыведения и начать свой рост.
- Очаги фокальной и перифокальной инфекции, которые сформировались по соседству с мочеполовой системой. Кишечная палочка, попадая из урины в кровоток, оседает в них и начинает размножаться.
- Несоблюдение правил личной гигиены особенно опасное для маленьких девочек, когда родители неправильно подмывают малышек – от ануса к уретре, а не наоборот.
- Беременность с гормональными нарушениями и ослабленным иммунитетом.
Нормой в анализе мочи считается количество Escherichia coli, не превышающее значение 10 в третьей или четвертой степени.
До показателя количества микробов 10 в седьмой степени – ситуация считается тяжелой, требующей срочного вмешательства, антибактериальной терапии. Превышение критического уровня 10 в седьмой степени свидетельствует о восходящем мочевом сепсисе с необратимыми последствиями.
Каждый лабораторный анализ требует соблюдения определенных правил сбора биоматериала и его сдачи. Моча – капризная субстанция, в ней чаще всего обнаруживаются патогенные микробы, которых не должно быть в норме, из-за несоблюдения правил интимной гигиены. Анальное отверстие и промежность настолько близко расположены друг к другу анатомически, что перекрыть доступ кишечной палочки из системы пищеварения во влагалище или уретру можно только тщательно дезинфицировав их средствами гигиены.
Половые органы моют в проточной воде и вытирают насухо. Посуду для сбора мочи нужно покупать в аптеке. Первые капли спускают в унитаз и только срединную порцию – в готовую емкость. У детей до года моча берется катетером. Доставить биоматериал в лабораторию необходимо в первые часы после сбора, от этого зависит достоверность результата тестирования.
Если появление Escherichia coli в моче – инфицирование и развитие воспаления, то это опасно для человека и требует неотложных мер. Чтобы не пропустить серьезное заболевание, следует знать основные причины, которые способствуют появлению кишечной палочки в моче:
- Осложнения системы фильтрации и мочевыведения.
- Беременность.
- Беспорядочная половая жизнь.
- Отсутствие навыков личной гигиены или их несоблюдение.
- Нестерильная емкость для сбора мочи.
Признаки инфекции, вызванной Escherichia coli, характерны для любого инфекционного процесса, дебютирующего в нижних отделах системы мочевыведения: жгучие боли при мочеиспускании, минимальный объем выделяемой мочи, частые позывы к опорожнению пузыря. При распространении инфекции присоединяются симптомы интоксикации: повышается температура, присоединяется озноб, подташнивание, разбитость, слабость, головная боль. Начинает болеть поясница. В моче визуально наблюдаются изменения: лейкоциты, эритроциты, белок, большое количество слизи.
Основа терапии Escherichia coli – антибиотики с учетом чувствительности микроба к ним (посев на питательные среды). Эффективны: пенициллиновая группа, цефалоспорины, тетрациклины. Присоединяются к комплексному лечению и уросептики, они помогают восстановить работу нефронов и вывести лишнюю жидкость. Применяют и иммуностимуляторы, иммуномодуляторы, фитопрепараты, лечение народными средствами. Очень важно в терапии соблюдение режима: без переохлаждения, переутомления, физических нагрузок. Питьевой режим, пищевой рацион рекомендует врач. Диета – важная составляющая комбинированного лечения.
Все лечение проходит под контролем лечащего доктора. Самолечение недопустимо, поскольку осложнения, вызванные недолеченным инфекционным процессом, опасны для жизни человека. В случае асимптомного обнаружения Escherichia coli в моче, врач наблюдает пациента, антибиотикотерапия в этом случае отсрочена.
Выявление кишечной палочки у детей всегда требует сдачи повторного анализа (гигиена). Но если кишечная палочка обнаружена как результат инфицирования, в каждой возрастной категории у детей это имеет свои серьезные последствия.
У новорожденных и детей до года инфицирование кишечной палочкой составляет около 3% от всех инфекций мочевыводящей системы. Девочки болеют чаще из-за анатомического строения уретры. При инфицировании скорость распространения инфекции по восходящему пути мгновенна, симптомы – острые: температура, нарастающая слабость, слипание губок уретры и их отек. Действовать нужно быстро: обращение к врачу и курс назначенной терапии в стационаре.
Есть и другой вариант заражения: если новорожденный часто принимал антибиотики, что привело к снижению иммунитета. Для Escherichia coli такая ситуация является сигналом к беспрепятственному проникновению через лимфу в кровь с развитием сепсиса и менингита.
В этом возрасте заболевание мальчиков – редкость, но все чаще болеют девочки (5%). Это объясняется нарастающим синтезом секрета простаты с антибактериальными свойствами у мальчиков и колебаниями гормонального фона у девочек. Симптоматика по-прежнему острая и требует экстренных мер, воспаление развивается быстро, но вместе с тем появляется и форма латентной бактериурии. Это тот самый случай, когда создаются наилучшие условия для поражения почек, поэтому родителям в этот период нужно быть максимально внимательными к здоровью своих детей, обращать внимание на любой признак неблагополучия в системе мочевыведения. Очень часто почечная инфекция, вызванная Escherichia coli, маскируется под грипп или аппендицит.
Вовремя выявленная и устраненная кишечная палочка – гарантия стабильности ситуации, но требует обязательной профилактики с целью исключения повторного инфицирования. Она проста:
- Соблюдение правил личной и интимной гигиены.
- Ежедневная смена нижнего белья, ношение прокладок женщинам.
- Регулярная смена постельных принадлежностей.
- Защищенный половой акт.
- Закаливание для укрепления иммунитета. Система должна быть разработана совместно с лечащим врачом.
- Рациональный питьевой режим по рекомендации врача (1-1,5 л чистой воды в сутки) – вода естественным образом выводит патогенные микробы.
- Правильное питание: клетчатка, фрукты и овощи должны преобладать в рационе для исключения запоров и профилактики анальных трещин с присоединением вторичной инфекции.
- Дозированные физические нагрузки.
- Использование народных рецептов для приготовления чаев из лекарственных трав и ягод, укрепляющих иммунитет.
источник